由于良好的抗病原体性能,抗生素在临床医疗、畜牧业和水产养殖等领域被广泛应用[1]。然而,抗生素的过度或不当使用使其环境浓度不断升高,因此抗生素对生物体,特别是其靶标生物细菌的胁迫效应引发了广泛关注。细菌在面对抗生素的胁迫时往往表现出“低浓度促进,高浓度抑制”的Hormesis效应[2]。例如,低剂量的氯霉素能够诱导费氏弧菌(Vibrio fischeri, V. fischeri)产生Hormesis效应[3];大肠杆菌(Escherichia coli, E. coli)能够对低于毒理学阈值剂量的磺胺类和四环素类抗生素表现出Hormesis效应[4-5]。目前,抗生素诱导的细菌Hormesis效应显著影响着其生态风险评价的关键环节。
已有研究表明,抗生素诱导的细菌Hormesis效应受到多种因素的调控。其中,环境温度、盐度、细菌的群体感应以及暴露时间被认为是影响抗生素诱导细菌Hormesis效应的关键因素[6]。然而,作为细菌代谢主要能量来源的碳源物质在抗生素诱导细菌Hormesis效应中的作用尚未引起足够重视。碳源物质可以通过调控代谢活动、种群密度、碳分解代谢物抑制(carbon catabolite repression, CCR)途径或群体感应系统决定细菌在外界胁迫下的生存策略,最终影响细菌的剂量效应特征甚至Hormesis现象的发生[7-9]。其中,CCR是细菌在混合碳源中生长时实现优先利用首选碳源(如葡萄糖, glucose, Glc)的一种全局代谢调控机制,这导致了细菌的二次生长,即只有首选碳源耗尽后,其他碳源才会被细菌消耗[10](图1(a))。而细菌在实际环境中往往会遇到多种碳源物质共存的情况[11]。因此,在包含多种碳源的培养体系中研究抗生素诱导的细菌Hormesis现象具有重要的现实意义。

图1 (a)细菌的二次生长示意图和(b)添加不同浓度Glc的MH培养基中E. coli 0~24 h的OD600的变化
注:Glc表示葡萄糖。
Fig. 1 (a) Schematic diagram of the diauxic growth of bacteria, and (b) Trends in OD600 of E. coli during 0~24 h in MH medium with different concentrations Glc
Note: Glc stands for glucose.
在混合碳源培养条件下测试抗生素对细菌的毒性效应,细菌受到了营养物质改变和抗生素胁迫2种因素的共同影响。如何有效评估外加碳源和抗生素对细菌的联合效应是值得关注的科学问题。Gurevitch等[12]构建了一种以Hegde’s d计算为基础的多种压力源交互效应的分析方法,该方法通过比较各压力源个体效应的加和与多重压力源总体效应的大小关系判别多种压力源对受体的交互效应类型,目前已被应用于生态环境等多领域内多重压力源交互效应的评价[13-14]。因此,本研究希望通过计算混合碳源培养体系中外加碳源和抗生素对细菌的交互效应来有效表征外界碳源改变和抗生素胁迫的联合作用。
本研究以经典模式生物E. coli为受试生物,选取盐酸四环素(tetracycline hydrochloride, TCH)和2(5H)-呋喃酮(2(5H)-furanone, 2F)2种典型抗生素作为受试化合物,测定了在外加不同浓度Glc(0.00、0.25、0.50、1.00、1.50、2.00 g·L-1)的Mueller-Hinton(MH)培养基中TCH和2F单一及联合暴露对E. coli的Hormesis效应,进而分析培养体系中外加碳源对抗生素诱导Hormesis效应的调控作用;然后,采用影响因素Hegde’s d计算方法,判别外加碳源和抗生素胁迫对E. coli生长的交互效应,从而为从外界碳源角度更加全面地评估抗生素的生态风险提供数据支持。
1 材料与方法(Materials and methods)
1.1 实验材料
本研究所用受试生物为E. coli K-12 MG1655菌株,购自Biovector生物科技有限公司(北京,中国)。D-(+)-葡萄糖、盐酸四环素和2(5H)-呋喃酮等试剂均购自上海阿拉丁生物科技股份有限公司(上海,中国),试剂纯度均为分析纯。化合物的基本信息见表1。
表1 化合物的理化参数
Table 1 Physicochemical parameters of the compound

序号Ordinal名称NameCAS号CAS number缩写Abbreviation相对分子质量Relative molecular mass结构式Structural formula1D-(+)-葡萄糖D-(+)-glucose50-99-7Glc180.1602盐酸四环素Tetracycline hydrochloride64-75-5TCH480.90032(5H)-呋喃酮2(5H)-furanone497-23-42F84.073
1.2 受试生物的培养及工作菌液的制备
将斜面培养基中培养至第三代的E. coli接种至5 mL Luria-Bertani(LB)液体培养基(胰蛋白胨10 g·L-1,酵母浸粉5 g·L-1,氯化钠10 g·L-1,pH=7.3 ± 0.1)中,在37 ℃、160 r·min-1条件下培养6 h至对数生长期。随后将菌液稀释105倍,使菌密度维持在104 cell·mL-1左右,磁力搅拌40 min后得到工作菌液用于后续实验。
1.3 E. coli二次生长的测定
在0~2 g·L-1之间选择6个浓度的Glc(分别为0.00、0.25、0.50、1.00、1.50、2.00 g·L-1)加入到培养体系中,测定E. coli在添加Glc的MH培养基中的二次生长现象。在96孔板中依次加入1% NaCl溶液、含有不同浓度Glc的MH培养基(牛肉浸粉2 g·L-1,酸水解酪蛋白17.5 g·L-1,可溶性淀粉1.5 g·L-1,pH=7.3 ± 0.1)和工作菌液,每孔总体系为200 μL,每个浓度包含5个平行。在37 ℃、160 r·min-1条件下振荡培养24 h,使用全波长酶标仪(Spectramax190,Molecular Devices,美国)每小时测定一次600 nm处的光密度(OD600),观察各培养条件下E. coli的二次生长。
1.4 毒性试验
1.4.1 抗生素单一毒性的测定
分别在单一碳源培养体系(分别为0.00、0.25、0.50、1.00、1.50、2.00 g·L-1的单一Glc和1.5 g·L-1的单一可溶性淀粉)和混合碳源培养体系(包含0.00、0.25、0.50、1.00、1.50、2.00 g·L-1 Glc的MH培养基)中测定抗生素对E. coli的毒性效应。实验时,将受试抗生素溶解于适量1% NaCl溶液配制成抗生素标准溶液。实验时将抗生素标准溶液用1% NaCl溶液稀释成16个等对数梯度系列,将抗生素溶液加入96孔板中,每孔包含80 μL不同浓度的受试抗生素(实验组)或1% NaCl溶液(对照组)、80 μL单一/混合培养基以及40 μL工作菌液,每个浓度梯度点设置3个平行。随后将96孔板在37 ℃、160 r·min-1条件下振荡培养24 h,结束培养后用全波长酶标仪测定其OD600值。抗生素对E. coli的毒性效应采用生长抑制率(Inhibition)进行表征,其计算公式见式(1):
(1)
式中:OD600,0为E. coli在无抗生素作用的OD600平均值;OD600,i为E. coli在不同浓度抗生素作用下的OD600平均值。当Inhibition>0时,表示抗生素对E. coli生长产生抑制作用,当Inhibition<0时,表示抗生素对E. coli生长产生促进作用。
采用Hormesis方程对单一毒性实验的剂量-效应关系进行拟合,其表达式[15]见式(2):
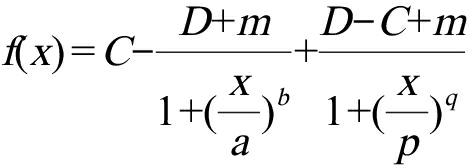
(2)
式中:C代表最大抑制率的趋近值;D代表低浓度处的趋近值;m代表最大刺激率的趋近值;a代表m/2处的浓度;b代表a处的斜率;p代表C/2处的浓度;q代表p处的斜率。
1.4.2 抗生素联合毒性的测定
根据单一抗生素的剂量-效应曲线(concentration-response curve, CRC)计算其半数效应浓度(EC50,mol·L-1),按照EC50A∶EC50B=1∶1的毒性比配制抗生素A与抗生素B的混合溶液。按照单一毒性的测定方法测定混合抗生素的联合毒性。采用独立作用模型(independent action model, IA)对2种抗生素的联合作用进行评价,IA模型计算公式[16-17]见式(3):
(3)
式中:cmix表示混合物的总浓度;E(ci)表示第i个组分独立存在且其浓度为ci时产生的效应;E(cmix)表示混合物的效应。基于单一毒性数据,IA曲线采用与实际CRC相同的拟合模型进行拟合,其统计学不确定性以95%置信区间表示,通过比较两者的位置关系判别2种抗生素的联合作用模式——实际CRC位于IA曲线及其95%置信区间的下方、中间和上方分别代表联合作用为拮抗、加和和协同。
1.5 外加碳源与抗生素对E. coli的交互效应
使用Hedge’s d[12]分别计算外加碳源和抗生素对E. coli生长的个体效应,个体效应表示E. coli对于单个应激源(外加碳源或抗生素)的反应,通过式(4)计算个体效应的Hedge’s d值:
(4)
式中:![]() 和
和![]() 分别是实验组和对照组中变量的平均值,s和J(m)分别是样本的标准偏差和校正项,通过式(5)和式(6)进行计算:
分别是实验组和对照组中变量的平均值,s和J(m)分别是样本的标准偏差和校正项,通过式(5)和式(6)进行计算:
(5)
(6)
式中:nt和st是实验组的样本量和标准偏差;nc和sc是对照组的样本量和标准偏差;m是自由度(m=nt+nc-2)。
随后,通过式(7)计算外加碳源和抗生素2个应激源对E. coli生长交互效应的Hedge’s d值:
(7)
式中:![]() 分别为对照组和实验组A、B及其组合(A+B)中变量的平均值,标准偏差(s)和自由度(m)分别通过式(8)和式(9)进行计算:
分别为对照组和实验组A、B及其组合(A+B)中变量的平均值,标准偏差(s)和自由度(m)分别通过式(8)和式(9)进行计算:
(8)
m=nc+nA+nB+nAB-4
(9)
根据式(7)计算的Hedge’s d值判别外加碳源和抗生素2个应激源对E. coli生长的交互效应类型:当Hedge’s d>0时,为拮抗作用,当Hedge’s d=0时,为相加作用;当Hedge’s d<0时,为协同作用。
2 结果与讨论(Results and discussion)
2.1 E. coli在混合碳源条件下的二次生长
E. coli在含有0.00(不添加Glc的对照组)、0.25、0.50、1.00、1.50、2.00 g·L-1 Glc的MH培养基中0~24 h的生长情况如图1(b)所示。如图1(a)所示,E. coli在添加Glc的MH培养基上生长期间呈现明显的二次生长模式,且E. coli 2次对数生长期之间的延滞期随培养体系中Glc浓度的升高而延长,这是E. coli的CCR机制调控的结果。
CCR为细菌在首选碳源存在的情况下,利用次级碳源的功能表达和相应酶的活性降低,进而阻碍细菌代谢次级碳源的一种调控现象。研究表明,由于Glc会诱导E. coli的CCR调控机制,E. coli在Glc和其他碳源(如乳糖、丙酮酸、富马酸等)的混合物中表现出二次生长的模式[18]。如图2所示,在E. coli中,EIIAGlc是CCR的中心处理单元,磷酸化的EIIAGlc可以结合并激活腺苷酸环化酶(adenylate cyclase, AC),从而导致环磷酸腺苷(cyclic adenosine monophosphate, cAMP)的合成,一定浓度的cAMP会触发cAMP-CRP复合物的形成,从而结合并激活分解代谢基因的启动子;而去磷酸化的EIIAGlc不能激活AC,这种情况下,EIIAGlc与次级碳源的代谢酶和转运蛋白结合,表现出对次级碳源代谢的抑制[19]。在本研究中,培养体系中加入Glc后,Glc的存在使EIIAGlc呈现去磷酸化的状态,此时E. coli优先代谢Glc(6~12 h),抑制其他碳源的代谢;Glc耗尽后,E. coli发生代谢适应性转变,进入延滞期;延滞期结束后,E. coli利用次级碳源进行生长,迎来一个新的对数生长期,E. coli呈现二次生长的模式。
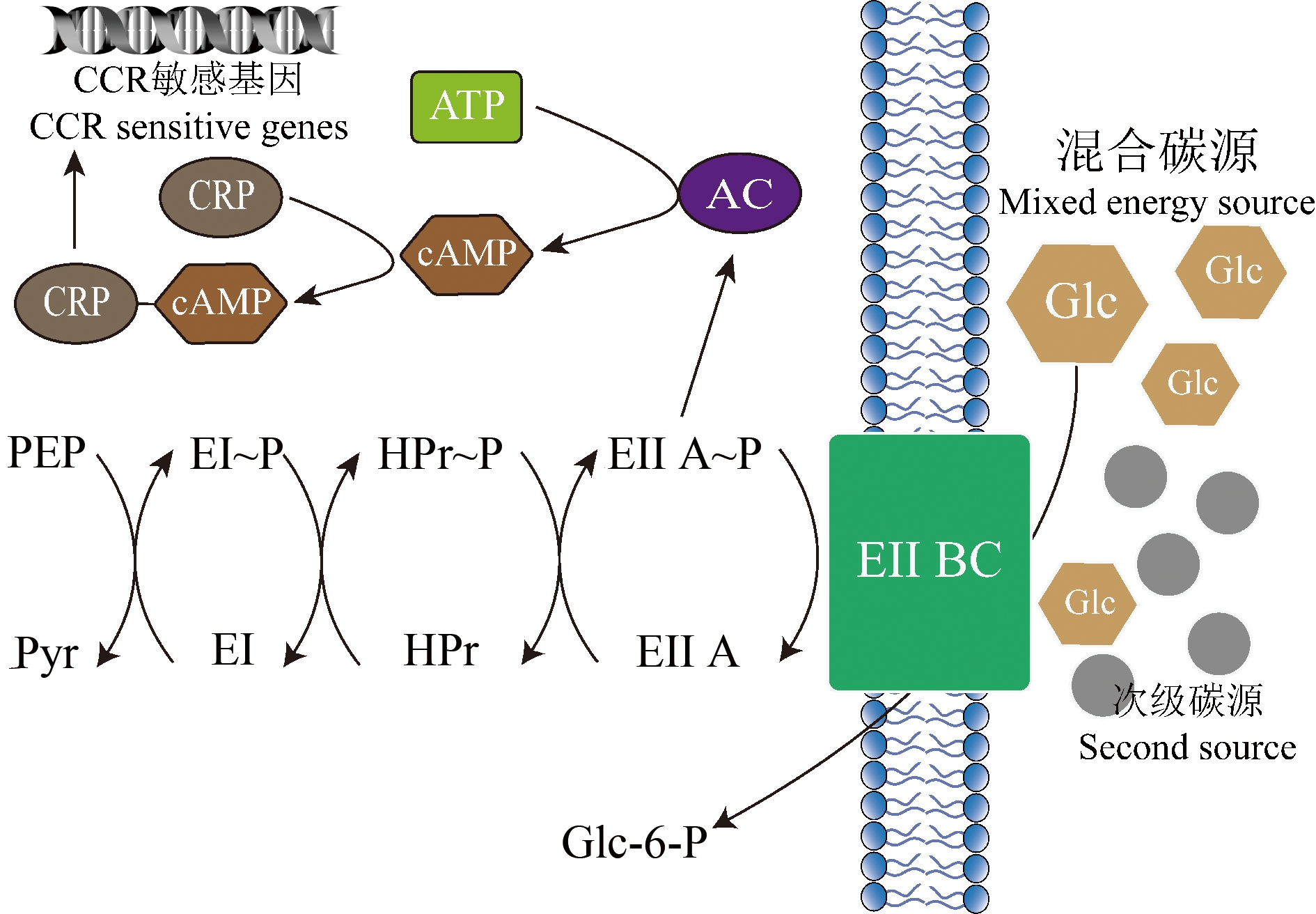
图2 E. coli的碳分解代谢物抑制
Fig. 2 Carbon catabolite repression in E. coli
然而,E. coli利用Glc快速生长期间会发生乙酸盐的“代谢溢出”。研究表明,Glc耗竭后E. coli发生适应性代谢调整,关键分解代谢过程的诱导被延迟[20],诱导前的延滞时间取决于乙酸盐的浓度——乙酸盐的浓度越高,延滞时间越长。当培养体系中Glc的浓度为2 g·L-1时,乙酸盐的“代谢溢出”严重,E. coli 2次对数生长之间的延滞期随之延长,导致该Glc浓度下生长的E. coli在培养第24小时仍处于延滞期。
2.2 外加碳源调控单一抗生素诱导的细菌Hormesis效应
结合2.1的实验结果,分别在含有相应浓度Glc、可溶性淀粉的单一碳源培养体系以及添加相应浓度Glc的MH培养基构成的混合培养体系中,测定24 h时TCH和2F单独作用对E. coli的毒性效应。由于单一Glc、可溶性淀粉培养条件中缺乏氮源,对照组(不添加抗生素)和各实验组(添加抗生素)中的E. coli均无法生长[21-22],故无法在这些培养条件下评估TCH和2F对E. coli的毒性效应。添加不同浓度Glc(0.00、0.25、0.50、1.00、1.50、2.00 g·L-1)的MH培养基中24 h时TCH和2F对E. coli的单一毒性剂量-效应曲线如图3所示,在MH培养基中生长的E. coli对2种抗生素的胁迫均表现出Hormesis效应。随着添加Glc浓度的增加,抗生素在低浓度下对E. coli的促进作用逐渐增强、促进区间逐步扩大,TCH和2F在第24小时对E. coli的最大促进率分别从44.58%和9.08%逐渐增加到158.65%和40.20%,促进区间右端点分别从1.96E-05 mol·L-1和3.56E-03 mol·L-1逐步增加到4.29E-05 mol·L-1和1.71E-02 mol·L-1;在高浓度下对E. coli的抑制作用逐渐减弱,TCH和2F在第24小时的EC50值分别由3.17E-05 mol·L-1和1.62E-02 mol·L-1逐渐增大到9.24E-05 mol·L-1和4.10E-02 mol·L-1。

图3 添加不同浓度Glc的MH培养基中24 h时TCH(a)和2F(b)对E. coli的单一毒性剂量-效应曲线
Fig. 3 Single toxic CRCs of TCH (a) and 2F (b) to E. coli in MH medium with different concentrations of Glc at 24 h
可见,添加Glc能够增强低浓度抗生素对E. coli生长的促进作用、减弱高浓度抗生素对E. coli的抑制作用。这可能与E. coli中CCR的调控有关。培养体系中Glc的存在使E. coli中的EIIAGlc呈现去磷酸化状态,去磷酸化的EIIAGlc不能激活AC,抑制了E. coli次级碳源分解代谢基因的表达;以往的研究表明抗生素进入细菌后可能与AC结合,从而暴露其活性位点,导致AC活性的增强,这将增加E. coli胞内cAMP的量以及cAMP-CRP复合物的积累[23],进而激活CCR敏感基因的转录,使得Glc耗尽后E. coli迅速转向对MH培养基中酸水解酪蛋白、牛肉浸粉等次级碳源的利用进行生长,导致抗生素在低浓度下对E. coli的促进作用的增强;另一方面,E. coli代谢Glc产生的代谢副产物乙酸盐可能会增强细菌外排泵的功能,减少抗生素的胞内积累[24],进而减少抗生素对E. coli的损伤,造成抗生素在高浓度下对E. coli抑制作用的减弱。
2.3 外加碳源调控混合抗生素诱导的细菌Hormesis效应
抗生素往往被混合使用以增加药效,因此TCH和2F在环境中存在共存可能。本文测定了添加不同浓度Glc(0.00、0.25、0.50、1.00、1.50、2.00 g·L-1)的MH培养基中24 h时TCH与2F对E. coli的联合毒性,并采用IA模型评价了2种抗生素在相应培养体系中的联合作用模式,结果如图4所示。
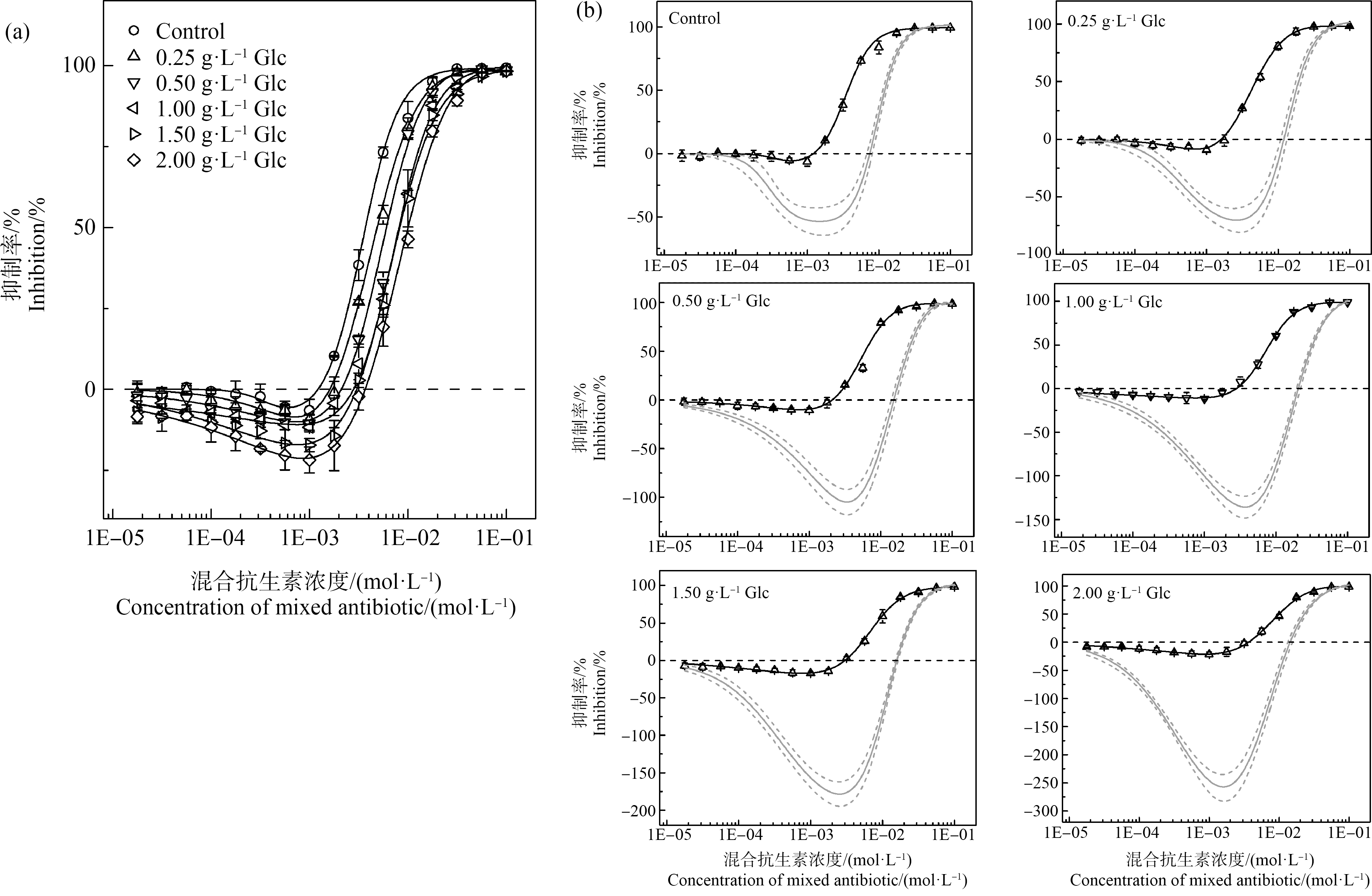
图4 添加不同浓度Glc的MH培养基中24 h时TCH与2F对E. coli的联合毒性剂量-效应曲线(a)及IA曲线(b)
注:图4(b)中,黑色实线代表实际的CRCs;灰色实线代表根据单一毒性数据计算拟合出的IA预测线;灰色虚线代表IA预测线的95%置信区间。
Fig. 4 Combined toxic CRCs (a) and IA curves (b) of TCH and 2F to E. coli in MH medium with different concentrations of Glc at 24 h
Note: In Fig.4(b), the solid black lines represent the actual CRCs; the solid grey line represents the calculated fitted IA prediction line based on a single toxicity data; the grey dashed line represents the 95% confidence interval of the IA prediction line.
添加不同浓度Glc(0.00、0.25、0.50、1.00、1.50、2.00 g·L-1)的MH培养基中24 h时TCH与2F对E. coli的联合毒性剂量-效应曲线如图4(a)所示。TCH与2F混合也可以诱导E. coli的Hormesis效应,与2.2的结果类似,添加Glc浓度的增加导致混合抗生素在低浓度下对E. coli的促进作用逐渐增强,在高浓度下对E. coli的抑制作用逐渐减弱,具体表现为最大促进率由5.63%逐渐增加到21.30%,促进区间右端点从1.22 E-03 mol·L-1逐渐扩大到3.68E-03 mol·L-1,EC50由3.71E-03 mol·L-1逐渐增加到1.01E-02 mol·L-1;这说明2种抗生素混合暴露时仍然能够影响E. coli的CCR机制。在各Glc浓度下TCH与2F联合作用的IA曲线如图4(b)所示,实际CRCs均位于IA曲线的上方,TCH与2F的联合作用呈现明显的协同效果;随着Glc浓度的增加,实际CRCs与IA曲线的距离逐渐增大,表明这2种抗生素的协同作用效果逐渐增强。
2.4 外加碳源与抗生素对E. coli生长的交互效应
本文使用影响因素Hedge’s d计算方法计算了混合培养体系中外加Glc和抗生素胁迫对E. coli的交互效应,结果如图5所示。

图5 培养体系中的Glc与抗生素对E. coli的交互效应
注:(a) TCH;(b) 2F;(c) TCH+2F。
Fig. 5 Interaction of Glc in culture systems and antibiotics on E. coli
Note: (a) TCH; (b) 2F; (c) TCH+2F.
Glc与TCH、2F、TCH+2F对E. coli的交互效应Hedge’s d值如图5(a)~5(c)所示。当TCH和2F单一暴露时,Glc与2种抗生素的交互效应Hedge’s d值均≥0,说明大部分情况下外加Glc和抗生素胁迫对E. coli的生长产生明显的拮抗作用。当TCH与2F联合暴露时,1.78E-05~1.00E-03 mol·L-1浓度范围内的混合抗生素与0.25 g·L-1 Glc的Hedge’s d值<0,其交互效应为协同作用;其余条件下混合抗生素与Glc的交互效应均表现为明显的拮抗作用(Hedge’s d>0)。随着培养体系中Glc浓度的增加,Hedge’s d值逐渐增大,拮抗作用也越来越明显。以上结果表明,无论抗生素单一作用还是混合作用,外加Glc与抗生素对E. coli的交互效应总体上为拮抗作用,且外加Glc浓度升高拮抗作用也随之增强,这说明外加Glc不利于抗生素细菌毒性的表达,但是有利于增强低浓度抗生素的Hormesis效应。
本文研究了添加0.00、0.25、0.50、1.00、1.50、2.00 g·L-1 Glc的MH培养基中2种抗生素(TCH和2F)单一及联合暴露对E. coli的Hormesis效应的调控作用,结果表明:
(1)无论是TCH或2F单一暴露还是TCH与2F联合暴露均能够诱导E. coli产生Hormesis效应,外加Glc能够对抗生素诱导E. coli产生的Hormesis效应具有调控作用——随着外加Glc浓度的升高,抗生素在低浓度下对E. coli的促进作用逐渐增强、促进区间逐步扩大,在高浓度下对E. coli的抑制作用逐渐减弱。外加Glc对抗生素诱导E. coli的Hormesis效应的调控作用可能与E. coli的CCR途径有关。
(2)IA模型计算的结果表明,TCH与2F的联合作用模式为协同,随着外加Glc浓度的升高,2种抗生素之间的协同作用逐渐增强。交互效应的计算结果表明,外加Glc与抗生素对E. coli的交互效应总体上呈拮抗作用,且外加Glc浓度的升高,拮抗作用也随之增强,表明外加Glc不利于抗生素细菌毒性的表达。
(3)本研究表明外加碳源能够调控抗生素诱导E. coli产生的Hormesis效应,进而抑制抗生素细菌毒性的表达。本研究可为Hormesis效应在抗生素的生态影响评估中的应用提供数据基础。
[1] Grenni P, Ancona V, Barra Caracciolo A. Ecological effects of antibiotics on natural ecosystems: A review [J]. Microchemical Journal, 2018, 136: 25-39
[2] Calabrese E J, Baldwin L A. Toxicology rethinks its central belief [J]. Nature, 2003, 421(6924): 691-692
[3] 于岩, 游瑞容, 姚志峰, 等. 氯霉素对费氏弧菌0~24h的Hormesis效应及其机制初探[J]. 同济大学学报(自然科学版), 2016, 44(5): 767-772
Yu Y, You R R, Yao Z F, et al. Chloramphenicol hormesis effects about time-dependent and mechanism on Vibrio fischeri [J]. Journal of Tongji University (Natural Science), 2016, 44(5): 767-772 (in Chinese)
[4] Shen H Y, Liu Y Y, Liu Y N, et al. Hormetic dose-responses for silver antibacterial compounds, quorum sensing inhibitors, and their binary mixtures on bacterial resistance of Escherichia coli [J]. Science of the Total Environment, 2021, 786: 147464
[5] 宋春磊, 方淑霞, 周虹, 等. 抗生素单一及联合暴露对RP4质粒介导的抗性基因水平转移的Hormesis效应研究[J]. 生态毒理学报, 2017, 12(1): 148-154
Song C L, Fang S X, Zhou H, et al. Hormesis effect of single and combined exposure of antibiotics on antibiotic resistance gene transfer mediated by RP4 plasmid [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 148-154 (in Chinese)
[6] Tang L A, Zhou Y, Zhang Y L, et al. The role of energy source or substrate in microbial hormesis [J]. Current Opinion in Toxicology, 2022, 29: 10-18
[7] Towbin B D, Korem Y, Bren A, et al. Optimality and sub-optimality in a bacterial growth law [J]. Nature Communications, 2017, 8: 14123
[8] Pacciani-Mori L,Giometto A, Suweis S, et al. Dynamic metabolic adaptation can promote species coexistence in competitive microbial communities [J]. PLoS Computational Biology, 2020, 16(5): e1007896
[9] Saitanis C J, Agathokleous E. Stress response and population dynamics: Is Allee effect hormesis? [J]. The Science of the Total Environment, 2019, 682: 623-628
[10] Heo J M, Kim H J, Lee S J. Efficient anaerobic consumption of D-xylose byE. coli BL21(DE3) via xylR adaptive mutation [J]. BMC Microbiology, 2021, 21(1): 332
[11] Sauvage S, Gaviard C, Tahrioui A, et al. Impact of carbon source supplementations on Pseudomonas aeruginosa physiology [J]. Journal of Proteome Research, 2022, 21(6): 1392-1407
[12] Gurevitch J, Morrow L L, Wallace A, et al. A meta-analysis of competition in field experiments [J]. The American Naturalist, 1992, 140(4): 539-572
[13] Crain C M, Kroeker K, Halpern B S. Interactive and cumulative effects of multiple human stressors in marine systems [J]. Ecology Letters, 2008, 11(12): 1304-1315
[14] Zhou L Y, Zhou X H, Shao J J, et al. Interactive effects of global change factors on soil respiration and its components: A meta-analysis [J]. Global Change Biology, 2016, 22(9): 3157-3169
[15] Deng Z Q, Lin Z F, Zou X M, et al. Model of hormesis and its toxicity mechanism based on quorum sensing: A case study on the toxicity of sulfonamides to Photobacterium phosphoreum [J]. Environmental Science &Technology, 2012, 46(14): 7746-7754
[16] Bureš M ![]() M, Miloloža M, et al. Modeling the toxicity of pollutants mixtures for risk assessment: A review [J]. Environmental Chemistry Letters, 2021, 19(2): 1629-1655
M, Miloloža M, et al. Modeling the toxicity of pollutants mixtures for risk assessment: A review [J]. Environmental Chemistry Letters, 2021, 19(2): 1629-1655
[17] 刘树深, 刘玲, 陈浮. 浓度加和模型在化学混合物毒性评估中的应用[J]. 化学学报, 2013, 71(10): 1335-1340
Liu S S, Liu L, Chen F. Application of the concentration addition model in the assessment of chemical mixture toxicity [J]. Acta Chimica Sinica, 2013, 71(10): 1335-1340 (in Chinese)
[18] Mahadevan R, Edwards J S, Doyle F J. Dynamic flux balance analysis of diauxic growth in Escherichia coli [J]. Biophysical Journal, 2002, 83(3): 1331-1340
[19] Görke B, Stülke J. Carbon catabolite repression in bacteria: Many ways to make the most out of nutrients [J]. Nature Reviews Microbiology, 2008, 6(8): 613-624
[20] Enjalbert B, Cocaign-Bousquet M, Portais J C, et al. Acetate exposure determines the diauxic behavior of Escherichia coli during the glucose-acetate transition [J]. Journal of Bacteriology, 2015, 197(19): 3173-3181
[21] Bren A, Park J O, Towbin B D, et al. Glucose becomes one of the worst carbon sources for E. coli on poor nitrogen sources due to suboptimal levels of cAMP [J]. Scientific Reports, 2016, 6: 24834
[22] Chubukov V, Sauer U. Environmental dependence of stationary-phase metabolism in Bacillus subtilis and Escherichia coli [J]. Applied and Environmental Microbiology, 2014, 80(9): 2901-2909
[23] Sun H Y, Zhang X Y, Wang D L, et al. Insights into the role of energy source in hormesis through diauxic growth of bacteria in mixed cultivation systems [J]. Chemosphere, 2020, 261: 127669
[24] Liu Y, Fang D, Yang K N, et al. Sodium dehydroacetate confers broad antibiotic tolerance by remodeling bacterial metabolism [J]. Journal of Hazardous Materials, 2022, 432: 128645