银(silver, Ag)的离子态(Ag+)具有高毒性,与铬(chromium, Cr)和镉(cadmium, Cd)在一个量级,但弱于汞(mercury, Hg)[1-3]。Ag+目前广泛应用为抗菌敷料、防辐射面料和电极材料等,对生态环境和人类健康具有潜在风险[4]。Ag+可以积累于植物体内,扰乱植物生理代谢。例如,Ag+显著积累于蓖麻(Ricinus communis L.)体内,并诱导了抗氧化酶活性和非酶抗氧化物含量的升高,并抑制了种子萌发[5]。另外,莴苣(Lactuca sativa L.)的根/叶Ag+暴露均会造成Ag+在植物体内的迁移与积累[6]。除此之外,玉米(Zea mays L.)可以内化暴露介质中的Ag+并将其转化为Ag NPs,伴随着Ag+与Cl-的共定位[7]。目前关于Ag+毒性的研究主要聚焦在食用作物上,然而一些具有药用与饲料营养价值的草本植物也与人类健康息息相关,例如红车轴草(Trifolium pratense L.),作为广泛分布的陆生豆科植物,常被应用为药用植物、牧草和观赏草。红车轴草还是矿区地区优势属,广泛用作修复植物和护坡草,而土壤是Ag+的重要归宿(例如含Ag矿区土壤污染、矿区废水和烟尘沉降),导致Ag+与红车轴草相互接触不可避免[8-9]。因此评估Ag+对红车轴草的生理生化效应有利于全面评价Ag潜在的生态风险。
Ag+对植物的毒性机制已被广泛研究与报道,例如生长抑制[10]、氧化应激[11]、抗氧化酶激活[12]、毒物兴奋效应[13]、遗传表达[14]和代谢变化[15]等。而Ag+对植物光合作用的影响尚需深刻探索。植物进行光合作用时可以通过同化无机碳化物的方式把太阳能转变为化学能并同时调节大气中氧气含量。对于红车轴草来说,其良好的光合效率对作物品质至关重要[16-17],例如氨基酸、类黄酮、糖类和维生素等物质的转化与合成均与其光合活性显著相关。因此,探索Ag+污染对红车轴草光合生理生化及分子机制具有重要学术价值和实际生产意义。本论文致力于从表观生理、生化指标以及细胞和分子水平上探索Ag+暴露对红车轴草光合活性的影响,从而提供Ag+对植物毒性的深层次理解。
本文选取豆科作物红车轴草作为受试植物,以AgNO3暴露近似Ag+暴露[18],探索了AgNO3对红车轴草光合效率的影响。研究的主要内容包括:(1) AgNO3处理下红车轴草的光合理化参数变化;(2) AgNO3处理下红车轴草的细胞结构变化;(3) AgNO3处理下红车轴草的光合基因表达情况。
1 材料与方法(Materials and methods)
1.1 植物材料与处理
从辽宁省农业科学院获得红车轴草种子用于评估AgNO3毒性。红车轴草种子用0.1% HgCl2表面灭菌10 min,去离子水洗涤3次。随后,将种子转移到含超纯水的幼苗托盘中,在种子萌发3 d后用1/2浓度的霍格兰营养液替换。种子在25~30 ℃的生长室中生长,明暗周期为12 h/12 h。光强度为100 μmol·m-2·s-1。培育2周后,选择大小均匀的红车轴草幼苗进行AgNO3暴露试验。从Sigma-Aldrich(西格玛奥德里奇(上海)贸易有限公司)购买的分析纯AgNO3用作Ag+源。幼苗暴露于0、29、294和588 μmol·L-1 AgNO3溶液内,分别代表低、中和高水平的AgNO3胁迫(此暴露浓度非环境浓度,仅用于理论研究参考)。在不含AgNO3的超纯水中培养的红车轴草幼苗作为对照组。经过3 d和8 d的AgNO3胁迫,取样并进行后续分析。
1.2 光系统Ⅱ(photosystem Ⅱ, PS Ⅱ)最大量子效率(optimal/maximal quantum yield of PSⅡ, Fv/Fm)与胞间CO2浓度的测定
Fv/Fm测定前,将待测红车轴草幼苗进行24 h遮光处理。利用便携式光合作用系统(美国LI-COR公司,LI-6400XT便携式光合作用测量系统)进行Fv/Fm的测定,操作参数如下:强度(intensity)设定为3;调制频率(rate)设定为0.25 kHz;信号平均频率(filter)为1;放大倍数(gain)为10;下降幅度(ramp)为30%;三阶段(phase 1, 2, 3)均为300 ms。同时测量细胞间CO2浓度。测量条件如下:温度25~30 ℃;相对湿度70%;光强100 μmol·m-2·s-1。
1.3 叶绿素a、b含量测定
叶绿素a、b含量的测定方法基于Zhao等[19]的研究,并进行了一些修改。准确称取新鲜叶片样品(0.2±0.001) g并将其浸入含有丙酮、乙醇和水(V∶V∶V= 4.5∶4.5∶1)的25 mL提取液中,并在黑暗中处理24 h。在649 nm和665 nm处测量上清液的吸光度。Chl a和Chl b的含量计算方法如下:
CChl a = 13.95A665-6.88A649
CChl b = 24.96A649-7.32A665
1.4 核酮糖-1,5-二磷酸核酮糖羧化酶活性测定
核酮糖-1,5-二磷酸核酮糖羧化酶活性测定方法参考Shabnam和Pardha-Saradhi[20]的研究。叶片在含有1 mmol·L-1二硫苏糖醇,5 mmol·L-1乙二胺四乙酸和5%聚乙烯吡咯烷酮且冷却的50 mmol·L-1 Tris-HCl缓冲液(pH 7.6)中均匀研磨。研磨匀浆在15 000 × g下,4 ℃离心20 min,上清液用作粗酶提取液,在(25±2) ℃下测定核酮糖-1,5-二磷酸核酮糖羧化酶活性。测定体系为粗酶提取液,Tris-HCl缓冲液(200 mmol·L-1, pH 8.5),1 mmol·L-1 1,5-二磷酸核酮糖,10 mmol·L-1碳酸氢钠,5 mmol·L-1氯化镁,0.1 mmol·L-1二硫苏糖醇,1 mmol·L-1三磷酸腺苷,5单位磷酸甘油酸激酶,5单位甘油醛-3-磷酸脱氢酶和0.2 mmol·L-1还原型辅酶Ⅰ(nicotinamide adenine dinucleotide, NADH)的混合物。在340 nm处记录NADH的氧化。核酮糖-1,5-二磷酸核酮糖羧化酶的活性计量单位是单位鲜质量、单位时间氧化的NADH物质的量,nmol·min-1·g-1,最终表达形式为单位鲜质量、单位时间固定的CO2物质的量,nmol·min-1·g-1。
1.5 显微结构观察
利用荧光显微镜(日本Olympus公司,Olympus BX 53)观察AgNO3暴露后红车轴草根,叶组织的显微结构变化。根据Tarrahi等[21]的方案,在10 min内用0.1%的金胺O染色并制作植物组织切片,随后在420~485 nm激发光下观察样本。
1.6 超微结构观察
利用透射电镜(日本Hitachi公司,Hitachi T7700)对红车轴草幼苗进行超微结构分析。将暴露于588 μmol·L-1 AgNO3和对照组的红车轴草幼苗根的分生区和1 mm×1 mm×2 mm叶片组织(避开叶脉)切片,收集并于3%戊二醛中预固定,然后在0.1 mol·L-1磷酸盐缓冲液(pH 7.2)中润洗。随后,将样品切片在1%的锇酸中固定2 h,然后进行漂洗,乙醇系列脱水,并将其固定在SPI 812环氧树脂中。最终,利用超薄切片机(德国Leica公司,Leica EM UC7)获取超薄切片,醋酸铀酰/柠檬酸铅进行染色,并上机观察。
1.7 转录组
转录组学委托中国苏州金唯智生物科技有限公司全权负责。
1.7.1 mRNA测序
收集长度约为1 cm,总质量至少为6 g的红车轴草幼苗根尖(588 μmol·L-1 AgNO3处理8 d),用于检测基因表达,使得每组处理共有约900株红车轴草幼苗(3次平行实验,每个实验300株)用于转录组测序。
使用Trizol试剂提取每个样品的总RNA。每个样品的总RNA通过生物分析仪(美国Agilent公司,Agilent 2100/2200)进行量化和鉴定。1 μg总RNA用于以下文库的制备。下一代测序文库的制备是根据制造商的协议构建的。使用Poly(A) mRNA磁性分离模块或rRNA去除套装进行Poly(A) mRNA分离。使用第一链合成反应缓冲液和随机引物进行mRNA的破碎和引物处理。使用ProtoScript Ⅱ逆转录酶合成第一链cDNA,使用第二链合成酶混合物合成第二链cDNA。然后用End Prep酶混合液处理纯化的双链cDNA,在一个反应中修复两端并添加dA-tailing,接着用T-A连接在两端添加适应体。然后用珠子对适配体连接的DNA进行大小选择,回收了约400 bp的片段(插入物大小约为300 bp)。然后使用P5和P7引物对每个样品进行PCR扩增,这2种引物都带有可与流动池退火的序列,以进行桥式PCR,P5/P7引物携带的指数可用于多路复用。PCR产物用珠子清理,用Qsep100(中国光鼎生物科技(江苏)有限公司,光鼎Qsep100)验证,并用荧光仪(美国Thermo Fisher Scientific公司,Thermo Fisher Scientific Qubit3.0)进行定量。
然后将不同指数的文库复用,并根据制造商的说明加载到Illumina HiSeq仪器(美国Illumina公司)或根据制造商的说明加载到MGI2000仪器(中国华大基因)。测序采用2 × 150配对末端配置;图像分析和碱基调用由HiSeq仪器上的HiSeq控制软件(HCS)+OLB+GAPipeline-1.6进行,图像分析和碱基调用由NovaSeq仪器上的NCS+OLB+GAPipeline-1.6进行;图像分析和碱基调用由MGI2000仪器上的Zebeacall进行。
1.7.2 数据分析
1.7.2.1 质量控制
为了去除技术序列,包括适配器,聚合酶链式反应引物或其片段,以及质量低于20的碱基,用Cutadapt(v1.9.1)处理fastq格式的通滤数据,使之成为高质量的清洁数据。
1.7.2.2 组装
首先,用Trinity(v2.2.0)进行组装,它代表了一种从RNA-seq数据中高效、稳健地从头重建转录组的新方法[22]。Trinity结合了3个独立的软件模块(Inchworm, Chrysalis, Butterfly)。按顺序用于处理大量的RNA-seq读数。其次,通过cd-hit去除重复的contigs,然后得到unigene序列文件。
1.7.2.3 表达式分析
以单基因序列文件作为参考基因文件,RSEM(v1.2.28)从对端清洁数据中估计基因和同种型的表达水平[23]。
1.7.2.4 差异表达分析
差异表达分析使用DESeq2 Bioconductor软件包,这是一个基于负二项分布的模型。分散性和对数倍变化的估计结合了数据驱动的先验分布,并将基因的Padj设定为<0.05以检测差异表达。
1.8 蛋白-蛋白相互作用分析(Protein-protein interaction analysis, PPI)
将差异表达基因列表过滤并输入至STRING数据库(v11.5)以获得相互作用网络。随后利用Cytoscape(v3.7.3)筛选目标基因并分析与可视化。
1.9 统计分析
以AgNO3浓度作为自变量,将Fv/Fm值,胞间CO2浓度,叶绿素a、b浓度,核酮糖-1,5-二磷酸核酮糖羧化酶活性作为因变量进行单因素方差分析。通过LSD测试比较数据均值的显著性差异(P<0.05)。数据呈现为均值±标准差。
2 结果与讨论(Results and discussion)
2.1 AgNO3暴露下红车轴草光合参数的变化
植物光合作用对外界环境条件的变化具有较强的敏感度,而PS Ⅱ在植物对逆境的光合响应过程中具有重要作用。叶绿素荧光参数可以反映环境条件对植物光能吸收、传递和分配等的影响。因此,为了评估AgNO3暴露对光合作用的影响,对受迫叶片PS Ⅱ的Fv/Fm进行了评估。AgNO3暴露显著影响了PS Ⅱ的效率,且伴随着明显的浓度效应(低促高抑)(图1(a))。具体来说,29 μmol·L-1 AgNO3暴露提升了Fv/Fm值,相比于对照组升高了30.63%。而294 μmol·L-1和588 μmol·L-1 AgNO3处理分别抑制了红车轴草的PS Ⅱ的效率,相比于对照组分别降低了33.51%和89.53% (P<0.05)。

图1 AgNO3暴露对红车轴草光合作用的效应
注:(a) Fv/Fm;(b) 叶绿素a含量;(c) 叶绿素b含量;(d) 核酮糖-1,5-二磷酸核酮糖羧化酶活性;(e) 胞间CO2浓度;(f) 根长;不同小写字母表示差异显著(P<0.05)。
Fig. 1 The effects of AgNO3 exposure on the Trifolium pratense L. photosynthesis
Note: (a) Fv/Fm value; (b) Chlorophyll a content; (c) Chlorophyll b content; (d) Rubisco activity; (e) Intercellular CO2 concentration; (f) Root length; different letters represent significant differences (P<0.05).
叶绿素含量会显著影响叶绿素荧光动力学。因此,我们评估了AgNO3暴露3 d条件下,叶绿素a和叶绿素b的含量变化。叶绿素a、b的浓度显著降低,呈现明显剂量效应(低促高抑)(图1(b), 1(c))。具体来说,29 μmol·L-1和294 μmol·L-1 AgNO3暴露促进了叶绿素a的合成,相比于对照组分别提升了32.68%和4.91%(P<0.05)。而588 μmol·L-1 AgNO3抑制了叶绿素a的合成,相比于对照组降低了22.36%。相似的,29 μmol·L-1 AgNO3处理促进了叶绿素b的合成,相比于对照组提升了38.37%。而294 μmol·L-1和588 μmol·L-1 AgNO3抑制了叶绿素b的合成,相比于对照组分别降低了5.34%和18.6%(P<0.05)。叶绿素a、b含量的降低潜在地显示AgNO3对色素合成酶的抑制[24-25]。同时,Ag可能竞争性地替换叶绿素中的Mg元素,扰乱其生理功能[26]。另外,AgNO3对光合电子传递链的扰乱也是重要原因[27]。相似的叶绿素含量降低的现象也在Ag+处理的拟南芥(Arabidopsis thaliana)[18]、小球藻(Chlorella vulgaris)[28]和紫萍(Spirodela polyrhiza)[29]中观察到。
受试植物叶片中核酮糖-1,5-二磷酸核酮糖羧化酶活性在588 μmol·L-1 AgNO3处理下也显著降低,相比于对照组降低了80.13%(P<0.05)(图1(d)),而核酮糖-1,5-二磷酸核酮糖羧化酶通常与植物的固碳能力有关。由此推断,AgNO3对红车轴草的光合抑制机制是:(1) Ag元素会与蛋白或色素结构中含有的金属离子进行交换,致使其失活,或与关键基因编码的功能蛋白发生作用(主要与巯基发生作用),致使蛋白及细胞功能紊乱;(2)Ag+介导活性氧(reactive oxygen species, ROS)的产生,攻击植物色素与功能酶;(3)Ag+或其诱导ROS对光合电子传递链的扰乱[30-32]。相应地,294 μmol·L-1和588 μmol·L-1 AgNO3处理下红车轴草的胞间CO2浓度显著升高,相较于对照组分别升高了2.43%和66.94%(P<0.05)(图1(e)),表明了红车轴草固碳能力的下降。
值得注意的是,低浓度29 μmol·L-1 AgNO3处理下光合能力的增强(例如Fv/Fm与叶绿素含量的升高和固碳能力的增强)可能与N元素的补充(源于![]() 促进光合色素及相关酶的合成[33-34]以及毒物兴奋效应有关,即低水平毒物的存在可以激活修复机制,过补偿毒性抑制[35]。特别地,植物根系生长状态与光合作用强度呈显著正相关关系(图1(f))。植物根系是吸收与传递营养物质的重要器官,而588 μmol·L-1 AgNO3处理下红车轴草根系生长显著减缓,相比于对照组降低了62.47%(P<0.05)。因此AgNO3对红车轴草光合作用的抑制可以部分归因于对根系的活性抑制,减弱了对叶片的能量与物质供应。
促进光合色素及相关酶的合成[33-34]以及毒物兴奋效应有关,即低水平毒物的存在可以激活修复机制,过补偿毒性抑制[35]。特别地,植物根系生长状态与光合作用强度呈显著正相关关系(图1(f))。植物根系是吸收与传递营养物质的重要器官,而588 μmol·L-1 AgNO3处理下红车轴草根系生长显著减缓,相比于对照组降低了62.47%(P<0.05)。因此AgNO3对红车轴草光合作用的抑制可以部分归因于对根系的活性抑制,减弱了对叶片的能量与物质供应。
2.2 AgNO3暴露下红车轴草的细胞形态观察
红车轴草的根、叶组织形态在AgNO3暴露下发生了明显变化。随着暴露时间的延长,叶片依次出现了黄化/枯萎/叶绿体萎缩(3 d,图2(b))、叶绿体的逐渐解体/紊乱分散(5 d,图2(c))以及叶绿体的消失和黑色物质的积累(8 d,图2(d))。而对照组叶片显示出良好的细胞形态和均一分布的叶绿体(离心分散,图2(a))。这也映证了之前所观察到的光合色素含量的下降和荧光参数的降低等现象(图1)。另外,在AgNO3暴露下,红车轴草根系逐渐发黑并伴随着黑色颗粒的形成(图2(f)),推测这与进入植物体内的AgNO3发生转化过程有关。例如,AgNO3会与还原性物质或含—SH的蛋白结合,形成Ag NPs或Ag (Ⅰ)-胞内络合物[8]。值得注意的是,根系是植物同化用于生理生化反应(例如光合作用)营养物质的重要器官。因此,根系的损伤可能会直接导致植物体光合速率的下降[36]。

图2 588 μmol·L-1 AgNO3暴露后红车轴草的显微结构分析
注:(a) 叶片-对照,(b) 叶片-3 d,(c) 叶片-5 d;(d) 叶片-8 d;(e) 根系-对照,(f) 根系-8 d。
Fig. 2 The microstructure analysis of Trifolium pratense L. after exposure to 588 μmol·L-1 AgNO3
Note: (a) Leaf-control, (b) Leaf-3 d, (c) Leaf-5 d, (d) Leaf-8 d; (e) Root-control, (f) Root-8 d.
2.3 AgNO3暴露下红车轴草的亚细胞结构变化
AgNO3暴露诱导了明显的亚细胞结构变化(图3)。在对照组叶片细胞中观察到了离心分布的细胞器、含淀粉粒的叶绿体和嗜锇颗粒等(图3(a))。而AgNO3处理严重破坏了细胞组织,呈现出解体的叶绿体和细胞内成分的聚集(图3(b)),这也在亚微观结构上解释了光合相关参数降低的原因(图1),并与光学显微结果互相映证(图2)。如前所述,根系的生理功能和植物稳态紧密相关[18],因此,对根细胞的亚微观形态进行了观察。相似地,在对照组根细胞中观察到了线粒体和内质网等细胞器和均匀分散的细胞内成分(图3(c))。而AgNO3暴露8 d后,根细胞内容物呈现明显的聚集态,并伴随有囊泡的形成(图3(d))。囊泡的形成通常与细胞自噬有关。细胞自噬是一种精细的细胞过程,双层膜结构的自噬小泡包裹损坏的蛋白或损伤的细胞器并将其送入液泡内进行降解以循环利用,从而维持细胞稳态,其可能会驱动胁迫条件下的细胞程序化死亡[37]。总地来说,细胞成分的破坏可能与以下原因有关:(1)AgNO3暴露诱导的类高盐度胁迫,致使细胞脱水,从而使细胞结构变形、萎缩;(2)营养限制,例如Fe元素的缺失会导致叶绿体的解体或液泡化;(3)AgNO3与细胞内成分(蛋白质或脂质)的结合,如含—SH的蛋白质,从而改变蛋白质构象,致使其失活;(4)AgNO3诱导ROS生成,通过损伤不饱和脂肪酸和结构蛋白,诱发细胞结构的改变[27]。
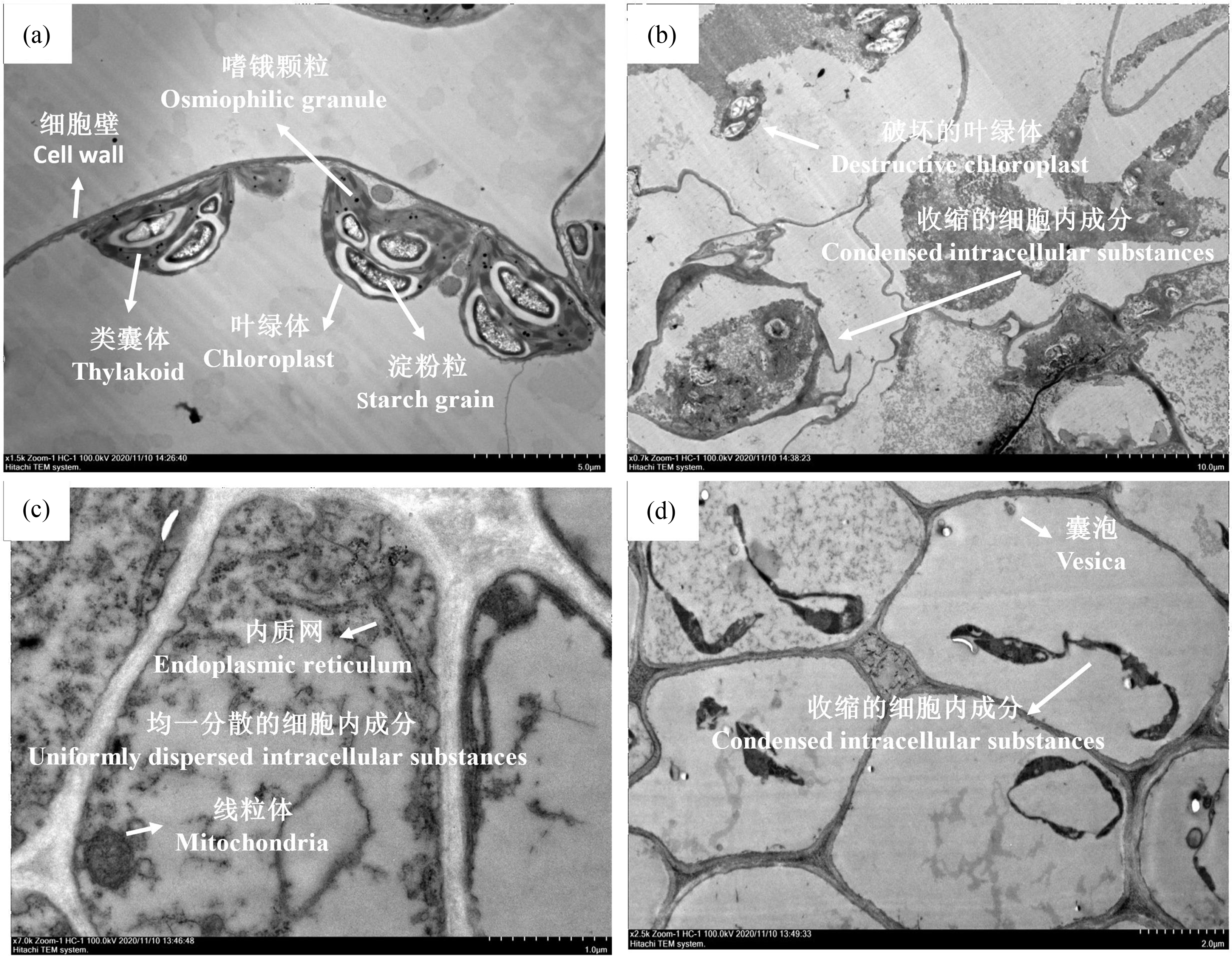
图3 588 μmol·L-1 AgNO3暴露8 d后红车轴草的超微结构分析
注:(a) 叶片-对照,(b) 叶片-8 d;(c) 根系-对照,(d) 根系-8 d。
Fig. 3 The ultrastructure analysis of Trifolium pratense L. after exposure to 588 μmol·L-1 AgNO3
Note: (a) Leaf-control, (b) Leaf-8 d; (c) Root-control, (d) Root-8 d.
2.4 AgNO3暴露下红车轴草光合相关基因的表达分析
AgNO3暴露8 d后,红车轴草基因表达水平显著提升(图4)。对差异表达基因(differential expressed genes, DEGs)中的光合作用相关基因进行了筛选,鉴别到数个高表达量基因(log2|Fold Change|≥10),例如RNA polymerase sigma factor sigE(Gene ontology (GO):0071483: cellular response to blue light, GO:0009658: chloroplast organization, GO:0010207: photosystem Ⅱ assembly, GO:0010218: response to far red light, GO:0010114: response to red light)、Heme oxygenase 1, chloroplastic(GO:0016117: carotenoid biosynthetic process, GO:0071494: cellular response to UV-C, GO:0010019: chloroplast-nucleus signaling pathway, GO:0015979: photosynthesis, GO:0010024: phytochromobilin biosynthetic process)和Glycerate dehydrogenase HPR, peroxisomal(GO:0071482: cellular response to light stimulus, GO:0009854: oxidative photosynthetic carbon pathway)等(表1)。
表1 AgNO3处理下红车轴草叶片内显著上调的10个光合作用相关基因
Table 1 Top 10 unique genes significantly up-regulated in leaves of Trifolium pratense L. following AgNO3 treatment
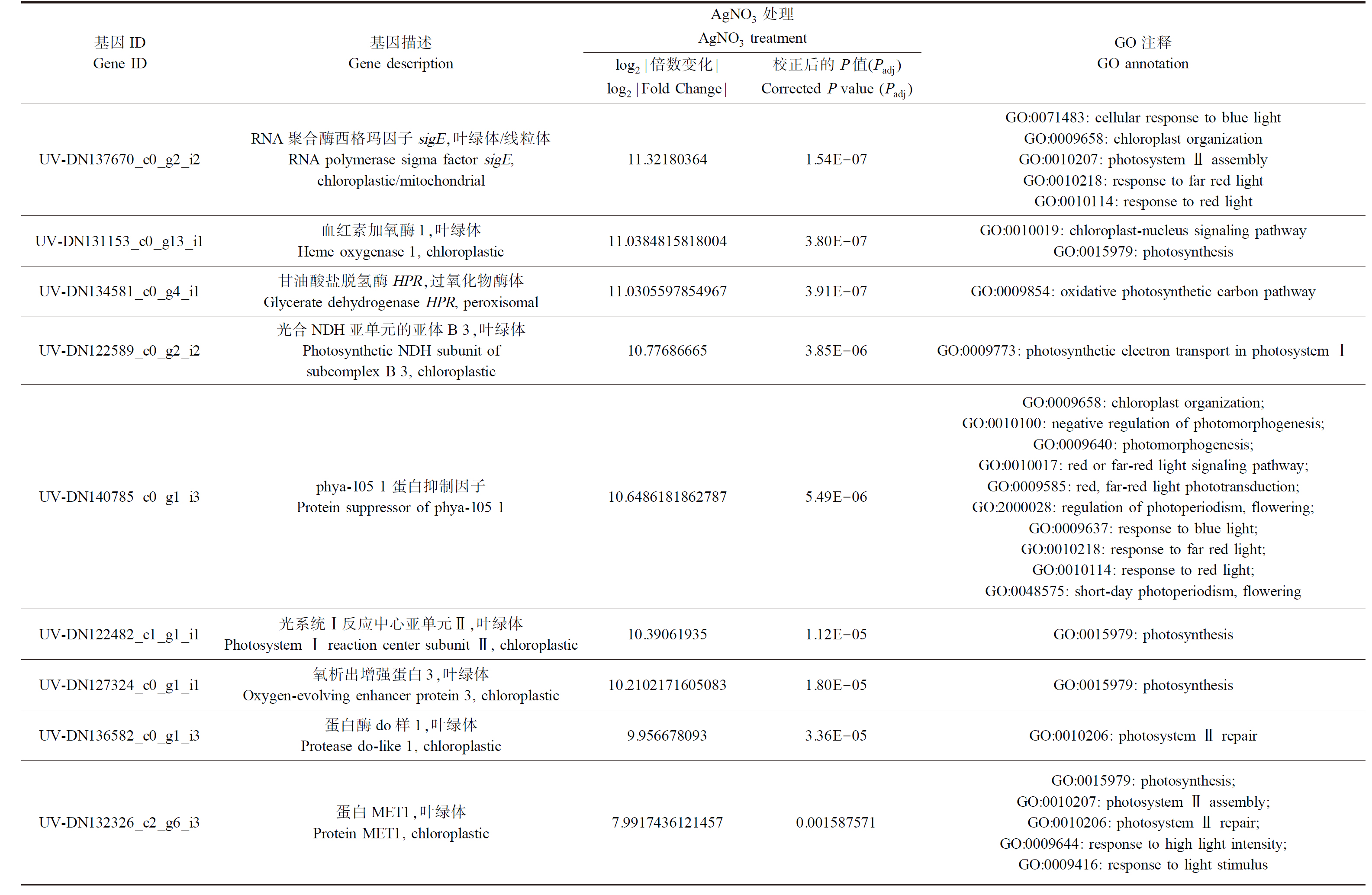
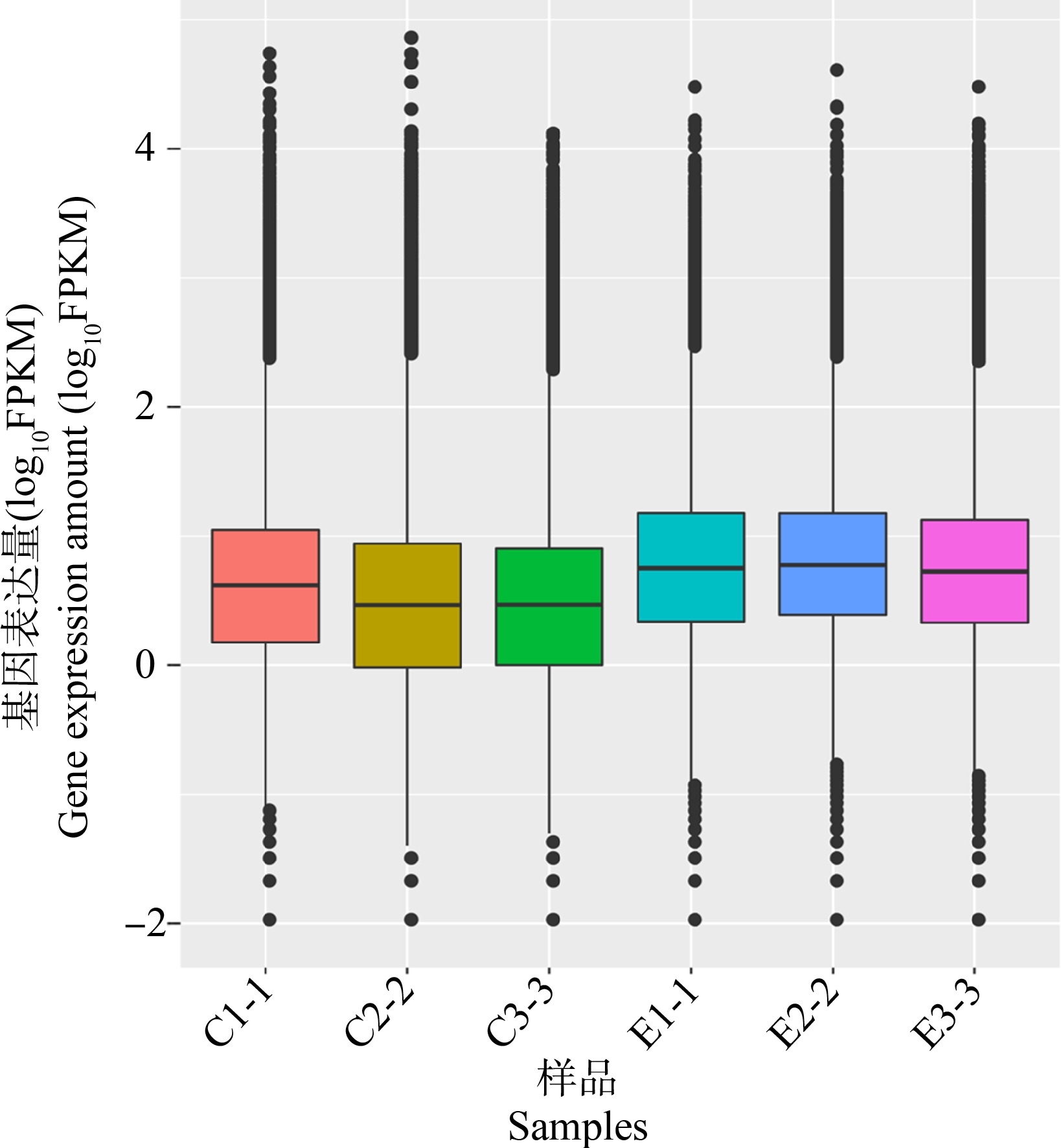
图4 基因表达水平对比
注:C1-1、C2-2、C3-3为对照组;E1-1、E2-2、E3-3为处理组。
Fig. 4 Comparison of gene expression levels
Note: C1-1, C2-2, C3-3 represent control groups; E1-1, E2-2, E3-3 represent experimental groups.
基因sigE,2型sigma因子,被证实在光胁迫耐受中具有重要作用。例如抵抗强光对PS Ⅱ的光抑制[38],侧面反映了AgNO3对PS Ⅱ的活性抑制。相似的sigma因子,例如RNA polymerase sigma factor sigB(log2|Fold Change|=8.85)、RNA polymerase sigma factor sigC(log2|Fold Change|=7.13)和RNA polymerase sigma factor sigD, chloroplastic(log2|Fold Change|=5.74)在AgNO3处理的红车轴草体内也显著上调表达。
Heme oxygenase (HO) 1, chloroplastic在AgNO3处理的红车轴草体内显著上调表达。HO是一种氧化还原酶,主要分为3类,HO-1、HO-2和HO-3,HO可以在动植物体内降解血红素以产生胆红素、CO和Fe2+[39],并积极调控植物代谢(如光合作用与氧化稳态)。例如,红车轴草体内的HO1显著影响了光合作用过程(GO:0015979: photosynthesis)和光合相关信号转导(GO:0010019: chloroplast-nucleus signaling pathway)。相似地,血红素处理通过调控HO1活性提升了熊胆草(Conyza blini)的光合能力[39]。另外,HO还可以通过促进光合色素的合成以提升植物抗逆性。例如,HO与红车轴草体内类胡萝卜素(GO:0016117: carotenoid biosynthetic process)和植物色素(GO:0010024: phytochromobilin biosynthetic process)等物质的合成与代谢相关。一方面,HO可以通过调控类胡萝卜素的生物合成,以调控光合作用强度。另一方面,类胡萝卜素也是一种良好的内源抗氧化剂,可以有效应对AgNO3介导的ROS胁迫[39]。光敏素是植物体内的重要蛋白(光敏素+发色团→光敏色素),植物可以通过光敏色素接收外界的信号来调节自身的生长和发育,特别是在AgNO3胁迫条件下。
红车轴草体内的氧化性光合碳通路(GO:0009854: oxidative photosynthetic carbon pathway,C2途径的反应导致两分子2-磷酸乙醇酸代谢转化为一分子3-磷酸甘油酸,可用于C3循环)在AgNO3存在下被显著扰乱,具体表现为以下基因的差异表达:Glycerate dehydrogenase HPR, peroxisomal(log2|Fold Change|=11.03)、(S)-2-hydroxy-acid oxidase GLO1(log2|Fold Change|=9.24)和Glyoxylate/hydroxypyruvate reductase A HPR2(log2|Fold Change|=9.19)等。Glycerate dehydrogenase HPR, peroxisomal(NADH-dependent hydroxypyruvate reductase 1)可以参与光呼吸过程中羟基丙酮酸向甘油酸盐的转化[40]、调控光呼吸CO2释放的化学计量学[41]和影响植物生长[42]。羟基酸氧化酶((S)-2-hydroxy-acid oxidase GLO1)可以催化乙醇酸向乙醛酸盐的氧化,伴随着O2向H2O2的还原(glycolate+O2 → glyoxylate+H2O2),在绿色植物的光呼吸中具有重要作用。研究表明,羟基酸氧化酶的活性与净光合速率具有强正相关关系。羟基酸氧化酶编码基因的活性抑制会诱导Rubisco活化酶的转录抑制,并提高异柠檬酸裂合酶和苹果酸合酶(乙醛酸盐循环中的关键酶)的表达。因此,乙醇酸氧化酶的缺乏可能通过反馈抑制Rubisco活化酶活性,并部分活化乙醛酸循环,补偿光呼吸乙醛酸盐循环。因此,红车轴草可能通过调控光合关键酶基因(例如羟基酸氧化酶和乙醛酸氧化酶)表达以应对AgNO3胁迫下的光合抑制,维持植物光合代谢能力[43]。
红车轴草体内的PNSB3(NDF4)基因(Photosynthetic NDH subunit of subcomplex B 3, chloroplastic)在AgNO3处理下显著上调表达(log2|Fold Change| = 10.78)。其生理功能主要是NDH通过FMN和铁硫(Fe-S)中心将电子从NAD(P)H:质体醌中传递到光合链和叶绿体呼吸链中的醌中。将氧化还原反应与质子易位耦合,从而在质子梯度中保存氧化还原能量(Uniprot, Q9LU21 PNSB3_ARATH)。PNSB3的基因表达与光系统Ⅰ的光合电子传递紧密相关(GO:0009773: photosynthetic electron transport in photosystem Ⅰ)。相似的,莠去津(Atr)和甲基紫精(MV)处理下,拟南芥(Arabidopsis thaliana)体内的NDH通路相关基因也显著上调表达,以维持循环电子传递链(CET)。作为补偿的是,Protein proton gradient regulation 5 (PGR5), chloroplastic在红车轴草体内显著上调表达(log2|Fold Change|=7.0),潜在表明了红车轴草在PNSB3表达和产物活性受到抑制时,可能通过上调PGR5相关基因以补偿AgNO3处理下循环电子传递链中的受抑制的电子传递[44]。特别地,AgNO3处理还显著上调了PGR5-like protein 1A, chloroplastic(PGRL1A, log2|Fold Change|=8.23),其作为一种存在于叶绿体类囊体上的跨膜蛋白,可以与PGR5共同调控CET。
红车轴草体内与光合作用(GO:0015979: photosynthesis)显著相关的Photosystem Ⅰ reaction center subunit Ⅱ, chloroplastic (PsaD)明显上调表达(log2|Fold Change|=10.39)。PsaD通常与光合作用膜基质侧铁氧化还原蛋白-停靠蛋白的形成有关,铁氧化还原蛋白含有铁硫原子簇,具有电子传递的功能。因此,PsaD的差异表达潜在表明了AgNO3对光合器官的扰乱,破坏铁氧化还原蛋白-停靠位点,从而扰乱光合电子传递。相似地,PsaD在高温处理的油菜(Brassica campestris L.)[45]、高盐处理的莱茵衣藻(Chlamydomonas reinhardtii)[46]和干旱/盐度组合胁迫的盐芥(Eutrema salsugineum)[47]体内也显著差异表达。除此之外,其他PS I反应中心亚单位如Photosystem Ⅰ reaction center subunit Ⅳ A, chloroplastic(PsaE, log2|Fold Change|=-3.77)、Photosystem Ⅰ reaction center subunit Ⅲ, chloroplastic(PsaF, log2|Fold Change|=6.42)、Photosystem Ⅰ reaction center subunit Ⅵ-2, chloroplastic(PSAH2, log2|Fold Change|=-6.19)和Photosystem Ⅰ reaction center subunit N, chloroplastic(PSAN, log2|Fold Change|=-2.32)在AgNO3处理的红车轴草体内也显著差异表达。Oxygen-evolving enhancer protein 3, chloroplastic在AgNO3处理的红车轴草组织内显著上调表达,也显著富集于光合作用通路(GO:0015979: photosynthesis)。析氧增强蛋白,作为析氧复合物(OEC)的一类外源蛋白,可以通过H2O向O2和4H+的光氧化、Ca2+/Cl-的保留活性有效调控PS Ⅱ的光活性[48]。
Protease do-like(DEGP-1)与protein MET1(MET1)编码基因的上调表达(GO:0010206: photosystem Ⅱ repair)揭示了AgNO3处理下红车轴草对受破坏光合系统的修复与活化,例如通过上调表达fructose-bisphosphate aldolase(log2|Fold Change|=10.9)和chlorophyll a-b binding protein(log2|Fold Change|=10.20)以促进碳固定和光反应[49]。AgNO3处理还显著影响了红车轴草的光信号转导(Peptidyl-prolyl cis-trans isomerase CYP18-3, log2|Fold Change|=10.9, GO:0009785: blue light signaling pathway/GO:0009585: red, far-red light phototransduction)、光呼吸(Gamma carbonic anhydrase 1, log2|Fold Change|=10.62, GO:0009853: photorespiration)、光响应(Stress enhanced protein 1, chloroplastic, log2|Fold Change|=10.34, GO:0071486: cellular response to high light intensity)和碳固定(Phosphoenolpyruvate carboxylase 2, log2|Fold Change|=10.01, GO:0015977: carbon fixation)等光合相关过程。
2.5 光合作用相关DEGs的蛋白-蛋白相互作用分析(Protein-protein interaction network analysis, PPI)
利用STRING(Version: 11.5)结合Cytoscape(Version: 3.7.1)对光合相关DEGs进行了蛋白功能注释与PPI分析以鉴别关键光合基因。在PPI分析中,通常利用连通度,即某一节点与其他节点的连接数量来判断该节点在整个网络中的贡献度。如图5及表2所示,基因PETC、PSBO2和PSBO1与其他基因具有最高连通度,即在红车轴草对AgNO3暴露的光合响应中具有核心作用。PETC(cytochrome b6-f complex iron-sulfur subunit, chloroplastic, log2|Fold Change| = 8.44, GO:0015979: photosynthesis)与植物光合自养紧密相关,可以通过光能热损耗和叶绿体内腔酸化(提升pH梯度)等方式赋予植物光氧化抵抗能力。PETC可以介导PS Ⅱ与PS I的电子转移,PS I的循环电子流动与状态转换。PETC的差异表达潜在地表明了AgNO3暴露对红车轴草叶绿体造成的氧化损伤与电子传递扰乱。相似地,PETC在核辐射的微拟球藻内和蓝光暴露的香草兰内显著上调表达,增强了光反应过程中的电子转移,从而提升了光合速率[50-51]。PSBO1和PSBO2编码PS Ⅱ的外在亚单位蛋白,在具有催化作用的锰团簇(与水裂解相关)的稳定中起重要作用。PSBO1(oxygen-evolving enhancer protein 1-1, chloroplastic, log2|Fold Change|=8.33, GO:0010207: photosystem Ⅱ assembly; GO:0042549: photosystem Ⅱ stabilization)与PSBO2(oxygen-evolving enhancer protein 1-2, chloroplastic, log2|Fold Change|=5.64, GO:0010207: photosystem Ⅱ assembly; GO:0042549: photosystem Ⅱ stabilization)的差异表达显示了AgNO3作用下红车轴草叶绿体蛋白结构的破坏,这也与光学显微镜与TEM观察到的类囊体结构的破坏相一致(图2和图3)。相关研究表明,PSBO基因与胁迫诱导下叶绿体囊泡形成介导的叶绿体降解过程紧密相关[52]。因此,PSBO相关基因在AgNO3暴露下红车轴草的抗逆行为中具有重要作用。
表2 光合相关基因中连通度最高的10个基因
Table 2 10 genes with highest connectivity in photosynthesis related genes
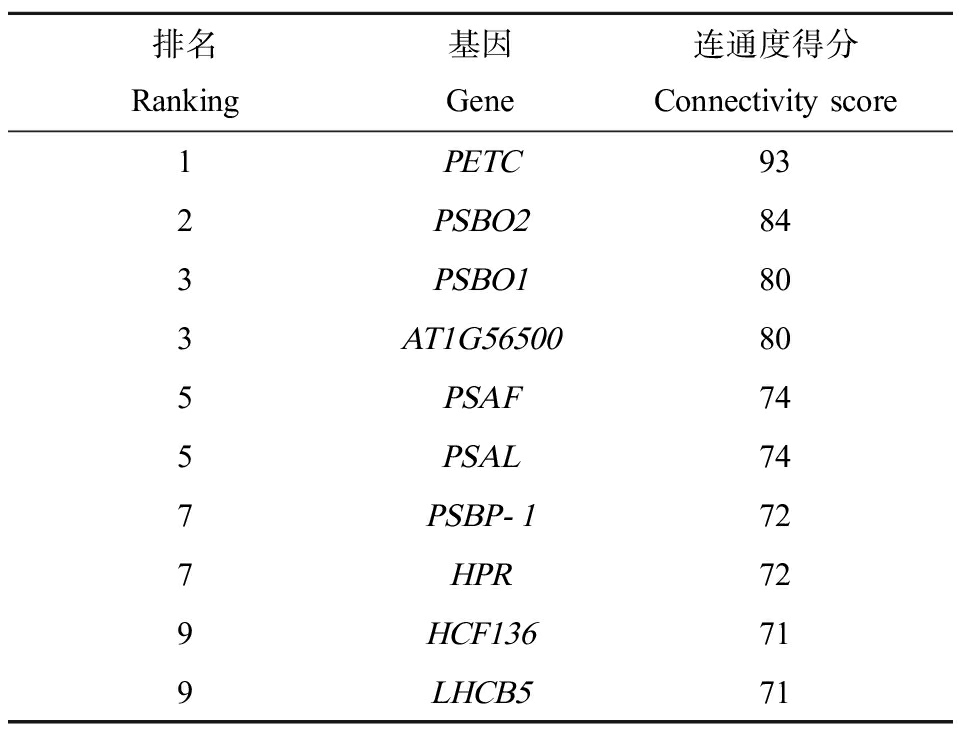
排名Ranking基因Gene连通度得分Connectivity score1PETC932PSBO2843PSBO1803AT1G56500805PSAF745PSAL747PSBP-1727HPR729HCF136719LHCB571
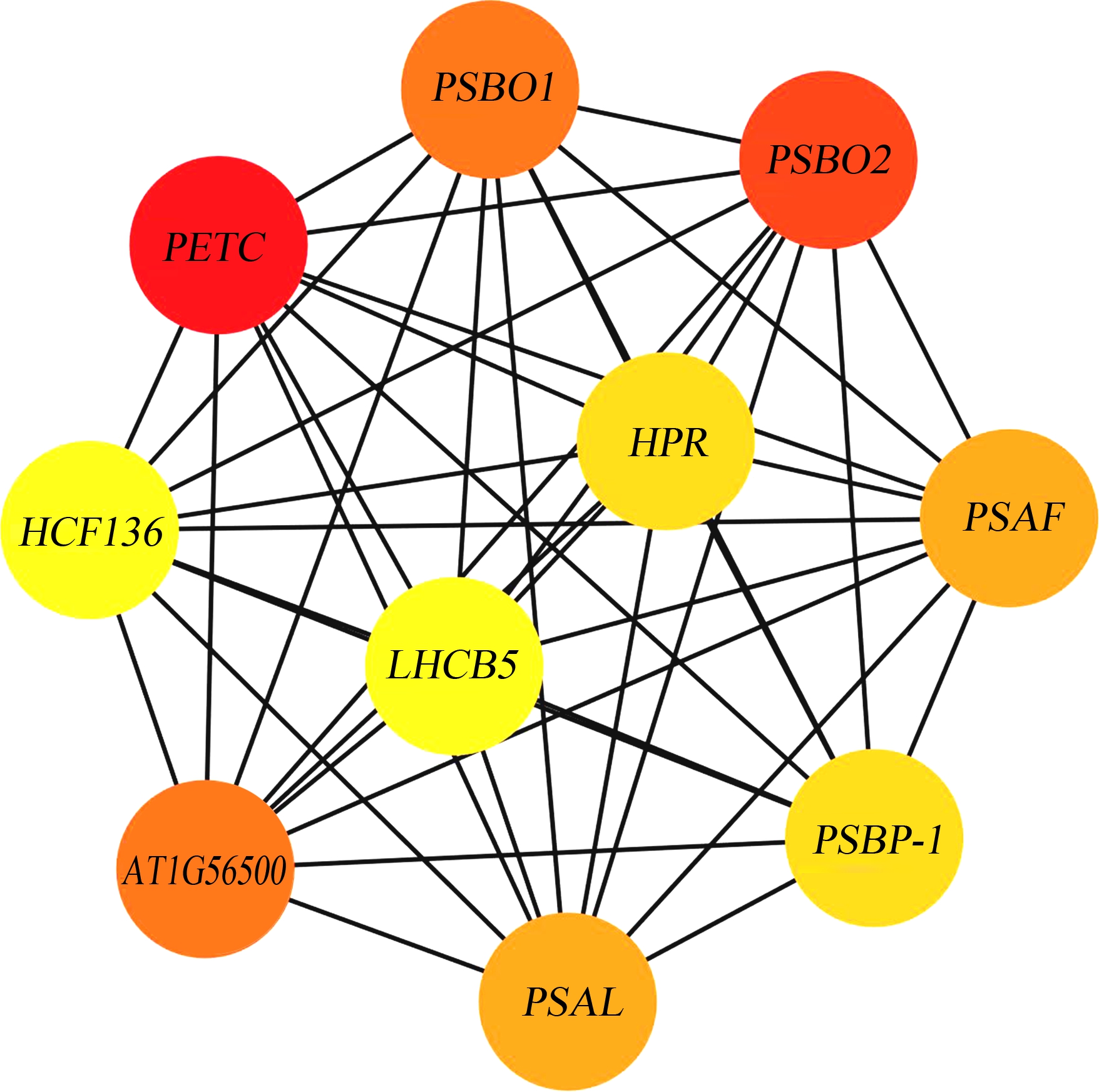
图5 蛋白-蛋白相互作用分析
(光合相关基因中连通度最高的10个基因)
注:节点颜色由黄到红代表节点连通度的升高。
Fig. 5 Protein-protein interaction analysis (10 genes with highest connectivity in photosynthesis related genes)
Note: The color turns from yellow to red, indicating the increment in connectivity.
STRING注释显示AgNO3暴露下,磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC, IPR018129, IPR022805, IPR033129,表3)与四氢叶酸脱氢酶(tetrahydrofolate, THF, IPR020867,表3)在红车轴草的光合响应中具有重要作用。PEPC已被证实与非生物逆境的胁迫响应有关,可以参与胁迫信号转导[53],这也与鉴别到的信号转导通路(KW-0736: 信号转导体;KW-0607: 光敏色素信号通路/GOCC:0008180: COP9信号复合体;表3)的富集相吻合。除此之外,高浓度AgNO3诱导的水分胁迫也可以诱导PEPC的差异表达[54]。THF广泛参与到1碳单位的转移。多种反应均可以产生THF的1碳单位,可被亚甲基-THF脱氢酶(1.5.1.5)、次甲基-THF水解酶(3.5.4.9)和甲酸基-THF合酶(6.3.4.3)所转化。因此,AgNO3暴露可能显著影响了红车轴草的碳固定。UniProt关键词注释所鉴别到的乙醇酸循环(KW-0323)、光呼吸(KW-0601)和CO2固定(KW-0120)等通路的富集(表3)也验证了PEPC和THF相关基因的显著差异表达及其在AgNO3暴露下的核心作用。亚细胞定位信息显示AgNO3暴露显著影响了PS I相关光捕获络合物I(GOCC:0009518)、PS I反应中心(GOCC:0009538)和叶绿体基质类囊体(GOCC:0009533),再次验证了AgNO3对叶绿体结构与功能的破坏。
表3 光合相关DEGs的STRING分析结果(303个基因)
Table 3 The STRING analysis results of photosynthesis related DEGs (303 genes)

编号Number描述Description强度Intensity基因列表Gene list蛋白质结构域和特征 Protein domains and characteristicsIPR018129磷酸烯醇丙酮酸羧化酶,赖氨酸活性位点Phosphoenolpyruvate carboxylase, Lys active site1.96PPC1, PPC4, PPC2, PPC3IPR022805磷酸烯醇丙酮酸羧化酶,细菌/植物型Phosphoenolpyruvate carboxylase, bacterial/plant-type1.96PPC1, PPC4, PPC2, PPC3IPR033129磷酸烯醇丙酮酸羧化酶,组氨酸活性位点Phosphoenolpyruvate carboxylase, His active site1.96PPC1, PPC4, PPC2, PPC3IPR020867四氢叶酸脱氢酶/环水解酶,保守位点Tetrahydrofolate dehydrogenase/cyclohydrolase, con-served site1.96AT2G38660, AT3G12290, EMB3127IPR021135磷酸烯醇丙酮酸羧化酶Phosphoenolpyruvate carboxylase1.86PPC1, PPC4, PPC2, PPC3关键词注释 Keywords annotationKW-0736信号转导体Signalosome1.86FUS5, CSN5A, CSN5B, FUS6, COP9, COP13, COP8, CSN6AKW-0607植物色素信号通路Phytochrome signaling pathway1.78FUS5, PIF3, GI, CSN5A, VOZ1, CSN5B, PHYB, ELF3, COP1, PTAC12, ELF4, PIF4, SPA1, RFI2, FUS9, HYH, FHY3, FUS6, EID1, DDB1A, SPA2, COP9, HB-2, LAF1, PKS4, HY5, COP13, COP8, CSN6A, SRR1KW-0323乙醇酸途径Glycolate pathway1.78HPR3, HPR, AT1G79870, AT1G80380, HAOX2, GOX1KW-0601光呼吸作用Photorespiration1.75HPR3, LrgB, HPR, AT1G79870, AT1G80380, AGT, AT2G38660, AT3G12290, HAOX2, GOX1, EMB3127, AT4G17360, AGT2, PGLP1, AT5G47435, RBCLKW-0120二氧化碳固定 Carbon dioxide fixation1.7PPC1, PPC4, PPC2, PPC3, RBCL亚细胞定位 Subcellular localizationGOCC:0008180COP9信号体COP9 signalosome1.86FUS5, CSN5A, CSN5B, FUS6, COP9, COP13, COP8, CSN6AGOCC:0009538光系统I反应中心Photosystem Ⅰ reaction center1.86PSAD-2, PSAF, PSAL, PSAE-1GOCC:0009533叶绿体基质类囊体Chloroplast stromal thylakoid1.83PSBY 2, AT3G61320, KCO6, HCF136, PSACGOCC:0016605早幼粒细胞白血病蛋白小体PML body1.83CRY2, SPA1, CRY1GOCC:0009518PS Ⅰ相关光捕获复合物ⅠPS Ⅰ associated light-harvesting complex Ⅰ1.78LHCA3, LHCA1
本研究系统探索了AgNO3暴露对红车轴草光合作用的影响机制。低(5 μmol·L-1)和高浓度(588 μmol·L-1)AgNO3分别促进和抑制了根系生长,根长相比于对照组分别增加和减少了160%和62%。作为植物体同化和吸收营养物质的重要器官,根系功能的抑制会显著扰乱叶绿素合成进而影响光合作用。高浓度AgNO3处理(588 μmol·L-1)显著破坏了红车轴草叶片的细胞结构,显示松散的类囊体和破坏的叶绿体。相应地,AgNO3处理显著影响了红车轴草的光合参数,具体表现为高浓度AgNO3(588 μmol·L-1)暴露下、Fv/Fm值、核酮糖-1,5-二磷酸核酮糖羧化酶活性和叶绿素a、b含量的下降,相比于对照组分别降低了89.53%、80.13%、22.36%和18.6%,这可能与AgNO3对光合电子传递的扰乱、与结构或功能蛋白的结合和其诱导的ROS攻击造成的酶失活有关。相应地,588 μmol·L-1 AgNO3处理下红车轴草光合相关基因表达量显著提升。具体来说,光合电子传递相关基因如PNSB3(log2|Fold Change|=10.78, GO:0009773: photosynthetic electron transport in photosystem Ⅰ)、光合作用相关基因如PsaD(log2|Fold Change|=10.39, GO:0015979: photosynthesis)以及光系统修复相关基因如MET1(log2|Fold Change|=7.99, GO:0010206: photosystem Ⅱ repair)等的上调表达表明了AgNO3对红车轴草光合过程的破坏以及植物驱动相关抗逆基因以维持光合代谢稳态的生物过程。最后通过PPI分析,鉴别发现PETC(log2|Fold Change|=8.44, GO:0015979: photosynthesis)、PSBO1 (log2|Fold Change|=8.33, GO:0010207: photosystem Ⅱ assembly; GO:0042549: photosystem Ⅱ stabilization)和PSBO2 (log2|Fold Change|=5.64, GO:0010207: photosystem Ⅱ assembly; GO:0042549: photosystem Ⅱ stabilization)为核心光合抗逆基因。STRING分析显示AgNO3胁迫会显著影响乙醇酸通路、光呼吸和CO2固定等生物过程。本文系统探索了AgNO3胁迫下红车轴草的光合生理生化响应及相关分子机制,深化了对AgNO3植物胁迫机制的认识。
[1] Ma C X, Chhikara S, Minocha R, et al. Reduced silver nanoparticle phytotoxicity in Crambe abyssinica with enhanced glutathione production by overexpressing bacterial γ-glutamylcysteine synthase [J]. Environmental Science &Technology, 2015, 49(16): 10117-10126
[2] Yuan L, Richardson C J, Ho M, et al. Stress responses of aquatic plants to silver nanoparticles [J]. Environmental Science &Technology, 2018, 52(5): 2558-2565
[3] Leonardo T, Farhi E, Pouget S, et al. Silver accumulation in the green microalga Coccomyxa actinabiotis: Toxicity, in situ speciation, and localization investigated using synchrotron XAS, XRD, and TEM [J]. Environmental Science &Technology, 2016, 50(1): 359-367
[4] 俞幼萍, 商成杰. 银纤维制备及在防辐射纺织品中的应用[J]. 针织工业, 2018(1): 27-31
Yu Y P, Shang C J. Preparation of silver fiber and its application in radiation-proof textiles [J]. Knitting Industries, 2018(1): 27-31 (in Chinese)
[5] Yasur J, Rani P U. Environmental effects of nanosilver: Impact on castor seed germination, seedling growth, and plant physiology [J]. Environmental Science and Pollution Research, 2013, 20(12): 8636-8648
[6] Wu J, Wang G Y, Vijver M G, et al. Foliar versus root exposure of AgNPs to lettuce: Phytotoxicity, antioxidant responses and internal translocation [J]. Environmental Pollution, 2020, 261: 114117
[7] Tong X L, Guo N, Dang Z Y, et al. In vivo biosynthesis and spatial distribution of Ag nanoparticles in maize (Zea mays L.) [J]. IET Nanobiotechnology, 2018, 12(7): 987-993
[8] Mo F, Li H B, Li Y H, et al. Exploration of defense and tolerance mechanisms in dominant species of mining area - Trifolium pratense L. upon exposure to silver [J]. The Science of the Total Environment, 2022, 811: 151380
[9] Guo H Y, Han F, Shang H P, et al. New insight into naturally formed nanosilver particles: Role of plant root exudates [J]. Environmental Science: Nano, 2021, 8(6): 1580-1592
[10] Yin L Y, Colman B P, McGill B M, et al. Effects of silver nanoparticle exposure on germination and early growth of eleven wetland plants [J]. PLoS One, 2012, 7(10): e47674
[11] Homaee M B, Ehsanpour A A. Silver nanoparticles and silver ions: Oxidative stress responses and toxicity in potato (Solanum tuberosum L) grown in vitro [J]. Horticulture, Environment, and Biotechnology, 2016, 57(6): 544-553
[12] Ghorbanpour M, Hatami M. Changes in growth, antioxidant defense system and major essential oils constituents of Pelargonium graveolens plant exposed to nano-scale silver and thidiazuron [J]. Indian Journal of Plant Physiology, 2015, 20(2): 116-123
[13] Shahid M, Niazi N K, Rinklebe J, et al. Trace elements-induced phytohormesis: A critical review and mechanistic interpretation [J]. Critical Reviews in Environmental Science and Technology, 2020, 50(19): 1984-2015
[14] Sun J Z, Wang L K, Li S, et al. Toxicity of silver nanoparticles to Arabidopsis: Inhibition of root gravitropism by interfering with auxin pathway [J]. Environmental Toxicology and Chemistry, 2017, 36(10): 2773-2780
[15] Zhang H L, Du W C, Peralta-Videa J R, et al. Metabolomics reveals how cucumber (Cucumis sativus) reprograms metabolites to cope with silver ions and silver nanoparticle-induced oxidative stress [J]. Environmental Science &Technology, 2018, 52(14): 8016-8026
[16] Malone L C, Mourtzinis S, Gaska J M, et al. Cover crops in a Wisconsin annual cropping system: Feasibility and yield effects [J]. Agronomy Journal, 2022, 114(2): 1052-1067
[17] Tahir M, Li C H, Zeng T R, et al. Mixture composition influenced the biomass yield and nutritional quality of legume-grass pastures [J]. Agronomy, 2022, 12(6): 1449
[18] Ke M J, Qu Q, Peijnenburg W J G M, et al. Phytotoxic effects of silver nanoparticles and silver ions to Arabidopsis thaliana as revealed by analysis of molecular responses and of metabolic pathways [J]. Science of the Total Environment, 2018, 644: 1070-1079
[19] Zhao Z L, Xu L M, Wang Y, et al. Toxicity mechanism of silver nanoparticles to Chlamydomonas reinhardtii: Photosynthesis, oxidative stress, membrane permeability, and ultrastructure analysis [J]. Environmental Science and Pollution Research International, 2021, 28(12): 15032-15042
[20] Shabnam N, Pardha-Saradhi P. Floating and submerged leaves of Potamogeton nodosus exhibit distinct variation in the antioxidant system as an ecophysiological adaptive strategy [J]. Functional Plant Biology, 2016, 43(4): 346-355
[21] Tarrahi R, Khataee A, Movafeghi A, et al. Toxicological implications of selenium nanoparticles with different coatings along with Se4+ on Lemna minor [J]. Chemosphere, 2017, 181: 655-665
[22] Grabherr M G, Haas B J, Yassour M, et al. Full-length transcriptome assembly from RNA-Seq data without a reference genome [J]. Nature Biotechnology, 2011, 29(7): 644-652
[23] Fu L M, Niu B F, Zhu Z W, et al. CD-HIT: Accelerated for clustering the next-generation sequencing data [J]. Bioinformatics, 2012, 28(23): 3150-3152
[24] Legocka J, Sobieszczuk-Nowicka E. Calcium variously mediates the effect of cytokinin on chlorophyll and LHCPⅡ accumulation during greening in barley leaves and cucumber cotyledons [J]. Acta Biologica Cracoviensia Series Botanica, 2015, 56(2): 27-34
[25] Diaz-Vivancos P, Faize M, Barba-Espin G, et al. Ectopic expression of cytosolic superoxide dismutase and ascorbate peroxidase leads to salt stress tolerance in transgenic plums [J]. Plant Biotechnology Journal, 2013, 11(8): 976-985
[26] 冯甜华. 叶绿素铜钠盐研究[J]. 食品安全导刊, 2015(32): 72
Feng T H. Study on sodium copper chlorophyllin [J]. China Food Safety Magazine, 2015(32): 72 (in Chinese)
[27] do Nascimento J L, de Almeida A A F, Barroso J P, et al. Physiological, ultrastructural, biochemical and molecular responses of young cocoa plants to the toxicity of Cr (Ⅲ) in soil [J]. Ecotoxicology and Environmental Safety, 2018, 159: 272-283
[28] Zheng S M, Zhou Q X, Chen C H, et al. Role of extracellular polymeric substances on the behavior and toxicity of silver nanoparticles and ions to green algae Chlorella vulgaris [J]. The Science of the Total Environment, 2019, 660: 1182-1190
[29] Jiang H S, Li M, Chang F Y, et al. Physiological analysis of silver nanoparticles and AgNO3 toxicity to Spirodela polyrhiza [J]. Environmental Toxicology and Chemistry, 2012, 31(8): 1880-1886
[30] Mirmoeini T, Pishkar L, Kahrizi D, et al. Phytotoxicity of green synthesized silver nanoparticles on Camelina sativa L. [J]. Physiology and Molecular Biology of Plants: An International Journal of Functional Plant Biology, 2021, 27(2): 417-427
[31] Varga M, ![]() L, et al. Physiological and biochemical effect of silver on the aquatic plant Lemna gibba L.: Evaluation of commercially available product containing colloidal silver [J]. Aquatic Toxicology, 2019, 207: 52-62
L, et al. Physiological and biochemical effect of silver on the aquatic plant Lemna gibba L.: Evaluation of commercially available product containing colloidal silver [J]. Aquatic Toxicology, 2019, 207: 52-62
[32] Du J, Tang J H, Xu S D, et al. A review on silver nanoparticles-induced ecotoxicity and the underlying toxicity mechanisms [J]. Regulatory Toxicology and Pharmacology, 2018, 98: 231-239
[33] 王灵哲, 史彦江, 宋锋惠, 等. 不同施肥处理对平欧杂种榛光合日变化及产量的影响[J]. 新疆农业科学, 2018, 55(8): 1495-1504
Wang L Z, Shi Y J, Song F H, et al. Effects of different fertilization treatments on the diurnal variation of photosynthesis and yield of hybrid of hazelnut [J]. Xinjiang Agricultural Sciences, 2018, 55(8): 1495-1504 (in Chinese)
[34] 李丹丹, 陈静波, 宗俊勤, 等. 施氮对‘Tifton85’狗牙根光合特性的影响[J]. 草业科学, 2017, 34(3): 472-478
Li D D, Chen J B, Zong J Q, et al. Effects of nitrogen on photosynthetic characteristics of ‘Tifton85’ bermudagrass [J]. Pratacultural Science, 2017, 34(3): 472-478 (in Chinese)
[35] Calabrese E J. Hormesis: Why it is important to toxicology and toxicologists [J]. Environmental Toxicology and Chemistry, 2008, 27(7): 1451-1474
[36] Li X X, Ke M J, Zhang M, et al. The interactive effects of diclofop-methyl and silver nanoparticles on Arabidopsis thaliana: Growth, photosynthesis and antioxidant system [J]. Environmental Pollution, 2018, 232: 212-219
[37] Liu Y, Wang X N, Wang J, et al. Graphene oxide attenuates the cytotoxicity and mutagenicity of PCB 52 via activation of genuine autophagy [J]. Environmental Science &Technology, 2016, 50(6): 3154-3164
[38] Hakkila K, Antal T, Gunnelius L, et al. Group 2 sigma factor mutant ΔsigCDE of the cyanobacterium Synechocystis sp. PCC 6803 reveals functionality of both carotenoids and flavodiiron proteins in photoprotection of photosystem Ⅱ [J]. Plant &Cell Physiology, 2013, 54(11): 1780-1790
[39] Wu J J, Li S Y, Li C, et al. The non-canonical effects of heme oxygenase-1, a classical fighter against oxidative stress [J]. Redox Biology, 2021, 47: 102170
[40] Timm S, Nunes-Nesi A, Pärnik T, et al. A cytosolic pathway for the conversion of hydroxypyruvate to glycerate during photorespiration in Arabidopsis [J]. The Plant Cell, 2008, 20(10): 2848-2859
[41] Cousins A B, Walker B J, Pracharoenwattana I, et al. Peroxisomal hydroxypyruvate reductase is not essential for photorespiration in Arabidopsis but its absence causes an increase in the stoichiometry of photorespiratory CO2 release [J]. Photosynthesis Research, 2011, 108(2): 91-100
[42] Liu Y P, Guérard F, Hodges M, et al. Phosphomimetic T335D mutation of hydroxypyruvate reductase 1 modifies cofactor specificity and impacts Arabidopsis growth in air [J]. Plant Physiology, 2020, 183(1): 194-205
[43] 梁天柱, 程凤玲, 张晓军, 等. 花生乙醇酸氧化酶基因鉴定及其响应非生物胁迫的表达分析[J]. 花生学报, 2022, 51(3): 13-20, 27
Liang T Z, Cheng F L, Zhang X J, et al. Identification of glycolate oxidase gene and expression analysis on its responding to abiotic stresses in peanut [J]. Journal of Peanut Science, 2022, 51(3): 13-20, 27 (in Chinese)
[44] Sun C C, Chen S, Jin Y J, et al. Effects of the herbicide imazethapyr on photosynthesis in PGR5- and NDH-deficient Arabidopsis thaliana at the biochemical, transcriptomic, and proteomic levels [J]. Journal of Agricultural and Food Chemistry, 2016, 64(22): 4497-4504
[45] Yuan L Y, Zheng Y S, Nie L B, et al. Transcriptional profiling reveals changes in gene regulation and signaling transduction pathways during temperature stress in Wucai (Brassica campestris L.) [J]. BMC Genomics, 2021, 22(1): 687
[46] Subramanyam R, Jolley C, Thangaraj B, et al. Structural and functional changes of PSI-LHCI super complexes of Chlamydomonas reinhardtii cells grown under high salt conditions [J]. Planta, 2010, 231(4): 913-922
[47] Goussi R, Manfredi M, Marengo E, et al. Thylakoid proteome variation of Eutrema salsugineum in response to drought and salinity combined stress [J]. Biochimica et Biophysica Acta Bioenergetics, 2021, 1862(12): 148482
[48] Rova E M, Ewen B M, Fredriksson P O, et al. Photoactivation and photoinhibition are competing in a mutant of Chlamydomonas reinhardtii lacking the 23-kDa extrinsic subunit of photosystem Ⅱ [J]. The Journal of Biological Chemistry, 1996, 271(46): 28918-28924
[49] Chauhan R, Awasthi S, Indoliya Y, et al. Transcriptome and proteome analyses reveal selenium mediated amelioration of arsenic toxicity in rice (Oryza sativa L.) [J]. Journal of Hazardous Materials, 2020, 390: 122122
[50] Lu H X, Cheng J, Wang Z Y, et al. Enhancing photosynthetic characterization and biomass productivity of Nannochloropsis oceanica by nuclear radiation [J]. Frontiers in Energy Research, 2020, 8: 143
[51] Ko S S, Jhong C M, Lin Y J, et al. Blue light mediates chloroplast avoidance and enhances photoprotection of vanilla orchid [J]. International Journal of Molecular Sciences, 2020, 21(21): 8022
[52] Wang S H, Blumwald E. Stress-induced chloroplast degradation in Arabidopsis is regulated via a process independent of autophagy and senescence-associated vacuoles [J]. The Plant Cell, 2014, 26(12): 4875-4888
[53] 赵晋锋, 王高鸿, 杜艳伟, 等. 谷子磷酸烯醇式丙酮酸羧化酶基因(PEPC)对逆境胁迫的响应[J]. 华北农学报, 2019, 34(4): 67-74
Zhao J F, Wang G H, Du Y W, et al. Response of phosphoenolpyruvate carboxylase (PEPC) gene to abiotic stresses in foxtail millet [J]. Acta Agriculturae Boreali-Sinica, 2019, 34(4): 67-74 (in Chinese)
[54] 唐犁, 施教耐. 水分胁迫对露花磷酸烯醇式丙酮酸羧化酶表达水平及特性的影响[J]. 植物生理学报, 1997, 23(2): 192-198
Tang L, Shi J N. The effects of water stress on leaf PEPCases in Mesembryanthemum cordifolium [J]. Acta Photophysiologica Sinica, 1997, 23(2): 192-198 (in Chinese)