甲基汞(methylmercury, MeHg)是公认的“全球性环境污染物”和持久性有机污染物,具有很强的神经毒性和蓄积毒性,极易通过血脑屏障和胎盘屏障进入胎儿体内,引起以中枢神经系统为主的全身性损害[1-2]。由于胎儿期及婴幼儿的中枢神经系统处于高速分化和快速发展时期,且未成熟中枢神经系统受到损害后不可逆[3]。因此,探寻生命早期接触甲基汞所致神经损伤的早期生物学标志至关重要。研究显示,母亲发汞含量每增加1 μg·g-1,胎儿智商平均下降约0.18[4],产前孕妇低水平甲基汞暴露可能会导致胎儿神经发育的延迟及损伤。学术界普遍认为,食用鱼类等水产品是人体甲基汞暴露的主要途径。然而,Feng等[5]研究发现,在中国西南地区万山汞矿区,水稻中甲基汞生物富集水平远高于无机汞,汞污染所导致的健康风险不容忽视。
神经递质被认为是神经元生长、分化和存活过程中的化学信使[6]。研究证实部分神经递质的失调与紊乱与阿尔兹海默症、帕金森病、抑郁症和精神分裂症[7-8]等多种神经病理过程密切相关。近年来,研究发现血浆中某些氨基酸水平的变化可能会改变大脑中神经递质的前体水平。此外,研究还报道血清中去甲肾上腺素(noradrenaline, NA)、多巴胺(dopamine, DA)和谷氨酸(glutamate, Glu)水平与大脑中神经递质NA、DA和Glu水平呈正相关[9]。血清中神经递质的变化可在一定程度上反映大脑中神经递质的变化水平。
基于此,本研究在建立围产期甲基汞暴露致子代大鼠神经损伤模型的基础上,通过分析成年子代大鼠脑汞、神经递质、学习记忆能力三者之间的关联性并探讨神经递质紊乱在甲基汞致子代成年大鼠学习记忆损伤中的贡献,从而为寻找甲基汞暴露所致健康损害的生物标志提供科学依据。
1 材料与方法(Materials and methods)
1.1 主要仪器与试剂
主要仪器:液相色谱-质谱联用仪(AB Triple QuadTM5500+,美国);Milli-Q超纯水处理系统(重庆市安特生,中国);Kinetex®XB-C18柱(100 mm×2.1 mm,2.6 μm,美国);全自动样品快速研磨仪(JXFSTPRP-64,上海净信实业发展有限公司,中国)。
主要试剂:氯化甲基汞(≥95%,Sigma,美国);NA、肾上腺素(adrenaline, A)均购自广州佳途科技股份有限公司(中国);乙酰胆碱(acetylcholine, ACh)、γ-氨基丁酸(γ-aminobutyric acid, GABA)、Glu、谷氨酰胺(glutamine amide, Gln)、5-羟色胺(5-hydroxytryptamine, 5-HT)、DA、甲醇及乙腈均购自Sigma-Aldrich公司(美国);3,4-二羟基苯乙酸(3, 4-dihydroxyphenylacetic acid, DHB)购自阿拉丁生物科技有限公司(中国)。
1.2 实验动物染毒及分组
选择健康清洁级Sprague-Dawley大鼠36只(雌∶雄=2∶1),体质量200~220 g,均购自辽宁长生生物技术有限公司,动物合格证号:SCXK(辽)2020-0001。室内温度为22~24 ℃,相对湿度为60%~70%,光照/黑暗交替12 h/12 h。适应性喂养1周后,按雌雄比2∶1配对合笼喂养,次日清晨检查雌鼠阴栓,查到阴栓之日视为GD 0 (gestation day, GD 0)。随后将孕鼠按体质量随机分为对照组(生理盐水)、低(0.6 mg·kg-1)、中(1.2 mg·kg-1)、高(2.4 mg·kg-1)剂量甲基汞染毒组共4个组,每组各6只。孕鼠自GD 5灌胃染毒至子鼠出生PND 21(postnatal day 21, PND 21)断乳,继续饲养至PND 60。在PND 60,分别从对照组、0.6 mg·kg-1、1.2 mg·kg-1、2.4 mg·kg-1 4个组别的每只孕鼠中随机选取一只子鼠,经戊巴比妥钠麻醉后采集子鼠血液样本进行神经递质的检测。采血结束后立即断头取脑,置于生理盐水中清洗干净,于冰上分离脑组织,进行汞含量的检测。其余的子鼠进行八臂迷宫实验。本研究经贵州医科大学伦理委员会审查批准(批准号:2000868)。
1.3 一般情况
观察并记录甲基汞染毒组子代大鼠饲喂期间毛发光泽度、活动度、精神状态等情况。
1.4 八臂迷宫实验
八臂迷宫,又称放射性迷宫,其主要由八边形中央区域和与其连接的8条工作臂组成。第1天,让子鼠适应迷宫环境,将饵料放在八臂迷宫中央以及各臂口,2只子鼠同时放入迷宫中央区域,让其自由摄食,探究10 min,每日训练2次;第2天,重复第1天的训练;第3天,迷宫及饵料位置不变,每只子鼠单独进入迷宫训练,每次训练结束后用75%酒精喷洒擦拭箱体以除去气味滞留,每日训练2次;第4天,仅在1、3、5、7臂顶端放入饵料,每只子鼠依次对各臂进行探索。训练开始时,把子鼠放入八边形中央内适应30 s,然后把各臂门打开,让子鼠自由觅食,直至10 min或提前完成所有臂的觅食。随后记录以下2个指标:(1)工作记忆错误次数(working memory errors, WME),即在同一次训练中子鼠再次进入已经吃过食物的臂;(2)参考记忆错误次数(reference memory errors, RME),即在同一次训练中子鼠进入无食物的臂。
1.5 汞含量的测定
脑汞含量的测定参考前期研究[10],称取子鼠脑组织,置于25 mL硼硅玻璃比色管中,加入5 mL HNO3,比色管口放上酸处理的玻璃球;95 ℃水浴3 h进行样品消解,冷却后先加入少量超纯水,然后再加入0.5 mL BrCl;约24 h后再加2~3滴NH2OH·HCl溶液,使淡黄色退去,加超纯水定容至25 mL;经SnCl还原后,采用冷原子荧光光谱法(cold atomic fluorescence spectrometry, CVAFS)测定。
1.6 神经递质检测
取出子鼠血液于4 ℃静置2 h后,3 500 r·min-1离心10 min后取血清100 μL加入300 μL乙腈,12 000 r·min-1离心10 min,每200 μL加入10 μL内标(DHBA, 4 μg·mL-1),混合均匀,氮气吹干,后用100 μL的水-甲醇(9/1, V/V)复溶,混匀后采用液相色谱-质谱联用仪(liquid chromatography-tandem mass spectrometer, LC-MS/MS)检测分析。液相条件:流动相A为1%甲酸-水;流动相B为乙腈。梯度洗脱程序:0~0.5 min,5% A;0.5~5 min,80% A;5~6 min,80% A;6~6.1 min,5% A;6.1~8 min,5% A。流速为0.2 mL·min-1;柱温40 ℃,进样量2 μL。
1.7 统计学分析
实验数据采用SPSS25.0软件进行分析,正态分布的数据以平均值±标准误差(mean ± SEM)表示,多组间比较采用单因素方差分析(One-way ANOVA),随后用Bonferroni进行组间两两比较;采用pairwise Pearson进行相关性分析,使用阳性错误发现率(FDR)校正多重统计检验中的P值,FDR<0.1差异具有统计学意义;中介效应分析将脑汞负荷作为自变量,学习记忆错误参数作为因变量,神经递质水平作为中介变量,建立“脑汞-神经递质-学习记忆”中介检验模型,通过PROCESS(v3.4.1)程序中的模型4采用Bootstrap法进行中介效应检验,检验水准α=0.05。
2 结果(Results)
2.1 围产期甲基汞暴露对子代大鼠一般生长情况的影响
实验期间,对照组子鼠毛发光泽、活动正常、精神状态良好;甲基汞染毒组子鼠出现精神萎靡、毛色暗淡、饮食活动减少等状况,尤以高剂量组明显。
2.2 围产期甲基汞暴露对子代大鼠学习记忆能力影响
八臂迷宫结果显示,不同剂量染毒组子鼠WME和RME组间比较差异具有统计学意义(F值分别为19.62、27.11,均P<0.05);与对照组相比,中、高剂量组子鼠WME和RME显著增加;与低剂量组相比,中、高剂量组子鼠WME和RME显著增加,差异具有统计学意义(P<0.05)(图1(a)和(b))。八臂迷宫轨迹图显示,与对照组相比,甲基汞染毒组子鼠在错误臂出现的次数增多(图1(c))。
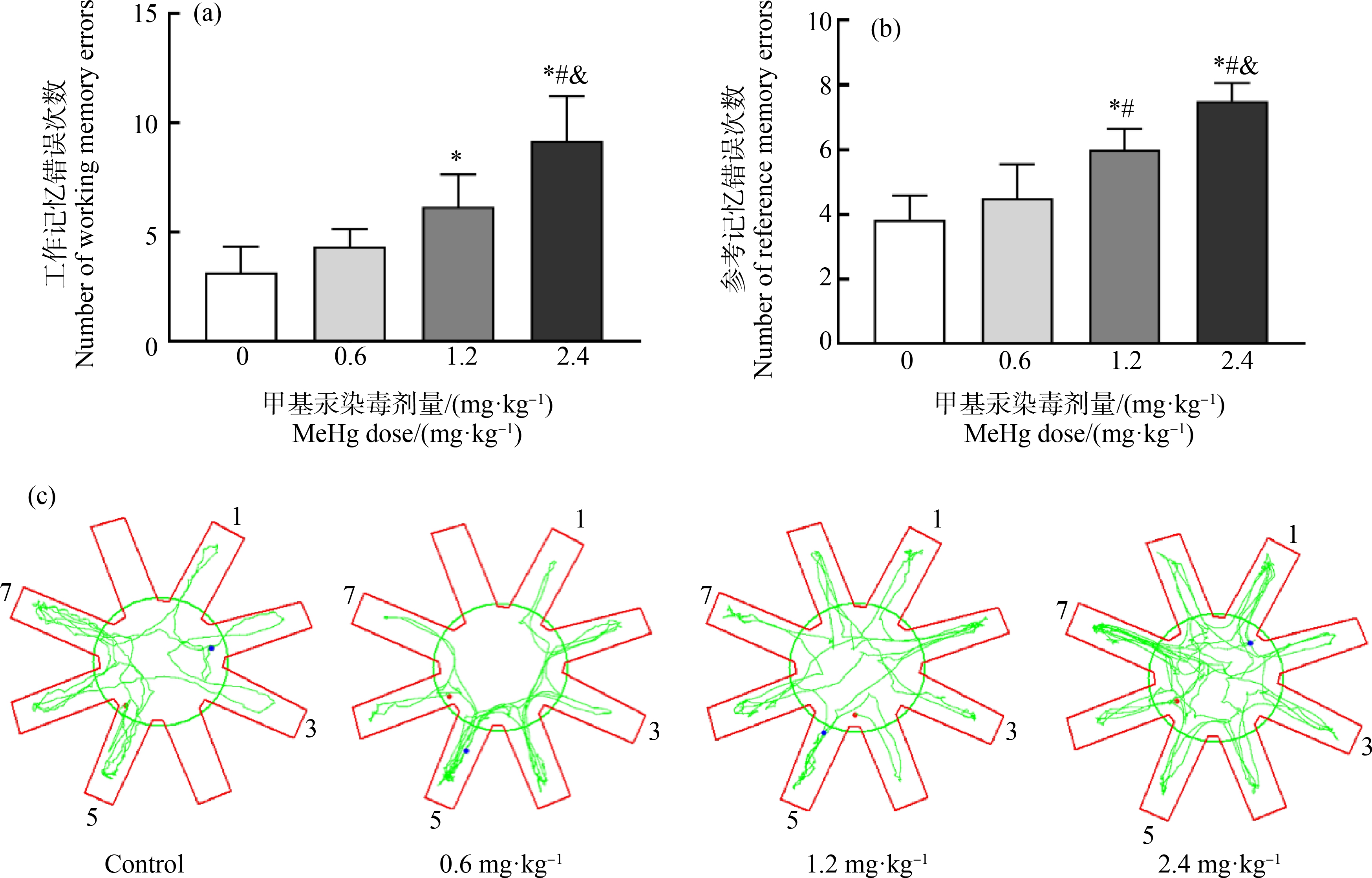
图1 围产期甲基汞暴露对子代成年大鼠学习记忆能力的影响
注:(a) 工作记忆错误次数;(b) 参考记忆错误次数;(c) 八臂迷宫轨迹图;*与对照组比较P<0.05;#与0.6 mg·kg-1组比较P<0.05;&与1.2 mg·kg-1组比较P<0.05。
Fig. 1 Effect of perinatal MeHg exposure on learning and memory ability of adult offspring rats
Note: (a) The number of working memory errors; (b) The number of reference memory errors; (c) Track diagram of eight-arm maze; *represents P<0.05, compared with control group; # represents P<0.05, compared with 0.6 mg·kg-1group; &represents P<0.05, compared with 1.2 mg·kg-1group.
2.3 围产期甲基汞暴露对子代大鼠脑汞含量及神经递质水平的影响
如表1所示,各剂量染毒组子鼠脑汞含量组间比较差异具有统计学意义(F值为81.11,P<0.05);与对照组相比,低、中、高剂量甲基汞染毒组子鼠脑汞含量显著增加(P<0.05);且随着甲基汞染毒剂量的增加脑汞含量逐渐增加(F趋势=20.56,P<0.05)。神经递质结果显示,各剂量染毒组子鼠ACh、5-HT、DA、NA、Glu、A、GABA组间比较差异具有统计学意义(F值分别为3.33、31.45、11.48、14.37、58.05、3.65、6.24,均P<0.05);与对照组相比,甲基汞染毒组子鼠血清中ACh、5-HT、DA、NA、Glu含量显著增加,而A、GABA含量显著降低,差异具有统计学意义(均P<0.05)。此外,低、中、高剂量甲基汞染毒组子鼠Glu/GABA比值与对照组相比显著增加(F值为13.51,P<0.05)。然而,甲基汞染毒组子鼠Gln水平较对照组无显著变化(P>0.05)。
表1 各组子代大鼠汞含量及神经递质水平比较(n=6)
Table 1 Comparison of mercury content and neurotransmitter levels of offspring rats in each group (n=6)
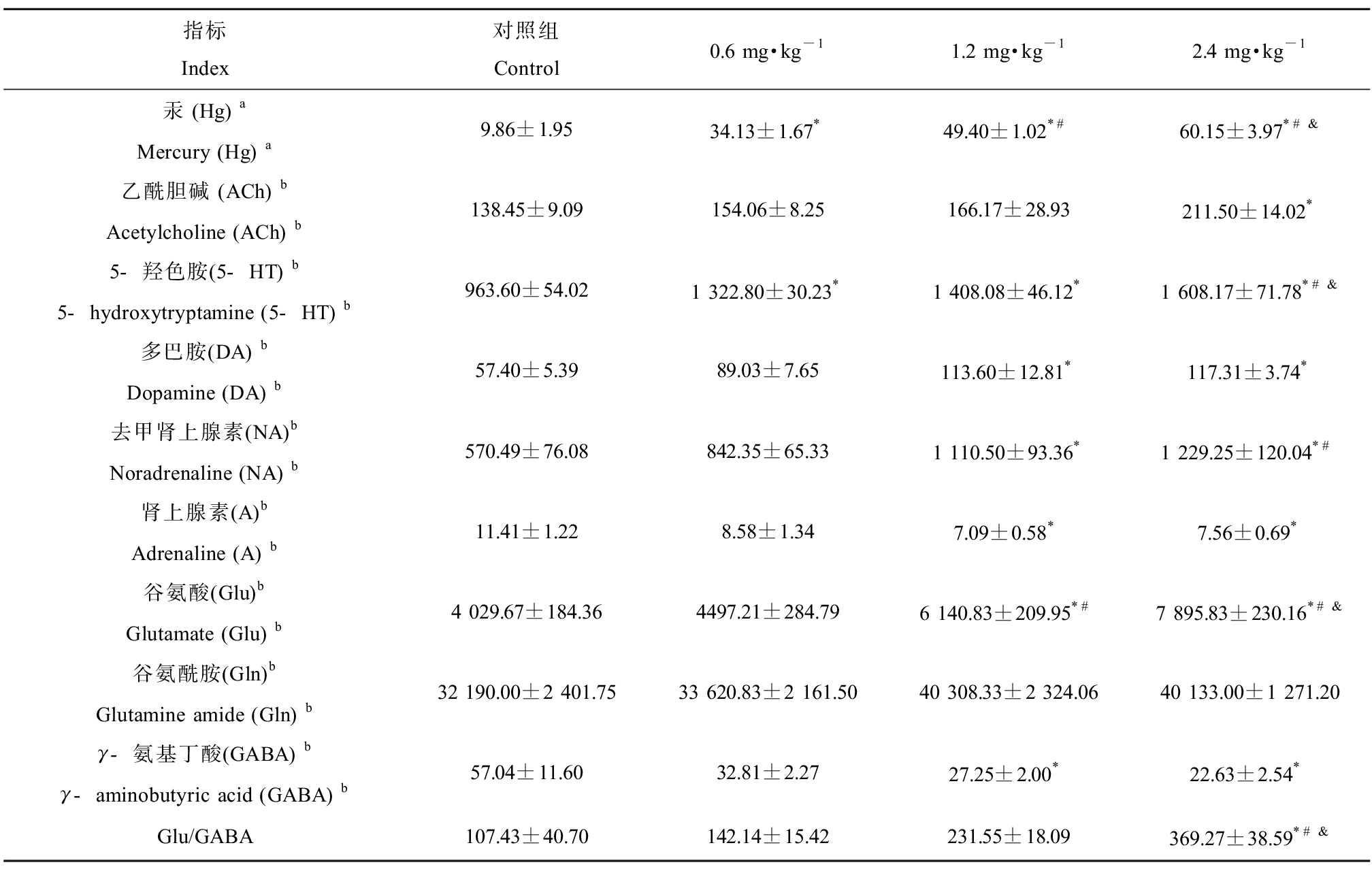
指标Index对照组Control0.6 mg·kg-11.2 mg·kg-12.4 mg·kg-1汞 (Hg) aMercury (Hg) a9.86±1.9534.13±1.67*49.40±1.02*#60.15±3.97*#&乙酰胆碱 (ACh) bAcetylcholine (ACh) b138.45±9.09154.06±8.25166.17±28.93211.50±14.02*5-羟色胺(5-HT) b5-hydroxytryptamine (5-HT) b963.60±54.021 322.80±30.23*1 408.08±46.12*1 608.17±71.78*#&多巴胺(DA) bDopamine (DA) b57.40±5.3989.03±7.65113.60±12.81*117.31±3.74*去甲肾上腺素(NA) bNoradrenaline (NA) b570.49±76.08842.35±65.331 110.50±93.36*1 229.25±120.04*#肾上腺素(A) bAdrenaline (A) b11.41±1.228.58±1.347.09±0.58*7.56±0.69*谷氨酸(Glu) bGlutamate (Glu) b4 029.67±184.364497.21±284.796 140.83±209.95*#7 895.83±230.16*#&谷氨酰胺(Gln) bGlutamine amide (Gln) b32 190.00±2 401.7533 620.83±2 161.5040 308.33±2 324.0640 133.00±1 271.20γ-氨基丁酸(GABA) bγ-aminobutyric acid (GABA) b57.04±11.6032.81±2.2727.25±2.00*22.63±2.54*Glu/GABA107.43±40.70142.14±15.42231.55±18.09369.27±38.59*#&
注:数据以平均值±标准误差表示(a汞含量单位ng·g-1;b神经递质水平单位μg·L-1);*与对照组比较P<0.05;#与0.6 mg·kg-1组比较P<0.05;&与1.2 mg·kg-1组比较P<0.05。
Note: Data are expressed as mean±SEM (a mercury content unit is ng·g-1; b neurotransmitter levels units are μg·L-1); *represents P<0.05, compared with control group; # represents P<0.05, compared with 0.6 mg·kg-1group; &represents P<0.05, compared with 1.2 mg·kg-1group.
2.4 子代大鼠脑汞负荷、神经递质代谢以及学习记忆能力三者之间的关联性分析
为了进一步探索汞负荷、神经递质水平和学习记忆能力之间的潜在关联,本研究采用pairwise Pearson相关性分析探讨了三者之间的关系。结果见表2。子鼠脑汞含量与神经递质水平ACh、5-HT、DA、NA、Glu以及学习记忆损伤参数WME、RME呈正相关,与A、GABA呈负相关。ACh、5-HT、DA、NA、Glu与WME呈正相关,GABA与WME呈负相关;ACh、5-HT、DA、NA、Glu与RME呈正相关,GABA与RME呈负相关。
表2 脑汞负荷、神经递质水平、学习记忆能力三者间的相关性分析(n=6)
Table 2 Correlation analysis of brain mercury content, neurotransmitter levels, learning and memory ability (n=6)
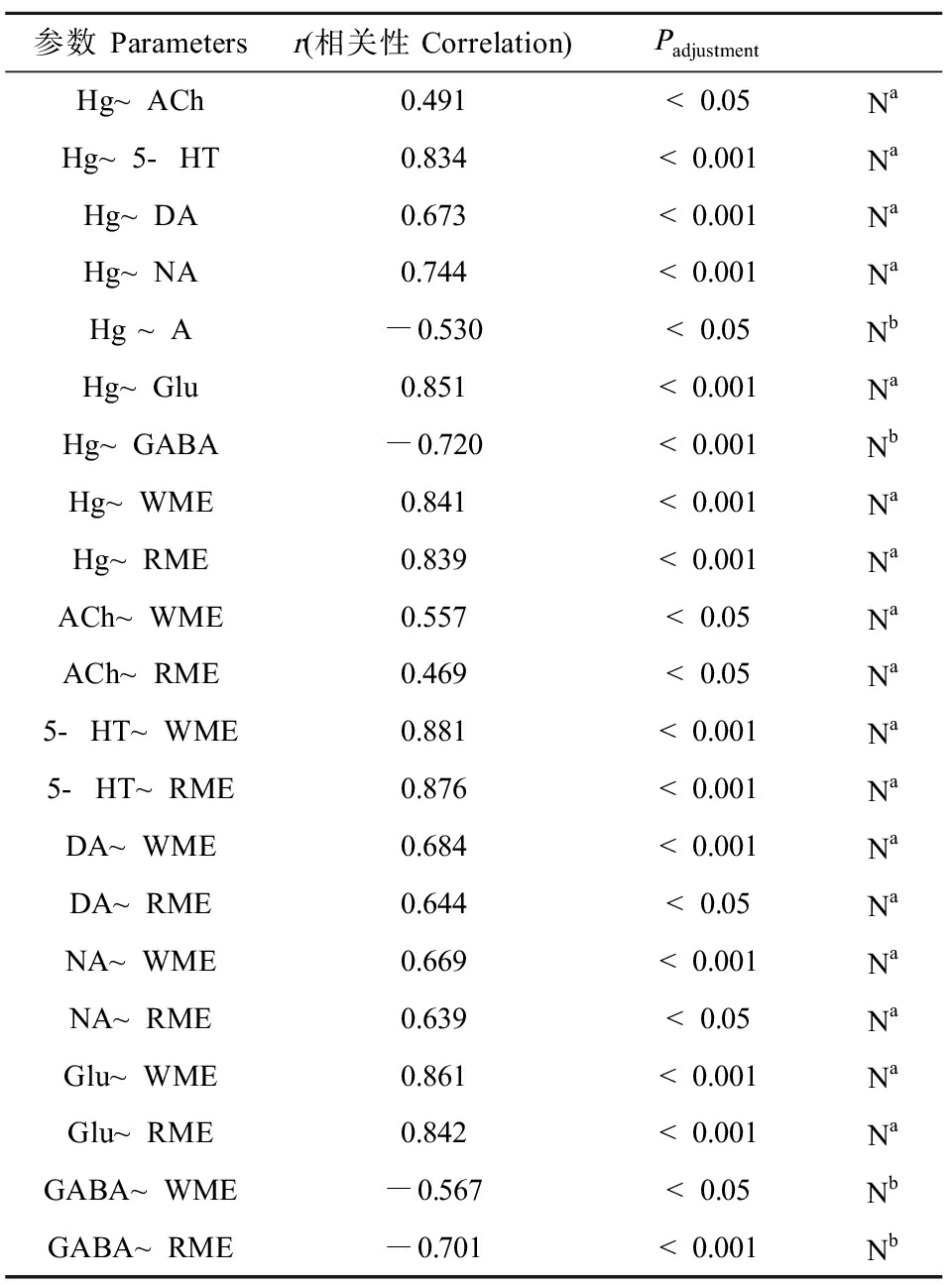
参数 Parametersr(相关性Correlation)PadjustmentHg~ACh0.491<0.05NaHg~5-HT0.834<0.001NaHg~DA0.673<0.001NaHg~NA0.744<0.001NaHg ~A-0.530<0.05NbHg~Glu0.851<0.001NaHg~GABA-0.720<0.001NbHg~WME0.841<0.001NaHg~RME0.839<0.001NaACh~WME0.557<0.05NaACh~RME0.469<0.05Na5-HT~WME0.881<0.001Na5-HT~RME0.876<0.001NaDA~WME0.684<0.001NaDA~RME0.644<0.05NaNA~WME0.669<0.001NaNA~RME0.639<0.05NaGlu~WME0.861<0.001NaGlu~RME0.842<0.001NaGABA~WME-0.567<0.05NbGABA~RME-0.701<0.001Nb
注:Na表示正相关,Nb表示负相关。
Note: Na means positive correlation; Nb means negative correlation.
2.5 中介效应分析
根据相关性分析结果的提示,对汞负荷、神经递质水平以及学习记忆能力进行了中介分析。结果见表3。ACh在甲基汞暴露致子代成年大鼠WME增加中存在中介效应作用,中介效应值为23.52%;5-HT和Glu在甲基汞暴露致子代成年大鼠WME增加中直接效应不显著,其在WME增加中起完全中介效应作用。
表3 神经递质在甲基汞暴露与学习记忆损伤间的中介效应分析(n=6)
Table 3 Analysis of the mediating effect of neurotransmitters between MeHg exposure and the learning and memory impairment (n=6)
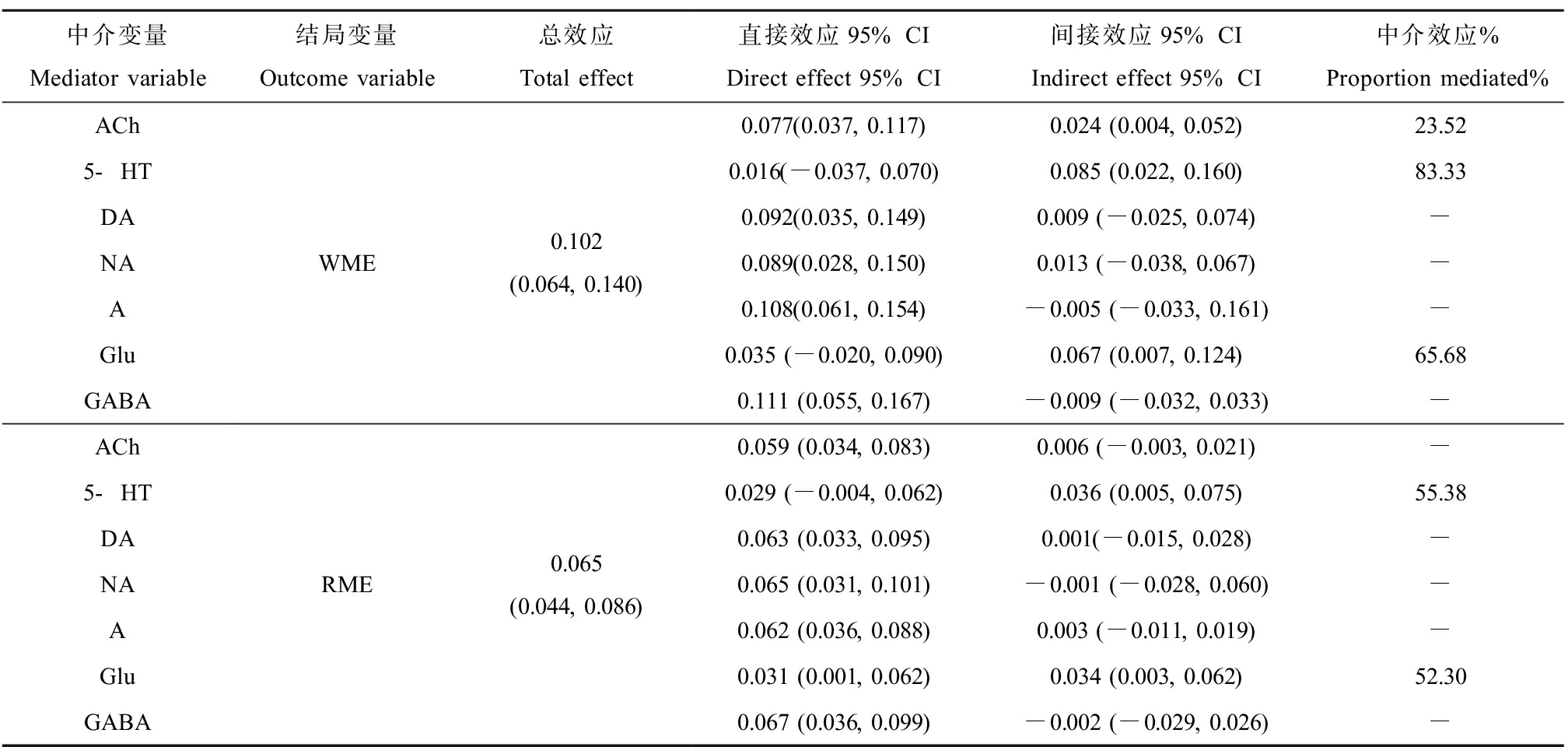
中介变量Mediator variable结局变量Outcome variable总效应Total effect直接效应95% CIDirect effect 95% CI间接效应95% CIIndirect effect 95% CI中介效应%Proportion mediated%ACh5-HTDANAAGluGABAWME0.102(0.064, 0.140)0.077(0.037, 0.117)0.024 (0.004, 0.052)23.520.016(-0.037, 0.070)0.085 (0.022, 0.160)83.330.092(0.035, 0.149)0.009 (-0.025, 0.074)-0.089(0.028, 0.150)0.013 (-0.038, 0.067)-0.108(0.061, 0.154)-0.005 (-0.033, 0.161)-0.035 (-0.020, 0.090)0.067 (0.007, 0.124)65.680.111 (0.055, 0.167)-0.009 (-0.032, 0.033)-ACh5-HTDANAAGluGABARME0.065(0.044, 0.086)0.059 (0.034, 0.083)0.006 (-0.003, 0.021)-0.029 (-0.004, 0.062)0.036 (0.005, 0.075)55.380.063 (0.033, 0.095)0.001(-0.015, 0.028)-0.065 (0.031, 0.101)-0.001 (-0.028, 0.060)-0.062 (0.036, 0.088)0.003 (-0.011, 0.019)-0.031 (0.001, 0.062)0.034 (0.003, 0.062)52.300.067 (0.036, 0.099)-0.002 (-0.029, 0.026)-
注:-无中介效应。
Note: - means no intermediary effect.
5-HT在甲基汞暴露致子代成年大鼠RME增加中直接效应不显著,其在RME中起完全中介效应作用,Glu在甲基汞暴露致子代成年大鼠RME中存在中介效应作用,中介效应值为52.30%。多重中介效应分析结果显示,神经递质在甲基汞暴露致学习记忆能力损伤中不存在多重中介作用,见表4。
表4 神经递质在甲基汞暴露与学习记忆损伤间的多重中介效应分析(n=6)
Table 4 Analysis of multiple mediating effects of neurotransmitters between MeHg exposure and learning and memory impairment (n=6)
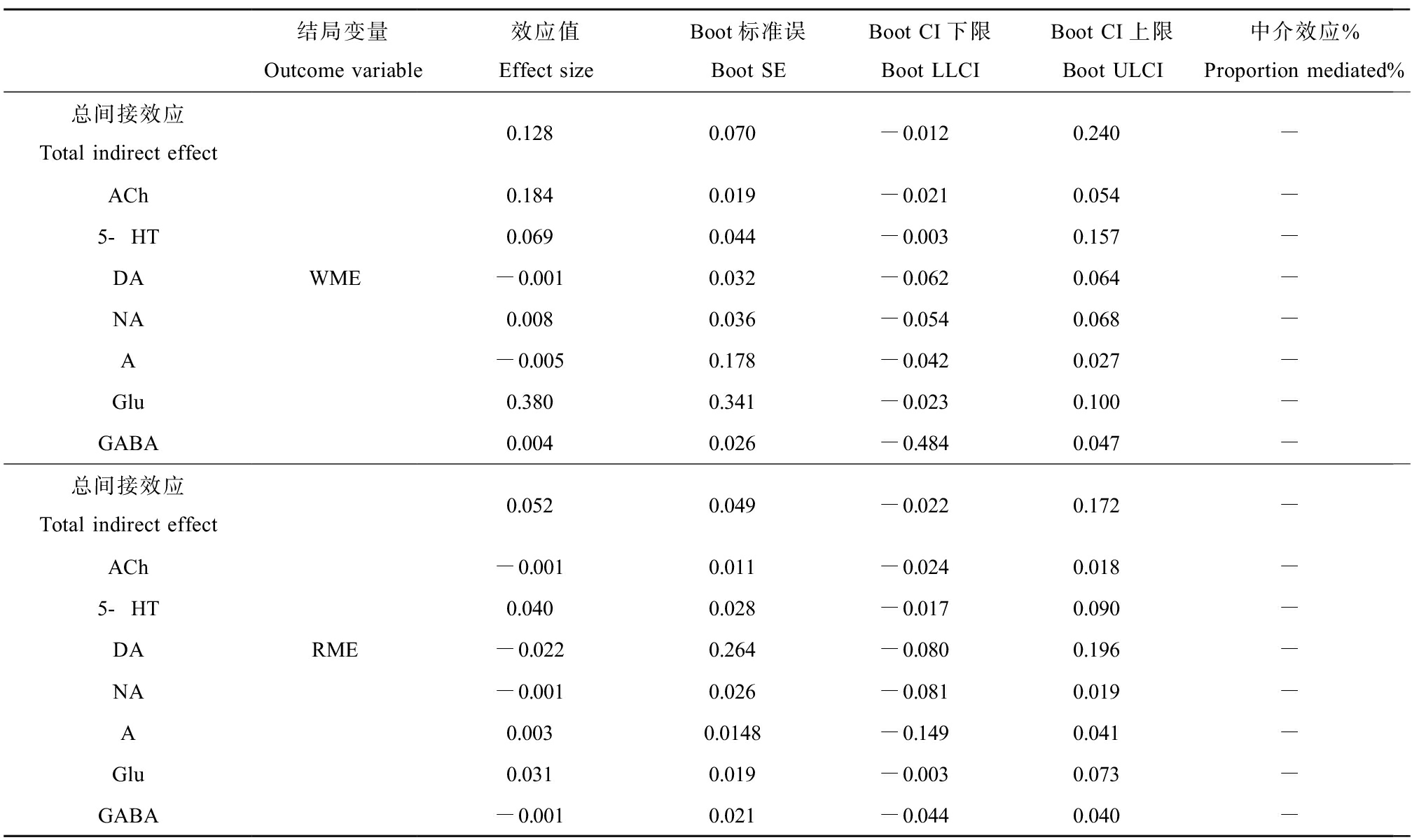
结局变量Outcome variable效应值Effect sizeBoot标准误Boot SEBoot CI下限Boot LLCIBoot CI上限Boot ULCI中介效应%Proportion mediated%总间接效应Total indirect effectACh5-HTDANAAGluGABAWME0.1280.070-0.0120.240-0.1840.019-0.0210.054-0.0690.044-0.0030.157--0.0010.032-0.0620.064-0.0080.036-0.0540.068--0.0050.178-0.0420.027-0.3800.341-0.0230.100-0.0040.026-0.4840.047-总间接效应Total indirect effectACh5-HTDANAAGluGABARME0.0520.049-0.0220.172--0.0010.011-0.0240.018-0.0400.028-0.0170.090--0.0220.264-0.0800.196--0.0010.026-0.0810.019-0.0030.0148-0.1490.041-0.0310.019-0.0030.073--0.0010.021-0.0440.040-
注:-无中介效应。
Note: - means no intermediary effect.
3 讨论(Discussion)
早期生命,尤其是产前环境会影响发育轨迹,进而影响后期疾病风险的理论,现在被广泛称为健康与疾病的发育起源(developmental origins of health and disease, DOHaD)假说,即除了遗传和环境因素,如果生命在发育过程的早期(包括胎儿和婴幼儿时期)经历不利因素,如营养或环境不良等,将会增加其成年后罹患多种疾病的几率,这种影响甚至会持续好几代人。虽然目前关于甲基汞的毒作用机制有多种学说[11-12]:与巯基蛋白结合,影响蛋白质功能,从而导致细胞损伤;产生氧自由基,造成脂质过氧化损伤;增加细胞内Ca2+浓度,导致细胞内钙超载;与硫氧还蛋白家族中的硒蛋白和谷胱甘肽(glutathione, GSH)-谷氧还蛋白家族中的硒位点相结合,导致线粒体功能障碍。然而目前尚未有一种学说可完整解释生命早期甲基汞致子代神经毒作用的机制。有文献报道,母体接触低剂量、不足以引起机体损伤剂量的甲基汞,出生后的婴儿会出现运动和神经系统方面的临床表现,这种损伤并不会随着年龄的增长而消退,且发育阶段接触低剂量甲基汞可通过影响多巴胺系统的功能,进而损伤成年期子代大鼠的学习记忆功能[13]。学习记忆能力是一切认知活动的基础,并且也是评价外源性化学物质神经毒性的敏感指标之一[14]。本研究中,甲基汞暴露显著增加了子代成年大鼠WME和RME。WME属于程序性记忆范畴,是在皮层-纹状体系统调控下完成的对进行中工作任务的重要信息的短期存储;RME则是空间定位物体本身以及物体与食饵的相对关系,以上结果进一步证实围产期甲基汞暴露诱导了子代成年大鼠学习记忆能力下降。
神经递质作为神经元之间或神经元与效应器细胞之间传递信息的化学信使,广泛分布于机体各组织器官,共同调控神经系统及其他各系统,使机体成为一个完整的统一体。胆碱能系统中ACh是最早被发现的一种重要神经递质,在中枢神经系统和外周神经系统起着非常重要的作用,能特异性作用于胆碱能受体,主要参与短时记忆。本研究结果发现,甲基汞暴露导致子代成年大鼠血清中ACh含量显著增加,提示甲基汞在一定程度上破坏了胆碱能系统的功能。单胺类神经递质与学习记忆密切相关,主要包括儿茶酚胺和吲哚胺两大类。儿茶酚胺包括DA、NA和A。NA参与情绪调节和觉醒系统激活[15]。DA是中枢神经系统内重要的神经递质和调质,与改善记忆紧密相关[16]。吲哚胺主要是5-HT,是广泛介导中枢神经系统功能的神经递质,如运动控制、认知、情绪、记忆处理、内分泌调节以及睡眠等[17]。本研究结果显示甲基汞暴露显著增加了子代大鼠血清中单胺类神经递质DA、NA及5-HT的表达水平,降低了A的表达水平,推测这可能是甲基汞暴露导致多种神经系统和神经精神疾病的物质基础。
Glu与GABA是中枢神经系统中最主要的兴奋性和抑制性神经递质,在神经系统的发育、学习和记忆中起着关键作用[18]。Gln不仅是谷氨酸能神经元中兴奋性神经递质谷氨酸的主要前体,也是突触中抑制性神经递质GABA的主要前体。本研究结果显示,甲基汞暴露可导致子代大鼠血清中Glu水平增加,GABA含量降低,从而导致Glu/GABA显著增加,推测甲基汞可能打破了大脑兴奋与抑制的平衡,造成大脑功能紊乱。前期研究表明,低剂量甲基汞短时间暴露导致大鼠脑组织中ACh含量显著增加[19]。Cheng等[20]用5 mg·kg-1和10 mg·kg-1剂量甲基汞对大鼠染毒7 d后,发现甲基汞暴露组大鼠血清中ACh含量显著降低。据相关文献报道,较低的汞浓度可以促进ACh的释放,而较高的汞浓度可能抑制ACh的释放[21]。Glu、Gln和GABA是大脑代谢和功能所必需的氨基酸[22]。在自闭症患者的大脑和血浆样本中,Glu的升高伴随着Gln和GABA水平的降低[23]。Glu/GABA比值在一定范围内的升高可提高学习记忆能力,比值过高则产生抑制作用。相关性分析发现,ACh、5-HT、DA、NA、Glu、GABA与WME显著相关,ACh、5-HT、DA、NA、Glu、GABA与RME显著相关。以上研究结果表明,甲基汞暴露扰乱了子代大鼠神经递质水平,而这些神经递质的变化与子代大鼠学习记忆损伤参数紧密相关。提示,神经递质代谢紊乱在围产期甲基汞暴露致子代成年大鼠学习记忆损伤进程中扮演了重要角色。
中介效应分析在一定程度上揭示了自变量对因变量影响的内在机制,是一种因果效应推断方法[24],鉴于本研究中汞含量、神经递质及学习记忆损伤三者关系满足中介效应检验中介因素与暴露因素和结局均相关的条件[25],因此,采用中介效应探讨神经递质在甲基汞暴露致子代成年大鼠学习记忆损伤中的贡献。结果发现,5-HT和Glu在甲基汞暴露致子代大鼠学习记忆损伤参数WME及RME改变中存在中介作用。
综上所述,神经递质代谢紊乱参与了围产期甲基汞暴露所致子代成年大鼠学习记忆损伤,动态观察5-HT和Glu表达可辅助判断甲基汞致神经损伤,该结果为进一步研究甲基汞致神经损伤的治疗和预防提供了科学依据。
[1] Fujimura M, Usuki F. Pregnant rats exposed to low-level methylmercury exhibit cerebellar synaptic and neuritic remodeling during the perinatal period [J]. Archives of Toxicology, 2020, 94(4): 1335-1347
[2] Rothenberg S E, Feng X B, Li P. Low-level maternal methylmercury exposure through rice ingestion and potential implications for offspring health [J]. Environmental Pollution, 2011, 159(4): 1017-1022
[3] Arbuckle T E, Fisher M, MacPherson S, et al. Maternal and early life exposure to phthalates: The plastics and personal-care products use in pregnancy (P4) study [J]. Science of the Total Environment, 2016, 551-552: 344-356
[4] Axelrad D A, Bellinger D C, Ryan L M, et al. Dose-response relationship of prenatal mercury exposure and IQ: An integrative analysis of epidemiologic data [J]. Environmental Health Perspectives, 2007, 115(4): 609-615
[5] Feng X B, Li P, Qiu G L, et al. Human exposure to methylmercury through rice intake in mercury mining areas, Guizhou Province, China [J]. Environmental Science &Technology, 2008, 42(1): 326-332
[6] 郭佳旗, 魏颖鸿, 张慧, 等. 阿尔茨海默病发病机制及基于神经递质治疗的研究进展[J]. 医学综述, 2021, 27(19): 3761-3766
Guo J Q, Wei Y H, Zhang H, et al. Research progress in pathogenesis and neurotransmitter-based therapy of Alzheimer’s disease [J]. Medical Recapitulate, 2021, 27(19): 3761-3766 (in Chinese)
[7] Jafari Z, Kolb B E, Mohajerani M H. Auditory dysfunction in Parkinson’s disease [J]. Movement Disorders: Official Journal of the Movement Disorder Society, 2020, 35(4): 537-550
[8] Chemchem M, Chemchem A, Ayd ner B, et al. Recent advances in colorimetric and fluorometric sensing of neurotransmitters by organic scaffolds [J]. European Journal of Medicinal Chemistry, 2022, 244: 114820
ner B, et al. Recent advances in colorimetric and fluorometric sensing of neurotransmitters by organic scaffolds [J]. European Journal of Medicinal Chemistry, 2022, 244: 114820
[9] Wang L S, Zhang M D, Tao X, et al. LC-MS/MS-based quantification of tryptophan metabolites and neurotransmitters in the serum and brain of mice [J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2019, 1112: 24-32
[10] 邓彩云, 孙宝飞, 黎健, 等. 宫内甲基汞暴露对子代大鼠学习记忆及海马区FOXP2表达的影响[J]. 环境与健康杂志, 2020, 37(7): 585-589
Deng C Y, Sun B F, Li J, et al. Effects of intrauterine methylmercury exposure on learning and memory and FOXP2 expression in hippocampus of offspring rats [J]. Journal of Environment and Health, 2020, 37(7): 585-589 (in Chinese)
[11] 张泓, 刘建文, 颜崇淮. 二十二碳六烯酸(DHA)对甲基汞神经毒性的保护效应及机制研究进展[J]. 环境与职业医学, 2020, 37(2): 187-191
Zhang H, Liu J W, Yan C H. Research progress on protective effects and mechanisms of docosahexaenoic acid (DHA) on neurotoxicity induced by methylmercury [J]. Journal of Environmental and Occupational Medicine, 2020, 37(2): 187-191 (in Chinese)
[12] Antunes Dos Santos A, Ferrer B, Marques Gonçalves F, et al. Oxidative stress in methylmercury-induced cell toxicity [J]. Toxics, 2018, 6(3): 47
[13] Daré E, Fetissov S, Hökfelt T, et al. Effects of prenatal exposure to methylmercury on dopamine-mediated locomotor activity and dopamine D2 receptor binding [J]. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2003, 367(5): 500-508
[14] 张萍, 贺凯宏, 陈建平, 等. 三氯化铝在酸性环境中对斑马鱼幼鱼运动及学习记忆能力的影响[J]. 生态毒理学报, 2018, 13(5): 288-295
Zhang P, He K H, Chen J P, et al. Effects of aluminum chloride on the movement and learning and memory performance of zebrafish larvae in acidic water environment [J]. Asian Journal of Ecotoxicology, 2018, 13(5): 288-295 (in Chinese)
[15] Bouret S, Sara S J. Network reset: A simplified overarching theory of locus coeruleus noradrenaline function [J]. Trends in Neurosciences, 2005, 28(11): 574-582
[16] 刘娜, 薛彬, 邢华, 等. 多巴胺参与的海马神经元长时程抑制在大鼠新环境探索中的作用[J]. 生理学报, 2009, 61(6): 511-516
Liu N, Xue B, Xing H, et al. Dopamine-dependent long-term depression in hippocampus of rat induced by exposure to spatial novelty [J]. Acta Physiologica Sinica, 2009, 61(6): 511-516 (in Chinese)
[17] Okaty B W, Commons K G, Dymecki S M. Embracing diversity in the 5-HT neuronal system [J]. Nature Reviews Neuroscience, 2019, 20(7): 397-424
[18] Ou C Y, He Y H, Sun Y, et al. Effects of sub-acute manganese exposure on thyroid hormone and glutamine (Gln)/glutamate (Glu)-γ- aminobutyric acid (GABA) cycle in serum of rats [J]. International Journal of Environmental Research and Public Health, 2019, 16(12): 2157
[19] 杨柳, 贾金平, 胡卫萱, 等. 甲基汞急性暴露大鼠脑中汞蓄积及胆碱能神经递质改变的研究[J]. 环境与健康杂志, 2004, 21(2): 72-74
Yang L, Jia J P, Hu W X, et al. Changes of mercury and ACh, AChE contents in rat brains after acute methylmercury chloride exposure [J]. Journal of Environment and Health, 2004, 21(2): 72-74 (in Chinese)
[20] Cheng J P, Yang Y C, Hu W X, et al. Effect of methylmercury on some neurotransmitters and oxidative damage of rats [J]. Journal of Environmental Sciences, 2005(3): 469-473
[21] Mirzoian A, Luetje C W. Modulation of neuronal nicotinic acetylcholine receptors by mercury [J]. The Journal of Pharmacology and Experimental Therapeutics, 2002, 302(2): 560-567
![]() ńska L, Sulkowski G. Relationships between glutamine, glutamate, and GABA in nerve endings under Pb-toxicity conditions [J]. Journal of Inorganic Biochemistry, 2004, 98(6): 951-958
ńska L, Sulkowski G. Relationships between glutamine, glutamate, and GABA in nerve endings under Pb-toxicity conditions [J]. Journal of Inorganic Biochemistry, 2004, 98(6): 951-958
[23] Arnold G L, Hyman S L, Mooney R A, et al. Plasma amino acids profiles in children with autism: Potential risk of nutritional deficiencies [J]. Journal of Autism and Developmental Disorders, 2003, 33(4): 449-454
[24] 杨春艳, 侯艳, 李康. 中介分析方法及在其医学研究中的应用[J]. 中国卫生统计, 2017, 34(1): 159-162
[25] 张涵, 康飞. 基于bootstrap的多重中介效应分析方法[J]. 统计与决策, 2016(5): 75-78