2004年Science杂志上报道海洋水体和沉积物中的塑料碎片问题,首次提出微塑料(microplastics, MPs)的概念。MPs通常指粒径<5 mm的塑料颗粒、碎片或者纤维[1]。作为水环境中普遍存在的一类新污染物,MPs因粒径小、难降解等特点,其生态环境危害和健康风险备受关注。2022年5月我国国务院办公厅印发《新污染物治理行动方案》中明确指出微塑料是当前危害生态系统和人体健康的四大新污染物之一。已有多项研究证实,水体环境中MPs可被多种水生生物(鱼类、浮游动物、浮游植物、贝类等)摄取进入体内,进而诱发一系列的直接毒性效应,包括生长抑制、炎症反应、能量耗竭、代谢紊乱及肝脏毒性等[2-4]。鉴于实际环境中MPs的多样性、持久性及可迁移性,MPs(特别是环境相关浓度)的环境生物效应仍需进一步探究。
多数研究表明,MPs在低浓度、短时间内暴露对水生生物无显著毒性效应,相比于高浓度MPs的直接毒性研究,其对共存污染物的影响更受关注。MPs可通过疏水作用、静电作用、π-π键或氢键作用吸附共存的重金属和有机污染物,进而影响其生物有效性和生物学响应[5]。例如,MPs可吸附并浓缩水体中疏水性有机污染物,增强十溴联苯醚和酚类抗氧化剂在海洋扇贝和斑马鱼体内的富集和毒性作用[6-7];另有研究表明,MPs可显著降低多环芳烃、多氯联苯和双酚A在斑马鱼、金鱼和大型蚤体内的富集含量和致毒效应,主要是因为吸附有机污染物的MPs聚集沉降后降低暴露体系中有机物的赋存浓度,且MPs的快速排出可促进有机物在生物体内的净化[8-10]。相对于MPs直接毒性效应研究的一致性结果,其对共存污染物生物效应的影响更为复杂,结论也更为多样,这可能是MPs-共存污染物-生物三元复合体系中不同相互作用过程的结果,亟待进一步补充研究。
有机磷系阻燃剂(organophosphate flame retardants, OPFRs)因其优越的阻燃、增塑、润滑等性能被广泛应用到电子、纺织、化工、建材及塑料等产品中。OPFRs主要以物理掺杂而非化学键结合的方式添加到产品中,在相关产品的生产、使用和处理等过程中极易从材料中释放出来进入环境[11]。磷酸三(1,3-二氯异丙基)酯(tris(1,3-dichloro-2-propyl) phosphate, TDCIPP)是一种高产的氯代OPFRs,在地表水、沉积物、空气、室内灰尘等环境介质和贝类、鱼类等生物体内均普遍存在[12-13]。实验证明,TDCIPP具有较强的生物危害作用,包括发育毒性、生殖毒性、肝脏毒性、神经毒性、内分泌干扰效应和潜在致癌性[14-15]。在水体环境中,TDCIPP的毒性效应易受共存污染物的影响。我们之前的研究发现,氧化石墨烯共暴露可通过激活线粒体呼吸链提高能量代谢缓解低浓度TDCIPP对斑马鱼幼鱼的发育毒性效应[16]。Ren等[17]研究发现,纳米二氧化钛可作为载体吸附TDCIPP,促进TDCIPP在斑马鱼肝脏、脑部和性腺组织内的生物富集,并增强其生殖毒性。大量研究表明,肝脏是TDCIPP毒性效应的靶器官,TDCIPP对鸡胚胎、大鼠和斑马鱼等均表现出明显的肝脏毒性[18-20]。TDCIPP作为一种疏水性有机污染物(log Kow=3.65,25 ℃),疏水性MPs的共存是否会显著影响其对典型水生生物的肝脏毒性效应还不可知。
聚酰胺(polyamide, PA)是广泛应用于服装、皮带、渔具、汽车轮胎等家庭和工业产品中的工程塑料。调查显示,PA是目前地表水、鱼体、人体肠道和粪便中检出频率和丰度最高的MPs之一[21-24]。研究发现,PA MPs可影响共存有机污染物的生物富集及毒性效应。例如,Rehse等[10]研究发现,PA MPs共存可显著降低双酚A在大型蚤(Daphnia magna)体内的富集,并降低双酚A对大型蚤的急性毒性;Yang等[25]研究发现PA MPs可减弱壬基酚对小球藻(Chlorella pyrenoidosa)生长发育和叶绿素合成的抑制效应,主要是因为MPs吸附有机物后的团聚和沉积降低水相中有机物浓度;Bartonitz等[26]发现PA MPs吸附菲后可降低菲的生物可利用性并缓解菲对淡水甲壳类动物钩虾(Gammarus roeseli)的致死亡作用。近期我们的研究发现,PA MPs对水体中TDCIPP的有效吸附及肠道流体内的快速解吸,使PA MPs作为载体促进了TDCIPP在成年斑马鱼肠道和生殖器官内的富集,增强其对斑马鱼肠道的损伤效应和传代发育毒性[27]。然而,与聚苯乙烯(PS)、聚乙烯和聚氯乙烯相比,有关PA MPs对水体共存污染物生物效应的影响研究相对较少,尤其是环境相关浓度下的研究还极少见报道。高通量代谢组学技术可通过动态监测生物体内所有代谢物含量的变化来灵敏指示外来干扰物在组织和器官水平的毒性效应,尤其在解析生物对低浓度污染物的响应机制中具有不可替代的作用[28]。基于此,本实验以PA MPs和TDCIPP为研究目标,以成年斑马鱼(Danio rerio)为模式生物,开展环境浓度PA与TDCIPP的单一及复合暴露实验,通过分析斑马鱼体长、体质量、肝体指数、肝脏TDCIPP富集含量、氧化损伤和组织病理学损伤等指标的变化,探讨环境浓度MPs对TDCIPP斑马鱼肝脏毒性的影响,并借助代谢组学技术揭示其相关分子机理,研究结果可为复合污染环境中MPs的生态效应及健康风险评估提供重要的理论基础和科学依据。
1 材料与方法(Materials and methods)
1.1 实验试剂
不含添加剂的PA MPs粉末(粒径5~20 μm,密度为1.13 g·cm-3)购自上海冠步机电科技有限公司,TDCIPP标准品(CAS No.13674-87-8,纯度>98.0%)、对三联苯-d14(CAS No.1718-51-0,内标物质)、色谱纯二甲基亚砜(DMSO)、二氯甲烷、乙腈、正己烷和丙酮购于上海安谱实验科技股份有限公司;N-甲基-N-(三甲基硅烷)-三氟乙酰胺(MSTFA;CAS No.123746,纯度>98.0%)和O-甲基羟胺盐酸盐(Cas No.189571,纯度>98.0%)购于北京百灵威科技有限公司;4%多聚甲醛固定液、分析纯乙醇和二甲苯购于阿拉丁试剂有限公司;苏木精-伊红(HE)染色试剂盒和磷酸盐缓冲液(PBS;pH 7.4)购于武汉赛维尔生物科技有限公司。活性氧(ROS)、总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)、丙二醛(MDA)、肿瘤坏死因子(TNF-α)、细胞白介素(IL-6)和三磷酸腺苷(ATP)含量分析生化试剂盒均从南京建成生物工程研究所购买。
1.2 微塑料表征
利用扫描电子显微镜(SEM;JSM-6390LV,日本株式会社日立高新技术公司)观察MPs形貌,使用激光粒度仪(S3500,麦奇克,美国)分析MPs粒径分布,利用傅里叶变换红外光谱仪(FTIR;Spectrum 400F,Perkin Elmer,美国)分析MPs表面官能团,接触角测定仪(Theta Flex,百欧林,瑞典)确定MPs的疏水性。
1.3 成年斑马鱼暴露与生长评估
体长和体质量大致相同的野生型斑马鱼(3个月龄,AB品系)购自上海费曦生物科技有限公司,将成鱼置于装有控温装置和过滤系统的鱼缸中驯化培养14 d后进行暴露实验,实验分为空白对照组、PA单独暴露组(100 μg·L-1)、TDCIPP单独暴露组(0.4、2和10 μg·L-1)、PA+TDCIPP联合暴露组(100 μg·L-1 PA+0.4、2或10 μg·L-1 TDCIPP)。由于环境介质中MPs的检测技术所限,已有研究地表水中MPs的含量几乎均用颗粒数表示,如particles·L-1和particles·m-3。据报道[29],中国、意大利、法国和日本等国家地表水中MPs的丰度为0.82~10 516 particles·m-3,质量浓度约在ng·L-1到mg·L-1之间[30];高污染区域海水中MPs的浓度可达7 800 particles·L-1(质量浓度约为4 500 μg·L-1),平均浓度在3~23 μg·L-1之间[31-32];Goldstein等[33]指出北太平洋亚热带环流中MPs浓度可达300 μg·L-1。本实验使用PA MPs的浓度为100 μg·L-1,具有一定的环境相关性,也是目前许多毒理学实验中使用的最低浓度之一[30, 34]。依据中国连云港水体(0.377 μg·L-1)[35]和日本固体废物处理场附近水体(6.18 μg·L-1)[36]中TDCIPP检测浓度分别设置TDCIPP染毒低剂量和高剂量。因此本实验中MPs和TDCIPP染毒浓度均为环境相关浓度。染毒溶液使用含60 mg·L-1海盐的去离子水配制,空白和处理组中均加入0.01% DMSO为助溶剂,每个浓度设置3个平行鱼缸。实验过程中水体连续充气,并用玻璃棒不定时搅拌,以保持MPs悬浮状态,水体温度为(26±1) ℃,14 h光照/10 h黑暗,每天早晚各喂一次新鲜孵化的丰年虾,喂食30 min后清理剩余食物残渣,并定时清理鱼体排泄物,保持水体干净,2 d更换1/2染毒液。经暴露4个月后,去离子水清洗鱼体,三卡因麻醉,滤纸吸干鱼体表面水分,测量其体长、体质量;冰浴解剖取出肝脏,称量质量,计算鱼的肝体指数(HIS)=肝质量(g)×100%/体质量(g)。部分肝脏组织用4%多聚甲醛固定,4 ℃保存,用于组织病理学分析;剩余肝脏组织,-20 ℃保存,用于TDCIPP含量测定和生化指标分析。实验动物的培养、染毒、解剖和生物样品的收集严格按照国际经济合作组织中斑马鱼毒性测试的要求进行,严格遵循河南师范大学科研实验伦理规范和《动物实验管理条例》相关规定。
1.4 肝脏组织内TDCIPP富集含量分析
依据之前的研究方法进行肝脏内TDCIPP的提取与含量测定[27]。每组分别收集6尾斑马鱼(雌雄比为1∶1),取肝脏组织称量质量后,加入4 mL乙腈和20 ng对三联苯-d14内标物,机械匀浆后,冰浴超声萃取40 min,离心收集上清液,残渣重复提取一次,合并提取液,旋转蒸发至2 mL后,转移到预先活化的SPE(Bond Elut-PPL,200 mg,3 mL)固相小柱,4 mL乙腈和2 mL甲醇洗脱,洗脱物在温和氮气流中吹至近干,用500 μL色谱纯正己烷重溶,转移至气质进样小瓶中,使用装载有HP-5 MS Ultra Inert色谱柱(30 m × 0.25 mm × 0.25 μm,安捷伦,美国)的气相色谱-三重四级杆质谱仪(GC-MS/MS,7890B-7000D,安捷伦,美国)测定TDCIPP的含量。进样量为1 μL,不分流模式,进样口温度290 ℃。柱升温程序:50 ℃恒温2 min,10 ℃·min-1升温至220 ℃,保留0.5 min,4 ℃·min-1升温至240 ℃,保留1.5 min。传输线温度为300 ℃,离子源温度为230 ℃,四级杆温度为150 ℃。TDCIPP和对三联苯-d14定性离子分别为75 m/z和224.2 m/z,定量离子分别为98.9、190.9、209和224.2 m/z。样品分析时设置溶剂空白和肝脏空白样品作为对照监测实验过程的背景污染。肝脏样品中对三联苯-d14的回收率为(94.4±10.6)%,TDCIPP的方法检出限为0.37 μg·kg-1,数据处理中的TDCIPP最终浓度是样品浓度与空白样品TDCIPP最高检测值的差值。
1.5 肝脏毒性指标分析
1.5.1 组织病理学观察
斑马鱼肝脏新鲜组织(雌∶雄=1∶1)用PBS冲洗干净后,立即放入4%多聚甲醛中4 ℃固定过夜,经酒精梯度脱水(50%、70%、85%、95%和100%)和二甲苯透明后,石蜡包埋,制作超薄切片(4 μm),HE染色后,倒置荧光显微镜(Leica DMi8,德国)观察肝脏组织病理学损伤程度,每个处理组设置3个平行。
1.5.2 氧化损伤及炎症因子分析
每组称取3份约30 mg湿质量的肝脏组织样品(雌∶雄=1∶1),按质量体积比1∶9加入预冷PBS,冰浴机械匀浆5 min后,1 500 r·min-1离心10 min收集上清液,按照试剂盒操作流程分别测定ROS、SOD、GPx、GSH、MDA和总蛋白的含量,评估肝脏氧化应激情况;另外,每组称取3份约20 mg湿质量的肝脏组织样本,按照上述步骤制备组织匀浆上清液,与ELISA试剂盒样品混合反应后,采用酶标仪(Synergy H1,BioTek,美国)测定吸光度,采用ELISACalc软件对标准曲线进行Logistic拟合,计算样本中TNF-α和IL-6的绝对浓度,评估肝脏炎症水平,以上指标均用单位蛋白含量计算。
1.6 肝脏代谢组学分析
采用基于GC-MS/MS的非靶向代谢物组学分析方法鉴定污染胁迫下斑马鱼肝脏内源代谢物含量的变化。每组收集斑马鱼肝脏新鲜组织50 mg,液氮快速冷冻,加入2 mL预冷的甲醇/氯仿/水混合提取液(体积比为2.5∶1∶1)研磨成匀浆,40 ℃微波萃取20 min,离心收集上清液,残渣重复萃取一次,合并2次提取液到10 mL离心管后加入500 μL灭菌的高纯水,离心得到分层的样品溶液,取出下层的氯仿相氮吹至近干,与上层的甲醇/水相混合,氮吹后冷冻干燥,-80 ℃密封保存。干燥的代谢物加入50 μL吡啶溶解的O-甲基羟胺盐酸盐(20 mg·mL-1),涡旋振荡混匀后,30 ℃水浴90 min,再加入80 μL的MSTFA,37 ℃水浴30 min。经两步衍生化后的代谢物样品4 ℃高速离心8 min(10 000 r·min-1),收集上清液转移至气质进样小瓶,GC-MS/MS上机检测,具体气相和质谱参数见我们前期研究报道[37]。数据采集以Scan模式获得总离子流色谱图,利用NIST14.0数据库对代谢物进行定性分析,生成包含化合物名称、保留时间、峰面积和匹配度等信息的文件。根据保留时间和匹配度筛选代谢物,以峰面积表示代谢物相对含量。使用SIMCA-P 13.0软件包对数据进行多元统计分析,通过主成分分析(PCA)得出处理组与空白组之间代谢物的离散趋势,利用MetaboAnalyst 5.0数据库对差异倍数>1.5的代谢物进行KEGG通路定位,找出显著富集的代谢通路。
1.7 数据处理
所有实验组均设置3个生物学重复,实验结果用平均值±标准偏差表示。使用SPSS 20.0软件进行统计数据处理及单因素方差(ANOVA)分析,当P<0.05时,表示2组之间具有显著性差异,所有图均使用Origin 9.0软件进行绘制。
2 结果(Results)
2.1 PA MPs理化性质分析
SEM结果显示PA MPs为无规则的片状结构(图1(a)),粒径范围在1~20 μm,其中粒径在5~15 μm的塑料颗粒占比67.7%,平均粒径为(15.2±7.4) μm(图1(b))。FTIR结果显示PA MPs具有显著的酰胺Ⅰ(—NH—C![]() O)、酰胺Ⅱ(—CH2—NH—)和氮氢(N—H)键(图1(c)),这与PA(尼龙66)的红外标准谱峰一致,表明本实验使用的PA MPs不含有化学添加剂(与商家提供的信息一致),因此毒性效应不涉及可能释放的添加剂的影响。PA MPs的水体接触角为92.72°±3.2°(图1(d)),表明其具有一定的亲水性。
O)、酰胺Ⅱ(—CH2—NH—)和氮氢(N—H)键(图1(c)),这与PA(尼龙66)的红外标准谱峰一致,表明本实验使用的PA MPs不含有化学添加剂(与商家提供的信息一致),因此毒性效应不涉及可能释放的添加剂的影响。PA MPs的水体接触角为92.72°±3.2°(图1(d)),表明其具有一定的亲水性。
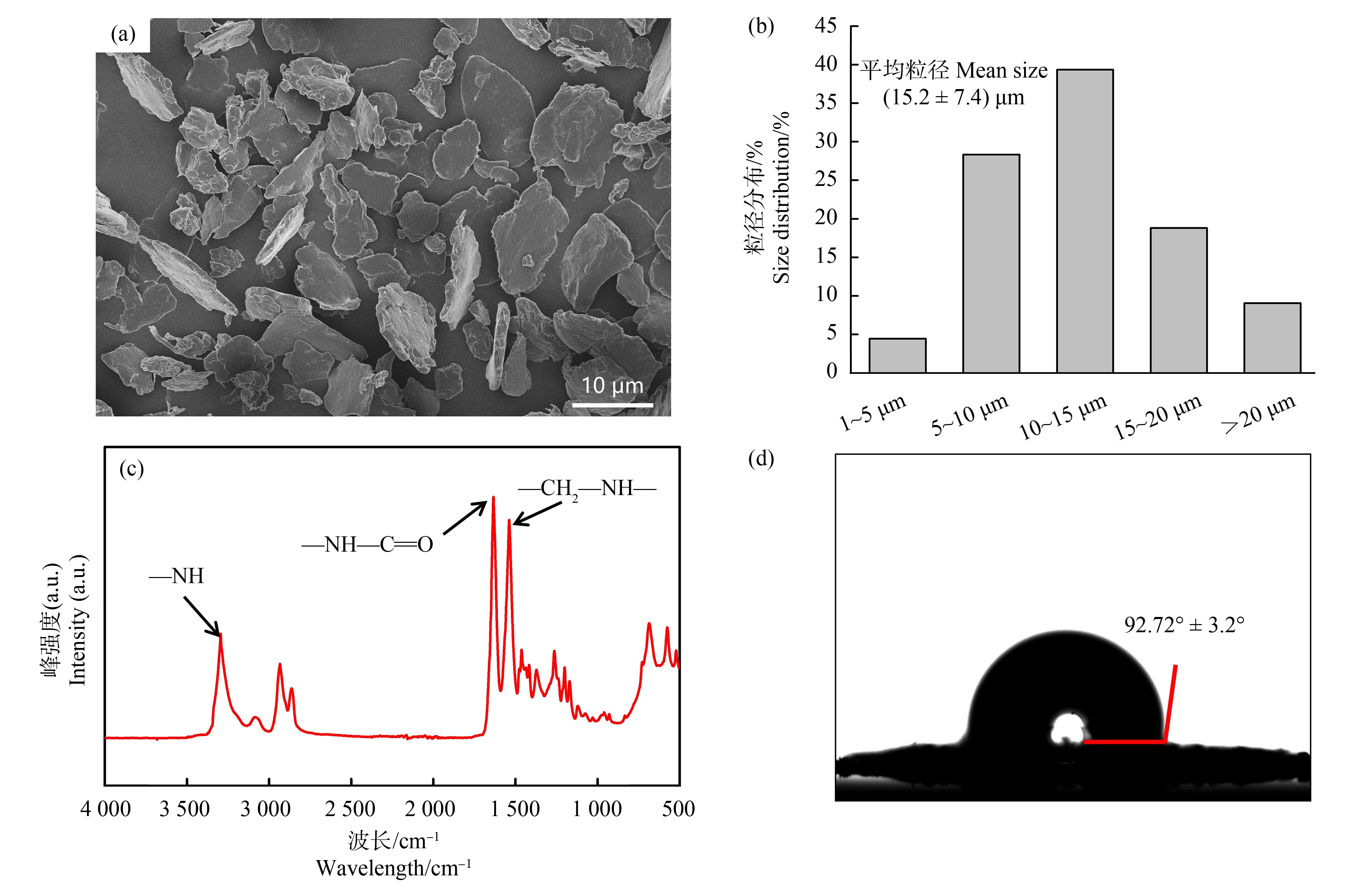
图1 聚酰胺微塑料(PA MPs)的扫描电镜(a)、粒径分布(b)、傅里叶红外(c)和接触角(b)分析
Fig. 1 Scanning electron microscope (a), size distribution (b), Fourier transform infrared spectroscopy (c) and contact angle analysis of polyamide microplastics (PA MPs)
2.2 斑马鱼生长发育和肝脏TDCIPP含量分析
如图2(a)和2(b)所示,经4个月暴露处理后,PA(100 μg·L-1)和低浓度TDCIPP(0.4 μg·L-1和2 μg·L-1)单独实验组中斑马鱼的体长和体质量与空白组之间均无显著性差异(P>0.05),高浓度的TDCIPP(10 μg·L-1)暴露导致斑马鱼体质量下降14.9%;相比于空白组,100 μg·L-1 PA和10 μg·L-1 TDCIPP复合处理组斑马鱼的体长和体质量分别降低16.3%和24.8%(P<0.05),表明PA和TDCIPP对斑马鱼生长表现出明显的协同抑制效应。肝体指数分析表明,单一TDCIPP或PA暴露均对斑马鱼肝脏无显著影响,但中、高浓度联合暴露使斑马鱼肝体指数明显降低,相对于单独TDCIPP处理组分别降低9.5%和13.0%(图2(c)),表明环境相关浓度MPs的共存显著增强TDCIPP对斑马鱼肝脏的损伤效应,诱发明显的肝脏萎缩。有机污染物的富集量是影响其毒性效应的关键因素,进一步分析斑马鱼肝脏TDCIPP含量发现,不同浓度的TDCIPP单一暴露时,斑马鱼肝脏内TDCIPP的富集量分别为0.18、0.54和4.12 μg·g-1(以单位湿质量计);PA MPs存在条件下,复合处理组中斑马鱼肝脏内TDCIPP的富集含量分别达至0.32、0.83和5.30 μg·g-1 (图2(d)),这些数据显示PA MPs共存可显著促进TDCIPP在斑马鱼肝脏内的富集,这可能是斑马鱼生长抑制和肝脏损伤效应加重的原因之一。
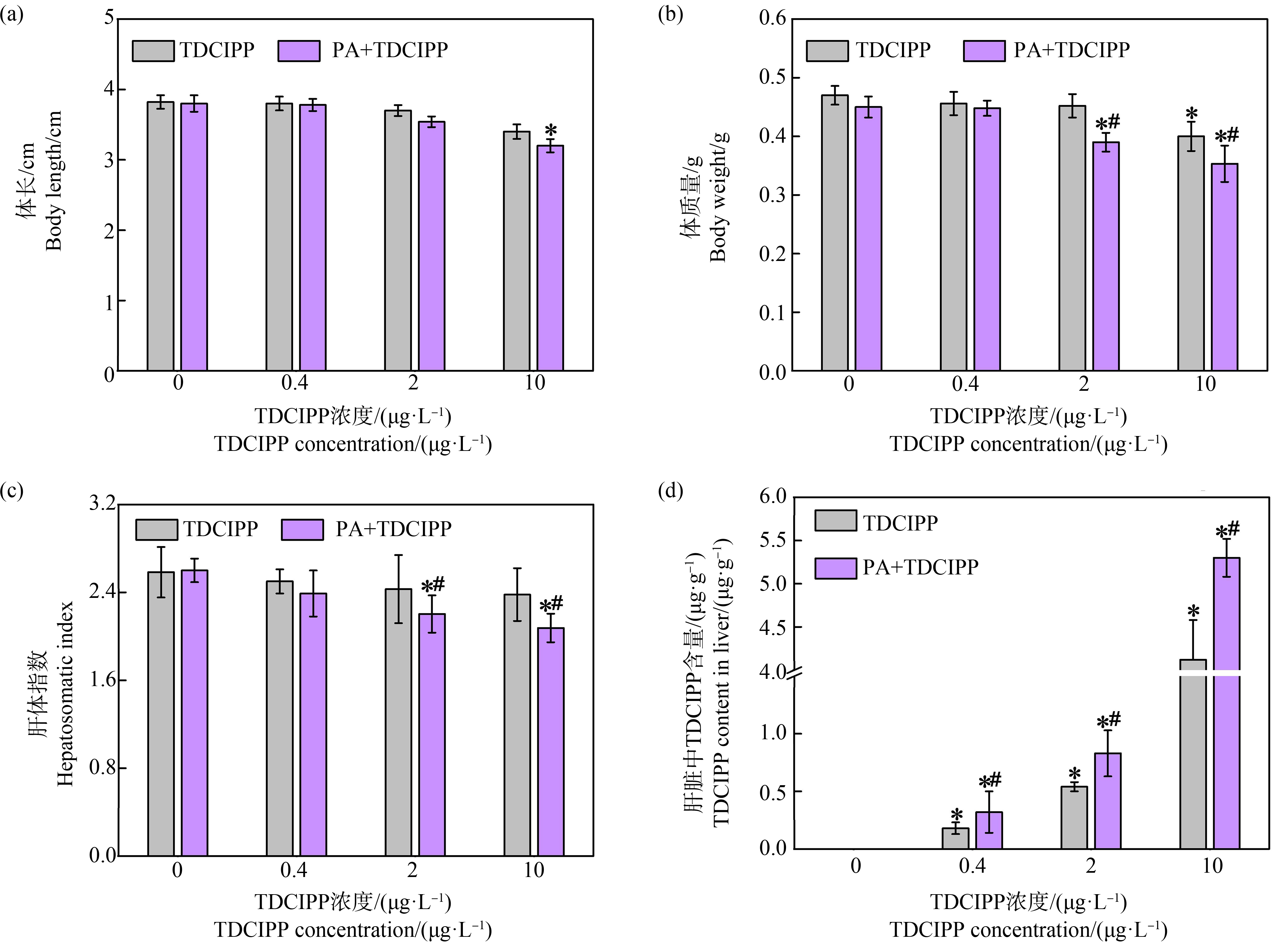
图2 斑马鱼生长情况和肝脏磷酸三(1,3-二氯异丙基)酯(TDCIPP)含量分析
注:*和#分别表示相对于空白组和单独TDCIPP处理组具有显著性差异(P<0.05)。
Fig. 2 Growth assessment of zebrafish and tris(1,3-dichloro-2-propyl) phosphate (TDCIPP) content in fish liver
Note: *and # represent significant differences compared with control and TDCIPP single group (P<0.05).
2.3 斑马鱼肝脏抗氧化酶和炎症因子水平分析
通过肝脏ROS水平和抗氧化酶SOD、GPx活性及MDA含量分析,评估PA与TDCIPP单一及复合暴露对斑马鱼肝脏的氧化损伤效应。如图3(a)所示,相对于空白对照,单一TDCIPP处理组中斑马鱼肝脏ROS水平均有不同程度的升高,当浓度为10 μg·g-1时,ROS水平提高了21.6%,同时单一PA暴露时ROS水平也显著升高(23.1%)。PA和TDCIPP复合暴露组中肝脏ROS水平变化更为显著,相对于空白和单一TDCIPP处理组,分别上调26.8%~61.6%和19.6%~31.3%。与此同时,SOD和GPx酶活性的变化呈现与ROS相似的趋势,从高到低的顺序为:PA+TDCIPP联合暴露组>PA暴露组>高浓度TDCIPP暴露组>>中、低浓度TDCIPP暴露组≈空白对照组(图3(b)和图3(c));相应地,中、高浓度联合暴露组中斑马鱼肝脏MDA含量相比于空白和TDCIPP暴露组分别提高18.9%~35.8%和12.5%~16.2%(P<0.05,图3(d))。上述研究结果表明,单一PA和TDCIPP暴露均一定程度上诱导斑马鱼肝脏组织ROS水平和抗氧化酶活性产生变化,二者联合暴露时肝脏ROS水平上调更为明显,抗氧化酶系统干扰程度加重,表现出更为显著的氧化损伤。进一步通过分析TNF-α和IL-6炎症因子水平变化,评估污染胁迫下斑马鱼肝脏的炎症响应。如图3(e)和图3(f)结果显示,环境浓度TDCIPP暴露不会诱发斑马鱼肝脏出现明显的炎症反应,单一PA暴露时,IL-6含量相对于空白增加28.3%;PA和TDCIPP联合暴露诱导最为显著的炎症反应,当PA和TDCIPP浓度分别为100 μg·L-1和10 μg·L-1时,相对于空白组和单一TDCIPP暴露组,TNF-α含量分别提高50.3%和35.8%,IL-6含量分别提高94.3%和63.5%(P<0.05),表明复合暴露中PA显著增强TDCIPP诱发的斑马鱼肝脏炎症效应。

图3 斑马鱼肝脏氧化损伤及炎症响应
注:*和#分别表示相对于空白组和单独TDCIPP处理组具有显著性差异(P<0.05)。
Fig. 3 Oxidative damage and inflammatory response of zebrafish liver
Note: *and # represent significant differences compared with control and TDCIPP single group (P<0.05).
2.4 斑马鱼肝脏组织病理学损伤
鉴于PA共存显著促进TDCIPP诱发的斑马鱼肝脏萎缩,并增强其氧化损伤和炎症效应,因此,进一步对空白组、TDCIPP(10 μg·L-1)、PA和PA+TDCIPP(100 μg·L-1、10 μg·L-1)复合暴露组中斑马鱼肝脏组织进行病理学损伤分析。如图4(a)所示,空白组中斑马鱼的肝细胞分布均匀,索状结构清晰,细胞间分布着丰富的毛细血管,细胞核呈圆形,位于细胞中央,细胞膜结构完整。与空白组相比,TDCIPP处理组中斑马鱼肝脏大部分胞核呈圆球形,位于细胞中央,细胞呈现清晰索状结构,无明显损伤(图4(b));而PA处理组中斑马鱼肝细胞基质变淡,部分区域细胞核萎缩变形(绿色箭头)、核溶解(黄色箭头),局部组织出现坏死情况(红色椭圆位置)(图4(c))。PA MPs和TDCIPP联合暴露使斑马鱼肝脏结构损伤明显加重,细胞排列疏松、间隙增大、索状结构消失,细胞间质增加,出现大规模的核萎缩、溶解和胞质溶解现象,组织坏死形成空洞(图4(d))。上述观察结果与肝体指数下降、氧化损伤和炎症因子水平结果是一致的。

图4 斑马鱼肝脏组织病理学观察
注:PA和TDCIPP的浓度分别为100 μg·L-1和10 μg·L-1;绿色箭头表示胞核固缩、核变形,黄色箭头表示核溶解,红色椭圆区域表示组织局部坏死,空洞形成;比例尺为20 μm。
Fig. 4 Histopathological observation of zebrafish liver
Note: The concentration of PA and TDCIPP was 100 μg·L-1 and 10 μg·L-1, respectively; green arrows indicate cell nucleus pyknosis and nuclear deformation, yellow arrows indicate nuclear dissolution, red ovals indicate local tissue necrosis and cavity formation, and the scale bars were 20 μm.
2.5 斑马鱼肝脏代谢组学分析
GC-MS/MS分析共检测到60种肝脏代谢物,主要包括糖类、脂肪酸、氨基酸、脂类、小分子酸和胆固醇等(表1)。PCA结果(图5(a))显示,空白组(Control)、PA、0.4 μg·L-1 TDCIPP (T0.4)、2 μg·L-1 TDCIPP (T2)和0.4 μg·L-1 TDCIPP +PA(PA-T0.4)处理组呈现聚集趋势,而10 μg·L-1 TDCIPP(T10)、2 μg·L-1 TDCIPP+PA(PA-T2)和10 μg·L-1 TDCIPP+PA(PA-T10)这3个处理组之间相关性较高,表明PA和低、中浓度TDCIPP单一暴露组斑马鱼肝脏代谢产物成分和含量与空白对照相似,而高浓度TDCIPP及中、高浓度复合暴露组中代谢物成分和含量与空白存在明显差异,表明PA共存显著增强TDCIPP对斑马鱼肝脏内源代谢过程的干扰作用。
表1 不同处理组斑马鱼肝脏代谢物的相对含量
Table 1 Relative abundances of metabolites in zebrafish liver from different groups
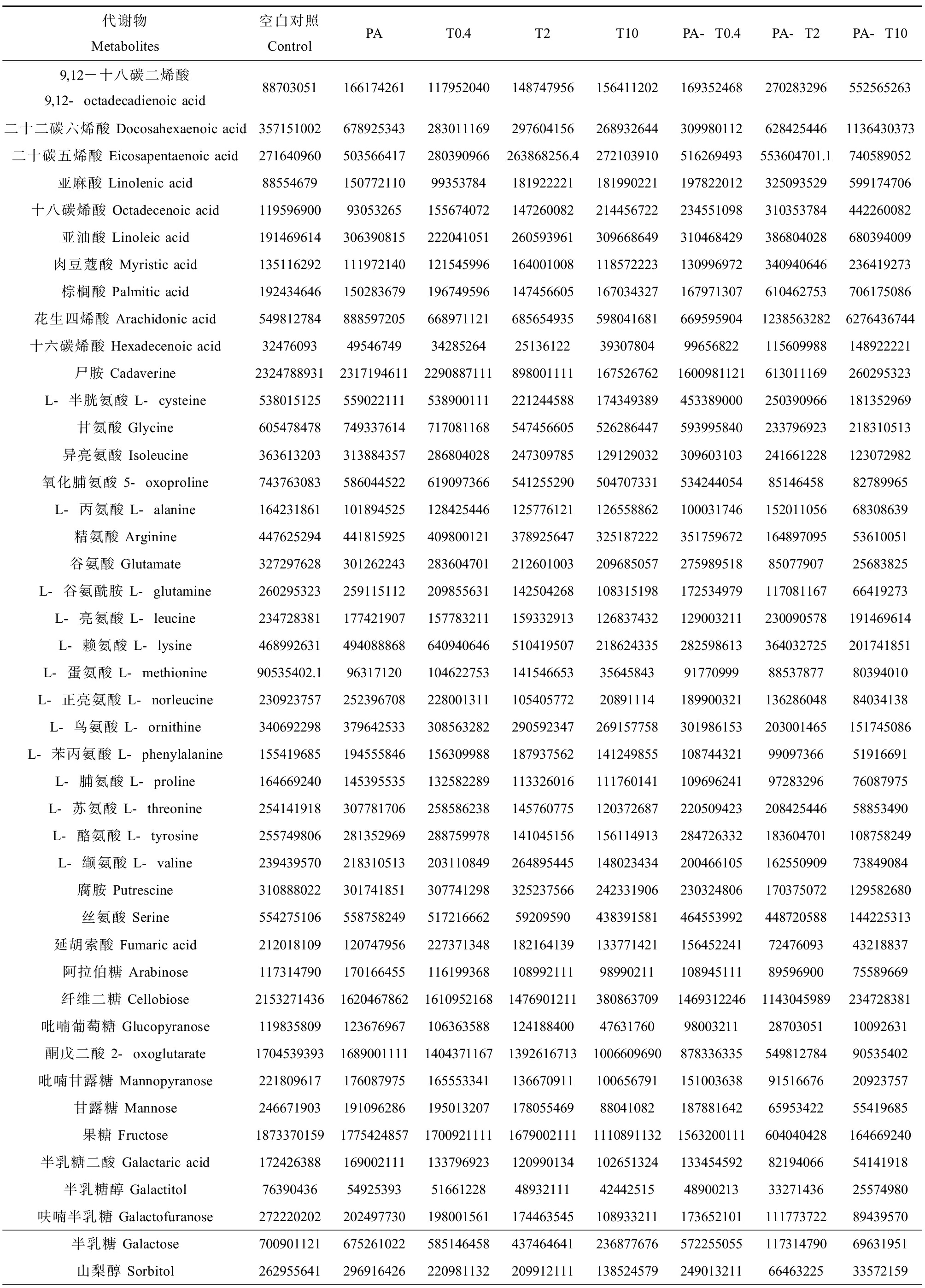
代谢物Metabolites空白对照ControlPAT0.4T2T10PA-T0.4PA-T2PA-T109,12-十八碳二烯酸9,12-octadecadienoic acid88703051166174261117952040148747956156411202169352468270283296552565263二十二碳六烯酸 Docosahexaenoic acid3571510026789253432830111692976041562689326443099801126284254461136430373二十碳五烯酸 Eicosapentaenoic acid271640960503566417280390966263868256.4272103910516269493553604701.1740589052亚麻酸 Linolenic acid8855467915077211099353784181922221181990221197822012325093529599174706十八碳烯酸 Octadecenoic acid11959690093053265155674072147260082214456722234551098310353784442260082亚油酸 Linoleic acid191469614306390815222041051260593961309668649310468429386804028680394009肉豆蔻酸 Myristic acid135116292111972140121545996164001008118572223130996972340940646236419273棕榈酸 Palmitic acid192434646150283679196749596147456605167034327167971307610462753706175086花生四烯酸 Arachidonic acid54981278488859720566897112168565493559804168166959590412385632826276436744十六碳烯酸 Hexadecenoic acid324760934954674934285264251361223930780499656822115609988148922221尸胺 Cadaverine2324788931231719461122908871118980011111675267621600981121613011169260295323L-半胱氨酸 L-cysteine538015125559022111538900111221244588174349389453389000250390966181352969甘氨酸 Glycine605478478749337614717081168547456605526286447593995840233796923218310513异亮氨酸 Isoleucine363613203313884357286804028247309785129129032309603103241661228123072982氧化脯氨酸 5-oxoproline7437630835860445226190973665412552905047073315342440548514645882789965L-丙氨酸 L-alanine16423186110189452512842544612577612112655886210003174615201105668308639精氨酸 Arginine44762529444181592540980012137892564732518722235175967216489709553610051谷氨酸 Glutamate3272976283012622432836047012126010032096850572759895188507790725683825L-谷氨酰胺 L-glutamine26029532325911511220985563114250426810831519817253497911708116766419273L-亮氨酸 L-leucine234728381177421907157783211159332913126837432129003211230090578191469614L-赖氨酸 L-lysine468992631494088868640940646510419507218624335282598613364032725201741851L-蛋氨酸 L-methionine90535402.19631712010462275314154665335645843917709998853787780394010L-正亮氨酸 L-norleucine2309237572523967082280013111054057722089111418990032113628604884034138L-鸟氨酸 L-ornithine340692298379642533308563282290592347269157758301986153203001465151745086L-苯丙氨酸 L-phenylalanine1554196851945558461563099881879375621412498551087443219909736651916691L-脯氨酸 L-proline1646692401453955351325822891133260161117601411096962419728329676087975L-苏氨酸 L-threonine25414191830778170625858623814576077512037268722050942320842544658853490L-酪氨酸 L-tyrosine255749806281352969288759978141045156156114913284726332183604701108758249L-缬氨酸 L-valine23943957021831051320311084926489544514802343420046610516255090973849084腐胺 Putrescine310888022301741851307741298325237566242331906230324806170375072129582680丝氨酸 Serine55427510655875824951721666259209590438391581464553992448720588144225313延胡索酸 Fumaric acid2120181091207479562273713481821641391337714211564522417247609343218837阿拉伯糖 Arabinose117314790170166455116199368108992111989902111089451118959690075589669纤维二糖 Cellobiose215327143616204678621610952168147690121138086370914693122461143045989234728381吡喃葡萄糖 Glucopyranose11983580912367696710636358812418840047631760980032112870305110092631酮戊二酸 2-oxoglutarate1704539393168900111114043711671392616713100660969087833633554981278490535402吡喃甘露糖 Mannopyranose2218096171760879751655533411366709111006567911510036389151667620923757甘露糖 Mannose246671903191096286195013207178055469880410821878816426595342255419685果糖 Fructose187337015917754248571700921111167900211111108911321563200111604040428164669240半乳糖二酸 Galactaric acid1724263881690021111337969231209901341026513241334545928219406654141918半乳糖醇 Galactitol7639043654925393516612284893211142442515489002133327143625574980呋喃半乳糖 Galactofuranose27222020220249773019800156117446354510893321117365210111177372289439570半乳糖 Galactose70090112167526102258514645843746464123687767657225505511731479069631951山梨醇 Sorbitol2629556412969164262209811322099121111385245792490132116646322533572159

续表1代谢物Metabolites空白对照ControlPAT0.4T2T10PA-T0.4PA-T2PA-T10葡萄糖酸 Gluconic acid39630585431755420245201105631795151813309001131883697811222020215116292葡萄糖 Glucose5705869478305333508259885408742365518083253858350754054211622262955641310888022乳糖 Lactose5470690114827899655211557484361227303283632354879001229131852754086643甲基半乳糖苷 Methyl galactoside10679265719830863911649789377987885650912221134370215586947822729186丙酮酸 Pyruvate1271960388001111312170453412538641698383234999902421979778812434646琥珀酸 Succinic acid1071916691490021111988001255401035678590446553695036060547069011239386666异柠檬酸 Isocitrate2172916281295826802112915352055995891082887351789983856834270111313991棕榈酸单甘油酯 1-monopalmitin293828013278153852256554778286389428461623372214525771816363588902442515氨基丁酸 4-aminobutanoic acid117448945127604156108066417127053994135237050171350501406609690602497730乙酸 Acetic acid386887814375026519280734234245508195531750734452521350358583507508524579胆固醇 Cholesterol169534221150469810226491786281955011441158284252789062674349390673286230肌酸酐 Creatinine60404042857165462571055863759313010191791996210569464989780410821054367093甘油 Glycerol40071085531604110841489709542059396197328623037392263921789253433726286447单硬脂酸甘油酯 Glycerol monostearate91537500900004198507790716400100816436709384589263224671903369164192乳酸 Lactic acid14372238222625559212028329612369555483541301241008951202103910220692003尿素 Urea280554917271353871263205118220019258204790321298000211202651324140737788
注:PA表示100 μg·L-1 PA MPs处理组,T0.4、T2和T10分别表示0.4、2和10 μg·L-1 TDCIPP处理组,PA-T0.4、PA-T2和PA-T10分别表示100 μg·L-1 PA和0.4、2和10 μg·L-1 TDCIPP联合暴露处理组。
Note: PA indicated 100 μg·L-1 of PA MPs exposure group; T0.4, T2 and T10 indicated 0.4, 2 and 10 μg·L-1 of TDCIPP exposure group, respectively; PA-T0.4, PA-T2 and PA-T10 indicated 100 μg·L-1 of PA and 0.4, 2 or 10 μg·L-1 of TDCIPP co-exposure group, respectively.
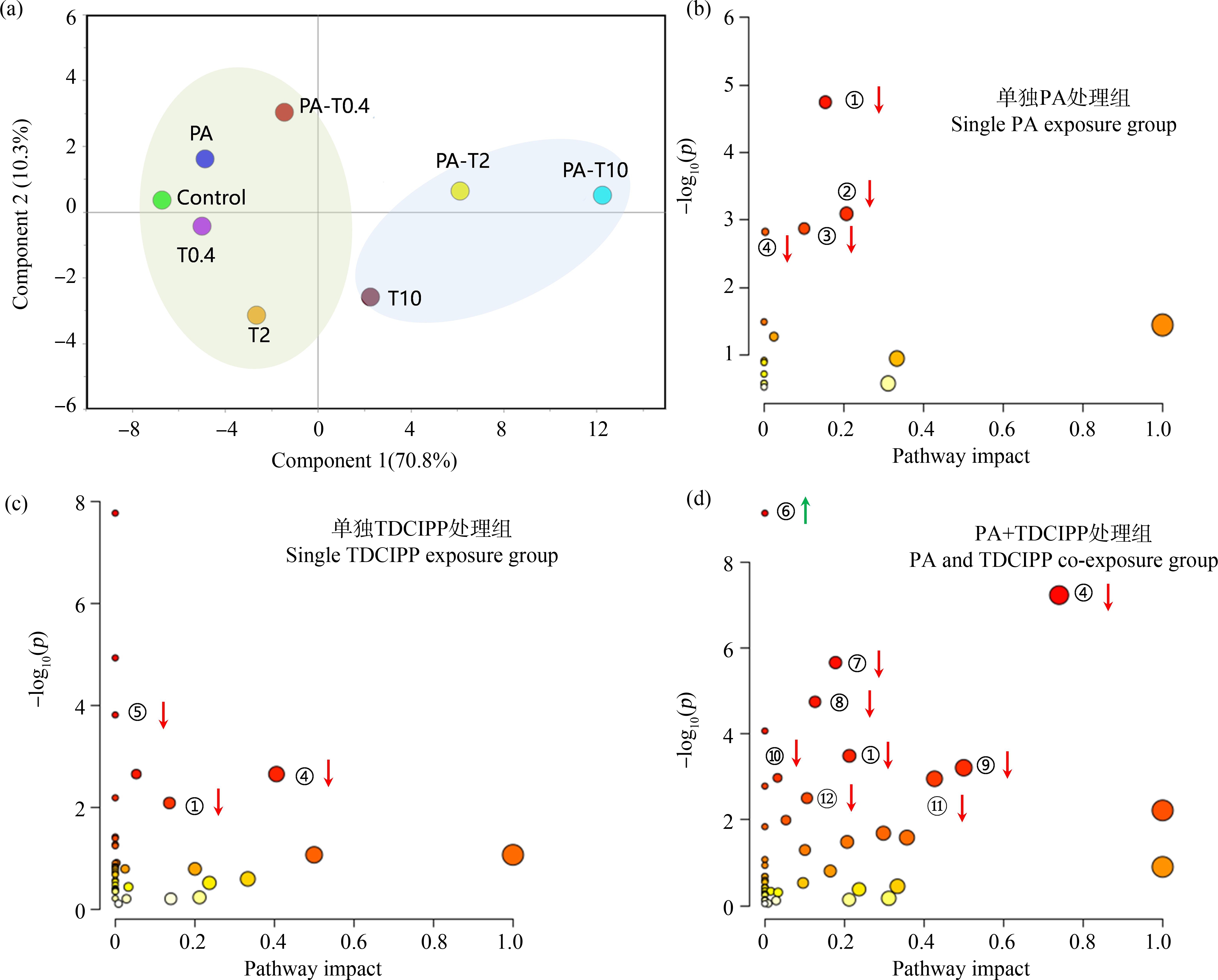
图5 斑马鱼肝脏代谢物PCA(a)和KEGG富集通路(b)~(d)分析
注:① ~![]() 依次表示三羧酸循环、丙酮酸代谢、糖解和糖代谢、丙氨酸、天冬氨酸和谷氨酸代谢、半乳糖代谢、不饱和脂肪酸合成、精氨酸合成、谷胱甘肽代谢、D-谷氨酰胺和D-谷氨酸代谢、丁酸代谢、精氨酸和脯氨酸代谢、乙醛酸和二羧酸代谢(P<0.05)。
依次表示三羧酸循环、丙酮酸代谢、糖解和糖代谢、丙氨酸、天冬氨酸和谷氨酸代谢、半乳糖代谢、不饱和脂肪酸合成、精氨酸合成、谷胱甘肽代谢、D-谷氨酰胺和D-谷氨酸代谢、丁酸代谢、精氨酸和脯氨酸代谢、乙醛酸和二羧酸代谢(P<0.05)。
Fig. 5 PCA (a) and KEGG pathway enrichment (b)~(d) analysis of metabolites in zebrafish liver
Note: ① ~![]() represent the pathway of citrate cycle (TCA cycle), pyruvate metabolism, glycolysis/gluconeogenesis, alanine, aspartate and glutamate metabolism, galactose metabolism, biosynthesis of unsaturated fatty acids, arginine biosynthesis, glutathione metabolism, D-glutamine and D-glutamate metabolism, butanoate metabolism, arginine and proline metabolism, glyoxylate and dicarboxylate metabolism, respectively.
represent the pathway of citrate cycle (TCA cycle), pyruvate metabolism, glycolysis/gluconeogenesis, alanine, aspartate and glutamate metabolism, galactose metabolism, biosynthesis of unsaturated fatty acids, arginine biosynthesis, glutathione metabolism, D-glutamine and D-glutamate metabolism, butanoate metabolism, arginine and proline metabolism, glyoxylate and dicarboxylate metabolism, respectively.
以差异倍数(处理组/对照组)≥ 1.5或≤ 0.66为标准筛选显著差异的代谢物,并导入MetaboAnalyst 5.0进行代谢路径富集分析,结果显示,单一PA暴露显著抑制三羧酸循环(TCA cycle)过程、丙酮酸代谢(pyruvate metabolism)、糖酵解与糖代谢(glycolysis/gluconeogenesis)以及丙氨酸、天冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism);单一的TDCIPP暴露显著抑制肝脏半乳糖代谢(galactose metabolism)、TCA循环以及丙氨酸、天冬氨酸和谷氨酸代谢,这些结果表明PA或TDCIPP胁迫主要抑制斑马鱼肝脏能量的合成,同时影响糖代谢中间产物氨基酸的合成过程。然而,在PA MPs和TDCIPP复合处理组中,斑马鱼肝脏TCA循环、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸代谢(arginine biosynthesis)、谷胱甘肽代谢(glutathione metabolism)和D-谷氨酰胺D-谷氨酸代谢(D-glutamine and D-glutamate metabolism)等过程均显著下调,与此同时,不饱和脂肪酸代谢(biosynthesis of unsaturated fatty acids)路径明显上调,相比于单独的PA MPs或TDCIPP,二者复合暴露对与抗氧化物质(如GSH、氨基酸)生物合成和炎症反应相关的不饱和脂肪酸等的代谢干扰显著加剧。
3 讨论(Discussion)
MPs和TDCIPP是水环境中普遍存在且备受关注的新污染物,二者不可避免地共存于水体环境,目前关于TDCIPP和MPs单一毒性效应的研究较多,而二者联合生物效应的毒理学数据十分缺乏,尤其是环境浓度条件下的相关研究亟待开展。本研究将PA(100 μg·L-1)、不同浓度TDCIPP(0.4、2和10 μg·L-1)及其二者复合后暴露于成年斑马鱼,通过系统比较不同处理组斑马鱼肝脏发育、氧化应激、炎症因子、TDCIPP富集量及内源代谢物的变化,探究环境相关浓度MPs对TDCIPP诱发斑马鱼肝脏毒性效应的影响及其分子机制。研究结果表明,100 μg·L-1 PA和低浓度(0.4 μg·L-1和2 μg·L-1)TDCIPP暴露未对斑马鱼体长、体质量和肝体指数产生明显影响,10 μg·L-1 TDCIPP会导致斑马鱼体质量降低,同时PA共暴露显著增强TDCIPP对斑马鱼体长、体质量和肝脏生长的抑制作用。前期研究证实,PA MPs可吸附水体中的TDCIPP(饱和吸附容量为0.363 mg·g-1),作为载体增强TDCIPP在斑马鱼肠道内的富集;因吸附态TDCIPP在肠道流体内可以快速解吸,PA显著促进了TDCIPP向鱼体生殖器官的迁移[27];本研究对肝脏内TDCIPP定量分析发现,相对于单一TDCIPP暴露,PA共存导致斑马鱼肝脏TDCIPP富集量增加了1.3倍~1.7倍,再次证实PA MPs在TDCIPP生物转运过程中的载体作用。Zhao等[38]研究发现纳米PS可促进TDCIPP在斑马鱼成鱼体内的富集并向子代迁移。因此,PA MPs促进TDCIPP的肝脏富集量是联合暴露诱发明显斑马鱼肝脏损伤的原因。然而,相反的报道指出,PA MPs吸附双酚A、壬基酚和菲后,复合体的团聚和沉降行为降低水相中有机物的浓度,进而缓和了有机物对大型蚤(Daphnia magna)[10]、小球藻(Chlorella pyrenoidosa)[25]和淡水甲壳类动物(Gammarus roeseli)的毒性效应[26]。MPs从水体转运到以上受试生物体内的方式有差异,本研究中PA MPs增强TDCIPP对斑马鱼的肝脏毒性,与斑马鱼易于摄食负载TDCIPP的MPs颗粒物导致靶器官内TDCIPP含量高有关。鉴于MPs与共存有机物的复合生物效应是微塑料-有机物-生物体三元体系中不同相互作用过程的结果,我们进一步探讨了MPs影响TDCIPP肝脏毒性作用的相关机制。
肝脏作为生物新陈代谢、异物解毒和有害物质排泄的主要器官,是众多有毒有害化合物的毒性作用靶器官,而活性氧、抗氧化物和炎症因子是肝脏损伤的敏感生物标记物。本实验研究发现,100 μg·L-1 PA和10 μg·L-1 TDCIPP单独暴露导致斑马鱼肝脏ROS水平、SOD及GPx活性升高,但是MDA含量无显著变化,表明PA和TDCIPP单独暴露均诱发氧化应激但是并没有形成明显的氧化损伤,而PA和TDCIPP联合暴露导致斑马鱼肝脏出现显著的氧化应激和氧化损伤,主要表现为肝脏ROS水平(图3(a))和脂质过氧化物MDA的含量明显增高(图3(d))。研究表明,MPs的毒性靶器官与其粒径密切相关。例如,100 μg·L-1的PS MPs(粒径≤1 μm)暴露使斑马鱼肝脏和性腺组织内ROS水平升高,扰乱鱼类的抗氧化防御系统,诱发明显的氧化损伤[39-40];然而,粒径>5 μm的MPs则很难穿透肠道上皮细胞进入鱼的内脏器官,粒径为5 μm的PS可以在斑马鱼鳃、肝脏和肠道中积累,20 μm的PS仅在鱼鳃和肠道中积累[41]。本研究中,PA粒径为1~20 μm,平均粒径为(15.2±7.4) μm,大部分塑料颗粒无法转运进入肝脏细胞,这可能是同样浓度PA MPs暴露没有诱导斑马鱼肝脏出现明显氧化损伤的原因。因此,二者联合暴露诱发斑马鱼出现更为严重的肝脏氧化损伤,这可能主要由PA促进TDCIPP肝脏富集导致的。单一TDCIPP暴露组未观察到明显炎症反应,单一PA处理组中肝脏炎症因子IL-6的含量显著升高,然而100 μg·L-1 PA和10 μg·L-1 TDCIPP复合组中TNF-α和IL-6含量相比空白组分别提高50.3%和94.3%(P<0.05),表明PA显著加强了TDCIPP对斑马鱼肝脏免疫系统的影响。氧化应激和炎症反应会引起肝脏出现病理学损伤,最终导致肝排泄和解毒功能异常。实验研究发现,10 μg·L-1的TDCIPP处理对鱼体肝脏组织结构无明显影响,单一PA处理后斑马鱼肝细胞基质变淡,出现轻微的细胞核萎缩变形、核溶解和组织坏死情况。二者复合暴露后,肝脏结构损伤明显加重,细胞排列疏松,间隙增大,大量的细胞核萎缩、溶解,组织坏死、空洞现象出现。以上结果表明,PA共存可促进TDCIPP的生物富集,并通过加剧氧化损伤和炎症反应增强其对肝脏组织结构的破坏。据报道,20 μg·L-1和200 μg·L-1的PS塑料颗粒(~5 μm)与重金属Cd复合暴露时,可以增加Cd在斑马鱼肝脏中的积累,诱发明显的肝脏炎症反应,增强Cd的肝毒性[42]。聚乙烯、聚丙烯和聚氯乙烯共暴露可增加三氯生在斑马鱼肝脏和肠道内的富集含量,加重肝脏氧化应激和脂质过氧化[43]。本研究首次证实环境浓度的PA MPs可促进TDCIPP在斑马鱼肝脏内的富集,加强肝脏氧化损伤和炎症反应,为全面认识水环境中MPs的间接载体作用提供了证据。
代谢物作为细胞功能的基础,其变化反映了生物功能或表型在环境刺激下的响应规律。本实验进一步利用代谢组学技术筛选污染胁迫下斑马鱼肝脏异常的代谢物和代谢通路,系统揭示PA与TDCIPP复合毒性增强的分子机制。如图6所示,基于不同处理组代谢物变化构建污染胁迫下斑马鱼肝脏代谢路径图,主要变化的代谢路径包括糖酵解/糖异生、TCA循环、不饱和脂肪酸的生物合成、谷胱甘肽代谢和精氨酸生物合成过程。糖酵解是葡萄糖转化为丙酮酸在体内产能的过程,丙酮酸作为糖酵解途径的最终产物,无氧条件下在细胞浆中还原成乳酸供能(少量ATP生成),有氧条件下则转入线粒体氧化生成乙酰辅酶A,进入TCA循环,最后通过氧化磷酸化合成大量ATP。数据显示(表1和图6),与空白相比,单一PA(100 μg·L-1)处理组中肝脏葡萄糖(glucose)含量降低了46.5%,丙酮酸(pyruvate)含量降低了37.1%,无氧代谢产物乳酸(lactic acid)含量升高了57.4%,有氧代谢的产物即三羧酸中间产物延胡索酸(fumaric acid)、琥珀酸(succinic acid)和异柠檬酸(isocitrate)的含量分别降低了43.0%、54.3%和40.3%。以上代谢物含量的变化表明单一PA暴露抑制了葡萄糖的有氧代谢产生ATP的过程,刺激其通过厌氧分解产生乳酸并合成ATP。研究证实,大颗粒(>10 μm)MPs暴露鱼体时可蓄积在鱼体鳃和肠道器官,造成鳃部和肠道的“淤堵”现象[44],这种MPs的局部堆集会抑制鱼体氧气的吸收与运输,这可能是本研究PA MPs诱发葡萄糖代谢从有氧代谢转化为无氧代谢产生能量的原因之一。此外,研究表明干扰机体糖类代谢和能量合成过程是MPs诱发生物毒性的机制之一[45-47]。例如,PS MPs通过抑制糖酵解关键基因(丙酮酸激酶和己糖激酶)的表达,降低斑马鱼幼鱼葡萄糖有氧代谢过程造成能量耗竭[47],PA是否通过抑制关键代谢酶活性干扰肝脏ATP合成的内在机理仍需进一步探讨。单独TDCIPP(10 μg·L-1)暴露时,斑马鱼肝脏内葡萄糖含量降低了55.6%,乳酸含量和丙酮酸含量没有明显变化,三羧酸中间产物琥珀酸、异柠檬酸和酮戊二酸(2-oxoglutarate)的含量分别降低45.0%、50.1%和41.0%,糖代谢的中间产物包括甘露糖(mannose)、果糖(fructose)、半乳糖醇(galactitol)、葡萄糖酸(gluconic acid)、半乳糖苷(glucopyranose)和吡喃甘露糖(mannopyranose)等含量下调33.6%~60.0%,表明TDCIPP胁迫下斑马鱼肝脏的糖类有氧代谢受到阻碍。我们前期利用蛋白组学技术分析发现,TDCIPP暴露主要抑制葡萄糖有氧代谢合成ATP过程中所需关键酶的蛋白表达水平,包括葡萄糖-6-磷酸异构酶、葡萄糖激酶和葡萄糖磷酸变位酶等,从而抑制斑马鱼幼鱼ATP合成过程[16]。KEGG通路富集分析结果进一步证实PA和TDCIPP均显著抑制斑马鱼肝脏ATP合成过程(图5(b)和5(c)),PA和TDCIPP联合暴露后,糖酵解、TCA循环和丙酮酸代谢的抑制程度明显加重。相对空白组,100 μg·L-1 PA和10 μg·L-1 TDCIPP复合处理组中肝脏丙酮酸含量下调近90%,延胡索酸、琥珀酸、异柠檬酸和酮戊二酸含量下降77.7%~94.8%,糖类中间产物含量下降66.5%~96.2%。肝脏ATP含量检测结果(图7(a))显示,与空白组相比,PA单一处理组ATP含量略有下降,但无显著性差异,10 μg·L-1 TDCIPP处理组肝脏ATP含量明显降低(18.0%),二者复合处理组中ATP含量最低(下降14.1%~30.2%),证明PA共存显著增强TDCIPP对斑马鱼肝脏能量合成的抑制效应。综合上述分析结果,我们推测原因如下:(1)PA吸附TDCIPP作为载体增强其在斑马鱼肝脏内的生物富集含量(图2(d));(2)PA MPs和TDCIPP单独暴露均对斑马鱼肝脏糖类有氧代谢过程产生抑制,联合暴露组出现同一生物学过程功能干扰的协同效应。

图6 斑马鱼肝脏代谢途径示意图
注:图示示踪中心代谢途径(糖酵解/糖异生、TCA循环、不饱和脂肪酸的生物合成)和其他代谢途径(谷胱甘肽代谢和精氨酸生物合成),紫色文本是本研究中检测到的代谢物,黑色、红色和绿色向上和向下的箭头分别标记PA、TDCIPP及PA+TDCIPP联合处理组中上调和下调的代谢物。
Fig. 6 Schematic diagram of proposed metabolic pathways of zebrafish liver
Note: Central metabolic pathways (glycolysis/glucongenesis, TCA cycle, biosynthesis of unsaturated fatty acids) and other metabolic pathways (glutathione metabolism and arginine biosynthesis) are shown, purple texts indicated the metabolites detected in this study. The black, red, and green upward and downward arrows represent metabolites that up- and down-regulated in PA, TDCIPP, and PA+TDCIPP combined treatment groups, respectively.
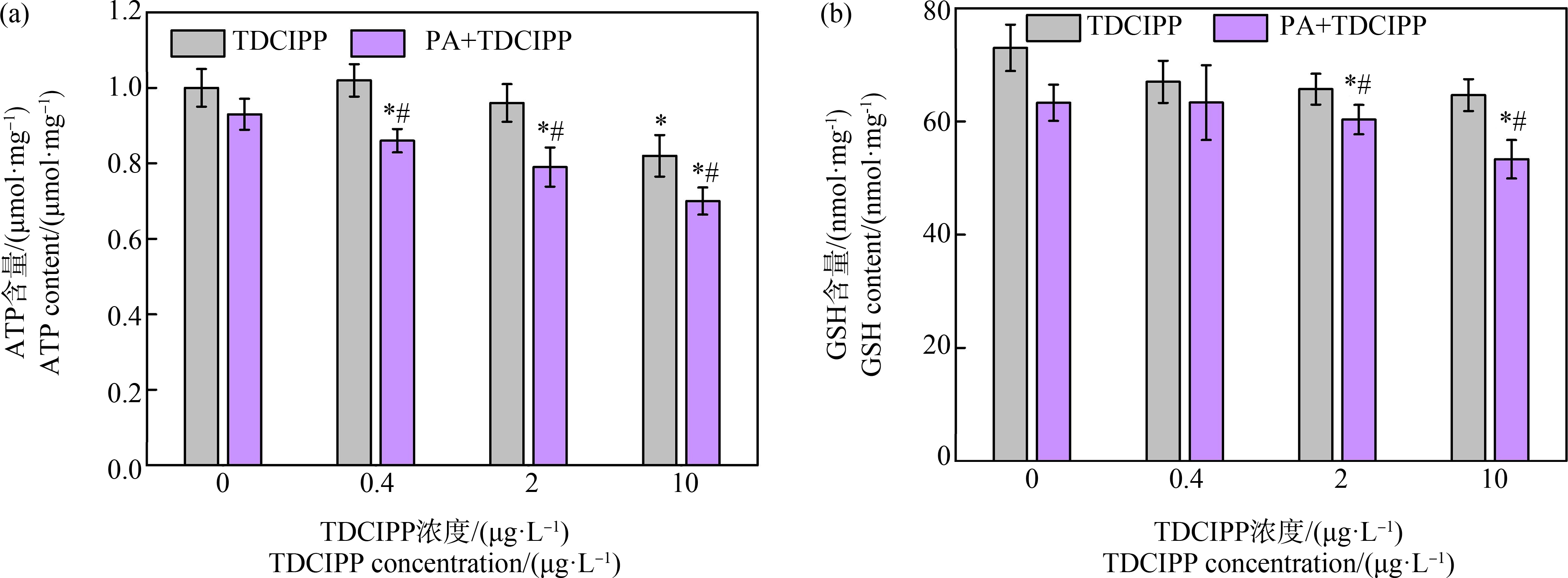
图7 不同处理组斑马鱼肝脏ATP和GSH含量
注:*和#分别表示相对于空白组和单独TDCIPP处理组具有显著性差异(P<0.05)。
Fig. 7 ATP and GSH content in zebrafish liver from different groups
Note: *and # represent significant differences compared with control and TDCIPP single group (P<0.05).
膳食代谢导致脂肪酸的产生,而脂肪酸是生物脂质的主要来源,在构建细胞膜和能量储存方面发挥着重要作用,其中不饱和脂肪酸通过β-氧化过程转化为乙酰辅酶A,进入TCA循环,合成鱼体生长所需的能量[48]。本实验中PA、TDCIPP和二者复合处理组中斑马鱼肝脏分别有7种、4种和10种不饱和脂肪酸的含量显著升高,不饱和脂肪合成代谢通路在PA和TDCIPP复合处理组中明显上调,表明鱼体可能通过激活脂肪酸的β-氧化过程补充糖类代谢抑制造成的能量耗竭。此外,亚麻酸(linolenic acid)、二十二碳六烯酸(docosahexaenoic acid, DHA)和二十碳五烯酸(eicosapentaenoic acid, EPA)等ω-3多不饱和脂肪酸,亚油酸(linoleic acid, LA)和花生四烯酸(arachidonic acid, AA)等ω-6不饱和脂肪酸是鱼体内的主要抗炎物质,可直接与脂肪组织免疫细胞相互作用抑制炎症反应的发生[49-50]。相对于空白组,PA胁迫导致斑马鱼肝脏内EPA、DHA、LA和AA含量升高60.0%~90.0%,TDCIPP处理使LA和AA含量分别提高61.7%和105.5%,二者联合暴露条件下,肝脏上述5种多不饱和脂肪酸含量显著提升1.72倍~5.76倍,且变化趋势与炎症因子升高趋势保持一致,表明鱼类通过提高不饱和脂肪酸的合成抵抗PA及TDCIPP联合暴露诱导的炎症反应。生物体的免疫系统和代谢系统共同进化,相互传递信号,形成一个复杂的相互作用网络维持生物体内稳态的动态平衡,其决定宿主对变化条件做出反应的灵活性及对外界压力的适应性[49]。不饱和脂肪酸在斑马鱼体内发挥重要的抗炎效应,例如,ω-3不饱和脂肪酸与M1巨噬细胞中G蛋白偶联受体120结合,激活β-arrestin 2信号通路,抑制细胞因子和TLR介导的炎症通路发挥抗炎作用[50];喂食ω-6不饱和脂肪酸如LA和AA可以通过调控TLR4/NF-κB信号通路途径增强抗炎细胞因子基因表达,抑制促炎细胞因子基因表达来提高鱼类免疫能力[51]。前期研究发现,PS MPs暴露可显著降低剑尾鱼体内LA和AA的含量,损伤斑马鱼的免疫功能[52]。本研究中,PA和TDCIPP复合暴露组不饱和脂肪酸含量、不饱和脂肪合成代谢通路及促炎因子TNF-α和IL-6水平相对于单一处理组均显著上调,表明斑马鱼可能通过加速其不饱和脂肪酸合成过程,提高机体内不饱和脂肪酸的含量,激活免疫相关通路应对复合暴露的炎症损伤效应。
肝脏主要依靠细胞内GSH与外来物质的Ⅰ相代谢产物或其本身发生结合反应生成易溶于水的物质,对异物进行解毒。与空白相比,PA和TDCIPP联合处理组中斑马鱼肝脏内羟基脯氨酸(5-oxoproline)、谷氨酸(glutamate)、L-半胱氨酸(L-cysteine)、甘氨酸(glycine)和腐胺(putrescine)的含量均显著下调,GSH代谢通路被抑制,而单独的PA或者TDCIPP处理组相关代谢物和代谢通路没有发生显著变化,意味着PA和TDCIPP对斑马鱼肝脏解毒功能的协同损伤效应。肝脏GSH含量测定结果表明,单一TDCIPP和PA暴露时斑马鱼肝脏内GSH含量与空白组水平接近,二者复合处理时肝脏GSH含量显著降低,特别是TDCIPP浓度为2 μg·L-1和10 μg·L-1时,相比于空白组分别下降17.8%和27.4%(P<0.05,图7(b))。精氨酸(arginine)主要参与生物尿素循环,排泄体内过量的氨,清除体内毒素。另外,鱼类相关研究表明,鱼体内精氨酸参与其营养代谢,刺激胰岛素释放,参与非特异性免疫反应和抗氧化反应,并提高疾病抵抗力[53];精氨酸主要代谢产物鸟氨酸(L-ornithine)是GSH合成的重要前提物。单一PA和TDCIPP处理组中斑马鱼肝脏精氨酸、鸟氨酸和尿素含量及精氨酸代谢通路均无显著变化,然而PA和TDCIPP复合暴露组中上述代谢物含量明显降低,精氨酸代谢通路亦被抑制,进一步证实复合污染胁迫下斑马鱼肝脏解毒和排毒功能受损。
综上所述,环境浓度PA MPs(100 μg·L-1)单一暴露对斑马鱼体长、体质量和肝脏生长无明显不良影响,但是显著增强环境浓度TDCIPP(0.4、2或10 μg·L-1)对斑马鱼生长的抑制效应,二者复合暴露时诱发斑马鱼出现明显的肝脏萎缩;另外,环境浓度PA MPs的共存可促进TDCIPP在斑马鱼肝脏内的富集,加剧TDCIPP诱发的斑马鱼肝脏氧化损伤、炎症反应和病理学损伤;代谢组学分析发现,相比于单一PA和TDCIPP暴露,二者联合暴露导致斑马鱼肝脏糖类有氧代谢和ATP合成的抑制程度明显加剧,肝脏解毒和排毒相关的GSH合成和精氨酸代谢过程也被抑制,同时,不饱和脂肪酸生物合成过程被激活形成大量的长链多不饱和脂肪酸,应对复合污染胁迫诱导的肝脏炎症反应和能量耗竭。本文从内源代谢物角度阐述低浓度PA微塑料与TDCIPP对斑马鱼肝脏的协同毒性分子机制,为环境相关浓度下微塑料对有机污染物慢性毒性的影响研究提供理论数据和技术支撑。
[1] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838
[2] 骆永明, 施华宏, 涂晨, 等. 环境中微塑料研究进展与展望[J]. 科学通报, 2021, 66(13): 1547-1562
Luo Y M, Shi H H, Tu C, et al. Research progresses and prospects of microplastics in the environment [J]. Chinese Science Bulletin, 2021, 66(13): 1547-1562 (in Chinese)
[3] Zhang Z Q, Gao S H, Luo G Y, et al. The contamination of microplastics in China’s aquatic environment: Occurrence, detection and implications for ecological risk [J]. Environmental Pollution, 2022, 296: 118737
[4] Castro-Castellon A T, Horton A A, Hughes J M R, et al. Ecotoxicity of microplastics to freshwater biota: Considering exposure and hazard across trophic levels [J]. The Science of the Total Environment, 2022, 816: 151638
[5] Xiang Y J, Jiang L, Zhou Y Y, et al. Microplastics and environmental pollutants: Key interaction and toxicology in aquatic and soil environments [J]. Journal of Hazardous Materials, 2022, 422: 126843
[6] Xia B, Zhang J, Zhao X G, et al. Polystyrene microplastics increase uptake, elimination and cytotoxicity of decabromodiphenyl ether (BDE-209) in the marine scallop Chlamys farreri [J]. Environmental Pollution, 2020, 258: 113657
[7] Zhao H J, Xu J K, Yan Z H, et al. Microplastics enhance the developmental toxicity of synthetic phenolic antioxidants by disturbing the thyroid function and metabolism in developing zebrafish [J]. Environment International, 2020, 140: 105750
[8] Trevisan R, Voy C, Chen S X, et al. Nanoplastics decrease the toxicity of a complex PAH mixture but impair mitochondrial energy production in developing zebrafish [J]. Environmental Science &Technology, 2019, 53(14): 8405-8415
[9] Grigorakis S, Drouillard K G. Effect of microplastic amendment to food on diet assimilation efficiencies of PCBs by fish [J]. Environmental Science &Technology, 2018, 52(18): 10796-10802
[10] Rehse S, Kloas W, Zarfl C. Microplastics reduce short-term effects of environmental contaminants. part Ⅰ: Effects of bisphenol A on freshwater zooplankton are lower in presence of polyamide particles [J]. International Journal of Environmental Research and Public Health, 2018, 15(2): 280
[11] Ma Y L, Stubbings W A, Abdallah M A, et al. Formal waste treatment facilities as a source of halogenated flame retardants and organophosphate esters to the environment: A critical review with particular focus on outdoor air and soil [J]. The Science of the Total Environment, 2022, 807(Pt 1): 150747
[12] Lee S, Cho H J, Choi W, et al. Organophosphate flame retardants (OPFRs) in water and sediment: Occurrence, distribution, and hotspots of contamination of Lake Shihwa, Korea [J]. Marine Pollution Bulletin, 2018, 130: 105-112
[13] Li Y, Huang K, Jiang J Q, et al. Tris(1,3-dichloro-2-propyl)phosphate induces mass mortality of crucian carp (Carassius carassius) embryos in Taihu Lake [J]. Environmental Science &Technology, 2021, 55(23): 15980-15988
[14] Yan Z F, Jin X W, Liu D Q, et al. The potential connections of adverse outcome pathways with the hazard identifications of typical organophosphate esters based on toxicity mechanisms [J]. Chemosphere, 2021, 266: 128989
[15] Du J, Li H X, Xu S D, et al. A review of organophosphorus flame retardants (OPFRs): Occurrence, bioaccumulation, toxicity, and organism exposure [J]. Environmental Science and Pollution Research International, 2019, 26(22): 22126-22136
[16] Zou W, Zhang X L, Ouyang S H, et al. Graphene oxide nanosheets mitigate the developmental toxicity of TDCIPP in zebrafish via activating the mitochondrial respiratory chain and energy metabolism [J]. The Science of the Total Environment, 2020, 727: 138486
[17] Ren X, Zhao X S, Duan X Y, et al. Enhanced bio-concentration of tris(1,3-dichloro-2-propyl) phosphate in the presence of nano-TiO2 can lead to adverse reproductive outcomes in zebrafish [J]. Environmental Pollution, 2018, 233: 612-622
[18] Farhat A, Buick J K, Williams A, et al. Tris(1,3-dichloro-2-propyl) phosphate perturbs the expression of genes involved in immune response and lipid and steroid metabolism in chicken embryos [J]. Toxicology and Applied Pharmacology, 2014, 275(2): 104-112
[19] 李学彦, 王思敏, 周启星, 等. 三(1,3-二氯-2-丙基)磷酸酯诱发肝脏损害及病理改变研究[J]. 生态毒理学报, 2018, 13(6): 234-241
Li X Y, Wang S M, Zhou Q X, et al. Tris (1,3-dichloro-2-propyl) phosphate induced hepatic damages and pathological changes [J]. Asian Journal of Ecotoxicology, 2018, 13(6): 234-241 (in Chinese)
[20] Liu C S, Su G Y, Giesy J P, et al. Acute exposure to tris(1,3-dichloro-2-propyl) phosphate (TDCIPP) causes hepatic inflammation and leads to hepatotoxicity in zebrafish [J]. Scientific Reports, 2016, 6: 19045
[21] Zhang X L, Xia M L, Zhao J Y, et al. Photoaging enhanced the adverse effects of polyamide microplastics on the growth, intestinal health, and lipid absorption in developing zebrafish [J]. Environment International, 2022, 158: 106922
[22] Yan M T, Nie H Y, Xu K H, et al. Microplastic abundance, distribution and composition in the Pearl River along Guangzhou City and Pearl River Estuary, China [J]. Chemosphere, 2019, 217: 879-886
[23] Klangnurak W, Chunniyom S. Screening for microplastics in marine fish of Thailand: The accumulation of microplastics in the gastrointestinal tract of different foraging preferences [J]. Environmental Science and Pollution Research International, 2020, 27(21): 27161-27168
[24] Schwabl P, Köppel S, Königshofer P, et al. Detection of various microplastics in human stool: A prospective case series [J]. Annals of Internal Medicine, 2019, 171(7): 453-457
[25] Yang W F, Gao X X, Wu Y X, et al. The combined toxicity influence of microplastics and nonylphenol on microalgae Chlorella pyrenoidosa [J]. Ecotoxicology and Environmental Safety, 2020, 195: 110484
[26] Bartonitz A, Anyanwu I N, Geist J, et al. Modulation of PAH toxicity on the freshwater organism G. roeseli by microparticles [J]. Environmental Pollution, 2020, 260: 113999
[27] Zhang X L, Zhao J Y, Gan T T, et al. Aging relieves the promotion effects of polyamide microplastics on parental transfer and developmental toxicity of TDCIPP to zebrafish offspring [J]. Journal of Hazardous Materials, 2022, 437: 129409
[28] Zhang X L, Zhou Q X, Zou W, et al. Molecular mechanisms of developmental toxicity induced by graphene oxide at predicted environmental concentrations [J]. Environmental Science &Technology, 2017, 51(14): 7861-7871
[29] Wong J K H, Lee K K, Tang K H D, et al. Microplastics in the freshwater and terrestrial environments: Prevalence, fates, impacts and sustainable solutions [J]. Science of the Total Environment, 2020, 719: 137512
[30] Leusch F D L, Ziajahromi S. Converting mg/L to particles/L: Reconciling the occurrence and toxicity literature on microplastics [J]. Environmental Science &Technology, 2021, 55(17): 11470-11472
[31] Reisser J, Slat B, Noble K, et al. The vertical distribution of buoyant plastics at sea: An observational study in the North Atlantic Gyre [J]. Biogeosciences, 2015, 12(4): 1249-1256
[32] Kang J H, Kwon O Y, Shim W J. Potential threat of microplastics to zooplanktivores in the surface waters of the southern sea of Korea [J]. Archives of Environmental Contamination and Toxicology, 2015, 69(3): 340-351
[33] Goldstein M C, Rosenberg M, Cheng L N. Increased oceanic microplastic debris enhances oviposition in an endemic pelagic insect [J]. Biology Letters, 2012, 8(5): 817-820
[34] Zhang C, Jeong C B, Lee J S, et al. Transgenerational proteome plasticity in resilience of a marine copepod in response to environmentally relevant concentrations of microplastics [J]. Environmental Science &Technology, 2019, 53(14): 8426-8436
[35] Hu M Y, Li J, Zhang B B, et al. Regional distribution of halogenated organophosphate flame retardants in seawater samples from three coastal cities in China [J]. Marine Pollution Bulletin, 2014, 86(1-2): 569-574
[36] Wei G L, Li D Q, Zhuo M N, et al. Organophosphorus flame retardants and plasticizers: Sources, occurrence, toxicity and human exposure [J]. Environmental Pollution, 2015, 196: 29-46
[37] 张杏丽, 邹威, 周启星. 基于代谢组学技术分析磷酸三苯酯诱导斑马鱼胚胎发育毒性的分子机制[J]. 生态毒理学报, 2019, 14(3): 79-89
Zhang X L, Zou W, Zhou Q X. Molecular mechanisms of developmental toxicity of triphenyl phosphate on zebrafish embryo revealed by metabolomics [J]. Asian Journal of Ecotoxicology, 2019, 14(3): 79-89 (in Chinese)
[38] Zhao X S, Liu Z B, Ren X, et al. Parental transfer of nanopolystyrene-enhanced tris(1,3-dichloro-2-propyl) phosphate induces transgenerational thyroid disruption in zebrafish [J]. Aquatic Toxicology, 2021, 236: 105871
[39] Umamaheswari S, Priyadarshinee S, Bhattacharjee M, et al. Exposure to polystyrene microplastics induced gene modulated biological responses in zebrafish (Danio rerio) [J]. Chemosphere, 2021, 281: 128592
[40] Qiang L Y, Cheng J P. Exposure to polystyrene microplastics impairs gonads of zebrafish (Danio rerio) [J]. Chemosphere, 2021, 263: 128161
[41] Lu Y F, Zhang Y, Deng Y F, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver [J]. Environmental Science &Technology, 2016, 50(7): 4054-4060
[42] Lu K, Qiao R X, An H, et al. Influence of microplastics on the accumulation and chronic toxic effects of cadmium in zebrafish (Danio rerio) [J]. Chemosphere, 2018, 202: 514-520
[43] Sheng C, Zhang S H, Zhang Y. The influence of different polymer types of microplastics on adsorption, accumulation, and toxicity of triclosan in zebrafish [J]. Journal of Hazardous Materials, 2021, 402: 123733
[44] Bhagat J, Zang L Q, Nishimura N, et al. Zebrafish: An emerging model to study microplastic and nanoplastic toxicity [J]. Science of the Total Environment, 2020, 728: 138707
[45] Zhu C X, Zhang T Q, Liu X W, et al. Changes in life-history traits, antioxidant defense, energy metabolism and molecular outcomes in the cladoceran Daphnia pulex after exposure to polystyrene microplastics [J]. Chemosphere, 2022, 308(Pt 1): 136066
[46] Missawi O, Venditti M, Cappello T, et al. Autophagic event and metabolomic disorders unveil cellular toxicity of environmental microplastics on marine polychaete Hediste diversicolor [J]. Environmental Pollution, 2022, 302: 119106
[47] Wan Z Q, Wang C Y, Zhou J J, et al. Effects of polystyrene microplastics on the composition of the microbiome and metabolism in larval zebrafish [J]. Chemosphere, 2019, 217: 646-658
[48] Xu T F, Lim Y T, Chen L Y, et al. A novel mechanism of monoethylhexyl phthalate in lipid accumulation via inhibiting fatty acid beta-oxidation on hepatic cells [J]. Environmental Science &Technology, 2020, 54(24): 15925-15934
[49] Zmora N, Bashiardes S, Levy M, et al. The role of the immune system in metabolic health and disease [J]. Cell Metabolism, 2017, 25(3): 506-521
[50] Oh D Y, Talukdar S, Bae E J, et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects [J]. Cell, 2010, 142(5): 687-698
[51] Kong L, Cheng S Y, Xiang X J, et al. Dietary conjugated linoleic acid modulates morphology, selective immune parameters, and gene expressions in the intestine of grass carp [J]. Fish &Shellfish Immunology, 2019, 86: 536-548
[52] Zhang Y K, Yang B K, Zhang C N, et al. Effects of polystyrene microplastics acute exposure in the liver of swordtail fish (Xiphophorus helleri) revealed by LC-MS metabolomics [J]. The Science of the Total Environment, 2022, 850: 157772
[53] Wang Q C, Xu Z, Ai Q H. Arginine metabolism and its functions in growth, nutrient utilization, and immunonutrition of fish [J]. Animal Nutrition, 2021, 7(3): 716-727