目前,我国的农药利用率低、用量大,造成了农药残留量大及环境污染等问题。纳米技术在农业的可持续发展中显示出巨大的应用潜力,其中纳米农药可增加农药活性成分的稳定性,延长有效持续时间,有效改善农药利用率,从而减少农药的环境负荷,其在农业生产中的使用已备受关注。但是随着纳米农药的广泛使用,将不可避免地导致了它们在环境中的残留,甚至进入人体产生危害,因此,阐明它们的生态风险及环境健康危害具有重要意义[1-2]。
纳米农药主要分为两大类:纳米材料作为载体包裹有机小分子农药活性成分;无机纳米农药。纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)是无机纳米农药的2种典型成分[1, 3]。由于CuO NPs和Cu2O NPs具有很好的抗菌活性,对多种菌类有效,被列为推荐药剂在农业领域得到广泛应用[4-6],并且一些研究表明,Cu2O NPs的抗菌活性较CuO NPs更强[7-8]。
纳米颗粒(nano-particles, NPs)进入人体最常见的途径是通过呼吸系统吸入,深入肺部,引起肺部氧化应激和炎症反应[9-10]。同时,NPs也可以通过肺泡或其他方式(如饮水、皮肤接触等)进入血液并影响其他器官[11]。与其他NPs类似,除了通过呼吸、饮水及皮肤暴露等方式以外,由于CuO NPs和Cu2O NPs在农业系统的广泛使用,通过农产品的摄入也是它们进入人体的重要途径。NPs对生物体的毒性机制主要是诱导氧化应激、炎症反应及DNA损伤等[9, 12-13]。目前已有较多研究显示了CuO NPs具有较强的细胞毒性作用。例如孙婷婷和蒋澄宇[14]通过比较CuO、Fe2O3、TiO2、SiO2等金属NPs对小鼠的肺部毒性作用,发现CuO NPs具有较强的毒性,可导致小鼠急性肺损伤,而其他几种金属NPs的作用较小;Fahmy和Cormier[15]对SiO2 NPs、Fe2O3 NPs和CuO NPs进行比较研究,发现CuO NPs导致气管上皮Hep-2细胞活力出现显著的剂量依赖性下降,而其他NPs基本无细胞毒性作用,并且CuO NPs的细胞毒性作用与氧化损伤直接相关;Fu[16]的研究证明CuO NPs可以抑制HepG2细胞增殖,对细胞产生氧化损伤作用,其机制与ROS诱导线粒体介导的细胞凋亡途径有关。此外,也有研究表明CuO NPs对植物[17-18]、水生动物[19]及微生物[20-21]的毒性作用,并且与氧化应激有关。
目前已有较多研究表明了CuO NPs的毒性作用,但对Cu2O NPs的研究非常缺乏。虽然有研究表明Cu2O NPs具有更强的抗菌活性,但其是否具有更强的非靶标毒性作用进而产生更严重的健康危害,需要进一步的毒理学评估。因此,本研究以A549人源肺细胞作为模型,对比研究了CuO NPs和Cu2O NPs的细胞毒性差异,并探讨了影响其毒性差异的潜在因素,有望为其环境健康风险评估及安全使用提供理论参考。
1 材料与方法(Materials and methods)
1.1 实验材料与试剂
人肺腺癌细胞A549、细胞培养基DMEM、PBS缓冲溶液购于武汉普诺赛生命科技有限公司;活性氧检测探针(DCFH-DA)、线粒体膜电位检测探针(Mito-Tracker Red CMXRos)购自碧云天生物技术有限公司;二甲基亚砜(DMSO,纯度为99%)和噻唑蓝(MTT,纯度>99%)购自上海麦克林生化科技有限公司;纳米氧化铜(CuO NPs,纯度>99.9%)和纳米氧化亚铜(Cu2O NPs,纯度>99.9%)购自北京中科科优科技有限公司,CuO NPs和Cu2O NPs暴露前采用细胞培养基配制,现配现用。
1.2 仪器设备
BB150-2TCS-L CO2培养箱(赛默飞世尔科技有限公司,美国);TECAN Spark 20M酶标仪(帝肯集团有限公司,瑞士);FA004分析天平(上海舜宇恒平仪器有限公司,中国);ZEISS Sigma 300型扫射电子显微镜(scanning electron microscope, SEM;蔡司,德国);FEI Tecnai F20透射电子显微镜(transmission electron microscope, TEM;FEI,美国);Malvern Zetasizer Nano ZS 90型动态光散射仪(dynamic light scattering, DLS;马尔文,英国);AA-6880原子吸收仪(岛津,日本)。
1.3 材料的表征
将CuO NPs和Cu2O NPs分散在去离子水中,超声后得到悬浮液。采用德国ZEISS Sigma 300 SEM和美国FEI Tecnai F20 TEM拍摄NPs形貌。用纳米粒度Zeta电位仪测定Zeta电位,同时以动态光散射法测定水合粒径。
1.4 细胞毒性检测
A549细胞采用加入了100 μg·mL-1链霉素、100 U·mL-1青霉素和10%(V∶V)胎牛血清的完全培养基(普诺塞,武汉)在恒温恒湿培养箱(37 ℃和5%(V∶V)CO2)中进行培养。在96孔板中每孔接种A549细胞(5×104 个),贴壁培养24 h。暴露不同浓度(0.1~100 mg·L-1)的CuO NPs和Cu2O NPs,继续培养24 h。吸出染毒液,用PBS对细胞进行清洗2次。加入MTT溶液孵育3 h,吸去探针,加入100 μL DMSO,以溶解MTT的深紫色产物(甲瓒)。轻轻摇晃,用酶标仪,以690 nm为参考波长,在490 nm的吸收度测定细胞活性。
1.5 活性氧检测
将A549细胞悬浮液(5×104 个,100 μL)接种在96孔板中孵育24 h。吸出培养基,加入10 μmol·L-1的DCFH-DA探针(100 μL)孵化20 min后吸出,用100 μL PBS轻轻洗涤2次。将细胞暴露于不同浓度(1~100 mg·L-1)的CuO NPs和Cu2O NPs。采用酶标仪检测荧光强度(激发波长485 nm,发射波长535 nm)。
1.6 线粒体膜电位检测
将A549细胞(5×104 个,100 μL)接种在96孔板中孵育24 h。吸出培养基,将细胞分别暴露于不同浓度(1~100 mg·L-1)的CuO NPs和Cu2O NPs 12 h。然后将含污染物的溶液吸出,分别加入100 nmol·L-1的线粒体膜电位探针,孵化20 min,再将探针去除后,用PBS将细胞洗3次,最后加入100 μL的PBS溶液用酶标仪检测荧光强度,设置激发波长为565 nm,发射波长610 nm。
1.7 培养基中铜离子浓度检测
将配好的20、40、50、100 mg·L-1的CuO NPs和Cu2O NPs悬浊液加入到12孔板中,与细胞在相同条件下处理24 h后,离心30 min(12 000 r·min-1),取上清液。用火焰原子吸收光谱仪检测上清液中铜离子含量。
1.8 统计学方法
采用GraphPad Prism 8和Excel进行实验数据处理和分析。所有的实验都进行3次重复,每个实验组都设置至少3个平行,用平均值±标准差来表示试验的结果。*P<0.05表示处理组与对照组具有显著性差异。
2 结果(Results)
2.1 NPs的表征
SEM和TEM图像显示CuO NPs和Cu2O NPs呈不规则形状的颗粒(图1(a)~(d)),CuO NPs呈棒状,而Cu2O NPs呈球状。Zeta电位测定结果表明,CuO NPs的Zeta电位为(19.97±5.98) mV,Cu2O NPs的Zeta电位为(25.5±6.55) mV。DLS结果显示CuO NPs的水合粒径为403 nm,Cu2O NPs的水合粒径为432 nm(图1(e)和(f)),在水溶液中分散比较均匀,有部分团聚。
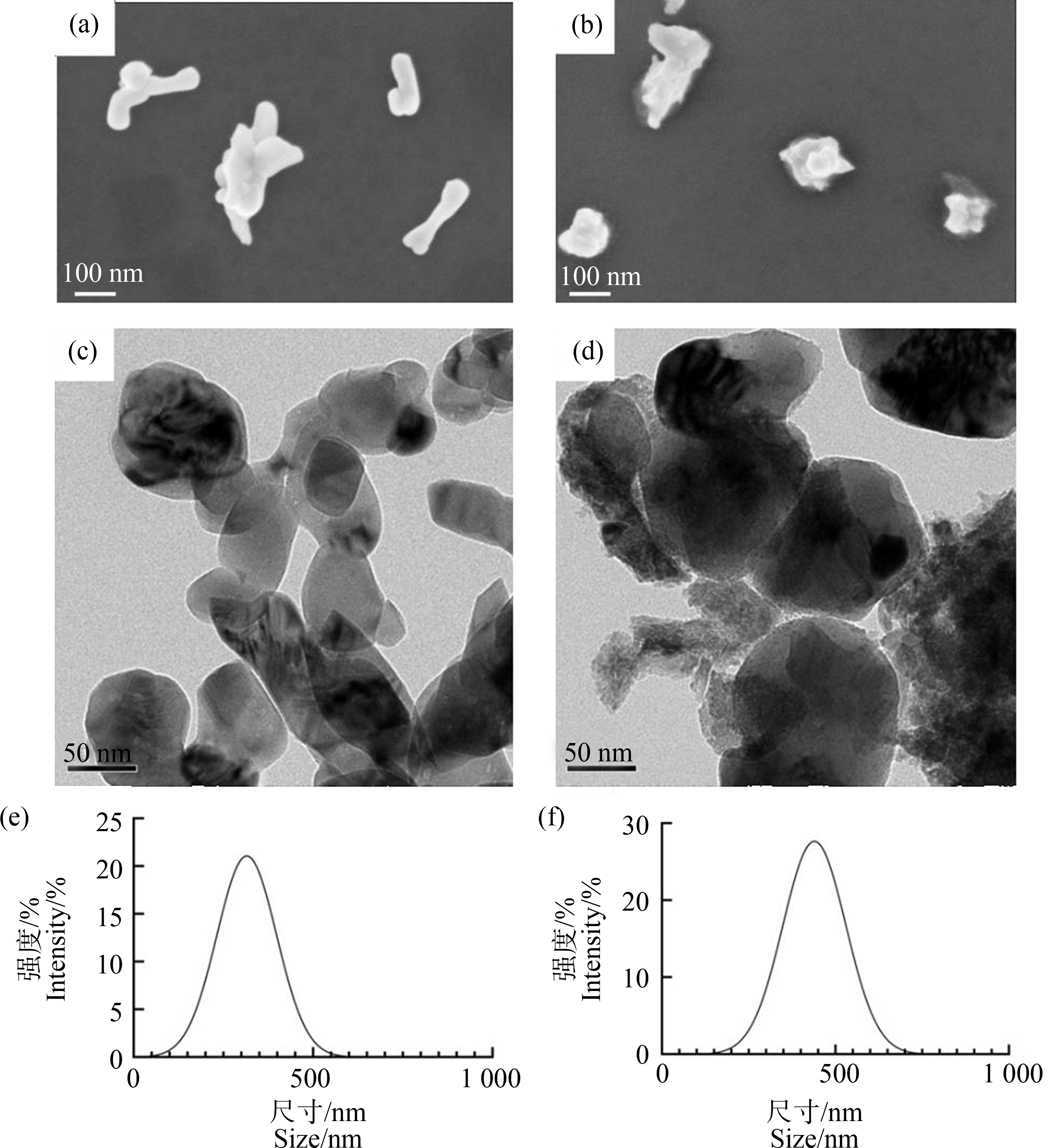
图1 纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)的形态及粒径表征
注:(a) CuO NPs的扫描电镜图;(b) Cu2O NPs的扫描电镜图;(c) CuO NPs的透射电镜图;(d) Cu2O NPs的透射电镜图;(e) 动态光散射测定CuO NPs的水合半径;(f) 动态光散射测定Cu2O NPs的水合半径。
Fig. 1 Morphology and particle size characterization of nano-copper oxide (CuO NPs) and nano-cuprous oxide (Cu2O NPs)
Note: (a) Scanning electron microscopy photograph of CuO NPs; (b) Scanning electron microscopy photograph of Cu2O NPs; (c) Transmission electron microscopy photograph of CuO NPs; (d) Transmission electron microscopy photograph of Cu2O NPs; (e) Hydrated radius of CuO NPs determined by dynamic light scattering; (f) Hydrated radius of Cu2O NPs determined by dynamic light scattering.
2.2 CuO NPs和Cu2O NPs对A549细胞活性的影响
如图2所示,无酚红DMEM配制的CuO NPs和Cu2O NPs呈均匀分散溶液,其中CuO NPs呈灰黑色,而Cu2O NPs呈浅黄色。如图3(a)所示,CuO NPs和Cu2O NPs均对A549细胞产生了明显的毒性,并且呈剂量依赖效应,观察到的最低效应浓度分别为20 mg·L-1和5 mg·L-1。并且不同浓度的细胞毒性对比也表明Cu2O NPs的A549细胞毒性效应明显强于CuO NPs。

图2 纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)的溶液
Fig. 2 Solution of nano-copper oxide (CuO NPs) and nano-cuprous oxide (Cu2O NPs)
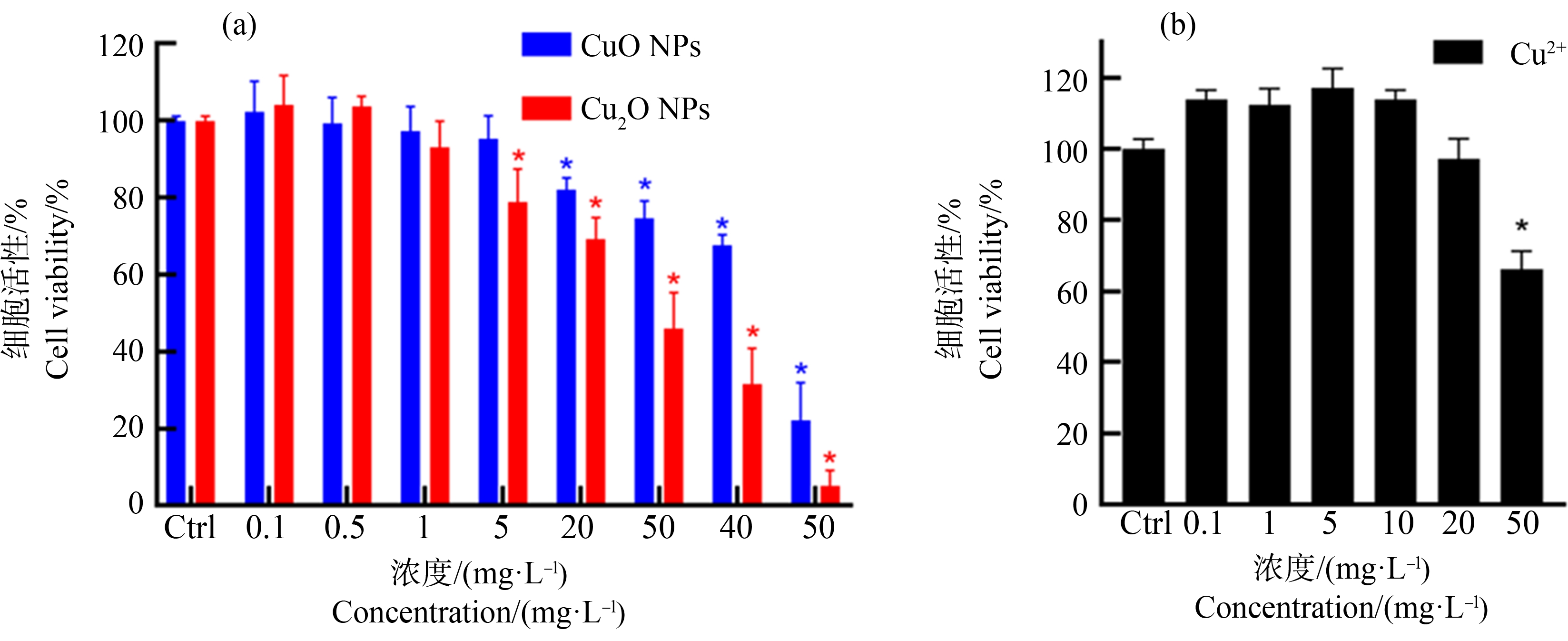
图3 纳米颗粒(NPs)(a)及铜离子(Cu2+)(b)对A549细胞的活性影响
注:Ctrl组表示等量稀释纳米材料的培养基处理,*表示与对照组相比差异显著(P<0.05)。
Fig. 3 Effects of nanoparticles (NPs) (a) and copper ion (Cu2+) (b) on A549 cell viability
Note: Ctrl group represents treatment with equal volume medium used to dilute nanomaterials; *represents significant difference compared with the control (P<0.05).
同时,考察了铜离子的细胞毒性以便作为对比。如图3(b)所示,A549细胞暴露在低浓度Cu2+溶液中时,活细胞数量与对照组相比有所增加,说明低浓度的Cu2+可以促进细胞增殖,这可能与Cu是人体生长的必需元素有关。当Cu2+浓度达到50 mg·L-1时表现出细胞毒性作用,但是与CuO NPs和Cu2O NPs相比,Cu2+细胞毒性相对较小。
2.3 CuO NPs和Cu2O NPs对A549细胞胞内活性氧生成的影响
前面我们发现了CuO NPs和Cu2O NPs的肺细胞毒性差异,为了进一步探讨细胞毒性差异的分子机理,对两者诱导活性氧生成进行了测定。NPs在细胞中与细胞器的相互作用促进活性氧的产生是其产生细胞毒性作用的典型分子机制之一。由图4可知,CuO NPs和Cu2O NPs暴露A549肺细胞3、6、12及24 h均可导致ROS过量生成,随着暴露时间增加明显出现了ROS的积累,并呈现剂量依赖关系。此外,Cu2O NPs诱导ROS生成效应明显强于CuO NPs。这一现象与它们的细胞毒性是一致的。因此,我们推断CuO NPs和Cu2O NPs的细胞毒性差异与两者诱导氧化应激效应有关。

图4 纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)对A549细胞活性氧(ROS)生成的影响(不同暴露时间)
注:(a) 3 h;(b) 6 h;(c) 12 h;(d) 24 h;Ctrl组表示等量稀释纳米材料的培养基处理。
Fig. 4 Effects of nano-copper oxide (CuO NPs) and nano-cuprous oxide (Cu2O NPs) on reactive oxygen species (ROS) generation in A549 cells (different exposure time)
Note: (a) 3 h; (b) 6 h; (c) 12 h; (d) 24 h; Ctrl group represents treatment with equal volume medium used to dilute nanomaterials.
2.4 CuO NPs和Cu2O NPs对线粒体膜电位的影响
NPs可以侵入细胞并粘附在线粒体膜上,从而破坏线粒体膜并导致其去极化。如图5所示,不同浓度CuO NPs、Cu2O NPs暴露A549细胞12 h后,均可在≥40 mg·L-1浓度下导致线粒体膜电位降低,导致线粒体去极化作用。同时,发现Cu2O NPs对肺细胞A549线粒体去极化作用明显大于CuO NPs,这与两者细胞毒性实验结果吻合。因此,CuO NPs、Cu2O NPs的不同细胞毒性可能与两者对线粒体损伤程度不同也有一定关系。
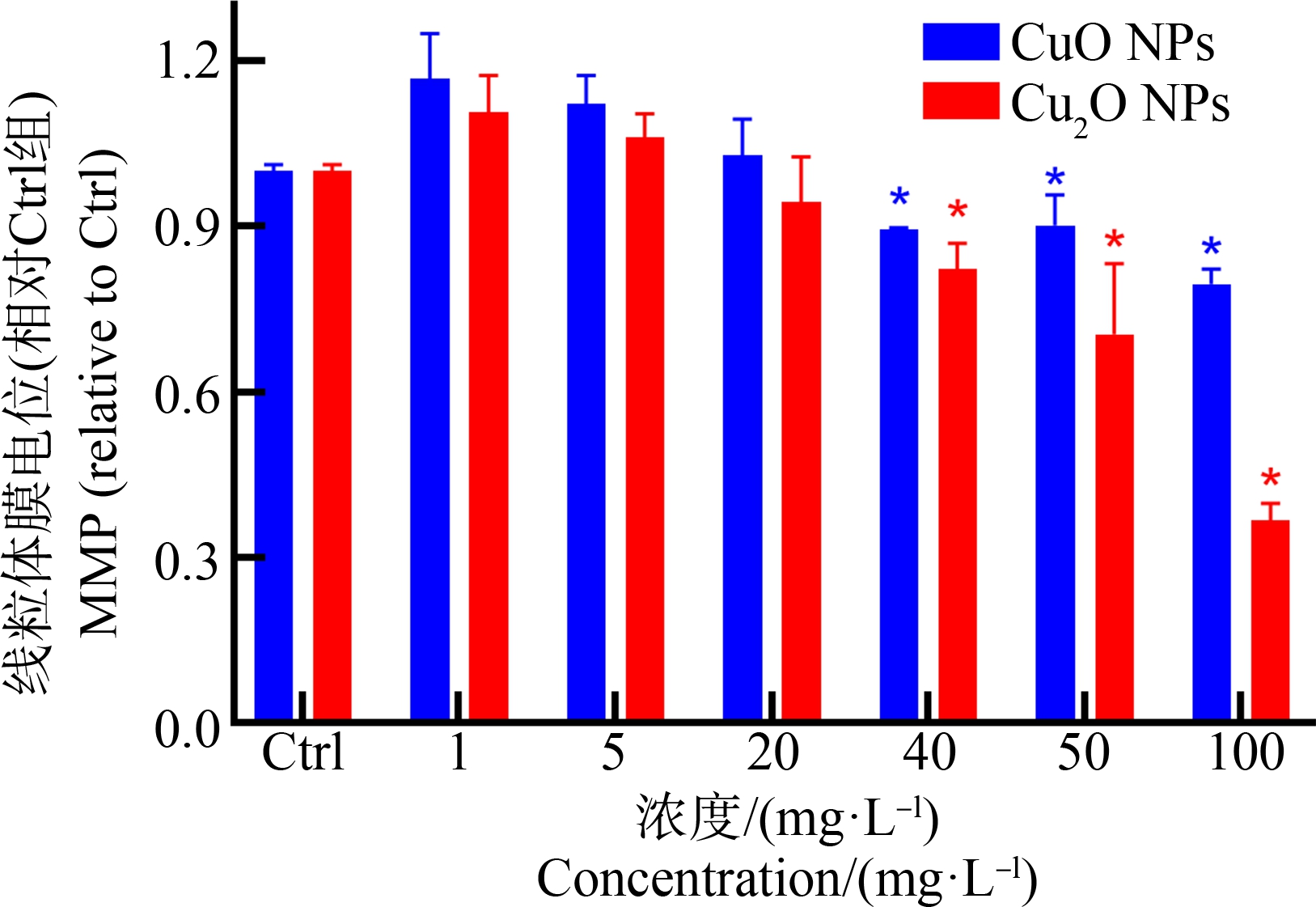
图5 纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)对A549细胞线粒体膜电位(MMP)的影响
注:Ctrl组表示等量稀释纳米材料的培养基处理,*表示与对照组相比差异显著(P<0.05)。
Fig. 5 Effects of nano-copper oxide (CuO NPs) and nano-cuprous oxide (Cu2O NPs) on mitochondrial membrane potential (MMP) of A549 cells
Note: Ctrl group represents treatment with equal volume medium used to dilute nanomaterials; *represents significant difference compared with the control (P<0.05).
2.5 培养基中CuO NPs和Cu2O NPs释放的铜离子浓度
金属离子的溶出是金属NPs产生细胞毒性的重要来源。CuO NPs和Cu2O NPs产生的细胞毒性差异也可能与它们溶出的铜离子浓度不同有关。因此,进一步对培养基中溶出的铜离子浓度进行了考察。但是由图6可知,CuO NPs和Cu2O NPs在培养基中释放的铜离子浓度没有明显差别,所释放的最大铜离子浓度均<16 mg·L-1,说明两者的毒性差异可能并不是由于其在培养基中所释放的铜离子总量不同所导致。
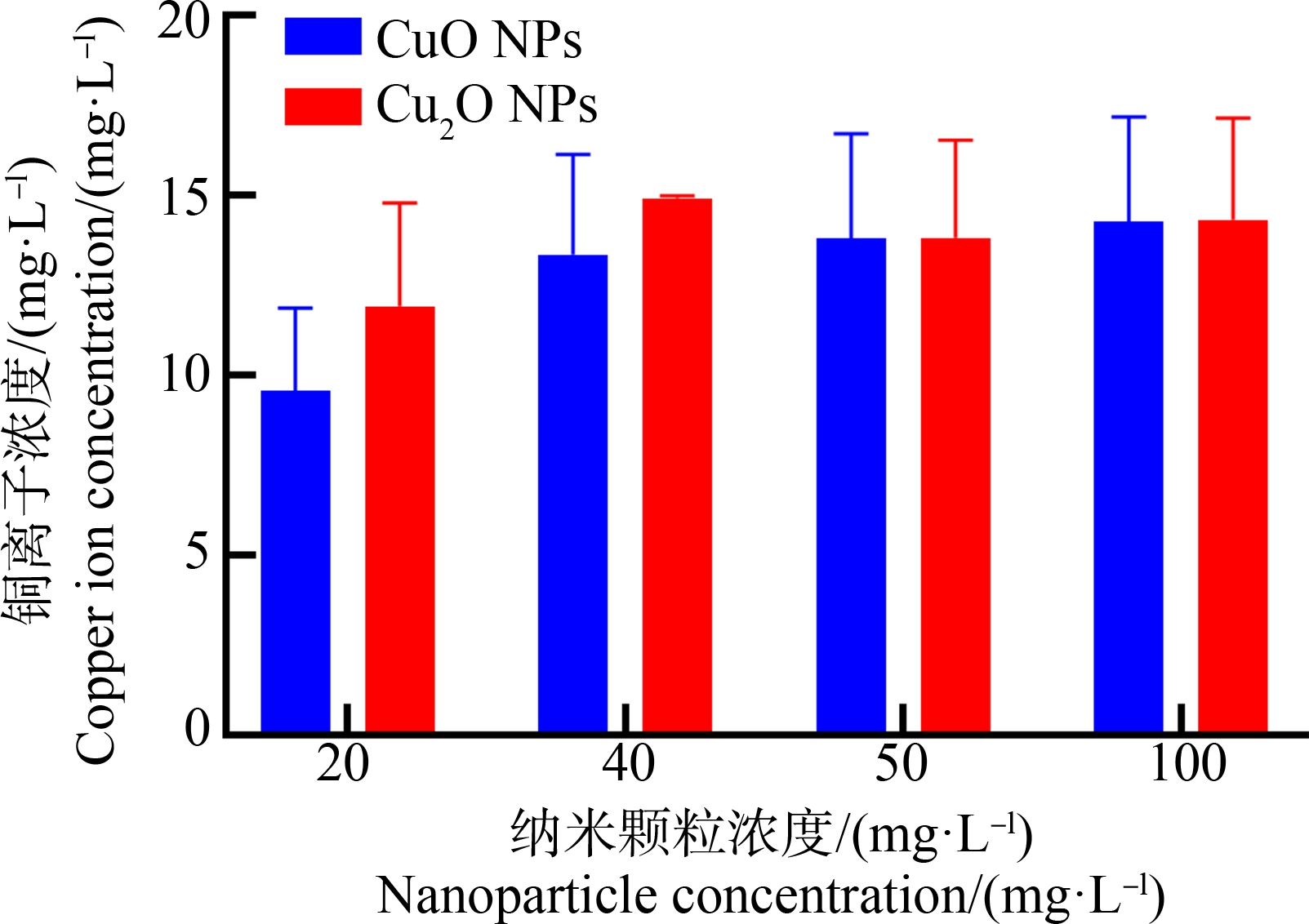
图6 纳米氧化铜(CuO NPs)和纳米氧化亚铜(Cu2O NPs)在细胞培养基中铜离子的释放
Fig. 6 Copper ions release from nano-copper oxide (CuO NPs) and nano-cuprous oxide (Cu2O NPs) in cell culture medium
3 讨论(Discussion)
随着农业纳米技术研发支出的迅速增加,中国有可能成为全球最大的纳米农药生产国和消费国。因此,纳米农药的调控和科学评价迫在眉睫。纳米材料通过呼吸进入肺部是其产生毒害作用的主要途径之一。本研究选用人源肺细胞A549作为细胞模型,以CuO NPs和Cu2O NPs为研究对象,首次对比研究两者的肺细胞毒性差异,并从氧化应激和线粒体损伤等角度探索两者导致细胞毒性差异的潜在分子机制,并对比了游离态铜离子的影响。
本研究发现纳米农药中2种主要成分CuO NPs和Cu2O NPs具有明显的肺细胞毒性作用。尤其是高浓度的CuO NPs和Cu2O NPs(≥50 mg·L-1)表现出极高的毒性,细胞存活率急剧下降。Cu2O NPs和CuO NPs短期染毒造成A549细胞毒性的临界浓度约为5 mg·L-1和20 mg·L-1。Cu2O NPs可在比CuO NPs浓度低得多的情况下对细胞产生毒性,说明Cu2O NPs比CuO NPs毒性更大。其中CuO NPs的研究结果与文献报道的细胞毒性效应结果基本一致[14-16]。同时,我们首次发现Cu2O NPs的细胞毒性作用较CuO NPs明显更强,其毒性效应值得更多关注。
氧化损伤是NPs产生细胞毒性的公认分子机制之一[9, 12-13]。因此,首先探讨了CuO NPs和Cu2O NPs的细胞毒性差异是否与氧化应激诱导能力不同有关。通过ROS检测,发现CuO NPs和Cu2O NPs均能诱导ROS的过量生成,并呈剂量依赖关系。但是Cu2O NPs的ROS诱导效应明显强于CuO NPs。由此,我们推断Cu2O NPs具有更强的细胞毒性作用很可能与其氧化损伤能力更强有关。ROS的大量积累使得细胞处于氧化应激状态,可导致DNA等生物大分子氧化损伤,进而导致细胞损伤和死亡。
线粒体是ROS生成的主要场所,而NPs导致线粒体等细胞器的损伤也是其产生细胞毒性效应的主要分子机制[22]。因此,进一步探讨了CuO NPs和Cu2O NPs对线粒体的损伤效应。CuO NPs和Cu2O NPs均能以剂量依赖的方式导致A549细胞线粒体膜电位的降低。CuO NPs和Cu2O NPs可通过诱导线粒体去极化作用,进而导致细胞凋亡,这也是两者产生细胞毒性的原因之一。同时,发现Cu2O NPs诱导A549细胞线粒体去极化的作用明显强于CuO NPs,这很可能也是Cu2O NPs具有更强细胞毒性作用的重要原因。
影响金属NPs毒性的主要因素有尺寸、形貌、组分、氧化态以及释放的重金属含量等[22-23]。从SEM可以看到Cu2O NPs更接近球形,而CuO NPs呈棒状,两者形貌差异可能进一步影响它们进入细胞的量。一般来说,NPs粒径越小,细胞毒性越大。从水合粒径来看,Cu2O NPs与CuO NPs没有很大差别,这可能不是导致毒性差异的主要原因。金属NPs毒性与游离态铜离子的关系并无确切结论,仍存在一定争议。本研究的结果显示Cu2O NPs与CuO NPs在细胞培养基中所释放的游离态铜离子浓度并无显著差别,并且均低于16 mg·L-1,在该浓度范围,铜离子并无显著细胞毒性。但是纳米颗粒进入细胞后颗粒表面的金属离子以及胞内溶解释放的铜离子的性质和毒性如何尚不清楚。此外,水和粒径检测表明我们所采用的纳米颗粒在水溶液中的水合半径达到400 nm,可能通过胞噬作用摄取进入细胞然后再次溶解产生毒性作用[24]。因此,后续工作需重点考察纳米颗粒进入细胞后的状态以及胞内游离态铜离子的浓度及价态,对于阐明两者毒性差异的影响因素非常关键。
综上所述,所研究的Cu2O NPs对A549细胞毒性作用远大于CuO NPs,并且与氧化应激和线粒体功能损伤有关,但是具体是何种因素导致两者毒性差异仍需进一步深入探究。
[1] Li L, Xu Z L, Kah M, et al. Nanopesticides: A comprehensive assessment of environmental risk is needed before widespread agricultural application [J]. Environmental Science &Technology, 2019, 53(14): 7923-7924
[2] Usman M, Farooq M, Wakeel A, et al. Nanotechnology in agriculture: Current status, challenges and future opportunities [J]. The Science of the Total Environment, 2020, 721: 137778
[3] Kumar S, Nehra M, Dilbaghi N, et al. Nano-based smart pesticide formulations: Emerging opportunities for agriculture [J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2019, 294: 131-153
[4] 谢婷, 谭辉. 无机铜氧化物在农药领域的应用专利技术综述[J]. 科技创新与应用, 2019(19): 23-24
[5] 陈朗, 姜辉, 周艳明, 等. 纳米农药的环境安全性浅析[J]. 农药科学与管理, 2018, 39(5): 30-38
Chen L, Jiang H, Zhou Y M, et al. A brief analysis on the environmental safety of nano-enabled pesticides [J]. Pesticide Science and Administration, 2018, 39(5): 30-38 (in Chinese)
[6] 范文宏, 刘通, 史志伟, 等. 立方体和八面体微/纳米氧化亚铜对大型水蚤(Daphnia magna)的氧化胁迫和生理损伤[J]. 生态毒理学报, 2016, 11(5): 40-48
Fan W H, Liu T, Shi Z W, et al. Oxidative stress and physiological damage of cubic and octahedral Cu2O micro/nanocrystals to Daphnia magna [J]. Asian Journal of Ecotoxicology, 2016, 11(5): 40-48 (in Chinese)
[7] Gurianov Y, Nakonechny F, Albo Y, et al. Antibacterial composites of cuprous oxide nanoparticles and polyethylene [J]. International Journal of Molecular Sciences, 2019, 20(2): 439
[8] Rodríguez-Llamazares S, Mondaca M A, Badilla C, et al. PVC/copper oxide composites and their effect on bacterial adherence [J]. Journal of the Chilean Chemical Society, 2012, 57(2): 1163-1165
[9] Oberdörster G, Oberdörster E, Oberdörster J. Nanotoxicology: An emerging discipline evolving from studies of ultrafine particles [J]. Environmental Health Perspectives, 2005, 113(7): 823-839
[10] Weichenthal S, Dufresne A, Infante-Rivard C. Indoor ultrafine particles and childhood asthma: Exploring a potential public health concern [J]. Indoor Air, 2007, 17(2): 81-91
[11] Jain A, Ranjan S, Dasgupta N, et al. Nanomaterials in food and agriculture: An overview on their safety concerns and regulatory issues [J]. Critical Reviews in Food Science and Nutrition, 2018, 58(2): 297-317
[12] Manke A, Wang L Y, Rojanasakul Y. Mechanisms of nanoparticle-induced oxidative stress and toxicity [J]. BioMed Research International, 2013, 2013: 942916
[13] Bhabra G, Sood A, Fisher B, et al. Nanoparticles can cause DNA damage across a cellular barrier [J]. Nature Nanotechnology, 2009, 4(12): 876-883
[14] 孙婷婷, 蒋澄宇. 纳米氧化铜导致小鼠急性肺损伤[J]. 基础医学与临床, 2012, 32(4): 386-389
Sun T T, Jiang C Y. Copper oxide nanoparticles induce acute pulmonary injury in mice [J]. Basic &Clinical Medicine, 2012, 32(4): 386-389 (in Chinese)
[15] Fahmy B, Cormier S A. Copper oxide nanoparticles induce oxidative stress and cytotoxicity in airway epithelial cells [J]. Toxicology in Vitro, 2009, 23(7): 1365-1371
[16] Fu X. Oxidative stress induced by CuO nanoparticles (CuO NPs) to human hepatocarcinoma (HepG2) cells [J]. Journal of Cancer Therapy, 2015, 6(10): 889-895
[17] Zhao L J, Ortiz C, Adeleye A S, et al. Metabolomics to detect response of lettuce (Lactuca sativa) to Cu(OH)2 nanopesticides: Oxidative stress response and detoxification mechanisms [J]. Environmental Science &Technology, 2016, 50(17): 9697-9707
[18] 王淑玲, 张玉喜, 刘汉柱, 等. 氧化铜纳米颗粒对水稻幼苗根系代谢毒性的研究[J]. 环境科学, 2014, 35(5): 1968-1973
Wang S L, Zhang Y X, Liu H Z, et al. Phytotoxicity of copper oxide nanoparticles to metabolic activity in the roots of rice [J]. Environmental Science, 2014, 35(5): 1968-1973 (in Chinese)
[19] Vignardi C P, Muller E B, Tran K, et al. Conventional and nano-copper pesticides are equally toxic to the estuarine amphipod Leptocheirus plumulosus [J]. Aquatic Toxicology, 2020, 224: 105481
[20] Zhang X X, Xu Z L, Qian X T, et al. Assessing the impacts of Cu(OH)2 nanopesticide and ionic copper on the soil enzyme activity and bacterial community [J]. Journal of Agricultural and Food Chemistry, 2020, 68(11): 3372-3381
[21] Carley L N, Panchagavi R, Song X, et al. Long-term effects of copper nanopesticides on soil and sediment community diversity in two outdoor mesocosm experiments [J]. Environmental Science &Technology, 2020, 54(14): 8878-8889
[22] Sengul A B, Asmatulu E. Toxicity of metal and metal oxide nanoparticles: A review [J]. Environmental Chemistry Letters, 2020, 18(5): 1659-1683
[23] García-Torra V, Cano A, Espina M, et al. State of the art on toxicological mechanisms of metal and metal oxide nanoparticles and strategies to reduce toxicological risks [J]. Toxics, 2021, 9(8): 195
[24] Manzanares D, Ce a V. Endocytosis: The nanoparticle and submicron nanocompounds gateway into the cell [J]. Pharmaceutics, 2020, 12(4): 371
a V. Endocytosis: The nanoparticle and submicron nanocompounds gateway into the cell [J]. Pharmaceutics, 2020, 12(4): 371