人类70%~90%的慢性疾病风险来自环境因素而非基因差异[1]。随着城市工业化进程加快,大气污染问题突出,细颗粒物(fine particulate matter,以PM2.5为代表)是危害人体健康的主要环境风险之一[2]。流行病学研究发现PM2.5与糖尿病的发生密切相关,PM2.5日平均浓度每增加10 μg·m-3,2型糖尿病发病率增加1%[3]。毒理学证据显示,吸入的PM2.5可深入肺泡进入血液循环,引起胰岛素靶组织的炎症反应、氧化应激和线粒体功能失调等[4],机体进而出现脂肪组织蓄积、产热减少、肝脏脂肪沉积,骨骼肌摄取葡萄糖障碍,引发糖代谢及脂代谢异常[5]。因此,血脂代谢异常可能在PM2.5诱发糖尿病中发挥重要作用。
除遗传和环境污染因素外,不良的饮食习惯亦会造成多种疾病的患病风险增加。动物实验结果表明,PM2.5和高脂饮食联合作用会导致氧化应激、胰岛素抵抗和内脏炎症/肥胖[6],相关的疾病发病率显著上升,如心血管疾病[7]、2型糖尿病[8]和中风[9]。长期摄入高碳水化合物同样会引起大鼠血脂异常和肥胖等问题[10]。近期有研究指出,饮食调节可能会改善空气污染导致的血压升高[11]和脑损伤[12],相关机制有待进一步研究。因此,有必要探究PM2.5与高脂和高碳水化合物2种饮食协同是否对机体产生类似的毒理效应。
肝脏作为人体最大的消化腺和代谢中心,直接影响代谢的过程和途径。肝脏中氧化应激与机体代谢环境密切相关,PM2.5暴露肝脏可能是最易受攻击的靶器官[13]。非靶标代谢组学能够识别宿主代谢产物的特征变化模式,发现深层的生物学信息[14]。为进一步揭示环境污染与相关疾病的内在关联,本研究结合不同饮食(正常、高脂、高碳水化合物),探讨PM2.5暴露对大鼠糖脂代谢及肝损伤的影响。
1 材料与方法(Materials and methods)
1.1 PM2.5组分表征
于2019年1月—12月,使用泵流速为6 L·min-1的PM2.5采样器(BGI, USA)收集大气中PM2.5于47 mm QMA石英滤膜(Whatman, UK)上。参照国家标准(HJ 799—2016、HJ 800—2016、HJ 830—2017),分别使用离子色谱法和波长色散荧光光谱检测了PM2.5中水溶性离子及无机元素的浓度。对PM2.5的形态结构进行表征[15],包括PM2.5的SEM图像、动力学直径和Zeta电位,详细PM2.5采样及制备方法见课题组的前期研究[16]。
1.2 PM2.5悬液制备
石河子市2019年PM2.5的年均浓度为0.064 mg·m-3,数据来自当地环境监测站。参考Curbani等[17]建立的大气颗粒物模型计算PM2.5暴露剂量。成年SD(Sprague-Dawley)大鼠的体质量为0.250 kg,呼吸容量(Vt)为2.100 mL,通气量(Vm)为252.0 mL·min-1,呼吸频率(f)为120 min-1,由于在实际暴露环境中,部分大气颗粒物会沉积于上呼吸道,因此定义PM2.5的实际吸入率为75%[17]。此外,考虑100倍不确定因子,最终动物染毒剂量为7 mg·kg-1[18]。由于操作过程中石英纤维滤膜所含物质可能混入PM2.5样品中,为排除滤膜中物质带来的干扰,对照组大鼠气管滴注滤膜过滤水溶液。
1.3 动物处理
实验方案及所有实验操作均通过石河子大学医学院第一附属医院实验动物伦理委员会审查(批件号A2019-107-01)。雄性SD大鼠(n=72,体质量为180~200 g,6~7周龄)购自新疆医科大学实验动物中心。实验动物随机分为6组每组12只:正常饮食+对照(ND-CON);正常饮食+PM2.5 (ND-PM);高脂饮食+对照(HFD-CON);高脂饮食+PM2.5 (HFD-PM);高碳水化合物饮食+对照(HCD-CON);高碳水化合物饮食+PM2.5 (HCD-PM)。动物饲养于12 h昼夜循环的环境中,室内温度为(24±2) ℃、湿度为(50±5)%。适应性饲养7 d后,按照实验分组提供基础、高脂和高碳水化合物饲料,大鼠饲料的组成信息见表1。实验期间不限制大鼠饮水量,各组饲料供给量相同,同时记录体质量变化。喂养8周后,使用气管滴注法染毒,每3天一次,共8次。末次染毒后进行糖耐量实验,然后处死大鼠收集血液、肝脏及粪便样品。
表1 大鼠饲料成分信息
Table 1 Composition of rat feed
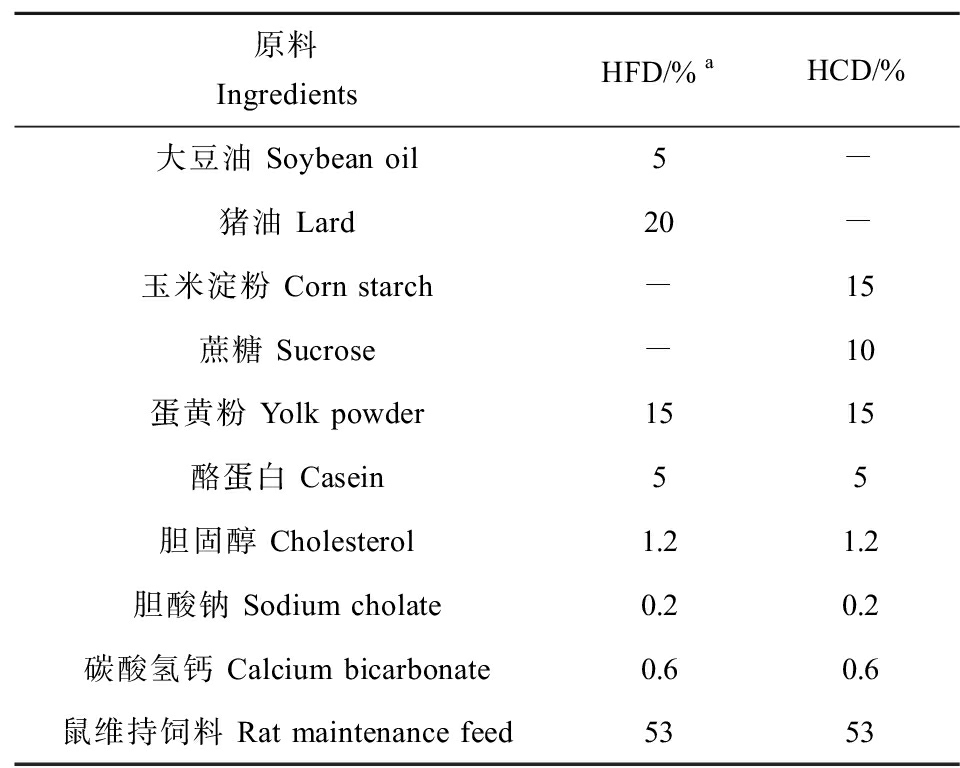
原料IngredientsHFD/%aHCD/%大豆油 Soybean oil5-猪油 Lard20-玉米淀粉 Corn starch-15蔗糖 Sucrose-10蛋黄粉 Yolk powder1515酪蛋白 Casein55胆固醇 Cholesterol1.21.2胆酸钠 Sodium cholate0.20.2碳酸氢钙 Calcium bicarbonate0.60.6鼠维持饲料 Rat maintenance feed5353
注:a 表示每100 g饲料中含有原料的质量(g);HFD表示高脂饮食;HCD表示高碳水化合物饮食。
Note: a represents grams of materials per 100 g of feed; HFD represents high fat diet; HCD represents high carbohydrate diet.
1.4 糖代谢相关指标
大鼠禁食不禁水14 h后,以50%葡萄糖注射液灌胃(生理盐水配制,剂量为2 g·kg-1)。选取大鼠灌胃前和灌胃后30、60、120 min,使用罗氏(ROCHE)卓越金采型血糖仪和血糖试纸,经鼠尾采血测定血糖值。根据大鼠空腹血浆胰岛素水平,计算胰岛素敏感指数(insulin sensitivity index, ISI)和稳态模型胰岛素抵抗指数(homeostasis model assessment resistance index, HOMA-IR)[19-20],计算公式如下:
ISI = -ln (FBG×FINS)
(1)
HOMA-IR = (FBG×FINS)/22.5
(2)
式中:FBG为空腹血糖水平(mmol·L-1);FINS为空腹胰岛素水平(mU·L-1)。
1.5 代谢组学分析
粪便样品经前处理后,采用超高效液相色谱系统(型号:Agilent 1290 Infinity LC)进行分析。流动相组成:A为水+25 mmol·L-1氨水+25 mmol·L-1乙酸铵;B为乙腈。色谱柱的温度为25 ℃,流速为0.3 mL·min -1。梯度洗脱程序如下:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%。随后在安捷伦6550质谱仪的电喷雾电离源的正/负离子模式下检测。采用质谱仪(型号:AB Triple TOF 6600)鉴定代谢物碎片,采集一级、二级谱图。获得的数据使用自建库方法(MetDDA和LipDDA)鉴定代谢物的分子结构。
1.6 肝脏组织病理学观察
将大鼠肝组织经4%多聚甲醛固定、脱水后,取出进行石蜡包埋,随后样品被切成5 mm厚的截面,使用苏木精-伊红(H&E)染色。在光学显微镜下对组织结构特征进行评估。
1.7 生化指标测定
室温下将大鼠血液静置20 min,于4 ℃、8 000 r·min-1离心15 min取上清液获得血浆,然后按照大鼠ELISA检测试剂盒(南京建成生物工程研究所)的说明测定胰岛素(INS)和C-反应蛋白(CRP)的水平。大鼠肝脏组织与4 ℃预冷的磷酸盐缓冲溶液按照固液比1∶10 (g·mL-1)制成组织匀浆液,离心取上清液用于检测甘油三酯(TG)和总胆固醇(TC),评估肝功能。
1.8 统计分析
利用柏拉图标准化(Pareto-scaling)对代谢物数据进行处理,然后使用偏最小二乘鉴别分析法(PLS-DA)分析。随后将代谢物数据输入KEGG数据库,并使用Fisher’s Exact Test筛选潜在的靶向通路。使用IBM SPSS Statistics 24 (Chicago, USA)进行统计分析。数据均使用平均数±标准差的方式表示。2组数据间的比较使用单因素方差法,使用Tukey事后检验。*P<0.05和**P<0.01代表组间差异具有统计学意义。
2 结果(Results)
2.1 PM2.5化学组分表征
根据前期研究,石河子市2018年PM2.5中水溶性离子的浓度呈现冬季>秋季>春季>夏季的规律。PM2.5中重金属Cu、Pb、Ni和Sb处于较高浓度水平,Co、Cd、Bi和Sn处于较低水平[21]。鉴于先前研究多关注采暖期间的PM2.5组分[16],本研究选取石河子市2019年4月的PM2.5样品,对主要的无机元素和水溶性离子浓度进行测定。如图1所示,无机离子的平均浓度为Ca (4.21 μg·m-3) >Si (3.15 μg·m-3) > Na (2.50 μg·m-3) >Al (0.71 μg·m-3) >K (0.48 μg·m-3) >Zn (0.43 μg·m-3) >Cl (0.36 μg·m-3) >As (0.15 μg·m-3) >Se (0.12 μg·m-3)。水溶性离子的平均浓度为Na+ (16.2 μg·m-3) >Cl- (6.25 μg·m-3) >SO42- (5.77 μg·m-3) >![]() (5.11 μg·m-3) >Ca2+ (2.74 μg·m-3) >K+ (2.33 μg·m-3) >NH4+ (1.74 μg·m-3) >F-(1.165 μg·m-3)。
(5.11 μg·m-3) >Ca2+ (2.74 μg·m-3) >K+ (2.33 μg·m-3) >NH4+ (1.74 μg·m-3) >F-(1.165 μg·m-3)。

图1 PM2.5中无机金属及水溶性离子
Fig. 1 Inorganic metals and water-soluble ions in PM2.5
2.2 PM2.5对不同饮食大鼠体质量及血糖的影响
PM2.5协同不同饮食对大鼠体质量及血糖的影响如图2所示。如图2(a)所示,高脂饮食组大鼠(HFD-CON和HFD-PM)的体质量远高于其他2组,高碳水化合物饮食组(HCD-CON和HCD-PM)略高于正常饮食组(ND-CON和ND-PM),说明饮食对于体质量有明显的影响。随着实验的进行,PM2.5暴露对大鼠的体质量也有一定影响,第5周时,正常饮食组和高脂饮食组中,对照组大鼠的体质量高于PM2.5暴露组,而高碳水化合物组中对照组呈现下降趋势。口服糖耐量实验结果如图2(b)所示,可知血糖随时间的变化曲线,曲线呈先上升后下降趋势,且在30 min时,各组血糖值达到最高点。从整体来看,3种饮食对照组(ND-CON、HFD-CON和HCD-CON)的血糖值均高于PM2.5暴露组(ND-PM、HFD-PM和HCD-PM)。上述现象表明,PM2.5暴露会导致大鼠体质量下降,同时造成大鼠糖耐量水平降低。
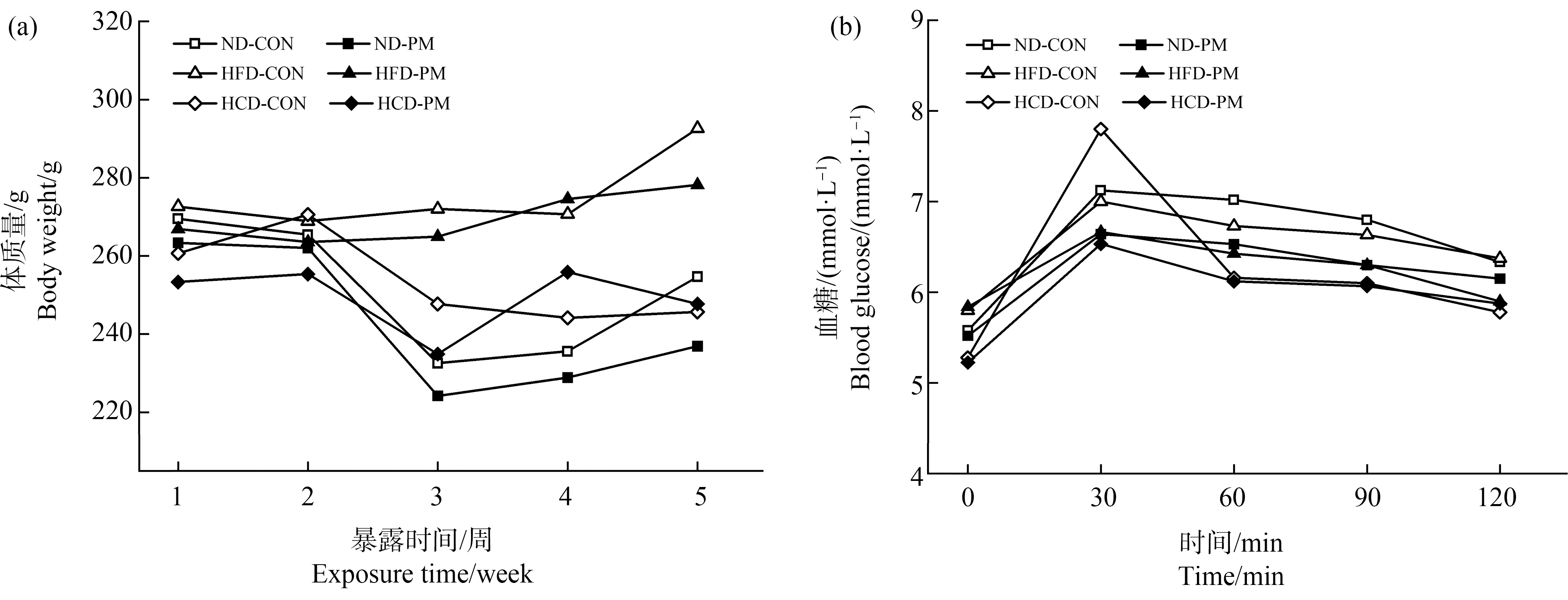
图2 体质量、糖耐量变化趋势图
Fig. 2 Trend chart of body weight and glucose tolerance
2.3 PM2.5对不同饮食大鼠胰岛素敏感指数的影响
如表2所示,对各饮食组大鼠进行组内比较,发现空腹血糖无显著差异;PM2.5暴露导致ND组和HFD组的空腹胰岛素水平显著下降;ND组大鼠的HOME-IR和ISI指标受PM2.5影响差异具有统计学意义。
表2 PM2.5对不同饮食大鼠FBG、FINS、HOME-IR、ISI的影响
Table 2 Effects of PM2.5 on FBG, FINS, HOME-IR and ISI in rats with different diets

组别GroupsFBGFINSHOMA-IRISIND-CON8.04±1.5613.84±1.334.91±0.86-4.69±0.18ND-PM8.75±1.569.59±1.66**3.73±0.87*-4.40±0.27*HFD-CON8.35±0.9312.23±0.634.56±0.73-4.62±0.15HFD-PM7.99±0.5810.14±1.53*3.62±0.72-4.38±0.19HCD-CON6.57±0.7511.26±0.493.29±0.41-4.30±0.13HCD-PM8.20±0.8311.01±1.643.95±0.22-4.49±0.06
注:FBG代表空腹血糖,单位为mmol·L-1,FINS代表空腹胰岛素,单位为mU·L-1,HOME-IR代表稳态模型胰岛素抵抗指数,ISI代表胰岛素敏感指数;各组数值均为平均值±标准差,n = 5~8;进行组内比较(ND-CON vs. ND-PM;HFD-CON vs. HFD-PM;HCD-CON vs. HCD-PM);*、**分别代表P<0.05、P<0.01。
Note: FBG represents fasting blood glucose, and the unit is mmol·L-1; FINS represents fasting insulin, and the unit is mU·L-1; HOME-IR represents homeostasis model assessment resistance index, and ISI represents insulin sensitivity index; the values of each group are mean±standard deviation, n = 5~8; within-group comparisons were performed (ND-CON vs. ND-PM; HFD-CON vs. HFD-PM; HCD-CON vs. HCD-PM); *, ** mean P<0.05, P<0.01 respectively.
2.4 PM2.5对不同饮食大鼠代谢物的影响
为深入探究PM2.5对糖脂代谢造成的可能影响,采用非靶标代谢组学技术筛选显著差异代谢物,进而确定靶向通路。采用偏最小二乘鉴别分析(PLS-DA)对各组的代谢物进行鉴别,PM2.5暴露组与对照组均有明显的区分(图3)。
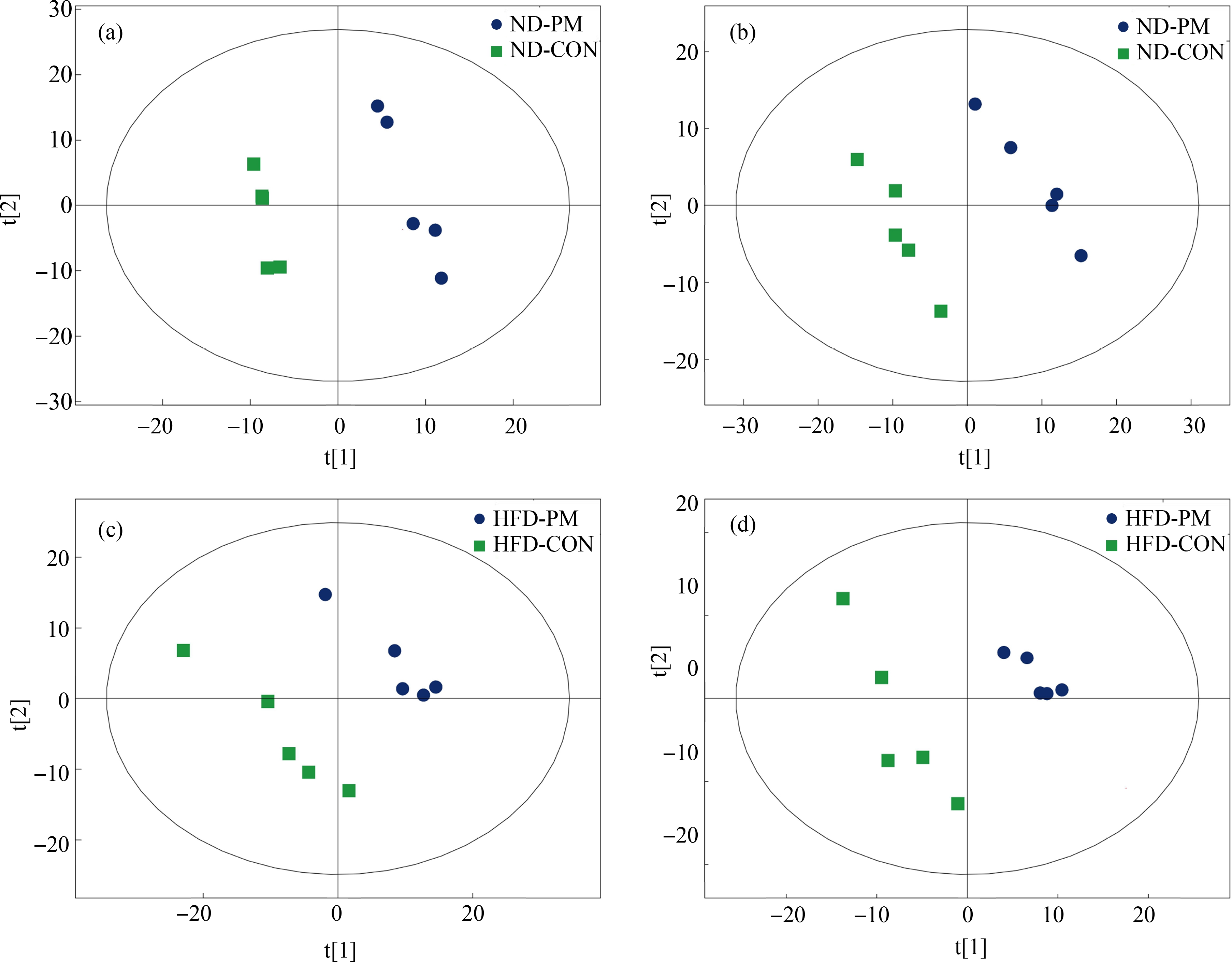
图3 代谢物的统计检验
注:(a)~(b)正/负离子模式下ND组代谢物PCA-DA得分图;(c)~(d)正/负离子模式下HFD组代谢物PCA-DA得分图。
Fig. 3 Statistical test of metabolites
Note: (a)~(b) PCA-DA score plot of ND group metabolites in positive and negative mode; (c)~(d) PCA-DA score plot of HFD group metabolites in positive and negative mode.
PM2.5诱导ND组和HFD组大鼠代谢通路的改变如图4所示。在正负离子模式下发现ND组有37个显著差异代谢物,其中7个代谢物含量上升,30个代谢物含量下降;HFD组共有20个显著差异代谢物,19个代谢物上升,1个代谢物下降;HCD组发现了81种,其中67个代谢物上升,14个代谢物下降[15]。基于上述差异代谢物,KEGG通路富集结果如图4所示。ND组和HFD组的富集差异代谢物较多的通路均为氨基糖和核苷酸糖代谢通路;HCD组的ABC转运蛋白通路最为显著,详见笔者所在课题组的前期研究[15]。

图4 PM2.5诱导ND组和HFD组大鼠代谢通路的改变
Fig. 4 PM2.5-induced changes in metabolic pathways in rats with ND and HFD diets
2.5 PM2.5对不同饮食大鼠肝脏病理变化的影响
肝脏在糖脂代谢过程中发挥重要作用,进一步探究PM2.5对肝脏的影响。大鼠的肝脏组织结构改变HE染色图如图5所示。ND-CON组结果如图5(a)所示,肝细胞以中央静脉为中心呈放射状排列,肝细胞索网眼间窦状隙和血窦组织结构基本正常。而ND-PM组(图5(b))与HFD-CON组(图5(c)),部分肝细胞中出现脂质空泡,同时伴有细胞核碎裂、核膜消失等细胞坏死现象。与HFD-CON组对应的HFD-PM组(图5(d)),肝细胞内脂质空泡显著增大,出现大量脂质变性特征。高碳水饮食组结果如图5(e)和图5(f)所示,HCD-CON组气管滴注滤膜过滤水溶液,从图5中发现少量肝细胞坏死,存在细胞核固缩和细胞核碎裂的现象,HCD-PM组气管滴注PM2.5,发现肝窦变宽且间隙中充满红细胞,肝组织中出现淤血。
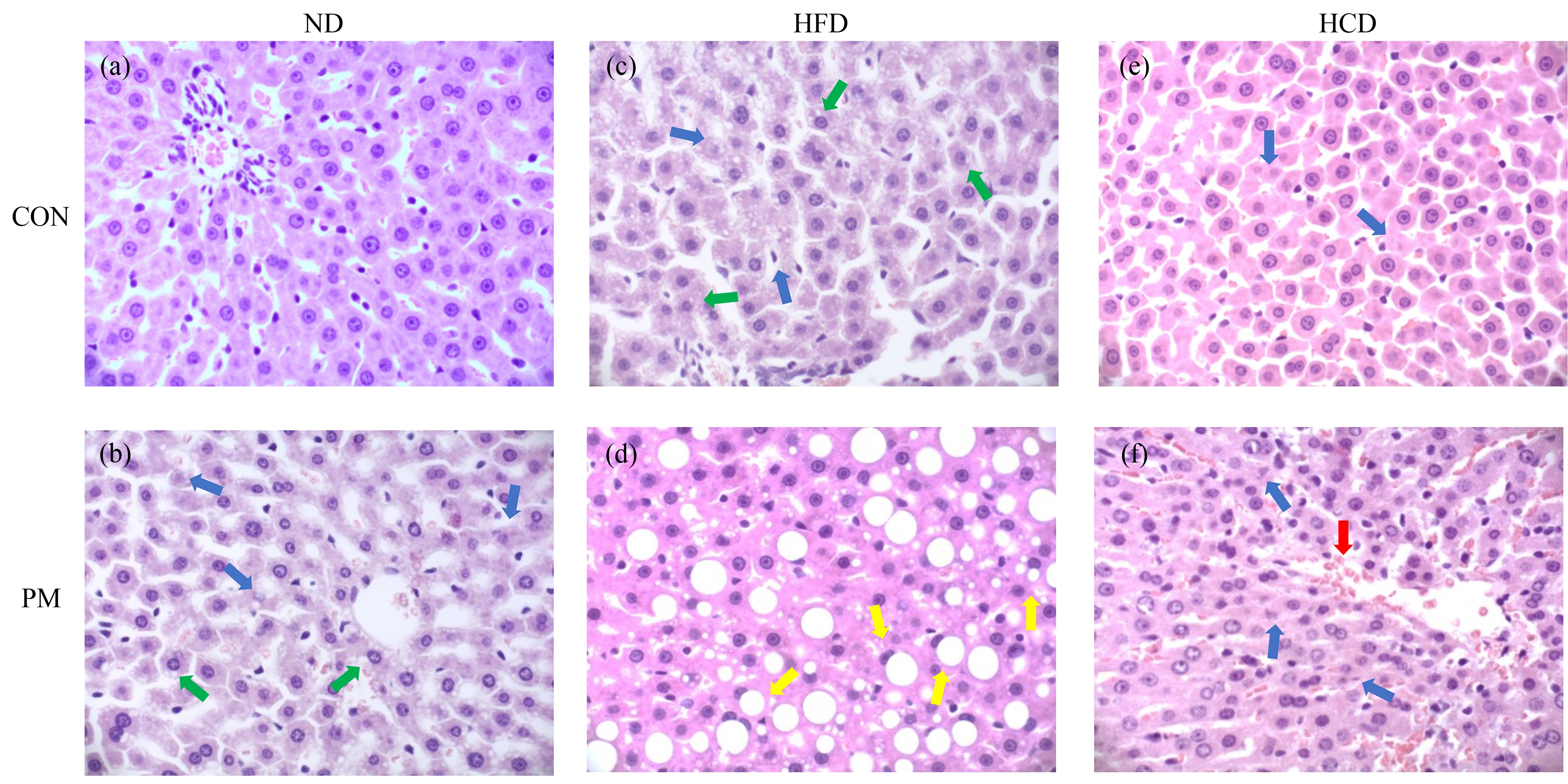
图5 大鼠肝脏的HE染色图片(×400)
注:(a)~(f)分别代表ND-CON、ND-PM、HFD-CON、HFD-PM、HCD-CON、HCD-PM组;蓝色箭头指向细胞核碎裂,肝细胞坏死;绿色箭头指向脂质空泡,疑似脂肪变性位点;黄色箭头指向脂质变性;红色箭头指向淤血点。
Fig. 5 HE staining of rat liver (×400)
Note: (a)~(f) represent ND-CON, ND-PM, HFD-CON, HFD-PM, HCD-CON and HCD-PM groups respectively; the blue arrow points to nuclear fragmentation and necrosis of liver cells; the green arrow points to the lipid vacuole, which is suspected to be the site of steatosis; the yellow arrow points to lipid denaturation; the red arrow points to the congestion point.
2.6 PM2.5对不同饮食大鼠生化指标的影响
根据大鼠肝脏组织病理情况,选取TG、TC和CRP进一步评估相关变化(图6)。结果表明ND和HFD饮食组的变化情况类似,PM2.5暴露组TG和TC水平均显著高于对照组。然而PM2.5与高碳水化合物饮食协同作用时,血脂指标并未升高。CRP为非特异性炎性标志物,可以反映系统炎症的水平。可以发现正常饮食组内差异不显著性;HFD-PM组低于HFD-CON组;HCD-PM组显著高于HCD-CON组。
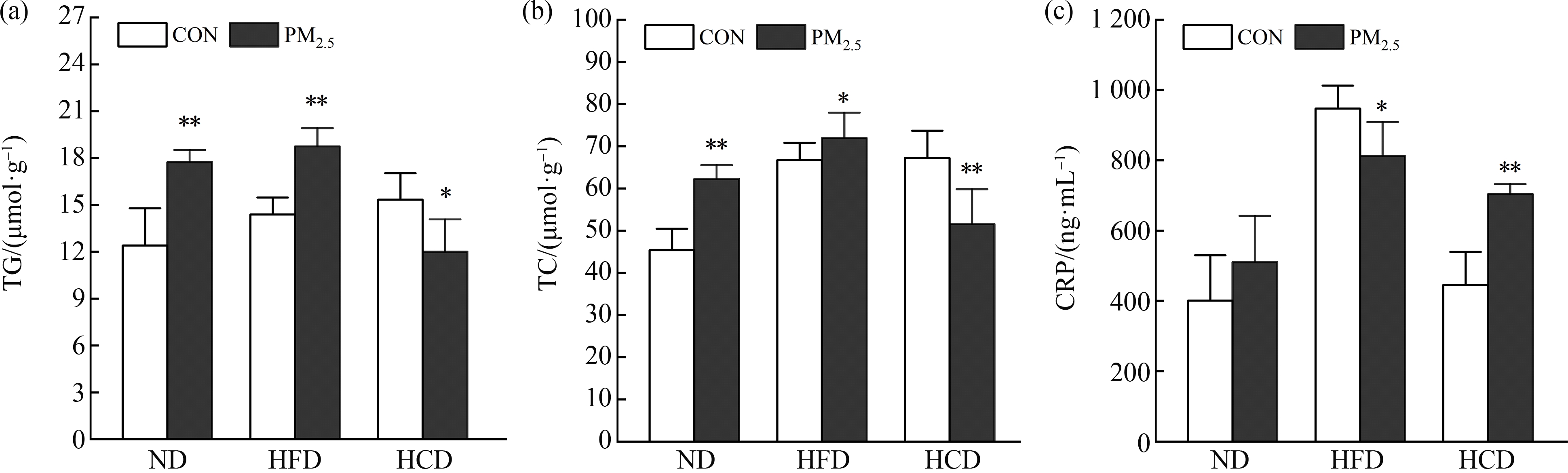
图6 PM2.5对不同饮食大鼠TG、TC、CRP的影响
注:TG代表甘油三酯,TC代表总胆固醇,CRP代表C-反应蛋白;与对照组相比,*、**分别代表P<0.05、P<0.01。
Fig. 6 Effects of PM2.5 on TG, TC and CRP in rats with different diets
Note: TG stands for triglyceride, TC stands for total cholesterol, and CRP stands for C-reactive protein; compared with the control group, *, **represent P<0.05, P<0.01, respectively.
3 讨论(Discussion)
PM2.5暴露导致大鼠体质量先升高后降低,可能是PM2.5对大鼠机体的损伤具有累积和滞后效应[22]。现有研究认为PM2.5增强胰岛素抵抗和内脏炎症水平[23],并且PM2.5和HFD联合作用可导致糖耐量异常[24]。本研究中,PM2.5暴露导致大鼠的糖耐量有不同程度降低;空腹血糖无显著性差异。可能与PM2.5暴露时长有关,8周的暴露周期不足以对血糖产生显著影响[25]。此外,ND组和HFD组胰岛素水平显著下降(P<0.05),Long等[26]发现PM2.5暴露会导致血浆中胰岛素水平下降,与本文一致。虽然PM2.5暴露并未造成血糖出现明显异常,但KEGG富集分析显示,氨基糖和核苷酸糖代谢途径中富集的显著差异代谢物最多。在糖代谢的一系列复杂的化学反应中,氨基糖是血糖的转变去路之一,由单糖分子中一个羟基被氨基取代形成。核苷酸糖为核苷二磷酸或核苷一磷酸与不同单糖异头体羟基形成的衍生物,是糖类合成或相互转换时的活化形式。由此说明,PM2.5暴露对ND组和HFD组大鼠糖代谢通路有重要的影响。
肝脏作为生物体代谢的主要场所,肝功能直接影响代谢的过程和途径。PM2.5暴露与肝脏密切相关,引起肝细胞凋亡和巨噬细胞浸润[27]。Qin等[9]认为HFD和PM2.5暴露的联合干预可导致脂肪酸的积累,进而触发脂类的形成。本文的结果显示,PM2.5可导致ND组和HFD组的大鼠肝脏出现脂质空泡,且HFD组出现明显的脂质变性。血脂指标进一步证实,TG和TC在ND组和HFD组显著升高,这一结果表明PM2.5能够诱导正常饮食和高脂饮食大鼠肝脏出现脂质变性,且高脂饮食加剧了血脂异常。对于HCD组,PM2.5暴露更倾向于导致大鼠肝脏细胞坏死,甚至出现淤血。为进一步探究该病理改变,选取CRP作为炎症标志物,观察PM2.5暴露对大鼠机体炎性因子水平的影响。与各组的对照组相比,HCD-PM组的CRP水平显著上升(P<0.01),而HFD-PM组CRP显著下降(P<0.05)。PM2.5结合高碳水饮食促进了CRP的表达,而高脂饮食导致的肥胖可能减轻了机体炎性损伤。综上,PM2.5暴露对不同饮食大鼠肝脏的影响不同。肝脏作为糖脂代谢的重要器官,PM2.5诱导糖脂代谢的相关机制仍需进一步研究。
在本研究考虑了多种饮食因素(正常、高脂和高碳水化合物饮食),探究PM2.5暴露对糖脂代谢的影响。结果表明,短期的PM2.5暴露不足以引起大鼠出现明显的糖耐量异常和胰岛素抵抗,但是对ND组和HFD组大鼠糖代谢通路有重要影响。ND和HFD的大鼠肝脏血脂指标TG和TC水平升高,HCD大鼠机体炎性标志物CRP水平升高,PM2.5对不同饮食大鼠糖脂代谢的影响不同。对于普通民众,在PM2.5污染的环境下,个人也许能够通过调节饮食结构来避免一定的健康风险。本研究进一步补充了PM2.5健康效应的实验证据,希望能为保护人群健康提供参考。
[1] Rappaport S M, Smith M T. Epidemiology. Environment and disease risks [J]. Science, 2010, 330(6003): 460-461
[2] 路曼曼, 宋静, 鲁娴娴, 等. PM2.5经皮肤暴露和气道滴注对小鼠肝脏的不同影响[J]. 化学与生物工程, 2018, 35(12): 14-19
Lu M M, Song J, Lu X X, et al. Different influences of PM2.5 on mouse liver through dermal exposure and intratracheal instillation [J]. Chemistry &Bioengineering, 2018, 35(12): 14-19 (in Chinese)
[3] Liu F F, Chen G B, Huo W Q, et al. Associations between long-term exposure to ambient air pollution and risk of type 2 diabetes mellitus: A systematic review and meta-analysis [J]. Environmental Pollution, 2019, 252(Pt B): 1235-1245
[4] 时文明, 赵卓慧. 大气PM2.5与2型糖尿病关系的研究进展[J]. 环境与职业医学, 2017, 34(7): 653-656
Shi W M, Zhao Z H. Review on associations between ambient fine particulate matters and type 2 diabetes mellitus [J]. Journal of Environmental &Occupational Medicine, 2017, 34(7): 653-656 (in Chinese)
[5] Hao J, Huang K P, Chen C, et al. Polydatin improves glucose and lipid metabolisms in insulin-resistant HepG2 cells through the AMPK pathway [J]. Biological &Pharmaceutical Bulletin, 2018, 41(6): 891-898
[6] Sun Q H, Yue P B, Deiuliis J A, et al. Ambient air pollution exaggerates adipose inflammation and insulin resistance in a mouse model of diet-induced obesity [J]. Circulation, 2009, 119(4): 538-546
[7] Hasslöf H, Molnár P, Andersson E M, et al. Long-term exposure to air pollution and atherosclerosis in the carotid arteries in the Malmö diet and cancer cohort [J]. Environmental Research, 2020, 191: 110095
[8] Liu F F, Chen G B, Huo W Q, et al. Associations between long-term exposure to ambient air pollution and risk of type 2 diabetes mellitus: A systematic review and meta-analysis [J]. Environmental Pollution, 2019, 252(Pt B): 1235-1245
[9] Qin X D, Qian Z M, Vaughn M G, et al. Gender-specific differences of interaction between obesity and air pollution on stroke and cardiovascular diseases in Chinese adults from a high pollution range area: A large population based cross sectional study [J]. The Science of the Total Environment, 2015, 529: 243-248
[10] 杨莹, 王薇薇, 李爱科, 等. 高脂饲粮和高碳水化合物饲粮对大鼠脂肪代谢的影响[J]. 动物营养学报, 2017, 29(7): 2603-2612
Yang Y, Wang W W, Li A K, et al. Effects of high fat diet and high carbohydrate diet on fat metabolism of rats [J]. Chinese Journal of Animal Nutrition, 2017, 29(7): 2603-2612 (in Chinese)
[11] Zhang J S, Cai L, Gui Z H, et al. Air pollution-associated blood pressure may be modified by diet among children in Guangzhou, China [J]. Journal of Hypertension, 2020, 38(11): 2215-2222
[12] Chen C, Hayden K M, Kaufman J D, et al. Adherence to a MIND-like dietary pattern, long-term exposure to fine particulate matter air pollution, and MRI-based measures of brain volume: The women’s health initiative memory study-MRI [J]. Environmental Health Perspectives, 2021, 129(12): 127008
[13] Li R, Wang Y X, Chen R C, et al. Ambient fine particulate matter disrupts hepatic circadian oscillation and lipid metabolism in a mouse model [J]. Environmental Pollution, 2020, 262: 114179
[14] 刘月涛, 胡英还, 秦雪梅. 非靶标代谢组学研究的影响因素分析[J]. 药物分析杂志, 2019, 39(1): 86-93
Liu Y T, Hu Y H, Qin X M. Analysis of influencing factors in untargeted metabolomics study [J]. Chinese Journal of Pharmaceutical Analysis, 2019, 39(1): 86-93 (in Chinese)
[15] Liu J H, Su X H, Lu J J, et al. PM2.5 induces intestinal damage by affecting gut microbiota and metabolites of rats fed a high-carbohydrate diet [J]. Environmental Pollution, 2021, 279: 116849
[16] 任慧清, 鲁建江, 宁建英, 等. 石河子市PM2.5中重金属污染及健康风险评价[J]. 环境化学, 2020, 39(6): 1716-1725
Ren H Q, Lu J J, Ning J Y, et al. Pollution and health risk assessment of heavy metals in PM2.5 of Shihezi City [J]. Environmental Chemistry, 2020, 39(6): 1716-1725 (in Chinese)
[17] Curbani F, de Oliveira Busato F, do Nascimento M M, et al. Inhale, exhale: Why particulate matter exposure in animal models are so acute? [J]. Environmental Pollution, 2019, 251: 230-237
[18] Jin X T, Su H L, Ding G B, et al. Exposure to ambient fine particles causes abnormal energy metabolism and ATP decrease in lung tissues [J]. Chemosphere, 2019, 224: 29-38
[19] Niu J M, Xu G Y, Jiang S, et al. In vitro antioxidant activities and anti-diabetic effect of a polysaccharide from Schisandra sphenanthera in rats with type 2 diabetes [J]. International Journal of Biological Macromolecules, 2017, 94(Pt A): 154-160
[20] Rostamkhani F, Zardooz H, Zahediasl S, et al. Comparison of the effects of acute and chronic psychological stress on metabolic features in rats [J]. Journal of Zhejiang University Science B, 2012, 13(11): 904-912
[21] Chen J D, Lu J J, Ning J Y, et al. Pollution characteristics, sources, and risk assessment of heavy metals and perfluorinated compounds in PM2.5 in the major industrial city of northern Xinjiang, China [J]. Air Quality, Atmosphere &Health, 2019, 12(8): 909-918
[22] Longhin E, Holme J A, Gutzkow K B, et al. Cell cycle alterations induced by urban PM2.5 in bronchial epithelial cells: Characterization of the process and possible mechanisms involved [J]. Particle and Fibre Toxicology, 2013, 10: 63
[23] Goettems-Fiorin P B, Grochanke B S, Baldissera F G, et al. Fine particulate matter potentiates type 2 diabetes development in high-fat diet-treated mice: Stress response and extracellular to intracellular HSP70 ratio analysis [J]. Journal of Physiology and Biochemistry, 2016, 72(4): 643-656
[24] 刘超, 王新茹, 卞晶晶, 等. 高脂饮食及实时PM2.5联合暴露对孕哺期大鼠糖脂代谢的影响[J]. 环境与健康杂志, 2020, 37(3): 222-227, 283
Liu C, Wang X R, Bian J J, et al. Effects of high-fat diet and real-time PM2.5 inhalation in combination on glucose and lipid metabolism in rats in pregnancy and lactation [J]. Journal of Environment and Health, 2020, 37(3): 222-227, 283 (in Chinese)
[25] Costa Beber L C, da Silva M O A F, dos Santos A B, et al. The association of subchronic exposure to low concentration of PM2.5 and high-fat diet potentiates glucose intolerance development, by impairing adipose tissue antioxidant defense and eHSP72 levels [J]. Environmental Science and Pollution Research International, 2020, 27(25): 32006-32016
[26] Long M H, Zhang C, Xu D Q, et al. PM2.5 aggravates diabetes via the systemically activated IL-6-mediated STAT3/SOCS3 pathway in rats’ liver [J]. Environmental Pollution, 2020, 256: 113342
[27] Li W Y, Dorans K S, Wilker E H, et al. Residential proximity to major roadways, fine particulate matter, and hepatic steatosis: The framingham heart study [J]. American Journal of Epidemiology, 2017, 186(7): 857-865