2011年3月福岛第一核电站(Fukushima Daiichi Nuclear Power Plant, FDNPP)受地震海啸影响,发生严重的核泄漏事故。该事故释放出大量放射性物质,通过大气沉降和核冷却水的排放进入北太平洋[1-4]。上述排放物中主要包含人工放射性核素,其活度过高会对海洋环境以及生物本身产生严重影响。同时,人工放射性核素能够通过海洋生物摄食以及体表吸收等方式进行富集,并随食物链传递,最终影响到人类健康。
在以往研究中,人工放射性核素134Cs、137Cs、90Sr和 110mAg是主要的研究对象[1],其中134Cs、137Cs是学者们的研究重点[4-5]。137Cs的半衰期较长为30.17 a,134Cs的半衰期为2.07 a,二者最初产生于20世纪50—60年代所进行的太平洋核试验中,在海水中以离子态的形式参与海洋中的各种物理化学过程[5]。90Sr的半衰期为28.6 a,同样以离子态的形式存在于海水中。90Sr在海洋中的分布较为广泛,垂直分布上可以达到较深海域,极易富集于不同水层的贝类外壳、鱼类鳞片以及骨骼等硬组织,通过食物链传递最终可诱发人类罹患白血病、骨癌等癌变疾病[2,4,6-8]。110mAg的半衰期较短,为249.76 d,在海水中活度很低,主要以离子态的形式存在,因此很难被悬浮颗粒吸收[5]。
海洋生物通过摄食等过程吸收大部分的放射性核素,根据放射性核素在生物体内的积累程度,人工放射性核素会对海洋生物产生放射性损伤,主要分为急性损伤以及慢性损伤[8]。急性放射性损伤会在短时间内令生物体死亡,对生物体本身不会造成持续性影响。然而对海洋生物影响更大的是慢性损伤,研究表明慢性辐射损伤会导致鱼类等海洋生物出现生殖损伤、免疫系统等方面的问题[8],从而会对海洋生物产生持续性的影响。北太平洋是诸多国家的重要渔场之一,同时也是全球重要的海洋生态系统之一。受到福岛核电站核事故的影响,该海域海洋生物的健康和生存条件也是各国学者关注的重点。根据以往的研究内容,大多都聚焦于以134Cs、137Cs为代表的人工放射性核素在北太平洋海域的运输机制,但关于核素富集对生物本身的研究讨论较少。因此本文重点总结近些年来福岛核电站泄漏事件中人工放射性核素对北太平洋海洋生物的影响研究,对比讨论生物营养级之间的关系,并对未来研究方向进行展望,以期为后续相关研究提供参考。
1 福岛核电站泄露放射性核素北太平洋中运输与分布(Transportation and distribution of leaked radionuclides in the North Pacific at Fukushima Nuclear Power Plant)
1.1 放射性核素的运输
关于福岛核电站泄露的人工放射性核素在太平洋中运输分布模式,在事故早期就受到广泛关注。在以往研究中,相关学者已重点对134Cs、137Cs在太平洋的扩散运输以及分布进行监测,而上述两核素是福岛核事故中主要的人工放射性核素,其具有高含量、较长的半衰期特性,可以有效地作为研究福岛核电站泄漏人工放射性核素运输分布的主要示踪剂[1,5],因此受到重点关注。134Cs、137Cs在大洋中随洋流在水平、垂直方向上的迁移,与北太平洋环流体系息息相关。北太平洋中的环流包括副热带环流体系与亚北极环流体系,包括北赤道流、黑潮、亲潮、北太平洋流、加利福尼亚流和阿拉斯加流,还有复杂的海水垂直运动机制。由此福岛放射性物质在北太平洋上的运输可以分为表层海水的水平迁移以及表层海水到深层海水的垂直迁移[2-3,7-9]。
福岛核事故发生后,大量的人工放射性核素如134Cs、137Cs以干湿粒子的形式随核冷却水、大气沉积物进入北太平洋洋流体系[10-11],最初人工放射性核素随亲潮南下并与黑潮汇合进入黑潮延伸流[3,6-7,9],在大尺度风生环流即顺时针副热带环流以及逆时针流动的亚北极环流的共同作用下在大洋中迁移[12],此时主要受亲潮(oyashio)以及黑潮延伸流(kuroshio extension, KE)的影响,亲潮向西南方向运动并于40°N处向东转向[3,7,9,13-16],而在35°N~36°N处黑潮延伸流由北向东转向与上方亲潮汇合,并在150°E左右将福岛核电站释放的放射性物质向东运输。
根据以往研究发现,福岛放射性核素通过洋流的作用,在泄露后的4~6个月内(2011年7—9月)到达165°E,7~9个月后(2011年10—12月)到达172°E处[11,13,15],10~12个月后(2012年1—3月)到达180°经线处,一年后到达165°W,近2年半后(2014年8月)到达加拿大西海岸(130°W~140°W)[6,12-13]。北太平洋西部40°N处的运输速度为7 km·d-1(8 cm·s-1)[15],2012年3月至2014年8月期间,福岛人工放射性核素随北太平洋漂流(North Pacific Drift, NPD)以3 km·d-1(3.5 cm·s-1)速度抵达北太平洋东部[6,9-12,17],2016年输运至北美沿岸,放射性物质随洋流南北分向,向北输运的放射性核素,随阿拉斯加流通过白令海峡跟随亚北极环流体系进入北冰洋,南向的放射性核素随加利福尼亚海流与北赤道流汇合,进入北太平洋副热带环流体系[6,15]。在整个过程中福岛核电站泄露的放射性核素在北太平洋的平均运输速度为4.3 km·d-1(5 cm·s-1)[10,12,15],在早期的预测以及后期的研究中表明,从福岛核电站事故发生开始到运输至北美沿岸大约要4~5年的时间[1,3],运输过程中速度的变化与洋流速度的变化保持一致[9],这也佐证了洋流对放射性核素的运输迁移中的作用。
垂直方向上,放射性核素的运输主要与副热带模式水(subtropical mode water, STMW)以及中央模式水(central mode water, CMW)运动模式一致,其中STMW形成于黑潮延伸区的南部,大约在30°N到35°N之间,CMW形成于155°E至160°W之间的亚北极锋带以南,放射性核素沿着内陆海洋随海水以大约每月1°(纬度)的速度向西南方向运输[12-13,15]。在运输过程中受到黑潮延伸流的北向流动,福岛核电站排放的以Cs为代表的放射性物质主要分布在36.5°N以北区域[3,11,18-19]。在某种程度上,黑潮延伸流成为福岛放射性核素向南传送的屏障[15],也因此在福岛核事故发生一年后放射性核素大都集中于北太平洋西部,而在北太平洋东部除高洄游物种外,其他生物中均没有检测到人工放射性核素。未来可能会到达北太平洋黑潮延伸流区域内,即在36.5°N~40°N带处的北太平洋中部海域,从中部区域至北太平洋东部的放射性核素含量会随海水稀释急速下降[5,14]。在随洋流向北太平洋西南方向运输后,底层海水的放射性核素也会随洋流运动返回北方。总的来说放射性核素在垂直方向上的运输机制可概括为:受温度以及洋流的作用(地转流以及中尺度涡旋)形成的复杂洋流俯冲机制[15,18]。
福岛核电站的运输方式总体来说可以概括为:两方式,两方向,三阶段。两方式,即随洋流运输的被动迁移方式以及生物主动迁移方式[3,7],两方向,即水平和垂直两个方向,三阶段,即第一个阶段是放射性物质的分布阶段,在邻近海域检测到大量的放射性物质,第二阶段放射性核素随着洋流迁移运输,第三阶段放射性核素含量呈指数级下降并随太平洋继续进行扩散[10](图1和图2)。

图1 北太平洋洋流分布及放射性核素扩散示意图[17]
注:CMW表示中央模式水,STMW表示副热带模式水,FDNPP表示福岛第一核电站。
Fig. 1 Schematic diagram of current distribution and the diffusion of the radioactive substances in the North Pacific Ocean[17]
Note: CMW represents central mode water, STMW represents subtropical mode water, and FDNPP represents Fukushima Daiichi Nuclear Power Plant.
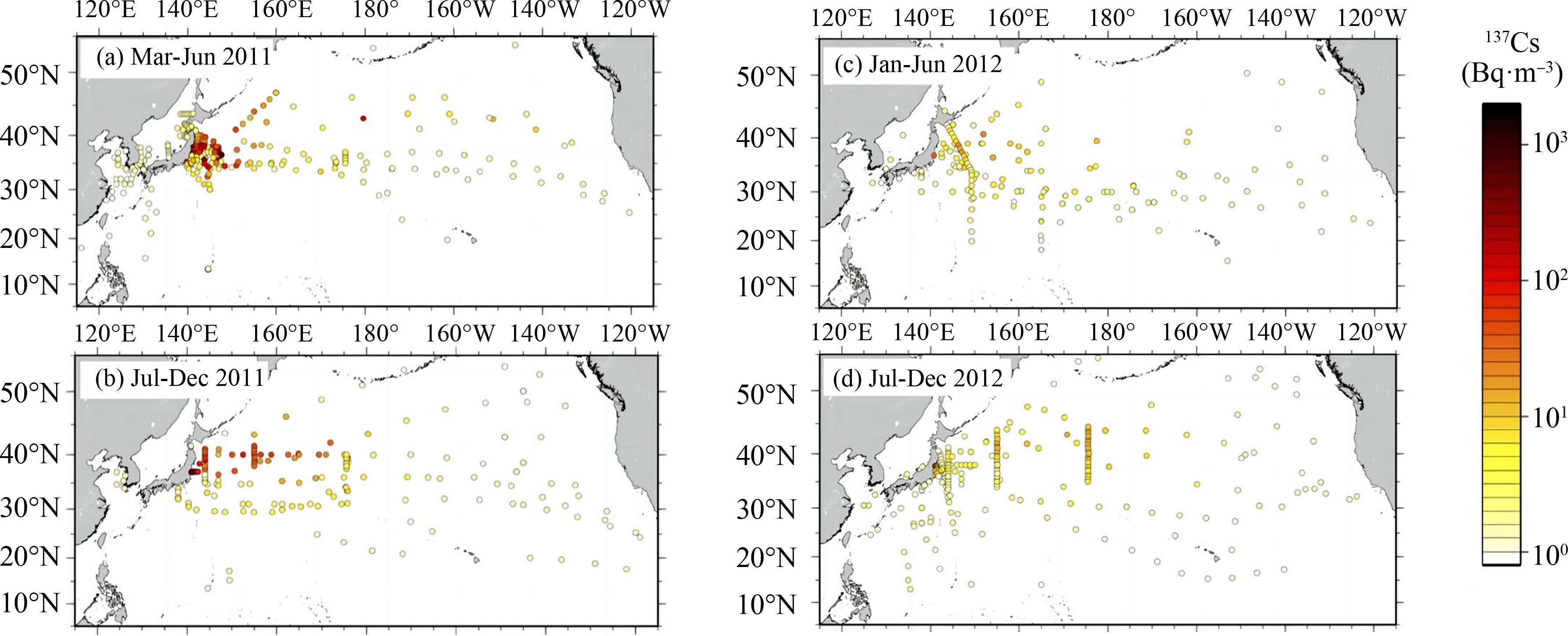
图2 2011年北太平洋放射性137Cs分布图[14]
Fig. 2 Distribution of radioactivity 137Cs in the North Pacific in year 2011[14]
1.2 放射性核素的分布
在福岛核电站事故后,总计向环境中释放了520 PBq(PBq指106贝可,是放射性活性活度单位)的放射性物质[9]。其中有1 PBq的90Sr随高浓度核废水进入海洋,并有大气沉积的12~15 PBq 134Cs以及核冷却水中的3~5 PBq 134Cs进入太平洋[1,5,9-10,16]。相关研究表明,134Cs与137Cs的活性活度比值接近于1,二者的总放射性活度水平相近[13,17-19],因此在太平洋中137Cs的总含量为15~18 PBq[18]。134Cs、137Cs集中分布于29°N~39°N区域内,与亲潮-黑潮延伸流域交界处以及中央模式水重合。低纬度地区超低活性活度的134Cs、137Cs分布情况,也进一步证明了黑潮延伸流作为福岛放射性核素向南屏障的作用[12,14];且根据在不同纬度和深度处的放射性核素分布,证明在副热带模式水形成以及中央模式水的俯冲作用下放射性核素的垂直分布特征,以及中央模式水对放射性核素的有效运输机制[9,20-25]。研究表明,经过大洋海水的稀释扩散和放射性核素的自身衰变,福岛放射性核素将在10年间覆盖整个北太平洋,经过20年的时间整个北太平洋海域的放射性核素将低于0.3~0.1 Bq·m-3,即低于当前背景下的检测值[25]。同时相关学者对未来30年内太平洋海域的放射性核素分布情况进行了预测[14](图3)。
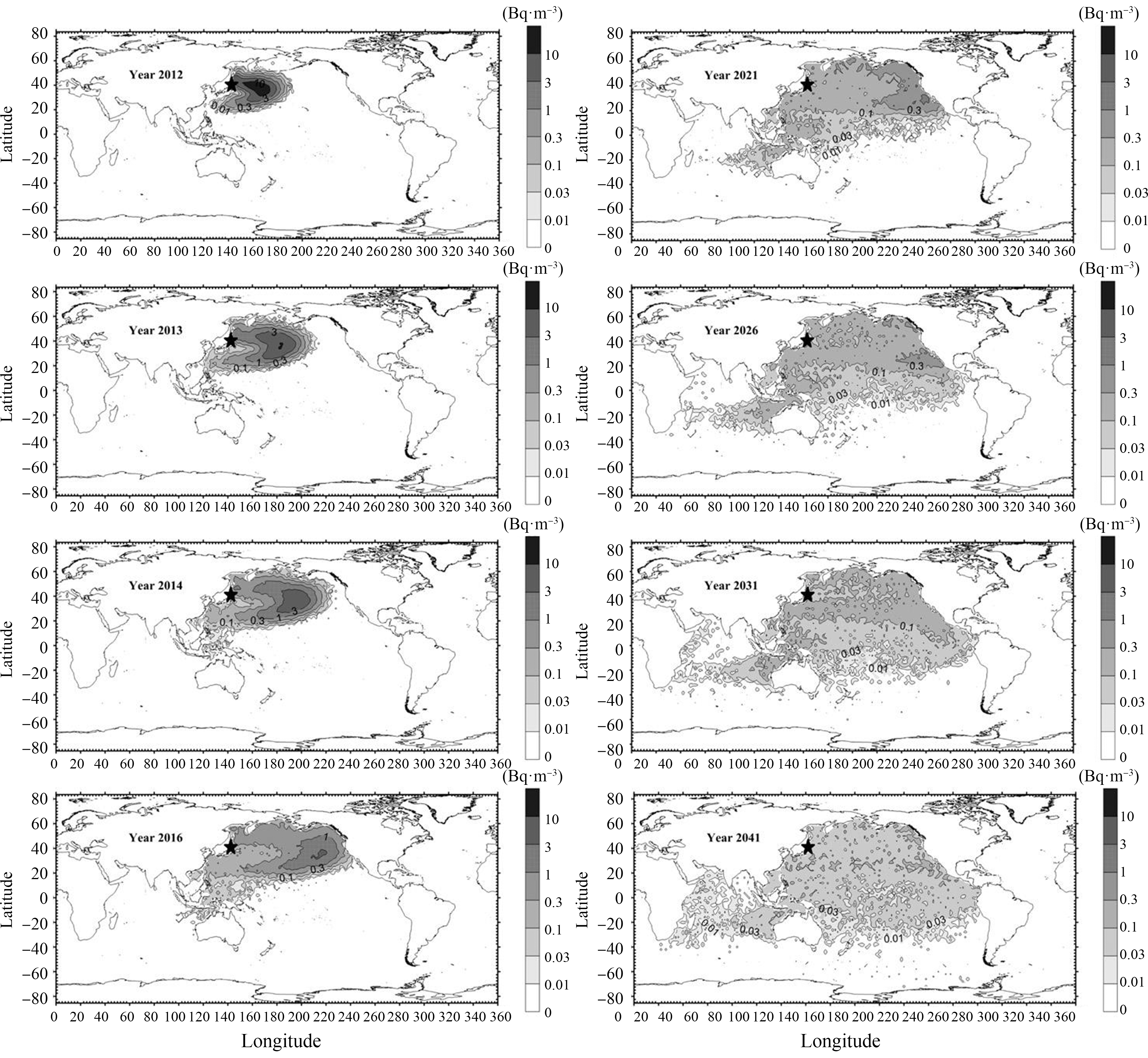
图3 福岛放射性核素未来分布预测图[25]
Fig. 3 Prediction diagram of the future distribution of the radionuclide activity in Fukushima[25]
2 福岛放射性核素对海洋生物的影响(Effects of Fukushima radionuclides on marine organisms)
2.1 指示生物的选择
部分学者对于核素指示生物的选择有一定的标准,可以分为2个角度:从研究角度来看,第一要求研究生物能够有效吸收富集放射性核素,并且积累的放射性核素可以在体内长时间停留,短时间内不会被排出[26]。其次从实际角度来看,需要了解研究生物产量丰富程度以及分布区域范围[27]。放射性核素研究不仅针对生物体本身,同时还需要结合该地区放射性核素的分布情况等因素,同时研究对象要易于获取,且与人类紧密联系[5,28-32]。例如在北太平洋主要的经济物种中,头足类等无脊椎动物占据重要地位,也是近些年来研究福岛放射性核素影响的重点生物之一,选择该物种主要是因为其处于中间营养级,在食物链中起承上启下的作用,并且对于放射性核素有很好的富集吸收能力[33-35]。在中高营养级物种中,Men等[9]选择了鲯鳅(Coryphaena hippurus)作为研究对象,该物种在空间上广泛分布于太平洋地区,并且处于食物链中间层次,具有一定的经济价值。在高营养级的生物中,Men等[32]则选择大青鲨(Prionace glauca)作为研究对象,作为顶级捕食者,大青鲨对核素的积累程度更高,同时寿命长,繁殖周期较长,同样具有较高的研究价值。同时,更应注重与人类活动密切相关的潜在物种供后续研究选择[36-38]。
2.2 模型研究
目前主流研究放射性核素对生物体影响的模型主要有尺寸结构食物网模型、动态食物网模型、种群动力学模型和三维舱室模型(Poseidon-R)等,常用的为动态食物网模型[26]。这些模型基本以生物学中年龄结构模型、生长模型和个体模型为基础。利用基础数据并结合多模型来对放射性核素向生物体内的转移过程进行模拟,很多学者将此过程模型参数化,可以将一些抽象的过程用模型表现,早在福岛核电站事故发生之前就有学者意识到相关领域研究的重要性,Beresford[33]曾总结强调要将放射性核素向生物体内转移参数化,目前对福岛核电站事故发生之后的相关研究则更加深入。
相关模型研究的案例较多。如使用尺寸结构食物网模型对太平洋海域的远洋生物中存在的137Cs进行数值模拟,利用该模型可以估计各项放射性生态指标,即最大活性活度、相应的时间以及生态半衰期,并可以利用该模型估计每个物种达到事故前137Cs含量所需要的时间。该模型应用了个体模型、年龄结构模型,同时考虑多物种数量机会捕食假设下系统确定不同物种相关性之间的相互作用,不同核素的数值模拟均可通用于该方法[29]。de With等[30]用Poseidon-R模型来描述沉积物和水体中放射性核素活性活度及在水环境的分布传播,以及生物摄食过程,并对各种核素在海洋生物的辐射剂量进行估算,模拟放射性核素向生物体内传递的过程,结果可以验证常见人工放射性核素的吸收速率,该模型可以对核素传递到生物体的过程都能进行不同程度的预测、过程模拟等,可以很大程度上帮助我们理解相关机制。动态食物网模型应用也比较广泛[31],利用动态食物网模型可以模拟出福岛核事故进展变化及影响,通过持续深入的研究,Vives Batlle等[10]在Johansen等的基础上对模型进行相关调整,能够模拟放射性核素在整个环境中的输运过程,同时可以重现福岛核电站事件的长期生态影响。通过生物动力学模型可以对整个放射性核素向生物的传播机制进行模拟,并且将来模型的研究方向都趋向于参数化的进展以及与其他多因素和多学科的结合。今后,应加深对整个生态系统中的放射性核素的来源去处以及进入生物体和人体等参数化进程的研究[10]。
2.3 福岛泄露放射性核素对西北太平洋海洋生物的影响
在福岛核泄漏以后对于核素对海洋生物的影响,从浮游动物、底栖生物到大青鲨等顶级捕食者的食物链各个营养级都有相关的研究。目前针对北太平洋海域研究最多的就是以柔鱼(Ommastrephes bartramii)为代表的中间营养级生物。本文就不同研究者对不同营养级物种的研究结果总结并讨论。
2.3.1 低营养级生物
Kitamura等[39]对西北太平洋浮游动物的放射性Cs污染的时间变化规律进行研究,在福岛核电站泄露以后的1个月到3年的时间,根据2个站点分别对亚北极环流以及亚热带环流区域的浮游生物进行研究,研究结果指出浮游生物中的137Cs的最大活性活度比事故前的水平高出2个数量级,在事故发生后4个月,亚热带海域浮游动物中放射性Cs的活性活度迅速下降,但于亚北极站未发现相同的现象,对此可解释为:亚热带的浮游动物寿命较短,在4个月后先前吸收核素的浮游动物被新生浮游动物取代,而亚北极站的寿命较长,核素活性活度较高。结合上述结论,可以证明生物本身的生活周期会对于放射性核素的积累有相应影响。长期监测表明,亚热带的浮游动物137Cs活性活度依旧较高,亚北极处的采样处的浮游动物137Cs活性活度已经下降到接近事故前的水平[39]。此处结合福岛放射性核素的运输,证明在亚热带地区福岛放射性核素的影响持续时间较长[38]。海水下层浮游动物中较高的放射性Cs活性活度受到生物积累的影响,结果表明浮游动物的放射性Cs活性活度不仅受环境放射性Cs的影响,还受到浮游动物群落特征的影响。因此放射性核素能够被浮游动物富集吸收,且对浮游动物产生潜在的影响[21,30]。
de With等[30]在进行动态食物链模型开发时,对底栖食物网中的生物吸收放射性核素总结出3个途径:第一是从水转移到大型藻类再转移到食草无脊椎动物中,第二是通过碎屑和浮游动物分辨的垂直通量转移,转移到摄食碎屑的无脊椎动物,第三是通过受污染的底部沉积物转移到以沉积物为食的无脊椎动物。
2.3.2 中营养级生物
针对中营养级物种的研究较多,如唐峰华等[40]研究了2013年北太平洋公海渔场的柔鱼受福岛核电站核泄漏的影响情况,并对不同胴长的柔鱼进行对比分析,研究表明137Cs在柔鱼中有较高的富集,针对不同组织含量分析可发现,含量最高的组织为内脏;同时其对柔鱼体内富集分布进行初步研究,对柔鱼胴长与放射性核素的关系进行讨论,但是未对柔鱼具体生活阶段的核素差异进行分析[34]。Men等[3]进行了更详尽的研究,在福岛核电站泄露之前,柔鱼的体内并没有检测到110mAg以及134Cs。核电站事故发生后,柔鱼体内检测到110mAg且相比于其他放射性核素活性活度较高,该结果证明了柔鱼对110mAg的具有较强的富集能力。随着时间的推移,人工放射性核素呈现出逐渐减小的趋势,而天然放射性核素,特别是210Po,在海水中检测出几个数量级的剂量率,远高于人工放射性核素的活性活度,2种核素之间剂量率的变化可能存在潜在联系[3]。Men等[16]对北太平洋海域的游泳生物的研究中,确定了生物内部剂量远大于外部剂量的影响,且人工放射性核素含量远低于天然放射性核素含量[39-40]。而环境中核素的变化以及再次影响生物的机制尚未明确。
针对中高级营养级的物种,Men等[9]选择鲯鳅(Coryphaena hippurus)进行研究,研究2011年1月至2012年9月福岛核事故发生早期太平洋鲯鳅中的134Cs、137Cs以及110mAg的3种核素的分布含量,并计算鲯鳅体内的放射性Cs的生物浓度因子,且估算了福岛核电站事故前的鲯鳅中的137Cs水平,研究显示3种放射性核素在鲯鳅中的放射性水平随着时间的推移急剧上升随后有下降趋势。与此同时,Men等[16]采样调查了放射性核素对2012年3—6月捕获的柔鱼(Ommastrephes bartramii)、黑须唇飞鱼(Cheilopogon pinnatibarbatus)、蛇鲭(Gempylus serpens)、紫魟(Pteroplatytrygon violacea)、卵圆疣鳞鲀(Canthidermis maculatus)、小甘鲹(Seriolina nigrofasciata)、青石斑鱼(Epinephelus awoara)、蓝猪齿鱼(Choerodon azurio)、月斑眶棘鲈(Scolopsis vosmeri)和网纹东方鲀(Takifugu reticularis)等10种生物样本的放射性影响[16],主要测量了其中的人工放射性核素,研究得出134Cs含量为0~0.12 Bq·kg-1,137Cs含量为0~0.22 Bq·kg-1,110mAg为0~2.29 Bq·kg-1,90Sr为0~0.12 Bq·kg-1。在考虑内外暴露途径的情况下,内部暴露(生物自身富集)的影响大于外部暴露(外界环境影响)的影响[18]。
2.3.3 高营养级生物
对于高营养级的生物来说,放射性核素在其体内积累程度较高,可更为便利地进行研究,Men等[32]选择大青鲨作为典型物种,对2011—2018年间134Cs、137Cs以及110mAg放射性污染、时间变化、母胎转移、组织分布和辐射剂量等方面进行研究。结果表明,大青鲨体内放射性核素污染短时间内急剧上升且随着时间的推移呈现出减少的趋势,134Cs与137Cs的分布倾向于肌肉之中,110mAg则分布于肠道之中,其中134Cs、137Cs会随母体转移到胎儿中去,大青鲨体内胎儿活性活度为母体的30%,大青鲨体内核素活性活度137Cs>134Cs>110mAg,在器官中的含量分布大小为肌肉>肠道>骨骼[35]。110mAg仅在肠道中发现,放射性Cs则多分布于肌肉当中。
综上所述,在北太平洋食物链中的中高低营养级的研究都有涉及,并在各个营养级的海洋生物富集核素的能力相对复杂,主要受到二方面影响:一方面是环境因素,如温度、盐度等环境指标,以及周围整体环境的变化,另一方面则是生物之间复杂的机制,如捕食量、被捕食者对于放射性核素浓集量、捕食者对于核素的吸收、不同核素在不同生物体内的存在形式分布情况等[15,22-23]。
2.4 不同营养级生物对人工放射性核素的吸收差异
对营养级之间关系的研究,Wen等[11]讨论了大青鲨、柔鱼以及鲯鳅之间的联系与区别。研究对比134Cs、137Cs的活性活度,2011—2018年,除2011年12月外生物体内的人工放射性核素活性活度最高的为大青鲨,其次是鲯鳅、柔鱼,造成上述差异的原因主要为鱼类吸收大量周围海水来补偿渗透水损失,放射性Cs的特性类似于钾,溶解于海水中的高水平矿物质,易被鱼类吸收,而柔鱼与周围环境具有相等的渗透压,对周围海水吸收能力较差;另一种原因是在通过食物网转移的方式不同,生物体内的放射性水平与它们在食物链的等级有相对应的关系。同时Wen等[11]讨论了110mAg的活性关系,110mAg与放射性Cs在生物体内活性相反,柔鱼>鲯鳅>大青鲨,也与食物链中的等级呈现相反的关系,相关原因可能与以上原因相同。同时它们有着不同的洄游模式,因此接触的污染海水存在差异,但相关机理较为复杂[9,34,40]。对太平洋海域中的主要经济物种,Belharet等[29]利用尺寸结构食物网模型的研究中对13个物种进行数值模拟,这些物种按照营养级估计了它们在受到福岛核电站泄露之后的影响后,恢复到原来放射性水平所需的时间。首先污染主要影响较低水平的营养级,比如以浮游生物幼虫为食的生物,该层次营养级平均在事故发生后的3~4个月达到最大值,之后较高营养级(以低营养级的生物为食)在事故发生后6.5~9个月内达到最大值,这说明低营养级的鱼类物种吸收速度较快。当所有物种达到最大值之后,生物体内积累的最大值相似[29]。研究表明营养级较高物种体内积累核素要14年左右恢复到事故前的水平,不同物种所恢复的时间也存在较大差异。唐峰华等[34]在研究柔鱼时,与鲨鱼、鲯鳅等进行对比,发现放射性Cs的含量与营养级有一定的相关性,但影响因素过于复杂并未下定论[31,35]。这种趋势的不同大多是因为摄食差异,以及不同生境下的生存差异等引起的,且生物对于放射性核素的净化速率也跟生物种群之间的特异性相关。Belharet等[29]则在研究中指出放射性核素在生物体内的积累与体型大小有关,体型越大积累得越多,利用模型研究时也显示出该趋势[26,29]。该结论与其他模型模拟以及生物实验一致[37-38]。
2.5 海洋生物对核辐射的吸收剂量
目前相关研究表明,福岛核辐射对海洋生物产生影响的最保守吸收剂量率为10 μGy·h-1(符号“Gy”,为戈瑞(Gray),单位质量受照物质所吸收的平均电离辐射能量;μGy·h-1,即测量地每小时吸收辐射剂量值)[9,32,39],而在海洋生物对福岛放射性核素吸收剂量率的研究中,根据研究区域不同分为太平洋公海区域以及日本福岛核电站附近的近海海域。
在北太平洋公海海域,Men等[3,9,32]研究了西北太平洋公海海域内的柔鱼、鲯鳅和大青鲨的辐射剂量率。研究表明,它们最高辐射剂量分别为0.063 μGy·h-1、0.7 nGy·h-1和0.14 μGy·h-1,远远小于保守吸收剂量率,但限于样本采集数量以及样本个体大小,其结果可能存在较大误差,需要后续进一步研究。在日本福岛核电站附近的近海海域中,经过长期检测发现,一些站点有一定数量的物种吸收剂量率高于保守吸收剂量值,例如,在2013年2月底和3月初于福岛核电站港口入口处捕获的底栖鱼类,它们134Cs和137Cs的吸收剂量率分别在17~44 μGy·h-1、32~82 μGy·h-1之间,高于保守吸收剂量率[41]。
以上相关数据表明,公海海域内福岛放射性核素在生物体内的吸收剂量率较低,初步研究结果显示,目前不排放核废料情况下已不会对公海海洋生物产生不利影响。而日本福岛核电站近海海域,生物之间的吸收剂量率根据采样站点以及物种的不同存在巨大差异,初步判断相关核排放行为会对生物本身产生不利影响,具体影响程度都还有待进行更深入的研究。
3 结论与展望(Conclusion and foresight)
本文总结了福岛放射性核素的运输机制及分布情况,以及福岛放射性核素对海洋生物的影响研究进展,认为放射性核素对生物体的研究已证明:摄食是生物体吸收放射性核素的主要途径,生物体对放射性核素的富集情况有所不同,主要与生物体自身特性以及放射性核素的特点有关,以往的研究表明福岛放射性核素释放早期在北太平洋生物体内积累程度较高,但随着时间推移积累程度逐渐减小,但对于生物体的持续性影响研究较少。并对后续研究福岛放射性核素对海洋生物影响的未来研究提出以下几个研究方向。
(1)未来应聚焦于多物种乃至整个食物网的生物放射性核素情况分析,同时对各营养级物种之间的放射性核素转移关系进行深入探索。另外,还可聚焦于生物个体情况,如某种核素会对生物体内组织产生何种影响,对整个生物体产生何种影响,以及核素向下一代转移情况等。
(2)在相关模型研究中,放射性核素向生物体转移过程已较好地向数学模型转化。但对于核素在食物链中的转移;对海洋生物或整个生态系统长期影响的参数化进程还有待开发。因此后续研究要重视北太平洋海域的数据收集,为后续模型优化提供依据。
(3)近期日本福岛方面正在准备进行后续再次排放核废水相关事宜,这种行为将会给太平洋海域带来持续影响,未来要重新且持续对北太平洋海洋生物进行研究,因此对整个环境以及生物中放射性核素数据收集十分重要,需进一步重视。
通信作者简介:方舟(1988—),男,博士,副教授,主要研究方向为海洋生态毒理学。
[1] Povinec P P, Gera M, ![]() K, et al. Dispersion of Fukushima radionuclides in the global atmosphere and the ocean [J]. Applied Radiation and Isotopes: Including Data, Instrumentation and Methods for Use in Agriculture, Industry and Medicine, 2013, 81: 383-392
K, et al. Dispersion of Fukushima radionuclides in the global atmosphere and the ocean [J]. Applied Radiation and Isotopes: Including Data, Instrumentation and Methods for Use in Agriculture, Industry and Medicine, 2013, 81: 383-392
[2] Bailly du Bois P, Laguionie P, Boust D, et al. Estimation of marine source-term following Fukushima Dai-ichi accident [J]. Journal of Environmental Radioactivity, 2012, 114: 2-9
[3] Men W, Wang F F, Yu W, et al. Impact of the Fukushima Dai-ichi nuclear power plant accident on the neon flying squids in the Northwest Pacific from 2011 to 2018 [J]. Environmental Pollution, 2020, 264: 114647
[4] 郭皓, 杜金秋. 海洋核污染与核素迁移[J]. 海洋开发与管理, 2014, 31(7): 83-86, 95
[5] Kumamoto Y, Aoyama M, Hamajima Y, et al. Radiocesium in the western subarctic area of the North Pacific Ocean, Bering Sea, and Arctic Ocean in 2015 and 2017 [J]. Polar Science, 2019, 21: 228-232
[6] Aoyama M, Kajino M, Tanaka T Y, et al. 134Cs and 137Cs in the North Pacific Ocean derived from the March 2011 TEPCO Fukushima Dai-ichi Nuclear Power Plant accident, Japan. Part two: Estimation of 134Cs and 137Cs inventories in the North Pacific Ocean [J]. Journal of Oceanography, 2016, 72(1): 67-76
[7] 林武辉, 余克服, 杜金秋, 等. 日本福岛核废水排海情景下海洋生态环境影响与应对[J]. 科学通报, 2021, 66(35): 4500-4509
Lin W H, Yu K F, Du J Q, et al. Consequences of marine ecological environment and our preparedness for Fukushima radioactive wastewater discharge into the ocean [J]. Chinese Science Bulletin, 2021, 66(35): 4500-4509 (in Chinese)
[8] 董宇辰, 秦松, 陈柯旭, 等. 人工放射性核素在海洋鱼类中的富集、分布及放射损伤研究进展[J]. 大连海洋大学学报, 2022, 37(6): 1066-1075
Dong Y C, Qin S, Chen K X, et al. Research progress on enrichment, distribution and radiation damage of artificial radionuclides in marine fish: A review [J]. Journal of Dalian Ocean University, 2022, 37(6): 1066-1075 (in Chinese)
[9] Men W, Wang F F, Yu W, et al. Impact of the Fukushima Dai-ichi nuclear power plant accident on dolphin fishes in the Northwest Pacific [J]. Chemosphere, 2020, 257: 127267
[10] Vives I Batlle J, Aoyama M, Bradshaw C, et al. Marine radioecology after the Fukushima Dai-ichi nuclear accident: Are we better positioned to understand the impact of radionuclides in marine ecosystems? [J]. The Science of the Total Environment, 2018, 618: 80-92
[11] Wen Y, Johansen M, Jianhua H, et al. Artificial radionuclides in neon flying squid from the northwestern Pacific in 2011 following the Fukushima accident [J]. Biogeosciences, 2018, 15(23): 7235-7242
[12] Wang F F, Men W, Huang J, et al. Fukushima-derived radiocesium in the waters of the Northwest Pacific Ocean in the winter of 2011 [J]. Marine Pollution Bulletin, 2022, 176: 113465
[13] Kumamoto Y, Aoyama M, Hamajima Y, et al. Time evolution of Fukushima-derived radiocesium in the western subtropical gyre of the North Pacific Ocean by 2017 [J]. Journal of Radioanalytical and Nuclear Chemistry, 2018, 318(3): 2181-2187
[14] Kaeriyama H. Oceanic dispersion of Fukushima-derived radioactive cesium: A review [J]. Fisheries Oceanography, 2017, 26(2): 99-113
[15] Kim S H, Lee H, Lee S H, et al. Distribution and accumulation of artificial radionuclides in marine products around Korean Peninsula [J]. Marine Pollution Bulletin, 2019, 146: 521-531
[16] Men W, Deng F F, He J H, et al. Radioactive impacts on nekton species in the Northwest Pacific and humans more than one year after the Fukushima nuclear accident [J]. Ecotoxicology and Environmental Safety, 2017, 144: 601-610
[17] Men W. Discharge of contaminated water from the Fukushima Daiichi Nuclear Power Plant Accident into the Northwest Pacific: What is known and what needs to be known [J]. Marine Pollution Bulletin, 2021, 173: 112984
[18] Fisher N S, Beaugelin-Seiller K, Hinton T G, et al. Evaluation of radiation doses and associated risk from the Fukushima nuclear accident to marine biota and human consumers of seafood [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(26): 10670-10675
[19] Aoyama M, Tsumune D, Hamajima Y. Distribution of 137Cs and 134Cs in the North Pacific Ocean: Impacts of the TEPCO Fukushima-Daiichi NPP accident [J]. Journal of Radioanalytical and Nuclear Chemistry, 2013, 296(1): 535-539
[20] Fakhri Y, Mahmudiono T, Ranaei V, et al. The concentration of radionuclides (lead-210, polonium-210, and cesium-137) in the muscle of sardine fish: A global systematic review, meta-analysis, and exposure assessment [J]. Biological Trace Element Research, 2023, 201(4): 2011-2021
[21] Kaeriyama H, Fujimoto K, Ambe D, et al. Fukushima-derived radionuclides 134Cs and 137Cs in zooplankton and seawater samples collected off the Joban-Sanriku coast, in Sendai Bay, and in the Oyashio region [J]. Fisheries Science, 2015, 81(1): 139-153
[22] Madigan D J, Baumann Z, Snodgrass O E, et al. Assessing Fukushima-derived radiocesium in migratory Pacific predators [J]. Environmental Science &Technology, 2017, 51(16): 8962-8971
[23] Fakhri Y, Sarafraz M, Pilevar Z, et al. The concentration and health risk assessment of radionuclides in the muscle of tuna fish: A worldwide systematic review and meta-analysis [J]. Chemosphere, 2022, 289: 133149
[24] Huang D K, Lin J, Du J Z, et al. The detection of Fukushima-derived radiocesium in the Bering Sea and Arctic Ocean six years after the nuclear accident [J]. Environmental Pollution, 2020, 256: 113386
[25] Nakano M, Povinec P P. Long-term simulations of the 137Cs dispersion from the Fukushima accident in the world ocean [J]. Journal of Environmental Radioactivity, 2012, 111: 109-115
[26] Tateda Y, Tsumune D, Tsubono T, et al. Radiocesium biokinetics in olive flounder inhabiting the Fukushima accident-affected Pacific coastal waters of eastern Japan [J]. Journal of Environmental Radioactivity, 2015, 147: 130-141
[27] Deng F F, Lin F, Yu W, et al. The distributions of 134Cs, 137Cs and 90Sr in the Northwest Pacific seawater in the winter of 2012 [J]. Marine Pollution Bulletin, 2020, 152: 110900
[28] 苏柯, 肖璋, 孔令丰, 等. 核电站液态排放中放射性核素从海水转移到海洋生物的数值模拟[J]. 太原理工大学学报, 2005, 36(3): 374-377
Su K, Xiao Z, Kong L F, et al. The numerical simulation for the transfer of radionuclide from the liquid releases of nuclear power station to aquatic biology [J]. Journal of Taiyuan University of Technology, 2005, 36(3): 374-377 (in Chinese)
[29] Belharet M, Charmasson S, Tsumune D, et al. Numerical modelling of 137Cs content in the pelagic species of the Japanese Pacific coast following the Fukushima Dai-ichi Nuclear Power Plant accident using a size-structured food-web model [J]. PLoS One, 2019, 14(3): e0212616
[30] de With G, Bezhenar R, Maderich V, et al. Development of a dynamic food chain model for assessment of the radiological impact from radioactive releases to the aquatic environment [J]. Journal of Environmental Radioactivity, 2021, 233: 106615
[31] Periá ez R, Qiao F L, Zhao C, et al. Opening Fukushima floodgates: Modelling 137Cs impact in marine biota [J]. Marine Pollution Bulletin, 2021, 170: 112645
ez R, Qiao F L, Zhao C, et al. Opening Fukushima floodgates: Modelling 137Cs impact in marine biota [J]. Marine Pollution Bulletin, 2021, 170: 112645
[32] Men W, Wang F F, Yu W, et al. Radioactive impacts of the Fukushima Dai-ichi Nuclear Power Plant Accident on blue sharks in the Northwest Pacific [J]. Chemosphere, 2021, 285: 131537
[33] Beresford N A. The transfer of radionuclides to wildlife [J]. Radiation and Environmental Biophysics, 2010, 49(4): 505-508
[34] 唐峰华, 张胜茂, 吴祖立, 等. 核素137Cs在北太平洋典型生物体内的分布与富集[J]. 生态环境学报, 2016, 25(10): 1684-1692
Tang F H, Zhang S M, Wu Z L, et al. Enrichment and distribution of nuclide 137Cs in typical organisms of North Pacific [J]. Ecology and Environmental Sciences, 2016, 25(10): 1684-1692 (in Chinese)
[35] 蔡福龙, 陈英, 许丕安, 等. 放射性核素的生物指示物及其监测方法研究[J]. 海洋通报, 1993, 12(3): 56-60
Cai F L, Chen Y, Xu P A, et al. Study on bioindicator and monitoring method of radionuclides [J]. Marine Science Bulletin, 1993, 12(3): 56-60 (in Chinese)
[36] Strady E, Harmelin-Vivien M, Chiffoleau J F, et al. 210Po and 210Pb trophic transfer within the phytoplankton-zooplankton-anchovy/sardine food web: A case study from the Gulf of Lion (NW Mediterranean Sea) [J]. Journal of Environmental Radioactivity, 2015, 143: 141-151
[37] Lu Y L, Yuan J J, Du D, et al. Monitoring long-term ecological impacts from release of Fukushima radiation water into ocean [J]. Geography and Sustainability, 2021, 2(2): 95-98
[38] Uddin S, Fowler S W, Behbehani M, et al. 210Po bioaccumulation and trophic transfer in marine food chains in the northern Arabian Gulf [J]. Journal of Environmental Radioactivity, 2017, 174: 23-29
[39] Kitamura M, Honda M C, Hamajima Y, et al. Temporal changes in radiocesium contamination derived from the Fukushima Dai-ichi Nuclear Power Plant accident in oceanic zooplankton in the western North Pacific [J]. Journal of Environmental Radioactivity, 2017, 172: 163-172
[40] 唐峰华, 张胜茂, 崔雪森, 等. 2013年北太平洋公海渔场柔鱼体内典型放射性核素分析及风险评估[J]. 应用生态学报, 2017, 28(9): 3071-3077
Tang F H, Zhang S M, Cui X S, et al. Analysis of the typical radionuclides for neon flying squid of the high seas fisheries in North Pacific Ocean and risk assessment in 2013 [J]. Chinese Journal of Applied Ecology, 2017, 28(9): 3071-3077 (in Chinese)
[41] Vives I Batlle J, Aono T, Brown J E, et al. The impact of the Fukushima nuclear accident on marine biota: Retrospective assessment of the first year and perspectives [J]. The Science of the Total Environment, 2014, 487: 143-153