四氯双酚A(tetrachlorobisphenol A, TCBPA)作为四溴双酚A(tetrabromobisphenol A,TBBPA)的替代品近年来被广泛使用,全球年产量高达10 000 t[1]。TCBPA主要是添加到建材、涂料、合成纤维纺织品、塑料制品、电路板和电子设备中用作阻燃剂,在相关产品的生产和使用过程中释放到环境中,而且由于TCBPA在环境介质中可以持久存在并且具有很强的疏水性,所以其在环境中被频繁检出,对环境中各种生物体包括人类产生极大的影响[2-3]。有研究报道在加拿大某工厂的废水处理污泥中发现TCBPA浓度为0.14~0.54 ng·g-1;日本静冈县造纸工厂的废水中检测到TCBPA的浓度可达2 μg·L-1 [4]。在我国北京某电子垃圾处理设施附近河流中也检测到TCBPA的存在,其中沉积物和水体中检测到TCBPA的浓度为分别为542.6 ng·g-1和224 ng·L-1 [5]。由于在自来水氯消毒过程中双酚A会转化成TCBPA,来自全国31个城市的自来水样品检测结果显示,TCBPA的平均浓度为4.9 ng·L-1 [6]。上述的环境监测数据表明,随着TCBPA使用量的增加,其环境污染状况日益严峻。
TCBPA的分子结构与甲状腺激素相似,其进入生物体后会干扰甲状腺内分泌系统的稳态[7]。研究发现0~1 000 nmol·L-1的TCBPA会引起非洲爪蛙中甲状腺激素相关基因和蛋白表达的显著改变[8]。斑马鱼在分子信号传导过程、遗传成分、组织器官结构以及神经发育方面与其他高阶脊椎动物具有同源性[9]。有研究发现,基于斑马鱼胚胎/幼鱼的半致死浓度TCBPA的毒性高于TBBPA,并且>1.0 mg·L-1的TCBPA暴露会造成发育毒性,降低胚胎孵化率并且会引起幼鱼卵黄囊和心包囊水肿[10]。对于鱼类而言,运动行为被认为是一个涉及多器官协调的综合终点,所以游泳速度可作为反映幼鱼发育缺陷和生存能力的敏感指标[11-12]。但是目前针对TCBPA对斑马鱼运动行为的影响及机制的研究还十分有限,尤其是对早期发育阶段的鱼类。
在鱼类的生命周期中,发育中的胚胎和幼鱼通常被认为是最易感的阶段,对水生环境中的污染物尤其敏感。当受到环境污染胁迫时运动行为发生改变,运动行为的影响被认为是污染物暴露后诱发的发育神经毒性一个重要的生物学标志[13-14]。因此本研究以斑马鱼胚胎为暴露模型,通过暴露于0、2、20和200 μg·L-1的TCBPA中,测定斑马鱼幼鱼死亡率、孵化率、畸形率以及光暗刺激下的运动行为,评估TCBPA对于斑马鱼幼鱼发育的影响;通过分析幼鱼吖啶橙(AO)染色情况、氧化产物丙二醛(malonic dialdehyde, MDA)、抗氧化酶超氧化物歧化酶(superoxide dismutase, SOD)、神经递质多巴胺(dopamine, DA)含量以及DA合成关键基因的转录等探究TCBPA对于斑马鱼幼鱼神经发育毒性的分子机制,识别TCBPA的危害特征,为评估TCBPA潜在环境危害和健康风险提供基础数据。
1 材料与方法(Materials and methods)
1.1 仪器和试剂
主要仪器:体式显微镜(SZ680,重庆奥特光学仪器有限责任公司,中国),Zebrabox行为测试(View Point Life Science,法国),荧光定量PCR仪(QuantStuadio7 Flex, Thermo Fisher Scientific),体式荧光显微镜(SMZ25, Nikon,日本),恒温光照培养箱(上海一恒科学仪器有限公司,上海,中国)。
主要试剂:TCBPA标准品(纯度>98%,东京TCI公司,日本),二甲基亚砜(dimethyl sulfoxide, DMSO;>99%;上海安普实验科技有限公司,中国),超氧化物歧化酶、丙二醛试剂盒(上海碧云天生物技术有限公司,中国)、多巴胺ELISA试剂盒(武汉伊艾博科技股份有限公司,中国)。
1.2 斑马鱼的饲养及胚胎毒性试验
产卵所用的4月龄野生型AB系斑马鱼(Brachydanio rerio)购自中国科学院武汉水生生物研究所,养殖在(28±0.5) ℃下的标准循环水系统中,循环水的pH为7.2~7.6,养殖房光暗周期为14 h∶10 h。用盐水孵化的丰年虫,每天投喂斑马鱼3次。实验前一天晚上挑选健康的性成熟斑马鱼雌鱼和雄鱼(雌雄比为3∶2)置于产卵盒中用中间隔板将雄雌分开,置于恒温室的环境中过夜。第2天早上开灯光照刺激后将中间隔板取出,雄鱼开始追逐雌鱼,在此过程雌鱼开始产卵,待交配结束后收集所产胚胎。在显微镜下选取发育正常并达到囊胚期的受精卵,用E3胚胎培养液[15](0.2 mmol·L-1 CaCl2、0.13 mmol·L-1 MgSO4、19.3 mmol·L-1 NaCl、0.23 mmol·L-1 KCl和0.003 mmol·L-1亚甲基蓝)冲洗3次后,用做后续TCBPA染毒暴露实验。
先前有研究报道斑马鱼胚胎暴露于TCBPA 120 h半致死浓度(LC50)为0.628 mg·L-1 [16],在本实验中选择TCBPA的暴露浓度根据实际环境中存在的TCBPA浓度(2 μg·L-1)[4]以及TCBPA 120 h LC50的1/30和1/3将暴露浓度设置为0、2、20和200 μg·L-1。将TCBPA固体粉末溶于DMSO中配制成母液,梯度稀释后加入到E3胚胎培养液中,配制成0、2、20和200 μg·L-1 TCBPA暴露液(暴露液中DMSO的浓度为0.01%)。每个组设置3个平行培养皿,每个培养皿中加入250 mL的暴露液和300颗胚。培养皿置于恒温培养箱中,培养温度和光暗周期的设置与养殖房一致。在暴露过程中每天更换暴露液,每天观察并及时将死卵/幼鱼挑出,统计胚胎/幼鱼的死亡数量、成功孵化幼鱼数量、幼鱼畸形数量。暴露120 h后计算每个组的死亡率、孵化率、畸形率且收集幼鱼样品,通过液氮速冻后保存于-80 ℃的冰箱,用MDA、DA含量的测定、SOD活性以及基因表达分析。在本研究中,所有涉及斑马鱼的实验规范均参考经济合作与发展组织(OECD)化学品测试指南TG 212《鱼类胚胎-卵黄囊吸收阶段的短期毒性试验》[17]。
1.3 斑马鱼幼鱼运动行为分析
为评价TCBPA对斑马鱼幼鱼运动行为的影响,参考先前报道的方法[15],利用ZebraLab视频跟踪系统监测120 hpf幼鱼的游泳速度。每个组随机挑选24条发育正常的幼鱼转移到24孔板中进行行为测试,幼鱼测试前在黑暗环境中适应0.5 h。为了减少昼夜节律对幼鱼运动行为监测的干扰,本研究幼鱼的行为监测选择的时间为下午(13:00—17:00),在光照和黑暗光周期刺激(10 min光照/10 min黑暗/10 min光照)下监测其运动行为,通过运动距离计算获得幼鱼的幼鱼速度。
1.4 细胞凋亡检测(AO染色)
暴露120 h后,从每个浓度组中随机选取12条幼鱼,用E3胚胎培养液清洗2~3次,每次5 min,然后用5 μg·mL-1 AO溶液在室温避光的条件下染色30 min,染色完用E3胚胎培养液清洗3次,每次5 min。最后使用0.03% MS-222将幼鱼麻醉,用体式荧光显微镜观察幼鱼头部荧光情况,对细胞凋亡状况进行评估,绿色荧光的定量使用ImageJ。
1.5 MDA含量和SOD活性测定
每个暴露组3个平行培养皿,每个培养皿取50条鱼混合作为一个样品处理,每个组包含3个平行样品。每个平行培养皿取约50条幼鱼于1.5 mL离心管中,麻醉后吸干水分称量。按照1∶9(质量∶体积)比例加入预冷的生理盐水进行匀浆,随后低温冷冻离心10 min(5 000×g,4 ℃)。取上清液,参照SOD活性检测试剂盒和MDA测定试剂盒说明书进行检测。
1.6 DA含量的检测
每个暴露组3个平行培养皿,每个培养皿取100条鱼混合作为一个样品处理,每个组包含3个平行样品。每个平行培养皿取约100条幼鱼于1.5 mL离心管中,按照1∶9(质量∶体积)加入预冷的生理盐水和1 mmol·L-1苯甲基磺酰氟(PMSF)进行匀浆,随后冷冻离心10 min(5 000×g,4 ℃)。取上清液,按照多巴胺ELISA试剂盒的说明书进行检测。
1.7 基因表达分析
每个暴露组有3个平行培养皿,每个培养皿取30条鱼混合作为一个样品处理,每个组有3个平行样品。暴露120 h后,每个平行培养皿取30条幼鱼用做基因表达分析。总RNA的提取、反转录cDNA的合成和qRT-PCR参照我们之前的方法[15]。内参基因的选择是根据TCBPA暴露后的幼鱼样品对β-actin和GAPDH这2个内参基因进行预实验后发现β-actin的表达更加稳定,因此选择β-actin作为内参基因。所研究基因的引物序列如表1所示。
表1 本研究中目标基因和引物序列
Table 1 Genes and primers used in this study
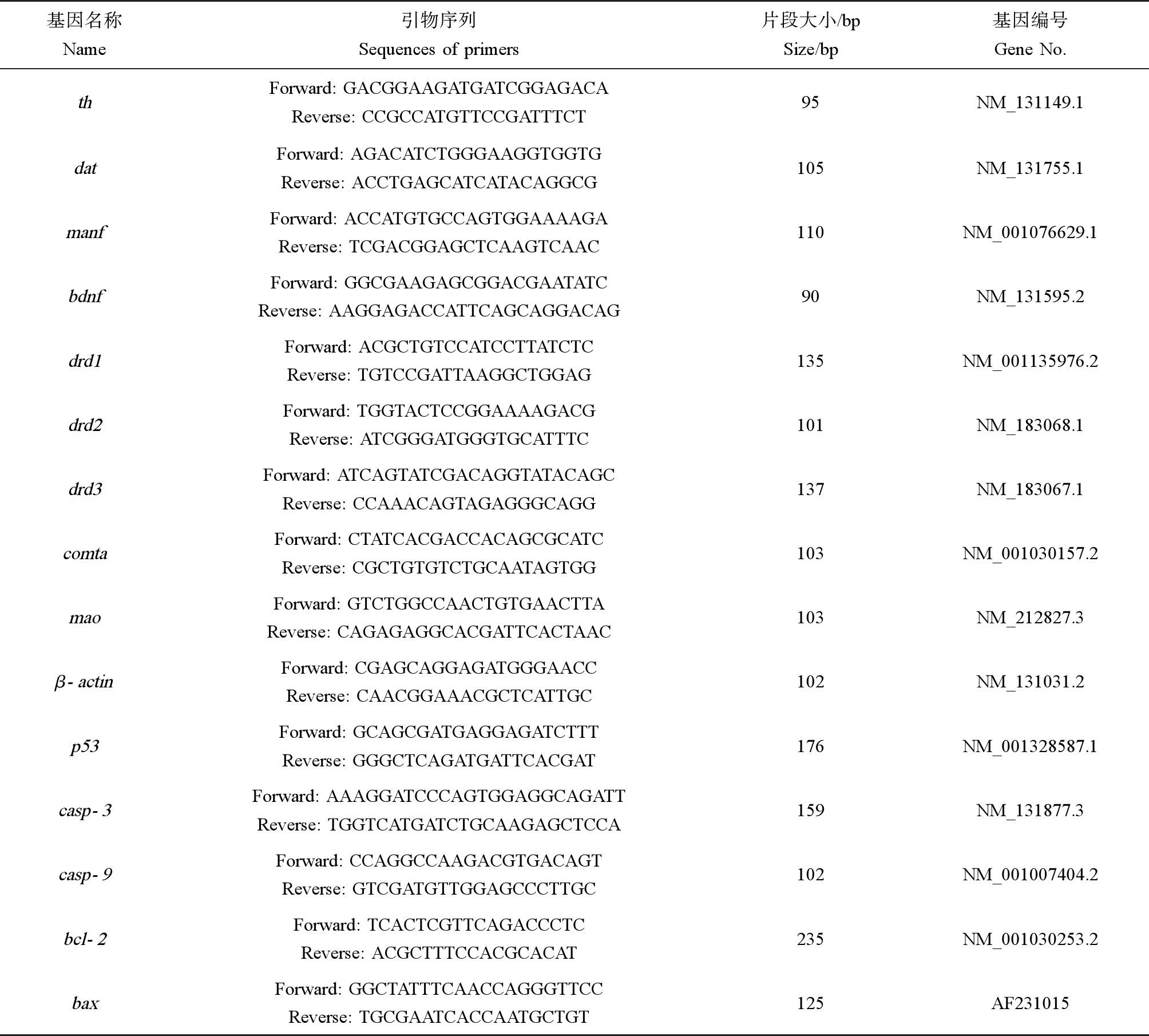
基因名称Name引物序列Sequences of primers片段大小/bpSize/bp基因编号Gene No.thForward: GACGGAAGATGATCGGAGACAReverse: CCGCCATGTTCCGATTTCT95NM_131149.1datForward: AGACATCTGGGAAGGTGGTGReverse: ACCTGAGCATCATACAGGCG105NM_131755.1manfForward: ACCATGTGCCAGTGGAAAAGAReverse: TCGACGGAGCTCAAGTCAAC 110NM_001076629.1bdnfForward: GGCGAAGAGCGGACGAATATCReverse: AAGGAGACCATTCAGCAGGACAG90NM_131595.2drd1Forward: ACGCTGTCCATCCTTATCTCReverse: TGTCCGATTAAGGCTGGAG135NM_001135976.2drd2Forward: TGGTACTCCGGAAAAGACG Reverse: ATCGGGATGGGTGCATTTC101NM_183068.1drd3Forward: ATCAGTATCGACAGGTATACAGC Reverse: CCAAACAGTAGAGGGCAGG137NM_183067.1comtaForward: CTATCACGACCACAGCGCATCReverse: CGCTGTGTCTGCAATAGTGG103NM_001030157.2maoForward: GTCTGGCCAACTGTGAACTTAReverse: CAGAGAGGCACGATTCACTAAC103NM_212827.3β-actinForward: CGAGCAGGAGATGGGAACCReverse: CAACGGAAACGCTCATTGC102NM_131031.2p53Forward: GCAGCGATGAGGAGATCTTTReverse: GGGCTCAGATGATTCACGAT176NM_001328587.1casp-3Forward: AAAGGATCCCAGTGGAGGCAGATT Reverse: TGGTCATGATCTGCAAGAGCTCCA159NM_131877.3casp-9Forward: CCAGGCCAAGACGTGACAGT Reverse: GTCGATGTTGGAGCCCTTGC102NM_001007404.2bcl-2Forward: TCACTCGTTCAGACCCTCReverse: ACGCTTTCCACGCACAT235NM_001030253.2baxForward: GGCTATTTCAACCAGGGTTCCReverse: TGCGAATCACCAATGCTGT125AF231015
1.8 数据分析
实验数据采用IBM SPSS18.0软件进行处理。以Kolmogorov-Smirnow方法进行正态性检验,然后以Levene’s方法进行方差齐性检验。满足假设后采用单因素方差(ANOVA)中Tukey分析暴露组和溶剂对照组之间的显著性差异。数据结果表示为平均值±标准差。P<0.05代表具有显著性差异。
2 结果(Results)
2.1 TCBPA暴露对幼鱼的发育毒性
TCBPA暴露对斑马鱼胚胎的孵化率、存活率和畸形率的影响如表2所示,与对照组相比较,在200 μg·L-1暴露组幼鱼的畸形率显著增加(P<0.05),幼鱼畸形的类型包含心包囊水肿、躯干弯曲,如图1所示,但是对斑马鱼的胚胎孵化率和幼鱼的死亡率没有显著的影响。

图1 斑马鱼幼鱼暴露于TCBPA的形态学特征(心包囊水肿、躯干弯曲)
Fig. 1 Morphology of zebrafish larvae exposed to TCBPA (pericardial sac edema, abnormal body axes)
表2 四氯双酚A(TCBPA)对斑马鱼幼鱼发育终点指标(死亡率、孵化率和畸形率)的影响
Table 2 Effects of tetrachlorobisphenol A (TCBPA) on developmental endpoints indicators (mortality rate, hatching rate and malformation) of zebrafish larvae
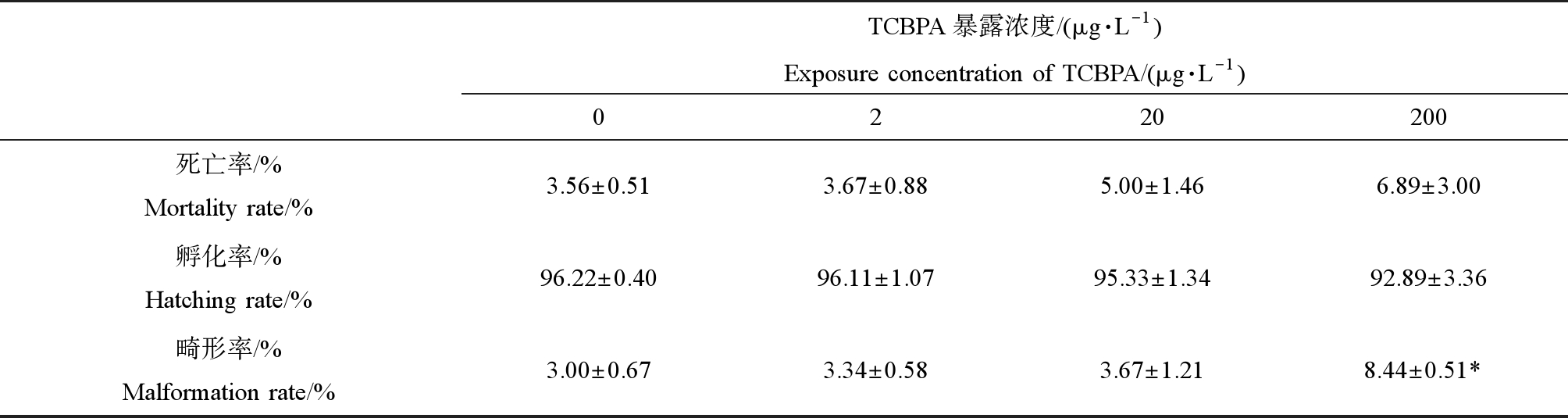
注:每个浓度组包含3个平行;*P<0.05表示对照组和暴露组有显著性差异。
Note: Each concentration was tested using three replicates; significant differences between the exposed larvae and the control group, *P<0.05.
TCBPA暴露浓度/(μg·L-1)Exposure concentration of TCBPA/(μg·L-1)0220200死亡率/% Mortality rate/%3.56±0.513.67±0.885.00±1.466.89±3.00孵化率/% Hatching rate/%96.22±0.4096.11±1.0795.33±1.3492.89±3.36畸形率/% Malformation rate/%3.00±0.673.34±0.583.67±1.218.44±0.51*
2.2 TCBPA对幼鱼运动行为的影响
暴露120 h后,最高浓度组不管是在光照还是黑暗条件下幼鱼的游泳速度均低于对照组(图2),200 μg·L-1 TCBPA浓度组中斑马鱼幼鱼的游泳速度和对照组相比显著性降低(P<0.05)。

图2 斑马鱼幼鱼暴露于TCBPA 120 hpf的游泳速度
注:(a)表示每10 min平均速度,(b)表示每分钟运动速度;每个暴露组检测24条幼鱼;*P<0.05表示对照组和暴露组有显著性差异。
Fig. 2 The swimming speed of zebrafish larvae exposed to TCBPA for 120 hpf
Note: (a) Average swimming speed during every 10 minutes and (b) the speed of movement in every minute; each exposure group was detected using 24 larvae; significant differences between the exposed zebrafish larvae and the control group *P<0.05.
2.3 TCBPA暴露对幼鱼脑细胞调亡的影响
与对照组相比较,斑马鱼幼鱼头部的荧光强度在200 μg·L-1 TCBPA组显著性增加,表明TCBPA诱导幼鱼脑细胞的凋亡(图3)。

图3 TCBPA暴露诱导斑马鱼幼鱼头部细胞的调亡
注:(a) 表示头部绿色荧光强度,(b) 表示量化后的绿色荧光;每个暴露组包含12个平行;* P<0.05表示对照组和暴露组有显著性差异。
Fig. 3 TCBPA-induced cell apoptosis in zebrafish larvae brain
Note: (a) Green  uorescence in zebrafish larvae brain and (b) statistic of
uorescence in zebrafish larvae brain and (b) statistic of  uorescence; each exposure group was tested using 12 larvae; significant differences between the exposed larvae and the control group *P<0.05.
uorescence; each exposure group was tested using 12 larvae; significant differences between the exposed larvae and the control group *P<0.05.
2.4 TCBPA对MDA含量以及SOD活力的影响
与对照组相比较,200 μg·L-1 TCBPA浓度组中幼鱼的MDA含量和SOD活性没有显著性改变(图4)。

图4 TCBPA暴露对斑马鱼幼鱼MDA(a)含量和SOD(b)活性的影响
注:每个浓度组包含3个生物学重复。
Fig. 4 Effects of TCBPA exposure on MDA (a) content and SOD (b) activity in larvae zebrafish
Note: Each exposure group was performed using three replicates.
2.5 TCBPA暴露对多巴胺含量的影响
与对照相比较,200 μg·L-1 TCBPA浓度组中斑马鱼幼鱼的多巴胺含量显著性降低(P<0.05)(图5)。
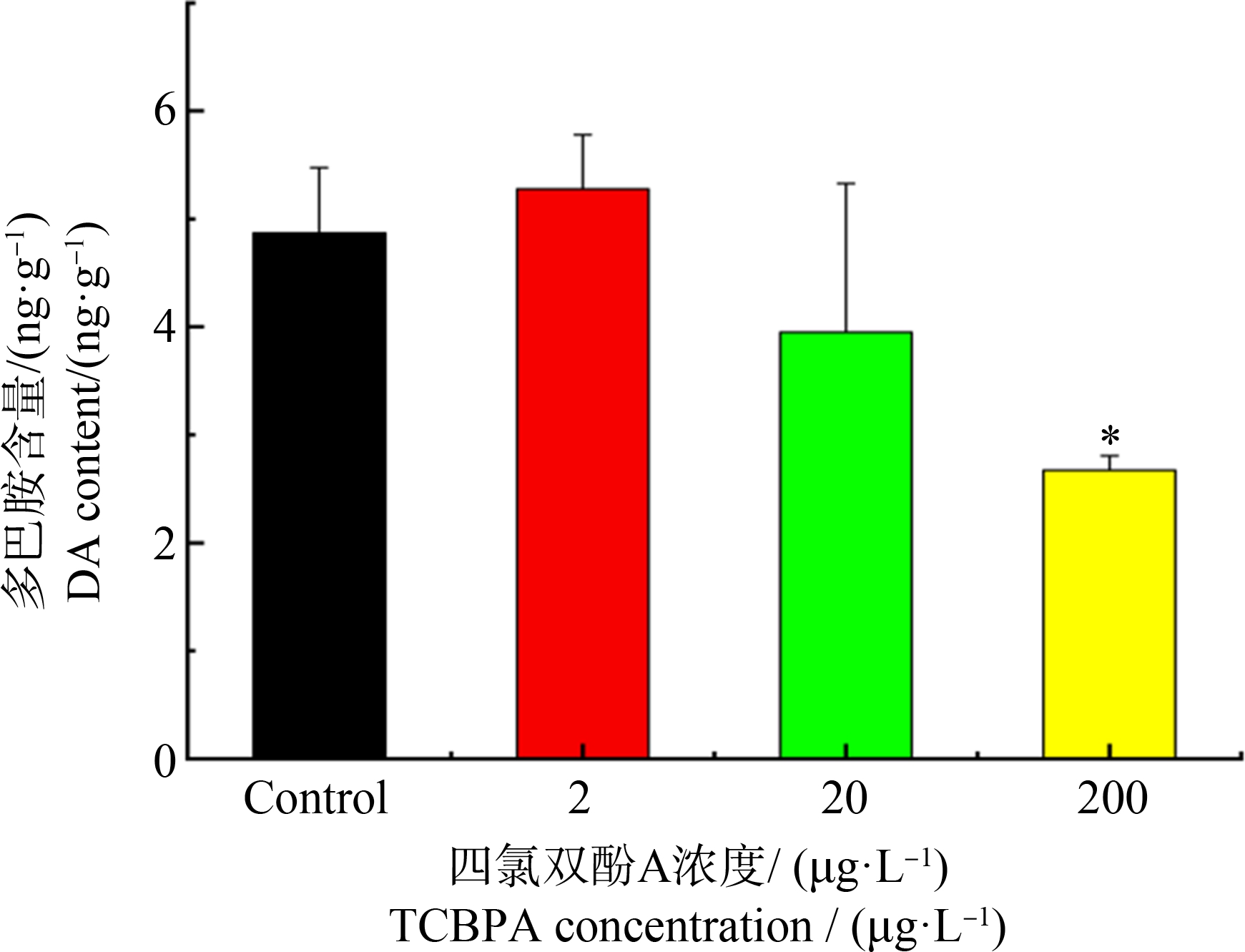
图5 TCBPA暴露对斑马鱼幼鱼多巴胺(DA)含量的影响
注:每个浓度组包含3个生物学重复;*P<0.05表示对照组和暴露组有显著性差异。
Fig. 5 Effect of TCBPA exposure on dopamine (DA) content in larvae zebrafish
Note: Each exposure group was performed using three replicates; significant differences between the exposed larvae and the control group *P<0.05.
2.6 TCBPA暴露对多巴胺相关基因的影响
与对照组相比较,TCBPA暴露引起脑神经元营养因子(bdnf)、酪氨酸羟化酶(th)、多巴胺转运体(dat)、儿茶酚-O-甲基转移酶(comta)和多巴胺受体(drd1和drd2)显著降低(P<0.05)。然而,TCBPA暴露引起中脑星形胶质细胞源性神经营养因子(manf)显著升高(P<0.05)(图6(a)和6(b))。与对照组相比较,细胞凋亡相关的基因p53和bax显著增高(图6(c))。

图6 TCBPA暴露对多巴胺相关基因(a)、(b)和细胞凋亡(c)相关基因表达的影响
注:每个浓度组包含3个生物学重复;*P<0.05、**P<0.01表示对照组和暴露组有显著性差异。
Fig. 6 Expression of genes involved in the dopamine system (a), (b) and cell apoptosis (c) in zebrafish larvae exposed to TCBPA
Note: Each concentration was tested using 3 replicates; significant differences between the exposed zebrafish larvae and the control group *P<0.05, **P<0.01.
3 讨论(Discussion)
TCBPA被报道在环境和生物介质中高频检出,但TCBPA对鱼类运动行为影响的研究甚少,并且对于如何引起相关毒性的作用机制较少涉及。在本研究中,统计了暴露于0、2、20和200 μg·L-1 TCBPA后120 h斑马鱼幼鱼的发育终点指标。实验结果表明,暴露于200 μg·L-1 TCBPA没有显著影响幼鱼的死亡率和孵化率,但幼鱼的畸形率显著升高。同时通过监测幼鱼运动行为,发现在最高浓度暴露可以显著降低幼鱼的游泳速度。运动行为是一个涉及多器官协调的综合发育终点指标,可以反映幼鱼的发育缺陷和生存能力[12]。类似的对斑马鱼幼鱼运动行为的影响在四溴双酚A和四溴双酚S上也被报道过[18-19]。因此,我们的研究发现TCBPA可以增加畸形率并且影响鱼类的运动行为,证实其对鱼类的生态危害。
氧化产物MDA是细胞膜中不饱和脂肪酸与自由基之间反应的产物,是评价生物体脂质过氧化的重要指标[20],其过量产生是由于脂质产生过量的氧化应激产物与机体抗氧化能力失衡导致的。在正常的生理状态下,MDA可以被抗氧化防御系统有效清除,污染物暴露可以导致机体产生MDA,引起氧化应激。抗氧化酶SOD是超氧化物歧化酶,可以将超氧自由基转化为过氧化氢,是抗氧化系统中的第一道防御屏障。本研究中幼鱼体内MDA和SOD均没有发生显著性改变。
细胞凋亡是一种基因编码的细胞程序性死亡,凋亡可以通过有针对性地消除单个细胞而实现组织内稳态,而不会破坏组织的生物功能[21]。但是环境污染物会导致恶性的细胞凋亡进而损害机体。本研究通过AO染色发现,200 μg·L-1 TCBPA导致斑马鱼幼鱼头部出现细胞凋亡的现象,其可能损害了神经系统,进而影响斑马鱼的运动行为。进一步对细胞凋亡的相关基因进行分析发现,Bax和p53的基因表达在最高暴露组显著上调。p53是一种肿瘤抑制基因,在细胞凋亡、DNA修复和肿瘤抑制途径中作为转录反式激活因子发挥作用,p53-bax-bcl2被认为是经典的细胞凋亡途径[22]。p53可以上调bax的表达水平,以及下调bcl-2的表达共同完成促进细胞凋亡作用,其中bcl-2可阻止凋亡形成因子如细胞色素c等从线粒体释放出来,具有抗凋亡作用,而bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素c的释放,具有凋亡作用[23]。因此推测TCBPA的暴露上调了幼鱼体内p53和bax的基因表达,促进了幼鱼头部细胞的凋亡,损伤了神经系统进而导致幼鱼速度降低。
运动行为本身是神经元信号传导的结果[24],为了进一步揭示TCBPA诱导神经行为的分子机制,分析了幼鱼体内多巴胺含量的变化。多巴胺是有机体控制运动的一种必需儿茶酚胺神经递质,在控制运动、认知以及动机上起到关键作用,尤其是发育早期的多巴胺在神经元发育等方面起着至关重要的作用[25]。多巴胺通路主要负责体内多巴胺的合成、转运、代谢等,其受到影响必然会导致神经递质多巴胺在体内发挥功能受到影响。多巴胺的生物合成是由酪氨酸羟化酶(th)转化酪氨酸而来,然后由儿茶酚氧甲基转移酶(comta)和单胺氧化酶(mao)代谢[15]。在本研究中,我们发现TCBPA导致斑马鱼幼鱼游泳速度降低并且伴随着体内多巴胺含量显著降低,进一步分析了斑马鱼幼鱼体内多巴胺信号通路相关的基因表达,发现TCBPA暴露引起th表达量降低,这可能是导致幼鱼体内多巴胺含量降低的直接原因。多巴胺含量的降低,直接导致了多巴胺转运体(dat)、单胺氧化酶(mao)、多巴胺受体drd1和drd2表达量降低。bdnf是一种神经营养蛋白,调节神经干细胞向功能性神经元(如多巴胺能神经元)的分化[26]。在本研究中,TCBPA暴露引起bdnf表达量降低,可能导致幼鱼脑内多巴胺能神经元的降低。manf是表达在神经元中的分泌蛋白,在调节和维持多巴胺能神经元细胞中起重要作用[27]。在本研究中,TCBPA暴露引起manf表达量升高,可能是由于多巴胺能神经元下降的一种代偿机制。
综上所述,斑马鱼早期发育暴露于TCBPA会导致幼鱼游泳速度降低,其可能是通过诱导头部细胞凋亡,降低幼鱼体内多巴胺含量并且干扰多巴胺信号通路关键基因转录从而造成的发育神经毒性。本研究的实验结果表明,TCBPA对斑马鱼胚胎具有明显的发育毒性和神经毒性,因此,应谨慎考虑TCBPA作为TBBPA的替代品。水环境中TCBPA的存在可能对水生生物具有一定的风险,本研究的相关结果可以增强对TCBPA致毒机制的理解,识别TCBPA对水生生物的危害,为评估TCBPA潜在环境危害和健康风险提供基础数据。
通信作者简介:于云江(1964—),男,博士,研究员,主要研究方向为环境与健康。
共同通信作者简介:李廷真(1978—),男,博士,教授,主要研究方向为环境化学与风险评估。
[1] Huang Q, Liu W, Peng P A, et al. Reductive dechlorination of tetrachlorobisphenol A by Pd/Fe bimetallic catalysts [J]. Journal of Hazardous Materials, 2013, 262: 634-641
[2] 杜琼霞. 典型双酚A类污染物对黑斑蛙蝌蚪发育及成蛙雄性生殖毒效应机理的研究[D]. 杭州: 杭州师范大学, 2019: 1-6
Du Q X. Study of the development of Rana nigromaculata tadpoles and mechanism of reproductive toxicity of male Rana nigromaculata by bisphenol A pollutants [D]. Hangzhou: Hangzhou Normal University, 2019: 1-6 (in Chinese)
[3] 刘舒巍. SBBR和人工湿地组合工艺的优化及对含TCBPA污水的处理研究[D]. 北京: 北京化工大学, 2017: 2-6
Liu S W. Removal effect of tetrachlorobisphenol-A in a combined process of SBBR and CW [D]. Beijing: Beijing University of Chemical Technology, 2017: 2-6 (in Chinese)
[4] Song S J, Song M Y, Zeng L Z, et al. Occurrence and profiles of bisphenol analogues in municipal sewage sludge in China [J]. Environmental Pollution, 2014, 186: 14-19
[5] Yuan S Y, Chen S J, Chang B V. Anaerobic degradation of tetrachlorobisphenol-A in river sediment [J]. International Biodeterioration &Biodegradation, 2011, 65(1): 185-190
[6] Fan Z L, Hu J Y, An W, et al. Detection and occurrence of chlorinated byproducts of bisphenol A, nonylphenol, and estrogens in drinking water of China: Comparison to the parent compounds [J]. Environmental Science &Technology, 2013, 47(19): 10841-10850
[7] Kitamura S, Jinno N, Ohta S, et al. Thyroid hormonal activity of the flame retardants tetrabromobisphenol A and tetrachlorobisphenol A [J]. Biochemical and Biophysical Research Communications, 2002, 293(1): 554-559
[8] 周佳奇. 四溴双酚A和四氯双酚A对非洲爪蛙甲状腺激素信号及下丘脑—垂体—甲状腺轴的干扰作用[D]. 昆明: 云南大学, 2018: 12-16
Zhou J Q. Disrupting effects of TBBPA and TCBPA on thyroid hormone signaling and hypothalamic-pituitary-thyroid axis in Xenopus laevis [D]. Kunming: Yunnan University, 2018: 12-16 (in Chinese)
[9] d’Amora M, Giordani S. The utility of zebrafish as a model for screening developmental neurotoxicity [J]. Frontiers in Neuroscience, 2018, 12: 976
[10] Song M Y, Liang D, Liang Y, et al. Assessing developmental toxicity and estrogenic activity of halogenated bisphenol A on zebrafish (Danio rerio) [J]. Chemosphere, 2014, 112: 275-281
[11] MacPhail R C, Brooks J, Hunter D L, et al. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol [J]. NeuroToxicology, 2009, 30(1): 52-58
[12] Sloman K A, McNeil P L. Using physiology and behaviour to understand the responses of fish early life stages to toxicants [J]. Journal of Fish Biology, 2012, 81(7): 2175-2198
[13] Drapeau P, Saint-Amant L, Buss R R, et al. Development of the locomotor network in zebrafish [J]. Progress in Neurobiology, 2002, 68(2): 85-111
[14] Rao J V, Begum G, Pallela R, et al. Changes in behavior and brain acetylcholinesterase activity in mosquito fish, Gambusia affinis in response to the sub-lethal exposure to chlorpyrifos[J]. International Journal of Environmental Research and Public Health, 2005, 2(3-4): 478-483
[15] Wu L Y, Dang Y, Liang L X, et al. Perfluorooctane sulfonates induces neurobehavioral changes and increases dopamine neurotransmitter levels in zebrafish larvae [J]. Chemosphere, 2022, 297: 134234
[16] Liu W T, Pan Y F, Yang L, et al. Developmental toxicity of TCBPA on the nervous and cardiovascular systems of zebrafish (Danio rerio): A combination of transcriptomic and metabolomics [J]. Journal of Environmental Sciences (China), 2023, 127: 197-209
[17] 梁艺怀, 张京佶, 张琨, 等. 稀有鮈鲫作为鱼类幼体生长试验受试鱼种的适用性研究[J]. 中国实验动物学报, 2018, 26(5): 618-623
Liang Y H, Zhang J J, Zhang K, et al. Applicability of Chinese rare minnows for the juvenile fish growth test [J]. Acta Laboratorium Animalis Scientia Sinica, 2018, 26(5): 618-623 (in Chinese)
[18] Chen J F, Tanguay R L, Xiao Y Y, et al. TBBPA exposure during a sensitive developmental window produces neurobehavioral changes in larval zebrafish [J]. Environmental Pollution, 2016, 216: 53-63
[19] Ding Y L, Dong X, Feng W W, et al. Tetrabromobisphenol S alters the circadian rhythm network in the early life stages of zebrafish [J]. Science of the Total Environment, 2022, 806: 150543
[20] 杨开智, 吴永贵, 王晓睿, 等. 不同类型植物凋落物参与下炼锌废渣对斑马鱼抗氧化酶和神经毒性的影响[J]. 环境科学学报, 2021, 41(6): 2457-2465
Yang K Z, Wu Y G, Wang X R, et al. Effects of leachate from plant litters amended zinc smelting waste slag on antioxidant enzymatic activity and neurotoxicity in zebrafish (Danio rerio) [J]. Acta Scientiae Circumstantiae, 2021, 41(6): 2457-2465 (in Chinese)
[21] Schattenberg J M, Galle P R, Schuchmann M. Apoptosis in liver disease [J]. Liver International: Official Journal of the International Association for the Study of the Liver, 2006, 26(8): 904-911
[22] Zeng C, Sun H, Xie P, et al. The role of apoptosis in MCLR-induced developmental toxicity in zebrafish embryos [J]. Aquatic Toxicology, 2014, 149: 25-32
[23] Félix L M, Vidal A M, Serafim C, et al. Ketamine induction of p53-dependent apoptosis and oxidative stress in zebrafish (Danio rerio) embryos [J]. Chemosphere, 2018, 201: 730-739
[24] Selderslaghs I W T, Hooyberghs J, Blust R, et al. Assessment of the developmental neurotoxicity of compounds by measuring locomotor activity in zebrafish embryos and larvae [J]. Neurotoxicology and Teratology, 2013, 37: 44-56
[25] Yu Y J, Hou Y B, Dang Y, et al. Exposure of adult zebrafish (Danio rerio) to tetrabromobisphenol A causes neurotoxicity in larval offspring, an adverse transgenerational effect [J]. Journal of Hazardous Materials, 2021, 414: 125408
[26] Budni J, Bellettini-Santos T, Mina F, et al. The involvement of BDNF, NGF and GDNF in aging and Alzheimer’s disease [J]. Aging and Disease, 2015, 6(5): 331-341
[27] Chen Y C, Sundvik M, Rozov S, et al. MANF regulates dopaminergic neuron development in larval zebrafish [J]. Developmental Biology, 2012, 370(2): 237-249