阿维菌素(avermectin,AVM)是一类十六元大环内酯类聚酮化合物,具有杀虫、杀螨、杀线虫等活性,是广泛应用的生物型农药和兽药[1-3],在我国种植业和畜牧业害虫防治体系发挥了重要作用。AVM因其广谱、低毒、高效等优点,曾被应用于水产养殖动物的寄生虫病防治,对鱼类体内外寄生虫如中华鳋、锚头鳋、鱼虱等[4-5],以及虾蟹体表寄生虫等[6]有较好的驱杀效果。水产养殖中AVM多是以全池泼洒方式施用,在驱杀靶标寄生虫的同时,对养殖动物、环境生物等非目标生物存在着潜在的毒副作用;施用后AVM与水中颗粒物的结合,在水和沉积物中的稳定性,以及水环境中的降解途径及其影响因素,是决定AVM素活性的重要因素。本文收集整理了相关文献对上述问题进行了分析和评价,以期为AVM在水产养殖中的应用提供理论依据。
1 阿维菌素分子结构及药理特性(Molecular structure and pharmacological properties of avermectin)
1.1 阿维菌素分子结构
AVM为阿维链霉菌(Streptomyces avermitilis)发酵产生的次级代谢产物[7],天然AVM中包含8个组分,有4个较多的组分(A1a、A2a、B1a和B2a),其总含量≥80%,还有4个较少的组分(A1b、A2b、B1b和B2b)(图1),其总含量≤20%。AVM中B1a和B1b为主要药效成分,其中B1a不低于90%、B1b不超过5%,原料药中以B1a来标定[8-9]。
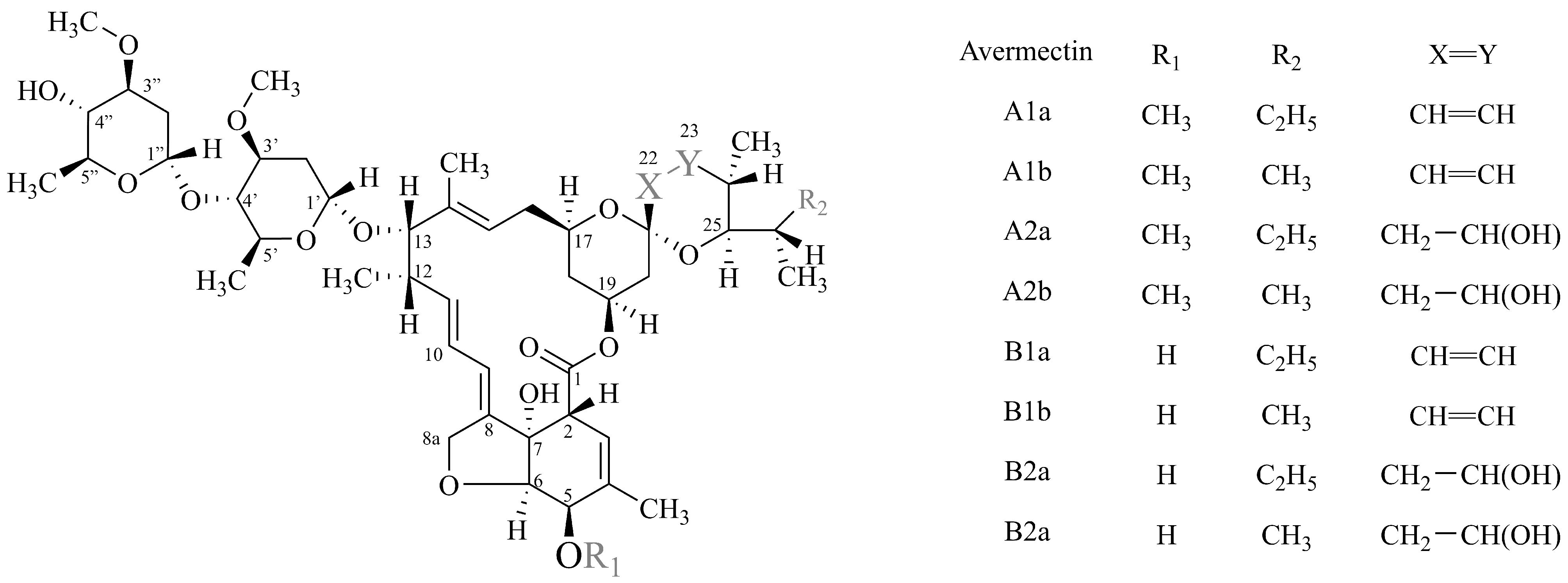
图1 阿维菌素异构体结构式图[8]
Fig. 1 Structures of the isomer for avermectin[8]
1.2 阿维菌素的作用机理
作为一种绿色生物型农药兽药,AVM与线虫和节肢动物体内的特异位点结合产生一系列的电生理和生物化学反应,从而发挥杀虫驱虫等生物活性。作用于γ-氨基丁酸(gamma-aminobutyric acid,GABA)介导的神经系统调节是AVM作用机理的最初解释。AVM作为GABA激动剂,促使神经末梢GABA大量释放,可导致由GABA介导的中枢神经及神经肌肉间传导受阻,产生长时间高强度抑制效应,使寄生虫麻痹致死,达到驱虫或杀虫效果[10]。在正常使用剂量下,由于哺乳动物的血脑屏障作用,导致药物在中枢神经系统的分布浓度很低,不足以引起GABA的释放。因此,AVM在哺乳动物中使用是相对安全的。
AVM的另一个作用机理是,可以引起与GABA系统无关的谷氨酸门控氯离子通道的开放,该通道广泛存在于线虫、节肢动物等体内[11]。AVM进入机体神经元突触后与原本由谷氨酸控制的谷氨酸门控氯离子通道结合,结合后会延长氯离子通道的开放,导致大量的氯离子由突触间隙进入运动神经元末端,引起神经元休止电位的超极化,使正常的动作电位不能释放,阻断神经信号传递,最终引起虫体麻痹或死亡[12]。然而,吸虫和绦虫体内由于缺少受谷氨酸控制的氯离子通道,导致AVM对吸虫和绦虫无效[13];在哺乳动物体内同样未发现受谷氨酸控制的氯离子通道[14]。AVM 8个同系物对细菌、真菌和原生动物没有抑制作用,但是对牲畜体内的寄生线虫、昆虫和螨类却具有很高的活性,其中B1杀虫活性最高,杀虫谱最广,B2次之,且对哺乳动物最安全。
2 水产养殖环境中阿维菌素的主要来源及迁移转化(Major sources, migration and transformation of avermectin in aquaculture environments)
2.1 阿维菌素的来源
水产养殖环境中AVM的来源主要有水源带入和水产养殖用药两部分,其中水源AVM污染主要来自种植业排放水、畜牧业养殖废水,以及工厂(药厂)废水等。
农作物喷洒AVM农药,吸附在植物体和土壤颗粒上的药物经雨水淋洗冲刷,随水体一起流入池塘、河流和湖泊而带来污染[15]。有研究报道,稻田施用AVM后,灌水后稻田水中AVM最高浓度达0.034 mg·L-1,并随着降雨排水进入河道[16];在对某一脐橙种植园周边水库的农药残留检测时发现,其水样的AVM检出率为35%,平均浓度达1.2 μg·L-1[17];青海格尔木南部枸杞园的土壤和地下水中阿维菌素残留分别为0.2~45.5 μg·kg-1和3.8~15 μg·kg-1[18];在模拟田间试验中,经种植区等环境迁移进入水体中的AVM浓度约为4~8 μg·L-1[19]。同时,AVM作为用于猪、牛和羊等牲畜体表和体内寄生虫的高效广谱驱虫药,主要对寄生于动物体内的线虫和节肢动物有极强的驱杀作用。但是,多数情况下高达90%的药物以原形或活性代谢物通过粪便、尿等排泄物方式排出而污染环境[20]。在给绵羊单次皮下注射0.2 mg·kg-1 AVM后,羊粪中的AVM在第3天检测到最大AVM残留浓度(1.277 μg·kg-1,干质量),其在羊粪中降解的半衰期为23 d[21]。广州市天河区一条流经农业区、植物园、工业区和居民区的河涌,采集9个野外采样点的沉积物均检出AVM残留,其浓度范围为0.3~50.3 ng·g-1(干质量)[22]。这些来自周边环境中的AVM污染可能随着地表径流带入养殖水环境,对水生态系统产生影响。
在水产养殖中,AVM对水产动物体外寄生虫如中华鳋、锚头鳋、鱼虱等有较好的驱杀效果[4-5],AVM全池泼洒的用药方式使得其更易在养殖环境中残留和富集。关于AVM在水产养殖环境的污染特征研究相对较少,在宜都周边养殖区采集的6份水样和7份鱼类肌肉组织中均检测到AVM的残留,残留浓度分别0.0044~0.1277 mg·kg-1和0.0317~1.0699 mg·kg-1[23]。采集自上海崇明的30份池塘水样中,AVM的检出率为6.7%,检出浓度分别为339 ng·L-1和445 ng·L-1[24]。
2.2 阿维菌素降解途径
进入水产养殖环境中AVM将在水体、沉积物和水生生物中降解,主要降解途径包括光解、水解、土壤吸附、植物降解和微生物降解等,这些过程关系着其在水产养殖环境中的残留浓度及其生态毒性。
2.2.1 阿维菌素光解
光降解是AVM药物降解的主要途径,在植物表面、土壤和水体中的AVM暴露于光照下均能被迅速降解[25-26]。在光照条件下,AVM降解速率随着光照强度增强而升高,初始浓度为2.5 mg·L-1的AVM在1 800 lx时半衰期为19.64 h,而在11 000 lx时半衰期仅为3.85 h[27],模拟太阳光,强度越大AVM光解速率越快,由此可见,AVM对光极不稳定。紫外线辐射波长影响AVM光解速率,波长越短,越有利于AVM光降解;在紫外线下,AVM能通过活性氧自由基途径发生降解[28];紫外吸收剂阿凡达、2,6-二-叔丁基对甲酚(BHT),以及光屏蔽剂纳米SiO2、表面活性剂十二烷基硫酸钠对AVM光降解均起到抑制作用[29]。AVM在水溶液中光降解速率随着初始浓度增大而减少,pH值越大光解速率越大,水中添加色素延长了AVM半衰期,色素阻挡了光的透过从而减少了AVM的光解速率[30]。刘慧琳和郭正元[31]通过模拟试验,研究了水介质中AVM的消解速率,在不同水体中AVM光解速率为河水>纯净水>池塘水>自来水;腐植酸对AVM的光解速率则表现出一定的光猝灭作用,可能是由于腐植酸和AVM对光量子的竞争引起的。另外,AVM不同剂型光解速率不同,光解速率大小表现为乳油>水乳剂>微乳剂[32]。
2.2.2 阿维菌素水解
AVM类药物水解是一个水化学反应过程,通过与水分子相互作用形成新基团。使用AVM后,通过各种途径进入水体环境,水解是AVM类药物的一个主要环境化学行为。有研究报道,AVM在中性条件下比较稳定,避光条件下水解速率较慢,在水温25 ℃、pH 7.0时水解半衰期为78.8 d,在杭州华家池池水(pH 7.21)中水解半衰期为88.9 d[27]。pH和温度是影响AVM类药物水解的主要因素。AVM在中性(pH 7.0)条件下极稳定,在30 d前几乎不降解,30 d后降解加快,半衰期接近80 d。在碱性(pH 11.0)和酸性(pH 3.0)条件下降解加快,半衰期分别只有15 d和20 d,这可能与分子中具有酯(C1位)和缩醛(C13和C4)结构有关。AVM水解速率随温度升高而加快,温度每提高10 ℃,AVM水解速率常数平均增加2倍,与范特荷夫规则基本吻合[27]。
2.2.3 阿维菌素土壤吸附降解
土壤的有机质含量和粘粒含量与AVM吸附常数(Kaf)呈显著正相关,两者是决定AVM在土壤上吸附能力的主要因素,AVM在土壤上的吸附属于物理吸附[33]。采用土壤薄层色谱法、间歇式平衡结合法和土壤柱式沥滤法,3种不同的方式测定AVM与土壤结合能力,结果显示AVM与土壤颗粒紧密结合,是一种非流性的化合物。Heinrich等[28]研究报道,AVM等大环内酯类抗寄生虫药显示出对土壤有机质和沉积物的强烈吸附,且其土壤解吸实验结果表明大部分是不可逆的吸附过程。有研究表明,AVM在土壤中较易降解,不同地区土壤中AVM半衰期在1.2~3.8 d不等[34],相比于有机质和粘土含量高的土壤,AVM在吸附性较低的沙质土壤中消散得更快[35];在模拟水产养殖生态系统底泥中的消除半衰期为115.5 h[36]。
2.2.4 阿维菌素植物分解
AVM对植物叶片穿透性较强,喷施叶片表面的药物在光照条件下迅速分解消散,渗入植物薄壁组织内的活性成份则较长时间存在于组织,通过传导对植物组织内取食的害虫有长残效性。水生植物从水体吸收农药的能力强,而陆生作物从土壤中吸收农药能力较弱。在泼洒AVM的水体(使得水体浓度为6 μg·L-1)生长的伊乐藻体内AVM在12 h达到峰值为8.75 μg·kg-1;第30天时,AVM浓度降至1.14 μg·kg-1[36]。而在浓度为3 mg·kg-1和0.3 mg·kg-1的粪便附近生长30 d的植物中,平均IVM浓度分别为(0.21±0.14) mg·kg-1和(0.03±0.02) mg·kg-1[37]。植物对污染物质除吸收、固定和分解污染物外,还间接地参与污染物的分解,对土壤中细菌、真菌等微生物的调控来进行环境修复[38-39]。因此,植物对环境修复过程是由高等植物、真菌、细菌等微生物共同组成的整体来完成。
2.2.5 微生物降解
AVM在环境中的降解效率与环境微生物息息相关。研究报道,在有菌土壤中阿维菌素含量减少50%所需的时间为4 d,90%消解需要12 d;而在灭菌土壤中,阿维菌素经37 d暴露仍没有降低,这表明,好氧微生物降解是土壤中阿维菌素消解的主要机制[40]。从土壤中分离到6株降解菌,对AVM降解半衰期在5.3~11.8 d之间[41];从某污水处理厂的活性污泥中分离出1株拟杆菌LYH,在温度为30 ℃、pH 7.0~8.0时,其48 h AVM降解率(初始浓度为250 mg·L-1)达84.7%~85.6%[42]。1株来源于长期使用AVM的稻田土壤中的嗜麦芽窄食单胞菌ZJB-14120对AVM表现出高效的生物降解能力(7.81 mg·L-1·h-1),该菌株在AVM初始浓度为200 mg·L-1时,48 h内对AVM的降解率为84.82%[43]。虽然其他环境中关于AVM的微生物降解研究有了初步的成果,但是关于水产养殖环境中的AVM降解菌的研究相对较少,有研究学者从受到AVM长期污染的河蟹养殖池塘底泥中分离出一株能够降解AVM的苍白杆菌AVM-2,其AVM降解率最高可达32.1%[44]。
2.3 阿维菌素在水生动物体内代谢
AVM具高脂溶性,药物被水生动物吸收后大部分蓄积在肝脏中,而后分布到肌肉等组织,其药代动力学呈现分布容积较大、消除缓慢等,且具有线性动力学特征。对鲫鱼肌肉中AVM残留消除规律研究表明,AVM单次泼洒给药,鲫鱼肌肉(皮)中AVM虽然吸收较快,但蓄积浓度不高,滞留时间较长和消除缓慢[45]。鲈鱼暴露于0.5 μg·L-1的AVM水溶液维持20 d,AVM在鲈鱼肌肉、鳃、肝脏和血液中峰浓度分别为7.74、10.56、87.36 μg·kg-1和19.10~0.63 μg·kg-1,消除半衰期为分别为6.9、9.5、8.2和10.7 d;鲈鱼体内富集AVM浓度远高于水体,且AVM富集和消除能力存在组织差异性,且70%并未被鱼体吸收,而主要是以原药形式经粪便排出[46]。异育银鲫暴露单次泼洒6 μg·L-1 AVM下,其血浆、肾、鳃、肝和肌肉组织中AVM最高浓度(Cmax)依次为50.9、45.37、21.25、15.47和11.9 μg·kg-1,消除半衰期分别为69.17、73.20、47.05、64.69和74.25 h;而在暴露于同一条件下的中华绒螯蟹,仅在鳃组织中检测到AVM(Cmax为8.08 μg·kg-1)[36]。AVM在水生动物体内药代动力学研究结果显示,正常施用剂量下其在水生动物体内蓄积量较低,AVM的使用在水产动物可食组织中存在残留的危害性很小。
2.4 阿维菌素在水生态系统归趋
AVM在水体迁移速度比在土壤和沉积物中要快,AVM进入水体能够快速分散。其分解途径主要经由水体表层的AVM在光照条件下快速分解,水体中的AVM被水生动植物吸收或吸附AVM对土壤沉积物吸附能力强,能吸附于沉积物中,水体沉积物为AVM主要归宿。张卫卫等[36]采用UPLC-MS/MS法,研究AVM在模拟水产养殖池塘生态系统中的环境行为,结果显示以6 μg·L-1浓度单次泼洒用药,水体AVM消解较快半衰期为63.8 h。AVM在养殖水环境中消减的同时,逐渐由水体向底泥、伊乐藻和水产动物迁移。该模拟系统中的异育银鲫(Carassius auratus gibelio)对AVM具有明显的吸收,而中华绒螯蟹(Eriocheir sinensis)仅鳃组织检出AVM,血淋巴、肌肉和肝胰腺等组织均未检出AVM,这恰好解释了AVM对中华绒螯蟹的毒性低于异育银鲫。生物富集系数(BCF)值显示对AVM的富集浓度由高到低依次为鲫鱼>伊乐藻>中华绒螯蟹>底泥,显示AVM在不同分配相和不同生物组织的富集作用差异显著[36];在该生态系统中,底泥和伊乐藻中AVM消除半衰期分别为115.5 d和315.0 d,明显大于水中消除半衰期。综上所述,AVM在水生态系统归趋特征,显示在不同生物相中分布具有差异性,为在水产养殖水体环境的安全评估提供具指导和借鉴作用。
3 阿维菌素对水生生物的毒性及生态风险评估分析(Toxicity and ecological risk assessment of avermectin to aquatic organisms)
3.1 阿维菌素对水生生物的毒性影响
AVM对水生动物的毒性研究主要集中在急性毒性试验,对不同的水生动物其毒性差异较大。有关AVM对淡水鱼类的急性毒性研究报道较多,这为该药的安全使用提供了基础数据。AVM对鱼类的毒性存在着明显的种属差异,如表1所示,在调查的26种鱼类中AVM对其的96 h-LD50在0.0032~16.1 mg·L-1之间。其中雅罗鱼杂交幼鱼(Leuciscus waleckiii×L. idus)最高为16.1 mg·L-1,冷水性鱼类虹鳟(Oncorhynchus mykiss)的最低为3.2 μg·L-1[47],大部分处于0.01~0.1 mg·L-1范围内。与鱼类一样,AVM对水生节肢动物的毒性在不同种属之间的差异也很大,如蓝蟹(Callinectes sapidus)96 h-LC50为0.153 mg·L-1[48],日本沼虾(Macrobrachium nipponense)的LC50分别为0.52 mg·L-1[49],而水生浮游动物大型溞(Daphnia magna)和蚤状溞(D. pulex)的48 h-LC50分别为0.25 μg·L-1和0.37 μg·L-1[49];但不同研究关于AVM对中华绒螯蟹(Eriocheir sinensis)的毒性存在差异,其96 h-LC50数据分别为0.954[50]、7.1[44]和73.44 mg·L-1[51],这可能与供试AVM制剂的溶剂有关,前两者采用丙酮、甲醇溶解AVM制剂,而后者采用的是AVM乳油制剂。AVM对藻类的毒性均低于鱼类和节肢动物,AVM对栅藻(Scenedesmus subspicatus)和蛋白核小球藻(Chlorella pyrenoidosa)在96 h-EC50分别为9.89 mg·L-1和7.31 mg·L-1[52]。水产养殖中使用AVM全池泼洒浓度为0.2~0.5 μg·L-1[53],该浓度远低于AVM对养殖鱼类、虾蟹类和藻类的96 h-LD50。水环境中施用的AVM虽可不停地被稀释,但在使用后仍会对生态环境产生潜在的负面影响,尤其是对AVM敏感的枝角类等有较大的风险。
表1 水产养殖水体中阿维菌素对水生动物的风险评估结果
Table 1 Risk assessment of avermectin to aquatic animals in aquaculture waters
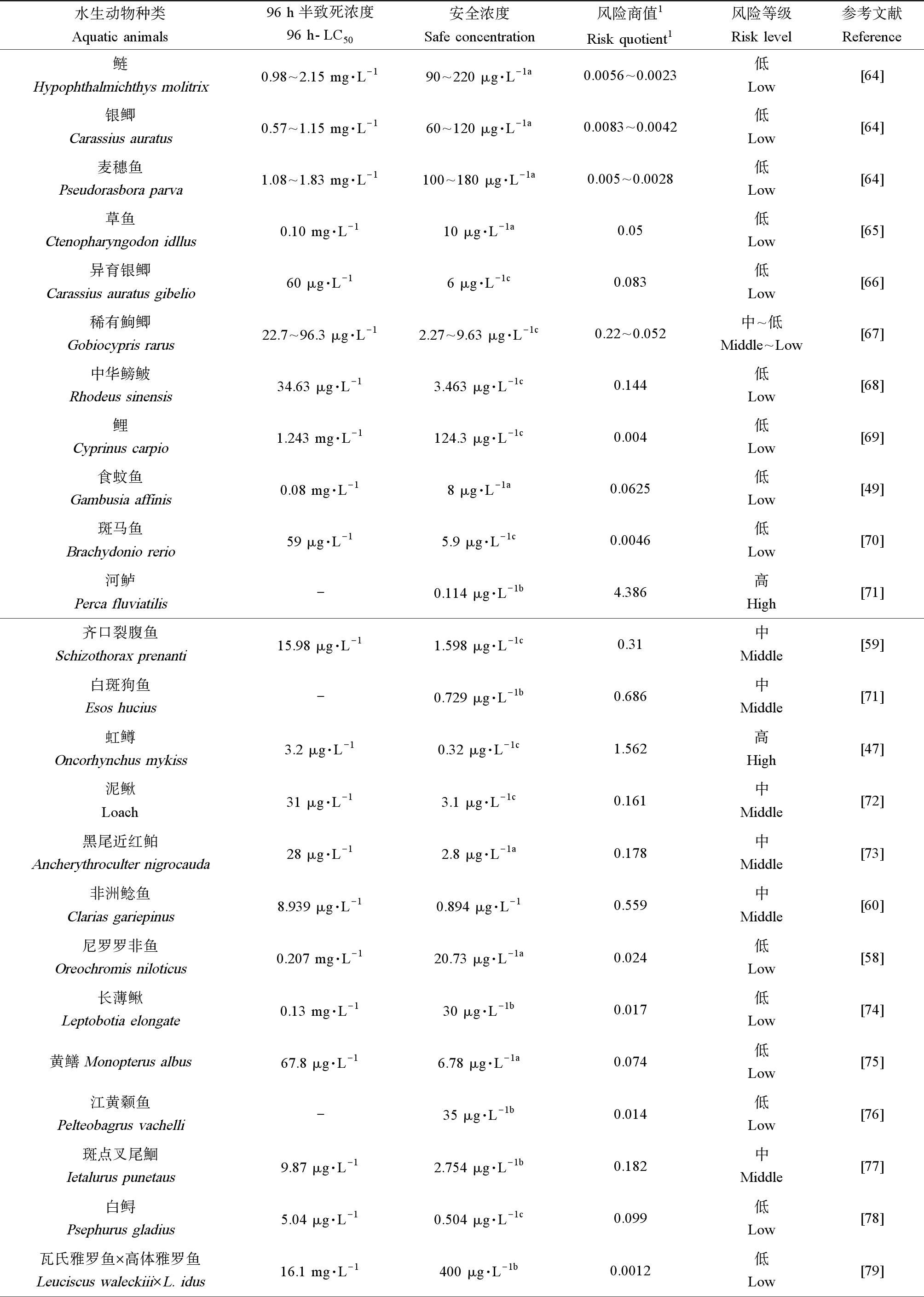
水生动物种类Aquatic animals96 h半致死浓度96 h-LC50安全浓度Safe concentration风险商值1Risk quotient1风险等级Risk level参考文献Reference鲢Hypophthalmichthys molitrix0.98^2.15 mg·L-190^220 μg·L-1a0.0056^0.0023低Low[64]银鲫Carassius auratus0.57^1.15 mg·L-160^120 μg·L-1a0.0083^0.0042低Low[64]麦穗鱼Pseudorasbora parva1.08^1.83 mg·L-1100^180 μg·L-1a0.005^0.0028低Low[64]草鱼Ctenopharyngodon idllus0.10 mg·L-110 μg·L-1a0.05低Low[65]异育银鲫Carassius auratus gibelio60 μg·L-16 μg·L-1c0.083低Low[66]稀有鮈鲫Gobiocypris rarus22.7^96.3 μg·L-12.27^9.63 μg·L-1c0.22^0.052中^低Middle^Low[67]中华鳑鲏Rhodeus sinensis34.63 μg·L-13.463 μg·L-1c0.144低Low[68]鲤Cyprinus carpio1.243 mg·L-1124.3 μg·L-1c0.004低Low[69]食蚊鱼Gambusia affinis0.08 mg·L-18 μg·L-1a0.0625低Low[49]斑马鱼Brachydonio rerio59 μg·L-15.9 μg·L-1c0.0046低Low[70]河鲈Perca fluviatilis-0.114 μg·L-1b4.386高High[71]齐口裂腹鱼Schizothorax prenanti15.98 μg·L-11.598 μg·L-1c0.31中Middle[59]白斑狗鱼Esos hucius-0.729 μg·L-1b0.686中Middle[71]虹鳟Oncorhynchus mykiss3.2 μg·L-10.32 μg·L-1c1.562高High[47]泥鳅Loach31 μg·L-13.1 μg·L-1c0.161中Middle[72]黑尾近红鲌Ancherythroculter nigrocauda28 μg·L-12.8 μg·L-1a0.178中Middle[73]非洲鲶鱼Clarias gariepinus8.939 μg·L-10.894 μg·L-10.559中Middle[60]尼罗罗非鱼Oreochromis niloticus0.207 mg·L-120.73 μg·L-1a0.024低Low[58]长薄鳅Leptobotia elongate0.13 mg·L-130 μg·L-1b0.017低Low[74]黄鳝Monopterus albus67.8 μg·L-16.78 μg·L-1a0.074低Low[75]江黄颡鱼Pelteobagrus vachelli-35 μg·L-1b0.014低Low[76]斑点叉尾鮰Ietalurus punetaus9.87 μg·L-12.754 μg·L-1b0.182中Middle[77]白鲟Psephurus gladius5.04 μg·L-10.504 μg·L-1c0.099低Low[78]瓦氏雅罗鱼×高体雅罗鱼Leuciscus waleckiii×L. idus16.1 mg·L-1400 μg·L-1b0.0012低Low[79]
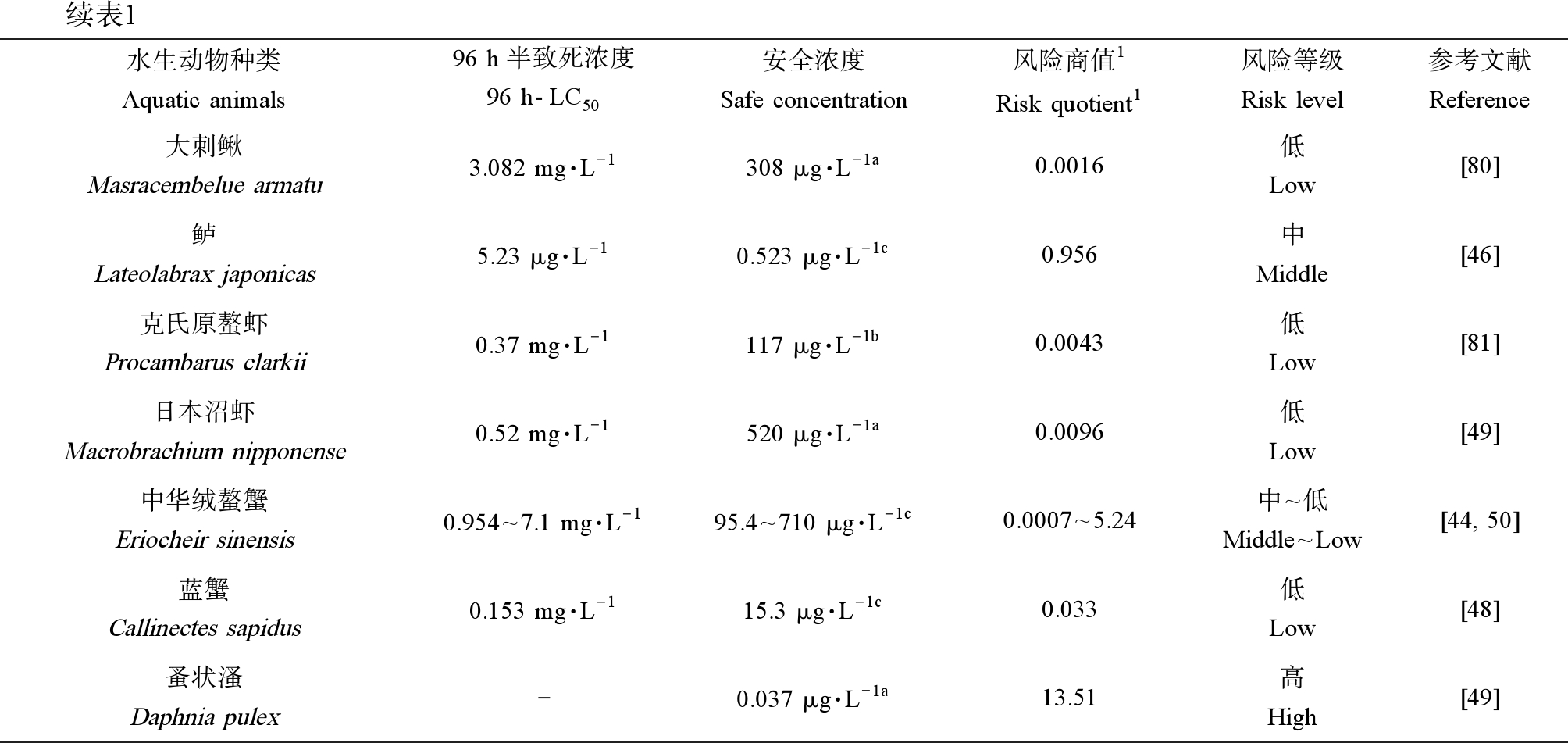
注:1. RQ = EEC/SC,EEC表示环境暴露浓度;安全浓度标注字母不同表明其来源不同,字母a表示其来源于对应参考文献,计算公式为SC=0.1×96 h-LC50,字母b表示其来源于对应参考文献,计算公式为SC=48 h-LC50×0.3/(24 h-LC50/48 h-LC50)2,字母c表示对应参考文献未提及,笔者以公式SC=0.1×96 h-LC50计算而得。
Note: 1. RQ = EEC/SC, EEC means environmental exposure concentration; the different letters of the safety concentration label indicate different sources, the letter a indicates that it comes from the corresponding reference, and the calculation formula is SC=0.1×96 h-LC50, the letter b indicates that it comes from the corresponding reference, the calculation formula is SC=48 h-LC50×0.3/(24 h-LC50/48 h-LC50)2, and the letter c indicates that the corresponding reference is not mentioned, we calculated it with the formula SC= 0.1×96 h-LC50.
续表1水生动物种类Aquatic animals96 h半致死浓度96 h-LC50安全浓度Safe concentration风险商值1Risk quotient1风险等级Risk level参考文献Reference大刺鳅Masracembelue armatu3.082 mg·L-1308 μg·L-1a0.0016低Low[80]鲈Lateolabrax japonicas5.23 μg·L-10.523 μg·L-1c0.956中Middle[46]克氏原螯虾Procambarus clarkii0.37 mg·L-1117 μg·L-1b0.0043低Low[81]日本沼虾Macrobrachium nipponense0.52 mg·L-1520 μg·L-1a0.0096低Low[49]中华绒螯蟹Eriocheir sinensis0.954^7.1 mg·L-195.4^710 μg·L-1c0.0007^5.24中^低Middle^Low[44, 50]蓝蟹Callinectes sapidus0.153 mg·L-115.3 μg·L-1c0.033低Low[48]蚤状溞Daphnia pulex-0.037 μg·L-1a13.51高High[49]
然而,AVM对水产养殖的风险评估不仅需要急性毒性的数据,还需要考察其慢性毒性,如组织损伤、生理生化和免疫相关指标的变化。近几年关于AVM对水生动物的慢性毒性研究相对较少,且较多集中于对斑马鱼胚胎的神经毒性效应。AVM对斑马鱼胚胎的自发尾部收缩(spontaneous tail contraction, SCT)有明显的抑制作用[54-55]。Raftery和Volz[56]认为AVM可与斑马鱼胚胎中谷氨酸门控氯离子通道配体可逆性结合,从而抑制神经传递,但其不影响脊髓运动神经元的神经突生长。研究表明,除寄生性桡足类外,AVM同样会对营自由生活的桡足类产生影响,甲维盐(以AVM为基础半合成)暴露下,日本虎斑猛水蚤(Tigriopus japonicus Mori)的摄食率、滤水率以及运动能力随甲维盐浓度的增加而降低,且甲维盐会降低其发育率和产卵能力[57]。暴露于AVM下(0.1×96 h-LC50,20.73 μg·L-1)尼罗罗非鱼(Oreochromis niloticus)的饲料转化率、比生长率等生长参数,明显低于对照组;且AVM显著降低了暴露鱼的IgG、IgA和C3水平,并对暴露鱼表现出肝毒性[58]。暴露于AVM亚致死浓度(0.5、2或8 μg·L-1)下的齐口裂腹鱼(Schizothorax prenanti)幼鱼出现肝细胞DNA损伤和细胞凋亡等现象[59]。在0.089 μg·L-1的AVM胁迫下,非洲鲶鱼(Clarias gariepinus)的白细胞、红细胞数量及血细胞比容水平均显著升高,且红细胞核出现微核、芽状核现象[60]。亚致死浓度(0.03、0.06、0.12、0.24和0.48 mg·L-1)的AVM暴露可显著降低中华绒螯蟹血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和总抗氧化能力(T-AOC)水平,并呈剂量和时间依赖关系,且各浓度AVM对中华绒螯蟹均有严重的遗传损伤作用[50];且在AVM的长期胁迫下,中华绒螯蟹肝胰腺出现白化现象,生理功能受损,并呈现出一定的剂量-效应关系[61]。
3.2 阿维菌素对水生生物的生态风险评估分析
AVM在水产养殖中多以全池泼洒方式给药,药物在发挥驱虫治疗作用的同时也会直接作用于水体中其他非靶标生物和环境介质。风险商值(risk quotient, RQ)常用于评估农药对水生动物的生态风险。RQ指的是测量的环境浓度(measured environmental concentrations, MEC)与预测的无影响浓度(predicted no effect concentrations, PNEC)之间的比值;本综述收集国内外AVM对水生动物毒性研究,统计AVM对30余种水生动物的半致死浓度(96 h-LC50)和安全浓度(safety concentration, SC),参照陈诚等[62]的方法计算风险商值RQ,结果见表1。表1中计算RQ时采用水产养殖推荐的AVM使用浓度(0.5 μg·L-1)[53]作为MEC,采用安全浓度或者1/10的96 h-LC50作为PNEC。根据农药对水生生物生态风险分级标准,RQ≥1.0为高风险,0.1≤RQ<1为中风险,RQ<0.1为低风险[63]。从表1可知,AVM对水生动物的生态风险并不高,在统计的31种水生动物中有3种表现为高风险、7种表现为中风险、2种表现为中~低风险、19种表现为低风险。3种高风险中,有2种为冷水性鱼类河鲈和虹鳟,因此,AVM对冷水性鱼类的毒性风险值得关注;在5种水生甲壳动物中,蚤状溞对AVM较为敏感表现为高风险,中华绒螯蟹表现为中~低风险,其他3种虾蟹为低风险。AVM在水产养殖中多以全池泼洒方式给药,药物在发挥驱虫治疗作用的同时也会直接作用于水体中其他非靶标生物,AVM对水生动物的毒性存在着明显的种属差异,因此在作用于靶生物的同时需要考虑到对养殖水体中非靶生物的危害。
4 总结(Summary)
AVM是作用于线虫和节肢动物的杀虫驱虫药,在水产养殖中,较低浓度的AVM即能发挥出药效作用,具有应用于防控水产动物中华鳋、锚头鳋、鱼虱等甲壳类寄生虫病的优势和前景。前文综合分析了AVM的光解、水解,以及土壤吸附、植物作用和微生物作用等,AVM进入池塘等养殖水体中的降解是多重因素综合作用的结果。在水产养殖中以全池泼洒方式施用后的AVM主要是通过光解作用降解,而在黑暗的池底或透明度较低的条件下,微生物发挥着一定的降解作用;虽然在养殖水环境中消除速度较快,但要加强池塘底泥沉积物中AVM的降解消除研究,这是因为水产养殖池塘底层是光照很弱甚至没有光照。同时,要充分考虑AVM的降解产物及其在环境中的归趋和生态毒性,全面评价AVM的生态风险。
在水生动物中,AVM对鱼类的生态风险存在着明显的种属差异,多数鱼类属于低风险,部分鱼类属于中风险,也有个别鱼类属于高风险。对节肢动物而言,AVM对枝角类表现出较高的毒性,对中华绒螯蟹等养殖经济虾蟹同样具有一定的毒性作用。水产用AVM制剂类型以微乳剂、乳油为主,用量极低(0.2~0.5 μg·L-1),在养殖水环境中的半衰期短,对大多数水生生物的风险较低,但施用时应考虑对养殖环境中非靶标生物的影响,避免生物富集导致的慢性毒性,同时尚需进一步扩大AVM对更多种类水生动物的急性、慢性毒性研究,不仅关注养殖对象动物,还要关注非养殖动物非靶标生物的安全性。
通信作者简介:房文红(1968—),男,博士,教授,主要研究方向为水产动物药理学和水产病原菌耐药性。
[1] Boxall A B A, Fogg L A, Blackwell P A, et al. Veterinary medicines in the environment [J]. Reviews of Environmental Contamination and Toxicology, 2004, 180: 1-91
[2] Li M, Zhang P, Xu W P, et al. Avermectin induces toxic effects in insect nontarget cells involves DNA damage and its associated programmed cell death [J]. Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2021, 249: 109130
[3] Cui G F, Yuan H Q, He W, et al. Synergistic effects of botanical curcumin-induced programmed cell death on the management of Spodoptera litura Fabricius with avermectin [J]. Ecotoxicology and Environmental Safety, 2022, 229: 113097
[4] Whyte S K, Poley J D, Mueller A, et al. Avermectin treatment for Lepeophtheirus salmonis: Impacts on host (Salmo salar) and parasite immunophysiology [J]. Aquaculture, 2019, 501: 488-501
[5] Lam C T, Rosanowski S M, Walker M, et al. Sea lice exposure to non-lethal levels of emamectin benzoate after treatments: A potential risk factor for drug resistance [J]. Scientific Reports, 2020, 10(1): 932
[6] 赵治国, 吴桃, 青格勒, 等. 3种农药对桡足类的急性毒性试验[J]. 畜牧与饲料科学, 2017, 38(11): 103-105
[7] Chen J S, Liu M, Liu X T, et al. Interrogation of Streptomyces avermitilis for efficient production of avermectins [J]. Synthetic and Systems Biotechnology, 2016, 1(1): 7-16
[8] Campbell W. Ivermectin and abamectin [J]. Quarterly Review of Biology, 1989, 3(2): 1-23
[9] Salman M, Abbas R Z, Mehmood K, et al. Assessment of avermectins-induced toxicity in animals [J]. Pharmaceuticals, 2022, 15(3): 332
[10] Xu Z F, Liu Y C, Wei P, et al. High gama-aminobutyric acid contents involved in abamectin resistance and predation, an interesting phenomenon in spider mites [J]. Frontiers in Physiology, 2017, 8: 216
[11] Nakao T, Banba S, Hirase K. Comparison between the modes of action of novel meta-diamide and macrocyclic lactone insecticides on the RDL GABA receptor [J]. Pesticide Biochemistry and Physiology, 2015, 120: 101-108
[12] Subbanna A R N S, Stanley J, Rajasekhara H, et al. Perspectives of microbial metabolites as pesticides in agricultural pest management [J]. Reference Series in Phytochemistry, 2020, 1: 925-952
[13] Shoop W, Soll M. Chemistry, Pharmacology and Safety of the Macrocyclic Lactones: Ivermectin, Abamectin and Eprinomectin [M].London: CAB International, 2002: 15-21
[14] El-Saber Batiha G, Alqahtani A, Ilesanmi O B, et al. Avermectin derivatives, pharmacokinetics, therapeutic and toxic dosages, mechanism of action, and their biological effects [J]. Pharmaceuticals, 2020, 13(8): 196
[15] 陈然. 农田中阿维菌素在水体和土壤中的残留特征研究[D]. 成都: 西南交通大学, 2016: 23-26
Chen R. Study on the characteristics of residue of avermectin analog simulated farmland for water and soil [D]. Chengdu: Southwest Jiaotong University, 2016: 23-26 (in Chinese)
[16] 傅强. 阿维菌素与甲维盐的稳定性及农田环境安全性评价研究[D]. 长沙: 湖南农业大学, 2013: 103-105
Fu Q. The stability of abamectin and emamectin benzoate and its safety evaluation on farmland environment[D]. Changsha: Hunan Agricultural University, 2013: 103-105(in Chinese)
[17] 王学雄, 薛珺, 朱钦娟, 等. 饮用水源地脐橙园面源污染监测与评价[J]. 中国水土保持, 2018(1): 47-49, 61
[18] Jing X Y, Zhang W Y, Xie J Y, et al. Monitoring and risk assessment of pesticide residue in plant-soil-groundwater system about medlar planting in Golmud [J]. Environmental Science and Pollution Research International, 2021, 28(21): 26413-26426
[19] 钱卓真, 汤水粉, 罗方方, 等. 石斑鱼中阿维菌素类药物多残留测定及食用安全风险评估[J]. 食品科学, 2017, 38(22): 309-316
Qian Z Z, Tang S F, Luo F F, et al. Determination and food safety risk assessment of avermectin residues in grouper [J]. Food Science, 2017, 38(22): 309-316 (in Chinese)
[20] Topi D, Spahiu J. Presence of veterinary antibiotics in livestock manure in two Southeastern Europe countries, Albania and Kosovo [J]. Environmental Science and Pollution Research International, 2020, 27(35): 44552-44560
[21] Kolar L, Flajs V C, Kuzner J, et al. Time profile of abamectin and doramectin excretion and degradation in sheep faeces [J]. Environmental Pollution, 2006, 144(1): 197-202
[22] 林志惠, 李慧珍, 游静. 高效液相色谱-串联质谱法检测水体沉积物中阿维菌素的残留量[J]. 分析测试学报, 2013, 32(8): 923-928
Lin Z H, Li H Z, You J. Determination of abamectin residue in sediment using high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Instrumental Analysis, 2013, 32(8): 923-928 (in Chinese)
[23] 胡飞飞, 陈良立, 刘珊, 等. 宜都周边养殖水体及鱼肉中阿维菌素含量测定[J]. 三峡大学学报(自然科学版), 2017, 39(5): 109-112
Hu F F, Chen L L, Liu S, et al. Determination of avermectin in the pond water and fish from the aquaculture areas in Yidu [J]. Journal of China Three Gorges University (Natural Sciences), 2017, 39(5): 109-112 (in Chinese)
[24] 王守英. 高压液相色谱-高分辨质谱快速筛查养殖环境及水产品中农药残留的研究[D]. 上海: 上海海洋大学, 2020: 70-76
Wang S Y. Reaserch on rapid screening of pesticide residues in aquaculture environment and aquatic products by high performance liquid chromatography-high resolution mass spectrometry [D]. Shanghai: Shanghai Ocean University, 2020: 70-76 (in Chinese)
[25] Halley B A, VandenHeuvel W J A, Wislocki P G. Environmental effects of the usage of avermectins in livestock [J]. Veterinary Parasitology, 1993, 48(1-4): 109-125
[26] Bai S H, Ogbourne S. Eco-toxicological effects of the avermectin family with a focus on abamectin and ivermectin [J]. Chemosphere, 2016, 154: 204-214
[27] 张卫. 农药阿维菌素在环境中降解和代谢研究[D]. 杭州: 浙江大学, 2004: 69-90
Zhang W. Degradation and metabolism of pesticide abamectin in environment [D]. Hangzhou: Zhejiang University, 2004: 69-90 (in Chinese)
[28] Heinrich A P, Zöltzer T, Böhm L, et al. Sorption of selected antiparasitics in soils and sediments [J]. Environmental Sciences Europe, 2021, 33(1): 77
[29] 宋伟杰, 路福绥. 阿维菌素光化学降解研究及其光稳定剂的筛选[J]. 现代农药, 2017, 16(2): 21-23, 56
Song W J, Lu F S. Photodegradation of abamectin and screening the photostabilizers [J]. Modern Agrochemicals, 2017, 16(2): 21-23, 56 (in Chinese)
[30] 杨会荣, 李学德, 罗水明, 等. 阿维菌素在水溶液中的光化学降解[J]. 安徽农业科学, 2009, 37(26): 12686-12688
Yang H R, Li X D, Luo S M, et al. Photochemical degradation of avermectin in aqueous solution [J]. Journal of Anhui Agricultural Sciences, 2009, 37(26): 12686-12688 (in Chinese)
[31] 刘慧琳, 郭正元. 阿维菌素在水介质中的光化学降解研究[J]. 湖南农业科学, 2012(7): 102-103, 106
Liu H L, Guo Z Y. Research on photochemical degradation of avermectin in aqueous media [J]. Hunan Agricultural Sciences, 2012(7): 102-103, 106 (in Chinese)
[32] 刘卫国, 朱欣妍, 尹明明, 等. 阿维菌素3种剂型的光解研究[J]. 农业环境科学学报, 2012, 31(10): 1906-1912
Liu W G, Zhu X Y, Yin M M, et al. Photodegradation of three abamectin liquid formulations [J]. Journal of Agro-Environment Science, 2012, 31(10): 1906-1912 (in Chinese)
[33] Putter I, Mac Connell J G, Preiser F A, et al. Avermectins: Novel insecticides, acaricides and nematicides from a soil microorganism [J]. Experientia, 1981, 37(9): 963-964
[34] 范文静, 张文君, 李慧冬, 等. 超高效液相色谱-串联质谱法分析梨和土壤中阿维菌素的降解动力学及残留量[J]. 安徽农业科学, 2019, 47(4): 198-201, 204
Fan W J, Zhang W J, Li H D, et al. Study on degradation kinetics and residues of abamectin in pear and soil by UPLC-MS/MS [J]. Journal of Anhui Agricultural Sciences, 2019, 47(4): 198-201, 204 (in Chinese)
[35] de Oliveira Ferreira F, Porto R S, Rath S. Aerobic dissipation of avermectins and moxidectin in subtropical soils and dissipation of abamectin in a field study [J]. Ecotoxicology and Environmental Safety, 2019, 183: 109489
[36] 张卫卫, 符贵红, 王元, 等. 阿维菌素在模拟水产养殖生态系统中的蓄积与消除规律[J]. 中国水产科学, 2016, 23(1): 225-232
Zhang W W, Fu G H, Wang Y, et al. Accumulation and elimination of avermectin in a simulated aquaculture ecosystem [J]. Journal of Fishery Sciences of China, 2016, 23(1): 225-232 (in Chinese)
[37] Iglesias L E, Saumell C, Sagüés F, et al. Ivermectin dissipation and movement from feces to soil under field conditions [J]. Journal of Environmental Science and Health Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 2018, 53(1): 42-48
[38] 钟哲科, 高智慧. 植物对环境的修复机理及其应用前景[J]. 世界林业研究, 2001, 14(3): 23-28
Zhong Z K, Gao Z H. The mechanism of phytoremediation and its application prospect [J]. World Forestry Research, 2001, 14(3): 23-28 (in Chinese)
[39] Lucia I, Cardoso Patricia G, Kiu C S, et al. Can mangroves work as an effective phytoremediation tool for pesticide contamination? An interlinked analysis between surface water, sediments and biota [J]. Journal of Cleaner Production, 2021, 295: 1
[40] Dionisio A C, Rath S. Abamectin in soils: Analytical methods, kinetics, sorption and dissipation[J]. Chemosphere, 2016, 151: 17-29
[41] 张卫, 林匡飞, 蔡兰坤, 等. 阿维菌素的微生物降解及其机理研究[J]. 生态环境, 2007, 16(2): 421-424
Zhang W, Lin K F, Cai L K, et al. Study on microbial degradation of abamectin and mechanism [J]. Ecology and Environment, 2007, 16(2): 421-424 (in Chinese)
[42] Li Z X, Song C Y, Yang J L, et al. Biodegradation of avermectin by bacteroidetes endosymbiont strain LYH [J]. World Journal of Microbiology and Biotechnology, 2008, 24(3): 361-366
[43] Wang Y S, Zheng X C, Hu Q W, et al. Degradation of abamectin by newly isolated Stenotrophomonas maltophilia ZJB-14120 and characterization of its abamectin-tolerance mechanism [J]. Research in Microbiology, 2015, 166(5): 408-418
[44] Ma Y B, Liu H L, Xia X L, et al. Toxicity of avermectin to Eriocheir sinensis and the isolation of aavermectin-degrading bacterium, Ochrobactrum sp. AVM-2 [J]. Ecotoxicology and Environmental Safety, 2021, 230: 113115
[45] Ruan J M. Blood-brain barrier permeability and residual tissue characteristics of avermectin (AVM) in Carassius auratusgibelio [J]. Journal of Fishery Sciences of China, 2013, 20(5): 1032-1038
[46] 邢丽红, 孙伟红, 冷凯良, 等. 阿维菌素在鲈组织中的富集及消除规律研究[J]. 中国渔业质量与标准, 2013, 3(4): 63-69
Xing L H, Sun W H, Leng K L, et al. Accumulation and elimination rules of avermectin in perch (Lateolabrax japonicus) [J]. Chinese Fishery Quality and Standards, 2013, 3(4): 63-69 (in Chinese)
[47] Jencic V, Cerne M, Erzen N K, et al. Abamectin effects on rainbow trout (Oncorhynchus mykiss) [J]. Ecotoxicology, 2006, 15(3): 249-257
[48] Tišler T, Eržen N K. Abamectin in the aquatic environment [J]. Ecotoxicology, 2006, 15(6): 495-502
[49] 王锡珍, 陆宏达. 阿维菌素对几种淡水水生动物的急性毒性作用[J]. 环境与健康杂志, 2009, 26(7): 593-597
Wang X Z, Lu H D. Acute toxic effect of abamectin on fresh-water aquatic animals [J]. Journal of Environment and Health, 2009, 26(7): 593-597 (in Chinese)
[50] Huang Y, Hong Y H, Huang Z Q, et al. Avermectin induces the oxidative stress, genotoxicity, and immunological responses in the Chinese mitten crab, Eriocheir sinensis [J]. PLoS One, 2019, 14(11): e0225171
[51] 李赫, 宋文华, 李文宽, 等. 三种常用农药对中华绒螯蟹幼蟹的急性毒性研究[J]. 水产学杂志, 2013, 26(6): 44-47
Li H, Song W H, Li W K, et al. Acute toxicity of three pesticides to juvenile Chinese mitten crab (Eriocheir sinensis) [J]. Chinese Journal of Fisheries, 2013, 26(6): 44-47(in Chinese)
[52] Ma J Y, Zheng R Q, Xu L G, et al. Differential sensitivity of two green algae, Scenedesmus obliqnus and Chlorella pyrenoidosa, to 12 pesticides [J]. Ecotoxicology and Environmental Safety, 2002, 52(1): 57-61
[53] 张卫卫, 湛嘉, 王元, 等. 药浴暴露下阿维菌素在异育银鲫体内蓄积和消除规律[J]. 海洋渔业, 2014, 36(5): 461-468
Zhang W W, Zhan J, Wang Y, et al. Accumulation and elimination of avermectinin Carassius auratus gibelio following medicated bath exposure [J]. Marine Fisheries, 2014, 36(5): 461-468 (in Chinese)
[54] Weichert F G, Floeter C, Meza Artmann A S, et al. Assessing the ecotoxicity of potentially neurotoxic substances—Evaluation of a behavioural parameter in the embryogenesis of Danio rerio [J]. Chemosphere, 2017, 186: 43-50
[55] Ogungbemi A O, Teixido E, Massei R, et al. Optimization of the spontaneous tail coiling test for fast assessment of neurotoxic effects in the zebrafish embryo using an automated workflow in KNIME® [J]. Neurotoxicology and Teratology, 2020, 81: 106918
[56] Raftery T D, Volz D C. Abamectin induces rapid and reversible hypoactivity within early zebrafish embryos [J]. Neurotoxicology and Teratology, 2015, 49: 10-18
[57] 王晶, 庄昀筠, 陈洪举, 等. 甲氨基阿维菌素苯甲酸盐对海洋桡足类日本虎斑猛水蚤的急慢性毒性效应[J]. 生态毒理学报, 2019, 14(5): 202-211
Wang J, Zhuang Y Y, Chen H J, et al. Acute and chronic toxicity of emamectin benzoate on marine copepod Tigriopus japonicus Mori [J]. Asian Journal of Ecotoxicology, 2019, 14(5): 202-211 (in Chinese)
[58] Mahmoud H, Reda F, Alagawany M, et al. The stress of abamectin toxicity reduced water quality, growth performance, immunity and antioxidant capacity of Oreochromis niloticus fish: Modulatory role of Simmondsia chinensis extract as a dietary supplement [J]. Aquaculture, 2021, 1: 534
[59] Hong Y H, Huang Y, Yang X Z, et al. Abamectin at environmentally-realistic concentrations cause oxidative stress and genotoxic damage in juvenile fish (Schizothoraxprenanti) [J]. Aquatic Toxicology, 2020, 225: 105528
[60] Amaeze N H, Komolafe B O, Salako A F, et al. Comparative assessment of the acute toxicity, haematological and genotoxic effects of ten commonly used pesticides on the African Catfish, Clarias gariepinus Burchell 1822 [J]. Heliyon, 2020, 6(8): e04768
[61] 杨宗英, 杨移斌, 张一柳, 等. 阿维菌素对中华绒螯蟹肝胰腺氧化胁迫效应和组织结构的影响[J]. 生态毒理学报, 2017, 12(4): 337-347
Yang Z Y, Yang Y B, Zhang Y L, et al. Effects of avermectin exposure on oxidative stress and histological structure of hepatopancreas in Eriocheir sinensis [J]. Asian Journal of Ecotoxicology, 2017, 12(4): 337-347(in Chinese)
[62] 陈诚, 罗纨, 邹家荣, 等. 稻田水体中毒死蜱和阿维菌素监测及水生动物生态风险评价[J]. 农业工程学报, 2019, 35(11): 195-205
Chen C, Luo W, Zou J R, et al. Monitoring chlorpyrifos and abamectin in water bodies of paddies and assessment of ecological risk to aquatic animals [J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(11): 195-205 (in Chinese)
[63] de Souza S M, Vasconcelos E C, Dziedzic M, et al. Environmental risk assessment of antibiotics: An intensive care unit analysis [J]. Chemosphere, 2009, 77(7): 962-967
[64] 周帅, 房文红, 吴淑勤. 渔用阿维菌素水乳剂的安全性和药效评价[J]. 上海海洋大学学报, 2009, 18(3): 327-331
Zhou S, Fang W H, Wu S Q. Evaluation of safety and efficacy of abamectin emulsion in water for aquaculture [J]. Journal of Shanghai Ocean University, 2009, 18(3): 327-331 (in Chinese)
[65] Li C J, Luo Y, Yang J W, et al. Study on the toxicity effect of abamectin and chlorpyrifos on grass carp (Ctenopharyngodon idllus) [J]. Plant Diseases and Pests, 2011, 2(1): 67-70
[66] 王锡珍, 陆宏达. 关于阿维菌素对异育银鲫的急性毒性和组织病理研究[J]. 大连水产学院学报, 2010, 25(1): 66-70
Wang X Z, Lu H D. The acute toxicity and histopathology of abamectin in allogynogenetic crucian carp [J]. Journal of Dalian Fisheries University, 2010, 25(1): 66-70 (in Chinese)
[67] 杨亚洲. 三种农药对稀有鮈鲫内分泌干扰效应初步研究[D]. 金华: 浙江师范大学, 2014: 54-56
Yang Y Z. Preliminary study of endocrine disrupting effects of three pesticides on rare minnow[D]. Jinhua: Zhejiang Normal University, 2014: 54-56 (in Chinese)
[68] 封琦, 王建国, 王权, 等. 伊维菌素和阿维菌素对中华鰟鮍的急性毒性效应[J]. 安徽农业科学, 2012, 40(32): 15729-15731
Feng Q, Wang J G, Wang Q, et al. Acute toxicity of ivermectin and avermectin on Rhodeus sinensis [J]. Journal of Anhui Agricultural Sciences, 2012, 40(32): 15729-15731(in Chinese)
[69] Hedayati A, Vajargah M F, Yalsuyi A M, et al. Acute toxicity test of pesticide abamectin on common carp (Cyprinus carpio) [J]. Journal of Coastal Life Medicine, 2014, 2(11): 841-844
[70] Sanches A L M, Vieira B H, Reghini M V, et al. Single and mixture toxicity of abamectin and difenoconazole to adult zebrafish (Danio rerio) [J]. Chemosphere, 2017, 188: 582-587
[71] 宋洋. 河鲈、白斑狗鱼对三种常用渔药的急性毒性研究[D]. 乌鲁木齐: 新疆农业大学, 2014: 26-27
Song Y. The acute toxicity of three common fishery drugs to Perca fluviatilis Linnaeus and Esox lucius Linnaeus [D]. Urumqi: Xinjiang Agricultural University, 2014: 26-27 (in Chinese)
[72] 刘鉴章, 刘慧君. 阿维菌素和三唑磷对泥鳅的急性毒性研究[J]. 农药科学与管理, 2009, 30(5): 27-29
Liu J Z, Liu H J. Acute toxicity of abamectin and triazophos to Misgurnus dabrvanu [J]. Pesticide Science and Administration, 2009, 30(5): 27-29 (in Chinese)
[73] 徐先栋, 曹义虎, 邓勇辉, 等. 六种常用渔药对黑尾近红鲌鱼种的急性毒性试验[J]. 水产科学, 2013, 32(12): 696-700
Xu X D, Cao Y H, Deng Y H, et al. Acute toxicity of six common fishery medicines to Ancherythroculter nigrocauda juveniles [J]. Fisheries Science, 2013, 32(12): 696-700(in Chinese)
[74] 张建明, 田甜, 姜伟. 8种水产药物对长薄鳅幼鱼的急性毒性试验[J]. 河南农业科学, 2018, 47(7): 137-143
Zhang J M, Tian T, Jiang W. Study on acute toxicity of eight kinds of aquatic drugs to elongate loach (Leptobotia elongata) [J]. Journal of Henan Agricultural Sciences, 2018, 47(7): 137-143 (in Chinese)
[75] 杨代勤, 阮国良, 刘家芳, 等. 阿维菌素对黄鳝及棘头虫的毒性影响[J]. 湖北农业科学, 2009, 48(8): 1973-1975
Yang D Q, Ruan G L, Liu J F, et al. Toxic effect of avermectin on Monopterus albus and the parasites of Acanthocephala [J]. Hubei Agricultural Sciences, 2009, 48(8): 1973-1975 (in Chinese)
[76] 谢瑞涛, 黄凯, 覃志彪, 等. 5种常用农药对江黄颡鱼急性毒性试验[J]. 水产科学, 2010, 29(5): 274-277
Xie R T, Huang K, Qin Z B, et al. The acute toxicity of five pesticides to yellow catfish Pelteobagrus vachelli [J]. Fisheries Science, 2010, 29(5): 274-277 (in Chinese)
[77] 简贺君, 张明辉, 谢俊刚. 阿维菌素对斑点叉尾鮰的急性毒性试验研究[J]. 安徽农学通报, 2014, 20(11): 134-135, 140
Jian H J, Zhang M H, Xie J G. Experimental study on acute toxicity of avermectin on the Ietalurus punetaus [J]. Anhui Agricultural Science Bulletin, 2014, 20(11): 134-135, 140 (in Chinese)
[78] Shen J Z, Zhang Q D, Ding S Y, et al. Bioconcentration and elimination of avermectin B1 in sturgeon [J]. Environmental Toxicology and Chemistry, 2005, 24(2): 396-399
[79] 张立民, 苏宝锋, 常玉梅, 等. 四种常用渔药对雅罗鱼杂交幼鱼的急性毒性[J]. 水产学杂志, 2016, 29(6): 47-51
Zhang L M, Su B F, Chang Y M, et al. Acute toxicity of four aquaculture drugs on hybrid dace(Leuciscus waleckii Dybowski×Leuciscus idus) juveniles [J]. Chinese Journal of Fisheries, 2016, 29(6): 47-51 (in Chinese)
[80] 陈斌, 樊海平, 钟全福, 等. 6种常用渔药对大刺鳅苗种的急性毒性试验[J]. 渔业研究, 2018, 40(4): 302-307
Chen B, Fan H P, Zhong Q F, et al. Acute toxicity test of six commonly-used aquaculture drugs on juvenile Masracembelue armatus [J]. Journal of Fisheries Research, 2018, 40(4): 302-307 (in Chinese)
[81] 徐滨, 朱祥云, 魏开金, 等. 四种稻田农药对克氏原螯虾的急性毒性研究[J]. 淡水渔业, 2014, 44(5): 38-42
Xu B, Zhu X Y, Wei K J, et al. Acute toxicity of four pesticides in rice field to Procambarus clarkii [J]. Freshwater Fisheries, 2014, 44(5): 38-42 (in Chinese)