药物的出现给人类身体健康和预期寿命带来不可否认的益处。然而,在许多个国家的内陆湖、地下水等多种环境水体中均可检测出人类使用的药物[1-3]。尽管这些药物的浓度较低(通常为纳克级别),但由于其源源不断地进入环境水体中,导致环境中的水生生物长期处于暴露状态,引起药物蓄积效应。由于药物本身所具有特殊生理活性,通常会对污染水体中的水生生物的生理功能产生影响,进而威胁其健康。因此,水体药物污染以及对水生生物健康的影响研究已然成为生态毒理学的研究热点之一。
选择性五羟色胺重摄取抑制剂(selective serotonin reuptake inhibitor, SSRI)为通过特异性结合突触前膜血清素转运体(serotonin transporter, SERT),抑制突触前膜对突触间隙内5-HT的重摄取,从而增加细胞外5-HT浓度的一类药物[4]。SSRI类药物主要包括氟西汀(fluoxetine)、帕罗西汀(paroxetine)、西酞普兰(citalopram)、舍曲林(sertraline)等。SSRIs的广泛使用开始于20世纪90年代中期,由于安全性高、副作用小及在减少抑郁症和焦虑症状方面的有效性,使得SSRIs在过去的几十年里已经成为应用最为广泛的抗抑郁药物[5-6]。其中,氟西汀和帕罗西汀为SSRIs的代表性药物。
人类排泄、未使用或过期而直接丢弃的SSRIs药物通过卫生间、下水道等管道系统进入生活废水,并主要通过污水处理厂进入环境水体中[7],最终汇入海洋。大量研究发现,在美国、加拿大以及欧洲的一些国家的污水处理厂废水中均检测到了不同浓度的SSRIs[8]。已有研究证实,污水处理厂无法彻底清除生活污水中的SSRIs药物[9],导致其成为药物持续低浓度进入环境水体的主要途径[2, 10-12]。有学者研究发现,在欧洲和北美的一些城市附近的污水排放口和其下游地表水中分别检测到氟西汀和其代谢物诺氟西汀残留,其浓度范围为0.001 μg·L-1到1.3 μg·L-1之间[13-14]。另有研究发现,水体环境中氟西汀半衰期通常为100 d以上,且抗光解、水解和生物降解能力强,导致其可长时间存在于环境中[15-16],因此在地表水、污水排放口、地表水和海水中被检出,其浓度分别为0.54、0.929、0.056和0.0026 μg·L-1[8, 14, 17]。而帕罗西汀半衰期则较短,通常<1 d[8],因此未见相关研究报道。基于二者半衰期比较,氟西汀对生态环境的影响可能比帕罗西汀更大。
头足类动物是研究复杂的大脑发育机制和激动剂的新兴模型之一[18-21]。章鱼是头足类代表性的动物之一,无脊椎动物相比于其他海洋生物对SSRIs更敏感[22]。头足类动物最显著的特征是拥有无脊椎动物中最高级、最复杂的中枢神经系统,具备处理信息和学习能力。头足类大脑由数百万个神经元构成,脑体质量比与脊椎动物相似。在脊椎动物中,5-HT受体有7种类型,即5-HT1、5-HT2、5-HT3、5-HT4、5-HT5、5-HT6和5-HT7受体。目前,根据结构和功能的差别已鉴定出15种亚型[23]。而无脊椎动物5-HT受体类型尚不明确且5-HT受体分布位置与脊椎动物也不完全相同。现有研究表明,5-HT在头足类动物中枢神经系统含量较低,仅在少数区域富集,如中壳缝和额叶皮质等[24],但5-HT神经递质系统在调节水生软体动物的生存和繁殖中发挥着重要作用。在对于乌贼心脏的研究中发现,心肌壁振动频率和幅度受5-HT1和5-HT2受体调节[25]。5-HT可调节海兔的摄食运动[26]、收缩反射[27]和防御[28];并参与调节太平洋牡蛎的配子体发生、胚胎发育、诱导卵母细胞成熟和排卵[29]。此外,Andrews等[30]用主动脉灌注技术向章鱼体内注射5-HT可以清楚观察到喷墨和排泄行为。5-HT在章鱼学习记忆中也起到重要作用,Shomrat等[31]认为5-HT能够通过增强与记忆形成相关的神经元之间的信号传递,以此促进长时程增强(long-term potentiation, LTP)的产生。
综上所述,抗抑郁药会通过多种渠道持续进入自然水体中并对其中生活的生物健康造成威胁。截至目前,关于抗抑郁药物水体环境污染对水生生物健康影响的研究较少。基于以上背景,本研究选取抗抑郁症代表性药物氟西汀和帕罗西汀,探讨2种药物对章鱼脑组织5-HT能神经递质系统的影响,为进一步研究水体环境药物污染对章鱼脑组织重要生理功能的影响提供基础数据。
1 材料与方法(Materials and methods)
1.1 药物
氟西汀(F132,CAS:56296-78-7)和帕罗西汀(Y0000578,CAS:78246-49-8)购于Sigma-Aldrich公司。将氟西汀和帕罗西汀于1%乙醇溶液中分别溶解,配制成终浓度为1 mg·L-1的药物溶液,置于4 ℃保存备用。
1.2 实验动物与处置方法
100只野生成体短蛸章鱼(O. ochellatus)(雌雄各半)捕捉自舟山市岱山县附近海域,雌性体质量为105.3~124.5 g;雄性体质量为98.7~128.1 g。于光照和温度受控的水培设施中驯化一周,水箱体积为(60 cm×30 cm×40 cm),光照周期为14 h∶10 h,温度恒定在(16±1) ℃,每日2次喂食脊尾白虾(Exopalaemon carinicauda)。选择参考文献报道的药物环境浓度水平[32-33],章鱼分别于100、50、20 ng·L-1氟西汀溶液、100、50、20 ng·L-1帕罗西汀溶液和100、50、20 ng·L-1氟西汀及帕罗西汀混合药物溶液中连续暴露14 d,同时设置1%乙醇溶液暴露组(溶剂对照组),10只•组-1,实验采用生物重复,取样数为5只•组-1。为保障暴露浓度稳定,每24 h更换一次暴露液,换水体积为100%。于暴露结束后收集脑组织。
1.3 RNA提出及qPCR
MgCl2溶液麻醉章鱼后收集全脑[34],采用RNAeasyTM动物RNA抽提试剂盒(上海碧云天生物技术有限公司)提取脑组织中RNA,所有步骤按照试剂盒说明书进行。取15~20 mg组织块,置于1.5 mL离心管中,迅速加入600 μL冰浴预冷的裂解液,用微型电动匀浆器匀浆。匀浆后,轻轻吹打匀浆液使其充分混合,室温放置3 min。然后约14 000×g离心2 min,将上清液移至新的离心管中。加入等体积结合液至裂解液中,轻轻颠倒混匀3~5次。将混合物转移至纯化柱内,12 000×g离心30 s,倒弃收集管内液体。加入600 μL洗涤液Ⅰ,12 000×g离心30 s,倒弃收集管内液体。加入600 μL洗涤液Ⅱ,12 000×g离心30 s,倒弃收集管内液体,重复一次。16 000×g离心2 min,去除残留的液体。将RNA纯化柱置于该试剂盒提供的RNA洗脱管中,加入40 μL洗脱液,室温放置3 min,最高速离心30 s,所得溶液即为纯化的RNA。采用NANODROP 2000c对RNA浓度进行测定。采用BeyoRTTM Ⅱ cDNA合成试剂盒(上海碧云天生物技术有限公司)进行反转录,每个反转录体系中加入1 μg RNA。
为了解药物对章鱼脑中5-HT神经递质系统正常功能的影响,分别选取了5-HT神经递质系统中重要的功能分子,包括5-HT转运体(SERT)、5-HT受体(5-HTR2A、5-HTR1B、5-THR1)等,各基因扩增效率均满足条件。引物序列见表1。q-PCR扩增采用CFXConnect系统(Bio-Rad,美国),使用BeyoFastTMSYBR Green qPCR Mix(上海碧云天生物技术有限公司),进行3次重复实验以消除数据误差。采用的PCR方案为:95 ℃下变性10 min,进行40次循环,熔解曲线为65~95 ℃范围内获得。采用熔解曲线分析的方法检测引物的特异性。表达数据与β-actin的表达进行归一化处理。采用2-△△Ct法计算各组间各基因水平的相对定量。
表1 引物序列
Table 1 Primers for Real-time PCR
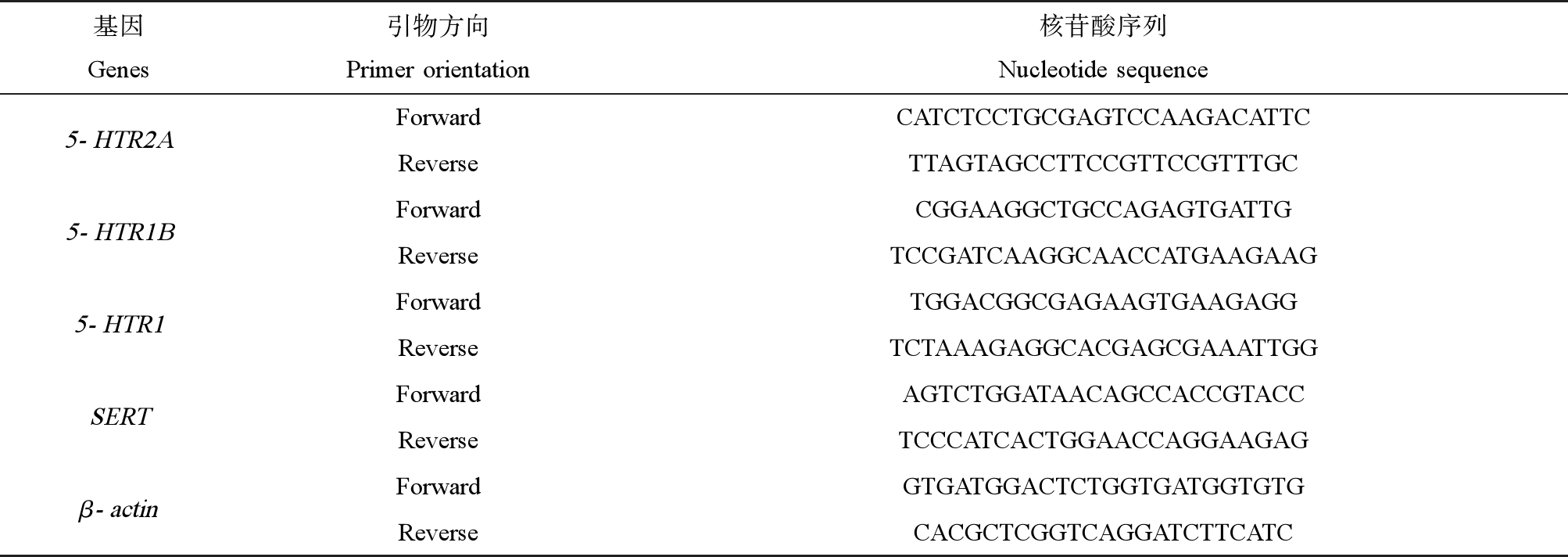
基因Genes引物方向Primer orientation核苷酸序列Nucleotide sequence5-HTR2AForwardCATCTCCTGCGAGTCCAAGACATTCReverseTTAGTAGCCTTCCGTTCCGTTTGC5-HTR1BForwardCGGAAGGCTGCCAGAGTGATTGReverseTCCGATCAAGGCAACCATGAAGAAG5-HTR1ForwardTGGACGGCGAGAAGTGAAGAGGReverseTCTAAAGAGGCACGAGCGAAATTGGSERTForwardAGTCTGGATAACAGCCACCGTACCReverseTCCCATCACTGGAACCAGGAAGAGβ-actinForwardGTGATGGACTCTGGTGATGGTGTGReverseCACGCTCGGTCAGGATCTTCATC
1.4 Western blot分析
动物麻醉后收集全脑,使用RIPA裂解液(P0013C,上海碧云天生物技术有限公司)提取蛋白质。组织块用预冷的PBS洗涤2~3次,加入10倍组织体积的裂解液(使用前数分钟内加入蛋白酶抑制剂),设置匀浆程序进行匀浆。将匀浆完成的匀浆管取出,放置冰上裂解30 min,每隔5 min震荡一次确保组织完全裂解。12 000 r·min-1、4 ℃,离心10 min,收集上清,即为总蛋白溶液。采用BCA蛋白定量试剂盒(上海碧云天生物技术有限公司)进行蛋白质浓度测定。将30 μg蛋白质通过10%浓度聚丙烯酰胺凝胶电泳进行分离。将载有蛋白质的PVDF膜进行5%脱脂奶粉室温封闭30 min后进行4 ℃一抗孵育过夜,包括兔抗5-HTR1(ab227165,abcam,1∶1 000)、兔抗5-HTR 1A(K009515P,Solarbio,1∶2 000)、兔抗5-HTR 1B(PA5-111905,Thermofisher,1∶500)、兔抗5-HTR 2B(K004123P,Solarbio,1∶2 000)、兔抗SERT (ab272912,abcam,1∶500)及小鼠抗β-actin (66009-1-lg,武汉三鹰,1∶3 000)。次日,回收一抗,用TBST快速涮洗膜3次,然后加入TBST,放置脱色摇床上快速洗脱,每次5 min,洗3次。将二抗用TBST按照1∶5 000的比例进行稀释,然后加入孵育槽中,放置摇床上慢摇,室温下孵育30 min。用TBST快速涮洗膜3次,然后再加入TBST,放置脱色摇床上快速洗脱,每次5 min,洗3次。在暗室中将ECL A液和ECL B液2种试剂在离心管中等体积混合,在曝光匣上贴双层PE手套或者其他透明薄膜,将PVDF膜的蛋白面朝上放在曝光匣两层薄膜之间,加入混合好的ECL溶液充分反应,1~2 min后,去尽残液,盖上层薄膜开始压胶片。压完的胶片用显影、定影试剂进行显影和定影(EPSON, V370)。根据不同的发光强度调整曝光条件。将胶片进行扫描存档,PhotoShop整理去色,Alpha(FluorChem E)系统分析目标带的光密度值。
1.5 数据分析
使用GraphPad Prism 9.2进行数据分析与制图。结果以平均值±标准误差表示。采用Levene和Kolmogorov-Smirnov Levene分别检验数据的方差齐性和正态性。SERT、5-HTR1、5-HTR1B和5-THR2A的相对转录差异,SERT、5-HTR1、5-HTR1A、5-HTR2B、5-HTR1B不同组的条带强度采用重复测量双向方差分析,然后采用Dunnett多重比较检验。概率(P)值<为0.05被认为有统计学意义。
2 结果(Results)
2.1 氟西汀和帕罗西汀对章鱼脑5-HT能神经递质系统相关基因表达的影响
2.1.1 氟西汀暴露对章鱼脑5-HT能神经递质系统相关基因表达的影响
由图1可知,经过14 d连续暴露,20 ng·L-1氟西汀暴露组章鱼脑组织中的5-HTR1B、5-HTR2A基因表达量低于对照组且差异具有显著性(P<0.05);50 ng·L-1氟西汀暴露组出现5-HTR1、5-HTR1B、SERT基因表达量低于对照组(P<0.05),5-HTR2A基因表达量低于对照组且差异具显著性(P<0.01);100 ng·L-1氟西汀暴露组对比对照组5-HTR1、5-HTR1B、SERT、5-HTR2A(P<0.05)基因表达量差异均显著(P<0.05),其中氟西汀对5-HTR2A影响最为显著,与对照组相比基因表达下调倍数最高为100倍。

图1 氟西汀连续暴露14 d引起章鱼脑5-HT能神经递质系统功能分子基因转录水平改变
注:*表示P<0.05,**表示P<0.01,***表示P<0.001;n=5。
Fig. 1 Fluoxetine exposure for 14 d induced changes in gene transcription levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05, **represents P<0.01, ***represents P<0.001; n=5.
2.1.2 帕罗西汀暴露对章鱼脑5-HT能神经递质系统相关基因表达的影响
由图2可知,帕罗西汀连续暴露14 d后引起章鱼脑组织5-HTR2A基因表达水平相对于对照组下调显著(P<0.05)。其中,20 ng·L-1帕罗西汀暴露组出现5-HTR1、5-HTR2A、SERT基因表达水平与对照组相比差异显著(P<0.05);5-HTR1B基因表达水平相较于对照组略有下降但差异不显著(P>0.05);与对照组相比50 ng·L-1帕罗西汀暴露组5-HTR1B、5-HTR2A基因表达水平差异显著(P<0.05),而5-HTR1与SERT基因表达水平对比对照组有下降趋势,但无显著性(P>0.05);与对照组相比100 ng·L-1帕罗西汀暴露组出现5-HTR1、5-HTR1B、5-HTR2A基因表达水平下调显著(P<0.05),但SERT基因相对表达水平无显著下调。5-HTR2A对帕罗西汀同样敏感,其基因表达水平下调倍数最高为25倍。
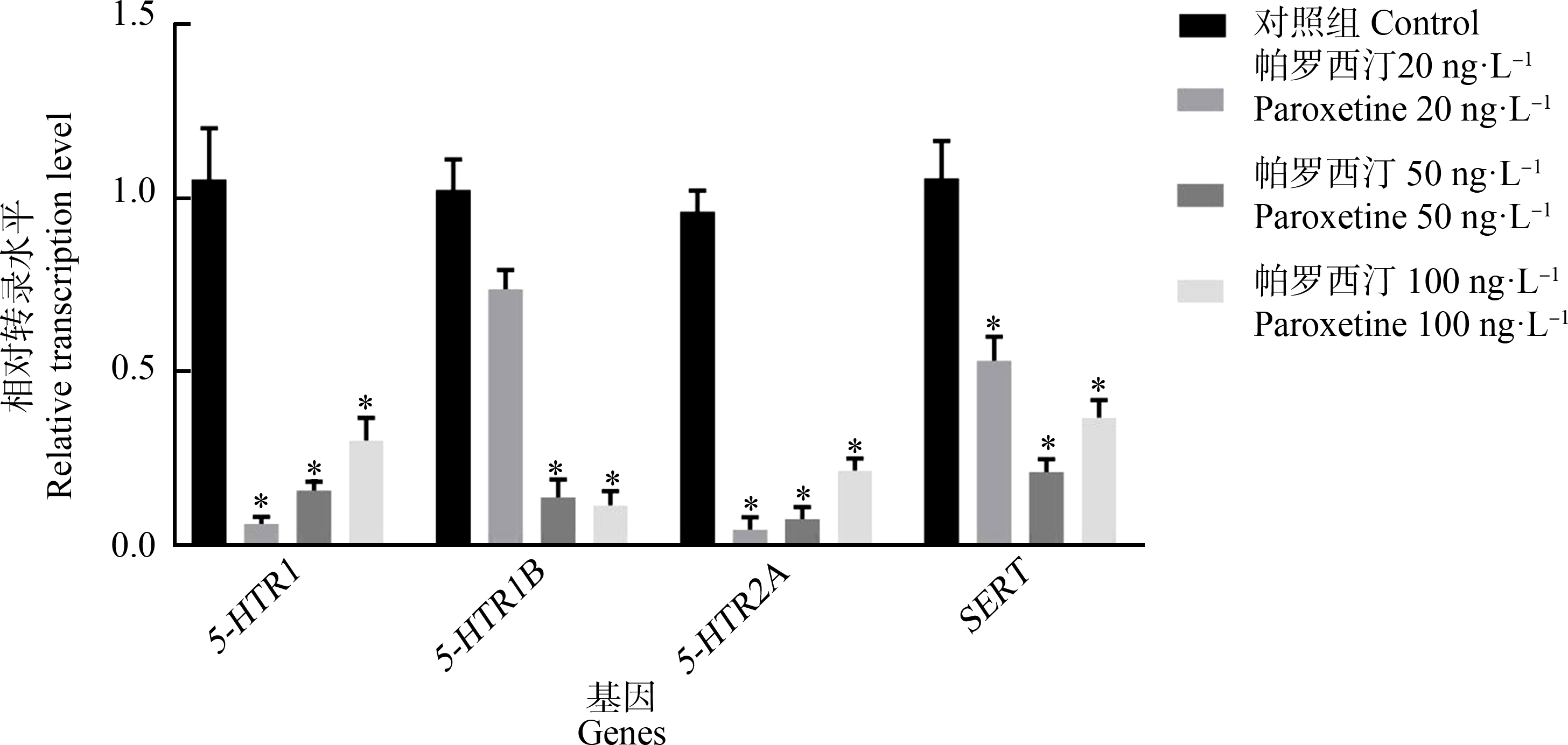
图2 帕罗西汀连续暴露14 d引起章鱼脑5-HT能神经递质系统功能分子基因转录水平改变
注:*表示P<0.05;n=5。
Fig. 2 Paroxetine exposure for 14 d induced changes in gene transcription levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05; n=5.
2.1.3 氟西汀和帕罗西汀混合暴露对章鱼脑5-HT能神经递质系统相关基因表达的影响
如图3所示,氟西汀和帕罗西汀混合暴露14 d对章鱼脑组织5-HTR1基因相对表达水平并无显著影响。但导致5-HTR2A、5-HT1B、SERT基因相对表达水平下调显著(P<0.05)。其中,20 ng·L-1、100 ng·L-1氟西汀和帕罗西汀混合暴露导致5-HTR1B、SERT基因相对表达水平对比对照组下调(P<0.05)且5-HT2A基因相对表达水平下调具显著性(P<0.01);50 ng·L-1氟西汀和帕罗西汀混合暴露组5-HTR1B、5-HTR2A、SERT基因相对表达水平对比对照组降低同样显著(P<0.05)。
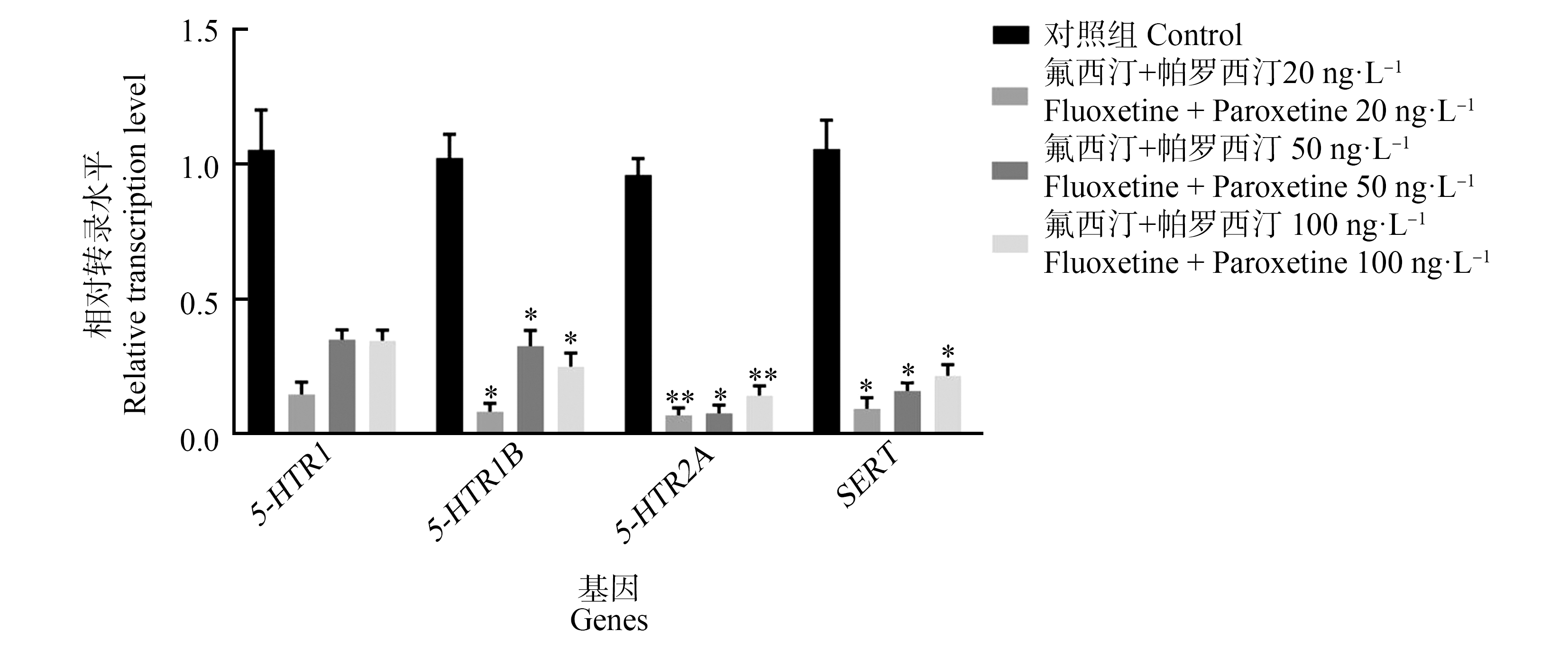
图3 氟西汀和帕罗西汀混合暴露14 d引起章鱼脑5-HT能神经递质系统功能分子基因转录水平改变
注:*表示P<0.05,**表示P<0.01;n=5。
Fig. 3 Fluoxetine and paroxetine combined exposure for 14 d induced changes in gene transcription levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05, **represents P<0.01; n=5.
2.2 氟西汀和帕罗西汀对章鱼脑5-HT能神经递质系统功能分子蛋白表达水平的影响
使用蛋白质印迹技术(Western-blotting)对药物不同浓度暴露后章鱼脑组织中5-HTR1、5-HTR1B、5-HTR1A、5-HTR2B和SERT的表达水平进行分析,结果如图4所示。并使用Alpha凝胶成像系统将图片信息转换为数据信息,进一步分析得出图5~7。
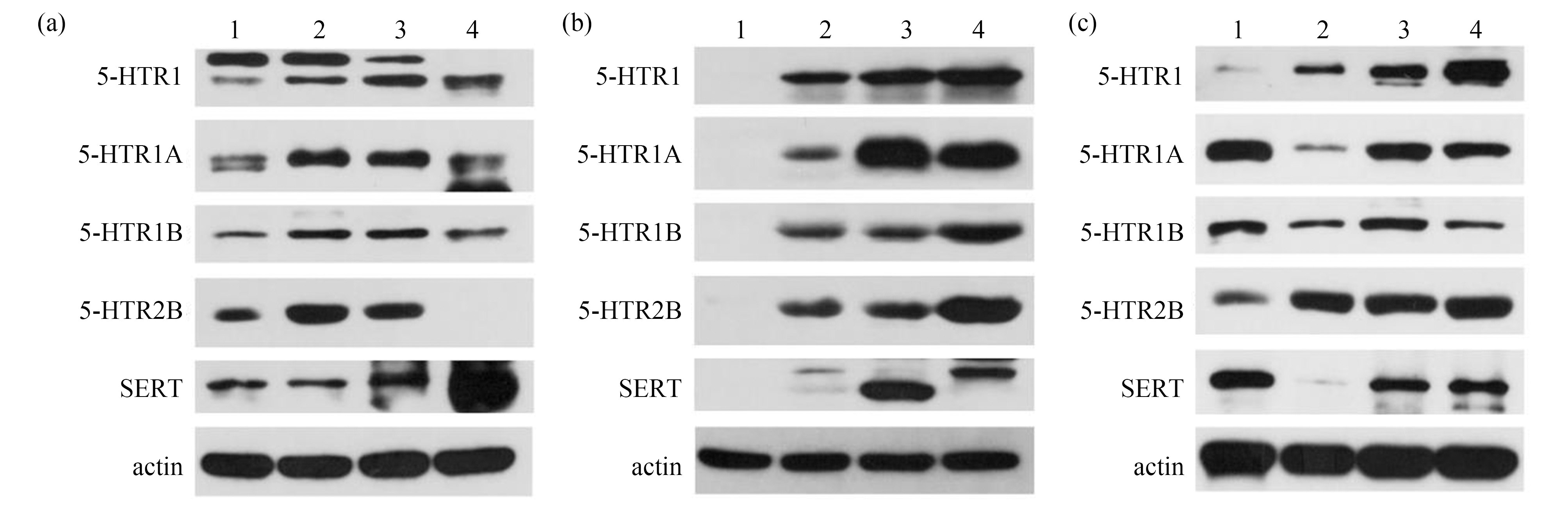
图4 氟西汀和帕罗西汀对章鱼脑组织中5-HT能神经递质系统功能分子蛋白表达水平的影响
注:(a)、(b)、(c)图依次为氟西汀、帕罗西汀与混合暴露组,其中1为空白对照组;2~4为2.20 ng·L-1、3.50 ng·L-1、4.100 ng·L-1组。
Fig. 4 Effect of fluoxetine and paroxetine on the expression levels of functional molecular proteins in the 5-HT-ergic neurotransmitter system in the octopus brain tissue
Note: (a), (b), (c) are respectively shown for fluoxetine, paroxetine and the mixed exposure group, of which 1 control group; 2~4 means 2.20 ng·L-1, 3.50 ng·L-1, 4.100 ng·L-1 groups.

图5 氟西汀暴露14 d引起章鱼脑5-HT能神经递质系统功能分子蛋白表达水平改变
注:*表示P<0.05,****表示P<0.0001;n=5。
Fig. 5 Fluoxetine exposure for 14 d induced changes in protein expression levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05, ****represents P<0.0001; n=5.
2.2.1 氟西汀暴露对章鱼脑5-HT能神经递质系统功能分子表达水平的影响
氟西汀连续暴露14 d对章鱼脑组织5-HTR1、SERT表达水平无显著影响(图5)。20 ng·L-1氟西汀暴露组5-HTR1A、5-HTR2B表达水平上调且具有显著性(P<0.05);50 ng·L-1氟西汀暴露组出现5-HTR1B表达水平显著升高(P<0.05);100 ng·L-氟西汀暴露组出现5-HTR2B表达水平显著降低(P<0.0001)。
2.2.2 帕罗西汀暴露对章鱼脑5-HT能神经递质系统功能分子表达水平的影响
帕罗西汀连续暴露14 d引起章鱼脑组织5-HTR1、5-HTR1B、5-HTR1A、5-HTR2B、SERT表达水平均有上升趋势(图6)。具体表现为帕罗西汀暴露使5-HTR1表达水平上调显著(P<0.05);5-HTR1A、5-HTR1B表达水平升高,但差异不显著(P>0.05);100 ng·L-1帕罗西汀暴露组出5-HTR1、5-HTR1B、5-HTR2B表达水平上调显著(P<0.01)。其中5-HTR1、5-HTR2B出现明显剂量-效应关系。

图6 帕罗西汀暴露14 d引起章鱼脑5-HT能神经递质系统功能分子蛋白表达水平改变
注:*表示P<0.05,**表示P<0.01,***表示P<0.001;n=5。
Fig. 6 Paroxetine exposure for 14 d induced changes in protein expression levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05, **represents P<0.01, ***represents P<0.001; n=5.
2.2.3 氟西汀和帕罗西汀混合暴露对章鱼脑5-HT能神经递质系统功能分子表达水平的影响
根据图7可知,20 ng·L-氟西汀和帕罗西汀混合暴露14 d引起章鱼脑组织SERT、5-HTR1A表达水平下调(P<0.05);并伴随着5-HTR2B表达水平升高(P<0.05)。;50 ng·L-1氟西汀和帕罗西汀混合暴露组出现5-HTR1、5-HTR2B表达水平上调(P<0.05);100 ng·L-1氟西汀和帕罗西汀混合暴露组出5-HTR1表达水平上调(P<0.05)。但氟西汀和帕罗西汀混合暴露对5-HT1B影响无显著性差异。
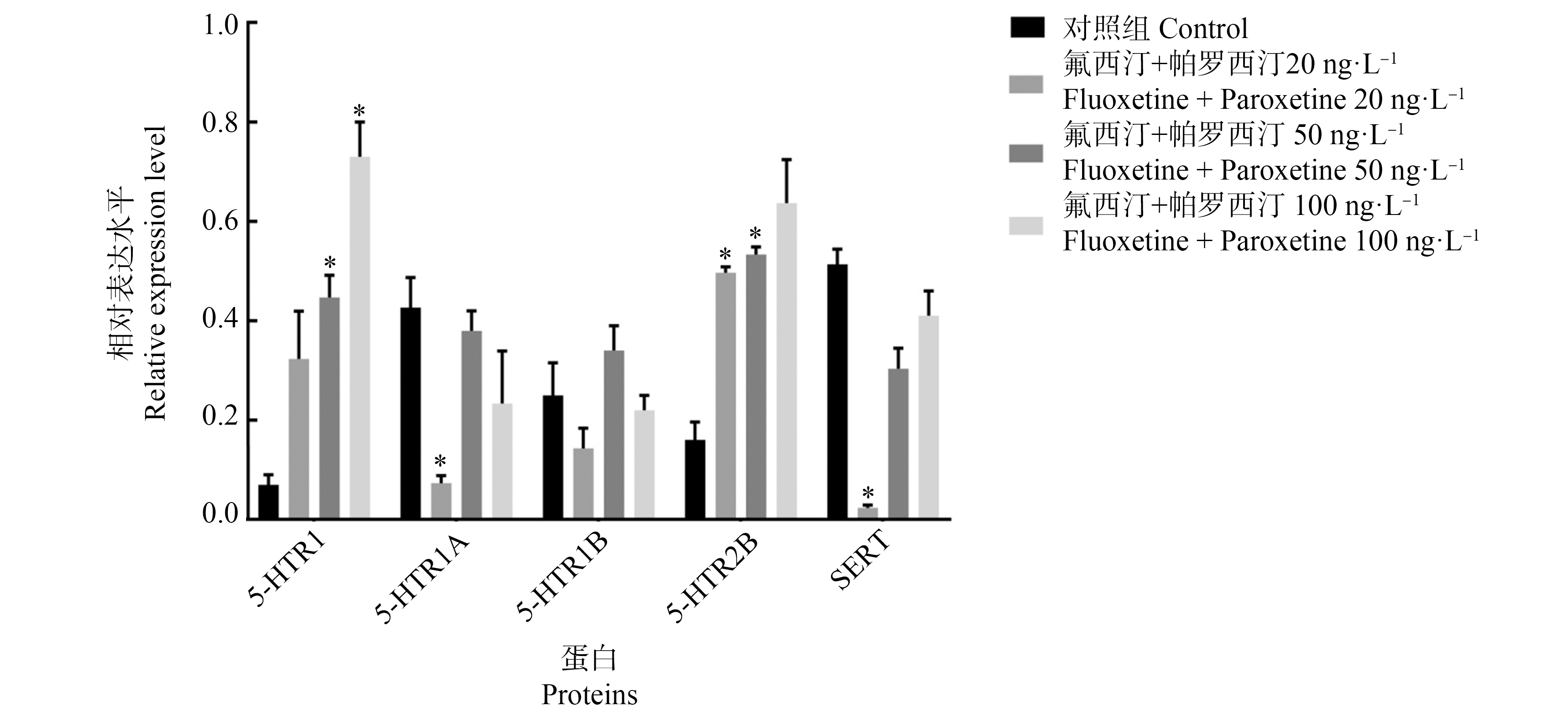
图7 氟西汀和帕罗西汀混合暴露14 d引起章鱼脑5-HT能神经递质系统功能分子蛋白表达水平改变
注:*表示P<0.05;n=5。
Fig. 7 Fluoxetine and paroxetine combined exposure for 14 d induced changes in protein expression levels of functional molecules of 5-HT neurotransmitter systems in octopus brain tissue
Note: *represents P<0.05; n=5.
3 讨论(Discussion)
5-HT能神经递质系统在调控运动、动机与行为、学习和记忆、情绪等脑功能中发挥重要作用[35]。受体表达水平的改变对神经递质系统信号的传导具有重要影响;5-HT转运蛋白(serotonin transporter, SERT)通过从突触间隙高亲和性摄取5-HT来调节5-HT能神经传递的强度和持续时间。本研究通过检测章鱼脑中5-HTR1、SERT、5-HTR1A、5-HTR2B、5-HTR1B基因转录水平与蛋白质表达水平的改变,探讨氟西汀与帕罗西汀对于章鱼脑组织中5-HT能神经传导系统的影响。
3.1 氟西汀暴露对于章鱼中枢神经系统5-HT影响
氟西汀通过抑制突触间隙5-HT重摄取的方式,导致5-HTR1、5-HTR2A、5-HTR1B和SERT基因转录水平下调,与前人研究一致[36-39]。与转录水平不同的是,氟西汀暴露引起章鱼脑中5-HT能系统功能蛋白表达水平出现升高,但这种升高呈现剂量依赖性下降,具体表现为5-HTRA、5-HTR1B、5-HTR2B蛋白表达水平上调,且随着氟西汀剂量增加上调程度出现下降趋势。其中,50 ng·L-1氟西汀暴露组5-HT能系统功能基因转录水平下调程度要高于100 ng·L-1组。产生这种现象的原因可能是在高剂量(100 ng·L-1)下,机体存在代偿机制,以抵消转录水平下调,在较低浓度(50 ng·L-1)下,没有超过生物体耐受阈值而引起机体的代偿效应[40]。出现基因转录水平与蛋白质表达水平矛盾且蛋白质表达水平随氟西汀剂量依赖性下降的原因为机体对药物产生的不良影响反应较早,在药物暴露前期已有大量功能蛋白分子表达并发挥调控作用,因此出现转录水平下调伴有蛋白表达水平上调[41]。
3.2 帕罗西汀暴露对于章鱼中枢神经系统5-HT影响
虽然帕罗西汀的半衰期很短,但由于污水处理厂无法彻底清除生活废水中的帕罗西汀,致使药物以相对低浓度、持续地进入环境水体,对生态环境造成的危害同样不可忽视。毒理学实验证实,环境浓度SSRIs通过影响围产期乌贼5-HT能系统导致其出现伪装效率损伤、挖砂行为增加等异常表现,严重影响了乌贼的个体生存[42]。研究发现,水体中帕罗西汀同样能够导致5-HT能系统功能分子发生变化,具体表现为5-HTR1、5-HTR2A、5-HTR1B和SERT转录水平均出现下调,伴随出现5-HTR1、SERT、5-HTR1A、5-HTR2B、5-HTR1B蛋白表达水平升高,较氟西汀相比效果更加显著。研究证实,帕罗西汀的疗效优于氟西汀[43-44]。同时,帕罗西汀与氟西汀具有相似的抗抑郁和抗焦虑功效与安全性及耐受性[45-47]。由此,我们认为产生上述差异的主要原因是物种不同导致对药物的反应性不同。此外,位于突触前膜的5-HTR1受体活化会抑制神经元活动,引起递质释放量减少(包括5-HTR1A,调控神经元放电和5-HTR1B,调控5-HT释放)[48]。同等剂量下帕罗西汀同样出现基因转录水平与蛋白质表达水平矛盾,原因可能是真核基因表达的转录和翻译发生的时间和位点存在时空间隔;其次需要经历转录后加工,转录产物的降解、翻译、翻译后加工及修饰等多个步骤[49],所以导致转录水平和翻译水平并不完全一致;另一个原因是,由于蛋白质比RNA更稳定,且生物体中翻译并不是在转录后立刻进行,导致在蛋白质含量增加或达到峰值时,RNA已经降解。帕罗西汀通过抑制突触间隙5-HT回收利用以及5-HT受体转录和表达的方式降低5-HT能系统活性并减弱5-HT能系统的信号传导。
3.3 氟西汀和帕罗西汀混合暴露对于章鱼中枢神经系统5-HT影响
实验结果显示,氟西汀和帕罗西汀混合暴露通过选择性抑制5-HT再摄取,对章鱼脑组织5-HT能系统产生影响。其中20 ng·L-1药物混合暴露组出现5-HTR1、5-HTR2A、5-HTR1B和SERT转录水平下调,以及5-HTR1、5-HTR2B蛋白表达水平上调现象。已有研究发现[50],5-HT再摄取抑制剂可降低患者中枢5-HT2A受体的密度。可能原因为5-HT2A受体的减少导致其介导的5-HT释放负反馈功能被抑制,导致5-HT合成增加、突触间隙5-HT转运回收减少。50 ng·L-1药物混合暴露组对5-HT能系统的影响与20 ng·L-1药物混合暴露组类似。不同的是,5-HTR1、5-HTR2A、5-HTR1B和SERT转录水平与5-HTR1、SERT、5-HTR1A、5-HTR2B、5-HTR1B蛋白表达水平较20 ng·L-1药物混合暴露组均出现上调,究其原因为突触间隙中过量的5-HT被SERT转运收回或被突触后膜的受体利用,表现为SERT、5-HTR1A、5-HTR2B、5-HTR1B、5-HTR2A表达水平上调。100 ng·L-1药物混合暴露组对5-HT能系统的影响与20 ng·L-1药物混合暴露组类似,但影响没有50 ng·L-1药物混合暴露组显著。表现为5-HTR1、5-HTR2A、5-HTR1B和SERT转录水平下调,同时出现5-HTR1A、5-HTR1B和SERT蛋白表达水平下调。这也印证了“低剂量”效应的存在——更低的剂量(或浓度)会产生高剂量(或浓度)无法产生的影响[51]。此外我们发现,2种药物混合暴露对5-HT能系统的影响程度弱于两者单独暴露,提示2种药物可能存在拮抗作用。同时,2种药物混合暴露对章鱼脑组织5-HT能系统的影响随剂量增加具有下降趋势,表现为2种神经递质系统功能分子表达水平出现降低,提示2种药物之间的拮抗作用随着剂量增加而增强,对章鱼脑组织5-HT能系统的影响随剂量增加而减弱。这点与之前文章的观点一致,即多种药物共同暴露在混合物中会降低单一化合物的影响[52-53]。
3.4 氟西汀与帕罗西汀对环境生态的影响
2种药物均属于SSRI类药物,关于SSRIs作用机制研究证实,急性SSRIs摄入引起的改变只是少量突触间隙5-HT水平的升高,长期SSRIs暴露会引起神经元出现适应性改变,包括基因转录和蛋白表达水平的改变等[54],这点与本文结论相匹配。虽然二者药理作用相同,但半衰期差异甚大,对生态环境造成的影响也截然不同。药物对海洋环境生态的影响主要源于其环境持久性和生物活性。尽管当前环境中的氟西汀不会对海洋生物造成致命危害,考虑到氟西汀半衰期过长,会引起海洋生物,特别是栖息于近岸的生物[55],出现的慢性暴露产生生物蓄积效应[56],严重威胁海洋生物健康。研究发现,海洋生物慢性暴露于药物会引起生物个体生理和行为异常,直接或间接影响生物体健康水平[57],最终可能致使海洋生态系统功能的长期变化。相比之下,即使含有帕罗西汀的污水持续进入海洋,但因其本身较短的半衰期,药物也不容易在生物体内形成富集。就二者对生态环境的危害而言,氟西汀危害更大。但这些药物往往以复杂混合物的形式存在于水生环境中,因此我们对氟西汀和帕罗西汀的联合作用进行了评估。
综合以上研究结果说明,抗抑郁药物氟西汀和帕罗西汀通过选择性抑制突触间隙5-HT再摄取引起章鱼脑组织中5-HT能神经递质系统功能异常,表现5-HT能功能分子转录和(或)表达水平出现异常上调或下调。已有研究发现,抗抑郁药物可干扰神经递质系统信号转导过程,影响5-HT能系统正常生理功能,导致海洋生物生理或行为异常[58-62]。因此,SSRI类抗抑郁药物暴露通过干扰章鱼脑组织5-HT能系统正常生理功能,严重威胁其健康。
本研究探讨环境浓度抗抑郁症代表性药物氟西汀和帕罗西汀对章鱼脑组织5-HT能神经递质系统的影响。结果显示,氟西汀和帕罗西汀通过选择性抑制突触间隙中5-HT再摄取,引起章鱼脑组织中5-HT能系统重要功能分子转录及表达水平异常,干扰其正常生理功能,严重威胁章鱼健康。本研究为进一步研究抗抑郁症药物对章鱼神经系统的不良影响提供科学依据,为研究其他药物对海洋生物的健康损害效应提供参考。
通信作者简介:郭远明(1977—),男,硕士,教授级高工,主要研究方向为渔业资源养护与利用。
[1] Dalahmeh S, Björnberg E, Elenström A K, et al. Pharmaceutical pollution of water resources in Nakivubo wetlands and Lake Victoria, Kampala, Uganda [J]. Science of the Total Environment, 2020, 710: 136347
[2] Mompelat S, Le Bot B, Thomas O. Occurrence and fate of pharmaceutical products and by-products, from resource to drinking water [J]. Environment International, 2009, 35(5): 803-814
[3] Gracia-Lor E, Sancho J V, Serrano R, et al. Occurrence and removal of pharmaceuticals in wastewater treatment plants at the Spanish Mediterranean area of Valencia [J]. Chemosphere, 2012, 87(5): 453-462
[4] Kreke N, Dietrich D R. Physiological endpoints for potential SSRI interactions in fish [J]. Critical Reviews in Toxicology, 2008, 38(3): 215-247
[5] Cipriani A, Furukawa T A, Salanti G, et al. Comparative efficacy and acceptability of 12 new-generation antidepressants: A multiple-treatments meta-analysis [J]. Lancet, 2009, 373(9665): 746-758
[6] Pratt L A, Brody D J, Gu Q P. Antidepressant use in persons aged 12 and over: United States, 2005-2008 [J]. NCHS Data Brief, 2011(76): 1-8
[7] Schultz M M, Furlong E T, Kolpin D W, et al. Antidepressant pharmaceuticals in two U.S. effluent-impacted streams: Occurrence and fate in water and sediment, and selective uptake in fish neural tissue [J]. Environmental Science &Technology, 2010, 44(6): 1918-1925
[8] Silva L J G, Lino C M, Meisel L M, et al. Selective serotonin re-uptake inhibitors (SSRIs) in the aquatic environment: An ecopharmacovigilance approach [J]. Science of the Total Environment, 2012, 437: 185-195
[9] Gulkowska A, Leung H W, So M K, et al. Removal of antibiotics from wastewater by sewage treatment facilities in Hong Kong and Shenzhen, China [J]. Water Research, 2008, 42(1-2): 395-403
[10] Lajeunesse A, Gagnon C, Sauvé S. Determination of basic antidepressants and their N-desmethyl metabolites in raw sewage and wastewater using solid-phase extraction and liquid chromatography-tandem mass spectrometry [J]. Analytical Chemistry, 2008, 80(14): 5325-5333
[11] Schultz M M, Furlong E T. Trace analysis of antidepressant pharmaceuticals and their select degradates in aquatic matrixes by LC/ESI/MS/MS [J]. Analytical Chemistry, 2008, 80(5): 1756-1762
[12] Dorelle L S, Da Cu a R H, Rey Vázquez G, et al. The SSRI fluoxetine exhibits mild effects on the reproductive axis in the cichlid fish Cichlasoma dimerus (Teleostei, Cichliformes) [J]. Chemosphere, 2017, 171: 370-378
a R H, Rey Vázquez G, et al. The SSRI fluoxetine exhibits mild effects on the reproductive axis in the cichlid fish Cichlasoma dimerus (Teleostei, Cichliformes) [J]. Chemosphere, 2017, 171: 370-378
[13] Christensen A M, Markussen B, Baun A, et al. Probabilistic environmental risk characterization of pharmaceuticals in sewage treatment plant discharges [J]. Chemosphere, 2009, 77(3): 351-358
[14] Metcalfe C D, Chu S G, Judt C, et al. Antidepressants and their metabolites in municipal wastewater, and downstream exposure in an urban watershed [J]. Environmental Toxicology and Chemistry, 2010, 29(1): 79-89
[15] Silva L J G, Pereira A M P T, Meisel L M, et al. Reviewing the serotonin reuptake inhibitors (SSRIs) footprint in the aquatic biota: Uptake, bioaccumulation and ecotoxicology [J]. Environmental Pollution, 2015, 197: 127-143
[16] Barbosa M, Inocentes N, Soares A M V M, et al. Synergy effects of fluoxetine and variability in temperature lead to proportionally greater fitness costs in Daphnia: A multigenerational test [J]. Aquatic Toxicology, 2017, 193: 268-275
[17] Styrishave B, Halling-Sørensen B, Ingerslev F. Environmental risk assessment of three selective serotonin reuptake inhibitors in the aquatic environment: A case study including a cocktail scenario [J]. Environmental Toxicology and Chemistry, 2011, 30(1): 254-261
[18] Lee P N, Callaerts P, De Couet H G, et al. Cephalopod Hox genes and the origin of morphological novelties [J]. Nature, 2003, 424(6952): 1061-1065
[19] Baratte S, Bonnaud L. Evidence of early nervous differentiation and early catecholaminergic sensory system during Sepia officinalis embryogenesis [J]. The Journal of Comparative Neurology, 2009, 517(4): 539-549
[20] Shigeno S, Sasaki T, Moritaki T, et al. Evolution of the cephalopod head complex by assembly of multiple molluscan body parts: Evidence from Nautilus embryonic development [J]. Journal of Morphology, 2008, 269(1): 1-17
[21] Navet S, Andouche A, Baratte S, et al. Shh and Pax6 have unconventional expression patterns in embryonic morphogenesis in Sepia officinalis (Cephalopoda) [J]. Gene Expression Patterns, 2009, 9(7): 461-467
[22] Sumpter J P, Donnachie R L, Johnson A C. The apparently very variable potency of the anti-depressant fluoxetine [J]. Aquatic Toxicology, 2014, 151: 57-60
[23] Barnes N M, Sharp T. A review of central 5-HT receptors and their function [J]. Neuropharmacology, 1999, 38(8): 1083-1152
[24] Messenger J B. Neurotransmitters of cephalopods [J]. Invertebrate Neuroscience, 1996, 2: 95-114
[25] Lehr T, Schipp R. Serotonergic regulation of the central heart auricles of Sepia officinalis L. (Mollusca, Cephalopoda) [J]. Comparative Biochemistry and Physiology Part A, Molecular &Integrative Physiology, 2004, 138(1): 69-77
[26] Rosen S C, Weiss K R, Goldstein R S, et al. The role of a modulatory neuron in feeding and satiation in Aplysia: Effects of lesioning of the serotonergic metacerebral cells [J]. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 1989, 9(5): 1562-1578
[27] MacKey S, Carew T J. Locomotion in Aplysia: Triggering by serotonin and modulation by bag cell extract [J]. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 1983, 3(7): 1469-1477
[28] Glanzman D L, MacKey S L, Hawkins R D, et al. Depletion of serotonin in the nervous system of Aplysia reduces the behavioral enhancement of gill withdrawal as well as the heterosynaptic facilitation produced by tail shock [J]. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 1989, 9(12): 4200-4213
[29] Wang Q, He M X. Molecular characterization and analysis of a putative 5-HT receptor involved in reproduction process of the pearl oyster Pinctada fucata [J]. General and Comparative Endocrinology, 2014, 204: 71-79
[30] Andrews P L R, Messenger J B, Tansey E M. The chromatic and motor effects of neurotransmitter injection in intact and brain-lesioned octopus [J]. Journal of the Marine Biological Association of the United Kingdom, 1983, 63(2): 355-370
[31] Shomrat T, Feinstein N, Klein M, et al. Serotonin is a facilitatory neuromodulator of synaptic transmission and “reinforces” long-term potentiation induction in the vertical lobe of Octopus vulgaris [J]. Neuroscience, 2010, 169(1): 52-64
[32] Christensen A M, Markussen B, Baun A, et al. Probabilistic environmental risk characterization of pharmaceuticals in sewage treatment plant discharges [J]. Chemosphere, 2009, 77(3): 351-358
[33] Metcalfe C D, Chu S G, Judt C, et al. Antidepressants and their metabolites in municipal wastewater, and downstream exposure in an urban watershed [J]. Environmental Toxicology and Chemistry, 2010, 29(1): 79-89
[34] Messenger J B, Nixon M, Ryan K P. Magnesium chloride as an anaesthetic for cephalopods [J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1985, 82(1): 203-205
[35] Mills K C. Serotonin syndrome [J]. American Family Physician, 1995, 52(5): 1475-1482
[36] Cunha V, Rodrigues P, Santos M M, et al. Fluoxetine modulates the transcription of genes involved in serotonin, dopamine and adrenergic signalling in zebrafish embryos [J]. Chemosphere, 2018, 191: 954-961
[37] Amador M H B, McDonald M D. Molecular and functional characterization of the Gulf toadfish serotonin transporter SLC6A4 [J]. The Journal of Experimental Biology, 2018, 221(Pt 7): jeb170928
[38] Gaworecki K M, Klaine S J. Behavioral and biochemical responses of hybrid striped bass during and after fluoxetine exposure [J]. Aquatic Toxicology, 2008, 88(4): 207-213
[39] Franzellitti S, Buratti S, Valbonesi P, et al. The mode of action (MOA) approach reveals interactive effects of environmental pharmaceuticals on Mytilus galloprovincialis [J]. Aquatic Toxicology, 2013, 140-141: 249-256
[40] Di Poi C, Darmaillacq A S, Dickel L, et al. Effects of perinatal exposure to waterborne fluoxetine on memory processing in the cuttlefish Sepia officinalis [J]. Aquatic Toxicology, 2013, 132-133: 84-91
[41] 陈瑜, 张博, 李铁军. 氟西汀和帕罗西汀对斑马鱼脑组织5-HT能神经传导系统的影响[J]. 浙江海洋大学学报(自然科学版), 2019, 38(4): 295-302
Chen Y, Zhang B, Li T J. Effects of SSRIs antidepressants fluoxetine and paroxetine on 5-HTergic neurotransmission system in zebrafish brain tissue [J]. Journal of Zhejiang Ocean University (Natural Science), 2019, 38(4): 295-302 (in Chinese)
[42] Di Poi C, Darmaillacq A S, Dickel L, et al. Effects of perinatal exposure to waterborne fluoxetine on memory processing in the cuttlefish Sepia officinalis [J]. Aquatic Toxicology, 2013, 132-133: 84-91
[43] Katona C, Livingston G. How well do antidepressants work in older people? A systematic review of Number Needed to Treat [J]. Journal of Affective Disorders, 2002, 69(1-3): 47-52
[44] Sun Y F, Liang Y F, Jiao Y, et al. Comparative efficacy and acceptability of antidepressant treatment in poststroke depression: A multiple-treatments meta-analysis [J]. BMJ Open, 2017, 7(8): e016499
[45] Geretsegger C, Böhmer F, Ludwig M. Paroxetine in the elderly depressed patient: Randomized comparison with fluoxetine of efficacy, cognitive and behavioural effects [J]. International Clinical Psychopharmacology, 1994, 9(1): 25-29
[46] Fava M, Rosenbaum J F, Hoog S L, et al. Fluoxetine versus sertraline and paroxetine in major depression: Tolerability and efficacy in anxious depression [J]. Journal of Affective Disorders, 2000, 59(2): 119-126
[47] Fava M, Amsterdam J D, Deltito J A, et al. A double-blind study of paroxetine, fluoxetine, and placebo in outpatients with major depression [J]. Annals of Clinical Psychiatry: Official Journal of the American Academy of Clinical Psychiatrists, 1998, 10(4): 145-150
[48] Sharp T, Barnes N M. Central 5-HT receptors and their function; present and future [J]. Neuropharmacology, 2020, 177: 108155
[49] Weaver R F著. 郑用琏等译. 分子生物学[M]. 第五版. 北京: 科学出版社, 2013: 558-579
[50] Jovanovic H, Cerin A, Karlsson P, et al. A PET study of 5-HT1A receptors at different phases of the menstrual cycle in women with premenstrual dysphoria [J]. Psychiatry Research, 2006, 148(2-3): 185-193
[51] Vandenberg L N, Colborn T, Hayes T B, et al. Hormones and endocrine-disrupting chemicals: Low-dose effects and nonmonotonic dose responses [J]. Endocrine Reviews, 2012, 33(3): 378-455
[52] Franzellitti S, Buratti S, Valbonesi P, et al. The mode of action (MOA) approach reveals interactive effects of environmental pharmaceuticals on Mytilus galloprovincialis [J]. Aquatic Toxicology, 2013, 140-141: 249-256
[53] Guler Y, Ford A T. Anti-depressants make amphipods see the light [J]. Aquatic Toxicology, 2010, 99(3): 397-404
[54] Schloss P, Williams D C. The serotonin transporter: A primary target for antidepressant drugs [J]. Journal of Psychopharmacology, 1998, 12(2): 115-121
[55] Lazzara R, Blázquez M, Porte C, et al. Low environmental levels of fluoxetine induce spawning and changes in endogenous estradiol levels in the zebra mussel Dreissena polymorpha [J]. Aquatic Toxicology, 2012, 106-107: 123-130
[56] Meredith-Williams M, Carter L J, Fussell R, et al. Uptake and depuration of pharmaceuticals in aquatic invertebrates [J]. Environmental Pollution, 2012, 165: 250-258
[57] Brodin T, Piovano S, Fick J, et al. Ecological effects of pharmaceuticals in aquatic systems—Impacts through behavioural alterations [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2014, 369(1656): 20130580
[58] Campos B, Rivetti C, Kress T, et al. Depressing antidepressant: Fluoxetine affects serotonin neurons causing adverse reproductive responses in Daphnia magna [J]. Environmental Science &Technology, 2016, 50(11): 6000-6007
[59] Valenti T W, Gould G G, Berninger J P, et al. Human therapeutic plasma levels of the selective serotonin reuptake inhibitor (SSRI) sertraline decrease serotonin reuptake transporter binding and shelter-seeking behavior in adult male fathead minnows [J]. Environmental Science &Technology, 2012, 46(4): 2427-2435
[60] Bidel F, Di Poi C, Imarazene B, et al. Pre-hatching fluoxetine-induced neurochemical, neurodevelopmental, and immunological changes in newly hatched cuttlefish [J]. Environmental Science and Pollution Research International, 2016, 23(6): 5030-5045
[61] Melnyk-Lamont N, Best C, Gesto M, et al. The antidepressant venlafaxine disrupts brain monoamine levels and neuroendocrine responses to stress in rainbow trout [J]. Environmental Science &Technology, 2014, 48(22): 13434-13442
[62] Heyland A, Bastien T, Halliwushka K. Transgenerational reproductive effects of two serotonin reuptake inhibitors after acute exposure in Daphnia magna embryos [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2020, 238: 108875