多菌灵(carbendazim, BCM)是一种广谱内吸型杀菌剂[1],又名甲基-苯并咪唑-2-氨基甲酸甲酯,分子式为C9H9N3O2[2],分子量为191.2[3]。由于其能有效防治多种作物病害而被广泛使用。积累在土壤表面的BCM可通过雨水冲刷汇入周边水域,近年来在多个水体环境中均检测出BCM残留,如佘伟铎等[4]对太湖流域西北部水体和沉积物检测中发现BCM浓度范围为16~46.9 ng·L-1,周怡彤[5]对太湖流域西北部地表水体检测得到BCM浓度范围为165~509 ng·L-1。已有研究表明,BCM对鱼类可产生氧化毒性、神经毒性和发育毒性效应,如BCM可致遮目鱼(Chanos chanos)肝脏功能受损、生殖率降低等[6];BCM可影响斑马鱼(Danio reri)幼体生长发育、体内激素分泌等[7];BCM可致非洲鲶鱼(African catfish)甲状腺和内分泌功能失调,引起免疫反应并诱导发细胞色素P450介导的解毒,干扰其生长发育[8]。大多BCM毒性效应报道主要集中于氧化应激酶活性,而有关解毒代谢酶活性以及基于综合生物标志物指数(integrated biomarker response, IBR)模式下评价BCM的生物毒性效应研究目前报道较少。
一定剂量农药在动物机体内累积可诱发产生大量活性氧(reactive oxygen species, ROS)[9],大量ROS作用于不饱和脂肪酸,可生成丙二醛(malondialdehyde, MDA)等过氧化产物,因此MDA含量被认为是细胞氧化损伤的重要指标之一[10]。8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine, 8-OHdG)是ROS攻击DNA分子产生的一种氧化性加合产物,是目前评价DNA氧化损伤程度的一种生物标志物[11]。机体需要及时清除或降低过量ROS,其中超氧化物歧化酶(superoxide dismutase, SOD)可将活性超氧阴离子转化为H2O2,目前已报道3种SOD基因亚型:Cu/Zn-sod、Mn-sod、Fe-sod,其中Cu/Zn-sod基因在真核细胞中较常见[12]。过氧化氢酶(catalase, CAT)可将H2O2转化为H2O和O2[13],目前报道CAT基因亚型中cat3在动物体内高表达[14]。动物体对外源化合物的代谢解毒反应主要包括3个阶段,(1)Ⅰ相代谢,细胞色素P450超家族可通过氧化水解过程将外源化合物转化为低活性易水解的产物[15];(2)Ⅱ相代谢,Ⅰ相代谢过程形成的产物与内源性分子如葡萄糖醛酸、甘氨酸等经生物化学反应形成毒性小且易被排出的产物[16];(3)Ⅲ相代谢,即转运蛋白将机体部分污染物和代谢产物通过跨膜运输排出[17]。7-乙氧基-3-异吩恶唑酮-脱乙基酶(7-ethoxy-3-isophenoxazolone deethylase, EROD)是Ⅰ相代谢中细胞色素P4501A亚家族的同工酶,可作为污染物对动物毒性检测的特异性生物标志物[18]。谷胱甘肽巯基转移酶(glutathione S-transferase, GST)是Ⅱ相代谢过程的关键酶,能催化底物与污染物结合,形成易排出体外的水溶性代谢产物,降低脂质过氧化带来的DNA氧化损伤,也可作为污染物毒性检测的生物标志物[19]。在生态毒性效应评价中,可将污染物胁迫下多个生物标志物的响应进行整合分析,利用IBR指数对污染物的生态毒性效应进行综合评价[20]。
泥鳅(Misgurnus anguillicaudatus)是一种栖息在淤泥和水体环境中的硬骨鱼,具备较强适应能力,易在实验室条件驯养,在污染物毒性评价中有作为模式生物的潜力。本研究以泥鳅为材料,检测在BCM胁迫下肝脏MDA、8-OHdG含量和SOD、CAT、EROD、GST活性的变化,测定Cu/Zn-sod、cat3、cyp1a1和gst基因mRNA相对表达量的变化,探究BCM对泥鳅抗氧化和代谢解毒过程的影响,并运用IBR模型,综合分析BCM对鱼类的毒性效应,以期为其污染治理和生态风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
多菌灵(CAS:10605-21-7,纯度≥98%,江苏蓝丰生物化工股份有限公司),二甲基亚砜(DMSO,分析纯,南通润丰石油化工有限公司);总蛋白定量、MDA和GST试剂盒购自南京建成生物工程研究所,EROD和8-OHdG试剂盒购自上海酶联生物科技有限公司;受试生物泥鳅购买于江苏生态泥鳅养殖基地,实验前泥鳅在实验室环境中用自然脱氯的水驯养14 d,每天定时喂食少量食物,维持水温为(25±2) ℃,pH为(7.5±0.2)。
1.2 染毒实验与恢复实验
BCM用DMSO配制为1 g·L-1母液,根据先前预实验急性毒性得出,BCM对泥鳅的24 h安全浓度(safe concentration, SC)为3.98 mg·L-1,等对数设置BCM浓度为0.020、0.075、0.282、1.060 mg·L-1,并设置空白对照组与溶剂对照组(DMSO水溶液),采用半静态亚急性毒性法,设置3组重复,每组均放入泥鳅15条,每24 h更换实验试剂,同时观察记录泥鳅情况,染毒时间为30 d。
染毒实验结束后,将4个BCM浓度处理组的泥鳅移入无BCM自然水体中恢复驯养30 d,并设置对照组。在BCM染毒10、20、30 d以及恢复驯养30 d时,分别从各BCM浓度组随机剖取3条泥鳅肝脏组织,在-80 ℃条件下保存待测。
1.3 抗氧化酶、代谢解毒酶活性及MDA、8-OHdG含量测定
提取肝脏组织并进行称量,将磷酸缓冲液依据质量:体积=1∶9比值加入,混至匀浆,以转速3 000 r·min-1处理20 min,取上清检测MDA、8-OHdG含量以及抗氧化酶、代谢解毒酶活性。总蛋白质量浓度、8-OHdG和MDA含量、EROD和GST酶活性测定步骤参照试剂盒说明书,SOD活性使用氮蓝四唑光化还原法测定[21],CAT活性使用钼酸铵比色法测定[22]。
1.4 Cu/Zn-sod、cat3、cyp1a1和gst基因的表达测定
1.4.1 引物设计
采用实时荧光定量PCR方法检测Cu/Zn-sod、cat3、cyp1a1和gst基因的表达,其中cyp1a1和gst的引物序列选用王亚星[23]的研究,选择机体基因稳定表达的β-actin作为相对定量内参。引物由上海生工生物工程股份有限公司合成,各引物序列如表1所示。
表1 特异性引物
Table 1 Specific primers
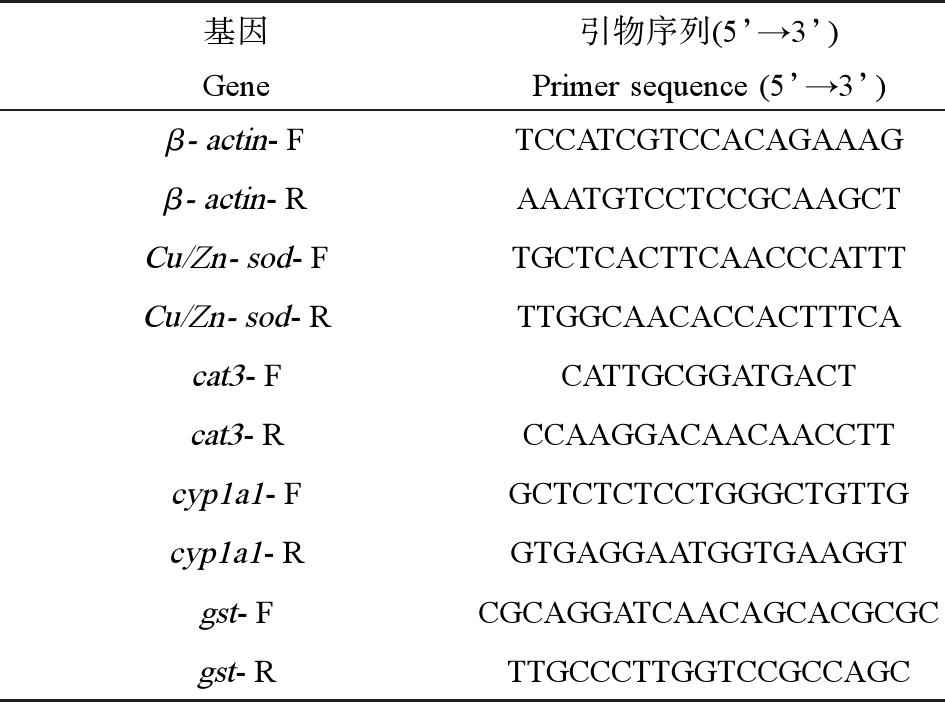
注:F代表上游引物,R代表下游引物。
Note: F represents upstream primer and R represents downstream primer.
基因引物序列(5’→3’)GenePrimer sequence (5’→3’)β-actin-FTCCATCGTCCACAGAAAGβ-actin-RAAATGTCCTCCGCAAGCTCu/Zn-sod-FTGCTCACTTCAACCCATTTCu/Zn-sod-RTTGGCAACACCACTTTCAcat3-FCATTGCGGATGACTcat3-RCCAAGGACAACAACCTTcyp1a1-FGCTCTCTCCTGGGCTGTTGcyp1a1-RGTGAGGAATGGTGAAGGTgst-FCGCAGGATCAACAGCACGCGCgst-RTTGCCCTTGGTCCGCCAGC
1.4.2 总RNA提取与Real-time PCR扩增
从样品中提取肝脏组织总RNA并用DEPC(diethylprocarbonate)水溶解,通过Prime Script TM RT reagent Kit with gDNA试剂盒进行去基因组和反转录实验。采用Real-time PCR(SYBR Green) 2-△△Ct相对定量方法,按照SYBR Green Pro Tap HS预混型qPCR试剂盒说明书进行实验操作。
1.4.3 Comparative Delta-delta Ct相对定量
以β-actin作为相对定量内参,目的基因表达量定义为:待测样品与对照组表达差异倍数,采用2-△△Ct法[24]计算Cu/Zn-sod、cat3、cyp1a1和gst的mRNA相对表达量,公式如下:
1.5 IBR综合指数
IBR综合指数采用第二代综合生物标志物响应指数法[25],计算各浓度组中多种生物标志物数值,公式如下:
各生物标志物标准化值:Y=log(X/X0)
(1)
各生物标志物均一化值:Zi=(Y-M)/SD
(2)
生物标志物偏离指数:A=Zi-Z0
(3)
IBR总值:IBR=∑|Ai|
(4)
式中:X及X0分别为生物标志物在各处理组及对照组所得平均值,Y为各生物标志物的标准化值,Z为生物标志物在各处理组及对照组所得均一化值,A为生物标志物偏离指数。
1.6 数据处理
实验结果以平均值±标准差(Mean±SD)表示,所有数据采用SPSS 18.0统计软件进行单因素方差分析(One-way ANOVA),采用Duncan法比较组间差异,使用Graphpad 9.0和Origin 2018作图。当0.01<P<0.05时用“*”标注表示处理组与对照组之间差异显著,P<0.01时用“**”标注表示处理组与对照组之间差异显著。
2 结果(Results)
2.1 BCM胁迫对肝脏MDA和8-OHdG含量变化
BCM对泥鳅肝脏MDA及8-OHdG含量的影响如图1所示。由图1(a)可知,与对照组相比,BCM胁迫10 d时,0.020、0.075、0.282 mg·L-1浓度组MDA未出现显著性差异,随着胁迫时间延长,各浓度组MDA呈现显著上升(P<0.01);恢复驯养30 d时BCM各浓度组略有降低,0.282、1.060 mg·L-1浓度组高于对照组(P<0.01)。由图1(b)可知,与对照组相比,各BCM浓度处理组胁迫周期内8-OHdG含量均高于对照组,呈现持续性上升并在30 d时达到最高值;恢复驯养30 d时,各浓度处理组8-OHdG上升趋势虽有所减弱,但仍显著性高于对照组。
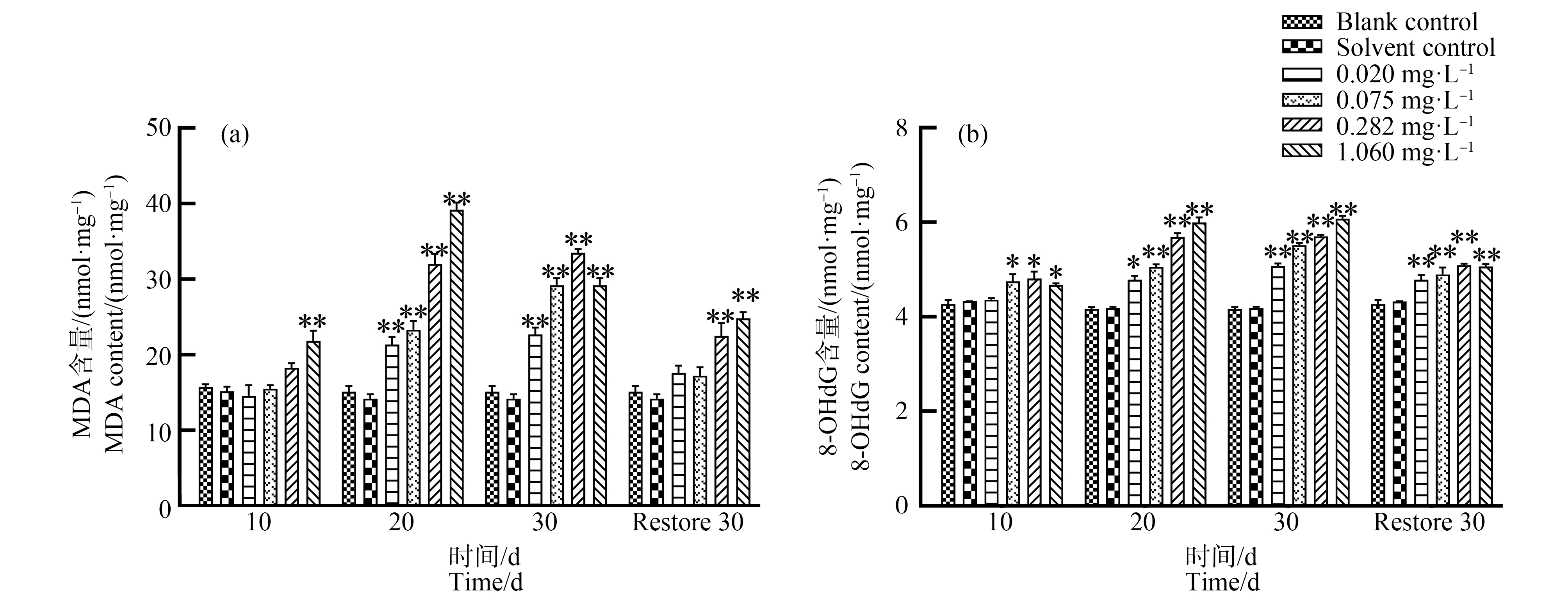
图1 多菌灵(BCM)胁迫对泥鳅肝脏丙二醛(MDA)和8-羟基脱氧尿苷(8-OHdG)含量的变化
Fig. 1 Changes of malondialdehyde (MDA) and 8-hydroxy-2 deoxyguanosine (8-OHdG) contents in loach liver under carbendazim (BCM) stress
2.2 BCM胁迫对肝脏抗氧化酶活性及其基因表达的影响
BCM胁迫对肝脏抗氧化酶活性及其基因表达的影响如图2所示。由图2(a)可知,与对照组相比,4个BCM浓度组胁迫10、20 d时SOD活性均显著升高(P<0.01),胁迫30 d时1.060 mg·L-1浓度组降低为对照组的1.05倍;恢复驯养30 d时,各浓度处理组活性仍显著升高,但低于胁迫前期。由图2(c)可知,相对于对照组,4个BCM浓度组胁迫10、20 d时,Cu/Zn-sod相对表达量出现显著持续性上升,1.060 mg·L-1浓度组胁迫30 d时显著低于对照组(P<0.01);恢复驯养30 d时,0.020、0.075、0.282 mg·L-1浓度组显著性升高(P<0.05)。

图2 BCM胁迫对泥鳅肝脏抗氧化酶活性及其基因表达的变化
Fig. 2 Changes of antioxidant enzyme activity and gene expression in loach liver under BCM stress
由图2(b)可知,与对照组相比,4个BCM浓度组胁迫10 d时,CAT活性降低且0.020、0.282、1.060 mg·L-1浓度组更显著,胁迫20 d时BCM各浓度组活性显著上升(P<0.01);恢复驯养30 d时,0.020、0.075 mg·L-1浓度组CAT活性低于胁迫期。
由图2(d)可知,与对照组相比,4个BCM浓度组胁迫10、20、30 d时,cat3相对表达量均显著高于对照组(P<0.05);恢复驯养30 d时,0.075、0.282、1.060 mg·L-1浓度组表达量均大幅降低,但仍显著高于对照组(P<0.01)。
2.3 BCM胁迫对肝脏代谢酶活性及其基因表达的影响
BCM对泥鳅肝脏EROD和GST活性及其基因表达的影响如图3所示。由图3(a)可知,与对照组相比,0.020、0.075、0.282 mg·L-1浓度组,胁迫10、20 d时EROD活性显著性升高(P<0.05),随着胁迫时间延长EROD活性有所降低;恢复驯养30 d时,BCM各浓度组再次显著降低(P<0.05)。由图3(c)可知,与对照组相比,4个BCM浓度组,胁迫10、20 d时cyp1a1相对表达量持续性升高,胁迫30 d时显著性降低(P<0.05);恢复驯养30 d时,0.075 mg·L-1浓度组cyp1a1表达量出现显著性上升(P<0.05),0.282、1.060 mg·L-1浓度组表达量持续性降低。
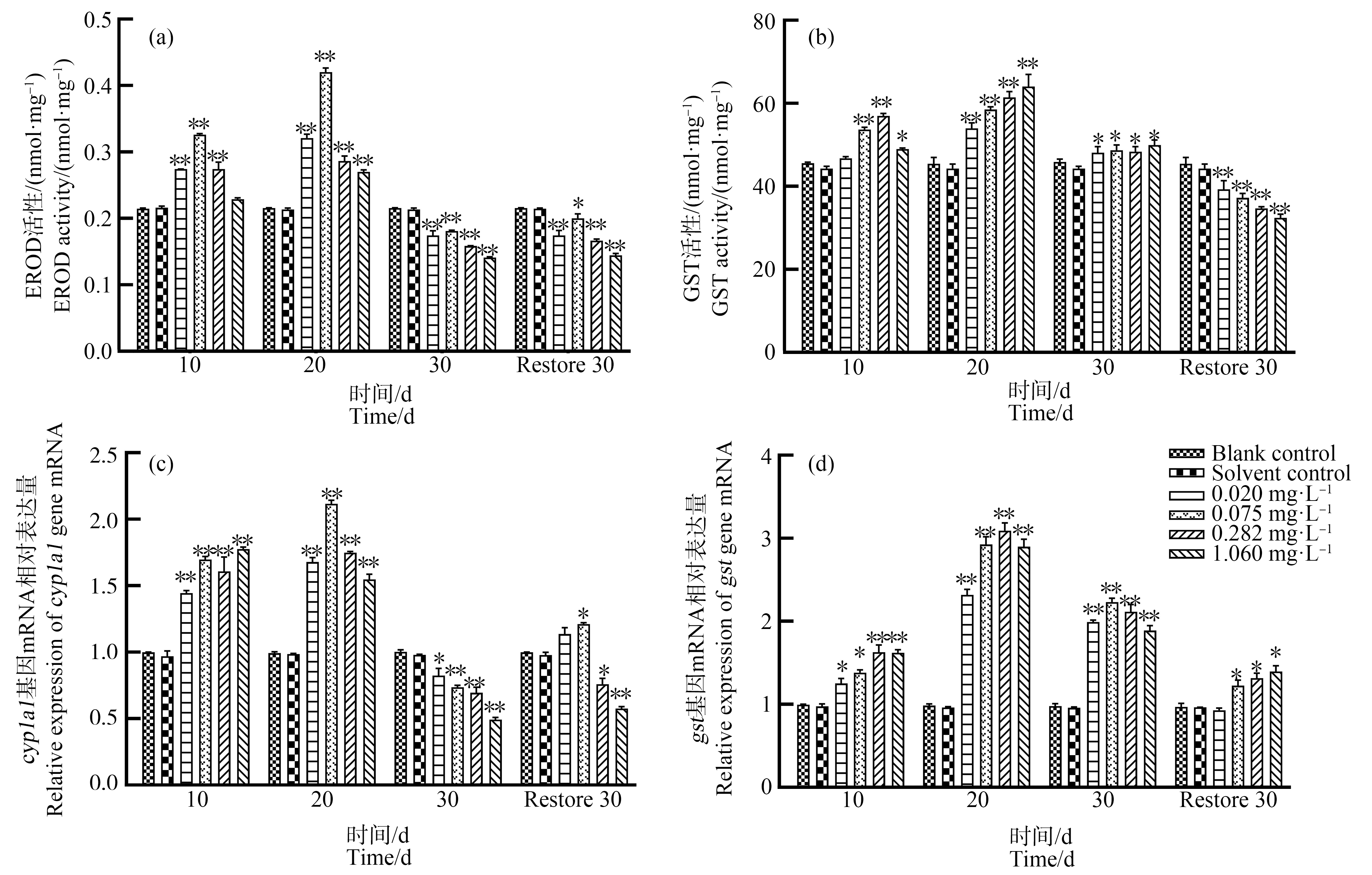
图3 BCM胁迫对泥鳅肝脏代谢解毒酶活性及其基因表达的变化
Fig. 3 Changes of metabolic detoxification enzyme activity and gene expression in loach liver under BCM stress
由图3(b)可知,与对照组相比,0.020 mg·L-1浓度组胁迫10 d时GST活性无显著差异,0.075、0.282 mg·L-1浓度组GST活性显著升高(P<0.01),随胁迫时间延长持续性升高,胁迫10 d时上升趋势减弱;恢复驯养30 d时,各浓度组均呈显著降低(P<0.01)。由图3(d)可知,与对照组相比,BCM各浓度处理组,胁迫10 d时gst基因表达量均显著升高,胁迫20 d时表达量出现最高值(P<0.01),胁迫30 d时gst表达量略有减小;恢复驯养30 d时,0.075、0.282、1.060 mg·L-1表达量显著升高(P<0.01)。
2.4 BCM胁迫下泥鳅肝脏IBR指数
选取4个BCM浓度组不同胁迫时间下,MDA、8-OHDG、SOD、CAT、EROD和GST 6个指标的变化构建IBR星状图分析(图4)。由图4可得,与对照组相比,各BCM处理组不同胁迫时间下的星状图面积均存在较大差异,星状图面积即代表着IBR指数。胁迫10、20、30 d时,IBR指数随胁迫浓度增加呈现升高趋势,其中1.060 mg·L-1浓度组IBR指数值最大,恢复驯养30 d时,1.060 mg·L-1浓度组IBR指数仍大于其他3个浓度组;同一BCM浓度下,泥鳅肝脏组织IBR指数随胁迫时间增加呈现升高趋势,BCM胁迫下泥鳅肝脏的IBR值表现为10 d<20 d<30 d;恢复驯养30 d时,各浓度组IBR指数小于胁迫期。星状图中辐射线长度代表着各生物标志物存在的组间差异,在BCM各浓度组中,6个生物标志物指标组间差异较大,且BCM胁迫下肝脏SOD活性所受的影响最大。

图4 BCM胁迫下泥鳅肝脏综合生物标志物指数(IBR)星状图
Fig. 4 Star diagram of integrated biomarker response (IBR) in loach liver under BCM stress
3 讨论(Discussion)
当肝脏组织中产生过量ROS,一方面ROS对机体造成氧化损伤,影响细胞内部系统运行,甚至可造成细胞凋亡或坏死,另一方面机体通过提高自身抗氧化酶活力清除过量ROS[26]。MDA是细胞氧化损伤的重要指标,可反映机体过氧化损伤情况[27]。宋志明等[28]研究发现,低温胁迫下点篮子鱼(gold saddle rabbitfish)肝脏MDA含量呈现上升的趋势,随胁迫时间延长升高趋势减缓,具有明显时间效应。本研究中,BCM各浓度处理组泥鳅肝脏MDA含量胁迫前期无显著变化,胁迫中后期有持续上升的趋势,而恢复驯养30 d后MDA含量虽大幅降低,但仍显著高于对照组,可能是BCM长期胁迫使得泥鳅体内大量ROS产生,机体抗氧化系统受到较为严重破坏,自身清除能力受损并导致大量MDA增加,通过一段时间内无BCM胁迫的恢复驯养,其抗氧化系统存在一定可逆性损伤恢复趋势,但暂时仍未修复到正常水平。8-OHdG作为机体中过氧化物质攻击DNA关键的生物标志物,因此其可广泛应用于DNA氧化损伤研究中[29]。Farag等[30]通过检测血清中8-OHdG含量的变化分析联苯菊酯胁迫下尼罗罗非鱼(Oreochromis niloticus)的DNA氧化损伤程度。本研究中,BCM高浓度组胁迫下及恢复驯养30 d时,8-OHdG含量均呈明显升高趋势,说明高浓度BCM胁迫可导致泥鳅体内大量ROS累积,对DNA分子造成严重损伤,即使经过30 d恢复驯养,DNA氧化损伤出现部分可逆性损伤修复,但仍未达到完全修复的程度,提示BCM长期胁迫可对泥鳅产生严重的氧化损伤效应。
SOD作为清除超氧阴离子的关键酶,其活性及Cu/Zn-sod相对表达量的变化可在一定程度上反映机体清除ROS的能力[31-32]。本研究中,BCM各浓度组胁迫前期SOD活性和Cu/Zn-sod相对表达量均显著上调,而胁迫后期高浓度组显著下调,恢复驯养30 d后再次上调,猜测是BCM可显著诱导Cu/Zn-sod基因表达,使得SOD活性升高以快速清除体内过量ROS,出现毒物刺激兴奋效应;高浓度BCM长期胁迫反而会抑制Cu/Zn-sod基因表达,使SOD活性下降,造成泥鳅体内严重的氧化损伤和代偿机制丧失,这与Zheng等[33]研究发现,锌胁迫初期大黄鱼(Larimichthys crocea)脾脏SOD活性和Cu/Zn-sod相对表达量上升的结果相似。通过无BCM恢复驯养一段时间后,Cu/Zn-sod表达可重新被诱导,SOD活性又重新升高,机体抗氧化能力得到一定程度修复,从而可能使得抗氧化酶系统正常运转,加速体内过氧化产物清除。CAT作为动物转化过多氧化产物的关键酶,也可反映机体氧化损伤状态[34]。高修歌等[35]研究发现,硫酸铜和马度米星铵联合暴露下鲫鱼(Carassius auratus)肝脏CAT活性和cat3相对表达量均呈上升趋势,并引起一定程度的血液毒性和肝脏氧化损伤 。本研究中,BCM各浓度组胁迫前期CAT活性与cat3相对表达量分别呈下降、上调趋势,随胁迫时间延长CAT活性和cat3相对表达量均上调;恢复驯养30 d时再次呈上调趋势,说明一定浓度BCM胁迫初期可抑制cat3表达,使得CAT活性降低,导致机体清除H2O2的能力下降;而一定剂量BCM持续刺激使得泥鳅体内产生大量H2O2,以激活cat3表达增加CAT活性,以降低BCM造成的氧化损伤,维持机体稳态;经过30 d恢复驯养,机体氧化应激系统仍在积极调控,抗氧化应激系统呈现一定可逆性损伤恢复趋势,但其还未完全恢复到正常水平。本研究结果也显示,BCM胁迫时抗氧化酶活性及相关基因表达的变化并不完全同步,提示BCM胁迫时酶活性及其基因表达调控关系的复杂性,因此有必要就BCM胁迫对鱼类抗氧化酶防御机制损伤的分子机制进行深入研究[36]。
EROD作为代谢解毒过程中的关键酶,其活性变化可反映机体对污染物的代谢解毒能力[37]。李思和刘晓宇[38]研究发现,辛硫磷暴露下鲫鱼EROD活性和cyp1a1表达量均受到抑制,并出现明显的毒物刺激反应。本研究中,BCM各浓度组EROD活性与cyp1a1相对表达量,随胁迫时间均呈先上调后下调的趋势;恢复驯养30 d时略有升高,0.075 mg·L-1浓度组cyp1a1表达量显著高于对照组,说明BCM短期胁迫可诱导cyp1a1基因表达,使EROD活性显著升高,但随着胁迫时间延长,BCM在体内逐渐累积,cyp1a1基因反而受到显著抑制,使得EROD活性降低,这与Santillán Deiú等[39]对氟虫腈胁迫下虎皮鱼(Puntius tetrazona)肝脏中CYP1A活性及其表达水平变化相似。恢复30 d驯养后,低浓度组泥鳅体内BCM易被代谢清除,使cyp1a1基因的抑制被解除,表达量又显著升高,而高浓度组长时间胁迫cyp1a1基因表达被深度抑制,即使恢复驯养也不能完全解除抑制,EROD活性仍然低于正常水平。GST是动物肝脏代谢过程中重要的解毒酶。田丽娜等[40]研究发现,短期低浓度原油可诱导大弹涂鱼(Boleophthalmus pectinirostris)GST活性,加速机体解毒代谢。本研究中,BCM各浓度组胁迫周期GST活性和gst相对表达量均呈上调趋势,胁迫后期GST活性和gst表达量上调趋势减弱,恢复驯养30 d时,高浓度组出现GST活性下调、表达量上调趋势;可能是BCM胁迫可激活泥鳅体内gst表达和GST活性,以清除体内累积的BCM,随着胁迫时间的延长,体内BCM不断累积使得gst基因和GST活性减弱;高浓度BCM长期胁迫时,GST活性受到显著抑制,泥鳅肝脏代谢解毒功能严重受损,即使经过一段时间恢复驯养,出现一定程度上可逆性损伤恢复趋势,也并没有将外源污染物完全代谢,使得已产生的毒物损伤完全修复。此外,本研究中gst基因相对表达量与GST活性变化并不完全同步,体现出BCM影响下基因调控的复杂性。
机体抗氧化酶系统与代谢解毒过程相互协作,共同形成防御体系,以降低或清除体内有毒物质,共同调节维持机体稳态[41-42]。MDA、8-OHdG、SOD、CAT、EROD、GST作为抗氧化和代谢解毒过程中重要的生物标志物,对污染物敏感度及响应时间存在一定的差异,因此单一指标的变化尚不能准确评价污染物的氧化胁迫效应,通过IBR指数分析可综合反映污染物胁迫对鱼类的氧化毒性效应[43-44]。代恒美等[45]研究发现,磷化工污染水体可诱导斑马鱼肝脏IBR指数升高,具有一定生物毒性。本研究中,BCM胁迫下泥鳅肝脏组织表现出毒性应激反应,BCM各胁迫浓度不同暴露时间时的肝脏IBR指数不同,IBR值越大,说明生物体受到的胁迫越严重。同一BCM浓度下,IBR指数随BCM胁迫时间延长而逐渐升高,BCM胁迫对泥鳅肝脏毒性效应表现为10 d<20 d<30 d;相同BCM胁迫时间下,IBR指数随胁迫浓度增加而升高;恢复驯养30 d后,BCM各浓度组IBR指数均明显降低,说明一定剂量BCM长期胁迫可对泥鳅肝脏抗氧化酶系和代谢解毒酶系造成严重损伤;虽然在清除BCM一段时间后,机体毒物损伤出现一定程度可逆性恢复,BCM毒性效应得到一定缓解,但仍不能得到完全修复。
通过分析BCM对泥鳅6个生物标志物及相关基因表达量的影响,初步证实水体环境中低浓度BCM短期胁迫下泥鳅肝脏综合毒性效应不明显,BCM长期胁迫下可能会干扰泥鳅肝脏正常生理功能,刺激氧化代谢基因进一步调控相关酶对BCM的毒性应答过程,使得泥鳅出现鲜明毒性效应。而进行30 d自然水体恢复,对泥鳅肝脏中毒症状有一定缓解作用,呈现逐步恢复趋势,低浓度胁迫组更明显,说明通过短时间自我修复,BCM的毒性效应可能出现一定程度的可逆性,但短期内不足以完全修复毒性损伤,并未出现完全可逆性影响。本研究仅对BCM毒性可逆性实验进行了初步探究,未来可就延长恢复时间或结合促恢复物质对BCM毒性效应的相互作用进行深入研究。综上所述,水环境中一定剂量BCM长期存在可能严重影响泥鳅抗氧化酶系统及其代谢解毒过程,因此在农业生产中应谨慎使用。
通信作者简介:雷忻(1972—),女,博士,教授,主要研究方向为生态毒理学。
[1] Huan Z B, Luo J H, Xu Z, et al. Acute toxicity and genotoxicity of carbendazim, main impurities and metabolite to earthworms (Eisenia foetida) [J]. Bulletin of Environmental Contamination and Toxicology, 2016, 96(1): 62-69
[2] Tripathi G, Shasmal J. Concentration related responses of chlorpyriphos in antioxidant, anaerobic and protein synthesizing machinery of the freshwater fish, Heteropneustes fossilis [J]. Pesticide Biochemistry and Physiology, 2011, 99(3): 215-220
[3] Abd-Elhaleem Z A. Pesticide residues in tomato and tomato products marketed in Majmaah Province, KSA, and their impact on human health [J]. Environmental Science and Pollution Research International, 2020, 27(8): 8526-8534
[4] 佘伟铎, 石运刚, 李洁, 等. 长江流域重庆段水体和沉积物中农药分布特征及风险评价[J]. 生态毒理学报, 2020, 15(2): 220-230
She W D, Shi Y G, Li J, et al. Distribution and risk assessment of pesticides in water and sediments in the Yangtze River of Chongqing section [J]. Asian Journal of Ecotoxicology, 2020, 15(2): 220-230 (in Chinese)
[5] 周怡彤. 太湖流域西北部农药的污染特征、来源及风险评价[D]. 邯郸: 河北工程大学, 2020: 25-27
Zhou Y T. Pollution characteristics, source and ecological risk assessment of pesticides in northwest of Taihu Lake basin [D]. Handan: Hebei University of Engineering, 2020: 25-27 (in Chinese)
[6] Palanikumar L, Kumaraguru A K, Ramakritinan C M, et al. Toxicity, biochemical and clastogenic response of chlorpyrifos and carbendazim in milkfish Chanos chanos [J]. International Journal of Environmental Science and Technology, 2014, 11(3): 765-774
[7] Andrade T S, Henriques J F, Almeida A R, et al. Carbendazim exposure induces developmental, biochemical and behavioural disturbance in zebrafish embryos [J]. Aquatic Toxicology, 2016, 170: 390-399
[8] Ezeoyili I C, Mgbenka B O, Atama C I, et al. Changes in brain acetylcholinesterase and oxidative stress biomarkers in African catfish exposed to carbendazim [J]. Journal of Aquatic Animal Health, 2019, 31(4): 371-379
[9] Yilmaz S. Effects of dietary caffeic acid supplement on antioxidant, immunological and liver gene expression responses, and resistance of Nile tilapia, Oreochromis niloticus to Aeromonas veronii [J]. Fish &Shellfish Immunology, 2019, 86: 384-392
[10] Mi e Yonar S, Yonar M E, Pala A, et al. Effect of trichlorfon on some haematological and biochemical changes in Cyprinus carpio: The ameliorative effect of lycopene [J]. Aquaculture Reports, 2020, 16: 100246
e Yonar S, Yonar M E, Pala A, et al. Effect of trichlorfon on some haematological and biochemical changes in Cyprinus carpio: The ameliorative effect of lycopene [J]. Aquaculture Reports, 2020, 16: 100246
[11] 刘宇洁, 周义军. 吡虫啉的DNA损伤研究进展[J]. 毒理学杂志, 2019, 33(5): 406-412
Liu Y J, Zhou Y J. Research progress on DNA damage of imidacloprid [J]. Journal of Toxicology, 2019, 33(5): 406-412 (in Chinese)
[12] Geret F, Manduzio H, Company R, et al. Molecular cloning of superoxide dismutase (Cu/Zn-SOD) from aquatic molluscs [J]. Marine Environmental Research, 2004, 58(2-5): 619-623
[13] Guo B Y, Xu Z T, Yan X J, et al. Novel ABCB1 and ABCC transporters are involved in the detoxification of benzo(α)pyrene in thick shell mussel, Mytilus coruscus [J]. Frontiers in Marine Science, 2020, 7: 119-130
[14] 黄永欢, 刘志鸿, 吴彪, 等. 魁蚶过氧化氢酶基因克隆及表达分析[J]. 水产学报, 2016, 40(6): 856-866
Huang Y H, Liu Z H, Wu B, et al. Gene cloning and expression analysis of catalase in Scapharca broughtonii [J]. Journal of Fisheries of China, 2016, 40(6): 856-866 (in Chinese)
[15] 黄卉颖, 贺永健, 刘焕, 等. 氨基脲诱导的SD大鼠氧化应激与肝脏代谢损伤研究[J]. 食品安全质量检测学报, 2021, 12(18): 7357-7363
Huang H Y, He Y J, Liu H, et al. Study on semicarbazide-induced oxidative stress and hepatic metabolic damage in SD rats [J]. Journal of Food Safety &Quality, 2021, 12(18): 7357-7363 (in Chinese)
[16] 许中天. 苯并[a]芘(BaP)急性暴露对泥蚶(Tegillarca granosa)毒性效应的研究[D]. 舟山: 浙江海洋大学, 2021: 33-37
Xu Z T. Study on toxic effects of acute benzo[a]pyrene exposure to the blood clam Tegillarca granosa [D]. Zhoushan: Zhejiang Ocean University, 2021: 33-37 (in Chinese)
[17] 田明明, 彭颖, 张睿, 等. 定量有害结局路径(qAOP)评估环境化学物质毒性的研究进展Ⅱ: 类二噁英物质及AhR-qAOP [J]. 生态毒理学报, 2021, 16(4): 1-16
Tian M M, Peng Y, Zhang R, et al. Research advance of quantitative adverse outcome pathway (qAOP) in environmental chemicals toxicity assessment Ⅱ: Dioxin-like compounds and AhR-qAOP [J]. Asian Journal of Ecotoxicology, 2021, 16(4): 1-16 (in Chinese)
[18] 崔雯婷. 海水酸化和镉复合胁迫下褐牙鲆(Paralichthys olivaceus)仔幼鱼抗氧化防御响应和免疫应答[D]. 北京: 中国科学院大学, 2020: 26-30
Cui W T. Antioxidant defense response and immune response of juvenile Paralichthys olivaceus under combined stress of seawater acidification and cadmium [D]. Beijing: University of Chinese Academy of Sciences, 2020: 26-30 (in Chinese)
[19] 边林鑫. 微塑料和多环芳烃联合胁迫对双齿围沙蚕的毒性效应研究[D]. 大连: 大连海洋大学, 2022: 31-36
Bian L X. Combined toxic effects of microplastics and polycyclic aromatic hydrocarbons on polychaete Perinereis aibuhitensis [D]. Dalian: Dalian Ocean University, 2022: 31-36 (in Chinese)
[20] 迟潇, 陈碧鹃, 孙雪梅, 等. 基于IBR模型研究BDE-47和BDE-153对半滑舌鳎的毒性效应[J]. 生态毒理学报, 2020, 15(4): 192-202
Chi X, Chen B J, Sun X M, et al. Toxic effects of BDE-47 and BDE-153 on Cynoglossus semilaevis Gunther based on IBR model [J]. Asian Journal of Ecotoxicology, 2020, 15(4): 192-202 (in Chinese)
[21] 沈文飚, 徐朗莱, 叶茂炳, 等. 氮蓝四唑光化还原法测定超氧化物歧化酶活性的适宜条件[J]. 南京农业大学学报, 1996, 19(2): 101-102
Shen W B, Xu L L, Ye M B, et al. The suitable conditions for determining SOD activity by nitro blue tetrazolium (NBT) photoreduction method [J]. Journal of Nanjing Agricultural University, 1996, 19(2): 101-102 (in Chinese)
[22] 郎杰, 朱银硕. 大米过氧化氢酶活性的2种测定方法比较[J]. 中国粮油学报, 2014, 29(2): 89-93, 99
Lang J, Zhu Y S. Comparison of two methods for determination of catalase activity in rice [J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(2): 89-93, 99 (in Chinese)
[23] 王亚星. 咪唑类氯化盐离子液体对泥鳅的抗氧化效应和免疫毒性以及挽救研究[D]. 新乡: 河南师范大学, 2018: 59-66
Wang Y X. Antioxidation, immune toxicity and rescue of imidazole chloride ionic liquids on loach [D]. Xinxiang: Henan Normal University, 2018: 59-66 (in Chinese)
[24] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative CT method [J]. Nature Protocols, 2008, 3(6): 1101-1108
[25] 焦雅琪. 邻苯二甲酸单丁酯对斑马鱼(Danio rerio)的毒性效应机制[D]. 哈尔滨: 东北农业大学, 2021: 51-58
Jiao Y Q. Toxic effect mechanism of monobutyl phthalate on zebrafish (Danio rerio) [D]. Harbin: Northeast Agricultural University, 2021: 51-58 (in Chinese)
[26] Hong Y H, Huang Y, Yang X Z, et al. Abamectin at environmentally-realistic concentrations cause oxidative stress and genotoxic damage in juvenile fish (Schizothorax prenanti) [J]. Aquatic Toxicology, 2020, 225: 105528
[27] 陆妍, 陈曦, 裘丽萍, 等. 灭多威对斑马鱼胚胎抗氧化防御系统的影响[J]. 农业环境科学学报, 2022, 41(3): 472-480
Lu Y, Chen X, Qiu L P, et al. Effects of methomyl on antioxidant defense system of zebrafish embryos [J]. Journal of Agro-Environment Science, 2022, 41(3): 472-480 (in Chinese)
[28] 宋志明, 刘鉴毅, 庄平, 等. 低温胁迫对点篮子鱼幼鱼肝脏抗氧化酶活性及丙二醛含量的影响[J]. 海洋渔业, 2015, 37(2): 142-150
Song Z M, Liu J Y, Zhuang P, et al. Influence of low-temperature stress on the antioxidant enzymes activities and malondialdehyde contents in liver of juvenile Siganus guttatas [J]. Marine Fisheries, 2015, 37(2): 142-150 (in Chinese)
[29] 裘红权, 沈小铁, 刘璟, 等. 脂质过氧化在环境污染物生化效应研究中的应用与展望[J]. 浙江大学学报(农业与生命科学版), 2021, 47(5): 543-556
Qiu H Q, Shen X T, Liu J, et al. Application and prospect of lipid peroxidation in the study of biochemical effects of environmental pollutants [J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2021, 47(5): 543-556 (in Chinese)
[30] Farag M R, Alagawany M, Taha H S A, et al. Immune response and susceptibility of Nile tilapia fish to Aeromonas hydrophila infection following the exposure to bifenthrin and/or supplementation with Petroselinum crispum essential oil [J]. Ecotoxicology and Environmental Safety, 2021, 216: 112205
[31] 孟顺龙, 陈曦, 陈泽秋, 等. 2,2’,4,4’-四溴联苯醚胁迫对尼罗罗非鱼肝脏抗氧化防御系统的影响[J]. 生态学杂志, 2021, 40(10): 3221-3227
Meng S L, Chen X, Chen Z Q, et al. Effects of 2,2’,4,4’-tetrabromodiphenyl ether on antioxidant defense system in liver of tilapia [J]. Chinese Journal of Ecology, 2021, 40(10): 3221-3227 (in Chinese)
[32] 田淑新, 杨淑玉, 赵文阁, 等. 两种农药对青鳉抗氧化酶活性和bcl6b基因表达的影响[J]. 生态学杂志, 2020, 39(6): 2033-2041
Tian S X, Yang S Y, Zhao W G, et al. Effects of two kinds of pesticides on activities of antioxidant enzymes and the expression of bcl6b gene in Oryzias latipes [J]. Chinese Journal of Ecology, 2020, 39(6): 2033-2041 (in Chinese)
[33] Zheng J L, Zeng L, Shen B, et al. Antioxidant defenses at transcriptional and enzymatic levels and gene expression of Nrf2-Keap1 signaling molecules in response to acute zinc exposure in the spleen of the large yellow croaker Pseudosciaena crocea [J]. Fish &Shellfish Immunology, 2016, 52: 1-8
[34] Madeira D, Andrade J, Leal M C, et al. Synergistic effects of ocean warming and cyanide poisoning in an ornamental tropical reef fish [J]. Frontiers in Marine Science, 2020, 7: 246
[35] 高修歌, 杨丹, 宋昕昊, 等. 硫酸铜和马度米星铵联合暴露对鲫鱼的毒性和效应标记物研究[J]. 生态毒理学报, 2021, 16(5): 285-300
Gao X G, Yang D, Song X H, et al. Toxicity and toxic effect markers of combined exposure of copper sulphate and maduramicin on Carassius auratus [J]. Asian Journal of Ecotoxicology, 2021, 16(5): 285-300 (in Chinese)
[36] 朱紫晴, 黄守龙, 张学胜, 等. 2,3,7,8-四氯代二苯并噻吩在锦鲫不同组织中的生物富集及对肝脏的氧化损伤[J]. 环境污染与防治, 2022, 44(1): 39-44, 50
Zhu Z Q, Huang S L, Zhang X S, et al. Tissues bioaccumulation and hepatic oxidative damage in Carassius auratus exposed to 2,3,7,8-tetrachlorodibenzothiophene [J]. Environmental Pollution &Control, 2022, 44(1): 39-44, 50 (in Chinese)
[37] 张银杰. 壬基酚在斑马鱼体内的富集清除及对抗氧化酶的影响研究[D]. 上海: 华东理工大学, 2021: 37-42
Zhang Y J. Bioaccumulation, elimination of nonylphenol in different tissues of zebrafish and its effect on antioxidant enzymes [D]. Shanghai: East China University of Science and Technology, 2021: 37-42 (in Chinese)
[38] 李思, 刘晓宇. 辛硫磷对鲫鱼肝微粒体中CYP1A活性及其表达水平的影响[J]. 南方农业学报, 2019, 50(10): 2329-2334
Li S, Liu X Y. Effects of phoxim on the activity and expression of CYP1A in liver microsomes of Carassius auratus gibebio (crucian carp) [J]. Journal of Southern Agriculture, 2019, 50(10): 2329-2334 (in Chinese)
[39] Santillán Deiú A, Miglioranza K S B, Ondarza P M, et al. Exposure to environmental concentrations of fipronil induces biochemical changes on a neotropical freshwater fish [J]. Environmental Science and Pollution Research International, 2021, 28(32): 43872-43884
[40] 田丽娜, 杨金生, 周佑霖, 等. 原油对潮间带大弹涂鱼(Boleophthalmus pectinirostris)抗氧化酶活性影响的初步探究[J]. 海洋环境科学, 2022, 41(1): 135-141
Tian L N, Yang J S, Zhou Y L, et al. The primary study on antioxidase activities of Boleophthalmus pectinirostris exposed to crude oil in intertidal zone [J]. Marine Environmental Science, 2022, 41(1): 135-141 (in Chinese)
[41] Dawood M A O, Noreldin A E, Sewilam H. Long term salinity disrupts the hepatic function, intestinal health, and gills antioxidative status in Nile tilapia stressed with hypoxia [J]. Ecotoxicology and Environmental Safety, 2021, 220: 112412
[42] Yu K, Huang K, Tang Z Y, et al. Metabolism and antioxidation regulation of total flavanones from Sedum sarmentosum Bunge against high-fat diet-induced fatty liver disease in Nile tilapia (Oreochromis niloticus) [J]. Fish Physiology and Biochemistry, 2021, 47(4): 1149-1164
[43] 邢永泽, 周浩郎, 吴斌, 等. 综合运用多种生物标志物监测海洋环境研究进展[J]. 海洋环境科学, 2013, 32(5): 795-800
Xing Y Z, Zhou H L, Wu B, et al. Recent advances in utilizing integrated multiple biomarkers to evaluate marine environment [J]. Marine Environmental Science, 2013, 32(5): 795-800 (in Chinese)
[44] 柳佳佳, 朱效鹏, 滕佳, 等. 微塑料和芘对菲律宾蛤仔的毒性效应研究[J]. 海洋通报, 2021, 40(6): 644-656
Liu J J, Zhu X P, Teng J, et al. Toxic effects of polystyrene microplastics and pyrene on Ruditapes philippinarum [J]. Marine Science Bulletin, 2021, 40(6): 644-656 (in Chinese)
[45] 代恒美, 郭子毓, 徐玉艳, 等. 基于IBR模型研究磷化工区溪流水体对斑马鱼的毒性效应[J]. 生态毒理学报, 2022, 17(4): 441-450
Dai H M, Guo Z Y, Xu Y Y, et al. Study on the toxic effects of streams in phosphorus chemical industry area on zebrafish based on IBR model [J]. Asian Journal of Ecotoxicology, 2022, 17(4): 441-450 (in Chinese)