酰胺类除草剂具有高效和高选择性,使用量在全球除草剂市场中排第4位[1]。在我国,酰胺类除草剂的应用仅次于氨基酸类除草剂和有机磷除草剂[2]。2009年,乙草胺、丁草胺、丙草胺、异丙甲草胺、甲草胺和敌稗等酰胺类除草剂在我国除草剂市场份额占比分别为10.5%、4.9%、0.73%、0.4%、0.3%和0.005%,占除草剂市场的18%[3]。截止到2014年,乙草胺、丁草胺、甲草胺,占该类除草剂总产量的96%[4]。除草剂等农药可以通过农田排水、降雨、淋溶和大气沉降等途径进入水环境[5]。酰胺类除草剂的水溶性较强,土壤吸附常数比较低,容易通过渗透作用进入到水环境中,且半衰期较长,成为地表水中常见的污染物[6]。其中,甲草胺和乙草胺作为一种内分泌干扰物,可通过食物链的富集作用,对生态系统和人类健康产生危害,已被美国环境保护局(United States Environmental Protection Agency, US EPA)定为B-2类致癌物,并在部分国家与地区禁用[7]。随着酰胺类除草剂在我国部分地区的大面积、高频率使用,其对环境的污染问题日益突出[8]。研究显示,乙草胺在我国重点流域水体中最高检出浓度为579.9 ng·L-1,检出率为74.1%[9]。在哈尔滨郊区的淡水养殖池塘水体中,池塘表层水体中除草剂浓度在nd~1 671.30 ng·L-1,其中乙草胺、丙草胺和丁草胺的检出率为100%[10]。黄淮海流域和松辽流域水体中乙草胺、丁草胺和异丙甲草胺的残留量均超过了地表水环境质量标准[11]。酰胺类除草剂对植物的主要作用机制是干扰与抑制植物的生理代谢,其中甲草胺、乙草胺、丁草胺和异丙甲草胺主要阻碍蛋白质合成进而抑制细胞生长,丙草胺为细胞分裂抑制剂[12];敌稗为茎叶处理剂[13-14]。大量研究显示,酰胺类除草剂可以对非靶标生物产生毒性效应[15-16]。丁草胺可以抑制斑马鱼胚胎发育[17]、使其孵化率下降以及内分泌代谢紊乱[18]。乙草胺可以抑制斑马鱼幼鱼酶活性和甲状腺的基因表达[19-20]。丙草胺和乙草胺均可以诱导斑马鱼细胞凋亡,引起氧化应激和免疫毒性[21-22]。异丙甲草胺会对藻类的抗氧化酶系产生影响[23],敌稗会使大型溞的糖原蛋白质储存量下降,从而影响大型溞繁殖[15]、使幼体和母溞死亡率升高。酰胺类除草剂的广泛使用已经对水环境造成了一定程度的污染,对水生生物可能存在的毒害效应值得关注,但是当前仍缺乏有效的评价依据或指标用于生态风险评价。
水质基准(water quality criteria, WQC)是水环境中污染物对特定对象不产生有害效应的最大可接受剂量或浓度[24],是污染物水环境质量标准制定和风险评价的主要科学依据。为评估酰胺类除草剂对水生态系统的毒害风险,US EPA建立了甲草胺、乙草胺、异丙甲草胺和敌稗的WQCs[25];加拿大环境保护局发布了异丙甲草胺的WQC[26]。李婧[27]基于钱塘江流域物种毒性数据研究了丁草胺的WQCs,为中国酰胺类除草剂WQCs的研究和建立提供了依据。鉴于当前我国除草剂的大量使用和污染现状,为有效进行酰胺类除草剂的生态风险评价和污染控制,有必要针对污染风险较高的酰胺类除草剂建立更加全面的水质基准体系。
本研究结合农药应用和污染情况选择典型酰胺类除草剂(包括甲草胺、乙草胺、丙草胺、丁草胺、异丙甲草胺和敌稗),应用物种敏感度分布(species sensitivity distribution, SSD)法推导了水生生物水质基准,同时对国内部分地表水中典型酰胺类除草剂的生态风险进行了初步评价,以期为中国酰胺类除草剂的水质标准制/修订和水质管理提供科学依据。
1 材料与方法(Materials and methods)
1.1 毒性数据收集和评价
从US EPA生态毒理学数据库ECOTOX (http://cf-pub.epa.gov/ecotox/)和已经公开发表的文献和报告中搜集酰胺类除草剂对淡水水生生物的毒性数据。对于急性毒性数据,选择鱼类或两栖动物的96 h半数效应浓度(EC50)或半数致死浓度(LC50)、无脊椎动物(如水蚤等)的48 h-EC50或LC50、藻类的24 h-LC50或EC50[28]。对于慢性毒性数据,幼鱼或成鱼的暴露时间一般>21 d,胚胎或仔鱼暴露时间一般>7 d;受试物种为无脊椎动物的暴露时间>96 h;藻类暴露时间>24 h或>48 h。如果同一研究中一个物种有多个毒性值时,选取最敏感的毒性数据。可按照优先顺序选择数据:最大可接受毒物浓度(MATC)>最大无效应浓度(NOEC)>最低有效应浓度(LOEC)>EC50>LC50[28]。如果同一物种存在不同环境条件下的毒性数据,则采用这些值的几何均值。
由于搜集到的毒性数据来自不同的实验室,或者基于不同的研究方法,数据质量可能存在一定差异。该研究采用欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods)开发的毒理学数据可靠性评价工具(ToxRTool)对所有收集到的毒性数据进行打分以定量评价其可靠性。ToxRTool针对体内实验标准共计21条,分为5组,分别为实验物质的鉴定、实验体系的特征、实验设计的描述、实验结果的记录、实验设计和结果的可信度[29]。该方法所涉及问题主要关于实验物质、实验物种和数量、实验过程中暴露途径、浓度、暴露时间和对照组、以及研究设计是否合适等。按照实验数据和信息是否符合各项标准来回答“是”或者“否”。回答“是”得1分,“否”得0分,最后计算总得分。按照得分将数据的可靠性分为3类,其中得分18~21为第1类,即严格按照标准实验方法实施的归为“无限制的可靠类”;得分13~17为第2类,即没有参照标准实验方法,但实验过程和结果记录完整,且有一定的科学性,归为“有限制的可靠类”;低于13分或者不满足以上所涉及的信息为第3类,为“不可靠类”数据。本研究只使用属于第一、二类的数据作为有效数据用于水质基准的推导。
应用Shapiro-Wilk (S-W)和Kolmogorov-Smirnov (K-S)检验数据的正态分布。考虑到本地物种毒性数据量有限,该研究同时收集了国外物种毒性数据。使用独立样本t检验和非参数检验-两独立样本中的Mann-Whitney U检验同一酰胺类除草剂的国外与本土物种毒性数据的差异。如果国外物种与本土物种毒性数据无显著性差异,则将国外物种数据与本土物种数据合并使用[30]。使用SPSS26完成所有统计分析。
1.2 水质基准推导
该研究使用SSD法推导酰胺类除草剂的WQCs。SSD法是通过累积概率分布函数将不同物种的毒性数据进行拟合,构建SSD曲线,依据数据分布函数计算影响5%物种的化学物浓度(hazardous concentration for 5% of species, HC5),即保护生态系统95%物种对应的浓度[30]。该方法是目前在水质基准研究中使用最多的统计外推法[24, 31]。具体步骤为[30, 32]:(1)计算物种平均毒性值。(2)将物种平均毒性值按从小到大的顺序进行排列,计算累积概率P=n/(N+1)。其中,n为毒性数据的排序,N为物种总数。(3)以物种平均毒性值为横坐标、累积概率为纵坐标构建SSD曲线。采用中国环境基准与风险评估国家重点实验室开发的EEC-SSD软件拟合SSD曲线[33]。应用软件中Normal、Log-Normal、Logistic和Log-Logistic模型同时对每一组毒性数据进行拟合。依据决定系数(R2)和均方根差(root mean square error, RMSE)等评价模型的拟合优度,选择最佳拟合模型计算HC5。将HC5除以评价因子(assessment factor, AF)获得水质基准值。根据有效毒性数据的质量和数量确定AF,一般取值为2~5[34]。该研究中AF取值为2。
如果慢性毒性数据较少,不能拟合SSD曲线时,使用急性基准值除以急慢性比率(acute-chronic ratio, ACR)获得慢性基准值[35]。计算ACR值的急性和慢性毒性值必须来自同一个研究的相同物种,或者是同一实验条件下得出的。无法获得ACR值时,使用US EPA推荐使用的默认值10[32]。
1.3 生态风险评价
该研究搜集了中国地表水中酰胺类除草剂的暴露浓度,应用商值法评价生态风险。风险商(risk quotient, RQ)的计算公式如下[36-37]:
式中:MEC为酰胺类除草剂的环境暴露浓度(ng·L-1);WQC为该研究推导的酰胺类除草剂的水质基准值(ng·L-1)。RQ≥1.0为高风险;0.1
2 结果(Results)
2.1 毒性数据
6种酰胺类除草剂对淡水生物毒性数据及统计值见表1。所有毒性数据均符合(对数)正态分布(P>0.05)。本土物种与非本土物种的毒性数据均不存在显著性差异(P>0.05),因此将符合要求的非本土物种也合并用于水质基准研究。对于急性毒性,鱼类对甲草胺和敌稗更为敏感,藻类对乙草胺和异丙甲草胺更为敏感,甲壳类动物对丁草胺和丙草胺更为敏感[39]。对于慢性毒性,6种酰胺类除草剂的最敏感生物分别为剑水蚤(NOEC,0.1 μg·L-1)、稀有鮈鲫(NOEL,0.2 μg·L-1)、克氏原螯虾(96 h-LC50,11.9 μg·L-1)、斑马鱼(NOEC,6.4 μg·L-1)、豹蛙(NOEC,0.22 μg·L-1)和黑头软口鲦(MATC,0.582 μg·L-1)。其中,甲壳类动物对甲草胺和丙草胺更为敏感,鱼类对乙草胺、丁草胺和敌稗更为敏感,而两栖类对异丙甲草胺更为敏感。
表1 6种酰胺类除草剂对淡水水生生物的毒性数据统计
Table 1 Statistical values for toxicity data of 6 amide herbicides to freshwater aquatic organisms

注:—为数据较少不足以做统计分析,P(S-W)和P(K-S)分别是正态分布检验概率。
Note: — the data is insufficient for statistical analysis; P(S-W) and P(K-S) are normally distributed test probabilities, respectively.
除草剂Herbicide毒性类别Toxicity category物种数Number of species毒性值范围/(μg·L-1)Range of toxicity values/(μg·L-1)P(S-W)P(K-S)甲草胺Alachlor急性Acute111 836^18 6000.320.70慢性Chronic140.1^25 0000.000.07乙草胺Acetochlor急性Acute6100^40 0000.050.40慢性Chronic100.2^34 756.10.000.16丙草胺Preochlor急性Acute715.7^5 3500.080.69慢性Chronic511.9^20 0300.000.17丁草胺Butachlor急性Acute1811.7^8 1800.000.14慢性Chronic106.4^8 616.20.0010.24异丙甲草胺Metolachlor急性Acute8240^46 2100.230.76慢性Chronic140.22^25 0000.000.15敌稗Propanil急性Acute6430^9 5000.020.49慢性Chronic30.4^550——
2.2 水质基准
Normal、Log-Normal和Logistic模型对酰胺类除草剂毒性数据的拟合效果较好,其中不同除草剂所对应的最佳拟合模型不同(表2)。甲草胺的急性毒性数据使用Normal模型拟合效果最好(图1(a)),基于该模型计算的急性HC5为2 343 μg·L-1,急性WQC为1 171.5 μg·L-1 (表2)。Logistic模型对乙草胺、丙草胺、丁草胺和异丙甲草胺的急性毒性数据拟合效果最好(图1(b)),基于该模型计算的急性HC5分别为57.3、143.5、90.82和1 663 μg·L-1,急性WQCs分别为28.65、71.75、45.41和831.5 μg·L-1 (表2)。Log-Normal模型对敌稗的急性毒性数据拟合效果最好(图1(c)),基于该模型计算的急性HC5为1 393 μg·L-1,急性WQC为696.5 μg·L-1 (表2)。Logistic模型对甲草胺、丙草胺、异丙甲草胺的慢性毒性数据拟合效果最好(图2(a)),慢性HC5分别为2、2.98和7.99 μg·L-1,慢性WQCs分别为1.01、1.49和3.99 μg·L-1 (表2)。Normal模型对乙草胺和丁草胺的慢性毒性数据拟合效果最好(图2(b)),基于该模型计算的慢性HC5分别为3.726 μg·L-1和21.64 μg·L-1,慢性WQCs分别为1.86 μg·L-1和10.82 μg·L-1 (表2)。由于敌稗的慢性数据较少不能构建SSD曲线且未获得同一物种的急性和慢性毒性数据,采用急性基准值和ACR默认值计算了敌稗的慢性基准值,结果为69.65 μg·L-1。
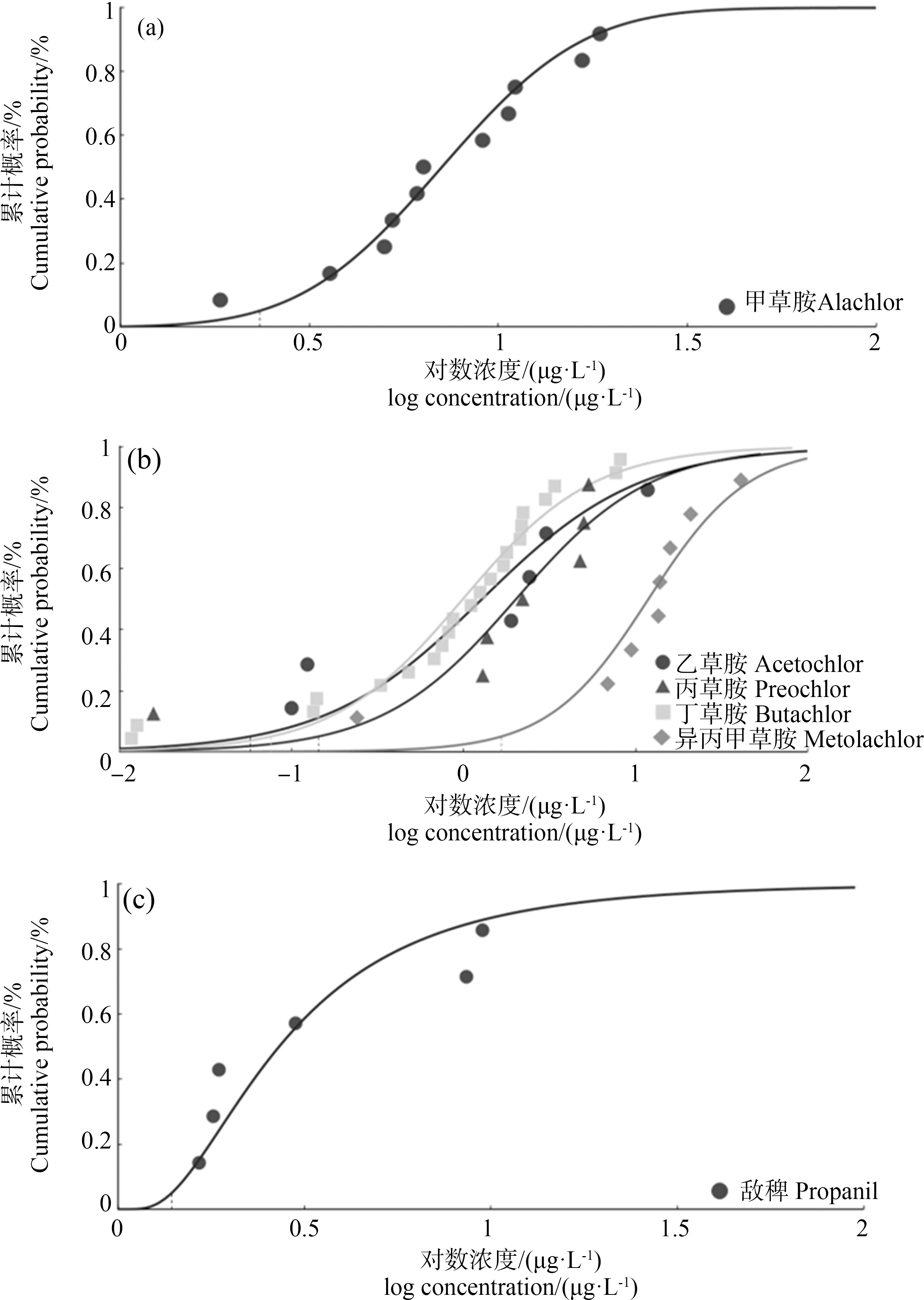
图1 酰胺类除草剂的急性毒性物种敏感度分布曲线
注:(a) Normal模型;(b) Logistic模型;(c) Log-normal模型。
Fig. 1 Species sensitivity distribution curves of amide herbicides acute toxicity
Note: (a) Normal model; (b) Logistic model; (c) Log-normal model.
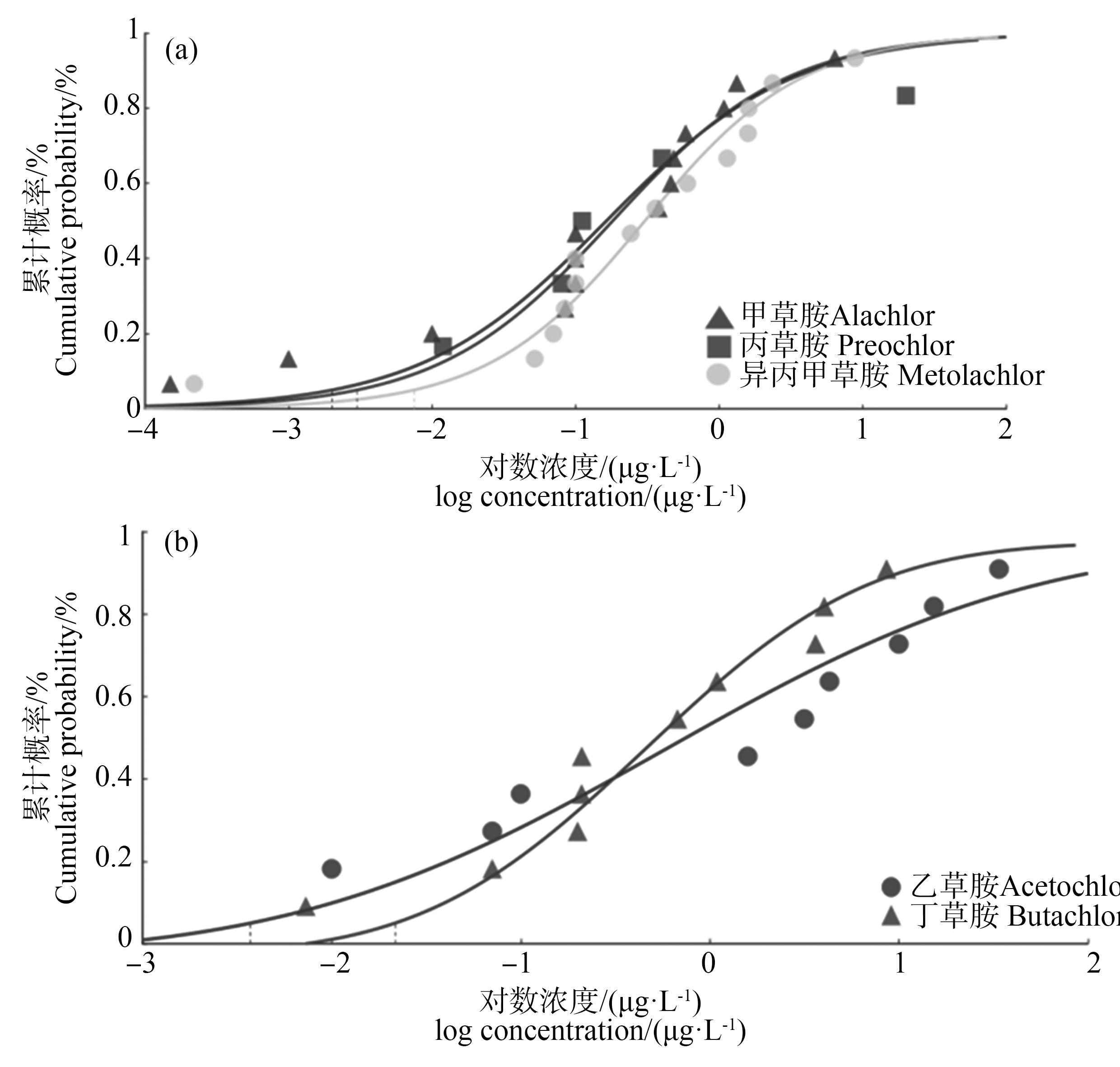
图2 酰胺类除草剂慢性毒性物种敏感度分布曲线
注:(a) Logistic模型;(b) Normal模型。
Fig. 2 Species sensitivity distribution curves of amide herbicides chronic toxicity
Note: (a) Logistic model; (b) Normal model.
表2 酰胺类除草剂的水生生物水质基准
Table 2 Aquatic life water quality criteria for amide herbicides

注:—为无相关数据,HC5是影响5%物种的化学物浓度;WQC是水质基准;SSD是物种敏感度分布;R2是决定系数;RMSE是均方根差;P(K-S)是正态分布检验概率。
Note: — no relevant data; HC5 is hazardous concentration for 5% of species; WQC is water quality criteria; SSD is species sensitivity distribution; R2 is coefficient of determination; RMSE is root mean square error; P(K-S) is the normally distributed test probability.
除草剂Herbicide毒性类别Toxicity category物种数Number of speciesHC5/(μg·L-1)WQC/(μg·L-1)SSD分布模型 SSD modelsR2RMSEP(K-S)甲草胺Alachlor急性Acute112 3431 171.5Normal0.970.044>0.05慢性Chronic142.011.01Logistic0.940.068>0.05乙草胺Acetochlor急性Acute657.328.65Logistic0.80.11>0.05慢性Chronic103.731.86Normal0.910.077>0.05丙草胺Preochlor急性Acute7143.571.75Logistic0.870.09>0.05慢性Chronic52.981.49Logistic0.90.76>0.05丁草胺Butachlor急性Acute1890.8245.41Logistic0.980.037>0.05慢性Chronic1021.6410.82Normal0.950.058>0.05异丙甲草胺Metolachlor急性Acute81 663831.5Logistic0.910.076>0.05慢性Chronic147.993.99Logistic0.970.049>0.05敌稗Propanil急性Acute61 393696.5Log-Normal0.810.11>0.05慢性Chronic3—69.65————
2.3 生态风险
研究搜集了国内部分水体中酰胺类除草剂的暴露浓度(表3),并与本研究中的WQCs值进行比较,进行初步风险评价。结果显示,国内地表水水体中甲草胺和丙草胺在水体中的暴露浓度较低,急性和慢性RQ值均低于0.1,生态风险较低。丁草胺在长江流域中下游地区部分点位水样的急性RQ值超过了1.0,该区域属于高风险地区。乙草胺在松花江、九龙江河口和广西甘蔗种植区水体中的慢性RQ值>0.1,存在中等风险。异丙甲草胺在广西种植区水域的慢性RQ值超过了0.1,该水体处于中风险水平。
表3 中国地表水中酰胺类除草剂的浓度和生态风险商值
Table 3 Concentrations and risk quotient of amide herbicides in surface water of China

注:-无对应地表水含量数据;*表示该区域除草剂的浓度是一个范围,其他区域暴露浓度为均值。
Note: - no corresponding data; *represents that the concentration of herbicides provided is a range, and the average values of the concentrations of herbicides were used in the risk assessment for other basins.
水体Water body除草剂浓度(ng·L-1)和风险商值Concentrations (ng·L-1) and risk quotient of amide herbicides甲草胺Alachlor乙草胺Acetochlor丙草胺Preochlor丁草胺 Butachlor异丙甲草胺Metolachlor浓度 Concentration急性Acute慢性 Chronic浓度Concentration急性Acute慢性Chronic浓度 Concentration急性Acute慢性 Chronic浓度Concentration急性Acute慢性 Chronic浓度 Concentration急性Acute慢性 Chronic松花江[9]Songhua River[9]---277.89.7×10-30.15---------黑龙江[9]Heilongjiang River[9]---120.34.2×10-36×10-2---------长江[11, 40]*Yangtze River[11, 40]*0.018.54×10-91×10-550.11.75×10-33×10-2---2.13^1.06×1054.7×10-5^2.331.94×10-4^9.82.603.13×10-67.27×10-4南水北调东线[9]South to North Water Diversion Project[9]---18.76.5×10-41×10-2---------九龙江河口[41-42]*Jiulong River[41-42]*---丰水期Wet season4.9^66.4枯水期Dry season3.3^296.91.15×10-4^0.011.78×10-3^0.16---丰水期Wet season3.5^40.7枯水期Dry season1.0^6.37.7×10-5^9×10-43.2×10-4^3.8×10-3---九里河[43]Jiuli River[43]---269.1×10-41.4×10-2------94.31.13×10-40.026广西甘蔗种植区水体[44]Water body in Guangxi sugarcane planting area[44]887.51×10-58.8×10-23111.1×10-20.17------1 3121.58×10-30.37太湖[45-46]Taihu Lake[45-46]---113.84×10-45.9×10-32.63.6×10-51.74×10-31.53.1×10-51.4×10-4738.78×10-50.02淡水河[47]Danshui River[47]---------10.12.2×10-49.3×10-42.482.98×10-66.9×10-4石马河[47]Shima River[47]3.032.59×10-63.03×10-3------9.62.1×10-48.87×10-4---
3 讨论(Discussion)
酰胺类除草剂的大量使用导致其在水环境中被广泛检出,可能会对水生生物存在潜在毒害风险。本研究使用可靠度较高的毒性数据,研究了典型酰胺类除草剂的WQCs,同时进行了初步的生态风险评价。基于急性HC5和WQCs,酰胺类除草剂的急性毒性大小顺序为乙草胺>丁草胺>丙草胺>敌稗>异丙甲草胺>甲草胺。这与刘迎等对斑马鱼的毒性研究结果相似[16]。从SSDs曲线也可以看出乙草胺、丙草胺和丁草胺对水生生物的毒性远高于异丙甲草胺(图1(b))。乙草胺、丙草胺和丁草胺的WQCs处于同一数量级,与其他3个除草剂相差2~3个数量级。丁草胺主要用于水田除草,其对水生生物毒性较高。而对于慢性毒性HC5和WQCs,其大小顺序为甲草胺>丙草胺>乙草胺>异丙甲草胺>丁草胺>敌稗。但是前5种除草剂的基准值处于同一数量级,与敌稗相比相差2个数量级。当前针对敌稗的慢性毒性研究相对有限,本研究仅搜集到3个符合要求的物种毒性数据,因此使用了急性WQC和ACR默认值计算了敌稗的慢性WQC,可能存在较大的不确定性。该慢性WQC也远高于已获得的敌稗对月牙藻和黑头软口鲦的慢性毒性值(0.4~31 μg·L-1),低于对大型溞的慢性毒性值(70~550 μg·L-1)。如果应用最低值,即黑头软口鲦(Pimephales promelas)基于生长或死亡的慢性毒性值0.53 μg·L-1[48] (MATC、NOEC和LOEC的几何均值)和评价因子10[49],计算获得敌稗的慢性WQC为0.053 μg·L-1;该值与本研究中计算的其他除草剂的慢性WQCs较为接近。但是为了获得更为准确的基准值,有必要开展更多物种敌稗的毒性效应研究,分析其物种敏感度分布特征。
作为应用广泛的一类除草剂,其他国家也开展了酰胺类除草剂的水质基准研究(表4)。加拿大环境保护局基于评价因子法,应用最敏感生物黑头软口鲦28 d的MATC乘以0.01得到了异丙甲草胺的临时水质基准7.8 μg·L-1[26],与本研究慢性WQC (3.99 μg·L-1)比较接近。US EPA的农药规划办公室提出了分别针对鱼类、无脊椎动物和植物的水质基准值;应用每个类别生物的最敏感物种的毒性值乘以关注级别(level of concern, LOC)得到淡水水生生物水质基准[25]。其中,LOC对水生脊椎和无脊椎动物的急性毒性取值为0.5,慢性毒性及其水生植物取值为1。本研究中得出的甲草胺、异丙甲草胺和敌稗的急性基准值与US EPA结果处于同一个数量级,乙草胺的急性基准值相差一个数量级;而慢性基准值则普遍较低。澳大利亚和新西兰[50]将异丙甲草胺对孔雀花鳉(Poecilia reticulata)的48 h-LC50乘以评价因子0.001获得了低可靠性触发值为0.02 μg·L-1,作为临时水质基准,低于本研究中的慢性基准值(3.99 μg·L-1)。以上水质基准值均由最敏感生物乘以评价因子得到,其基准值存在很大不确定性,本研究采用SSD法所获结果较为可靠。与钱塘江流域水质基准值相比,本研究中丁草胺急性基准值低2倍,但处于同一个数量级,而慢性基准值则相差1 900多倍。应用独立样本t检验进行差异性分析,结果显示丁草胺对钱塘江物种慢性毒性值与本研究筛选数据间存在显著性差异(P<0.05)。慢性基准值差异之大的原因可能是前者搜集的丁草胺的慢性数据相对较少,仅有5个;这也造成所有拟合模型的R2均低于0.9[27]。在水质基准的研究中有必要选择符合区域环境和生物区系特征的毒性数据,且数据越多结果越可靠。除了敌稗的慢性毒性数据之外,其他所有WQCs均是基于可靠度较高的毒性数据和SSDs获得,可用于中国地表水中酰胺类除草剂的水质管理。
表4 其他研究中酰胺类除草剂的水质基准
Table 4 Water quality criteria of amide herbicides in other studies (μg·L-1)
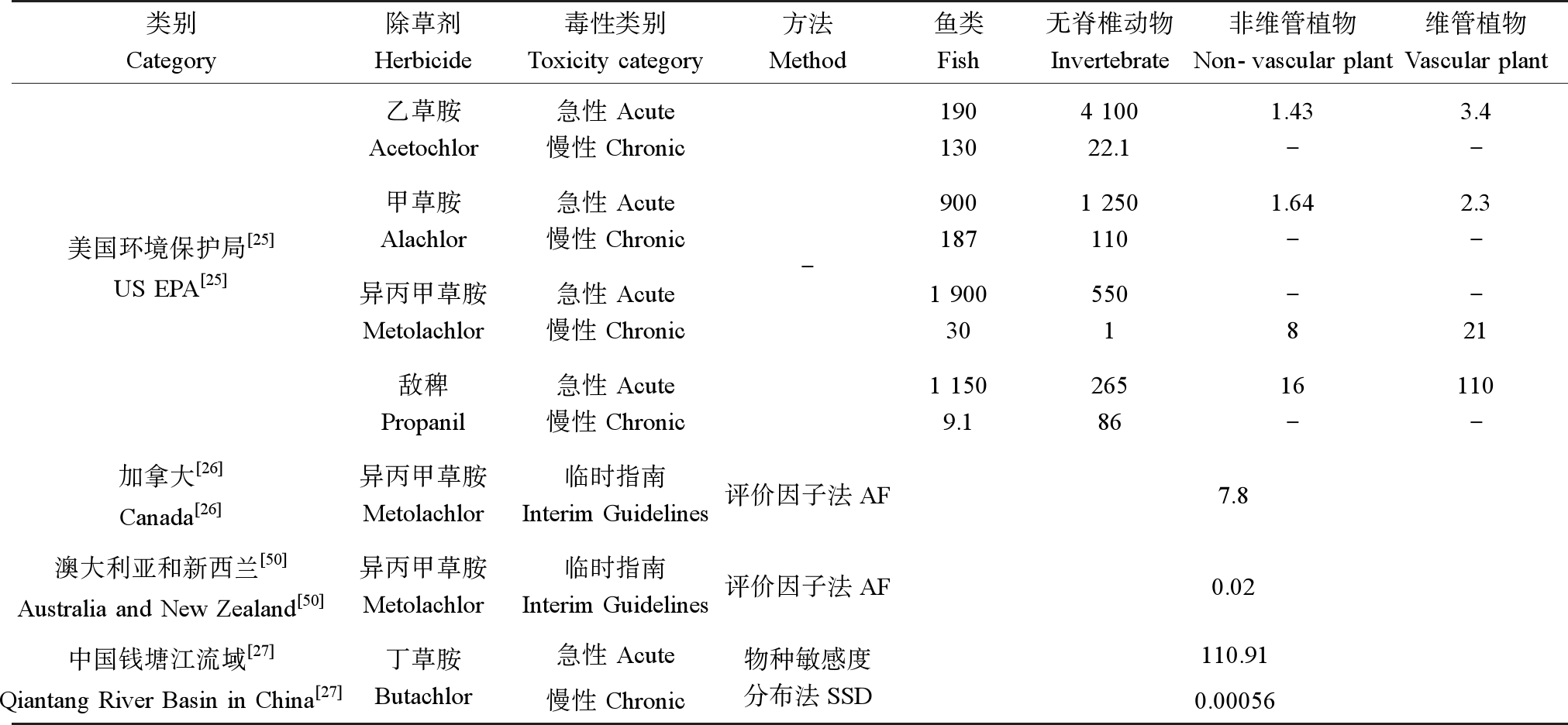
注:-为无相关数据。
Note: - no relevant data.
类别Category除草剂Herbicide毒性类别Toxicity category方法Method鱼类Fish无脊椎动物Invertebrate非维管植物Non-vascular plant维管植物Vascular plant美国环境保护局[25]US EPA[25]乙草胺Acetochlor甲草胺Alachlor异丙甲草胺Metolachlor敌稗Propanil急性 Acute慢性 Chronic急性 Acute慢性 Chronic急性 Acute慢性 Chronic急性 Acute慢性 Chronic-1901304 10022.11.43-3.4-9001871 2501101.64-2.3-1 900305501-8-211 1509.12658616-110-加拿大[26]Canada[26]异丙甲草胺Metolachlor临时指南Interim Guidelines评价因子法AF7.8澳大利亚和新西兰[50] Australia and New Zealand[50]异丙甲草胺Metolachlor临时指南Interim Guidelines评价因子法AF0.02中国钱塘江流域[27]Qiantang River Basin in China[27]丁草胺Butachlor急性 Acute慢性 Chronic物种敏感度分布法SSD110.910.00056
初步风险评价结果显示,中国部分地表水体中酰胺类除草剂具有中等或较高的暴露风险。广西种植区、长江流域和松花江流域周边为农业活动密集区,部分水体中乙草胺、丁草胺或异丙甲草胺具有中等或较高风险[46],可能与区域农药使用量较大有关。九龙江河口丰水期部分点位水样中丁草胺对水生生物构成了中等风险[41],主要来自中上游农业区域输入暴露。因此,这些区域地表水中酰胺类除草剂的暴露水平和毒害风险需要长期关注,对于具有较高丁草胺毒害风险的长江流域部分点位应采取积极的防控措施。
农药对水生生物的毒性受多种因素的影响,包括温度、湿度、溶解有机物、降解产物、共存重金属或其他农药以及助剂等。研究显示在较高温度下,异丙甲草胺对太平洋牡蛎有更大的毒性[51]。甲草胺、乙草胺和异丙甲草胺对作物的毒性随着湿度的上升而上升,且在低温高湿环境下更易产生药害[52]。另外,研究显示毒死蜱和乙草胺复合污染对胚胎的致畸毒性强于单剂暴露[53];镉和乙草胺混合物毒性效应高于单一污染[54];丁草胺复配剂对藻类的毒性高于单剂,但对大型溞的毒性低于单剂[55]。由于数据有限,该研究没能考虑环境因素和共存化学物等因素对酰胺类除草剂毒性和水质基准的影响。开展不同环境条件下酰胺类除草剂的毒性效应研究,探索环境因素与毒性的定量关系,可以为建立更加准确的水质基准和风险评价提供依据。
农药在实际使用中会添加助剂以发挥最大效用。目前多项研究表明农药制剂的毒性远大于其原药。Beggel等[56]的研究中发现联苯菊酯和氟虫腈农药制剂的毒性大于活性成分。Mesnage等[57]研究发现9种农药制剂中有8种的毒性高于其纯活性成分。针对草甘膦水质基准研究显示,草甘膦技术纯和相应农药制剂(比如,农达)的毒性存在显著性差异,获得的急性水质基准相差16倍,慢性水质基准相差50倍[30]。Pereira等[58]的研究证明敌稗商业制剂对大型溞的急性毒性高于活性成分,但对藻类的慢性毒性研究发现其活性成分的毒性大于商业制剂。因此,在农药的水质基准研究中必须要考虑农药助剂对其毒性的影响。本研究显示酰胺类除草剂在部分地区水体中存在中等以上风险,由于其他污染物或农药助剂的存在可能会促进酰胺类除草剂的毒性,需要持续关注该类除草剂的污染水平和毒害风险。但由于大部分实验或农药制剂都没有提供助剂配方或商业制剂中的其他添加剂成分,暂时也不能确定助剂对酰胺类除草剂原药毒性或基准的定量影响。因此,在今后研究中可能需要更多关注农药助剂对除草剂毒性的影响,为水质基准的建立和生态风险评价提供更加准确的信息。
综上,本研究获得了较为可靠的典型酰胺类除草剂的水生生物水质基准值,可以为酰胺类除草剂的水质基准和标准的制/修订及污染控制提供科学的参考依据。同时,乙草胺、丁草胺和异丙甲草胺在我国部分水体中存在中等以上毒害风险,需要长期监测和制定有效的污染控制措施。
通信作者简介:张瑞卿(1984—),男,博士,副教授,主要研究方向为环境地球化学和水质基准研究。
共同通信作者简介:李会仙(1976—),女,副研究员,博士,主要研究方向为生态毒理学和水质基准研究。
[1] 张一宾. 酰胺类除草剂的全球市场、品种及发展趋向[J]. 现代农药, 2011, 10(1): 41-43, 50
Zhang Y B. Market and products and development trend of amide herbicides [J]. Modern Agrochemicals, 2011, 10(1): 41-43, 50 (in Chinese)
[2] 陈鑫. 酰胺类除草剂在微塑料表面的载体效应[D]. 哈尔滨: 东北农业大学, 2021: 2-4
Chen X. Carrier effect of amide herbicides on the surface of microplastics [D]. Harbin: Northeast Agricultural University, 2021: 2-4 (in Chinese)
[3] 华乃震. 酰胺类除草剂制剂的研发和进展[J]. 现代农药, 2011, 10(1): 8-15
Hua N Z. Amide herbicides formulations and their progress of R &D [J]. Modern Agrochemicals, 2011, 10(1): 8-15 (in Chinese)
[4] 丁丽, 付颖, 叶非. 酰胺类除草剂的研究和应用进展[J]. 农药科学与管理, 2011, 32(9): 22-26
Ding L, Fu Y, Ye F. Progress in research and application of amide herbicides [J]. Pesticide Science and Administration, 2011, 32(9): 22-26 (in Chinese)
[5] Kaur P, Kaur P. Time and temperature dependent adsorption-desorption behaviour of pretilachlor in soil [J]. Ecotoxicology and Environmental Safety, 2018, 161: 145-155
[6] 王可, 黄笑晨, 赵灵芝, 等. 酰胺类除草剂的残留检测技术研究进展[J]. 食品安全质量检测学报, 2019, 10(17): 5590-5596
Wang K, Huang X C, Zhao L Z, et al. Research progress on detection technology of amide herbicide residues [J]. Journal of Food Safety &Quality, 2019, 10(17): 5590-5596 (in Chinese)
[7] 欧阳康, 冯唐奇, 明坤, 等. 甲草胺对非靶标生物的毒理学研究进展[J]. 农药学学报, 2021, 23(4): 628-635
Ouyang K, Feng T Q, Ming K, et al. Research advance on toxicology of alachlor to non-target organisms [J]. Chinese Journal of Pesticide Science, 2021, 23(4): 628-635 (in Chinese)
[8] 李敏. 黑龙江省稻稗对丁草胺的抗药性研究[D]. 哈尔滨: 东北农业大学, 2017: 7-11
Li M. Study on the resistance of Echinochloa oryzicola Vasing. to butachlor in rice fields of Heilongjiang Province [D]. Harbin: Northeast Agricultural University, 2017: 7-11 (in Chinese)
[9] 徐雄, 李春梅, 孙静, 等. 我国重点流域地表水中29种农药污染及其生态风险评价[J]. 生态毒理学报, 2016, 11(2): 347-354
Xu X, Li C M, Sun J, et al. Residue characteristics and ecological risk assessment of twenty-nine pesticides in surface water of major river-basin in China [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 347-354 (in Chinese)
[10] 黄晓丽, 高磊, 黄丽, 等. 哈尔滨地区养殖池塘中除草剂类农药残留及分布特征[J]. 水产学杂志, 2019, 32(2): 37-43
Huang X L, Gao L, Huang L, et al. Residues and distribution characteristics of herbicides in aquaculture ponds in Harbin area [J]. Chinese Journal of Fisheries, 2019, 32(2): 37-43 (in Chinese)
[11] 王未, 黄从建, 张满成, 等. 我国区域性水体农药污染现状研究分析[J]. 环境保护科学, 2013, 39(5): 5-9
Wang W, Huang C J, Zhang M C, et al. Study on status of regional water pollution by pesticides in China [J]. Environmental Protection Science, 2013, 39(5): 5-9 (in Chinese)
[12] Mukherjee I, Das S K, Kumar A. Atmospheric CO2 level and temperature affect degradation of pretilachlor and butachlor in Indian soil [J]. Bulletin of Environmental Contamination and Toxicology, 2018, 100(6): 856-861
[13] Pedroso R M, Al-Khatib K, Abdallah I, et al. Resistance to propanil in ricefield bulrush (Schoenoplectus mucronatus) is conferred by a psbA mutation, Val219 to Ile [J]. Weed Science, 2016, 64(4): 562-569
[14] Valverde B E, Boddy L G, Pedroso R M, et al. Cyperus difformis evolves resistance to propanil [J]. Crop Protection, 2014, 62: 16-22
[15] Villarroel M J, Sancho E, Andreu-Moliner E, et al. Caloric content of Daphnia magna as reflect of propanil stress during a short-term exposure and its relationship to long-term responses [J]. Environmental Toxicology and Pharmacology, 2013, 35(3): 465-472
[16] 刘迎, 胡燕, 姜蕾, 等. 5种酰胺类除草剂对斑马鱼胚胎发育的毒性效应[J]. 农药, 2014, 53(11): 806-808, 811
Liu Y, Hu Y, Jiang L, et al. The toxicity effects of five amide herbicides on embryo development of zebrafish [J]. Agrochemicals, 2014, 53(11): 806-808, 811 (in Chinese)
[17] 夏勇, 傅剑云, 郑云燕, 等. 丁草胺对斑马鱼及其胚胎发育毒性影响的研究[J]. 浙江预防医学, 2011, 23(1): 11-16
Xia Y, Fu J Y, Zheng Y Y, et al. Study on toxicity of butachlor on zebrafish and its embryo development [J]. Zhejiang Journal of Preventive Medicine, 2011, 23(1): 11-16 (in Chinese)
[18] Chang J H, Liu S Y, Zhou S L, et al. Effects of butachlor on reproduction and hormone levels in adult zebrafish (Danio rerio) [J]. Experimental and Toxicologic Pathology: Official Journal of the Gesellschaft Fur Toxikologische Pathologie, 2013, 65(1-2): 205-209
[19] 胡竞进, 曹楚彦, 杨梅, 等. 乙草胺对斑马鱼幼鱼早期发育阶段甲状腺相关基因的影响[J]. 农药学学报, 2015, 17(4): 409-416
Hu J J, Cao C Y, Yang M, et al. Effects of acetochlor on the expression of thyroid related genes in early development stage of zebrafish (Danio rerio) larvae [J]. Chinese Journal of Pesticide Science, 2015, 17(4): 409-416 (in Chinese)
[20] Wang H L, Meng Z, Zhou L Q, et al. Effects of acetochlor on neurogenesis and behaviour in zebrafish at early developmental stages [J]. Chemosphere, 2019, 220: 954-964
[21] Jiang J H, Chen Y H, Yu R X, et al. Pretilachlor has the potential to induce endocrine disruption, oxidative stress, apoptosis and immunotoxicity during zebrafish embryo development [J]. Environmental Toxicology and Pharmacology, 2016, 42: 125-134
[22] Jiang J H, Wu S G, Liu X J, et al. Effect of acetochlor on transcription of genes associated with oxidative stress, apoptosis, immunotoxicity and endocrine disruption in the early life stage of zebrafish [J]. Environmental Toxicology and Pharmacology, 2015, 40(2): 516-523
![]() J, et al. S-metolachlor promotes oxidative stress in green microalga Parachlorella kessleri - A potential environmental and health risk for higher organisms [J]. The Science of the Total Environment, 2018, 637-638: 41-49
J, et al. S-metolachlor promotes oxidative stress in green microalga Parachlorella kessleri - A potential environmental and health risk for higher organisms [J]. The Science of the Total Environment, 2018, 637-638: 41-49
[24] Li L, He Y J, Song K, et al. Derivation of water quality criteria of zinc to protect aquatic life in Taihu Lake and the associated risk assessment [J]. Journal of Environmental Management, 2021, 296: 113175
[25] United States Environmental Protection Agency (US EPA). Aquatic life benchmarks and ecological risk assessments for pesticide registration [R]. Washington DC: Office of Pesticide Programs, 2015
[26] Canadian Council of Ministers of the Environment (CCME). Canadian water quality guidelines for the protection of aquatic life: Metolachlor [R]. Ottawa: Canadian Council of Ministers of the Environment, 1999
[27] 李婧. 钱塘江10种化合物淡水生物水质基准研究[D]. 杭州: 浙江工业大学, 2014: 45-58
Li J. Study of water quality criteria for 10 contaminates in Qiantang River [D]. Hangzhou: Zhejiang University of Technology, 2014: 45-58 (in Chinese)
[28] Canadian Council of Ministers of the Environment (CCME). A protocol for the derivation of water quality guidelines for the protection of aquatic life [R]. Ottawa: Canadian Council of Ministers of the Environment, 2007
[29] Schneider K, Schwarz M, Burkholder I, et al. “ToxRTool”, a new tool to assess the reliability of toxicological data [J]. Toxicology Letters, 2009, 189(2): 138-144
[30] Fan Y L, Zhang K B, Zhang R Q, et al. Derivation of water quality criteria for glyphosate and its formulations to protect aquatic life in China [J]. Environmental Science and Pollution Research International, 2022, 29(34): 51860-51870
[31] Ding T T, Zhang Y H, Zhu Y, et al. Deriving water quality criteria for China for the organophosphorus pesticides dichlorvos and malathion [J]. Environmental Science and Pollution Research International, 2019, 26(33): 34622-34632
[32] 张瑞卿, 吴丰昌, 李会仙, 等. 应用物种敏感度分布法研究中国无机汞的水生生物水质基准[J]. 环境科学学报, 2012, 32(2): 440-449
Zhang R Q, Wu F C, Li H X, et al. Deriving aquatic water quality criteria for inorganic mercury in China by species sensitivity distributions [J]. Acta Scientiae Circumstantiae, 2012, 32(2): 440-449 (in Chinese)
[33] 国家生态环境基准专家委员会. 国家生态环境基准计算软件物种敏感度分布法[EB/OL]. (2022-03-04) [2022-08-16]. https://www.mee.gov.cn/ywgz/fgbz/hjjzgl/mxrj/202203/t20220304_970658.shtml
[34] 中华人民共和国环境保护部. 淡水水生生物水质基准制定技术指南: HJ 831—2017[S]. 北京: 中国环境出版社, 2017
[35] Stephan C E, Mount D I, Hansen D J, et al. Guidelines for deriving numerical national water quality criteria for the protection of aquatic organisms and their uses [R]. Washington DC: United States Environmental Protection Agency, 1985
[36] Chen H Y, Jing L J, Teng Y G, et al. Characterization of antibiotics in a large-scale river system of China: Occurrence pattern, spatiotemporal distribution and environmental risks [J]. The Science of the Total Environment, 2018, 618: 409-418
[37] Spilsbury F D, St Warne M J, Backhaus T. Risk assessment of pesticide mixtures in Australian rivers discharging to the great barrier reef [J]. Environmental Science &Technology, 2020, 54(22): 14361-14371
[38] European Commission (EC). Technical guidance documents in support of the Commission Directive 93/67/EEC on risk assessment for new notified substances and the Commission Regulation (EC) 1488/94 on risk assessment for existing substances [R]. Ispra: European Chemical Bureau, 1996
[39] 吴雷明, 韩光明, 王守红, 等. 3种酰胺类稻田除草剂对克氏原螯虾的急性毒性[J]. 生物安全学报, 2019, 28(4): 301-305
Wu L M, Han G M, Wang S H, et al. Acute toxicity of three amide herbicides to Procambarus clarkii [J]. Journal of Biosafety, 2019, 28(4): 301-305 (in Chinese)
[40] 佘伟铎, 石运刚, 李洁, 等. 长江流域重庆段水体和沉积物中农药分布特征及风险评价[J]. 生态毒理学报, 2020, 15(2): 220-230
She W D, Shi Y G, Li J, et al. Distribution and risk assessment of pesticides in water and sediments in the Yangtze River of Chongqing section [J]. Asian Journal of Ecotoxicology, 2020, 15(2): 220-230 (in Chinese)
[41] Zheng S, Chen B, Qiu X Y, et al. Distribution and risk assessment of 82 pesticides in Jiulong River and estuary in South China [J]. Chemosphere, 2016, 144: 1177-1192
[42] 宋伟. 典型酰胺类除草剂在九龙江河口表层水中的存在状况及其非生物降解研究[D]. 厦门: 厦门大学, 2011: 7-8
Song W. Study on the existence and non-biological degradation of typical amide herbicides in surface water of Jiulong River Estuary [D]. Xiamen: Xiamen University, 2011: 7-8 (in Chinese)
[43] 陈晓, 钱宗耀, 朱赫特, 等. 望虞河西岸九里河中四种除草剂的污染现状[J]. 环境监控与预警, 2019, 11(6): 36-40, 46
Chen X, Qian Z Y, Zhu H T, et al. Contamination status of four herbicides in Jiuli River from the west bank of Wangyu River [J]. Environmental Monitoring and Forewarning, 2019, 11(6): 36-40, 46 (in Chinese)
[44] 冯玉洁. 主要甘蔗田除草剂对广西蔗区环境水体的影响[D]. 南宁: 广西大学, 2013: 43-47
Feng Y J. Effects of herbicides on the environmental water system in the sugarcane fields in Guangxi [D]. Nanning: Guangxi University, 2013: 43-47 (in Chinese)
[45] 卢昕妍, 王菲, 张丽敏, 等. 太湖西岸地表水中极性有机污染物非靶向筛查与生态风险评估[J]. 环境科学, 2021, 42(11): 5284-5293
Lu X Y, Wang F, Zhang L M, et al. Nontarget screening and ecological risk assessment of polar organic pollutants in surface water on the west bank of Taihu Lake [J]. Environmental Science, 2021, 42(11): 5284-5293 (in Chinese)
[46] Wang T L, Zhong M M, Lu M L, et al. Occurrence, spatiotemporal distribution, and risk assessment of current-use pesticides in surface water: A case study near Taihu Lake, China [J]. The Science of the Total Environment, 2021, 782: 146826
[47] Huang G Y, Liu Y S, Liang Y Q, et al. Multi-biomarker responses as indication of contaminant effects in Gambusia affinis from impacted rivers by municipal effluents [J]. The Science of the Total Environment, 2016, 563-564: 273-281
[48] Call D J, Geiger D L. Subchronic Toxicities of Industrial and Agricultural Chemicals to Fathead Minnows (Pimephales promelas) [M]. Wisconsin: Lake Superior Research Institute, 1992: 271-276
[49] 吴丰昌, 孟伟, 曹宇静, 等. 镉的淡水水生生物水质基准研究[J]. 环境科学研究, 2011, 24(2): 172-184
Wu F C, Meng W, Cao Y J, et al. Derivation of aquatic life water quality criteria for cadmium in freshwater in China [J]. Research of Environmental Sciences, 2011, 24(2): 172-184 (in Chinese)
[50] Australian and New Zealand Environment and Conservation Council, Agriculture and Resource Management Council of Australia and New Zealand (ANZECC and ARMCANZ). Australian and New Zealand guidelines for fresh and marine water quality: Volume 2 - Aquatic ecosystems - rationale and background information [R]. Canberra: Agriculture and Resource Management Council of Australia and New Zealand, 2000
[51] Gamain P, Gonzalez P, Cachot J, et al. Combined effects of temperature and copper and S-metolachlor on embryo-larval development of the Pacific oyster, Crassostrea gigas [J]. Marine Pollution Bulletin, 2017, 115(1-2): 201-210
[52] 张云鹏, 何林, 陈国庆, 等. 温湿度对3种酰胺类除草剂毒力的影响[J]. 西南师范大学学报(自然科学版), 2007, 32(1): 123-126
Zhang Y P, He L, Chen G Q, et al. Effects of temperature and humidity on the toxicity of 3 acyl amino herbicides [J]. Journal of Southwest China Normal University (Natural Science Edition), 2007, 32(1): 123-126 (in Chinese)
[53] 钱姣娟. 毒死蜱和乙草胺复合污染对热带爪蟾胚胎的致畸效应与分子机制初探[D]. 杭州: 浙江农林大学, 2015: 14-32
Qian J J. Teratogenic effects and mechanism of chlopyrifos and acetochlor combined exposure on embryos of Xenopus tropicalis [D]. Hangzhou: Zhejiang A &F University, 2015: 14-32 (in Chinese)
[54] 湛灵芝, 铁柏清, 曾桂华. Cd2+、乙草胺单一及其复合污染对少根紫萍生理生化特性的影响[J]. 安全与环境学报, 2013, 13(3): 9-13
Zhan L Z, Tie B Q, Zeng G H. Single and the synthetic effects of Cd2+ and the acetochlor on the physiological behaviors of Spirodela oligorrhiza [J]. Journal of Safety and Environment, 2013, 13(3): 9-13 (in Chinese)
[55] 曾兆华, 林涛, 林岭虹, 等. 丁草胺及其复配剂对水生生物的急性毒性与安全性评价[J]. 武夷科学, 2019, 35(2): 115-121
Zeng Z H, Lin T, Lin L H, et al. Acute toxicity and safety evaluation of butachlor and its compound agents on aquatic organisms [J]. Wuyi Science Journal, 2019, 35(2): 115-121 (in Chinese)
[56] Beggel S, Werner I, Connon R E, et al. Sublethal toxicity of commercial insecticide formulations and their active ingredients to larval fathead minnow (Pimephales promelas) [J]. The Science of the Total Environment, 2010, 408(16): 3169-3175
[57] Mesnage R, Defarge N, Spiroux de Vend mois J, et al. Major pesticides are more toxic to human cells than their declared active principles [J]. BioMed Research International, 2014, 2014: 179691
mois J, et al. Major pesticides are more toxic to human cells than their declared active principles [J]. BioMed Research International, 2014, 2014: 179691
[58] Pereira J L, Antunes S C, Castro B B, et al. Toxicity evaluation of three pesticides on non-target aquatic and soil organisms: Commercial formulation versus active ingredient [J]. Ecotoxicology, 2009, 18(4): 455-463