我国是畜禽养殖大国,2012—2021年我国肉猪年出栏量均保持在7亿头左右,年出栏量占世界出栏总量的50%左右[1]。生猪养殖产生的大量废水具有高氨氮、高磷酸盐等特点。据估计,2018年我国养猪场产生的废水总量就达到了1.6亿t左右[2],其中养猪粪水混合物中氨氮浓度高达800~2 200 mg·L-1,远超畜禽养殖行业排放标准中的80 mg·L-1[3]。畜禽养殖废水中氨氮和有机污染物的有效去除一直是难点问题[4]。
抗生素作为预防和治疗细菌感染的药物和饲料添加剂被广泛应用于畜禽养殖中[5-6],调查显示,2013年我国抗生素总使用量约为16.2万t,其中约52%用于动物[7]。多种抗生素残留于养殖粪污,养猪废水中检测到较高水平的磺胺类、大环内酯类、四环素类和喹诺酮类等常见抗生素[8-10]。在我国养猪废水传统处理系统中通常采用的是活性污泥法[11-12],然而,目前大部分污水处理厂所采用的生物法污水处理工艺并不能有效去除污水中的抗生素[13]。近年来抗生素对生物脱氮的影响已经引起了广泛关注[14]。已有研究发现磺胺嘧啶能抑制湿地底泥中氮转化微生物及相关氮转化过程,而且磺胺嘧啶的浓度与氨氧化抑制作用呈正相关[15],如Katipoglu-Yazan等[16]通过将50 mg·L-1磺胺甲恶唑添加进活性污泥系统中进行持续暴露,观察到氨氧化细菌活性显著降低,而37 d后氨氮降解率恢复至90%。50 mg·L-1四环素暴露下,可导致活性污泥中硝化细菌丰度下降和功能基因表达[17]。Xu等[18]向SBR反应器中加入50 mg·L-1红霉素,发现脱氮细菌活性和丰度降低,严重抑制其硝化功能。研究表明,100 mg·L-1泰乐菌素能够影响脱氮微生物群落结构,并导致N2O排放增加[19]。实验暴露浓度往往高达数十或数百mg·L-1,然而实际环境中抗生素浓度主要分布在40~4 000 μg·L-1之间[20],关于环境相关浓度水平下抗生素对实际养猪废水中硝化作用等脱氮过程影响机制仍不清楚。
硝化反应在废水生物脱氮中起着重要作用,是养猪废水中氮素去除的主要过程之一。硝化作用包括氨氧化作用![]() 和亚硝化作用
和亚硝化作用![]() 个过程[21-22],由氨氧化菌和亚硝酸盐氧化菌等共同完成,其中氨氧化菌主导的氨氧化作用被认为是硝化作用的限速步骤[23]大部分关于抗生素对养殖废水中氮去除影响的研究主要集中于对高浓度抗生素的影响,然而实际养猪废水中抗生素浓度远远达不到这么高的浓度。因此,本研究选取2种代表性抗生素(磺胺嘧啶和泰乐菌素),以采集的广州南沙某养猪废水中实测浓度为前提(磺胺嘧啶253 μg·L-1、泰乐菌素162 μg·L-1),设计抗生素实验浓度梯度为50、100、250、500和1 000 μg·L-1,对比研究不同浓度抗生素暴露对养猪废水硝化污泥体系中氨氧化和亚硝化反应的变化规律和功能菌群组成结构影响差异。本研究探究养猪废水硝化作用的差异性影响机制,以揭示抗生素对关键脱氮微生物的作用机制。
个过程[21-22],由氨氧化菌和亚硝酸盐氧化菌等共同完成,其中氨氧化菌主导的氨氧化作用被认为是硝化作用的限速步骤[23]大部分关于抗生素对养殖废水中氮去除影响的研究主要集中于对高浓度抗生素的影响,然而实际养猪废水中抗生素浓度远远达不到这么高的浓度。因此,本研究选取2种代表性抗生素(磺胺嘧啶和泰乐菌素),以采集的广州南沙某养猪废水中实测浓度为前提(磺胺嘧啶253 μg·L-1、泰乐菌素162 μg·L-1),设计抗生素实验浓度梯度为50、100、250、500和1 000 μg·L-1,对比研究不同浓度抗生素暴露对养猪废水硝化污泥体系中氨氧化和亚硝化反应的变化规律和功能菌群组成结构影响差异。本研究探究养猪废水硝化作用的差异性影响机制,以揭示抗生素对关键脱氮微生物的作用机制。
1 材料与方法(Materials and methods)
1.1 主要试剂
基于抗生素在养猪行业使用量和废水残留量等特征,本研究选取2种不同类型的抗生素进行试验,分别为磺胺类抗生素磺胺嘧啶(CAS#68-35-9; sulfadiazine, SDZ; C10H10N4O2S)、大环内酯类抗生素泰乐菌素(CAS# 1401-69-0; tylosin, TYL; C46H77NO17)。标准品均采购自中国上海源叶生物科技有限公司。甲醇、乙腈、甲酸、磷酸二氢钾和柠檬酸均采用高效液相色谱级,其他普通化学试剂等均为分析纯。
1.2 污泥采集及驯化
硝化污泥采自广州南沙某养猪场的曝气生化池。采用如图1(a)所示的间歇式活性污泥法反应器(sequential batch reactor, SBR)装置驯化硝化污泥。反应器直径120 mm,高450 mm,总有效体积为4 L,底部放置气石并连接气泵;进水由蠕动泵控制,出水由电磁阀控制,呈序批式运行,活性污泥悬浮固体浓度(MLSS)浓度为2 500 mg·L-1,单次循环水力停留时间(HRT)为510 min,总体上包括:进水(6 min)、静置(30 min)、曝气(450 min)、沉淀(30 min)、出水(6 min)、闲置(3 min)。污泥停留时间(SRT)为20 d,反应装置中pH始终维持在7.5~8.0之间,控制温度为27 ℃。进水采用模拟人工养猪废水,以葡萄糖和乙酸钠作为电子供体和碳源,以氯化铵作为电子受体和氮源,碳酸氢钠调节pH,通过加入硫酸锌、硫酸镁、氯化钴、氯化锰和硼酸等补充微生物所需的微量元素[24]。进水COD浓度和![]() 浓度等指标与污泥采样所处的养猪场废水中的指标基本一致,分别为1 500 mg·L-1和250 mg·L-1,每次循环进水量为2 L。试验前10天每天随机抽取一个运行周期测定其进水以及出水的
浓度等指标与污泥采样所处的养猪场废水中的指标基本一致,分别为1 500 mg·L-1和250 mg·L-1,每次循环进水量为2 L。试验前10天每天随机抽取一个运行周期测定其进水以及出水的![]() 浓度、亚硝态氮浓度,如图1(b)所示,当起始浓度为250 mg·L-1
浓度、亚硝态氮浓度,如图1(b)所示,当起始浓度为250 mg·L-1 ![]() 的进水,在每次循环后去除率稳定达到90%以上,并且没有亚硝态氮的累积,则表示硝化污泥驯化完成,可以用于后续的试验。
的进水,在每次循环后去除率稳定达到90%以上,并且没有亚硝态氮的累积,则表示硝化污泥驯化完成,可以用于后续的试验。
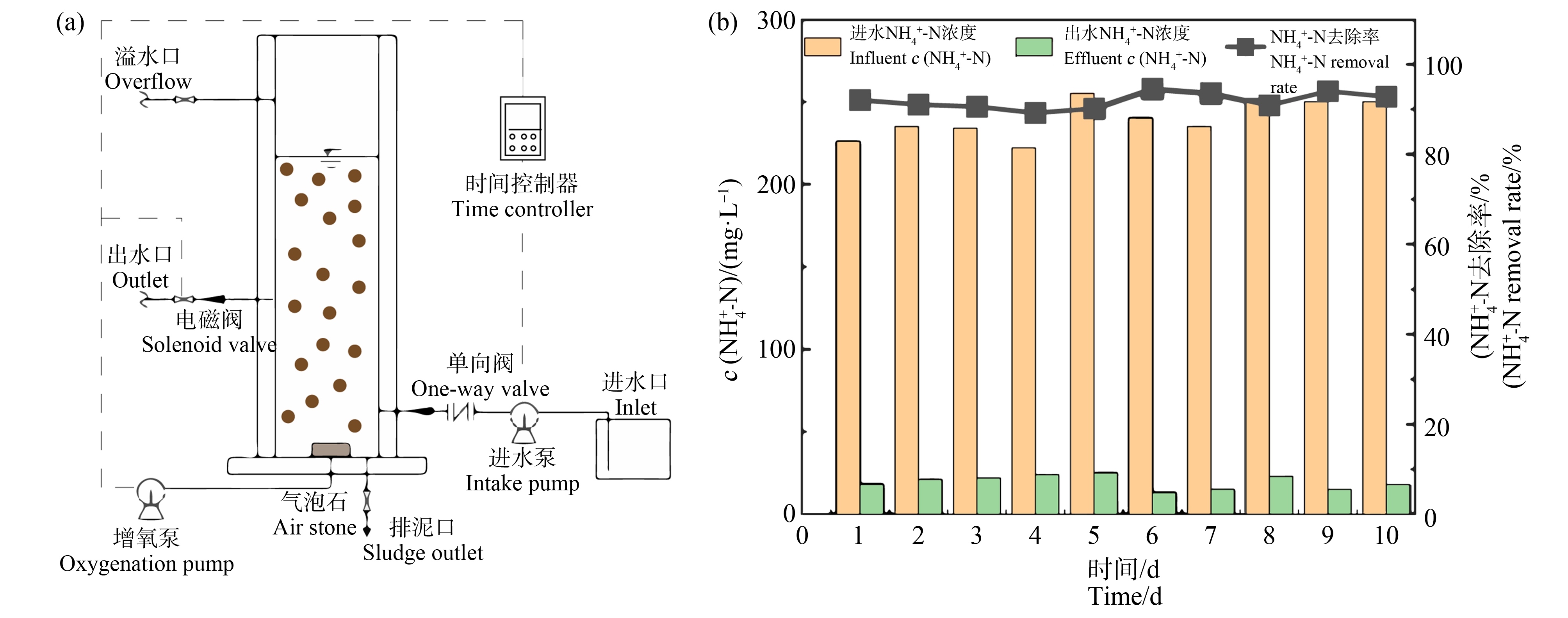
图1 间歇式活性污泥反应器示意图(a)与脱氮稳定性测试(b)
Fig. 1 Diagram of sequential batch reactor (a) and denitrification stability test (b)
1.3 抗生素暴露体系与样品采集
试验体系:所有试验均在1 000 mL的锥形瓶中进行,反应起始体系中![]() 浓度与原污泥驯化体系保持一致,为
浓度与原污泥驯化体系保持一致,为![]() 和
和![]() 的浓度为0。试验体系中SDZ和TYL均设置5个暴露水平(表1),分别为50、100、250、500和1 000 μg·L-1,另外设未添加任何抗生素的空白组。将活性污泥从SBR反应器中取出经过沉淀后,分装至11个50 mL离心管中,分别于1 000 r·min-1离心5 min,去上清后,加入去离子水至50 mL,重复操作3次。将处理过的污泥接种至试验体系中,MLSS与SBR反应器保持一致。为了保证试验过程中曝气量一致,采用相同功率的气泵和气石经行曝气,pH为7.5~8.0,温度为27 ℃。
的浓度为0。试验体系中SDZ和TYL均设置5个暴露水平(表1),分别为50、100、250、500和1 000 μg·L-1,另外设未添加任何抗生素的空白组。将活性污泥从SBR反应器中取出经过沉淀后,分装至11个50 mL离心管中,分别于1 000 r·min-1离心5 min,去上清后,加入去离子水至50 mL,重复操作3次。将处理过的污泥接种至试验体系中,MLSS与SBR反应器保持一致。为了保证试验过程中曝气量一致,采用相同功率的气泵和气石经行曝气,pH为7.5~8.0,温度为27 ℃。
表1 试验组编号及分析数据类型
Table 1 Test group number and conditions
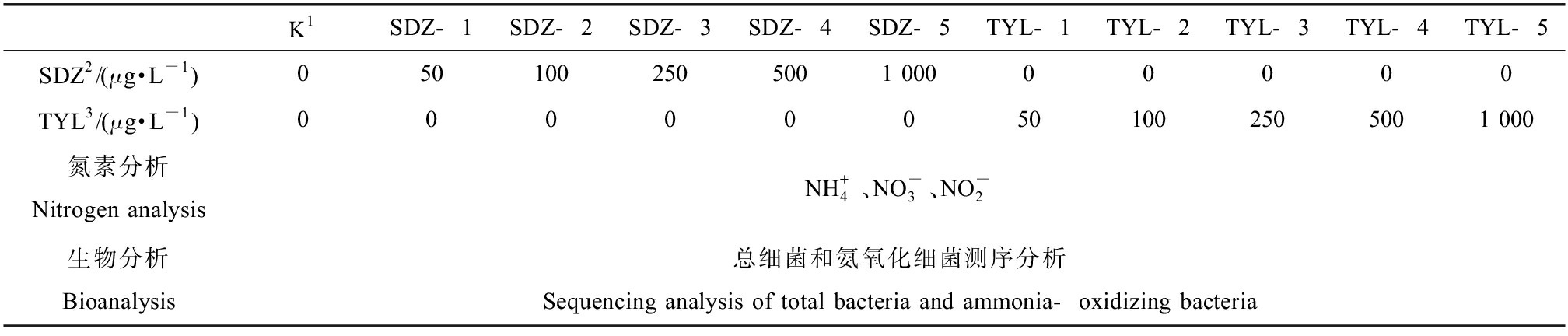
K1SDZ-1SDZ-2SDZ-3SDZ-4SDZ-5TYL-1TYL-2TYL-3TYL-4TYL-5SDZ2/(μg·L-1)0501002505001 00000000TYL3/(μg·L-1)000000501002505001 000氮素分析Nitrogen analysisNH+4、NO-3、NO-2生物分析Bioanalysis总细菌和氨氧化细菌测序分析Sequencing analysis of total bacteria and ammonia-oxidizing bacteria
注:1. 空白组;2. 磺胺嘧啶;3. 泰乐菌素。
Note: 1. Blank group; 2. Sulfadiazine; 3. Tylosin.
样品采集:分别在0、4、8、12、24、48和72 h取样检测![]() 及各抗生素浓度。从各试验组中取30 mL的泥水混合物于离心管中,在4 000 r·min-1离心5 min,取其上清液,用0.22 μm的聚四氟乙烯水相滤膜过滤后,用于分析抗生素
及各抗生素浓度。从各试验组中取30 mL的泥水混合物于离心管中,在4 000 r·min-1离心5 min,取其上清液,用0.22 μm的聚四氟乙烯水相滤膜过滤后,用于分析抗生素![]() 和
和![]() 将污泥样品分别置于4 ℃(用于理化分析)和-20 ℃(用于生物分析)的条件下保存。每个试验组在各时间点均采集3个平行样品用于理化分析与生物分析。
将污泥样品分别置于4 ℃(用于理化分析)和-20 ℃(用于生物分析)的条件下保存。每个试验组在各时间点均采集3个平行样品用于理化分析与生物分析。
1.4 样品分析
1.4.1 理化性质分析
抗生素采用超高效液相色谱(Agilent 1260,美国)测定。SDZ检测条件:色谱柱为Athena C18、120A色谱柱(4.6 mm×150 mm,5 μm,CNW Technologies GmbH,德国);柱温25 ℃;进样体积为100 μL;30%甲醇和70%的0.1%甲酸水溶液等度洗脱,DAD检测波长为280 nm,回收率为85.3%~94.2%,检出限为0.5~2.0 μg·L-1[25]。TYL检测条件:色谱柱为Athena C18、120A色谱柱(4.6 mm×150 mm,5 μm,CNW Technologies GmbH,德国);柱温35 ℃;进样体积为100 μL;65%甲醇和35%的0.05 mol·L-1磷酸二氢钾水溶液等度洗脱,DAD检测波长为285 nm,回收率为84.6%~96.2%,检出限为1.4~1.9 ![]() 和
和![]() 均采用HACH相应配套试剂盒和DR3900可见光分光光度计(HACH,美国)测定。悬浮固体浓度(MLSS)和挥发性悬浮固体浓度(MLVSS)用重量法测定[27]。
均采用HACH相应配套试剂盒和DR3900可见光分光光度计(HACH,美国)测定。悬浮固体浓度(MLSS)和挥发性悬浮固体浓度(MLVSS)用重量法测定[27]。
1.4.2 总细菌与氨氧化细菌测序分析
DNA提取和与高通量测序:污泥样品总DNA采用DNeasy® Power Soil® Pro Kit (QIAGEN,德国)抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度。分别使用引物515F/806R (5’-GTGYCAGCMGCCGCGGTAA-3’,5’-GGACTACNVGGGTWTCTAAT-3’)[28-29]、bamoA1F/bamoA2R (5’-GGGGTTTCTACTGGTGGT-3’,5’-CCCCTCKGSAAAGCCTTCTTC-3’) [30]对总细菌和氨氧化细菌的16S rRNA基因进行PCR扩增。PCR产物经切胶回收与纯化后,使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库,委托上海美吉生物医药科技有限公司利用Illumina Miseq PE300平台进行扩增子测序。
测序数据分析:利用QIIME2平台进行扩增子测序数据分析[31]。使用fastp[32](version 0.20.0)软件对原始测序序列进行质控,使用FLASH[2](version 1.2.7)软件进行拼接。使用DADA2序列降噪优化数据,获得ASV(Amplicon Sequence Variant)特征序列和丰度信息[33]。利用RDP classifier[34] (version 2.2)和Silva 16S rRNA数据库(version 138)对每条序列进行物种分类注释[35]。基于ASV代表序列及丰度信息,在美吉生物云平台(https://www.majorbio.com/)进行群落多样性、物种组成与差异、PCoA分析与相关性等统计与可视化分析。
2 结果与讨论(Results and discussion)
2.1 2种抗生素对硝化反应速率影响分析
使用采用超高效液相色谱分析0、4、8、12、24、48和72 h 7个取样时间点水样中SDZ和TYL含量,结果显示2种抗生素的高浓度试验组中抗生素含量维持在50%左右,而低浓度试验组在72 h时抗生素含量低于检出限。SDZ和TYL在暴露组分别于8 h和12 h对体系中的硝化反应速率产生显著性影响,而此时高浓度抗生素暴露组中抗生素残留量仍维持在90%左右。硝化作用包括氨氧化作用和硝化作用,分别由氨氧化菌将![]() 氧化成
氧化成![]() 再由亚硝酸盐氧化菌将
再由亚硝酸盐氧化菌将![]() 氧化成
氧化成![]() 由图1可知,在SBR反应器中,
由图1可知,在SBR反应器中,![]() 去除率始终保持在90%以上,表明经过驯化的活性污泥具有良好的脱氮性能。SDZ和TYL对硝化反应的影响如图2所示。由图2(a)可知,比较了不同浓度SDZ对活性污泥氨氧化作用产生的抑制作用,低浓度SDZ(SDZ_1,50 μg·L-1)几乎没有影响。随着SDZ浓度的上升,试验组中
去除率始终保持在90%以上,表明经过驯化的活性污泥具有良好的脱氮性能。SDZ和TYL对硝化反应的影响如图2所示。由图2(a)可知,比较了不同浓度SDZ对活性污泥氨氧化作用产生的抑制作用,低浓度SDZ(SDZ_1,50 μg·L-1)几乎没有影响。随着SDZ浓度的上升,试验组中![]() 去除率抑制程度越显著。SDZ_2、SDZ_3、SDZ_4、SDZ_5试验组的
去除率抑制程度越显著。SDZ_2、SDZ_3、SDZ_4、SDZ_5试验组的![]() 去除率同比空白对照组下降了(13±1.4)%、(27±1.9)%、(53±3.6)%和(72±2.2)%。赵美玲[36]研究磺胺甲噁唑对硝化反应的影响,也发现低浓度的磺胺甲噁唑对
去除率同比空白对照组下降了(13±1.4)%、(27±1.9)%、(53±3.6)%和(72±2.2)%。赵美玲[36]研究磺胺甲噁唑对硝化反应的影响,也发现低浓度的磺胺甲噁唑对![]() 去除率几乎没有影响。卿叶等[15]通过探讨SDZ对湿地系统中氮素转化的影响,发现SDZ对水体中
去除率几乎没有影响。卿叶等[15]通过探讨SDZ对湿地系统中氮素转化的影响,发现SDZ对水体中![]() 转化的抑制率高达53%,且SDZ浓度与氨氧化抑制作用呈正相关。不同浓度TYL对活性污泥氨氧化抑制作用如图2(d)所示,
转化的抑制率高达53%,且SDZ浓度与氨氧化抑制作用呈正相关。不同浓度TYL对活性污泥氨氧化抑制作用如图2(d)所示,![]() 去除率与TYL浓度呈负相关,TYL_1、TYL_2、TYL_3、TYL_4、TYL_5试验组的
去除率与TYL浓度呈负相关,TYL_1、TYL_2、TYL_3、TYL_4、TYL_5试验组的![]() 去除率分别下降了(5±0.4)%、(11±1.8)%、(27±0.5)%、(57±3.2)%和(65±1.4)%。相较而言,前8 h高浓度SDZ对污泥的氨氧化作用抑制程度更为显著,不过12 h以后,同等浓度(250、500和1 000 μg·L-1)的试验组中,TYL试验组对氨氧化作用抑制程度大于SDZ试验组,其原因可能是2种抗生素的抑菌机理不同,除此之外,2种抗生素在污泥上吸附后的生物可利用性差异也可能造成影响。SDZ通过与对氨基苯甲酸(PABA)竞争二氢叶酸合成酶,影响二氢叶酸的合成,从而使细菌生长和繁殖受到抑制;而TYL则是结合到细菌核糖体50S亚基上,阻断转肽作用及mRNA位移,选择性抑制蛋白质合成,并且这是不可逆的[37-39],这可能是造成随着反应进行TYL对氨氧化菌的抑制效果更大的原因。
去除率分别下降了(5±0.4)%、(11±1.8)%、(27±0.5)%、(57±3.2)%和(65±1.4)%。相较而言,前8 h高浓度SDZ对污泥的氨氧化作用抑制程度更为显著,不过12 h以后,同等浓度(250、500和1 000 μg·L-1)的试验组中,TYL试验组对氨氧化作用抑制程度大于SDZ试验组,其原因可能是2种抗生素的抑菌机理不同,除此之外,2种抗生素在污泥上吸附后的生物可利用性差异也可能造成影响。SDZ通过与对氨基苯甲酸(PABA)竞争二氢叶酸合成酶,影响二氢叶酸的合成,从而使细菌生长和繁殖受到抑制;而TYL则是结合到细菌核糖体50S亚基上,阻断转肽作用及mRNA位移,选择性抑制蛋白质合成,并且这是不可逆的[37-39],这可能是造成随着反应进行TYL对氨氧化菌的抑制效果更大的原因。

图2 各试验组中不同形态氮素的变化
注:SDZ试验组![]() 去除率
去除率![]() 浓度变化
浓度变化![]() 生成率(c);TYL试验组
生成率(c);TYL试验组![]() 去除率
去除率![]() 浓度变化
浓度变化![]() 生成率(f)。
生成率(f)。
Fig. 2 Changes in different forms of nitrogen in the experimental group
Note: ![]() removal rate (a),
removal rate (a), ![]() concentration change (b),
concentration change (b), ![]() generation rate (c) in SDZ test group;
generation rate (c) in SDZ test group; ![]() removal rate (d),
removal rate (d), ![]() concentration change (e) and
concentration change (e) and ![]() generation rate (f) in TYL test group.
generation rate (f) in TYL test group.
由硝化反应![]() 可知,亚硝酸盐浓度取决于
可知,亚硝酸盐浓度取决于![]() 的氧化和
的氧化和![]() 的氧化速率,即与
的氧化速率,即与![]() 的生成速率和降解速率有关。与空白组相比,SDZ各试验组的曲线最高点都出现了后移(图2(b)),与SDZ对
的生成速率和降解速率有关。与空白组相比,SDZ各试验组的曲线最高点都出现了后移(图2(b)),与SDZ对![]() 氧化的抑制过程相吻合,在试验所用浓度和反应条件下,对
氧化的抑制过程相吻合,在试验所用浓度和反应条件下,对![]() 氧化的抑制影响大于对
氧化的抑制影响大于对![]() 氧化的抑制影响。1 000 μg·L-1 SDZ极大限度地抑制了
氧化的抑制影响。1 000 μg·L-1 SDZ极大限度地抑制了![]() 氧化,导致
氧化,导致![]() 的积累(图2(c))。而1 000 μg·L-1 TYL对
的积累(图2(c))。而1 000 μg·L-1 TYL对![]() 氧化和
氧化和![]() 生成影响较小(图2(e)和图2(f))。
生成影响较小(图2(e)和图2(f))。
以上试验表明,低浓度的SDZ对硝化反应几乎没有影响,在较高浓度(100、250、500和1 000 μg·L-1)SDZ和TYL作用下,短时间内活性污泥的氨氧化作用受到抑制,且抑制程度与抗生素浓度呈正相关,1 000 μg·L-1 SDZ严重抑制![]() 氧化,且有
氧化,且有![]() 积累。而SDZ和TYL在8 h前后对氨氧化作用抑制程度不同的原因则可能与其属于2种不同种类(磺胺类和大环内酯类)抗生素的抑菌机理有关。
积累。而SDZ和TYL在8 h前后对氨氧化作用抑制程度不同的原因则可能与其属于2种不同种类(磺胺类和大环内酯类)抗生素的抑菌机理有关。
2.2 SDZ和TYL对系统微生物群落结构的影响
2.2.1 活性污泥群落多样性分析
空白对照组和抗生素处理组在ASV水平下进行PCoA分析(图3)。由图3(a)可知,对不同处理组中总细菌群落进行PCoA分析,2种抗生素分别作用下均能够影响微生物群落多样性,其中SDZ对微生物群落物种组成影响最大,与空白对照组相比呈现显著差异(ANOSIM,P<0.05),且TYL和SDZ 2种抗生素的作用时间越长,微生物群落物种组成差异性越大。从总细菌群落多样性Shannon指数箱线图(图3(c))也能看出SDZ试验组的微生物群落多样性更高(P<0.05)。氨氧化细菌群落PCoA分析也有类似的规律(图3(b)),反应初期,TYL对氨氧化细菌菌群的影响不显著,反应末期,有差异但也不明显,而SDZ对氨氧化细菌菌群的影响从反应初期就表现出群落特征差异显著(P<0.05),且暴露时间越长,差异性越大。将试验组按抗生素种类且相同浓度分组并进行ASV级PCoA分析(图3(d)~3(g)),不管是总细菌还是氨氧化细菌,不同浓度的2种抗生素,均对微生物群落多样性都有影响,且高浓度抗生素处理组对其影响相对较大,但是整体差异不显著,造成这种现象的原因很可能是抗生素浓度差值不够大。Guo等[40]的研究表明,在一个系统中,如果某一类菌种群落的丰富度过高,反而会降低系统中微生物群落多样性。本研究中,SDZ的作用显著改变了总细菌和氨氧化细菌群落结构,菌群多样性显著增加,微生物群落的改变使得试验末期SDZ对![]() 去除率的抑制弱于TYL。
去除率的抑制弱于TYL。
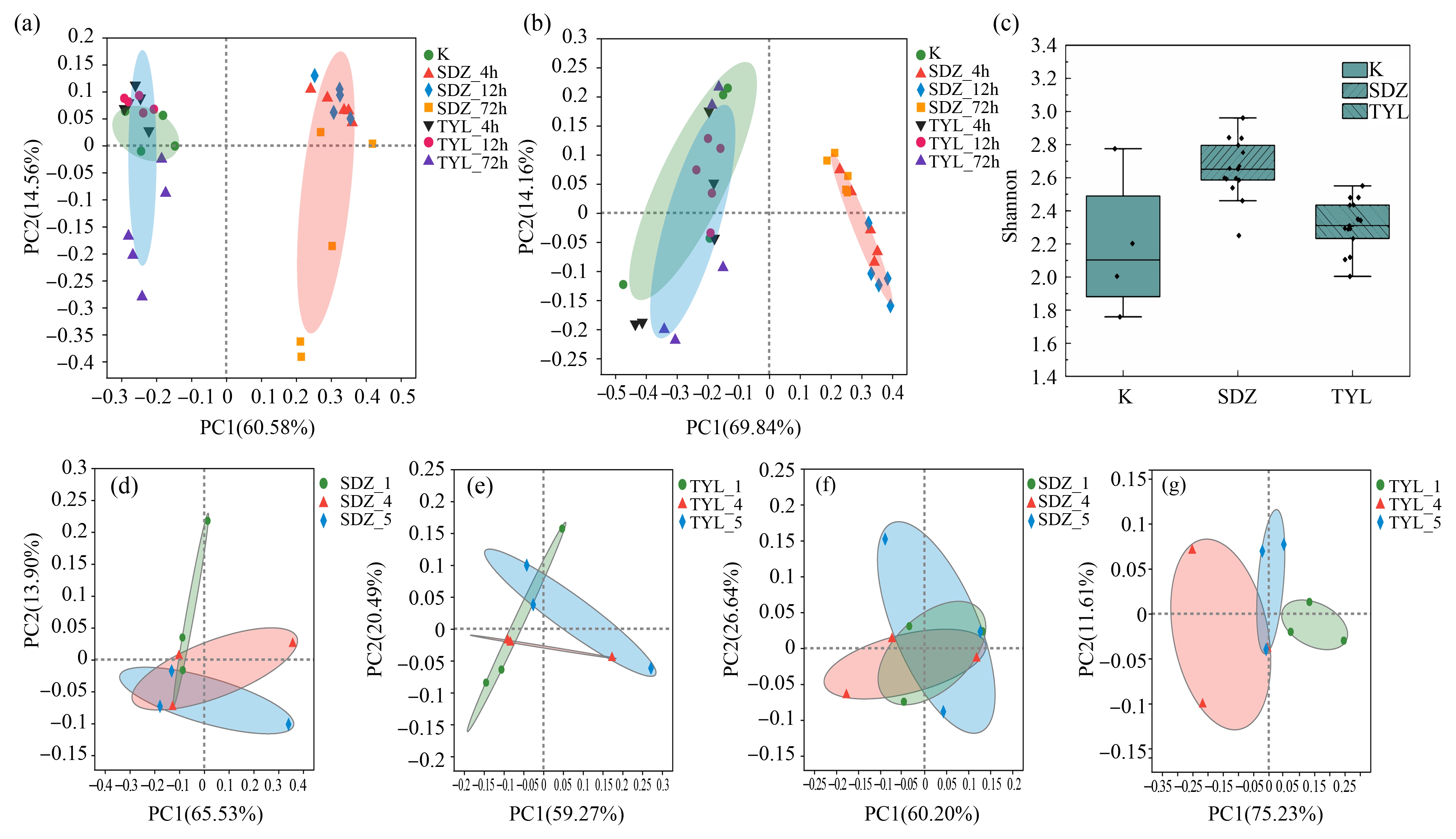
图3 ASV级PCoA分析及箱线图
注:(a)不同处理组总细菌PCoA分析,(b)不同处理组氨氧化细菌PCoA分析,(c)总细菌Shannon指数箱线图,(d)不同浓度SDZ作用下总细菌PCoA分析,(e)不同浓度TYL作用下总细菌PCoA分析,(f)不同浓度SDZ作用下氨氧化细菌PCoA分析,(g)不同浓度TYL作用下氨氧化细菌PCoA。
Fig. 3 PCoA analysis on ASV level and box diagram
Note: (a) PCoA analysis of total bacteria in different treatment groups, (b) PCoA analysis of ammonia oxidizing bacteria in different treatment groups, (c) Shannon index box graph of total bacteria, (d) PCoA analysis of total bacteria under the action of different concentrations of SDZ, (e) PCoA analysis of total bacteria under the action of different concentrations of TYL, (f) PCoA analysis of ammonia oxidizing bacteria under the action of different concentrations of SDZ, (g) PCoA analysis of ammonia oxidizing bacteria under the action of different concentrations of TYL.
2.2.2 微生物群落组成与物种差异分析
如图4(a)所示,反应体系中总细菌群落共涉及变形杆菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetota)、疣微菌门(Verrucomicrobiota)、放线菌门(Actinobacteriota)、黏菌门(Myxococcota)、酸杆菌门(Acidobacteriota)、螺旋体门(Spirochaetota)、WPS-2和Bdellovibrionnta共12个门,主要优势菌门(菌群丰度>1%)为Proteobacteria、Bacteroidota、Chloroflexi、Firmicutes、Planctomycetota、Verrucomicrobiota、Actinobacteriota和Myxococcota,其中Proteobacteria、Chloroflexi和Firmicutes在SDZ处理下逐渐减少,而Bacteroidota、Myxococcota却逐渐增加;Bacteroidota在TYL处理下逐渐减少,Proteobacteria逐渐增加。从总菌的属层面分析,SDZ极大程度地抑制了Proteobacteria中陶厄氏菌属(Thauera)硝化菌群,促进了亚硝化单胞菌属(Nitrosomonas)硝化菌群生长。由总细菌双向聚类热图(图4(a))可知,SDZ试验组不同时间段的微生物群落相较于空白对照组均差异显著,而随着抗生素暴露时间的增加,TYL试验组也表现出了显著的差异性,也印证了PCoA分析中,在环境相关浓度抗生素的作用下,作用时间的影响大于浓度的影响。如图4(b)所示,反应体系中氨氧化细菌在ASV水平下主要包括ASV1、ASV2、ASV3、ASV4、ASV5、ASV6、ASV7、ASV8、ASV9、ASV13、ASV18和ASV19,可明显看出SDZ对氨氧化细菌群落的影响更大,不仅抑制了ASV1、ASV3的生长,还促进了优势菌群ASV4、ASV5、ASV6和ASV9的生长。总细菌物种差异LEfSe分析如图5(a)所示,由图5可知,SDZ对微生物群落结构的影响大于TYL,与PCoA分析结果一致。对功能微生物群落LDA分析表明,控制组中的标志菌群主要为变形菌门、β-变形菌纲,TYL对功能微生物菌群影响较小,与控制组相比无显著性差异的物种,而SDZ在出现了5类显著差异物种(图5(b))(LDA score>4)。2种抗生素作用下,TYL富集的功能菌群主要包括变形菌门中几类氮素转化相关的菌群,如亚硝化单胞菌科(f_Nitrosomonadaceae)、亚硝化单胞菌目(o_Nitrosomonadales)、亚硝化单胞菌属(g_Nitrosomonas)和β-变形菌纲(c_Betaproteobacteria)(图5(c))(LDA score>4);而SDZ则富集了5类未知分类的菌群。以上结果表明,SDZ虽然抑制了变形菌门细菌中亚硝化单胞菌目(Nitrosomonadales)、亚硝化单胞菌科(Nitrosomonadaceae)和亚硝化单胞菌属(Nitrosomonas)等脱氮菌群,但显著促进了未知氨氧化功能菌群的生长。本试验末期发现SDZ对![]() 去除率的抑制弱于TYL,说明这些未知氨氧化菌群对SDZ对养猪废水处理中氨氧化作用的抑制产生显著影响。
去除率的抑制弱于TYL,说明这些未知氨氧化菌群对SDZ对养猪废水处理中氨氧化作用的抑制产生显著影响。
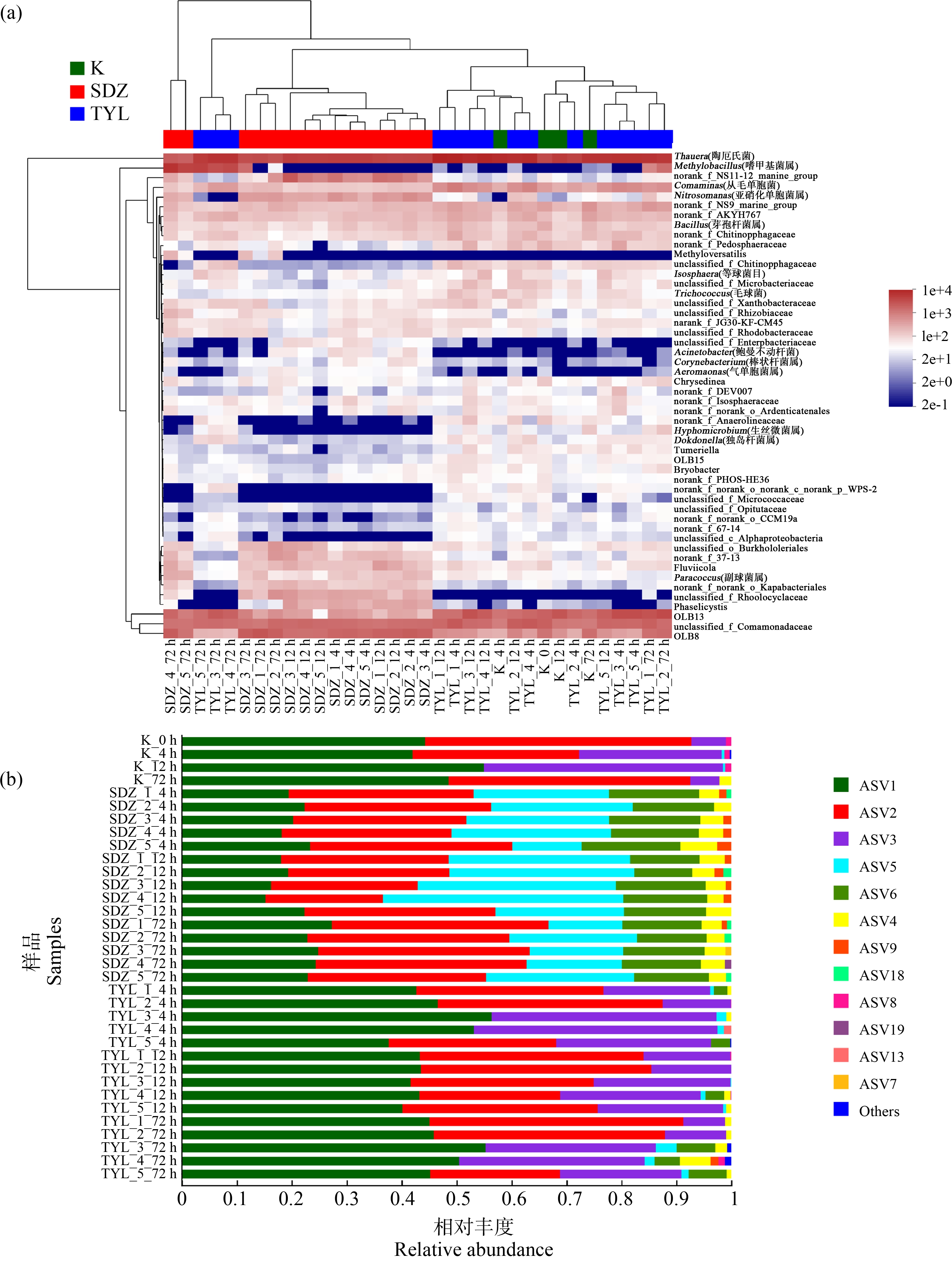
图4 群落组成分析
注:(a)总细菌双向聚类热图,(b)氨氧化细菌群落组成柱状图。
Fig. 4 Analysis of community composition
Note: (a) Two-way cluster thermogram of total bacteria, (b) Histogram of ammonia oxidizing bacteria community composition.

图5 2种抗生素作用下微生物群落差异分析
注:(a)总细菌物种差异LEfSe分析,(b) (c)功能菌群LDA判别柱状图。
Fig. 5 Analysis of microbial community differences under the action of two antibiotics
Note: (a) LEfSe analysis of total bacterial species difference, (b) (c) LDA discrimination histogram of functional flora.
综上,本研究表明:
(1)2种典型抗生素SDZ和TYL在环境相关浓度水平下均抑制了养猪废水处理中氨氧化作用,且抑制程度与抗生素暴露浓度呈正相关。短期暴露中,SDZ对氨氧化作用抑制程度高于TYL,高浓度SDZ试验组(1 000 μg·L-1)中氨氮去除率低至19%;而长期暴露中,TYL对氨氧化作用抑制程度高于SDZ。
(2)在环境相关浓度抗生素的作用下,微生物群落呈现不同程度的改变,抗生素作用时间的影响大于暴露浓度的影响。TYL对硝化功能菌群多样性和组成微生物菌群影响较小,而在SDZ作用下,微生物群落多样性显著增加,在暴露初期与实验过程中总细菌菌群和氨氧化菌群组成均表现出了显著的差异。
(3)在总细菌中,SDZ极大程度地抑制了变形杆菌门(Proteobacteria)陶厄氏菌属(Thauera)硝化菌群;在功能菌群层面,SDZ虽然抑制了亚硝化单胞菌目(Nitrosomonadales)、亚硝化单胞菌科(Nitrosomonadaceae)和亚硝化单胞菌属(Nitrosomonas)等硝化功能菌群,但富集了5类未知分类的氨氧化菌群。
[1] 中华人民共和国国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2021: 203-213
National Bureau of Statistics of the People’s Republic of China. China Statistical Yearbook [M]. Beijing: China Statistics Press, 2021: 203-213 (in Chinese)
[2] Liu S, Li J H, Xu S, et al. A modified method for enhancing adsorption capability of banana pseudostem biochar towards methylene blue at low temperature [J]. Bioresource Technology, 2019, 282: 48-55
[3] 国家环境保护总局. 畜禽养殖业污染物排放标准: GB 18596—2001[S]. 北京: 中国标准出版社, 2001:5-8
[4] 严祝东. 规模化畜禽养殖废水处理技术现状探析[J]. 中国畜牧业, 2022(16): 83-84
[5] Chen K, Zhou J L. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China [J]. Chemosphere, 2014, 95: 604-612
[6] Zhao X, Shen J P, Shu C L, et al. Attenuation of antibiotic resistance genes in livestock manure through vermicomposting via Protaetia brevitarsis and its fate in a soil-vegetable system [J]. The Science of the Total Environment, 2022, 807(Pt 1): 150781
[7] Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science &Technology, 2015, 49(11): 6772-6782
[8] Ma Z, Wu H H, Zhang K S, et al. Long-term low dissolved oxygen accelerates the removal of antibiotics and antibiotic resistance genes in swine wastewater treatment [J]. Chemical Engineering Journal, 2018, 334: 630-637
[9] Cheng D L, Hao Ngo H, Guo W S, et al. Contribution of antibiotics to the fate of antibiotic resistance genes in anaerobic treatment processes of swine wastewater: A review [J]. Bioresource Technology, 2020, 299: 122654
[10] Ben W W, Wang J, Pan X, et al. Dissemination of antibiotic resistance genes and their potential removal by on-farm treatment processes in nine swine feedlots in Shandong Province, China [J]. Chemosphere, 2017, 167: 262-268
[11] 王荣昌, 王超颖, 曾旭. 污水处理过程中抗生素抗性基因的检测及其水平转移机制的研究进展[J]. 环境化学, 2017, 36(12): 2567-2573
Wang R C, Wang C Y, Zeng X. Detection and horizontal transfer of antibiotic resistance genes during wastewater treatment processes [J]. Environmental Chemistry, 2017, 36(12): 2567-2573 (in Chinese)
[12] 施胜利, 侯勇, 王新锋. 我国畜禽养殖废水处理模式的研究进展[J]. 黑龙江畜牧兽医, 2021(21): 29-35
Shi S L, Hou Y, Wang X F. Research progress on treatment mode of livestock and poultry wastewater in China [J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(21): 29-35 (in Chinese)
[13] Watkinson A J, Murby E J, Kolpin D W, et al. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water [J]. The Science of the Total Environment, 2009, 407(8): 2711-2723
[14] Wang N, Gao J, Wang Q Y, et al. Antimicrobial peptide antibiotics inhibit aerobic denitrification via affecting electron transportation and remolding carbon metabolism [J]. Journal of Hazardous Materials, 2022, 431: 128616
[15] 卿叶, 李红芳, 张苗苗, 等. 养猪废水中磺胺嘧啶对湿地底泥中氮转化微生物及过程影响[J]. 环境科学研究, 2021, 34(9): 2191-2199
Qing Y, Li H F, Zhang M M, et al. Effects of sulfadiazine in swine wastewater on microorganisms and nitrogen transformation processes in wetland sediment [J]. Research of Environmental Sciences, 2021, 34(9): 2191-2199 (in Chinese)
[16] Katipoglu-Yazan T, Merlin C, Pons M N, et al. Chronic impact of sulfamethoxazole on the metabolic activity and composition of enriched nitrifying microbial culture [J]. Water Research, 2016, 100: 546-555
[17] Katipoglu-Yazan T, Merlin C, Pons M N, et al. Chronic impact of tetracycline on nitrification kinetics and the activity of enriched nitrifying microbial culture [J]. Water Research, 2015, 72: 227-238
[18] Xu H, Liu B H, Qi W Y, et al. Combined impact of TiO2 nanoparticles and antibiotics on the activity and bacterial community of partial nitrification system [J]. PLoS One, 2021, 16(11): e0259671
[19] Zhang K Y, Gu J, Wang X J, et al. Analysis for microbial denitrification and antibiotic resistance during anaerobic digestion of cattle manure containing antibiotic [J]. Bioresource Technology, 2019, 291: 121803
[20] Chen C, Li Y, Yin G Y, et al. Antibiotics sulfamethoxazole alter nitrous oxide production and pathways in estuarine sediments: Evidenced by the N15-O18 isotopes tracing [J]. Journal of Hazardous Materials, 2022, 437: 129281
[21] Jiang X M, Wang H, Wu P K, et al. Nitrification performance evaluation of activated sludge under high potassium ion stress during high-ammonia nitrogen organic wastewater treatment [J]. Journal of Environmental Sciences (China), 2022, 111: 84-92
[22] Holt J G, Krieg N R, Sneat P, et al. Bergey’s Manual of Determinative Bacteriology [M]. Baltimore: Williams and Wilkins, 1994: 8-15
[23] 张敏, 廖明军, 李大鹏, 等. 三种抗生素对池塘底泥氨氧化微生物生长及硝化作用的影响[J]. 渔业现代化, 2013, 40(3): 25-30, 36
Zhang M, Liao M J, Li D P, et al. Effects of three kinds of antibiotic on the nitrification and the growth of ammonia-oxidizing microorganism in freshwater aquaculture pond sediment [J]. Fishery Modernization, 2013, 40(3): 25-30, 36 (in Chinese)
[24] Tian Y J, Li J Z, Fan Y Y, et al. Performance and nitrogen removal mechanism in a novel aerobic-microaerobic combined process treating manure-free piggery wastewater [J]. Bioresource Technology, 2022, 345: 126494
[25] Christoforidou S, Karageorgou E, Ioannidou M, et al. Detection of antibacterial residues in milk by HPLC-DAD and microbial inhibitor tests [J]. Czech Journal of Food Sciences, 2020, 38(1): 63-71
[26] Wang K, Yu S P, Zhou J. HPLC-based quantitative detection of tylosin in soil [J]. IOP Conference Series Earth and Environmental Science, 2021, 657: 012035
[27] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 93-98
[28] Walters W, Hyde E R, Berg-Lyons D, et al. Improved bacterial 16S rRNA gene (V4 and V4-5) and fungal internal transcribed spacer marker gene primers for microbial community surveys [J]. mSystems, 2015, 1(1): e00009-e00015
[29] Sampson T R, Debelius J W, Thron T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease [J]. Cell, 2016, 167(6): 1469-1480.e12
[30] Mao Y J, Yannarell A C, Mackie R I. Changes in N-transforming archaea and bacteria in soil during the establishment of bioenergy crops [J]. PLoS One, 2011, 6(9): e24750
[31] Bolyen E, Rideout J R, Dillon M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2 [J]. Nature Biotechnology, 2019, 37(8): 852-857
[32] Chen S F, Zhou Y Q, Chen Y R, et al. Fastp: An ultra-fast all-in-one FASTQ preprocessor [J]. Bioinformatics, 2018, 34(17): i884-i890
[33] Callahan B J, McMurdie P J, Rosen M J, et al. DADA2: High-resolution sample inference from Illumina amplicon data [J]. Nature Methods, 2016, 13(7): 581-583
[34] Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy [J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267
[35] Fish J A, Chai B L, Wang Q, et al. FunGene: The functional gene pipeline and repository [J]. Frontiers in Microbiology, 2013, 4: 291
[36] 赵美玲. 磺胺甲恶唑对强化生物除磷系统的影响研究[D]. 天津: 天津大学, 2012: 3
[37] Fu L, Huang T, Wang S, et al. Toxicity of 13 different antibiotics towards freshwater green algae Pseudokirchneriella subcapitata and their modes of action [J]. Chemosphere, 2017, 168: 217-222
[38] Halling-Sørensen B. Inhibition of aerobic growth and nitrification of bacteria in sewage sludge by antibacterial agents [J]. Archives of Environmental Contamination and Toxicology, 2001, 40(4): 451-460
[39] 尹晖, 王亦琳, 叶妮, 等. UPLC-MS/MS法检测禽蛋中10种大环内酯类药物多残留的研究[J]. 中国兽医杂志, 2020, 56(8): 77-83
Yin H, Wang Y L, Ye N, et al. Determination of macrolides residue in poultry eggs by UPLC-MS/MS [J]. Chinese Journal of Veterinary Medicine, 2020, 56(8): 77-83 (in Chinese)
[40] Guo F, Zhang T. Profiling bulking and foaming bacteria in activated sludge by high throughput sequencing [J]. Water Research, 2012, 46(8): 2772-2782