近年来,抗生素等抗微生物药物滥用造成耐药微生物的环境污染问题严重危害着全球人类健康,由此引起的生态风险和公共健康问题逐渐引起各界的广泛关注[1]。世界卫生组织(WHO)将抗微生物药物抗性列为全球十大健康威胁之一[2]。抗生素等抗微生物药所施加的选择压力,增加了抗生素耐药菌株的发生率,导致大肠杆菌和肠球菌等获得抗性成为抗生素抗性细菌(ARB),并在水环境中的广泛分布[3-4]。研究发现,在污水处理系统中ARB的检出率超过70%,远高于海洋河流等其他水体[5]。污水处理厂作为抗生素进入水环境的重要门户,也是抗生素耐药性扩散的热点[6],不可避免地成为ARB的主要来源之一[7]。传统的污水处理厂能够高效去除有机物、氮、磷和重金属,但其对ARB去除效果有限[8]。为了更好地解决污水处理厂水体中抗性菌造成的环境问题,以太阳能作为能量来源的光催化技术近年成为抗性菌灭活研究领域的热点之一[9]。光催化法作为绿色高效的消毒灭菌技术,能够克服传统消毒方法产生消毒副产物、处理率低等局限性。然而,一些催化剂存在稳定性差、合成复杂,原料昂贵等问题[10-12]。因此,开发出具有高稳定性、高处理效率、低成本的光催化灭菌材料对有效控制抗性菌传播具有重要意义。
随着对光催化杀菌材料的研究逐渐深入,其种类也越来越丰富。金属光催化材料,如氧化锌[13]、氧化铁[14]等,虽具备光催化抗菌能力,但由于带隙值较大,以及缓慢释放出金属离子等缺陷限制了其实际应用。常见光催化材料TiO2具有稳定、无毒、价格低廉等优点,但其带隙较宽(~3.23 eV),只能被紫外光所激发,导致其对太阳光的利用效率很低,难以满足应用要求[15]。相比之下,类石墨相氮化碳(g-C3N4)因其稳定性强、非金属成分、良好的可见光响应性和可调节的电子结构,被广泛应用于污染物降解[16]和去除ARB[17]。然而,纯g-C3N4本身有比表面积小、可见光响应范围有限、电子-空穴复合速率快和光子量子效率低等缺点[18-20],极大地限制了g-C3N4的应用。目前,非金属元素掺杂已被证明能够有效提高g-C3N4对污染物的催化降解性能[21]。然而,有关非金属元素掺杂g-C3N4光催化材料在可见光下对抗性菌灭活效能和机理研究鲜见有报道。本文采用热聚合法制备硫掺杂g-C3N4,研究其对水环境中具有抗生素抗性的大肠杆菌的去除效果,并进一步探究其对菌形态和组成的影响及参与反应的活性物种关键作用,以期为未来光催化材料灭菌技术的发展提供借鉴。
以热聚合法制备硫掺杂g-C3N4(SCN)光催化剂,用三聚氰胺和硫脲分别作为合成前驱体与硫源。首先,称取5 g三聚氰胺分别与不同量的硫脲(1.0、1.5、2.0和2.5 g)于研钵中研磨、混匀后放入瓷坩埚,加盖置于马弗炉,升温程序设置为5 ℃·min-1至600 ℃,并保持4 h,等炉内温度降到室温时再取,将坩埚里的固体再次进行研磨,制得黄色粉末,即得到含硫质量分数为7.0%、9.7%、12.0%和14.0%的SCN。
采用扫描电子显微镜(SEM,S4800,日本Hitachi)观察催化剂的微观结构和表面形貌;采用X-射线光电子能谱仪(XPS,ESCALAB 250Xi,美国Thermo)检测材料的元素组成及化学形态。采用(UV-Vis DRS,Evolution 220,美国Thermo Fisher)测定样品光学吸收性能,其与光带隙能量(Eg)有关。通过以下公式可以计算半导体的带隙值[22]:
αhν=A(hν-Eg)n/2
(1)
式中:ν、h、α、Eg和A分别表示光频率(Hz)、普朗克常数(J·s)、吸收系数、样品能带值和比例常数;n的值由半导体跃迁特性(直接跃迁n=1,间接跃迁n=4)决定,g-C3N4的n值为1[23]。因此,纯g-C3N4和SCN的Eg值可以用(αhν)2与光子能量(hν)作图获得。将图象直线部分外推至横坐标轴,即y=0上,与横坐标的交点值即为Eg值。
具有氯霉素抗性基因的大肠杆菌菌株E. coli K-12 MG1655(由中国科学院微生物研究所提供)作为供试菌。无菌水将培养的E. coli K12稀释成108 CFU·L-1备用。在超净工作台下,分别称取10 mg 光催化材料置于20 mL E. coli K12菌液中,空白对照组未添加光催化材料。在无菌条件下,暗环境反应30 min,使菌落在光催化材料表面达到吸附-解吸平衡[24]。在氙灯光源(100~500 W)照射下,材料和抗性菌混合搅拌反应60 min,每15 min取一次样。利用平板菌落计数法确定残余活菌数量,计算光催化材料灭菌率。改变光催化材料投加量和光照强度,研究其对抗性菌灭活的影响。光催化材料投加量分别设置为2、5、10和20 mg。光照强度分别设置为100、300和500 W功率氙灯照射。
对光催化材料进行离心回收后用乙醇和去离子水清洗3次以上,置于烘箱中60 ℃烘干备用。重复4次光催化灭菌反应,测定SCN对抗性菌灭活率,评估材料的光催化灭菌性能稳定性。
利用不同淬灭剂选择性淬灭光催化SCN生成的活性氧簇(ROS)和光生电子及空穴。在暗反应30 min后,分别向反应体系中加入1 mmol·L-1的三乙醇胺(TEA)、1 mmol·L-1的异丙醇(IPA)、0.5 mmol·L-1的重铬酸钾(K2Cr2O7)、0.5 mmol·L-1的L-组氨酸(L-HIS)、1 mmol·L-1的丙酮酸钠(SP)和1 mmol·L-1的TEMPOL对空穴(h+)、羟基自由基(·OH)、光生电子(e-)、单线态氧(1O2)、过氧化氢(H2O2)和超氧自由基![]() 进行淬灭[25-26],测定经不同的淬灭反应后光催化SCN产生的活性物种对灭菌性能的影响,从而确定其对抗性菌灭活的关键活性物种。
进行淬灭[25-26],测定经不同的淬灭反应后光催化SCN产生的活性物种对灭菌性能的影响,从而确定其对抗性菌灭活的关键活性物种。
采用2.5%戊二醛对光催化SCN处理前后的大肠杆菌在室温下过夜固定后[27],进行制样、镀膜,利用场发射电子扫描显微镜(SEM,S4800,日本Hitachi)分析大肠杆菌的形态结构变化;经光催化SCN处理前后的大肠杆菌菌体细胞去除材料后,用PBS缓冲液清洗3次,获得的菌体细胞真空冷冻干燥处理后,采用溴化钾(KBr)压片法制备测定样品,利用傅里叶变换红外吸收光谱仪(FTIR,Nicolet iS50,美国Thermo)以扫描速率4 cm·min-1、扫描范围500~4 000 cm-1,分析菌体细胞表面官能团变化[28]。
SEM表征结果显示g-C3N4光催化剂具有比较清晰的层状构造和多孔结构(图1(a))。随着硫元素的掺杂,材料褶皱增多同时表面粗糙度也有所增加(图1(b))。有研究发现改性g-C3N4光催化材料的褶皱增加能够增强材料的孔隙结构和表面积[29],硫掺杂后g-C3N4的褶皱和粗糙度均有所提高,表明其可能具有更大的反应接触面积,有利于与抗性菌充分接触,增加灭活率。

图1 纯类石墨相氮化碳(g-C3N4)和硫掺杂氮化碳(SCN)的SEM图谱
注:(a) g-C3N4;(b) SCN。
Fig. 1 SEM images of pure graphitic carbon nitride (g-C3N4) and sulfur doped carbon nitride (SCN)
Note: (a) g-C3N4; (b) sulfur doped carbon nitride (SCN).
g-C3N4和12% SCN的XPS全谱扫描显示存在C、N和O 3种元素峰,S元素在12% SCN样品中的特征峰不显著(图2(a)),然而S 2p图谱中在165.9 eV处的存在S元素特征峰(图2(e)),该峰对应于SCN的C—S键,表明S元素成功被掺杂到g-C3N4晶格氮中[30]。Lin等[31]也报道了硫掺杂g-C3N4在晶格中掺杂的S离子很少(10% S掺杂的SCN中硫含量约3.5%)。S掺杂g-C3N4中硫含量较少可能是由于SCN在制备过程中经过高温煅烧导致硫损失。此外,2种材料的C 1s图谱显示,样品中出现了不同类型的C原子,284.7 eV和288.1 eV处出现的强峰(图2(b)),分别对应于石墨环境中的C原子[32](C—C键)和N环sp2杂化碳(N—C![]() N)[33]。N 1s的图谱表明氮原子以不同的状态存在,398.5、399.2、400.9和404.4 eV处的4个峰(图2(c)),分别对应于sp2杂化态氮(C
N)[33]。N 1s的图谱表明氮原子以不同的状态存在,398.5、399.2、400.9和404.4 eV处的4个峰(图2(c)),分别对应于sp2杂化态氮(C![]() N—C)、sp3杂化态氮(N—(C)3)[34]、氨基(C—N—H)[35]和杂环中的荷电效应[36]。g-C3N4和12% SCN的O 1s图谱表明,2种样品均只存在一种状态的氧原子530.2 eV(图2(d))对应于sp2杂化态氧(N—C—O),其中O可能会取代七嗪单元边缘的N[37]。上述结果表明,虽然硫掺杂到g-C3N4过程中存在损失,但仍有部分硫成功掺杂到g-C3N4中。
N—C)、sp3杂化态氮(N—(C)3)[34]、氨基(C—N—H)[35]和杂环中的荷电效应[36]。g-C3N4和12% SCN的O 1s图谱表明,2种样品均只存在一种状态的氧原子530.2 eV(图2(d))对应于sp2杂化态氧(N—C—O),其中O可能会取代七嗪单元边缘的N[37]。上述结果表明,虽然硫掺杂到g-C3N4过程中存在损失,但仍有部分硫成功掺杂到g-C3N4中。

图2 纯g-C3N4和12% SCN的XPS谱图
注:(a) 全谱图;(b) C 1s;(c) N 1s;(d) O 1s;(e) S 2p。
Fig. 2 XPS spectra of pure g-C3N4 and 12% SCN
Note: (a) Full spectrum; (b) C 1s; (c) N 1s; (d) O 1s; (e) S 2p.
UV-Vis DRS光吸收性能分析结果表明(图3(a)),g-C3N4的吸收边界为462 nm,对紫外和可见光都有响应。硫掺杂后g-C3N4吸收光谱发生了轻微移动,可能与其结构改变引起的量子尺寸效应有关[38-39];不同硫掺杂比例的SCN,在可见光区域吸收强度均有所提高。这一结果与Lin等[31]研究相一致,g-C3N4吸收边界由465 nm,变为15% SCN后的480 nm,拓宽的可见光吸收范围有助于激发SCN产生更多的光生载流子[30],使其光催化活性明显高于纯g-C3N4。利用g-C3N4和12% SCN的(αhν)2对hν作图,如图3(b)所示,12% SCN的带隙能比g-C3N4低0.04 eV。综上表明非金属硫掺杂能拓宽g-C3N4可见光利用范围并减少其带隙能量。

图3 纯g-C3N4和不同比例硫掺杂g-C3N4(SCN)光催化结果
注:(a) 纯g-C3N4和不同硫掺杂比例的SCN的UV-Vis谱图;(b) g-C3N4和12% SCN的禁带宽度图。
Fig. 3 Photocatalytic results of pure g-C3N4 and different ratios of sulfur-doped g-C3N4 (SCN)
Note: (a) UV-Vis patterns of pure g-C3N4 and SCN with different sulfur-doped proportions; (b) Band-gap widths of g-C3N4 and 12% SCN.
在纯g-C3N4和SCN初始浓度0.5 g·L-1时,其在光催化作用下对抗性菌的灭活率为73.70%(图4(a));不同比例硫掺杂的g-C3N4在相同的反应时间内展现出比g-C3N4更高的抗性菌灭活率,其中12.0% SCN在光催化作用下,对抗性菌的灭活率最高,在反应60 min时抗性菌灭活率达98.54%(图4(a))。可见,12% SCN具有最佳的抗菌性能,杀菌率是纯g-C3N4的1.33倍。经光催化材料在可见光下处理后的菌液菌落图中,能够比较直观地观察到12% SCN具有最佳的灭菌性能(图4(b))。主要原因是硫掺杂能够拓宽g-C3N4对可见光的吸收范围,其中12% SCN对可见光的吸收范围最大,因此,12% SCN具有最佳的可见光的吸收能力,能够进一步增强对抗性菌的去除效果。同时,SCN降低的带隙能有利于其在可见光区域内捕获更多的光子以产生e-和h+,从而增强材料的光催化灭菌性能[40]。此外,在暗反应过程中,总抗性菌比例变化可以忽略不计,说明光催化剂本身对抗生素抗性菌影响有限。这与Ouyang等[41]的研究结果一致,在黑暗对照(无光照射的催化剂(C60, C70)/C3N4)实验中未观察到明显的细菌失活。
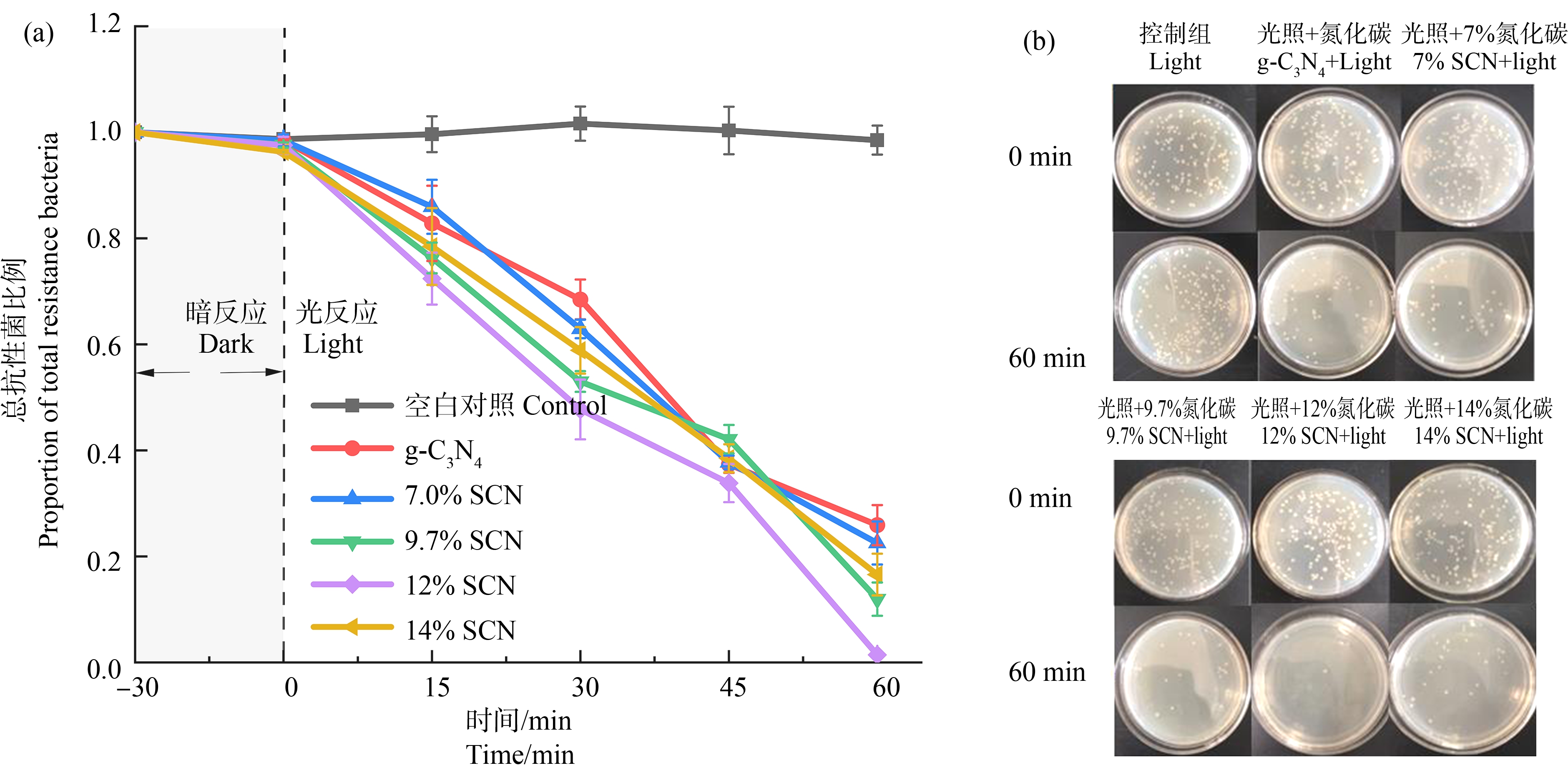
图4 光催化材料使抗性菌的失活效果
注:(a) 抗性菌的降解率曲线图;(b) 抗性菌液培养菌落变化图。
Fig. 4 Inactivation effect of photocatalytic materials against resistant bacteria
Note: (a) Degradation rate curve of drug-resistant bacteria; (b) Colony change of drug-resistant bacteria in liquid culture.
催化剂投加量和光照强度均会对抗性菌灭活效果产生影响。由图5(a)可知,当12% SCN投加量由2 mg增加到10 mg时,抗生素耐药菌的灭活率由51.50%增加到98.54%,当投加量继续增加至20 mg时,抗生素耐药菌灭活率降至91.29%。灭菌率随着催化剂投加量先增后降,主要归因于催化剂增加能为反应体系提供了更多的活性位点,并产生更多的活性物种(RS),有利于材料对细菌灭活。然而,当催化剂量过多时,会降低材料对光的利用率限制材料表面RS的产生[42],从而导致光催化材料灭活抗性菌的效率降低。
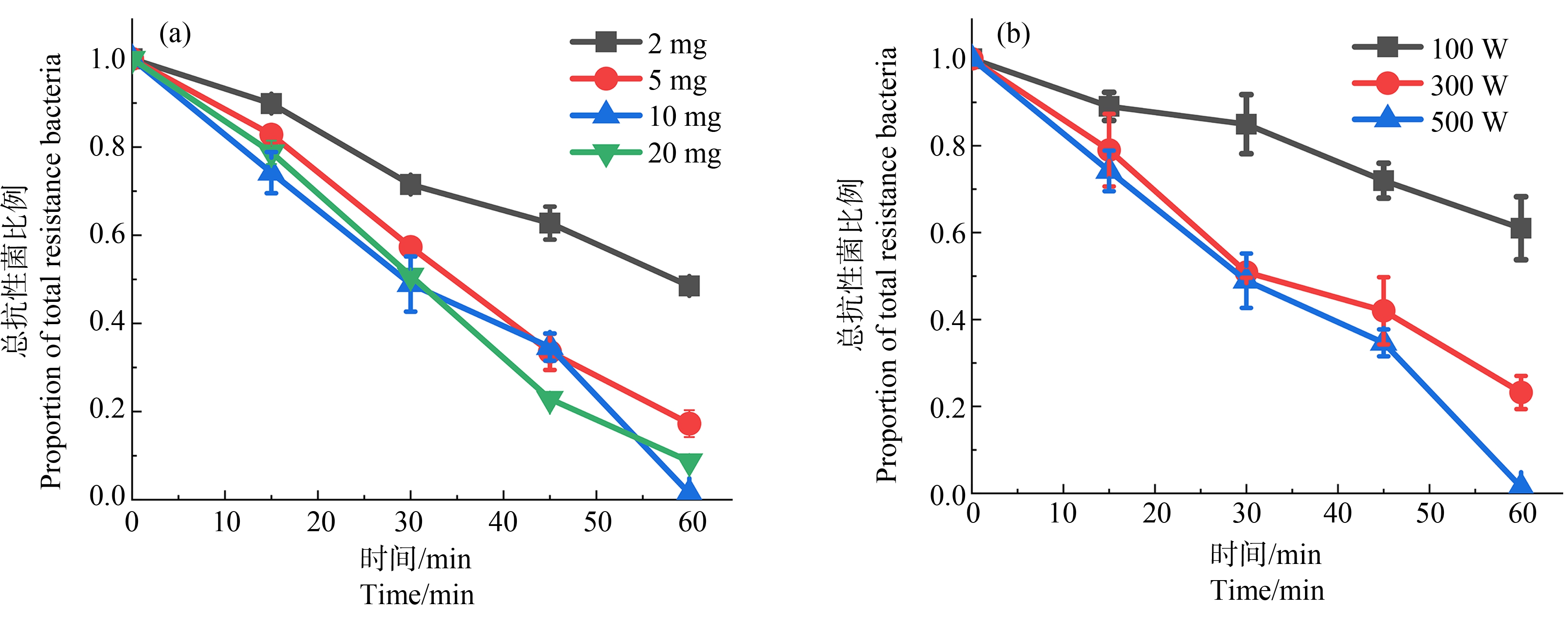
图5 影响SCN灭活抗性菌的因素分析(初始浓度108 CFU·mL-1;pH 7.2;温度37 ℃)
注:(a) 催化剂投加量对灭菌效果的影响;(b) 光照强度对灭菌效果的影响。
Fig. 5 Analysis of factors affecting SCN inactivation of drug-resistant bacteria (Initial concentration 108 CFU·mL-1; pH 7.2; temperature 37℃)
Note: (a) Effect of catalyst dosage on sterilization effect; (b) Effect of light intensity on sterilization effect.
光照强度对抗性菌灭活的影响由图5(b)所示,材料在光催化作用下对抗性菌的灭活率随着光照强度的增强而增加,其中500 W功率下对抗生素抗性菌的灭活率达到了98.54%,是100 W功率下灭活率的2.59倍。这一结果与齐菲等[17]的报道相同,g-C3N4在100、300和500 W汞灯光催化60 min时对多重耐药菌的灭活率依次升高。
对未处理抗性菌、光照处理抗性菌和光催化SCN灭活后的抗性菌形态变化表征结果显示,未经任何处理和仅光照处理的抗生素抗性菌表现出完整的正常的棒状样貌,并且细胞膜相对完整无破损(图6(a)和图6(b))。经过光催化SCN处理60 min之后,细胞膜表面出现了形状改变如体积缩小、向内凹陷(图6(b)中实线框部分),部分细胞出现较为明显的细胞膜破损(图6(b)虚线框部分),可能与SCN在光催化作用下产生RS攻击细菌从而引起细菌形态改变、代谢失常,最终导致细菌细胞死亡有关[43]。

图6 大肠杆菌的SEM图
注:(a) 未经任何处理;(b) 仅光照处理;(c) 光催化SCN处理。
Fig. 6 SEM images of E.coli
Note: (a) Without any treatment; (b) Light treatment only; (c) SCN photocatalytic treatment.
对比光催化SCN灭菌前后细菌细胞FTIR谱图,处理前的菌体细胞在位于2 924.49 cm-1和2 958 cm-1处出现吸收峰,主要由脂肪酸中CH2和CH3的不对称伸缩振动引起[44-45],同时菌体细胞在1 652.71 cm-1和1 545.37 cm-1处的峰值,分别归因于酰胺中蛋白质C![]() O的拉伸(酰胺Ⅰ)和N—H键的弯曲、C—N键的拉伸(酰胺Ⅱ)[46];处理后的细菌菌体在上述吸收峰的峰值均有所减弱,说明经光催化SCN作用处理后,细菌的蛋白结构发生变化。此外,处理前的细菌细胞在1 395.62 cm-1的吸收峰来自于脂肪酸和氨基酸的COO—对称拉伸振动,位于1 240.86 cm-1处的峰值代表核酸和磷脂的不对称拉伸;然而,经光催化SCN作用处理后的细菌上述2处峰值均发生偏移,说明光催化作用引起核酸发生改变(图7)。以上结果说明,光催化剂SCN灭活抗性菌过程中,主要作用于其细胞内的多糖、蛋白质以及脂质。
O的拉伸(酰胺Ⅰ)和N—H键的弯曲、C—N键的拉伸(酰胺Ⅱ)[46];处理后的细菌菌体在上述吸收峰的峰值均有所减弱,说明经光催化SCN作用处理后,细菌的蛋白结构发生变化。此外,处理前的细菌细胞在1 395.62 cm-1的吸收峰来自于脂肪酸和氨基酸的COO—对称拉伸振动,位于1 240.86 cm-1处的峰值代表核酸和磷脂的不对称拉伸;然而,经光催化SCN作用处理后的细菌上述2处峰值均发生偏移,说明光催化作用引起核酸发生改变(图7)。以上结果说明,光催化剂SCN灭活抗性菌过程中,主要作用于其细胞内的多糖、蛋白质以及脂质。
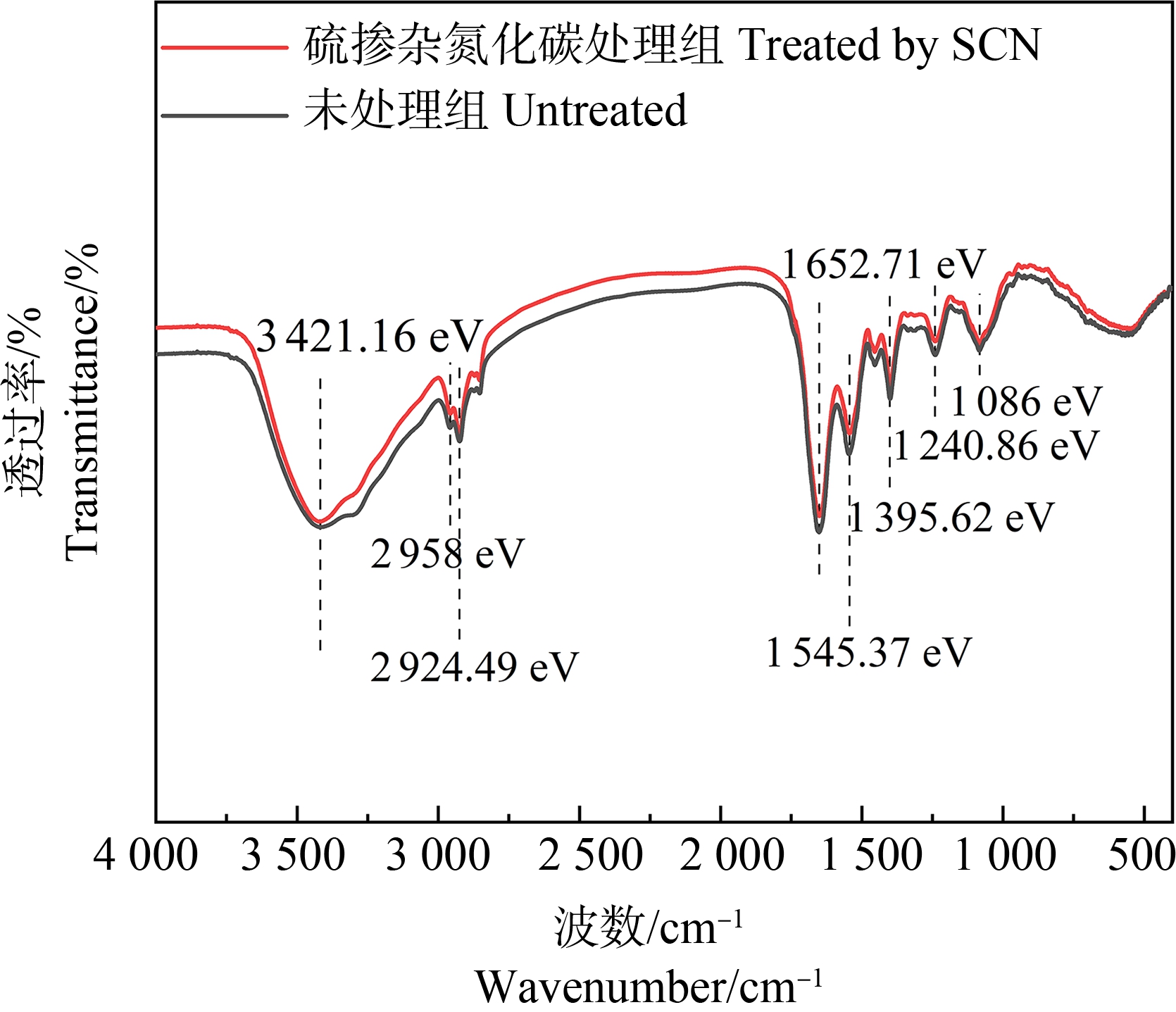
图7 未处理和经过SCN光催化处理后抗性菌的FTIR光谱
Fig. 7 FTIR spectra of drug-resistant bacteria in untreated and photocatalytic treatment with SCN
不同淬灭剂对光催化SCN灭菌率影响如图8所示。无淬灭剂体系内,60 min SCN抗性菌灭活率为98.54%。当体系中添加·OH与1O2淬灭剂之后,灭菌率和对照组相比无变化,表明这2种活性物种在光催化SCN灭菌过程中不发挥明显效用。同等条件下,体系添加H2O2和·O2淬灭剂后,灭活率为82.91%、90.06%,说明光催化SCN会通过产生H2O2和![]() 对抗性菌产生一定的灭活作用。在加入h+和e-淬灭剂后,对抗性菌的灭活率有明显的下降,且灭菌率分别降至73.54%、66.75%,表明这2种活性物种在光催化SCN灭菌时发挥重要作用。实验表明参与到光催化SCN灭菌的活性物种活跃顺序依次为:
对抗性菌产生一定的灭活作用。在加入h+和e-淬灭剂后,对抗性菌的灭活率有明显的下降,且灭菌率分别降至73.54%、66.75%,表明这2种活性物种在光催化SCN灭菌时发挥重要作用。实验表明参与到光催化SCN灭菌的活性物种活跃顺序依次为:![]() 可见,e-和h+在抗生素抗性菌灭活过程中具有关键作用。
可见,e-和h+在抗生素抗性菌灭活过程中具有关键作用。

图8 活性基团捕获剂对抗性菌灭菌性能的影响
Fig. 8 The effect of active group trapping agent on the sterilization performance of drug-resistant bacteria
光催化灭菌机理主要分为直接反应机理和间接反应机理[47]。直接反应机理是指细菌的有机组成成分直接与e-和h+反应,从而导致细胞凋亡。间接反应机理是指光照下产生的电子-空穴对与水或氧气形成ROS,ROS再与细菌的有机组成成分发生反应[48]。综合上述抗性菌形态和组成变化以及活性物种作用分析可知,SCN在可见光灭活抗生素抗性菌过程中受可见光激发产生电子跃迁,并在催化剂内部主要生成强氧化能力的e-和h+,直接对抗性菌的有机成分,如脂质、蛋白质和多糖产生损伤;其次,光催化SCN产生的H2O2和![]() 也会间接作用于细菌有机组分,破坏细菌细胞膜。
也会间接作用于细菌有机组分,破坏细菌细胞膜。
经过4个循环的光催化SCN灭活抗性菌反应,其对抗性菌的灭活率略有下降,但仍保持在90%左右(图9),可见SCN光催化材料在细菌灭活重复利用过程中具有良好的稳定性。催化剂的可循环利用性和稳定性是衡量其是否具有一定的科研价值和实际应用价值的重要指标[49]。在循环实验中,SCN展现出良好的可重复利用性,在光催化灭菌领域具有良好的应用前景。

图9 SCN灭活抗性菌的循环实验
Fig. 9 Circulation experiment of SCN inactivation of drug-resistant bacteria
本研究通过对硫掺杂改性g-C3N4光催化材料在水体中对抗生素抗性菌的灭活性能及机理分析,能为光催化材料去除水体中抗生素抗性菌提供了一种有效途径。在该领域上,继续全面评估g-C3N4及其改性光催化灭菌材料灭菌性能,不仅能为解决光催化材料在微生物处理方向上实际应用提供新的突破,而且有利于减轻水体中抗生素抗性菌的污染问题。
[1] Pruden A, Joakim Larsson D G, Amézquita A, et al. Management options for reducing the release of antibiotics and antibiotic resistance genes to the environment [J]. Environmental Health Perspectives, 2013, 121(8): 878-885
[2] World Health Organization. Ten threats to global health in 2019 [EB/OL]. [2022-04-21]. https://www.who.int/vietnam/news/feature-stories/detail/ten-threats-to-global-heal th-in-2019
[3] Sungpyo K, Aga Diana S. Potential ecological and human health impacts of antibiotics and antibiotic-resistant bacteria from wastewater treatment plants [J]. Journal of Toxicology and Environmental Health Part B, Critical Reviews, 2007, 10(8): 559-573
[4] Boczek L A, Rice E W, Johnston B, et al. Occurrence of antibiotic-resistant uropathogenic Escherichia coli clonal group A in wastewater effluents [J]. Applied and Environmental Microbiology, 2007, 73(13): 4180-4184
[5] Sanganyado E, Gwenzi W. Antibiotic resistance in drinking water systems: Occurrence, removal, and human health risks [J]. The Science of the Total Environment, 2019, 669: 785-797
[6] Biancullo F, Moreira N F, Ribeiro A R, et al. Heterogeneous photocatalysis using UVA-LEDs for the removal of antibiotics and antibiotic resistant bacteria from urban wastewater treatment plant effluents [J]. Chemical Engineering Journal, 2019, 367: 304-313
[7] Rizzo L, Manaia C, Merlin C, et al. Urban wastewater treatment plants as hotspots for antibiotic resistant bacteria and genes spread into the environment: A review [J]. The Science of the Total Environment, 2013, 447: 345-360
[8] Rodríguez-Chueca J, Varella Della Giustina S, Rocha J, et al. Assessment of full-scale tertiary wastewater treatment by UV-C based-AOPs: Removal or persistence of antibiotics and antibiotic resistance genes? [J]. The Science of the Total Environment, 2019, 652: 1051-1061
[9] Gu H Y, Xing G J, Gu H M, et al. A novel strategy to promote photo-oxidative and reductive abilities via the construction of a bipolar Bi2WO6/N-SrTiO3 material [J]. RSC Advances, 2017, 7(82): 52218-52226
[10] Zheng Y, Lin L H, Wang B, et al. Graphitic carbon nitride polymers toward sustainable photoredox catalysis [J]. Angewandte Chemie (International Ed in English), 2015, 54(44): 12868-12884
[11] Xu K, Li X L, Chen P Z, et al. Hydrogen dangling bonds induce ferromagnetism in two-dimensional metal-free graphitic-C3N4 nanosheets [J]. Chemical Science, 2015, 6(1): 283-287
[12] Ong W J, Tan L L, Ng Y H, et al. Graphitic carbon nitride (g-C3N4)-based photocatalysts for artificial photosynthesis and environmental remediation: Are we a step closer to achieving sustainability? [J]. Chemical Reviews, 2016, 116(12): 7159-7329
[13] Ko Y C, Fang H Y, Chen D H. Fabrication of Ag/ZnO/reduced graphene oxide nanocomposite for SERS detection and multiway killing of bacteria [J]. Journal of Alloys and Compounds, 2017, 695: 1145-1153
[14] Gao N, Chen Y J, Jiang J. Ag@Fe2O3-GO nanocomposites prepared by a phase transfer method with long-term antibacterial property [J]. ACS Applied Materials &Interfaces, 2013, 5(21): 11307-11314
[15] Zhou L, Zhang H Y, Sun H Q, et al. Recent advances in non-metal modification of graphitic carbon nitride for photocatalysis: A historic review [J]. Catalysis Science &Technology, 2016, 6(19): 7002-7023
[16] Zhao Z W, Sun Y J, Dong F. Graphitic carbon nitride based nanocomposites: A review [J]. Nanoscale, 2015, 7(1): 15-37
[17] 齐菲, 孙迎雪, 常学明, 等. 石墨相氮化碳光催化灭活水中多重耐药菌研究[J]. 中国环境科学, 2018, 38(10): 3767-3774
Qi F, Sun Y X, Chang X M, et al. Graphite carbon nitride (g-C3N4) photocatalytic disinfection on a multidrug resistant E. coli strain from secondary effluent [J]. China Environmental Science, 2018, 38(10): 3767-3774 (in Chinese)
[18] 刘润学. g-C3N4基复合材料制备及其催化性能研究[D]. 贵阳: 贵州大学, 2020: 8-10
Liu R X. Study on preparation and catalytic performance of g-C3N4 based composites [D]. Guiyang: Guizhou University, 2020: 8-10 (in Chinese)
[19] Li S N, Dong G H, Hailili R, et al. Effective photocatalytic H2O2 production under visible light irradiation at g-C3N4 modulated by carbon vacancies [J]. Applied Catalysis B: Environmental, 2016, 190: 26-35
[20] Dong G H, Yang L P, Wang F, et al. Removal of nitric oxide through visible light photocatalysis by g-C3N4 modified with perylene imides [J]. ACS Catalysis, 2016, 6(10): 6511-6519
[21] Wang M, Zeng Y B, Dong G H, et al. Br-doping of g-C3N4 towards enhanced photocatalytic performance in Cr(Ⅵ) reduction [J]. Chinese Journal of Catalysis, 2020, 41(10): 1498-1510
[22] Jiang D L, Chen L L, Zhu J J, et al. Novel p-n heterojunction photocatalyst constructed by porous graphite-like C3N4 and nanostructured BiOI: Facile synthesis and enhanced photocatalytic activity [J]. Dalton Transactions, 2013, 42(44): 15726-15734
[23] Dai K, Lu L H, Liang C H, et al. A high efficient graphitic-C3N4/BiOI/graphene oxide ternary nanocomposite heterostructured photocatalyst with graphene oxide as electron transport buffer material [J]. Dalton Transactions, 2015, 44(17): 7903-7910
[24] Cao Y, Xing Z P, Li Z Z, et al. Mesoporous black TiO2-x/Ag nanospheres coupled with g-C3N4 nanosheets as 3D/2D ternary heterojunctions visible light photocatalysts [J]. Journal of Hazardous Materials, 2018, 343: 181-190
[25] Ahmed Y, Lu J, Yuan Z G, et al. Efficient inactivation of antibiotic resistant bacteria and antibiotic resistance genes by photo-Fenton process under visible LED light and neutral pH [J]. Water Research, 2020, 179: 115878
[26] Zhang C, Li Y, Wang C, et al. Different inactivation behaviors and mechanisms of representative pathogens (Escherichia coli bacteria, human adenoviruses and Bacillus subtilis spores) in g-C3N4-based metal-free visible-light-enabled photocatalytic disinfection [J]. Science of the Total Environment, 2021, 755: 142588
[27] Li G Y, Liu X L, Zhang H M, et al. Comparative studies of photocatalytic and photoelectrocatalytic inactivation of E. coli in presence of halides [J]. Applied Catalysis B: Environmental, 2013, 140-141: 225-232
[28] Cakmak G, Togan I, ![]() C, et al. FT-IR spectroscopic analysis of rainbow trout liver exposed to nonylphenol [J]. Applied Spectroscopy, 2003, 57(7): 835-841
C, et al. FT-IR spectroscopic analysis of rainbow trout liver exposed to nonylphenol [J]. Applied Spectroscopy, 2003, 57(7): 835-841
[29] Li G Y, Nie X, Chen J Y, et al. Enhanced visible-light-driven photocatalytic inactivation of Escherichia coli using g-C3N4/TiO2 hybrid photocatalyst synthesized using a hydrothermal-calcination approach [J]. Water Research, 2015, 86: 17-24
[30] Wang J, Wang G H, Cheng B, et al. Sulfur-doped g-C3N4/TiO2 S-scheme heterojunction photocatalyst for Congo red photodegradation [J]. Chinese Journal of Catalysis, 2021, 42(1): 56-68
[31] Lin Y R, Dizon G V C, Yamada K, et al. Sulfur-doped g-C3N4 nanosheets for photocatalysis: Z-scheme water splitting and decreased biofouling [J]. Journal of Colloid and Interface Science, 2020, 567: 202-212
[32] Wang X Y, Liu M Y. Photocatalytic enhancement mechanism of direct Z-scheme heterojunction O-g-C3N4@Fe-TiO2 under visible-light irradiation [J]. Applied Surface Science, 2019, 485: 353-360
[33] Cao S W, Low J, Yu J G, et al. Polymeric photocatalysts based on graphitic carbon nitride [J]. Advanced Materials, 2015, 27(13): 2150-2176
[34] Oh W D, Lok L W, Veksha A, et al. Enhanced photocatalytic degradation of bisphenol A with Ag-decorated S-doped g-C3N4 under solar irradiation: Performance and mechanistic studies [J]. Chemical Engineering Journal, 2018, 333: 739-749
[35] Wang K, Li Q, Liu B S, et al. Sulfur-doped g-C3N4 with enhanced photocatalytic CO2-reduction performance [J]. Applied Catalysis B: Environmental, 2015, 176-177: 44-52
[36] Xu Q L, Zhu B C, Jiang C J, et al. Constructing 2D/2D Fe2O3/g-C3N4 direct Z-scheme photocatalysts with enhanced H2 generation performance [J]. Solar RRL, 2018, 2(3): 1800006
[37] Chu Y C, Lin T J, Lin Y R, et al. Influence of P, S, O-doping on g-C3N4 for hydrogel formation and photocatalysis: An experimental and theoretical study [J]. Carbon, 2020, 169(1): 338-348
[38] Liu G, Niu P, Sun C H, et al. Unique electronic structure induced high photoreactivity of sulfur-doped graphitic C3N4 [J]. Journal of the American Chemical Society, 2010, 132(33): 11642-11648
[39] Yang P J, Ou H H, Fang Y X, et al. A facile steam reforming strategy to delaminate layered carbon nitride semiconductors for photoredox catalysis [J]. Angewandte Chemie (International Ed in English), 2017, 56(14): 3992-3996
[40] Cui Y J, Zhang J S, Zhang G G, et al. Synthesis of bulk and nanoporous carbon nitride polymers from ammonium thiocyanate for photocatalytic hydrogen evolution [J]. Journal of Materials Chemistry, 2011, 21(34): 13032-13039
[41] Ouyang K, Dai K, Chen H, et al. Metal-free inactivation of E. coli O157: H7 by fullerene/C3N4 hybrid under visible light irradiation [J]. Ecotoxicology and Environmental Safety, 2017, 136: 40-45
[42] Chen G, Zhang X Y, Gao Y J, et al. Novel magnetic MnO2/MnFe2O4 nanocomposite as a heterogeneous catalyst for activation of peroxymonosulfate (PMS) toward oxidation of organic pollutants [J]. Separation and Purification Technology, 2019, 213: 456-464
[43] Liu W X, Zhang Y N, Zhang Y L, et al. Black phosphorus nanosheets counteract bacteria without causing antibiotic resistance [J]. Chemistry-A European Journal, 2020, 26(11): 2478-2485
[44] Naumann D, Helm D, Labischinski H. Microbiological characterizations by FT-IR spectroscopy [J]. Nature, 1991, 351(6321): 81-82
[45] Cakmak G, Togan I, Severcan F. 17Beta-estradiol induced compositional, structural and functional changes in rainbow trout liver, revealed by FT-IR spectroscopy: A comparative study with nonylphenol [J]. Aquatic Toxicology, 2006, 77(1): 53-63
[46] 林晓燕, 牟仁祥, 曹赵云, 等. 耐镉细菌菌株的分离及其吸附镉机理研究[J]. 农业环境科学学报, 2015, 34(9): 1700-1706
Lin X Y, Mou R X, Cao Z Y, et al. Isolation and cadmium adsorption mechanisms of cadmium-resistant bacteria strains [J]. Journal of Agro-Environment Science, 2015, 34(9): 1700-1706 (in Chinese)
[47] Yin Q Q, Tan L X, Lang Q Q, et al. Plasmonic molybdenum oxide nanosheets supported silver nanocubes for enhanced near-infrared antibacterial activity: Synergism of photothermal effect, silver release and photocatalytic reactions [J]. Applied Catalysis B: Environmental, 2018, 224: 671-680
[48] Fu F Y, Gu J Y, Cao J F, et al. Reduction of silver ions using an alkaline cellulose dope: Straightforward access to Ag/ZnO decorated cellulose nanocomposite film with enhanced antibacterial activities [J]. ACS Sustainable Chemistry &Engineering, 2017, 6(1): 738-748
[49] 吴春红, 方艳芬, 赵萍, 等. Ag-BiVO4复合光催化剂的制备及其可见光光催化机理的研究[J]. 分子催化, 2015, 29(4): 369-381
Wu C H, Fang Y F, Zhao P, et al. Preparation of Ag-BiVO4 composite and its photocatalytic oxidation mechanism [J]. Journal of Molecular Catalysis (China), 2015, 29(4): 369-381 (in Chinese)