新精神活性物质(new psychoactive substances, NPS)是指“未被联合国《麻醉品单一公约》《精神药物公约》所管制,但具有滥用潜力并可以引起公共健康风险的精神活性物质”。根据《2022年世界毒品报告》,在2009—2021年期间,134个国家向联合国毒品和犯罪问题办公室(United Nations Office on Drugs and Crime, UNODC)报告了1 127种NPS[1]。NPS作用于人体可产生兴奋、欣快和致幻等精神活性,滥用时极易过量造成中毒和死亡,全球因NPS死亡或犯罪的事件屡见不鲜。氯胺酮(ketamine, KET)就是其中一种典型的NPS。KET是苯环己哌啶(phencyclidine, PCP)衍生物,是非竞争性N-甲基-D-天门冬氨酸(N-methyl-D-aspartate, NMDA)受体拮抗剂。KET在1962年首次被美国化学家Calvin Stevens在实验室合成后,因其具有相当的麻醉效果和一定的止痛作用,广泛用于人类和兽医学的静脉麻醉剂[2]。同时,KET对中枢神经系统具有兴奋和抑制两方面作用,其中,对丘脑-新皮质系统有抑制作用,而对丘脑和边缘系统有兴奋作用[3-4]。重要的是KET还具有致幻作用,可以激动阿片受体,使用后可产生幻觉、视听分离感和欣快感而在全球被“娱乐性”滥用[5]。
由于个人滥用和医疗中作为麻醉剂的大量使用,而KET尚不能被人体完全代谢,KET会以母体化合物或代谢物的形式经由下水道进入污水处理厂[6]。目前大多数污水处理厂对KET去除率低于50%[7],水体中KET较难挥发、吸附、水解和生物降解,在自然水体中的自然衰减率非常低,导致在地表水中广泛检出[8-9]。KET在地表水和废水中的检出水平为ng·L-1~μg·L-1[8,10-12],例如中国台北河流中检出浓度高达420 ng·L-1,台北医院排放废水中浓度甚至达到了10 μg·L-1[8]。自然水体中精神活性物质的污染对水生生物的生态风险引起社会各界的广泛关注。重要的是,KET(951、9.5×104、9.5×105和9.5×106ng·L-1)暴露青鳉胚胎和幼鱼,导致胚胎心率降低,孵化延迟,心脏畸形率增加,青鳉鱼幼鱼运动的平均速度产生类似于斑马鱼和哺乳动物的“倒U”剂量反应,即低剂量引起多动和高剂量诱导较低的运动活力[13]。因此,低浓度KET对鱼类的影响不容忽视。
传统毒理学研究表明,高浓度KET暴露水生生物会导致神经毒性[10,13-14]、发育毒性[13,15-17]和生殖毒性[13,18]等。例如,KET对成年斑马鱼的行为具有抑制和兴奋2种效应:2×106ng·L-1KET增强了斑马鱼成鱼脑组织的细胞凋亡,影响与基底神经节受体结合,进而抑制运动行为;2×107ng·L-1KET持续暴露斑马鱼成鱼后,nr1a基因上调,机体通过代偿性上调NMDA受体表达,过度激活NMDA受体通道导致斑马鱼产生兴奋效应[14]。在NMDA受体表达(约24 hpf)前,KET(2×108、4×108和8×108ng·L-1)暴露斑马鱼胚胎20 min后,可通过沉默合子基因组导致畸形发育[15-16]。此外,KET(50~2.5×105ng·L-1)还可通过提高多巴胺和苯乙醇胺的含量从而增加秀丽隐杆线虫的摄食率和运动速度[10]。这表明KET也可能影响多巴胺以及其他神经通路导致神经毒性。多巴胺(dopamine, DA)和γ-氨基丁酸(GABA)都是在中枢神经表达的关键神经递质,参与中枢神经系统的信号转导、神经发育和运动调节等过程。然而目前关于环境浓度水平KET对水生生物影响的神经毒性数据非常有限,神经毒性效应的具体分子机制研究较少。为进一步阐明KET的毒性作用机制,本研究将采用行为学、生化指标以及基因相对表达量分析相结合的方法,探讨低浓度KET对斑马鱼幼鱼的毒性效应。
1 材料与方法(Materials and methods)
1.1 实验试剂和仪器
1.1.1 实验试剂
氯胺酮盐酸盐(分子式为C13H16ClNO·HCl,CAS号1867-66-9,纯度≥99.5%),购自上海原思标物科技有限公司。氯胺酮盐酸盐母液溶于无菌超纯水中,浓度为1 mg·mL-1,并保存于-20 ℃冰箱备用。
RNAiso Plus、HiScript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)反转录试剂和ChamQ Universal SYBR qPCR Master Mix荧光定量PCR试剂购买于南京诺唯赞生物科技股份有限公司,保存于-20 ℃冰箱。基因引物序列购自生工生物工程(上海)股份有限公司。
根据ISO 7346/3标准配制胚胎母液(294.0 mg·L-1CaCl2·2H2O,123.3 mg·L-1MgSO4·7H2O,63.0 mg·L-1NaHCO3,5.5 mg·L-1KCl),将母液按1∶4稀释得到胚胎培养液,pH 7.8±0.2,通气24 h以上,维持水温(27±1)℃。
1.1.2 主要仪器
实时荧光定量PCR仪(ABI,QuantStudioTM7 Flex System,美国),普通PCR仪(Bio-Rad公司,T100TMThermal Cycler,美国),实验室碎花冰制冰机(松下,SIM-F140AY65-PC,日本),低温离心机(贝克曼库尔特,Microfuge 20R,美国),体视普通生物显微镜(奥特光学,SZ780,中国),光学显微镜(尼康,Nikon Eclipse 50i,日本),斑马鱼行为分析系统(ViewPoint Life Sciences,Zebralab,法国),超高效液相色谱/三重四级杆串联质谱仪(Waters,XEVO TQ-S,美国)。
1.2 实验动物及分组
AB品系野生型成年斑马鱼(Danio rerio)来源于南京一树梨花生物科技有限公司。正式实验前,成年斑马鱼在流动式循环系统中至少培养2个月。饲养期间,每7天换一次水,维持水温(27±1)℃,水含氧量不低于80%,pH维持在7~8,饲养光暗周期为14 h∶10 h(光照∶黑暗),每天定时投喂丰年虾。暴露试验用的胚胎收集方法参照本课题组之前的研究[19]。按照已报道的KET相关环境浓度[8,10-12],设置暴露浓度10、100和1 000 ng·L-1。将正常发育的胚胎分成4组,包括对照组和3个不同浓度KET组,每组含4个平行,每个平行300颗胚胎(即n=4,共1 200颗胚胎),暴露试验在斑马鱼胚胎受精后2 hpf(hours post-fertilization)开始,在7 dpf(days post-fertilization)时结束。
1.3 化学分析
为测定暴露溶液中KET的实际平均浓度,在暴露第5天时对每个平行烧杯中的溶液进行化学分析。每24 h更换一次暴露液,在24 h(换水前)和0 h(换水后)2个时间点,从每个平行烧杯中分别收集500 mL暴露液,每个浓度4个生物平行,计算出每个平行中KET分别在这2个时间点的实际浓度,求出暴露周期内KET在每个烧杯中的平均浓度,以表示斑马鱼幼鱼的实际暴露浓度。
1.4 一般毒性试验
每组斑马鱼胚胎分别培养于盛有2 L新鲜胚胎培养液的烧杯中,在2 hpf时开始暴露,分别在12、24、48、60、72、84、96 hpf和7 dpf记录斑马鱼胚胎白卵数、幼鱼孵化数和死亡数,统计孵化率、24 hpf成活率和7 dpf死亡率。在7 dpf时,从每个平行中随机选取12条孵出的幼鱼(n=4,共48条幼鱼),用3%甲基纤维素固定,侧面向上在体视显微镜下录像30 s,统计心率(次·min-1)。
1.5 行为学分析
行为的连续出现与神经系统的发育紧密相连,为探究KET对斑马鱼神经系统发育的影响,从宏观上观察和分析斑马鱼胚胎和幼鱼的行为,主要包括自发摆尾运动、触碰反应、自由游泳运动和趋触性分析,测试时间统一在9:00—15:00间进行。
1.5.1 自发摆尾运动分析
在24 hpf,从每个平行烧杯中随机选取30颗胚胎(n=4,共120颗胚胎),放入装有相应浓度暴露液的24孔板的单个孔中,在体视显微镜下录像1 min,根据录像记录1 min内胚胎摆尾次数,统计自发摆尾频率(次·min-1)。
1.5.2 触碰反应分析
由于在24 hpf斑马鱼自发摆尾运动仍在进行,且此时不具备触碰逃逸反应能力,而27 hpf自发摆尾运动已结束且开始游泳(表现为触碰逃逸)、48 hpf具备受控的游泳行为能力[20-24],故选择在27 hpf和48 hpf进行触碰反应测试。在27 hpf和48 hpf,分别从每个平行烧杯中随机选取15颗(n=4,共60颗胚胎)正常发育的胚胎到24孔板的单个孔中,用0.1 g·mL-1链霉菌蛋白酶E溶液在室温下摇床轻摇30 min,以溶解卵膜,溶解后将幼鱼置于新鲜胚胎培养液中。测试时用解剖针尖轻轻触碰斑马鱼头部10次,每次触碰间隔10 s,同时在体视显微镜下录像,根据录像对每次触碰后斑马鱼的行为反应进行评分。根据斑马鱼发育时间及特点的不同,在27 hpf和48 hpf分别对触碰反应进行评分。在27 hpf,每次触碰斑马鱼头部时,表现为剧烈的游泳反应记为1分,游泳缓慢或异常反应记为0.5分,无反应记为0分,每条鱼在10次触碰结束后得分相加记为触碰得分,最大得分为10分[25]。在48 hpf,斑马鱼器官原基的形态发生基本完成,此时可表现出受控的游泳行为[20-21],斑马鱼对触碰反应的评分标准微调后如表1所示[26]。
表1 触碰反应评分标准
Table 1 Touch reaction scoring criteria

行为Behavior分数Score鱼不运动Fish do not move1鱼甩尾巴回应触碰但不游动Fish flick the tail in response to touch, but do not swim2鱼对触碰的反应较慢,游泳距离较短Fish slowly respond to touch, and swim a shorter distance3鱼对触碰的反应迅速,包括长时间游泳和迷失方向Fish rapidly respond to touch, including prolonged and disoriented swimming4鱼迅速游离触碰源,横跨孔板的单孔直径长度到孔的另一端Fish rapidly swim away from the source of the touch, and move across the length of the well5
1.5.3 游泳运动分析
在6 dpf晚上8点,从每个平行烧杯中随机选取12条幼鱼(n=4,共48条幼鱼)到盛有相应浓度溶液的24孔板中,每孔一条幼鱼,过夜适应孔板环境,于7 dpf早上9点开始进行游泳运动行为测试。斑马鱼幼鱼首先在ZebraLab系统中适应5 min的黑暗环境,之后在10 min光照和10 min黑暗条件下监测自由游泳运动行为。使用斑马鱼行为分析系统收集并记录每条幼鱼每分钟的运动数据(运动距离和运动持续时间),随后使用Excel软件进一步分析斑马鱼幼鱼自由游泳运动行为,包括总平均运动速度、黑暗条件下运动速度和光照条件下运动速度。
1.5.4 趋触性分析
在6 dpf晚上8点,从每个平行烧杯中随机选取12条幼鱼(n=4,共48条幼鱼)到盛有相应浓度溶液的24孔板中,每孔一条鱼,过夜适应孔板环境,于7 dpf早上9点开始进行趋触性行为测试。斑马鱼幼鱼首先在ZebraLab系统中适应5 min的黑暗环境,之后设置观察区域和检测程序,在10 min光照和10 min黑暗条件下采集20 min的幼鱼运动视频。使用斑马鱼行为分析系统收集并记录每条幼鱼每分钟的运动数据,包括总运动距离及运动持续时间、内圈运动距离及运动持续时间,随后使用Excel软件进一步分析斑马鱼幼鱼在外圈中的运动数据,包括外圈中运动总时间和距离,以及黑暗/光照条件下外圈中的运动时间和距离,其中以外圈累积时间百分比为指标表征幼鱼的趋触性[27]。
1.6 大脑细胞凋亡水平
在7 dpf时,使用浓度为5 μg·mL-1的吖啶橙溶液对斑马鱼幼鱼进行染色,分析幼鱼大脑细胞凋亡情况。从每个平行烧杯中随机选取5条幼鱼(n=4,共20条幼鱼)放入24孔板中,每孔含有吖啶橙染液的胚胎培养液,幼鱼在孔板中避光孵育40 min后用新鲜的胚胎培养液清洗5次。随后迅速使用正置荧光显微镜拍摄荧光图像,用Image J软件对幼鱼头部荧光强度进行量化分析。
1.7 幼鱼体内活性氧检测(reactive oxygen species, ROS)
在7 dpf时,使用浓度为20 μg·mL-1的2’,7’-二氯荧光素二乙酸酯(DCFH-DA)探针测量斑马鱼幼鱼体内ROS的产生情况。从每个平行烧杯中随机选取5条幼鱼(n=4,共20条幼鱼)放入含有DCFH-DA溶液的24孔板中,幼鱼在孔板中避光孵育40 min后用新鲜的胚胎培养液清洗5次。随后迅速使用正置荧光显微镜拍摄荧光图像,用Image J软件对幼鱼腹部荧光强度进行量化分析。
1.8 荧光定量PCR检测分析
在7 dpf,从每个平行烧杯中随机选取40条幼鱼(n=4,共160条幼鱼)到1.5 mL离心管中,加入1 mL RNA Later保存,使用Trizol法提取斑马鱼幼鱼总RNA,随后用微量核酸测定仪Nano-200分光光度计测定RNA样品的浓度及在260 nm与280 nm处的吸光值,OD260/OD280的比值都在1.8~2.1之间,说明RNA质量较好。根据HiScript®Ⅲ RT SuperMix for qPCR(+gDNA wiper)反转录试剂盒说明书步骤操作进行反转录合成cDNA,利用qRT-PCR方法检测差异表达基因,其反应体系和反应程序参照ChamQ Universal SYBR qPCR Master Mix荧光定量PCR试剂盒说明书,利用荧光定量PCR仪检测目的基因相对表达量,目的基因包括多巴胺通路中酪氨酸羟化酶基因th(tyrosine hydroxylase)、多巴脱羧酶基因ddc(dopa decarboxylase)、多巴胺受体基因drd1a(dopamine receptor D1a)、drd2a(dopamine receptor D2a)、drd2b(dopamine receptor D2b)、drd3(dopamine receptor D3)、drd4a(dopamine receptor D4a));γ-氨基丁酸通路中谷氨酸脱羧酶1a基因gad1a(glutamate decarboxylase 1a)、γ-氨基丁酸转运蛋白1基因slc6a1b(solute carrier family 6 member 1b)、γ-氨基丁酸转运蛋白2基因slc6a13(solute carrier family 6 member 13)、去甲肾上腺素转运蛋白基因slc6a2(solute carrier family 6 member 2)、多巴胺转运蛋白基因slc6a3(solute carrier family 6 member 3)、维持未成熟神经元中去极化的GABA活性的溶质载体家族12成员2蛋白基因slc12a2(solute carrier family 12 member 2)、超极化GABA能信号传导的溶质载体家族12成员5b蛋白基因slc12a5b(solute carrier family 12 member 5b)、钾内向整流通道亚家族J成员蛋白基因kcnj5、kcnj6、kcnj9、kcnj19b(potassium inwardly rectifying channel subfamily J member 5/6/9/19b)。除了参照本课题组已有引物,新基因引物均在生工生物工程(上海)股份有限公司设计和合成。通过Primer-BLAST(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)检测引物特异性。β-actin、rpl13α和ef1-α为本文的内参基因[19],采用2-ΔΔCt相对定量法计算各组目的基因的相对表达量。qPCR检测的基因名称、登录号、引物序列、扩增产物长度和扩增效率如表2所示。
表2 实时荧光定量PCR引物序列
Table 2 Sequences of primers used for qPCR
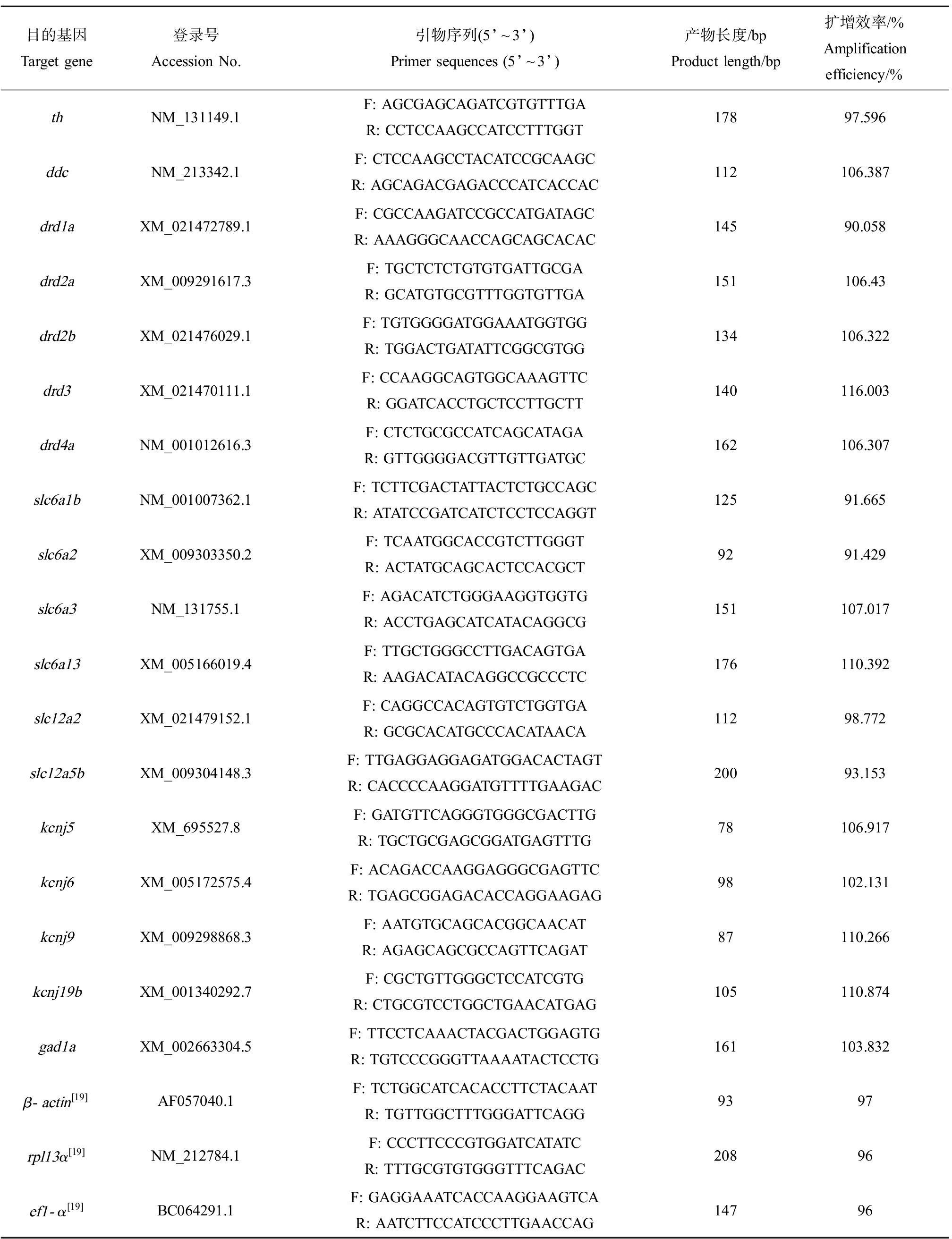
目的基因Target gene登录号Accession No.引物序列(5’~3’)Primer sequences (5’~3’)产物长度/bpProduct length/bp扩增效率/%Amplification efficiency/%thNM_131149.1F: AGCGAGCAGATCGTGTTTGAR: CCTCCAAGCCATCCTTTGGT17897.596ddcNM_213342.1F: CTCCAAGCCTACATCCGCAAGCR: AGCAGACGAGACCCATCACCAC112106.387drd1aXM_021472789.1F: CGCCAAGATCCGCCATGATAGCR: AAAGGGCAACCAGCAGCACAC14590.058drd2aXM_009291617.3F: TGCTCTCTGTGTGATTGCGAR: GCATGTGCGTTTGGTGTTGA151106.43drd2bXM_021476029.1F: TGTGGGGATGGAAATGGTGGR: TGGACTGATATTCGGCGTGG134106.322drd3XM_021470111.1F: CCAAGGCAGTGGCAAAGTTCR: GGATCACCTGCTCCTTGCTT140116.003drd4aNM_001012616.3F: CTCTGCGCCATCAGCATAGAR: GTTGGGGACGTTGTTGATGC162106.307slc6a1bNM_001007362.1F: TCTTCGACTATTACTCTGCCAGCR: ATATCCGATCATCTCCTCCAGGT12591.665slc6a2XM_009303350.2F: TCAATGGCACCGTCTTGGGTR: ACTATGCAGCACTCCACGCT9291.429slc6a3NM_131755.1 F: AGACATCTGGGAAGGTGGTGR: ACCTGAGCATCATACAGGCG151107.017slc6a13XM_005166019.4F: TTGCTGGGCCTTGACAGTGAR: AAGACATACAGGCCGCCCTC176110.392slc12a2XM_021479152.1F: CAGGCCACAGTGTCTGGTGAR: GCGCACATGCCCACATAACA11298.772slc12a5bXM_009304148.3F: TTGAGGAGGAGATGGACACTAGTR: CACCCCAAGGATGTTTTGAAGAC20093.153kcnj5XM_695527.8F: GATGTTCAGGGTGGGCGACTTGR: TGCTGCGAGCGGATGAGTTTG78106.917kcnj6XM_005172575.4 F: ACAGACCAAGGAGGGCGAGTTCR: TGAGCGGAGACACCAGGAAGAG98102.131kcnj9XM_009298868.3F: AATGTGCAGCACGGCAACATR: AGAGCAGCGCCAGTTCAGAT87110.266kcnj19bXM_001340292.7F: CGCTGTTGGGCTCCATCGTGR: CTGCGTCCTGGCTGAACATGAG105110.874gad1aXM_002663304.5F: TTCCTCAAACTACGACTGGAGTGR: TGTCCCGGGTTAAAATACTCCTG161103.832β-actin[19]AF057040.1F: TCTGGCATCACACCTTCTACAATR: TGTTGGCTTTGGGATTCAGG9397rpl13α[19]NM_212784.1F: CCCTTCCCGTGGATCATATCR: TTTGCGTGTGGGTTTCAGAC20896ef1-α[19]BC064291.1F: GAGGAAATCACCAAGGAAGTCAR: AATCTTCCATCCCTTGAACCAG14796
1.9 统计学分析
使用SPSS 25统计软件分析实验数据,Origin 2021软件进行绘图,实验数据均以平均值±标准差(Mean±SEM)表示。Kolmogorov-Simirnov和Levene’s检验用于对数据的正态分布和方差齐性的分析。单因素方差分析(One-way ANOVA)中的LSD多重比较用于分析暴露组与对照组之间的显著性差异,显著性水平表示为P<0.05、P<0.01和P<0.001。
2 结果(Results)
2.1 KET实际浓度测定
KET暴露第5天在T0和T24时间点所检测到的实际浓度如表3所示。结果显示T0和T24时刻检测的浓度和设计浓度比较接近,说明KET在暴露过程中整体较稳定。本文全篇使用KET的名义浓度。
表3 氯胺酮(KET)暴露斑马鱼胚胎/幼鱼实验中名义浓度和实测浓度
Table 3 Nominal and measured concentrations of ketamine(KET)in the zebrafish embryo/larvae exposure
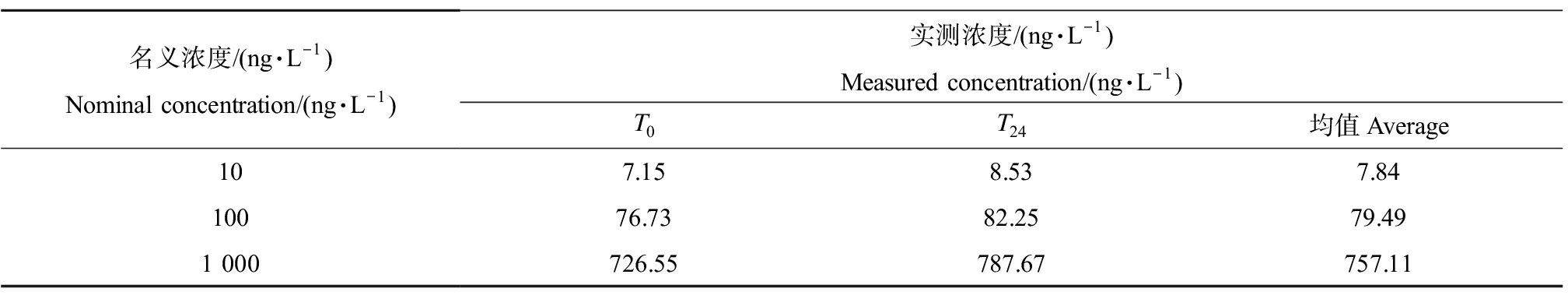
名义浓度/(ng·L-1)Nominal concentration/(ng·L-1)实测浓度/(ng·L-1)Measured concentration/(ng·L-1)T0T24均值Average107.158.537.8410076.7382.2579.491 000726.55787.67757.11
注:T0和T24表示暴露时间(0 h和24 h),实测浓度取平均值(n=4)。
Note: T0and T24represent exposure time(0 h and 24 h), and measured concentrations are given as mean(n=4 replicates).
2.2 一般毒性
将2 hpf的斑马鱼胚胎暴露于不同浓度的KET溶液中,统计各组胚胎在48、60、72、78、84和96 hpf的孵化率、24 hpf成活率、7 dpf死亡率和7 dpf心率。结果如图1所示,孵化率(F1=1.000, P1>0.05; F2=1.100, P2>0.05; F3=2.074, P3>0.05; F4=4.746, P4>0.05; F5=2.087, P5>0.05)、成活率(F=1.699, P>0.05)、死亡率(F=2.514, P>0.05)无显著的统计学差异。10 ng·L-1KET降低了7 dpf心率(F=1.416, P=0.034)。

图1 斑马鱼幼鱼孵化率(a)、成活率(b)、死亡率(c)和心率(d)
注:与对照组比较,*P<0.05。
Fig.1 Hatching rate(a), survival rate(b), mortality rate(c)and heart rate(d)of zebrafish larvae
Note: Compared with control group, *P<0.05.
2.3 KET对斑马鱼幼鱼行为的影响
2.3.1 KET暴露对胚胎自发摆尾运动的影响
不同浓度KET暴露组胚胎在24 hpf后的自发摆尾运动结果如图2所示。与对照组相比,100 ng·L-1和1 000 ng·L-1KET组胚胎自发摆尾次数显著增加(F=22.301, P<0.001)。这表明较高浓度KET暴露促进斑马鱼胚胎自发摆尾运动。
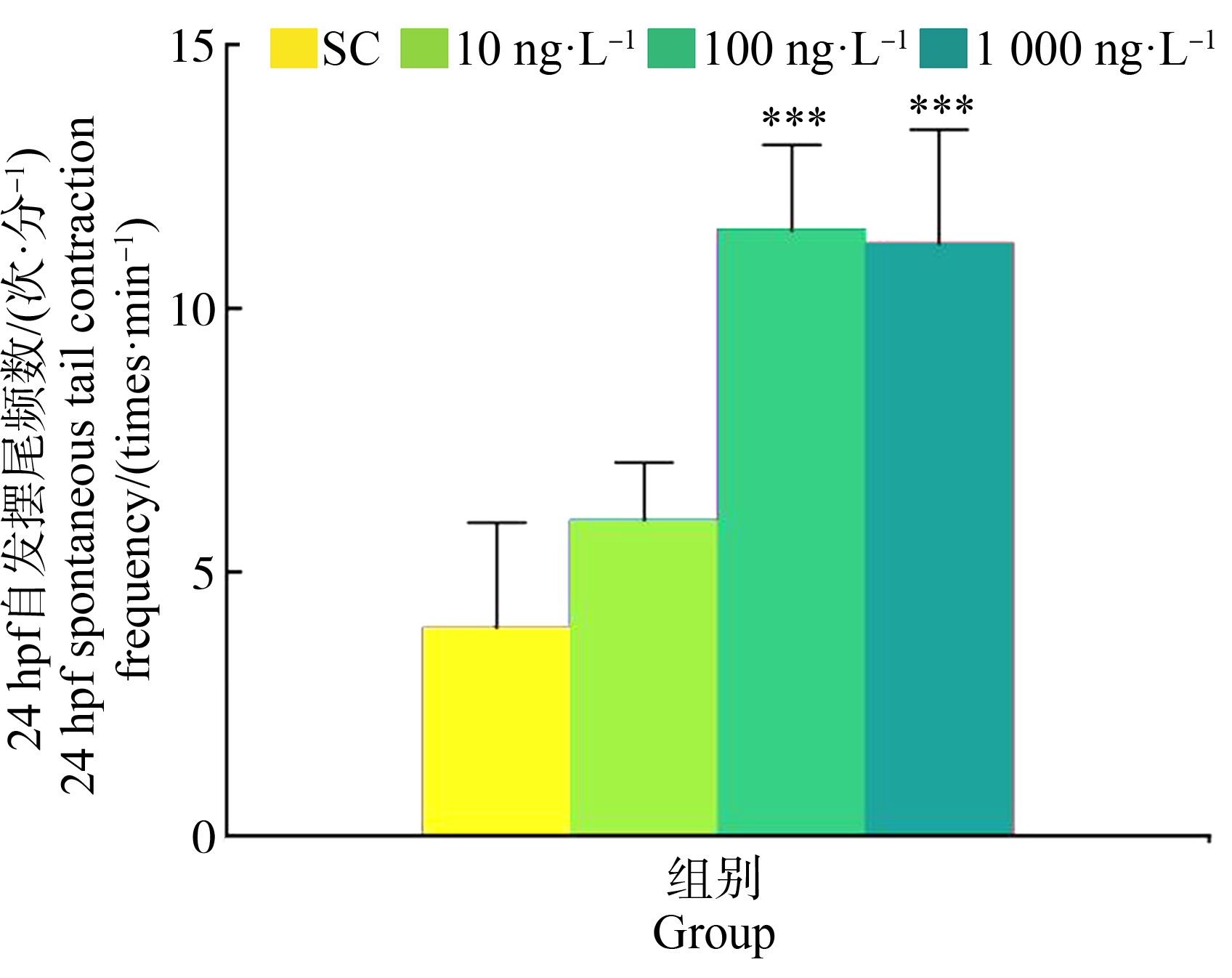
图2 斑马鱼胚胎24 hpf自发摆尾运动
注:与对照组比较,***P<0.001。
Fig.2 Spontaneous tail contraction of zebrafish embryos at 24 hpf
Note: Compared with control group, ***P<0.001.
2.3.2 KET暴露对幼鱼触碰反应的影响
不同浓度KET暴露组幼鱼分别在27 hpf和48 hpf进行触碰反应测试,结果如图3所示。与对照组相比,在27 hpf,1 000 ng·L-1KET组的斑马鱼幼鱼在触碰反应中得分增加,对触碰反应更敏感(F=8.990,P=0.005);而在48 hpf,1 000 ng·L-1KET组的斑马鱼幼鱼在触碰反应中得分降低,对触碰反应敏感程度降低(F=6.035, P=0.008)。随着暴露时间增加,KET暴露导致不同的触碰反应。
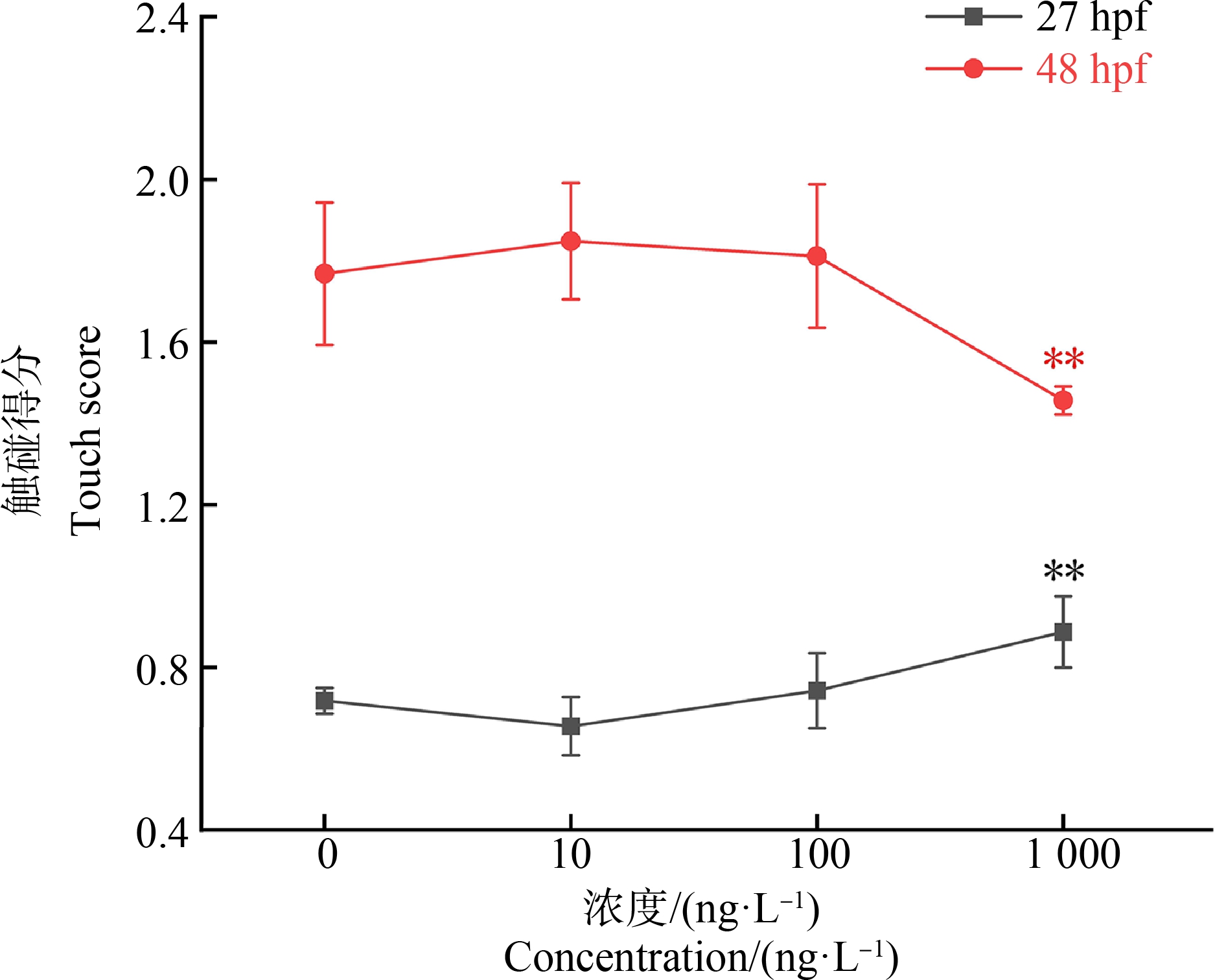
图3 斑马鱼幼鱼27 hpf和48 hpf触碰反应结果
注:与对照组比较,**P<0.01。
Fig.3 Results of contact reaction at 27 hpf and 48 hpf in zebrafish larvae
Note: Compared with control group, **P<0.01.
2.3.3 KET暴露对幼鱼自由游泳运动的影响
不同浓度KET暴露组幼鱼在7 dpf进行光暗条件刺激下的游泳运动测试和趋触性分析,结果如图4所示。与对照组相比,不同浓度暴露组幼鱼游泳速度无显著的统计学差异(P>0.05)。但是,与对照组相比,在黑暗条件下,10 ng·L-1KET组幼鱼在外圈停留时间百分比降低(F=2.436, P=0.015),同时幼鱼在外圈停留距离百分比也有降低的趋势,提示10 ng·L-1KET降低幼鱼在由强光刺激状态进入黑暗状态时的焦虑程度。

图4 光暗条件刺激下斑马鱼幼鱼游泳速度变化(a)和趋触性分析(b)和(c)
注:与对照组比较,*P<0.05。
Fig.4 Changes of swimming speed(a)and thigmotactic analysis(b),(c)of zebrafish larvae under light and dark conditions
Note: Compared with control group, *P<0.05.
2.4 KET对斑马鱼幼鱼大脑细胞凋亡的影响
白色虚线框内为各个组别中斑马鱼大脑细胞凋亡统计范围。斑马鱼幼鱼暴露于不同浓度的KET后,在7 dpf统计大脑细胞凋亡的荧光信号强度,结果如图5所示。与对照组相比,KET暴露均增加了大脑细胞凋亡水平,但是却无显著的统计学差异(P>0.05)。
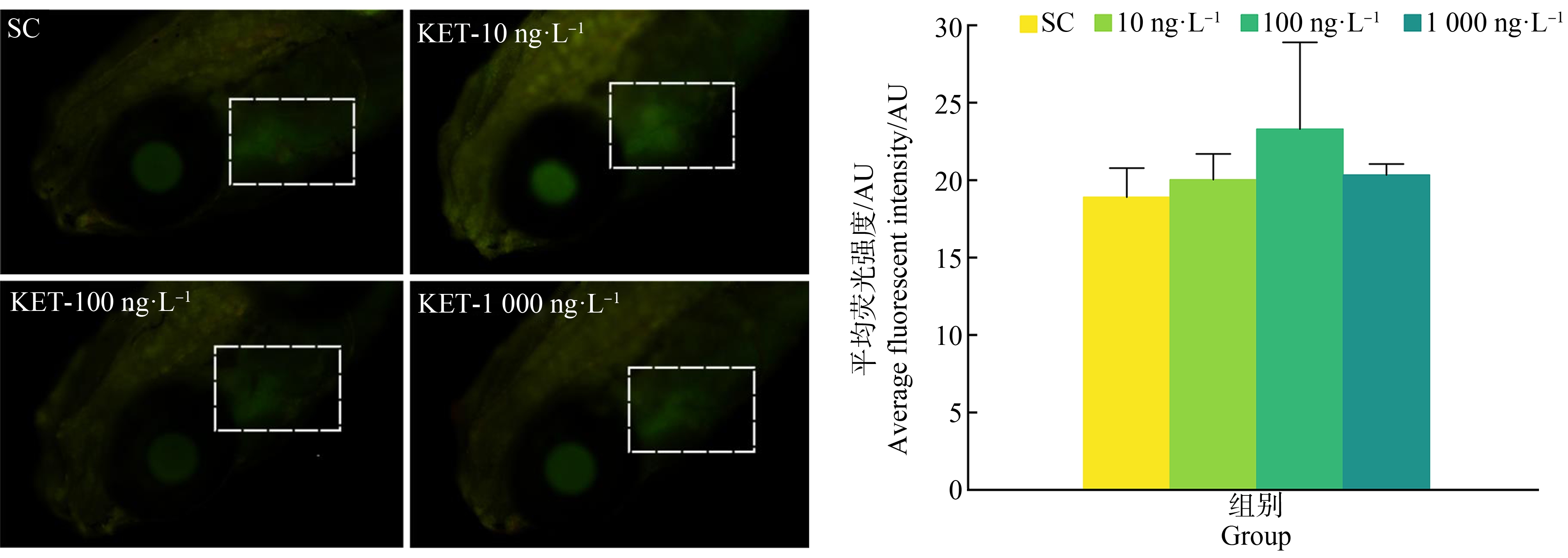
图5 KET对斑马鱼幼鱼大脑细胞凋亡的影响
Fig. 5 Effect of KET on apoptosis of brain cells in zebrafish larvae
2.5 KET对斑马鱼幼鱼体内ROS产生的影响
斑马鱼幼鱼暴露于不同浓度的KET后,在7 dpf统计腹部ROS荧光信号强度,ROS荧光图片和ROS荧光信号强度统计结果如图6所示。与对照组相比,1 000 ng·L-1KET组斑马鱼幼鱼腹部ROS荧光信号强度增加(F=4.039, P=0.045)。该实验结果提示,KET能够导致斑马鱼体内ROS水平出现异常。
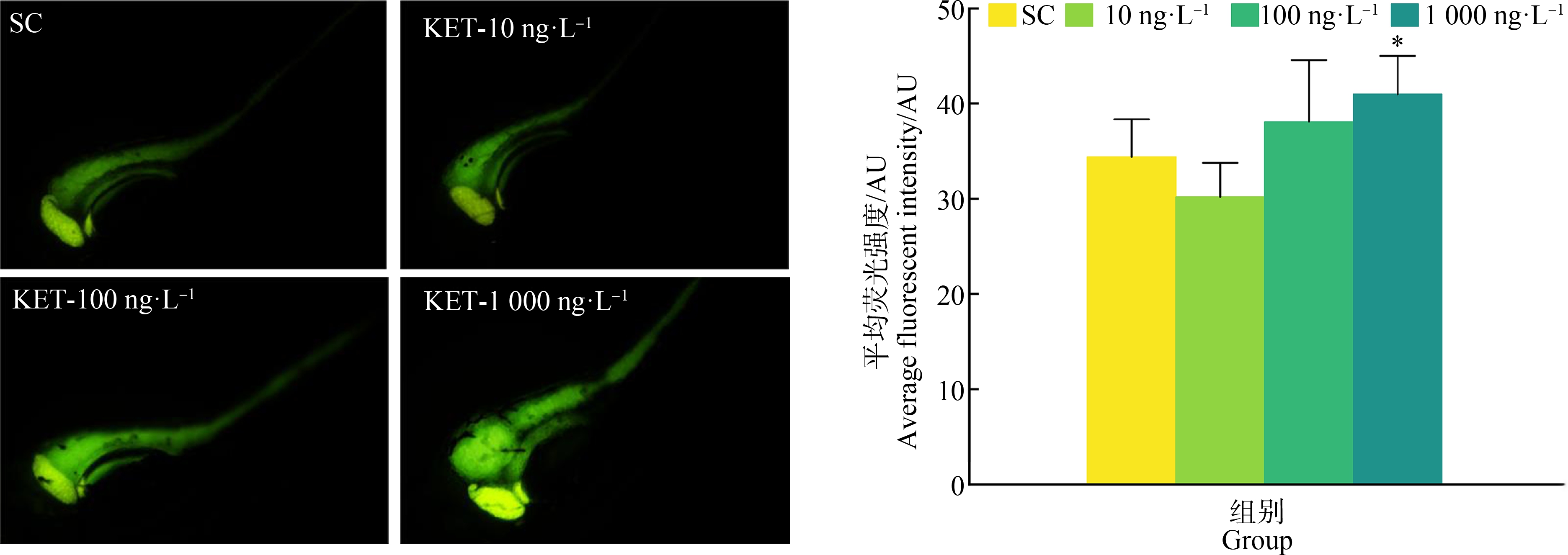
图6 KET对斑马鱼幼鱼腹部ROS的影响
注:与对照组比较,*P<0.05。
Fig.6 Effect of KET on ROS in zebrafish larvae abdomen
Note: Compared with control group, *P<0.05.
2.6 斑马鱼幼鱼神经相关基因转录变化
荧光定量PCR结果如图7所示,不同浓度的KET暴露斑马鱼幼鱼7 d后,各组间多巴胺合成及其受体、γ-氨基丁酸转运和离子通道蛋白等神经相关基因ddc、drd3、slc6a1b、kcnj5和kcnj6的转录水平差异具有统计学意义。与对照组相比,ddc在100 ng·L-1KET组上调(F=2.251, P=0.010),drd3在10 ng·L-1和100 ng·L-1KET组下调(F=12.610, P1<0.001, P2=0.032),slc6a1b在1 000 ng·L-1KET组上调(F=8.328, P=0.013),kcnj5在1 000 ng·L-1KET组上调(F=1.281, P=0.039),kcnj6在100 ng·L-1KET组上调(F=5.445, P=0.041)。该实验结果提示,KET能够影响斑马鱼多巴胺合成及其受体、γ-氨基丁酸转运蛋白及离子通道蛋白等神经相关基因从而导致神经毒性。
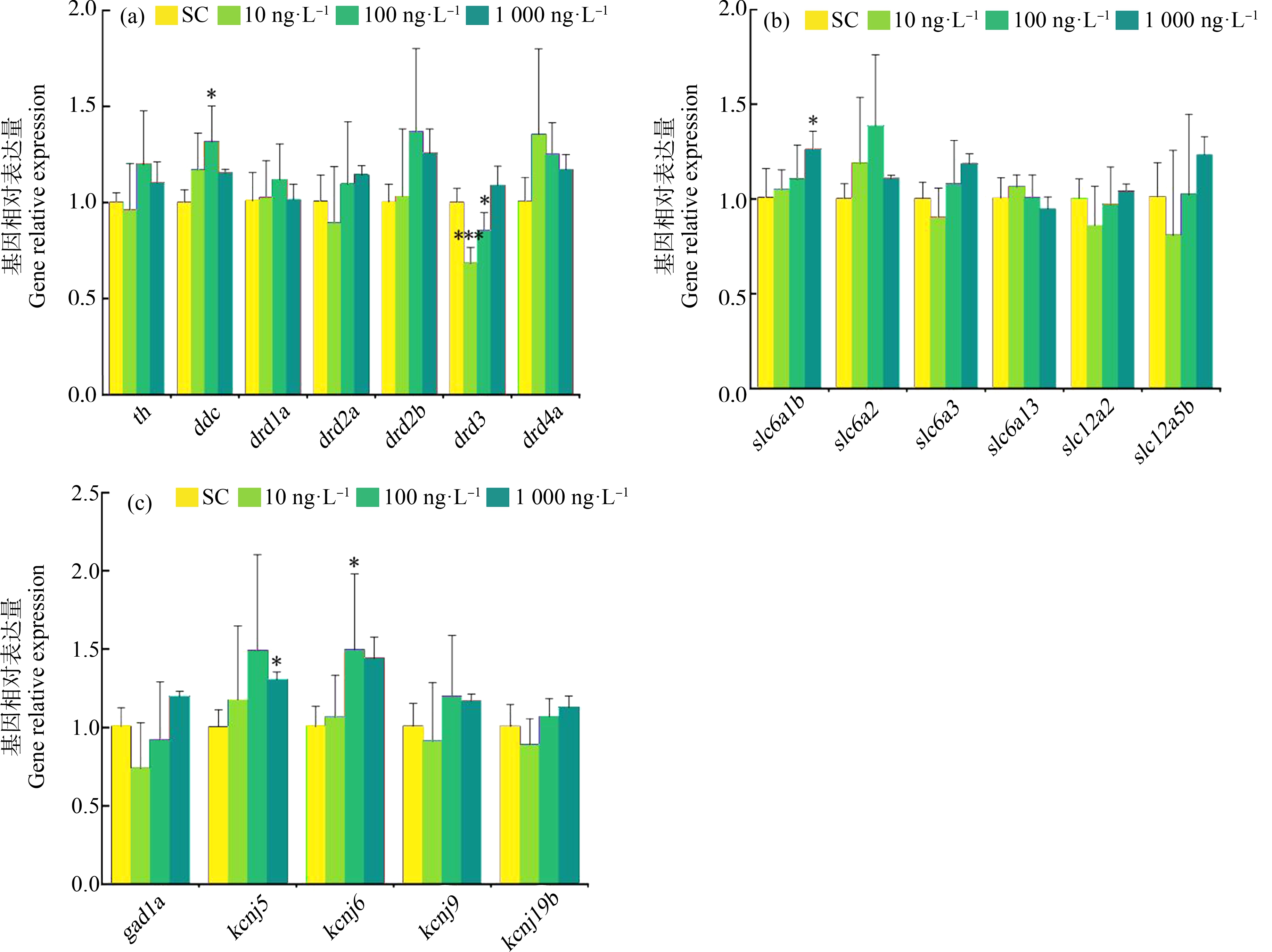
图7 斑马鱼幼鱼体内神经相关基因表达情况
注:与对照组比较,*P<0.05、***P<0.001。
Fig.7 Expression of nerve related genes in zebrafish larvae
Note: Compared with control group, *P<0.05, ***P<0.001.
3 讨论(Discussion)
本研究利用行为学、生化指标以及基因相对表达量分析相结合的方法,在KET暴露斑马鱼7 d的试验中,检测了斑马鱼胚胎和幼鱼一般毒性终点(孵化率、成活率、死亡率和心率)、胚胎和幼鱼行为、活性氧水平、神经递质合成、受体、转运和离子通道等神经相关基因转录水平的差异,结果发现KET可显著影响斑马鱼幼鱼行为和神经相关基因的转录水平,具有潜在的神经毒性。
心脏是斑马鱼胚胎发育过程中最先发育和发挥功能的重要器官[28],心率作为一项常用的鱼类胚胎毒性测试的亚致死指标,用来评估鱼体的生长发育情况。斑马鱼的心脏跳动起始于22 hpf,在受精72 h后,幼鱼心脏可以完成一系列复杂的代谢过程,心率反映了心脏的功能[29],发育中的心脏是发育毒性的敏感靶点[30]。本研究中,在7 dpf时测得10 ng·L-1KET组的斑马鱼幼鱼心率降低提示低浓度KET可能引起早期发育期间斑马鱼幼鱼的心率降低。在其他研究中也观察到类似的现象。例如,Liao等[13]的研究表明KET(951、9.5×104、9.5×105和9.5×106ng·L-1)暴露青鳉鱼胚胎7 d后均显著降低胚胎心率。Kanungo等[31]的研究表明,用1.1875×109ng·L-1KET暴露26 hpf斑马鱼胚胎2 h后显著降低其心率,在52 hpf斑马鱼胚胎中,2.375×108ng·L-1KET暴露2 h、1.1785×108ng·L-1KET暴露20 h后显著降低胚胎心率。在对包括人类的哺乳动物的研究中,也有关于KET降低心率的报道[32-33]。
行为学分析作为一种可视化、可操作性强的方法,能从早期宏观层面上判断外源化学物质造成的神经功能性障碍。本研究基于斑马鱼胚胎发育过程中,不同发育节点对外界刺激的行为反应,如自发摆尾运动、触碰逃逸反应、游泳行为和趋触性。这有利于充分评估KET对斑马鱼不同生长发育阶段的行为影响。自发摆尾运动(spontaneous tail contraction, STC)是常用的监测指标之一。STC的发生伴随着斑马鱼胚胎最初的简单神经网络的发育,在17 hpf胚胎出现第一次自发摆尾运动,该运动受到脊髓运动神经元的支配[34-35],在27 hpf时已结束[22]。大多数情况下,STC以24 hpf为终点进行测试分析[36]。本研究发现100 ng·L-1和1 000 ng·L-1KET均显著增加斑马鱼胚胎STC的频率,可能是通过影响斑马鱼幼鱼脊髓运动神经元的发育,从而导致STC的改变,后续将进一步研究。
Saint-Amant和Drapeau[22]研究发现从21 hpf开始,触碰胚胎/幼鱼的头部或尾部会产生强有力的尾部向头部线圈式全卷曲的运动,在48 hpf之前达到最大收缩速度。在27 hpf,胚胎开始对外界刺激做出反应,可以进行较小规模的起搏式游泳行为(表现为逃脱反应),这种逃脱反应利于幼鱼逃避天敌[24]。本研究发现1 000 ng·L-1KET组斑马鱼的触碰反应得分在27 hpf增加,却在48 hpf减少,说明KET分别在27 hpf时升高、在48 hpf时降低斑马鱼对触碰的敏感程度,而幼鱼对触碰敏感程度的降低不利于斑马鱼躲避天敌。同一浓度下在27 hpf和48 hpf测得斑马鱼对触碰反应的敏感程度不同,可能是由于KET对斑马鱼暴露时间长短不同而造成对神经发育的影响不同导致的。例如,本研究中24 hpf斑马鱼自发摆尾运动频率显著增加,这与27 hpf斑马鱼触碰反应得分提高吻合,而48 hpf后呈麻醉效应,减缓了对外界刺激的反应。
120 hpf后斑马鱼仔鱼逐渐形成较为完善的常规游泳行为等行为,之后几天斑马鱼仔鱼会整合各种感觉系统(如视觉、触觉和味觉等)进行复杂行为(如焦虑行为、运动行为等)[37]。在7 dpf检测幼鱼在明暗条件下的游泳行为,发现幼鱼在明暗转换条件下的运动活性发生改变,具体表现为在光照条件下运动减少(游泳速度减小)、黑暗条件下运动活跃(运动速度增大),这与其他精神活性物质(如地西泮)对斑马鱼胚胎行为的影响效果一致[38-39]。通常情况下,斑马鱼仔鱼具有趋光性,表现为更喜欢光照环境[40]。斑马鱼仔鱼运动呈现出贴壁效应,这是趋触性行为表现,有利于斑马鱼在自然环境中躲避天敌[41-42],同时也能反映斑马鱼焦虑情绪。斑马鱼在孔板中心区域停留时间越长表明其越不焦虑,在孔板边缘区域停留时间越长表明越焦虑。本试验统计斑马鱼幼鱼光照和黑暗期间在外圈运动时间占运动总时间的百分比,结果表明,在黑暗期间,10 ng·L-1KET组幼鱼在外圈停留时间百分比降低,其他浓度KET组(100 ng·L-1和1 000 ng·L-1)幼鱼在外圈停留时间百分比也有降低的趋势,整体在外圈停留时间百分比均低于对照组水平,而光照期间无显著性差异。提示10 ng·L-1KET可能降低幼鱼在由强光刺激状态进入黑暗状态时的焦虑程度。
通过以上研究表明,KET可以显著影响斑马鱼胚胎重要发育节点的行为。行为变化往往与神经系统变化有密切的联系。为了探究其潜在的分子机制,本研究进一步分析了KET对大脑凋亡水平和基因表达的影响。ROS主要是通过分子氧的不完全还原产生于各种器官和组织的细胞线粒体中,在外界刺激和损伤的情况下,ROS水平会急剧增加[43],当体内ROS的产生和清除这一动态平衡状态被破坏时,就会导致氧化应激[44]。研究表明,KET在暴露青鳉鱼胚胎7 d和14 d后,呈剂量依赖性特征增加其体内ROS水平。KET还有其他麻醉剂如异氟醚通过ROS介导的线粒体途径诱导神经元凋亡,引发神经毒性[45-47]。就本试验研究结果来看,与对照组相比,1 000 ng·L-1KET组斑马鱼幼鱼腹部ROS荧光信号强度增加,表明KET增加了斑马鱼幼鱼腹部ROS的产生,可能引发神经毒性。
行为的连续出现与神经系统的发育紧密联系,神经元的树突棘除了是树突接收信号的重要部位外,还有多种受体和离子通道。突触传递作为中枢神经系统内神经元间的信息传递方式,通过突触前膜释放神经递质作用于突触后膜,神经递质的合成、贮存、释放、与受体结合和失活等过程中任一环节受到外源有毒物质的影响,都有可能导致神经系统功能异常,产生神经毒性[48]。
DA是一种单胺类神经递质,是以酪氨酸为起始原料,先由酪氨酸羟化酶(tyrosine hydroxylase, TH)催化生成左旋多巴(即L-3,4-二羟基苯丙氨酸,L-3,4-dihydroxyphenylalanine, L-DOPA),再通过多巴脱羧酶(dopa decarboxylase, DDC)催化而成。DA是一种关键的神经递质,在运动控制、认知、动力、多巴胺神经元和多巴胺能回路的发育上起着重要作用[49]。DRD3受体具有大脑边缘区特异性分布的特点,与情绪密切相关[50-51],同时在运动和社会行为中起作用[52]。Steiner等[53]的研究表明DRD3受体缺乏减少了小鼠焦虑样行为。在某些药物干预等条件下,DRD3受体可能参与了与情绪相关的行为变化,抗抑郁药物在DRD3受体敲除型小鼠中诱导了更好的行为表现[54]。提示KET可能通过下调drd3来降低斑马鱼幼鱼在由强光刺激状态进入黑暗状态时的焦虑程度。
GABA是一种存在于中枢神经系统的抑制性神经递质,GABA在突触后作用于离子型GABAA/GABAC和代谢型GABAB受体,以诱导神经元抑制,其突触传递的终止是通过位于突触前末端质膜和神经胶质细胞上的GABA转运蛋白(GAT)的再摄取来实现的[55-57]。slc6a1b基因编码GABA转运蛋白GAT1。研究表明,转基因GAT1过表达小鼠模型(TG1小鼠)中,GAT1过度表达,TG1小鼠大脑中的GABA摄取增加[58],同时过表达GAT1导致小鼠疼痛敏感性升高[59]。本研究中KET暴露使GABA转运体基因slc6a1b上调,可能使GABA转运蛋白GAT1表达增加,从而增加GABA再摄取,使得斑马鱼对触碰反应更加敏感。
此外,kcnj5和kcnj6基因是钾内向整流通道亚家族J成员5和6,编码形成由G蛋白调节的向内整流型钾通道的整合膜蛋白亚基,其中,由kcnj5和kcnj6编码的蛋白亚基在心脏表达[60]。心房特异性K+电流对于心房动作电位的形成至关重要,当由kcnj5编码的蛋白亚基组成的KACh型通道被激活时会导致心房收缩和心室传导减少[61]。本研究发现斑马鱼幼鱼心率降低,kcnj5、kcnj6基因上调,可能是由于KET上调钾内向整流通道蛋白的表达,激活了钾内向整流通道,从而降低斑马鱼幼鱼心率。
综上所述,氯胺酮对早期发育期间的斑马鱼具有潜在的神经毒性。氯胺酮可能通过上调钾内向整流通道蛋白基因而上调钾内向整流通道蛋白的表达,激活钾内向整流通道,从而降低斑马鱼幼鱼心率。另一方面,氯胺酮可能通过影响斑马鱼幼鱼的脊髓运动神经元的发育来提高自发摆尾运动频率,通过下调drd3来降低斑马鱼幼鱼在由强光刺激状态进入黑暗状态时的焦虑程度,通过上调slc6a1b来增加GAT1的表达使得斑马鱼对触碰反应更加敏感,导致神经毒性。
[1] United Nations Office on Drugs and Crime.World Drug Report 2022[R].New York: United Nations Publications, 2022
[2] Jansen K L R.A review of the nonmedical use of ketamine: Use, users and consequences[J].Journal of Psychoactive Drugs, 2000, 32(4): 419-433
[3] Curran H V, Morgan C.Cognitive, dissociative and psychotogenic effects of ketamine in recreational users on the night of drug use and 3 days later[J].Addiction, 2000, 95(4): 575-590
[4] 郑涵予, 王雪.氯胺酮神经精神毒性的研究进展[J].中国药物依赖性杂志, 2010, 19(6): 450-453
[5] Bobo W V, Miller S C.Ketamine as a preferred substance of abuse[J].American Journal on Addictions, 2002, 11(4): 332-334
[6] Wang K C, Shih T S, Cheng S G.Use of SPE and LC/TIS/MS/MS for rapid detection and quantitation of ketamine and its metabolite, norketamine, in urine[J].Forensic Science International, 2005, 147(1): 81-88
[7] Du P, Li K Y, Li J, et al.Methamphetamine and ketamine use in major Chinese cities, a nationwide reconnaissance through sewage-based epidemiology[J].Water Research, 2015, 84: 76-84
[8] Lin A Y C, Lee W N, Wang X H.Ketamine and the metabolite norketamine: Persistence and phototransformation toxicity in hospital wastewater and surface water[J].Water Research, 2014, 53: 351-360
[9] Wang Z L, Han S, Cai M, et al.Environmental behavior of methamphetamine and ketamine in aquatic ecosystem: Degradation, bioaccumulation, distribution, and associated shift in toxicity and bacterial community[J].Water Research, 2020, 174: 115585
[10] Wang Z L, Xu Z Q, Li X Q.Impacts of methamphetamine and ketamine on C. elegans’s physiological functions at environmentally relevant concentrations and eco-risk assessment in surface waters[J].Journal of Hazardous Materials, 2019, 363: 268-276
[11] Baker D R, Kasprzyk-Hordern B.Multi-residue analysis of drugs of abuse in wastewater and surface water by solid-phase extraction and liquid chromatography-positive electrospray ionisation tandem mass spectrometry[J].Journal of Chromatography A, 2011, 1218(12): 1620-1631
[12] Vazquez-Roig P, Andreu V, Blasco C, et al.Spatial distribution of illicit drugs in surface waters of the natural park of Pego-Oliva Marsh(Valencia, Spain)[J].Environmental Science and Pollution Research International, 2012, 19(4): 971-982
[13] Liao P H, Hwang C C, Chen T H, et al.Developmental exposures to waterborne abused drugs alter physiological function and larval locomotion in early life stages of medaka fish[J].Aquatic Toxicology, 2015, 165: 84-92
[14] Riehl R, Kyzar E, Allain A, et al.Behavioral and physiological effects of acute ketamine exposure in adult zebrafish[J].Neurotoxicology and Teratology, 2011, 33(6): 658-667
[15] Félix L M, Antunes L M, Coimbra A M.Ketamine NMDA receptor-independent toxicity during zebrafish(Danio rerio)embryonic development[J].Neurotoxicology and Teratology, 2014, 41: 27-34
[16] SchierA F.The maternal-zygotic transition: Death and birth of RNAs[J].Science, 2007, 316(5823): 406-407
[17] Guo R, Liu G J, Du M, et al.Early ketamine exposure results in cardiac enlargement and heart dysfunction in Xenopusembryos[J].BMC Anesthesiology, 2015, 16(1): 23
[18] Li S W, Wang Y H, Lin A Y C.Ecotoxicological effect of ketamine: Evidence of acute, chronic and photolysis toxicity to Daphnia magna[J].Ecotoxicology and Environmental Safety, 2017, 143: 173-179
[19] Shi W J, Ying G G, Huang G Y, et al.Transcriptional and biochemical alterations in zebrafish eleuthero-embryos(Danio rerio)after exposure to synthetic progestogen dydrogesterone[J].Bulletin of Environmental Contamination and Toxicology, 2017, 99(1): 39-45
[20] Kimmel C B, Ballard W W, Kimmel S R, et al.Stages of embryonic development of the zebrafish[J].Developmental Dynamics, 1995, 203(3): 253-310
[21] Sztal T E, Ruparelia A A, Williams C, et al.Using touch-evoked response and locomotion assays to assess muscle performance and function in zebrafish[J].Journal of Visualized Experiments, 2016, 116: 54431
[22] Saint-Amant L, Drapeau P.Time course of the development of motor behaviors in the zebrafish embryo[J].Journal of Neurobiology, 1998, 37(4): 622-632
[23] Grunwald D J, Kimmel C B, Westerfield M, et al.A neural degeneration mutation that spares primary neurons in the zebrafish[J].Developmental Biology, 1988, 126(1): 115-128
[24] 邹苏琪, 殷梧, 杨昱鹏, 等.斑马鱼行为学实验在神经科学中的应用[J].生物化学与生物物理进展, 2009, 36(1): 5-12
Zou S Q, Yin W, Yang Y P, et al.The ethology application of zebrafish in neuroscience[J].Progress in Biochemistry and Biophysics, 2009, 36(1): 5-12(in Chinese)
[25] Carmean V, Yonkers M A, Tellez M B, et al.Pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability[J].Journal of Neurophysiology, 2015, 114(2): 1146-1157
[26] Stanley K A, Curtis L R, Simonich S L, et al.Endosulfan Ⅰ and endosulfan sulfate disrupts zebrafish embryonic development[J].Aquatic Toxicology, 2009, 95(4): 355-361
[27] Schnörr S J, Steenbergen P J, Richardson M K, et al.Measuring thigmotaxis in larval zebrafish[J].Behavioural Brain Research, 2012, 228(2): 367-374
[28] Hill A J, Teraoka H, Heideman W, et al.Zebrafish as a model vertebrate for investigating chemical toxicity[J].Toxicological Sciences, 2005, 86(1): 6-19
[29] Li J J, Zhang Y, Liu K C, et al.Xiaoaiping induces developmental toxicity in zebrafish embryos through activation of ER stress, apoptosis and the Wnt pathway[J].Frontiers in Pharmacology, 2018, 9: 1250
[30] Kopf P G, Walker M K.Overview of developmental heart defects by dioxins, PCBs, and pesticides[J].Journal of Environmental Science and Health, Part C, 2009, 27(4): 276-285
[31] Kanungo J, Cuevas E, Ali S F, et al.L-Carnitine rescues ketamine-induced attenuated heart rate and MAPK(ERK)activity in zebrafish embryos[J].Reproductive Toxicology, 2012, 33(2): 205-212
[32] Hotchkiss C E, Wang C, Slikker W Jr.Effect of prolonged ketamine exposure on cardiovascular physiology in pregnant and infant rhesus monkeys(Macaca mulatta)[J].Journal of the American Association for Laboratory Animal Science, 2007, 46(6): 21-28
[33] 李岳振, 王文军, 王航, 等.小剂量氯胺酮麻醉对感染性休克患者C-反应蛋白的影响[J].中华医院感染学杂志, 2016, 26(11): 2519-2521
Li Y Z, Wang W J, Wang H, et al.Impact of low dose of ketamine anesthesia on C-reactive protein of septic shock patients[J].Chinese Journal of Nosocomiology, 2016, 26(11): 2519-2521(in Chinese)
[34] Drapeau P, Saint-Amant L, Buss R R, et al.Development of the locomotor network in zebrafish[J].Progress in Neurobiology, 2002, 68(2): 85-111
[35] Saint-Amant L.Development of motor networks in zebrafish embryos[J].Zebrafish, 2006, 3(2): 173-190
[36] Richendrfer H, Creton R, Colwill R M.Zebrafish[M].Hauppauge: Nova Science Publishers, 2014: 245-264
[37] Borla M A, Palecek B, Budick S, et al.Prey capture by larval zebrafish: Evidence for fine axial motor control[J].Brain, Behavior and Evolution, 2002, 60(4): 207-229
[38] Leuthold D, Klüver N, Altenburger R, et al.Can environmentally relevant neuroactive chemicals specifically be detected with the locomotor response test in zebrafish embryos?[J].Environmental Science &Technology, 2019, 53(1): 482-493
[39] 吴敏.地西泮药物污染对斑马鱼神经行为毒性及机制研究[D].镇江: 江苏大学, 2021: 19-20
Wu M.Neurobehavioral toxicity and related mechanisms of diazepam to zebrafish(Danio rerio)[D].Zhenjiang: Jiangsu University, 2021: 19-20(in Chinese)
[40] Lau B Y, Mathur P, Gould G G, et al.Identification of a brain center whose activity discriminates a choice behavior in zebrafish[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(6): 2581-2586
[41] Sackerman J, Donegan J J, Cunningham C S, et al.Zebrafish behavior in novel environments: Effects of acute exposure to anxiolytic compounds and choice of Danio rerioline[J].International Journal of Comparative Psychology, 2010, 23(1): 43-61
[42] Miller N, Gerlai R.From schooling to shoaling: Patterns of collective motion in zebrafish(Danio rerio)[J].PLoS One, 2012, 7(11): e48865
[43] Childs E W, Udobi K F, Wood J G, et al.In vivovisualization of reactive oxidants and leukocyte-endothelial adherence following hemorrhagic shock[J].Shock, 2002, 18(5): 423-427
[44] Wang L, Ryu B, Kim W S, et al.Protective effect of gallic acid derivatives from the freshwater green alga Spirogyrasp.against ultraviolet B-induced apoptosis through reactive oxygen species clearance in human keratinocytes and zebrafish[J].Algae, 2017, 32: 379-388
[45] Bai X W, Yan Y S, Canfield S, et al.Ketamine enhances human neural stem cell proliferation and induces neuronal apoptosis via reactive oxygen species-mediated mitochondrial pathway[J].Anesthesia and Analgesia, 2013, 116(4): 869-880
[46] Zhang Y Y, Dong Y L, Wu X, et al.The mitochondrial pathway of anesthetic isoflurane-induced apoptosis[J].The Journal of Biological Chemistry, 2010, 285(6): 4025-4037
[47] Wang C, Zhang X, Liu F, et al.Anesthetic-induced oxidative stress and potential protection[J].The Scientific World Journal, 2010, 10: 1473-1482
[48] Jones D C, Miller G W.The effects of environmental neurotoxicants on the dopaminergic system: A possible role in drug addiction[J].Biochemical Pharmacology, 2008, 76(5): 569-581
[49] Iversen S D, Iversen L L.Dopamine: 50 years in perspective[J].Trends in Neurosciences, 2007, 30(5): 188-193
[50] Beaulieu J M, Gainetdinov R R.The physiology, signaling, and pharmacology of dopamine receptors[J].Pharmacological Reviews, 2011, 63(1): 182-217
[51] Xu M, Koeltzow T E, Santiago G T, et al.Dopamine D3 receptor mutant mice exhibit increased behavioral sensitivity to concurrent stimulation of D1 and D2 receptors[J].Neuron, 1997, 19(4): 837-848
[52] Liang X F, Zhao Y Q, Liu W, et al.Butylated hydroxytoluene induces hyperactivity and alters dopamine-related gene expression in larval zebrafish(Danio rerio)[J].Environmental Pollution, 2020, 257: 113624
[53] Steiner H, Fuchs S, Accili D.D3 dopamine receptor-deficient mouse: Evidence for reduced anxiety[J].Physiology &Behavior, 1997, 63(1): 137-141
[54] Leggio G M, Micale V, Drago F.Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test(FST)[J].European Neuropsychopharmacology, 2008, 18(4): 271-277
[55] Borden L A.GABA transporter heterogeneity: Pharmacology and cellular localization[J].Neurochemistry International, 1996, 29(4): 335-356
[56] Morara S, Brecha N C, Marcotti W, et al.Neuronal and glial localization of the GABA transporter GAT-1 in the cerebellar cortex[J].Neuroreport, 1996, 7(18): 2993-2996
[57] Gadea A, López-Colomé A M.Glial transporters for glutamate, glycine and GABA Ⅰ.Glutamate transporters[J].Journal of Neuroscience Research, 2001, 63(6): 453-460
[58] Ma Y H, Zhou X G, Duan S H, et al.Overexpression of gamma-aminobutyric acid transporter subtype Ⅰ leads to cognitive deterioration in transgenic mice[J].Acta Pharmacologica Sinica, 2001, 22(4): 340-348
[59] Hu J H, Yang N, Ma Y H, et al.Hyperalgesic effects of gamma-aminobutyric acid transporter Ⅰ in mice[J].Journal of Neuroscience Research, 2003, 73(4): 565-572
[60] Isomoto S, Kondo C, Takahashi N, et al.A novel ubiquitously distributed isoform of GIRK2(GIRK2B)enhances GIRK1 expression of the G-protein-gated K+current in Xenopusoocytes[J].Biochemical and Biophysical Research Communications, 1996, 218(1): 286-291
[61] Dhein S, van Koppen C J, Brodde O E.Muscarinic receptors in the mammalian heart[J].Pharmacological Research, 2001, 44(3): 161-182