有机氯农药(OCPs)是一类持久性有机污染物(POPs),其理化性质稳定,难以降解,容易在环境介质、人类食品甚至人体组织中积累,并产生严重毒性[1]。林丹(γ-六氯环己烷,γ-HCHs)是一种常见的OCPs,在水环境最高浓度可达22.43 ng·L-1[2],土壤环境最高浓度可达152.84 μg·kg-1[3],在农作物的可食用茎块部分浓度可达14.0 ng·g-1[4]。与此同时,林丹的毒性也备受关注。林丹可以对神经、内分泌和生殖等产生危害[5],而且林丹还能够诱发癌症,增加癌症死亡率[5-6],因而也被IARC列入一类致癌物[7]。尽管已经在世界各国大范围禁用,但其化学结构的稳定性使其在环境中能够持久性存在,因而其健康危害与潜在机理仍受到普遍关注[5]。
值得注意的是,OCPs在环境中的持久性存在,使其能够与抗生素等新污染物共存于环境介质甚至食品中[8]。抗生素是一种因广泛使用、排放以及难降解等原因,在各种环境介质甚至食品中普遍存在的新污染物。例如,磺胺类抗生素(例如磺胺甲恶唑)在水环境中最高浓度可达791.2 ng·L-1[9],在鲇鱼等海产品中最高浓度可达245.91 ng·g-1[10]。再如,四环素类抗生素在地表水中浓度可达121.04 ng·L-1甚至更高[9-11],在土壤中浓度可达90.42 μg·kg-1[12],在鸡肉类产品中最高浓度可达62.8 μg·kg-1[13]。抗生素也具有显著的环境毒性与健康危害。环境抗生素不仅可以筛选或增强环境抗性基因,干扰微生物致病性[14],而且可以干扰大型溞的存活和生殖[15],削弱尾草履虫和膨胀肾形虫的种群[16],损伤蚕豆根尖细胞DNA[17],干扰斑马鱼孵化和发育[18]等。然而,以抗生素、OCPs为代表的新、旧污染物间的毒性相互作用,尚缺乏系统研究,为评价环境污染物的健康危害与机理提出了新的考验。
环境污染物的健康危害中,诱发癌症效应因后果严重备受关注。生命科学研究表明,约90%癌症患者的直接死因是肿瘤细胞迁移,该环节既是癌症早期形成与晚期扩散的标志性环节,也是各种因素促发癌症的研判依据[19-20]。环境毒理学研究表明,林丹能够显著增加黑腹果蝇体内肿瘤细胞迁移的发生概率,与其可促进癌变的效应一致[21]。与此同时,抗生素的使用显著干扰了免疫检查点抑制剂(ICIs)对癌症的治疗效果,继而增加癌症病人的死亡率[22],表现出潜在的肿瘤细胞迁移效应。截至目前,林丹与抗生素对肿瘤细胞迁移的联合作用尚无报道,潜在机理也亟待开展。
肿瘤细胞迁移过程中,与活性氧自由基(ROS)产生的氧化胁迫及其诱发的抗氧化响应密切相关。其中,ROS损害细胞内的脂质、蛋白质和DNA等生物分子,干扰细胞增殖和凋亡调控信号通路,继而促发上皮间质转化(EMT)等肿瘤细胞迁移关键环节[23-24]。谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)和谷胱甘肽S-转移酶(GST)等抗氧化物功能受阻,或者异常增多,也会促进癌细胞迁移[25-27]。丙二醛(MDA),作为脂质过氧化的生物标志物,也与肺癌密切相关[28]。已有研究表明,林丹与抗生素对ROS、抗氧化物和MDA等氧化胁迫与抗氧化响应的效应非常普遍[29-30]。因此,氧化胁迫、抗氧化响应和氧化损伤等内容将为阐释林丹与抗生素对肿瘤细胞迁移联合作用的潜在机理提供重要方向。
本研究选择林丹、磺胺甲恶唑和四环素作为目标物质,基于黑腹果蝇肿瘤细胞迁移模型[21],开展林丹-磺胺甲恶唑、林丹-四环素二元混合物对肿瘤细胞迁移的联合作用,围绕氧化胁迫、抗氧化响应、氧化损伤探究联合作用的潜在机理。本研究发现了林丹、磺胺甲恶唑均能够显著增加肿瘤细胞迁移水平,林丹-磺胺甲恶唑、林丹-四环素二元混合物表现出明显的协同作用,上述效应与ROS、CAT等抗氧化响应、MDA等密切相关,为探究新、旧环境污染物的健康危害提供关键信息,甚至为因旧污染物诱发的癌症等疾病的抗生素等治疗方案提供参考。
1 材料与方法(Materials and methods)
1.1 实验化合物
林丹(γ-HCH,C6H6Cl6;≥97%,Dr.Ehrenstorfer GmbH,德国)、磺胺甲恶唑(sulfamethoxazole, SMX;麦克林,中国)采用二甲基亚砜(DMSO;99%,Vetec,德国)溶解,使用含0.1% DMSO(V/V)的无菌水稀释获得浓度为10.0 mg·L-1的林丹与SMX储备液。盐酸四环素(tetracycline hydrochloride, TET;Adamas-beta,中国)直接使用0.1% DMSO无菌水在烧杯中进行溶解、稀释,获得浓度为100.0 mg·L-1的TET储备液。所有储备液保存于4 ℃,使用时利用含0.1% DMSO的无菌水稀释获得不同浓度梯度的工作液,加入至黑腹果蝇培养基中进行暴露实验。
1.2 黑腹果蝇
本实验使用的黑腹果蝇(Drosophila melanogaster)包含2种品系,分别为:(1)yw, ey-Flp;Tub-Gal80 FRT40A; act>y+>Gal4 UAS-GFP,简写为GFP品系;(2)w; lgl4 FRT40A UAS-RasV12/CyO; Sb/TM6BTb,简写为RAS品系;2种品系果蝇都来自Bloomington Drosophila Stock Center(USA)实验室。其中,GFP品系的眼部和脑部则带有绿色荧光蛋白(GFP),RAS品系的眼部和脑部带有癌症细胞,GFP品系的雄蝇与RAS品系的处女蝇杂交,其产生的后代为RasV12/lgl-/-品系,在荧光显微镜下可通过绿色荧光信号直接标定癌细胞所在位置[31]。
黑腹果蝇的固体培养基(1.0 L)包含红糖135.0 g、玉米粉85.0 g和琼脂7.0 g,煮至微沸状态、不断搅拌均匀,冷却10 min后,依次倒入提前溶解的8.0 g活性酵母和4.0 mL丙酸,再次微沸后,冷却至60~70 ℃,趁热将其分装至已灭菌的培养管中,用新鲜棉花堵住已倒好的培养管,在室温下通风处自然冷却凝固备用[21, 31-32]。采用二氧化碳麻醉黑腹果蝇,将其转移至通有二氧化碳的麻醉板上,利用体视显微镜挑取发育情况较好的成虫,放入新鲜配制的普通培养基中,并向培养基加入少许活性干酵母,促进果蝇交配和产卵,加塞后放在25 ℃、60%湿度的培养箱内储存培养,每3~5 d转管一次,同一品系果蝇在3~5 d内充分交配,产卵后转入相同的培养体系内培养,以此循环完成扩增。
1.3 污染物暴露与样品采集
目标污染物添加于培养基中对黑腹果蝇虫卵开始暴露,主要操作步骤如下。普通培养基配制过程中,在糊状培养基冷却至60~70 ℃时,趁热称量58.8 g普通培养基,而后加入1.2 mL暴露液或0.1%DMSO无菌水(作为空白),搅拌均匀后分装至6个培养管,每管10 g,加棉花塞或海绵塞,在管壁处标记组别与浓度以及配制日期,在室温下通风处自然冷却凝固备用[32]。本研究所用林丹、SMX和TET的最高暴露浓度分别为100、400和1 000 ng·g-1,分别表征它们在食品等环境介质中的浓度水平[4, 10, 13]。
RasV12/lgl-/-品系果蝇实验。采用二氧化碳麻醉黑腹果蝇,将其转移至通有二氧化碳的麻醉板上,在体视显微镜下,挑取较为年轻的GFP品系的雄蝇和RAS品系的处女蝇,处女蝇的标志是带有明显胎粪的雌蝇。按照8♀:![]() 的比例在上午8时先放入普通培养基中,加入干酵母促进交配;在下午8时将其转入含有目标污染物或对照溶液的培养基中,撒入少许酵母促进雌蝇产卵,至于25 ℃、60%湿度的培养箱中[31]。包括空白的每个组别均包含2个培养管作为平行。第2天早8时,各组别成虫分别转入相同组别、尚无果蝇的新培养管中;第3天重复相同操作,使每个组别共含有6个培养管作为平行。第4天,各组成虫倒出。
的比例在上午8时先放入普通培养基中,加入干酵母促进交配;在下午8时将其转入含有目标污染物或对照溶液的培养基中,撒入少许酵母促进雌蝇产卵,至于25 ℃、60%湿度的培养箱中[31]。包括空白的每个组别均包含2个培养管作为平行。第2天早8时,各组别成虫分别转入相同组别、尚无果蝇的新培养管中;第3天重复相同操作,使每个组别共含有6个培养管作为平行。第4天,各组成虫倒出。
暴露组(或对照组)的黑腹果蝇自杂交后4~8 d左右会发育到三龄幼虫阶段,三龄幼虫会自主爬至管壁上的不同高度处准备结蛹,为统一样品采集时间以及方便相关操作[31]。本研究在每管转入黑腹果蝇后的第8天,用镊子轻轻夹取管中的三龄幼虫,转移至离心管中,随后冻存在-80 ℃冰箱中,用于后续肿瘤细胞迁移检测(1.5)与生化指标检测(1.6)。
1.4 混合物设计
根据直接均分法进行二元混合物的设计[33],全面表征其在环境介质中潜在的混合比例。混合物采用林丹、SMX和TET的储备液进行配制,利用含0.1% DMSO的无菌水稀释获得不同浓度梯度的工作液,按上述步骤加入至黑腹果蝇培养基中进行混合物暴露与样品采集。
1.5 肿瘤细胞迁移检测
从暴露组、对照组的每个组别中随机取得10只三龄幼虫,体视显微镜下进行解剖,保留大部分神经组织的前2/3,采用荧光显微镜进行绿色荧光的识别与观察,若幼虫眼部和脑部之外的部位,例如前庭核复合体(vestibular nuclear complex, VNC)处有绿色荧光,则说明该幼虫存在肿瘤细胞迁移[31]。
1.6 生化指标检测
从暴露组、对照组的每个组别中随机取得3根离心管,每根离心管中含有至少6只RasV12/lgl-/-品系三龄幼虫完整个体,在冰浴条件下,加入0 ℃磷酸盐缓冲液(PBS)进行研磨,4 ℃离心后,上清液分装至1.5 mL离心管中,用于后续生化指标测定[32]。采用酶联免疫吸附法(ELISA)测定ROS、SOD、GSH、CAT和MDA等指标,同时测定每个样品中的总蛋白(TP)用于消除样品间生物量差异的影响[30]。
1.7 混合物联合毒性计算
林丹与抗生素混合物的效应采用独立作用(IA)模型预测[34],IA模型公式如下:E(cmix)=1-∏(1-E(cj)),其中,E(cj)为混合物某组分以其在混合物中浓度水平单独作用时的效应,E(cmix)为混合物预测效应。当混合物实际效应大于E(cmix)时,表明混合物各组分发生协同作用;当混合物实际效应小于E(cmix)时,表明混合物各组分发生拮抗作用。
1.8 数据处理与统计分析
采用Origin软件(Origin, USA)对数据进行统计分析与作图,采用One-way ANOVA进行组间差异显著性分析(P<0.05),采用线性拟合对单个物质效应进行分析,采用层次聚类分析探索不同指标之间的潜在关联。
2 结果与讨论(Results and discussion)
2.1 单个污染物对黑腹果蝇肿瘤细胞迁移的毒性效应
林丹、SMX和TET对黑腹果蝇肿瘤细胞迁移的效应如图1所示。林丹在20 ng·g-1浓度水平,并未显著增加黑腹果蝇的肿瘤细胞迁移水平;在40~100 ng·g-1浓度范围内显著增强了肿瘤细胞迁移。随着浓度从40 ng·g-1升高到100 ng·g-1,肿瘤细胞迁移的水平从空白组的1.24倍(P<0.05)逐渐升高至1.72倍(P<0.05),表现出明显的浓度依赖关系。与此同时,SMX在80~320 ng·g-1浓度水平均没有对黑腹果蝇的肿瘤细胞迁移水平产生显著影响;SMX在400 ng·g-1浓度显著增加了肿瘤细胞迁移水平,是空白组的1.36倍(P<0.05)。TET在200~400 ng·g-1浓度并未对肿瘤细胞迁移产生显著影响,在600~1000ng·g-1浓度水平显著增强肿瘤细胞迁移,增强效果从空白组的1.20倍(P<0.05)逐渐上升至1.49倍(P<0.05),也表现出显著的浓度依赖效应。

图1 林丹(a)、磺胺甲恶唑(SMX)(b)、盐酸四环素(TET)(c)诱发黑腹果蝇肿瘤细胞迁移
注:肿瘤细胞迁移率相对空白倍数以平均值±标准误差的方式表达;*与对照组相比具有显著性差异(P<0.05)。
Fig.1 Stimulation of lindane(a), sulfamethoxazole(SMX)(b)and tetracycline hydrochloride(TET)(c)on the tumor cell migration in Drosophila melanogaster
Note: Fold change of migration rate against the control was expressed as the mean±standard deviation;*indicates significant difference from the control(P<0.05).
上述结果表明,林丹虽然暴露浓度最小,但对肿瘤细胞转移效应最强。本研究结果,与林丹对黑腹果蝇三龄幼虫的肿瘤迁移率的增加效果随浓度升高逐渐升高的先期报道一致,也与其致癌性相一致[21]。同时,本研究结果也与抗生素干扰癌症治疗效果、增加癌症病人的死亡率的报道相一致[22]。值得注意的是,世界各国虽然早已限制林丹的使用,但林丹在环境介质甚至是食品中依然普遍检出,但实际暴露浓度往往不会超过20 ng·g-1[4]。与此同时,本研究涉及的SMX、TET这2种抗生素的暴露浓度也参照其等环境介质中的浓度水平[10, 13]。本研究结果中,林丹在20 ng·g-1浓度水平并未产生显著效应,2种抗生素单独暴露时也只在较高浓度产生肿瘤细胞迁移效应。但是,在偶发的环境事故或极端的环境污染中,林丹与抗生素依然能够对癌症等疾病产生显著促进的影响。
2.2 林丹与SMX或TET二元混合物对肿瘤细胞迁移的联合效应
林丹与SMX二元混合物对肿瘤细胞迁移的联合效应如表1所示。结果表明,随着二元混合物中林丹浓度的逐渐升高,二元混合物的肿瘤细胞迁移效应逐渐增强,从空白组的1.48倍(P<0.05)逐渐上升至1.77倍(P<0.05)。根据二元混合物与IA预测值的比较,二元混合物主要表现出协同作用。林丹与TET二元混合物对肿瘤细胞迁移的联合效应如表2所示。结果表明,随着二元混合物中林丹浓度的逐渐升高,二元混合物的肿瘤细胞迁移效应逐渐增强,从空白组的1.48倍(P<0.05)逐渐上升至1.66倍(P<0.05)。根据二元混合物与IA预测值的比较,二元混合物也主要表现出协同作用。
表1 林丹与SMX二元混合物诱发黑腹果蝇肿瘤细胞迁移效应
Table 1 Binary mixture effects of lindane and SMX on the tumor migration in Drosophila melanogaster
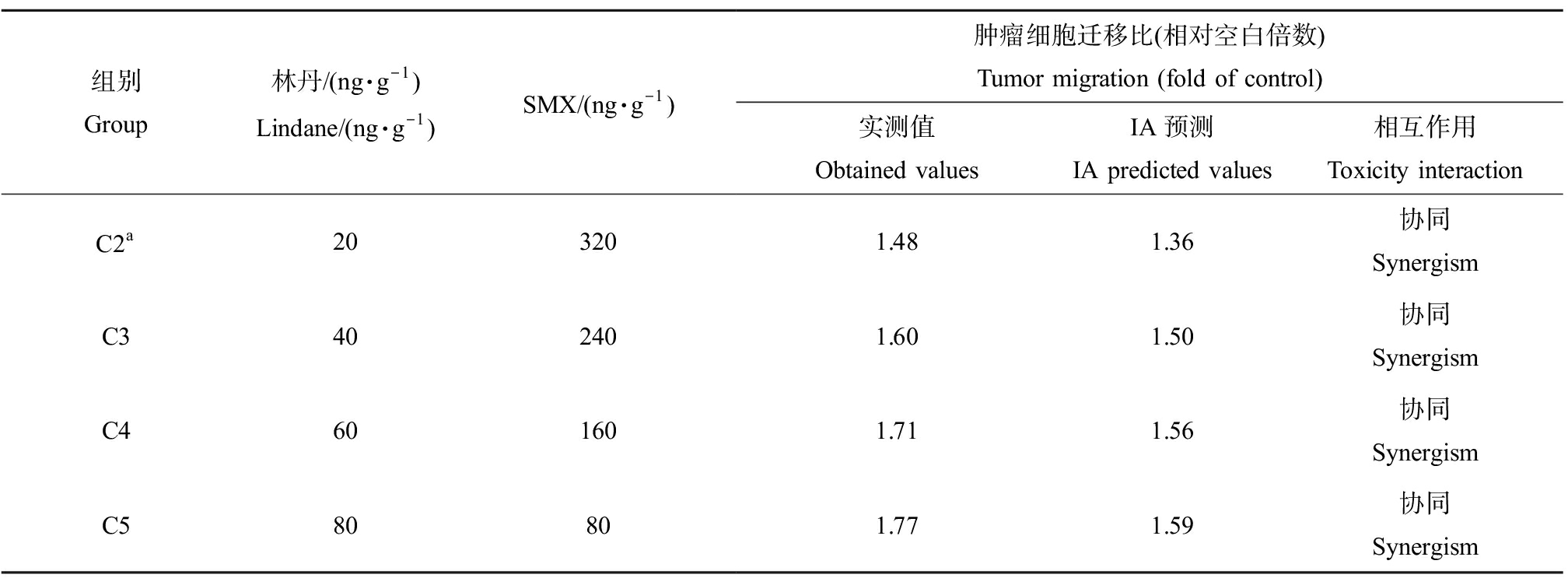
组别Group林丹/(ng·g-1)Lindane/(ng·g-1)SMX/(ng·g-1)肿瘤细胞迁移比(相对空白倍数) Tumor migration (fold of control)实测值Obtained valuesIA预测IA predicted values相互作用Toxicity interactionC2a203201.481.36协同 SynergismC3402401.601.50协同 SynergismC4601601.711.56协同 SynergismC580801.771.59协同 Synergism
注:a, C1组为400 ng·g-1SMX的单独暴露组,C6组为100 ng·g-1林丹的单独暴露组。
Note: a, C1 or C6 group represented individual exposure to 400 ng·g-1SMX or 100 ng·g-1lindane.
表2 林丹与TET二元混合物诱发黑腹果蝇肿瘤细胞迁移效应
Table 2 Binary mixture effects of lindane and TET on the tumor migration in Drosophila melanogaster
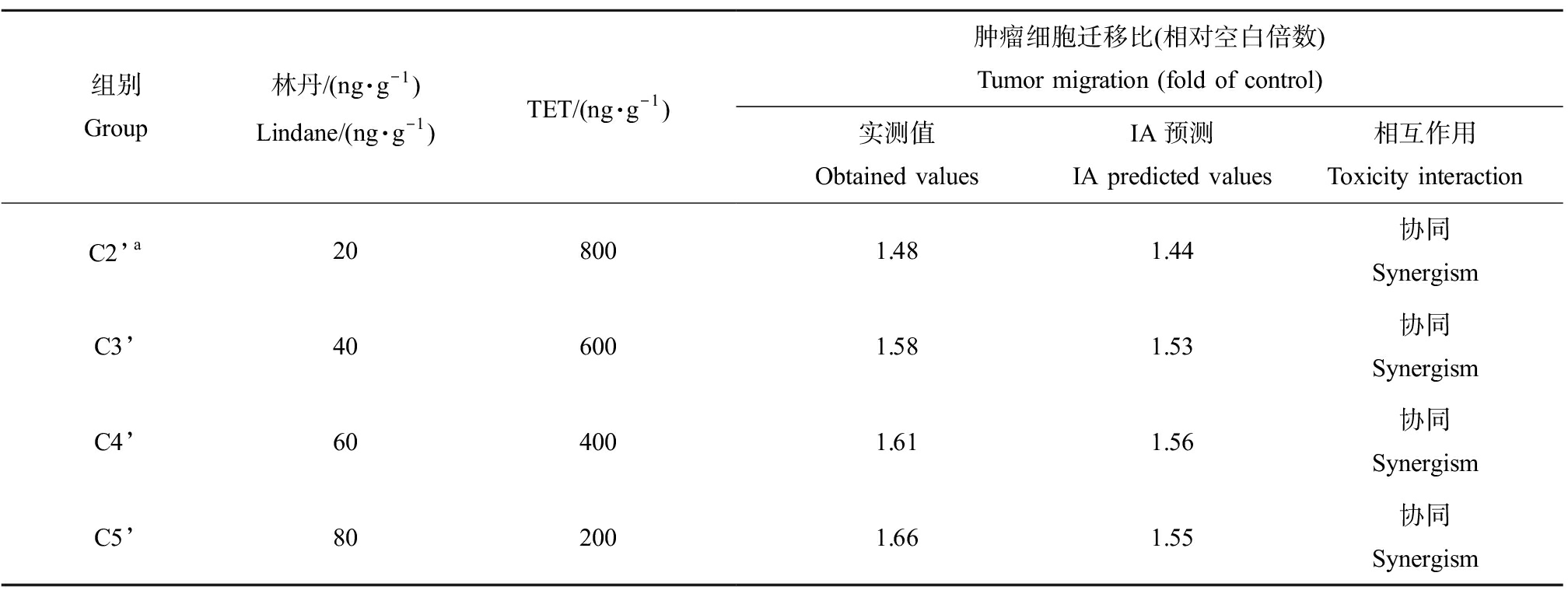
组别Group林丹/(ng·g-1)Lindane/(ng·g-1)TET/(ng·g-1)肿瘤细胞迁移比(相对空白倍数) Tumor migration (fold of control)实测值Obtained valuesIA预测IA predicted values相互作用Toxicity interactionC2’a208001.481.44协同 SynergismC3’406001.581.53协同 SynergismC4’604001.611.56协同 SynergismC5’802001.661.55协同 Synergism
注:a, C1’组为1 000 ng·g-1TET的单独暴露组,C6’组为100 ng·g-1林丹的单独暴露组。
Note: a, C1’ or C6’ group represented individual exposure to 1 000 ng·g-1TET or 100 ng·g-1lindane.
以抗生素、OCPs为代表的新、旧污染物间的毒性相互作用,为评价环境污染物的健康危害提供重要信息。已有研究表明OCPs能够与抗生素等新污染物共存于环境介质甚至食品中[8]。本研究发现二者对肿瘤细胞迁移效应中的协同作用,表明环境介质中OCPs等旧污染物与抗生素等新污染物的结合将显著增加混合物诱发癌症等环境健康风险。值得注意的是,人体组织样品中普遍检出OCPs等旧的POPs[1],并能够对人体神经、内分泌、生殖等疾病、甚至癌症具备显著贡献[5-6]。本研究表明,使用抗生素的疾病治疗方法,需要考虑病人体内其他污染物的赋存现状,避免污染物与药物的相互作用干扰治疗结果甚至危害健康。
2.3 林丹单独暴露、与SMX或TET联合暴露对抗氧化体系干扰作用
对林丹及其与SMX或TET联合暴露下对ROS、SOD、CAT、GSH和MDA的效应如表3和表4所示。对数据进行Pearson与Spearman相关性分析发现(表4),林丹与SMX的联合作用中,肿瘤细胞迁移效应与CAT呈负相关(Spearman,-0.8857, P<0.05),ROS与MDA呈正相关(Pearson, 0.8183, P<0.05),SOD与GSH呈正相关(Pearson, 0.8726, P<0.05; Spearman, 0.8857, P<0.05);林丹与TET的联合作用中,SOD与CAT呈正相关(Pearson, 0.8297, P<0.05)。根据聚类分析结果(图2),林丹与SMX联合作用对肿瘤细胞迁移的效应中,CAT与GSH关系最为密切,ROS和SOD共同与肿瘤细胞迁移密切关联;林丹与TET的联合作用对肿瘤细胞迁移的效应中,CAT与GSH的关系依然最为密切,与林丹和SMX相似;但ROS与肿瘤细胞迁移的关联密切,与林丹和SMX的混合物效应显著不同。
表3 林丹(C6)与SMX(C1)及其二元混合物诱发黑腹果蝇肿瘤细胞迁移效应与抗氧化响应
Table 3 Effects of lindane(C6)and SMX(C1)and their binary mixtures on the tumor migration and antioxidant responses in Drosophila melanogaster
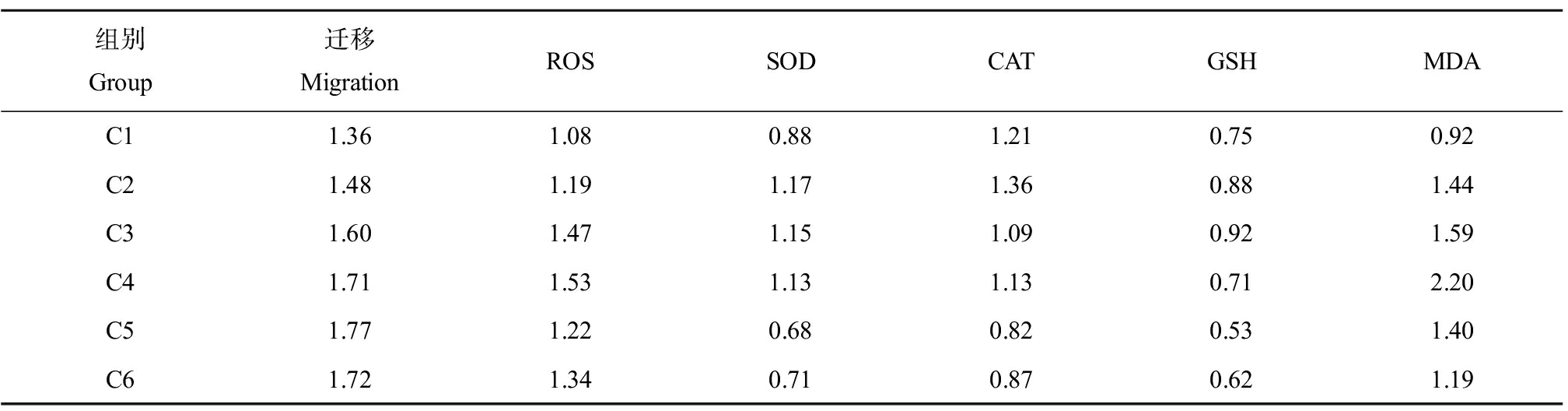
组别Group迁移MigrationROSSODCATGSHMDAC11.361.080.881.210.750.92C21.481.191.171.360.881.44C31.601.471.151.090.921.59C41.711.531.131.130.712.20C51.771.220.680.820.531.40C61.721.340.710.870.621.19
注:表中数据为相对空白组的倍数。
Note: Data were represented as fold changes against the control.
表4 林丹(C6’)与TET(C1’)及其二元混合物诱发黑腹果蝇肿瘤细胞迁移效应与抗氧化响应
Table 4 Effects of lindane(C6’)and TET(C1’)and their binary mixtures on the tumor migration and antioxidant responses in Drosophila melanogaster
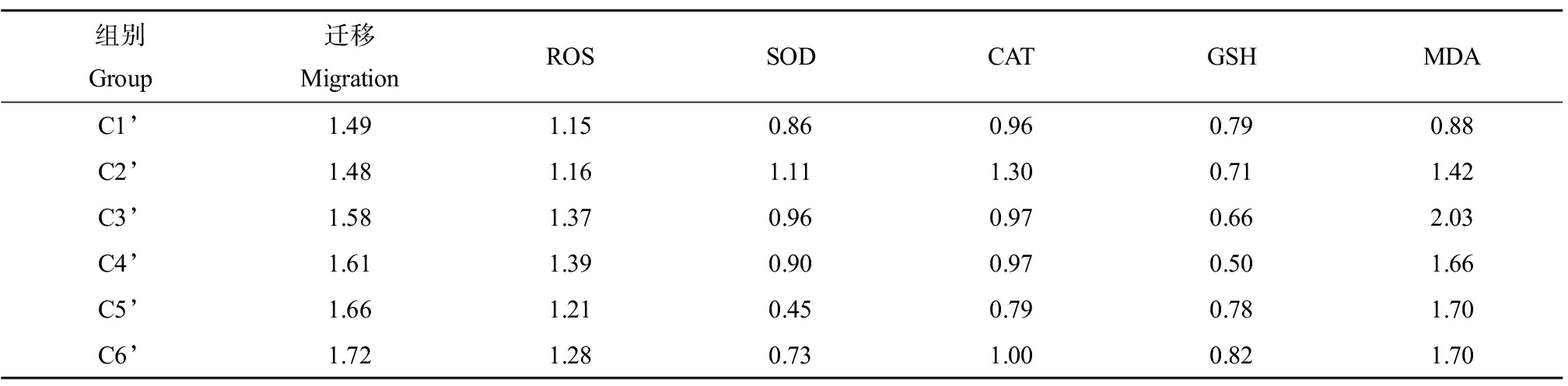
组别Group迁移MigrationROSSODCATGSHMDAC1’1.491.150.860.960.790.88C2’1.481.161.111.300.711.42C3’1.581.370.960.970.662.03C4’1.611.390.900.970.501.66C5’1.661.210.450.790.781.70C6’1.721.280.731.000.821.70
注:表中数据为相对空白组的倍数。
Note: Data were represented as fold changes against the control.
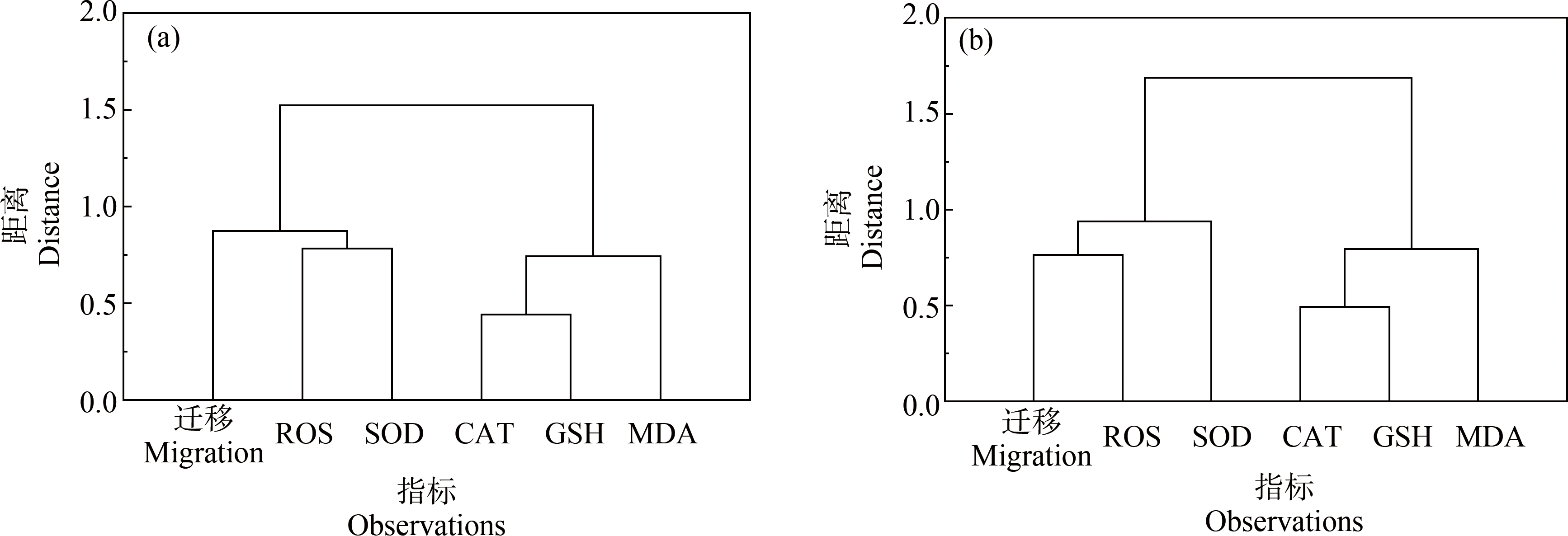
图2 林丹与SMX(a)、林丹与TET(b)诱发黑腹果蝇肿瘤细胞迁移及抗氧化响应的聚类分析
Fig. 2 Hierarchical cluster analysis on the effects of lindane and SMX(a), and lindane and TET(b)on the tumor cell migration and antioxidant responses in Drosophila melanogaster
肿瘤细胞迁移与氧化应激响应的密切关系早有报道。外源污染物产生的ROS促发EMT等肿瘤细胞迁移关键环节[23-24];抗氧化系统既能够清除ROS,也能够提升癌细胞活跃程度,并为其EMT等过程发挥抗氧化保护,促进癌细胞的迁移[25-26];MDA作为脂质过氧化的生物标志物,也与肺癌密切相关[28]。因此,本研究中二元混合物诱发肿瘤细胞迁移过程中,ROS与MDA、SOD与GSH、SOD与CAT之间的正相关关系,以及肿瘤细胞迁移与ROS/SOD的密切关联,均与上述报道相一致。值得注意的是,ROS、氧化胁迫与抗氧化响应在林丹、抗生素及其二者混合物诱发癌症细胞迁移中的具体过程与角色,尚需进一步研究予以确认。
林丹与SMX的联合作用中,肿瘤细胞迁移效应与CAT呈负相关,一方面是因为林丹浓度逐渐上升、诱发肿瘤细胞迁移效应增强[21],同时林丹产生的ROS增多[29],损害抗氧化响应;另一方面,SMX单独作用能够刺激CAT增加[35],但随其在混合物中的浓度降低,刺激效应减弱,无法抵抗林丹的氧化胁迫。该结果也说明林丹与SMX在诱发肿瘤细胞迁移过程中氧化应激发挥关键作用。与此同时,TET单独作用及其与其他污染物(例如重金属)联合作用时,对CAT等抗氧化酶普遍产生抑制效应[36-37],因而表现出与SMX、林丹联合作用不同的效应。
林丹与SMX、林丹与TET的联合作用在聚类分析中表现出不同的结果,可能与2种抗生素自身的生物效应相关。SMX的主要抗菌途径是干扰病原菌叶酸代谢,从而影响DNA合成。TET的主要抗菌机制是与细菌核蛋白体30S亚单位在A位特异性结合,阻止氨基酸肽链延伸和细菌蛋白质合成。研究表明,抗生素能够对肠道菌产生影响[32, 38],继而干扰叶酸与氨基酸合成,最终对氧化应激产生不同程度的影响[39-41]。该推测尚需进一步的机理研究予以证实。
综上,本文研究了环境浓度条件下林丹与不同抗生素对黑腹果蝇肿瘤细胞迁移的联合毒性,发现2类化学品毒性间的协同作用,因此OCPs等持久性有机污染物、抗生素等新污染物联合作用的环境危害亟待进一步关注。同时,林丹、SMX和TET诱发肿瘤细胞迁移过程中,显著影响了氧化应激响应;而且,林丹与SMX、林丹与TET的二元混合物结果表明抗生素的类别能够显著影响二元混合物诱发氧化应激的响应模式,潜在机理尚需进一步研究,进而揭示混合物毒性效应机制。
[1] Abass K, Unguryanu T, Junqué E, et al.Pilot study on the concentrations of organochlorine compounds and potentially toxic elements in pregnant women and local food items from the Finnish Lapland[J].Environmental Research, 2022, 211: 113122
[2] 刘明丽.长江流域水相、沉积相中多溴联苯醚及有机氯农药的污染特征和风险评价[D].北京: 北京交通大学, 2018
Liu M L.Characteristics and risk assessment of polybrominated diphenyl ethers and organochlorine pesticides in water and sediment of the Yangtze River Basin[D].Beijing: Beijing Jiaotong University, 2018(in Chinese)
[3] 周晓芳, 高良敏, 陈晓晴, 等.杨庄煤矿区农田塌陷水域多介质OCPs污染特征及生态风险研究[J].农业环境科学学报, 2020, 39(5): 1085-1093
Zhou X F, Gao L M, Chen X Q, et al.Pollution characteristics and ecological risks of organochlorine pesticides in multiple-media of farmland subsidence water in Yangzhuang coal mine area, China[J].Journal of Agro-Environment Science, 2020, 39(5): 1085-1093(in Chinese)
[4] 魏抱楷.典型有毒有机污染物在农作物中迁移规律的研究[D].北京: 中央民族大学, 2020
Wei B K.Study on the migration law of typical toxic organic pollutants in crops[D].Beijing: Central University for Nationalities, 2020(in Chinese)
[5] Vijgen J, Fokke B, van de Coterlet G, et al.European cooperation to tackle the legacies of hexachlorocyclohexane(HCH)and lindane[J].Emerging Contaminants, 2022, 8: 97-112
[6] Polanco Rodríguez  G, Riba López M I, DelValls Casillas T
G, Riba López M I, DelValls Casillas T  , et al.Monitoring of organochlorine pesticides in blood of women with uterine cervix cancer[J].Environmental Pollution, 2017, 220(Pt B): 853-862
, et al.Monitoring of organochlorine pesticides in blood of women with uterine cervix cancer[J].Environmental Pollution, 2017, 220(Pt B): 853-862
[7] Loomis D, Guyton K, Grosse Y, et al.Carcinogenicity of lindane, DDT, and 2,4-dichlorophenoxyacetic acid[J].The Lancet Oncology, 2015, 16(8): 891-892
[8] Eissa F, Ghanem K, Al-Sisi M.Occurrence and human health risks of pesticides and antibiotics in Nile tilapia along the Rosetta Nile Branch, Egypt[J].Toxicology Reports, 2020, 7: 1640-1646
[9] Tang J P, Wang S, Tai Y P, et al.Evaluation of factors influencing annual occurrence, bioaccumulation, and biomagnification of antibiotics in planktonic food webs of a large subtropical river in South China[J].Water Research, 2020, 170: 115302
[10] Jansomboon W, Boontanon S K, Boontanon N, et al.Monitoring and determination of sulfonamide antibiotics(sulfamethoxydiazine, sulfamethazine, sulfamethoxazole and sulfadiazine)in imported Pangasiuscatfish products in Thailand using liquid chromatography coupled with tandem mass spectrometry[J].Food Chemistry, 2016, 212: 635-640
[11] Liu Y H, Chen Y, Feng M J, et al.Occurrence of antibiotics and antibiotic resistance genes and their correlations in river-type drinking water source, China[J].Environmental Science and Pollution Research International, 2021, 28(31): 42339-42352
[12] Gu J Y, Chen C Y, Huang X Y, et al.Occurrence and risk assessment of tetracycline antibiotics in soils and vegetables from vegetable fields in Pearl River Delta, South China[J].Science of the Total Environment, 2021, 776: 145959
[13] Yang Y, Qiu W Q, Li Y X, et al.Antibiotic residues in poultry food in Fujian Province of China[J].Food Additives &Contaminants Part B, Surveillance, 2020, 13(3): 177-184
[14] Zainab S M, Junaid M, Xu N, et al.Antibiotics and antibiotic resistant genes(ARGs)in groundwater: A global review on dissemination, sources, interactions, environmental and human health risks[J].Water Research, 2020, 187: 116455
[15] 冯琳钧, 许瀚文, 王艺霏, 等.3种β-内酰胺类抗生素对大型溞毒性影响的研究[J].环境科学与技术, 2020, 43(12): 1-7
Feng L J, Xu H W, Wang Y F, et al.Effects of threeβ-lactam antibiotics on Daphnia magnatoxicity[J].Environmental Science &Technology, 2020, 43(12): 1-7(in Chinese)
[16] 杜明磊.三种抗生素对两种纤毛虫的毒性效应研究[D].哈尔滨: 哈尔滨师范大学, 2020
Du M L.Research on the toxicity of three antibiotics to two ciliates[D].Harbin: Harbin Normal University, 2020(in Chinese)
[17] 钱坤, 任连泉, 王敬, 等.常见抗生素类兽药对作物的遗传毒性研究分析[J].畜禽业, 2020, 31(4): 23
Qian K, Ren L Q, Wang J, et al.Study on genetic toxicity of common antibiotic veterinary drugs to crops[J].Livestock and Poultry Industry, 2020, 31(4): 23(in Chinese)
[18] 刘仁彬, 姜锦林, 张宇峰, 等.磺胺甲恶唑对斑马鱼胚胎/仔鱼的毒性效应[J].环境污染与防治, 2020, 42(3): 310-316
Liu R B, Jiang J L, Zhang Y F, et al.Toxic effects of sulfamethoxazole on zebrafish(Danio rerio)embryo/larva[J].Environmental Pollution &Control, 2020, 42(3): 310-316(in Chinese)
[19] Zhang L W, Zhu Z J, Yan H W, et al.Creatine promotes cancer metastasis through activation of Smad2/3[J].Cell Metabolism, 2021, 33(6): 1111-1123.e4
[20] Gui P, Bivona T G.Evolution of metastasis: New tools and insights[J].Trends in Cancer, 2022, 8(2): 98-109
[21] 沈佳颖, 于振洋, 尹大强, 等.林丹通过MAPK和UPR通路与干扰线粒体功能诱导黑腹果蝇(Drosophila melanogaster)肿瘤细胞迁移[J].生态毒理学报, 2018, 13(5): 97-109
Shen J Y, Yu Z Y, Yin D Q, et al.Tumor cell migration of Drosophila melanogasterby lindane exposure with involvement of MAPK and UPR pathways and mitochondrial dysfunction[J].Asian Journal of Ecotoxicology, 2018, 13(5): 97-109(in Chinese)
[22] Pinato D J, Howlett S, Ottaviani D, et al.Association of prior antibiotic treatment with survival and response to immune checkpoint inhibitor therapy in patients with cancer[J].JAMA Oncology, 2019, 5(12): 1774-1778
[23] Cai J H, Xia L M, Li J L, et al.Tumor-associated macrophages derived TGF-β-induced epithelial to mesenchymal transition in colorectal cancer cells through Smad2,3-4/snail signaling pathway[J].Cancer Research and Treatment, 2019, 51(1): 252-266
[24] Liao Z H, Chua D, Tan N S.Reactive oxygen species: A volatile driver of field cancerization and metastasis[J].Molecular Cancer, 2019, 18(1): 65
[25] Blazquez R, Rietkötter E, Wenske B, et al.LEF1supports metastatic brain colonization by regulating glutathione metabolism and increasing ROS resistance in breast cancer[J].International Journal of Cancer, 2020, 146(11): 3170-3183
[26] Ogata F T, Simões Sato A Y, Coppo L, et al.Thiol-based antioxidants and the epithelial/mesenchymal transition in cancer[J].Antioxidants &Redox Signaling, 2022, 36(13-15): 1037-1050
[27] Zińczuk J, Maciejczyk M, Zaręba K, et al.Pro-oxidant enzymes, redox balance and oxidative damage to proteins, lipids and DNA in colorectal cancer tissue.Is oxidative stress dependent on tumour budding and inflammatory infiltration?[J].Cancers, 2020, 12(6): 1636
[28] Otsmane A, Kacimi G, Adane S, et al.Clinico-epidemiological profile and redox imbalance of lung cancer patients in Algeria[J].Journal of Medicine and Life, 2018, 11(3): 210-217
[29] Yu Y J, Chen H B, Hua X, et al.Long-term toxicity of lindane through oxidative stress and cell apoptosis in Caenorhabditis elegans[J].Environmental Pollution, 2021, 272: 116036
[30] Zheng Y G, Yu Z Y, Zhang J.Multi-generational effects of enrofloxacin on lifespan and reproduction of Caenorhabditis eleganswith SKN-1-mediated antioxidant responses and lipid metabolism disturbances[J].Science of the Total Environment, 2022, 804: 150250
[31] Srivastava A.A protocol for genetic induction and visualization of benign and invasive tumors in cephalic complexes of Drosophila melanogaster[J].Journal of Visualized Experiments, 2013, 79: 50624
[32] Yu Z Y, Shen J Y, Li Z, et al.Obesogenic effect of sulfamethoxazole on Drosophila melanogasterwith simultaneous disturbances on eclosion rhythm, glucolipid metabolism, and microbiota[J].Environmental Science &Technology, 2020, 54(9): 5667-5675
[33] Dou R N, Liu S S, Mo L Y, et al.A novel direct equipartition ray design(EquRay)procedure for toxicity interaction between ionic liquid and dichlorvos[J].Environmental Science and Pollution Research International, 2011, 18(5): 734-742
[34] 刘树深, 刘玲, 陈浮.浓度加和模型在化学混合物毒性评估中的应用[J].化学学报, 2013, 71(10): 1335-1340
Liu S S, Liu L, Chen F.Application of the concentration addition model in the assessment of chemical mixture toxicity[J].Acta Chimica Sinica, 2013, 71(10): 1335-1340(in Chinese)
[35] Yu Z Y, Yin D Q, Hou M F, et al.Effects of food availability on the trade-off between growth and antioxidant responses in Caenorhabditis elegansexposed to sulfonamide antibiotics[J].Chemosphere, 2018, 211: 278-285
[36] Han T, Liang Y P, Wu Z N, et al.Effects of tetracycline on growth, oxidative stress response, and metabolite pattern of ryegrass[J].Journal of Hazardous Materials, 2019, 380: 120885
[37] Man Y C, Zhang H, Huang J, et al.Combined effect of tetracycline and copper ion on catalase activity of microorganisms during the biological phosphorus removal[J].Journal of Environmental Management, 2022, 304: 114218
[38] Garrido-Mesa J, Algieri F, Rodríguez-Nogales A, et al.Immunomodulatory tetracyclines ameliorate DNBS-colitis: Impact on microRNA expression and microbiota composition[J].Biochemical Pharmacology, 2018, 155: 524-536
[39] Boonma T, Navasumrit P, Parnlob V, et al.SAM and folic acid prevent arsenic-induced oxidative and nitrative DNA damage in human lymphoblast cells by modulating expression of inflammatory and DNA repair genes[J].Chemico-Biological Interactions, 2022, 361: 109965
[40] Nadeesha Dilrukshi H N, Torrico D D, Brennan M A, et al.Effects of extrusion processing on the bioactive constituents, in vitrodigestibility, amino acid composition, and antioxidant potential of novel gluten-free extruded snacks fortified with cowpea and whey protein concentrate[J].Food Chemistry, 2022, 389: 133107
[41] Andlid T A, D’Aimmo M R, Jastrebova J.Folate and Bifidobacteria[M].Pittsburg: Academic Press, 2018: 195-212