我国是全球最大的染料生产和消费国,约有500家染料企业,生产供应2 000多种主要染料产品,年产染料77~93万t,约占全球总产量的70%[1]。染料生产过程中会产生大量废水,截至2015年,我国年排放染料废水达3亿t[2]。染料生产原料种类多、生产工艺长、产品收率低,因此,染料废水通常具有有机物浓度高、色度深、高盐高毒和难生物降解等特点[3]。染料废水“高浓度”“高盐度”“难降解”三大特性使得生物处理效率大幅降低甚至失效,生物处理出水仍含有大量难降解有机物,且水体色度较高,若不对其加以妥善处理,将会严重威胁受纳环境的生态安全。
臭氧催化氧化技术因为高效、便捷、二次污染低,成为难降解工业废水中广泛应用的高级氧化技术(advanced oxidation process, AOPs)。向臭氧体系投加催化剂可以催化臭氧(O3,2.07 V)分解产生氧化能力更强的羟基自由基(·OH,2.80 V),氧化甚至矿化臭氧难以降解的小分子物质[4]。值得注意的是,使用AOPs技术处理难降解工业废水具有一定优势,能够很好地氧化去除难降解有机物,但在处理含盐(主要指Cl-和Br-)废水时,存在生成可吸附有机卤素(adsorbable organic halogens, AOX)的风险,可能使得排水毒性不降反升[5]。已有研究指出在高级氧化体系中,卤素离子(X-)会被氧化生成含卤自由基(X·)。在高浓度X-环境中,X·与X-极易生成氧化活性较弱的![]() 从而降低整个体系对有机物的去除效率,增大氧化剂用量成本[6]。同时,反应生成的一系列活性含卤自由基(如
从而降低整个体系对有机物的去除效率,增大氧化剂用量成本[6]。同时,反应生成的一系列活性含卤自由基(如![]() 和
和![]() 等)也具有一定氧化能力,能够与有机物反应生成多种有毒甚至致癌的卤代有机副产物。Xie等[5]使用UV/H2O2和紫外/过氧二硫酸盐(UV/PDS)工艺处理焦化废水膜生物反应器出水,发现2种工艺出水AOX浓度随着初始Cl-浓度的升高而升高,出水对青海弧菌Q67发光抑制作用不断增强。Fang等[7]使用钴/过氧一硫酸盐(Co/PMS)工艺处理含盐废水时,发现Cl-的存在使得体系内AOX浓度升高,出水对明亮发光杆菌T3急性毒性增强。因此,在使用AOPs技术处理难降解含盐废水时,不仅需要考虑如何尽可能地提高污染物去除效果,还应该评估处理后的废水毒性,确保实现废水的减毒处理,否则有毒有害物质的长期积累可能会对生态系统和人体健康造成严重威胁[8-9]。目前,国内外研究学者多采用生物毒性实验评价废水毒性,取得了较好的研究成果。张瑛等[10]使用4种微藻评估了不同行业废水的急性毒性效应,结果发现不同行业废水对4种微藻的急性毒性效应有所不同,印染废水及城市污水处理厂的进出水对海水小球藻的毒性较为显著,制药废水对斜生栅藻的毒性效应最为明显。武毛妮等[11]使用小球藻对生活污水处理厂各个处理单元进出水的生物毒性进行检测,结果发现污水的生物毒性与COD表现出良好的相关性,生物毒性随着污染物的去除明显降低。Magdeburg等[12]使用了5种生物对臭氧氧化工艺出水的综合毒性进行评估,结果发现出水对其中3种生物的毒性增强。
等)也具有一定氧化能力,能够与有机物反应生成多种有毒甚至致癌的卤代有机副产物。Xie等[5]使用UV/H2O2和紫外/过氧二硫酸盐(UV/PDS)工艺处理焦化废水膜生物反应器出水,发现2种工艺出水AOX浓度随着初始Cl-浓度的升高而升高,出水对青海弧菌Q67发光抑制作用不断增强。Fang等[7]使用钴/过氧一硫酸盐(Co/PMS)工艺处理含盐废水时,发现Cl-的存在使得体系内AOX浓度升高,出水对明亮发光杆菌T3急性毒性增强。因此,在使用AOPs技术处理难降解含盐废水时,不仅需要考虑如何尽可能地提高污染物去除效果,还应该评估处理后的废水毒性,确保实现废水的减毒处理,否则有毒有害物质的长期积累可能会对生态系统和人体健康造成严重威胁[8-9]。目前,国内外研究学者多采用生物毒性实验评价废水毒性,取得了较好的研究成果。张瑛等[10]使用4种微藻评估了不同行业废水的急性毒性效应,结果发现不同行业废水对4种微藻的急性毒性效应有所不同,印染废水及城市污水处理厂的进出水对海水小球藻的毒性较为显著,制药废水对斜生栅藻的毒性效应最为明显。武毛妮等[11]使用小球藻对生活污水处理厂各个处理单元进出水的生物毒性进行检测,结果发现污水的生物毒性与COD表现出良好的相关性,生物毒性随着污染物的去除明显降低。Magdeburg等[12]使用了5种生物对臭氧氧化工艺出水的综合毒性进行评估,结果发现出水对其中3种生物的毒性增强。
针对我国染料废水处理效率低、容易生成AOX等问题,本研究以某大型染料企业分散染料生物处理出水为研究对象,开展基于臭氧催化氧化技术处理染料废水的研究,并通过蛋白核小球藻和青海弧菌Q67对处理出水生物毒性进行评估,确定最佳反应工艺,从而为难降解染料废水的减毒处理提供思路与解决办法,为地方和企业决策提供参考依据。
本研究所用碳基锰催化剂制备方法详见此前研究[13]。主要药品:高锰酸钾(KMnO4)为分析纯,购自中国上海沪试;浓硝酸(HNO3)为分析纯,购自中国北京蓝弋化工;氢氧化钠(NaOH)为分析纯,购自中国上海泰坦;亚硫酸钠(Na2SO3)为分析纯,购自中国上海泰坦;硝酸钠(NaNO3)为分析纯,购自中国西陇;二氯甲烷(CH2Cl2)为分析纯,购自中国国药;无水硫酸钠(Na2SO4)为分析纯,购自中国北京化工;过氧化氢(H2O2)为分析纯,购自中国北京蓝弋化工;甲醇(CH3OH)为色谱纯,购自美国费希尔;碘化钾(KI)纯度为99%,购自中国上海迈瑞尔;二甲基亚砜(DMSO)纯度为99%,购自中国上海迈瑞尔;5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)纯度为97%,购自中国上海源叶生物。实验所用蛋白核小球藻(C. pyrenoidosa)购自南京海洱斯生物科技有限公司,培养温度为(25±1)℃,光暗周期比为14 h∶10 h。实验所用青海弧菌Q67(V. qinghaiensissp.-Q67)由中国科学院生态环境研究中心提供,保存于4 ℃冰箱。培养方法参照马梅等[14]的研究。研究所用水样基本水质指标如表1所示。
表1 研究水样基本水质指标
Table 1 Characteristics of water samples
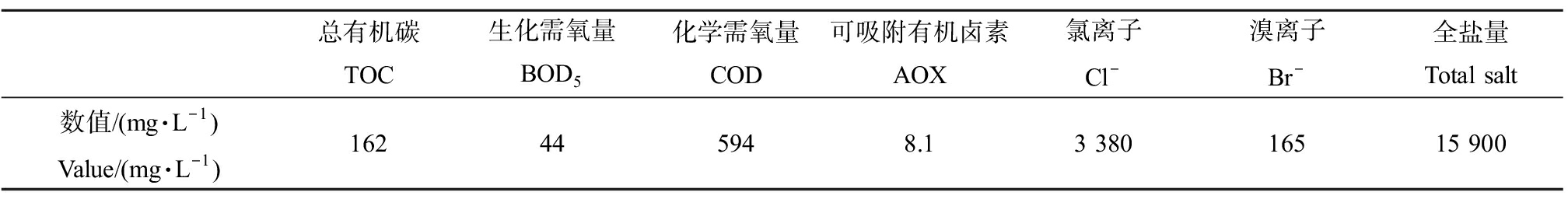
总有机碳TOC生化需氧量BOD5化学需氧量COD可吸附有机卤素AOX氯离子Cl-溴离子Br-全盐量Total salt数值/(mg·L-1)Value/(mg·L-1)162445948.13 38016515 900
1.2.1 碳基锰催化臭氧氧化处理染料废水
实验反应体积为500 mL,臭氧浓度为40 mg·L-1,臭氧流量为0.5 L·min-1,催化剂投加量为1.0 g·L-1,H2O2投加量为1 000 μmol·L-1。反应总时长为90 min,取样时间为0、5、15、30、45、60和90 min。为淬灭水样中残留的活性自由基,取样时分别向2份经0.45 μm滤膜过滤的15 mL水样中加入1 mL 0.2 mol·L-1亚硫酸钠溶液和1 mL甲醇,分别用于测定水样中的TOC和AOX指标(考虑到AOX指标受亚硫酸钠影响较大,故选择甲醇作为淬灭剂)。
1.2.2 出水对蛋白核小球藻的生长抑制作用
实验容器为10 mL的洁净透明玻璃瓶,经高温灭菌后使用。实验选取处于对数生长期的小球藻,采用酶标仪计数法确定藻细胞浓度。取一定体积的水样,加入到含有小球藻的培养基中,确保体系终体积为5 mL,小球藻初始密度为1.0×106cells·mL-1。经过预实验发现,当实验水样体积占比为20%(即添加量为1 mL)时较为合适,此时水体色度对小球藻生长的影响可以忽略。添加完样品的小瓶经无菌透气封口膜密封后,放置于光照培养箱中培养,暴露期间需早晚各摇藻一次以使其良好生长,96 h后确定藻细胞浓度,通过式(1)计算其生长率,之后带入式(2)计算藻类生长抑制率。
(1)
式中:μ为藻的平均生长率;t为培养时间(d);Nt为培养t(d)后藻细胞浓度;N0为藻细胞初始浓度;
(2)
式中:α为生长抑制率;μ0为空白组藻的平均生长率;μc为实验组藻的平均生长率。
1.2.3 出水对青海弧菌Q67的生长抑制作用
将保存的青海弧菌Q67斜面菌种接种到新鲜斜面,置于22 ℃恒温培养箱内培养24 h。完成培养后,将菌种接种到15 mL液体培养基中,于22 ℃、180 r·min-1条件下培养16~18 h。将完成培养的发光细菌培养液于2 000 r·min-1离心10 min,弃去上清液,保留菌体并用模拟湖水制成菌悬液,调整菌液密度,控制起始发光量在200万~600万光子单位之间。接着,向96孔白板的每孔中加入90 μL模拟湖水、90 μL样品(每个样品设置3个平行,以模拟湖水作为空白对照)和20 μL菌悬液,于恒温96孔平板摇床混匀,培养15 min后用酶标仪测定相对发光强度(relative light units, RLU)。最后,根据式(3)计算样品的相对发光抑制率。
相对发光抑制率![]()
(3)
式中:RLU0为空白对照相对发光强度;RLUc为样品相对发光强度。
臭氧浓度使用臭氧检测仪(德国安索罗斯,GM-6000-OEM)检测。TOC使用总有机碳分析仪(日本岛津,TOC-VCPH)检测。溶解性有机物组分分布情况使用荧光分光光度计(日本日立,F-7100)测定,激发波长(Ex)为200~350 nm,发射波长(Em)为210~500 nm,扫描速度为60 000 nm·min-1,采样间隔和狭缝均为5 nm,测定时扣除超纯水空白。腐殖化程度分析使用紫外-可见分光光度计(日本岛津,UV-2450)测量,扫描范围为220~700 nm,扫描间隔1 nm。AOX使用总有机卤素分析仪(德国耶拿,Multi X2500)测定,测试方法参考颉亚玮[15]的研究。有机物组成及降解产物分析使用气相色谱-质谱联用仪(日本岛津,GCMS-QP2010)测定。活性物种变化分析使用电子顺磁共振波谱仪(日本JEOL,FA-200)检测。检测·OH时,以5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)为捕获剂,水为溶剂;检测![]() 时,以DMPO为捕获剂,DMSO为溶剂。
时,以DMPO为捕获剂,DMSO为溶剂。
4种氧化工艺对染料废水TOC和AOX的去除效果分别如图1所示。随着反应进行,4种氧化工艺对染料废水TOC去除率不断升高。反应90 min时,O3、O3/H2O2、MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺对TOC去除率分别为27.8%、12.9%、36.9%和67.6%。其中,MnOx-GAC/O3/H2O2工艺对TOC去除效果最好,TOC去除率较单纯臭氧氧化升高了39.8%,较MnOx-GAC/O3工艺提高了30.7%,表明加入H2O2会显著提高TOC去除效果。
由图1(b)可知,不同工艺对AOX去除率均是先升高后降低,表明体系内AOX经历了氧化去除和氧化生成2个阶段。在氧化去除AOX阶段,可以发现MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺对AOX去除速率明显高于O3和O3/H2O2工艺,在30 min内即可去除约50% AOX,而O3和O3/H2O2工艺在45 min时才能达到同样的效果。在氧化生成AOX阶段,MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺较O3和O3/H2O2工艺更容易反应生成AOX。这可能是因为MnOx-GAC/O3和MnOx-GAC/O3/H2O2体系内的自由基含量较高,使得因自由基氧化生成的含卤自由基较多,进而与未降解完全的小分子有机物反应生成AOX。并且,研究发现加入H2O2对AOX去除效果没有显著影响,O3/H2O2工艺对AOX去除效果与O3工艺相近,MnOx-GAC/O3/H2O2工艺对AOX去除效果与MnOx-GAC/O3相近。

图1 不同氧化工艺对TOC(a)和AOX(b)去除效果图
Fig. 1 Removal effects on TOC(a)and AOX(b)by different oxidation processes
2.2.1 溶解性有机物组分变化
利用三维荧光光谱技术分析不同氧化工艺处理90 min时出水溶解性有机物(dissolved organic matter, DOM)组成情况,结果如图2所示。可以发现,染料废水中的DOM组成复杂,在5个分区内均有分布,以Ⅱ区(简单的芳香蛋白,色氨酸类蛋白质)和Ⅳ区(溶解性微生物代谢产物)为主。经过氧化处理90 min时,可以发现水中大部分的DOM被去除,残留DOM主要分布在Ⅰ区、Ⅱ区和Ⅳ区。其中,O3氧化处理水中DOM总荧光强度相应降低了80.8%,很好地氧化去除了类富里酸和腐殖质酸物质,但对一些类蛋白物质和低分子量的微生物代谢产物去除效果不佳。MnOx-GAC/O3工艺处理水中DOM总荧光强度相应降低了88.7%,对DOM氧化去除效率更高,对O3体系难以去除的类蛋白物质和小分子代谢产物具有更好的去除效果。MnOx-GAC/O3/H2O2工艺处理水中DOM总荧光强度相应降低了87.3%,与MnOx-GAC/O3氧化效果相近,表明向MnOx-GAC/O3体系加入1 000 μmol·L-1的H2O2对水中DOM组分去除无显著影响。

图2 不同氧化处理出水溶解性有机物(DOM)组分分析
注:(a)染料废水,(b)O3氧化,(c)MnOx-GAC/O3氧化,(d)MnOx-GAC/O3/H2O2氧化。
Fig.2 Component analysis of dissolved organic matter(DOM)in effluent by 90 min treatment of different processes
Note:(a)dye wastewater;(b)O3oxidation;(c)MnOx-GAC/O3oxidation;(d)MnOx-GAC/O3/H2O2oxidation.
2.2.2 有机物组成及降解产物分析
使用GC-MS检测了不同氧化工艺处理90 min时出水有机物组成情况。未经处理的染料废水中的有机物组成情况如图3(a)所示,可以发现原水中的有机物成分复杂,主要包括两大类:一类是保留时间在0~7.5 min的低分子量卤代烃类,另一类是保留时间在11~22 min的卤代芳香族化合物和长链化合物。经过O3、MnOx-GAC/O3和MnOx-GAC/O3/H2O2氧化处理90 min后,可以发现水中大部分卤代芳香族化合物被去除,生成了较多种类的长链化合物和低分子量卤代烃物质。相比于原水,O3氧化工艺处理出水(图3(b))中的低分子量卤代烃类物质种类和数目增多,以二氯二溴乙烷为主;相比于O3工艺处理出水,MnOx-GAC/O3工艺处理出水(图3(c))中的低分子量卤代烃物质含量降低,以三溴甲烷为主;MnOx-GAC/O3/H2O2工艺处理出水(图3(d))低分子量卤代烃类物质含量最低。

图3 不同反应工艺出水有机物GC-MS谱图
注:(a)染料废水;(b)O3氧化;(c)MnOx-GAC/O3氧化;(d)MnOx-GAC/O3/H2O2氧化。
Fig.3 GC-MS spectra of organic matter in effluent by different processes
Note:(a)dye wastewater;(b)O3oxidation;(c)MnOx-GAC/O3oxidation;(d)MnOx-GAC/O3/H2O2oxidation.
不同氧化工艺出水有机物组分峰面积分布情况如图4所示,可以发现氧化处理对水中酚类、苯胺类和炔类等还原性较强的物质去除效果较好,几乎可以实现完全去除;经氧化后,体系内的卤代烃和烷烃类化合物明显增加。其中,相比于O3和MnOx-GAC/O3工艺,MnOx-GAC/O3/H2O2工艺有效减少卤代烃物质的产生,表明加入H2O2减少了卤代烃的生成。

图4 不同氧化工艺出水有机物峰面积图
Fig. 4 Peak area diagram of organic matter in effluent by different processes
不同氧化处理体系中的DMPO-OH和DMPO-*OOH信号变化情况分别如图5所示,2个信号分别代表了·OH和![]() 自由基,2种自由基相对定量分析结果如表2所示。可以发现向O3体系添加MnOx-GAC和H2O2均可以增加体系内·OH含量,4种体系中的·OH自由基含量:MnOx-GAC/O3/H2O2>MnOx-GAC/O3>O3/H2O2>O3。其中,MnOx-GAC/O3/H2O2和MnOx-GAC/O3体系内·OH自由基含量分别较O3氧化体系提高了2.21倍和1.86倍,这也是2种工艺TOC去除率较高的重要原因。
自由基,2种自由基相对定量分析结果如表2所示。可以发现向O3体系添加MnOx-GAC和H2O2均可以增加体系内·OH含量,4种体系中的·OH自由基含量:MnOx-GAC/O3/H2O2>MnOx-GAC/O3>O3/H2O2>O3。其中,MnOx-GAC/O3/H2O2和MnOx-GAC/O3体系内·OH自由基含量分别较O3氧化体系提高了2.21倍和1.86倍,这也是2种工艺TOC去除率较高的重要原因。

图5 不同氧化体系捕获的DMPO-OH(a)和DMPO-*OOH(b)信号图
Fig. 5 Signals of DMPO-OH(a)and DMPO-*OOH(b)by different processes
结合图5(b)和表2,可以发现向O3和O3/H2O2体系添加MnOx-GAC可以提高![]() 自由基含量,但向MnOx-GAC/O3体系添加H2O2会降低
自由基含量,但向MnOx-GAC/O3体系添加H2O2会降低![]() 自由基含量。并且,添加MnOx-GAC的MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺对AOX去除效果较差,二者氧化生成AOX速率较快;而添加H2O2之后的MnOx-GAC/O3/H2O2和O3/H2O2工艺较MnOx-GAC/O3和O3工艺对AOX去除效果略有改善,降低了AOX生成速率。由此表明
自由基含量。并且,添加MnOx-GAC的MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺对AOX去除效果较差,二者氧化生成AOX速率较快;而添加H2O2之后的MnOx-GAC/O3/H2O2和O3/H2O2工艺较MnOx-GAC/O3和O3工艺对AOX去除效果略有改善,降低了AOX生成速率。由此表明![]() 自由基含量与AOX去除效果呈现一定的负相关关系,自由基含量越高,越容易通过氧化生成新的AOX物质,AOX去除效果越差。
自由基含量与AOX去除效果呈现一定的负相关关系,自由基含量越高,越容易通过氧化生成新的AOX物质,AOX去除效果越差。
2.4.1 不同氧化工艺出水对蛋白核小球藻的毒性
不同氧化工艺出水对蛋白核小球藻生长状况的影响如图6所示,可以发现未经处理的染料废水对小球藻96 h生长抑制率为28.0%,表明染料废水对小球藻生长具有一定抑制作用。经O3和MnOx-GAC/O3处理90 min后,出水对小球藻生长抑制率均有所上升,分别为42.1%和64.3%,分别较原水升高了14.1%和36.3%。经O3/H2O2和MnOx-GAC/O3/H2O2处理90 min后,出水对小球藻生长抑制作用减弱,生长抑制率分别为15.8%和-7.6%,表明加入H2O2可以有效降低出水对小球藻的毒性作用,甚至可能促进小球藻生长。这可能是因为加入H2O2会抑制溴酸盐的生成[16],而溴酸盐会促进活性氧在小球藻细胞内积累,引起小球藻细胞膜破碎、酯酶活性和线粒体膜电位异常,导致小球藻生长受到抑制甚至死亡[17]。

图6 不同工艺出水对小球藻生长抑制作用
Fig. 6 Growth inhibition of C. pyrenoidosaby effluent from different processes
2.4.2 不同氧化工艺出水对青海弧菌Q67的毒性
不同氧化工艺出水对青海弧菌Q67生长状况的影响如图7所示,可以发现未经处理的染料废水对青海弧菌Q67发光抑制率为96.4%,表明染料废水对青海弧菌Q67生长具有强抑制作用,青海弧菌Q67几乎不能生长。经过O3、O3/H2O2、MnOx-GAC/O3和MnOx-GAC/O3/H2O2工艺处理之后,出水对青海弧菌Q67毒性降低,对青海弧菌Q67发光抑制率分别为37.0%、27.4%、15.1%和33.6%,分别较原水降低了59.4%、69.0%、81.3%和62.8%,以MnOx-GAC/O3出水毒性最低,这与不同氧化工艺出水对蛋白核小球藻毒性作用结果有所不同,可能是因为2个物种对毒物的敏感程度不同。小球藻对无机溴酸盐较为敏感,而青海弧菌Q67对消毒副产物和农药等有机物较为敏感[18]。

图7 不同工艺出水对青海弧菌Q67发光抑制作用
Fig. 7 Luminescence inhibition of V. qinghaiensissp. -Q67 by effluent from different processes
综合不同氧化工艺出水对蛋白核小球藻和青海弧菌Q67毒性作用,可以发现在4种氧化工艺中,只有O3/H2O2和MnOx-GAC/O3/H2O2工艺处理90 min出水对蛋白核小球藻和青海弧菌Q67的毒性较未处理时减弱。其中,MnOx-GAC/O3/H2O2工艺出水毒性最低。
![]()
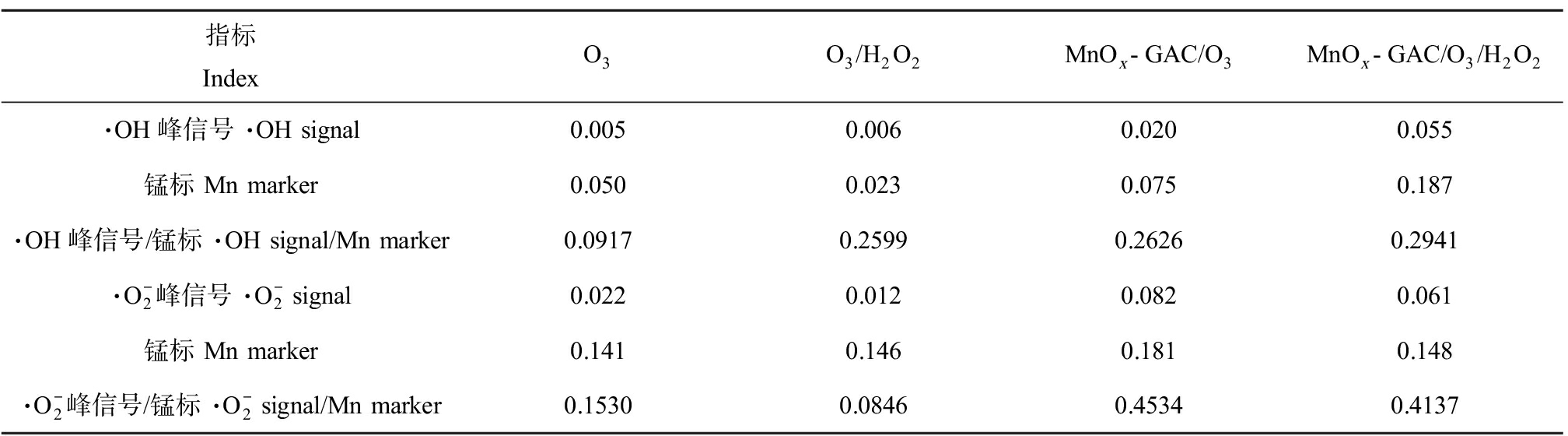
指标 IndexO3O3/H2O2MnOx-GAC/O3MnOx-GAC/O3/H2O2·OH峰信号 ·OH signal0.0050.0060.0200.055锰标 Mn marker0.0500.0230.0750.187·OH峰信号/锰标 ·OH signal/Mn marker0.09170.25990.26260.2941·O-2峰信号 ·O-2 signal0.0220.0120.0820.061锰标 Mn marker0.1410.1460.1810.148·O-2峰信号/锰标 ·O-2 signal/Mn marker0.15300.08460.45340.4137
综上,研究发现MnOx-GAC/O3/H2O2工艺对污染物去除效果最佳,体系内自由基含量最高。该工艺能够去除大部分卤代芳香族化合物,对O3体系难以去除的类蛋白物质和小分子代谢产物具有更好的去除效果,能有效降低出水TOC,同时减少卤代副产物生成。并且,MnOx-GAC/O3/H2O2工艺出水对蛋白核小球藻和青海弧菌Q67毒性均有所降低,能够实现染料废水减毒处理。因此,MnOx-GAC/O3/H2O2工艺可以作为一种较为安全的染料废水高效处理技术,用于处理难降解染料废水。
然而,MnOx-GAC/O3/H2O2工艺对AOX去除效果并不理想。工艺在短时间内可以有效去除AOX,但随着反应进行,AOX会进一步生成,去除效果变差,这在氧化体系中是难以避免的。若要进一步增强对AOX去除效果,建议在氧化工艺后开发还原工艺,通过还原脱卤技术进一步去除体系内的AOX。此外,染料废水经氧化处理之后,水体色度及大部分有机组分被去除,出水有机组分含量少、无机盐组分(以NaCl和Na2SO4为主)含量多,建议将氧化出水通过纳滤、反渗透等手段对盐分进行回收,变废为宝,实现工业废水“零排放”。
[1] 鞠雪敏, 罗莉涛, 张鸿涛, 等.染料行业废水无害化处理技术现状及发展趋势[J].科技导报, 2021, 39(17): 45-54
Ju X M, Luo L T, Zhang H T, et al.Current situation and development trend of harmless treatment technology for dye wastewater in fine chemical industry[J].Science &Technology Review, 2021, 39(17): 45-54(in Chinese)
[2] 任丹, 李碟, 黄昭露, 等.水热炭化对吸附处理染料废水产生的废活性炭的再生效果[J].环境科学研究, 2021, 34(2): 365-371
Ren D, Li D, Huang Z L, et al.Regeneration of spent powdered activated carbon from adsorption of dyestuff wastewater by hydrothermal carbonization[J].Research of Environmental Sciences, 2021, 34(2): 365-371(in Chinese)
[3] 曾伟.改性氧化石墨烯材料制备及其对水中亚甲基蓝染料的吸附性能研究[D].长沙: 湖南大学, 2017: 1-3
Zeng W.Modified graphene oxide material preparation and its adsorption properties of methylene blue in wastewater[D].Changsha: Hunan University, 2017: 1-3(in Chinese)
[4] El Hassani K, Kalnina D, Turks M, et al.Enhanced degradation of an azo dye by catalytic ozonation over Ni-containing layered double hydroxide nanocatalyst[J].Separation and Purification Technology, 2019, 210: 764-774
[5] Xie Y W, Xu R, Liu R, et al.Adsorbable organic halogens formed during treatment of Cl--containing wastewater by sulfate and hydroxyl radical-based advanced oxidation processes[J].Chemical Engineering Journal, 2020, 389: 124457
[6] 刘宇程, 杨冰, 李沁蔓, 等.Cl-和pH对高级氧化工艺去除含盐废水中有机物的影响及机理[J].环境工程学报, 2021, 15(5): 1487-1499
Liu Y C, Yang B, Li Q M, et al.Effects and mechanism of Cl-and pH on organic matter removal in salt containing wastewater treatment by advanced oxidation processes[J].Chinese Journal of Environmental Engineering, 2021, 15(5): 1487-1499(in Chinese)
[7] Fang C L, Xiao D X, Liu W Q, et al.Enhanced AOX accumulation and aquatic toxicity during 2,4,6-trichlorophenol degradation in a Co(Ⅱ)/peroxymonosulfate/Cl-system[J].Chemosphere, 2016, 144: 2415-2420
[8] Zhou S B, di Paolo C, Wu X D, et al.Optimization of screening-level risk assessment and priority selection of emerging pollutants—The case of pharmaceuticals in European surface waters[J].Environment International, 2019, 128: 1-10
[9] 刘铮, 曹婷, 王璠, 等.行业全过程水特征污染物和优控污染物清单筛选技术研究及其在常州市纺织染整业的应用[J].环境科学研究, 2020, 33(11): 2540-2553
Liu Z, Cao T, Wang F, et al.Screening technology of water characteristic pollutants and priority pollutants list from whole-process of industry and its application in textile dyeing and finishing industry of Changzhou City[J].Research of Environmental Sciences, 2020, 33(11): 2540-2553(in Chinese)
[10] 张瑛, 王斯扬, 张锡龙, 等.不同微藻对典型行业废水急性毒性响应的敏感性研究[J].生态毒理学报, 2016, 11(3): 92-100
Zhang Y, Wang S Y, Zhang X L, et al.Comparative study on acute toxic effect response of four microalgae to typical industrial wastewaters[J].Asian Journal of Ecotoxicology, 2016, 11(3): 92-100(in Chinese)
[11] 武毛妮, 葛媛, 朱艳芳.生活污水的生物毒性检测及成因分析[J].环境科学与技术, 2021, 44(3): 130-134
Wu M N, Ge Y, Zhu Y F.Biotoxicity test and cause analysis in domestic wastewater[J].Environmental Science &Technology, 2021, 44(3): 130-134(in Chinese)
[12] Magdeburg A, Stalter D, Oehlmann J.Whole effluent toxicity assessment at a wastewater treatment plant upgraded with a full-scale post-ozonation using aquatic key species[J].Chemosphere, 2012, 88(8): 1008-1014
[13] 迟彤彤, 徐冉云, 李菲菲, 等.酸热氧化修饰合成MnOx/GAC催化臭氧氧化降解邻氯酚[J].环境工程, 2021, 39(11): 119-126
Chi T T, Xu R Y, Li F F, et al.Catalytic ozonation of o-chlorophenol with MnOx/GAC synthesized via acid-thermal oxidation modification method[J].Environmental Engineering, 2021, 39(11): 119-126(in Chinese)
[14] 马梅, 童中华, 王子健, 等.新型淡水发光菌(Vibrio qinghaiensissp.—Q67)应用于环境样品毒性测试的初步研究[J].环境科学学报, 1998, 18(1): 86-91
Ma M, Tong Z H, Wang Z J, et al.Application of new type of fresh water luminescent bacterium(Vibrio qinghaiensissp.—Q67)for toxicity bioassay[J].Acta Scientiae Circumstantiae, 1998, 18(1): 86-91(in Chinese)
[15] 颉亚玮.杭州湾可吸附有机卤素污染溯源和源减排工艺研究[D].北京: 清华大学, 2017: 18
Xie Y W.Source tracing of the adsorbable organic halogens in the Hangzhou Bay and the research on its removal technology[D].Beijing: Tsinghua University, 2017: 18(in Chinese)
[16] 李磊, 王波, 张苗, 等.O3/H2O2高级氧化技术抑制溴酸盐生成中试[J].中国给水排水, 2021, 37(13): 60-64
Li L, Wang B, Zhang M, et al.Pilot test on bromate formation inhibition by O3/H2O2advanced oxidation technology[J].China Water &Wastewater, 2021, 37(13): 60-64(in Chinese)
[17] 王执伟, 刘冬梅, 张文娟, 等.溴酸盐对普通小球藻的生长以及生理特性的影响[J].环境科学, 2016, 37(6): 2158-2163
Wang Z W, Liu D M, Zhang W J, et al.Effects of bromate on the growth and physiological characteristics of Chlorella vulgaris[J].Environmental Science, 2016, 37(6): 2158-2163(in Chinese)
[18] Chen Y H, Qin L T, Mo L Y, et al.Synergetic effects of novel aromatic brominated and chlorinated disinfection byproducts on Vibrio qinghaiensissp.-Q67[J].Environmental Pollution, 2019, 250: 375-385