自闭症(ASD)是一种起病于婴幼儿时期的典型神经发育障碍疾病,典型症状包括:社交障碍、重复刻板行为、认知和探索能力下降等。随着ASD发病率的增加,给家庭和社会带来了严重的负担,ASD发病机制复杂是遗传因素与环境因素共同作用的结果[1-3]。空气污染是一种由多种污染物共同组成的复杂暴露体系,广泛存在于室内和室外空气中[4]。研究表明,空气污染物不仅会损害人类的心血管和呼吸系统,还可能会影响大脑[5]。流行病学研究表明,孕期和出生早期空气污染暴露会增加儿童罹患ASD的可能,说明空气污染暴露可能是ASD的重要环境危险因素[6-7]。
PM2.5作为典型的室外空气污染物,甲醛(FA)作为典型的室内空气污染物,从空间上看二者可能不会出现联合暴露的情况。但研究表明,PM2.5可以通过很多途径,例如:渗透、通风设备进入室内,加之室内也存在多种内源性PM2.5,使得室内PM2.5含量甚至有可能超过室外[8-9]。因此,随着人们在室内环境中度过的时间逐渐增加,事实上PM2.5和FA的联合暴露情况极有可能出现。流行病学调查研究结果已显示PM2.5和FA单独暴露与新生儿罹患ASD风险增加有关[10-11],但目前对于PM2.5和FA联合暴露对ASD影响的研究,尤其是实验研究还非常有限,加之二者联合暴露极可能发生,所以选择PM2.5和FA联合暴露作为本研究的暴露条件。前期的研究表明,氧化应激和炎症反应是空气污染物暴露产生毒性损伤的重要机制之一[12]。尽管ASD的致病因素仍不明确,但已有证据表明氧化应激和神经炎症可能参与ASD的发生和发展过程[13-14]。丝裂原活化蛋白激酶(MAPK)信号通路的异常活化在一些神经元毒性损伤中已被证实,作为MAPK家族的关键分子,P38和JNK磷酸化介导的炎症和凋亡在神经损伤中发挥着重要作用[15]。
因此,本研究对出生早期的大鼠进行PM2.5和FA联合暴露,观察暴露后大鼠的行为改变和脑组织病理学损伤,并通过对暴露后大鼠脑组织中氧化应激水平、炎症因子表达及P38和JNK磷酸化情况进行检测探讨可能的作用机制,为全面了解PM2.5和FA联合暴露对ASD的影响提供参考。
1 材料与方法(Materials and methods)
1.1 实验动物
SPF级出生后(PND)3 d的雄性SD大鼠40只,购自贵州医科大学实验动物中心,饲养于SPF级实验动物房中,大鼠置于无病原专用鼠笼内,每天12 h光照和12 h黑暗,允许自由进食和饮水。动物饲养室内温度控制在20~25 ℃,室内相对湿度为50%~70%,保持室内安静,避免强光照。
1.2 主要仪器与试剂
主要仪器:酶标仪(ELx800,Bio-Tek,美国),多功能荧光酶标仪(Hide Chameleon V,Hidex,芬兰),低温冷冻离心机(5424R,Eppendorf,德国),显微镜(DP73,Olympus,日本),荧光显微镜(BZ-X,KEYENCE,日本),空气颗粒物采样器(KC-100,崂山,中国),动物行为学分析系统(SuperMaze,欣软,中国),动物行为学分析系统(ANY-MazeTM,Stoeling Co,美国)。
主要试剂及试剂盒:液态甲醛、2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)、硫代巴比妥酸(TBA),5,5’-二硫代双(2-硝基苯甲酸)(DTNB)均购自美国Sigma-Aldrich公司,其他试剂均为国产分析纯。兔抗鼠-胶质纤维酸性蛋白(GFAP)抗体、兔抗鼠-巨噬细胞特异性蛋白(Iba1)抗体、兔抗鼠-磷酸化P30及JNK抗体、FITC标记的山羊抗兔IgG均购自美国Abcam公司。超氧化物歧化酶(SOD)活性检测试剂盒购自南京建成生物工程研究所(中国)。4-羟基壬烯醛(4-HNE)和8-羟基脱氧鸟苷(8-OHdG)检测试剂盒购自美国eBioscience公司。22种鼠类细胞因子检测微列阵购自美国Abcam公司。
1.3 PM2.5样品收集
将KC-100釆样器置于某路口,配合石英纤维滤膜采集大气PM2.5。采样点PM2.5的主要来源有道路扬尘、机动车尾气扬尘和建筑施工扬尘等,与人们生活环境中PM2.5的来源基本相同。采样后将采有PM2.5的滤膜裁剪为长宽均为1 cm,浸入去离子水中,超声振荡15 min,重复3次,洗脱PM2.5,振荡液用6层纱布过滤,滤液冷冻真空干燥,低温冰箱保存备用。暴露时,用无菌生理盐水配制成相应的浓度。
1.4 染毒液配制及分组
参考PM2.5和FA的人群环境暴露剂量和国家标准,选择PM2.5 100 μg·m-3,FA 0.08 mg·m-3作为人群暴露剂量标准,按照人与大鼠试验给药剂量等效换算得出本研究中PM2.5和FA的暴露剂量分别为:0.1351 mg·kg-1·d-1、0.1085 mg·kg-1·d-1[16-17]。将实验大鼠随机分为:空白对照组(NS组)、PM2.5暴露组(0.1351 mg·kg-1·d-1)、FA暴露组(0.1085 mg·kg-1·d-1)、联合暴露组(0.1351 mg·kg-1·d-1 PM2.5+0.1085 mg·kg-1·d-1 FA),从PND8开始采用鼻腔滴注的方式对大鼠进行为期14 d的连续暴露。
1.5 行为学检测分析
1.5.1 三箱社交试验(TCS)
在PND18进行TCS,采用具有3个室的透明社交箱,首先将待检测大鼠放置在中间室,允许其自由探索2侧。随后将陌生大鼠1置于侧室中,使用网笼罩住,另一侧放置空网笼,允许待检测大鼠自由探索。最后保留大鼠1,向另一侧室空网笼内放置陌生大鼠2,使用网笼罩住,允许待检测大鼠在三箱之中自由探索5 min,记录待检测大鼠在每个室中停留的时间和嗅探的时间[18]。
1.5.2 埋珠试验(MBT)
在PND19进行MBT,在鼠笼中铺上厚5 cm的垫料,垫料表面均匀放置20颗玻璃珠(5排,每排4颗),将待检测大鼠置于鼠笼内,每只观察记录30 min,按玻璃珠被埋部分达2/3为标准记录大鼠所埋玻璃珠数量[19]。
1.5.3 旷场试验(OFT)
在PND20进行OFT,将待检测大鼠置于正方形黑色不透明塑料箱内,人为将箱体底部进行4×4划分成16格,中间4格为“中央区”,外周12格为“外周区”,允许大鼠自由活动,观察记录5 min,记录待检测大鼠在箱中、中央区和外周区的运动情况及排便数量(大便颗粒数)[20]。
1.5.4 水迷宫试验(MWM)
在PND15~PND21进行MWM,PND15~PND19为定向航行试验,记录待检测大鼠在水池中找到逃逸平台所花费的时间,即逃逸潜伏期。每天对每只大鼠进行3次训练。PND20停止试验,为遗忘期。PND21开始空间探索试验,撤去逃逸平台,让大鼠在迷宫中游泳60 s,记录待检测大鼠在平台所在象限的运动情况[21]。
1.6 脑组织样品制备
在PND22脱颈处死试验大鼠,取全脑组织。每组随机选择3个全脑采用多聚甲醛固定用于制备组织切片,其余脑组织制备组织匀浆。将脑组织采用玻璃匀浆器,加入冷的磷酸盐缓冲液(PBS,pH=7.5)制成10%的组织匀浆,然后在4 ℃下以10 000 r·min-1离心10 min,取上清分装置于-80 ℃冰箱待检测,大鼠脑组织匀浆蛋白含量采用Lowry法进行测定。
1.7 脑组织病理切片制作及免疫荧光观察
对大鼠脑组织进行石蜡包埋和切片,进行H&E和Nissl染色,随后在显微镜下进行观察。对Nissl染色切片,应用Image Pro Plus 6.0软件进行Nissl染色光密度值(OD)分析[22]。采用抗体稀释液将兔抗小鼠GFAP和Iba1抗体进行稀释(1∶200)作为一抗,FICT标记的山羊抗兔IgG为二抗,对脑切片进行免疫荧光染色,随后在荧光显微镜下进行观察。
1.8 脑组织氧化应激水平变化测定
采用DCFH-DA、TBA和DTNB法对1.6中的脑组织匀浆进行活性氧(ROS)、丙二醛(MDA)及谷胱甘肽(GSH)含量的检测[16]。SOD活性、4-HNE和8-OHdG含量按试剂盒说明书操作步骤进行测定。
1.9 脑组织炎症因子表达水平测定
采用细胞因子微列阵对1.6中脑组织匀浆中的细胞因子表达情况进行测定,操作按说明书要求进行。
1.10 P30和JNK磷酸化水平测定
采用蛋白免疫印迹法对P30和JNK磷酸化水平进行测定。将脑组织蛋白在SDS-PAGE凝胶中分离,随后转膜置PVDF膜上,采用5%的脱脂牛奶进行封闭,漂洗后加入一抗(1∶1 000稀释),4 ℃孵育过夜,漂洗后加入过氧化物酶标记的二抗(1∶5 000稀释),室温孵育1 h,加入底物显色,利用凝胶成像系统进行扫描,对蛋白条带灰度值进行分析[23]。
1.11 统计分析
采用方差分析(ANOVA)对实验数据的差异性进行检测,数据统计图使用GraphPad Prism 8.0(San Diego,美国)生成,用SPSS 13.0(SPSS,美国)分析数据。采用多重ANOVA进行水迷宫定向航行实验数据分析,使用t检验确定各暴露组之间的差异性,其他数据采用单因素ANOVA,使用t检验分析差异性,差异显著性水平是P<0.05。
2 结果(Results)
2.1 大鼠ASD样行为变化
暴露后各组大鼠ASD样行为变化如图1所示。TCS结果显示各组大鼠在没有放置陌生鼠时对于在各室停留并没有偏好(图1(a))。当放置陌生鼠1后,各组大鼠对于陌生鼠1的嗅探时间均显著增加,但是联合暴露组对陌生鼠1的嗅探时间显著少于NS组(图1(b))。放置陌生鼠2后,其他各组大鼠更倾向对陌生鼠2进行嗅探,嗅探时间显著高于陌生鼠1,但联合暴露组大鼠对于陌生鼠1和2的嗅探时间没有出现差异,且对陌生鼠2的嗅探时间显著少于NS组(图1(c))。MBT的结果显示,联合暴露组大鼠埋珠数量显著多于其他各组(图1d))。在OFT中,联合暴露组大鼠的总移动距离显著低于NS和PM2.5组(图1(e)),进入中央区运动的次数和时间则显著低于NS组(图1(f)、图1(g)),同时排便数量高于其他各组(图1(h))。MWM结果显示,定向航行试验中各组小鼠的逃逸潜伏期随着训练天数的增加都在不断减小,但是在PND18、PND19时,联合暴露组大鼠的逃逸潜伏期已显著高于NS组(表1)。在PND21的空间探索试验中,联合暴露组大鼠在目标象限中的移动距离和进入次数均低于其他各组,停留时间也少于NS和FA组(图1(i)~(k))。
表1 各组大鼠逃逸潜伏期
Table 1 The escape latency of rat in each group (s)
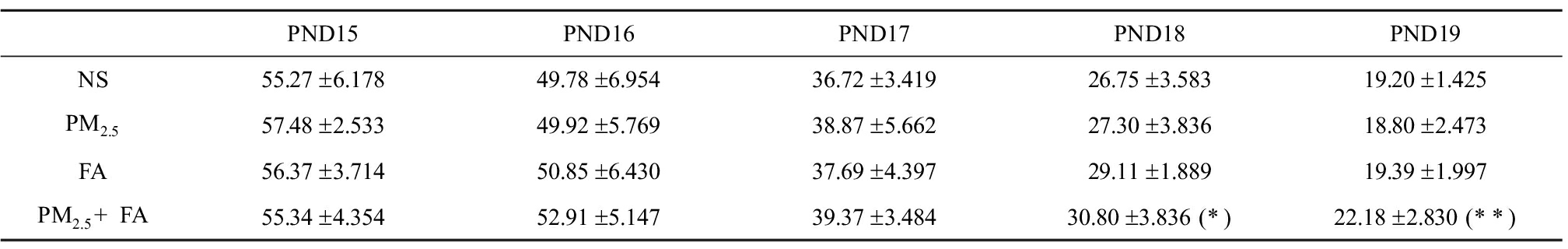
注:*P<0.05,**P<0.01,与NS组相比。
Note: *P<0.05, **P<0.01, compared with control group.

图1 各组大鼠自闭症(ASD)样行为变化
注:(a) TCS各室停留时间;(b) TCS陌生大鼠1嗅探时间;(c) TCS陌生大鼠1、2嗅探时间;(d) MBT埋珠数量;(e) OFT总移动距离;(f) OFT中央区进入次数;(g) OFT中央区停留时间;(h) OFT大鼠排便次数;(i) MWM目标象限移动距离;(j) MWM目标象限停留时间;(k) MWM目标象限进入次数;*P<0.05,**P<0.01;NS表示空白对照组,PM2.5表示PM2.5暴露组,FA表示甲醛暴露组,PM2.5+FA表示联合暴露组。
Fig. 1 Autism (ASD)-like behavioral phenotypes in rat after exposure
Note: (a) Time spent in each chamber during habituation of TCS; (b) Time spent in sniffing of the stranger rat 1 of TCS; (c) Time spent in sniffing of the stranger rat 1 and 2 of TCS; (d) The buried marbles number of MBT; (e) The total travel distance of OFT; (f) The number of center area entries of OFT; (g) The time spent in center area of OFT; (h) The defecation number of rat in OFT; (i) The swimming distance in target quadrant of MWM; (j) The swimming time in target quadrant of MWM; (k) The number of target quadrant entries of MWM; *P<0.05, **P<0.01; NS means control group; FA means formaldehyde exposure group; PM2.5 means PM2.5 exposure group; PM2.5+FA means combined exposure group.
2.2 大鼠脑组织病理学观察
各组大鼠暴露后脑海马H&E染色结果显示(图2(a)),NS、PM2.5和FA组大鼠海马区锥体细胞排列整齐,呈清晰的多边形。每个细胞的顶端树突清晰可见。但联合暴露后,大鼠的锥体细胞排列变得松散无序,细胞形态肿胀变形,顶端树突缩短甚至消失。脑海马Nissl染色如图2(b)和2(e)所示,联合暴露组大鼠Nissl染色OD值较其他组显著下降。图2(c)显示各组大鼠大脑皮层细胞形态并无明显变化,但联合暴露导致大鼠皮层细胞数量显著减少(图2(d))。

图2 各组大鼠脑组织病理观察(10×40;bar=50 μm)
注:(a) 脑海马组织H&E染色;(b) 脑海马组织Nissl染色;(c) 大脑皮层H&E染色;(d) 大脑皮层细胞计数;
(e) 脑海马Nissl染色OD值;*P<0.05,**P<0.01。
Fig. 2 Rat brain histopathological observation of each group (10×40; bar=50 μm)
Note: (a) H&E stains for hippocampus; (b) Nissl stains for hippocampus; (c) H&E staining for cerebral cortex; (d) The cell number in cerebral cortex; (e) The OD of Nissl staining; *P<0.05, **P<0.01.
2.3 大鼠脑组织胶质细胞激活情况
暴露后各组大鼠脑组织星形胶质细胞和小胶质细胞激活情况如图3所示。如图3(a)、3(e)所示,联合暴露组大鼠GFAP阳性细胞体积增加、分支增多。同时Iba1阳性细胞体积增大、神经突触变粗、出现棘状突起(图3(b)、3(d))。
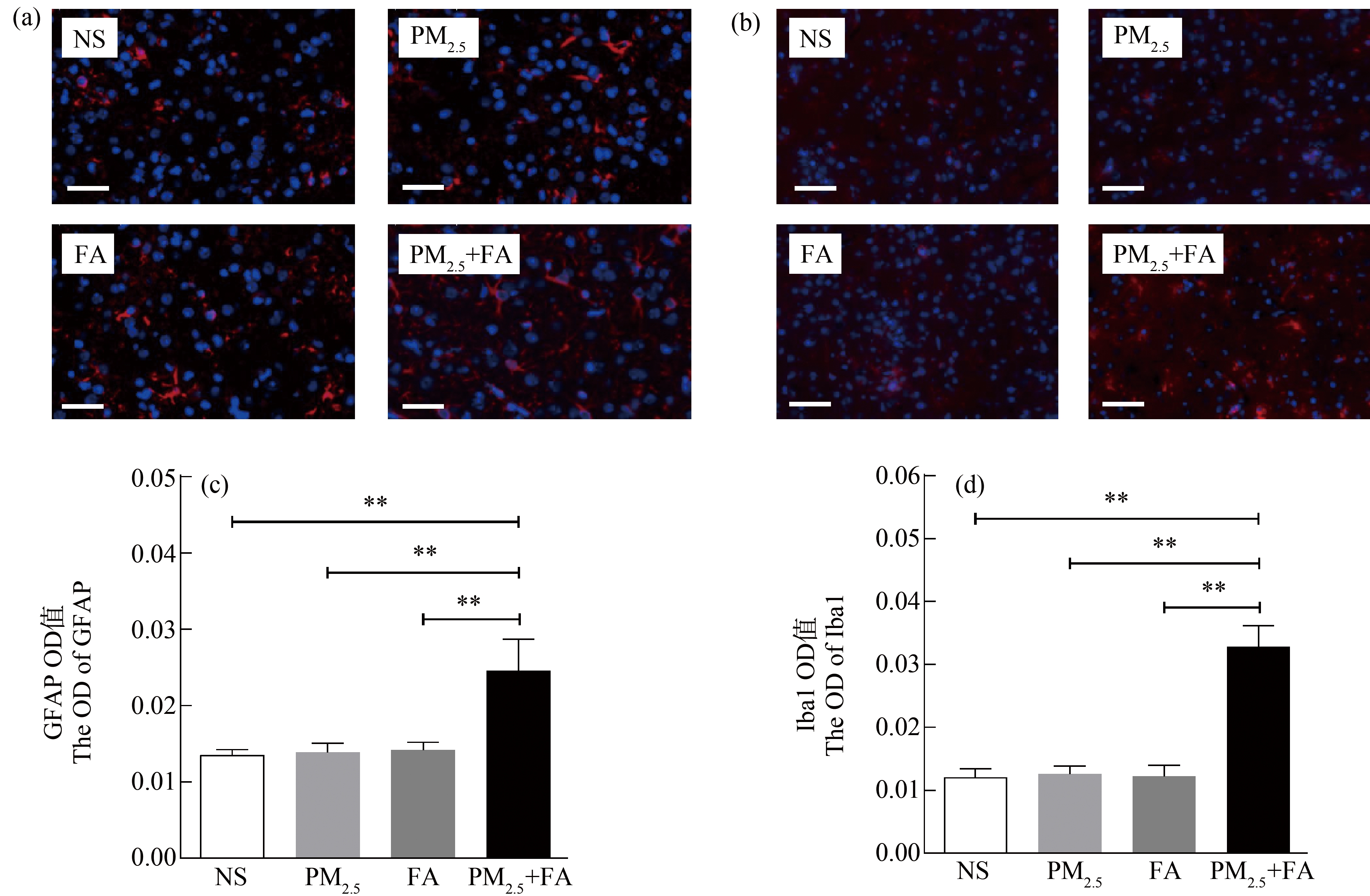
图3 各组大鼠脑组织免疫荧光染色观察(10×40;bar=50 μm)
注:(a) GFAP;(b) Iba1;*P<0.05,**P<0.01。
Fig. 3 Rat brain immunofluorescence staining observation of each group (10×40; bar=50 μm)
Note: (a) GFAP; (b) Iba1; *P<0.05, **P<0.01.
2.4 大鼠脑组织氧化应激水平变化
暴露后各组大鼠脑组织氧化应激相关指标检测结果如图4所示,联合暴露后大鼠脑组织中ROS相对荧光强度、MDA和4-HNE含量均出现了显著上升,GSH含量和SOD活性出现了显著性下降,8-OHdG并未出现变化。而PM2.5和FA组大鼠分别只有GSH含量和SOD活性出现了下降。

图4 各组大鼠脑组织氧化应激水平变化
注:*P<0.05,**P<0.01。
Fig. 4 Oxidative stress level changes of rat in each group
Note: *P<0.05, **P<0.01.
2.5 出生早期大鼠脑组织细胞因子表达情况变化
暴露后各组大鼠脑组织细胞因子表达水平变化如图5所示,对联合暴露后大鼠脑组织中22种细胞因子相对表达量变化进行检测,其中IL-2、MCP-1、IL-6、IL-17、INF-γ、sTNFRI、TNF-α和MCP-5相对表达水平出现了显著性上升,而PM2.5和FA组分别只有TNF-α和sTNFRI表达水平出现了升高。其他14种细胞因子相对表达水平无显著性改变。
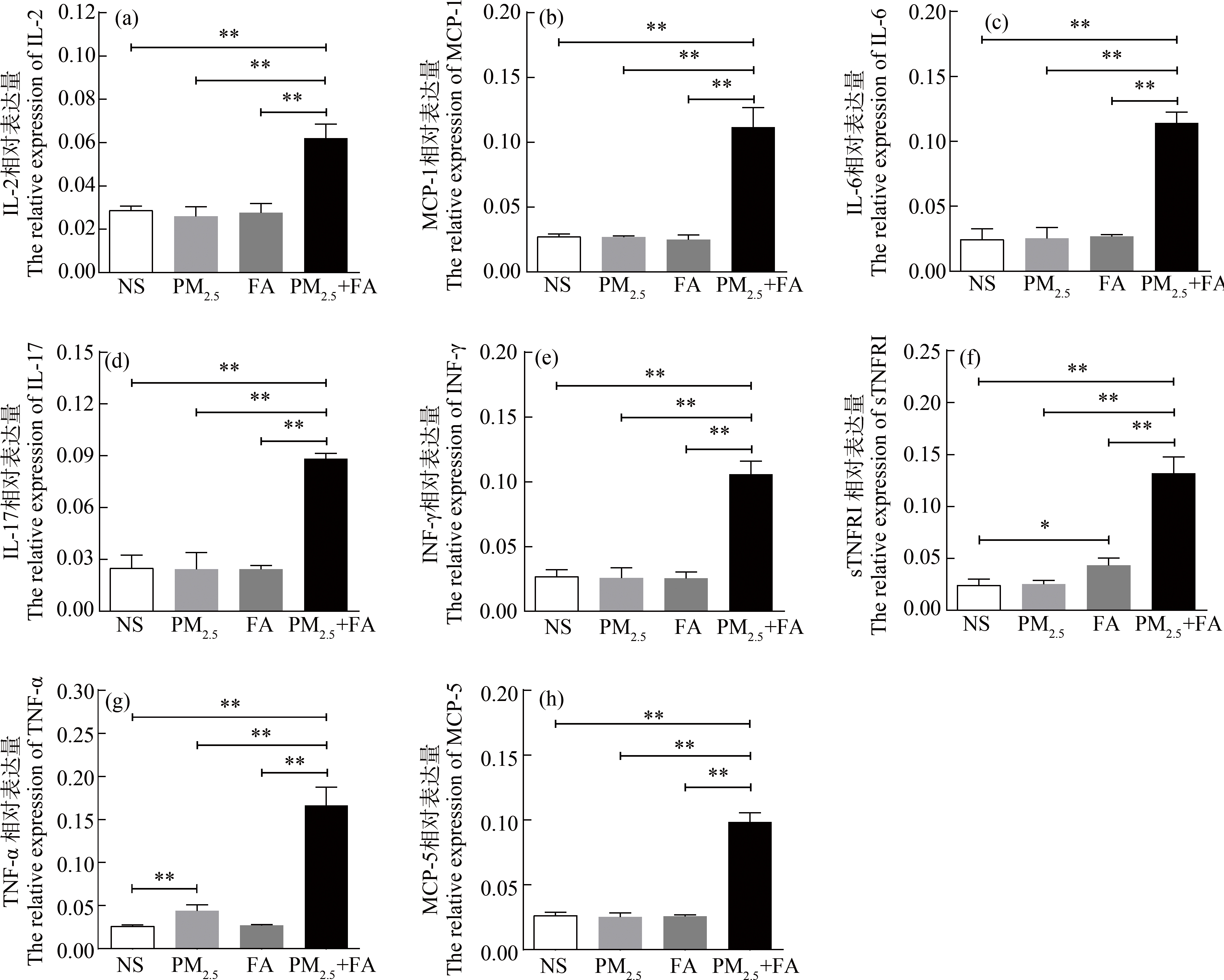
图5 各组大鼠细胞因子表达水平变化
注:*P<0.05,**P<0.01。
Fig. 5 Cytokines level changes of rat in each group
Note: *P<0.05, **P<0.01.
2.6 大鼠脑组织P30、JNK磷酸化表达情况
暴露后各组大鼠脑组织P30、JNK磷酸化表达情况如图6所示,联合暴露后大鼠脑组织中P30、JNK磷酸化水平相对于其他各组均出现了显著性上升。

图6 各组大鼠P38、JNK磷酸化表达情况
注:*P<0.05,**P<0.01。
Fig. 6 Phosphorylation expression of P38 and JNK in rats of each group
Note: *P<0.05, **P<0.01.
3 讨论(Discussion)
空气污染作为一个多污染物联合暴露的复杂体系已经显示出了一定的神经毒性作用,PM2.5和FA作为2种典型的空气污染物,联合暴露的情况经常存在。但是以往多是针对二者单独暴露进行研究,而忽略了现实暴露实际是一个联合暴露体系。ASD作为一种典型的儿童神经系统发育障碍性疾病,其致病风险因素和机制还有待进一步阐明。
本研究分别使用了TCS、MBT、OFT和MWM对各暴露组出生早期大鼠的社交能力、重复刻板行为、认知及探索能力进行检测。结果显示,在PM2.5和FA单独暴露后,出生早期大鼠并未出现明显的行为异常。但是二者联合暴露后,TCS显示联合暴露组大鼠对陌生鼠1、2的嗅探时间均显著低于NS组,说明该组大鼠对于陌生大鼠1、2的偏好显著弱于NS组,社交意愿出现下降。MBT结果显示,联合暴露组大鼠埋珠数量明显多于其他各组,说明该组大鼠重复刻板行为增多。在OFT中,联合暴露组大鼠同样显示出总移动距离和在中央区活动的减少,说明该组大鼠对陌生环境的探索能力减弱。而MWM定向航行试验结果表明,联合暴露组大鼠PND18、PND19的逃逸潜伏期显著高于NS组,需要花费更多的时间才能够找到逃逸平台,说明该组大鼠的学习能力出现下降。而在MWM空间探索试验中,联合暴露组大鼠在目标平台所在象限中停留的时间以及进入该象限的次数均出现显著性下降,说明大鼠的记忆能力也受到了影响。以上结果表明,PM2.5和FA的联合暴露导致出生早期大鼠出现了社交能力下降、重复刻板行为增多、探索和认知能力减弱等典型的ASD样行为变化。
对各暴露组大鼠脑组织病理学检测结果显示,联合暴露组大鼠脑海马组织椎体神经元形态变化明显,同时Nissl小体含量下降,二者在形成记忆和神经递质的合成过程中均起着重要作用[24]。大脑皮层神经元细胞计数结果显示,联合暴露虽未对皮层神经元形态产生影响,但显著降低了神经元数量。这些脑组织病理学的改变均说明PM2.5和FA的联合暴露引起了出生早期大鼠脑组织的病变,但这些改变在PM2.5、FA单独暴露后并不明显。
氧化应激和神经炎症是空气污染造成神经损伤的主要机制之一,脑组织作为耗氧量高、脂质含量高而抗氧化系统薄弱的组织,很容易受到ROS的影响,氧化水平的提高进一步会引起脂质等生物大分子损伤,同时激活炎症信号通路释放炎症因子[25-26]。小胶质细胞和星形胶质细胞,作为脑组织中2种重要的胶质细胞,其高度活化和很多神经疾病以及神经细胞损伤有关,活化的胶质细胞会产生ROS和细胞因子,而ROS和这些细胞因子又可以进一步的激活胶质细胞,如此反复最终导致神经细胞的损伤[27]。在本研究中,联合暴露组大鼠脑组织中ROS相对荧光强度显著高于各组,同时脂质过氧化产物MDA和4-HNE也显著升高,抗氧化物质GSH含量和SOD活性则出现了下降,而细胞因子检测结果显示,部分促炎症因子表达水平提高。同时星形胶质细胞和小胶质细胞活化标志物GFAP、Iba1[16]表达水平上升。这说明联合暴露后大鼠脑组织胶质细胞活化状态、氧化应激和神经炎症水平显著上调。MAPK蛋白家族执行着介导细胞表面信号到细胞核的传输功能,参与介导细胞炎症、凋亡和核转录因子等多种途径的激活作用,在多种神经损伤的机制研究中已被证实[28],本研究证明在PM2.5和FA联合暴露后,MAPK家族2个主要成员P38和JNK的磷酸化水平上调,MAPK的活化参与了介导PM2.5和FA联合暴露所致的大鼠脑组织损伤。
综上所述,在本研究中PM2.5和FA的单独暴露并未对出生早期大鼠产生显著影响,但二者的联合暴露会引起大鼠ASD样变化,联合暴露引起的大鼠脑组织MAPK信号通路的激活、氧化应激和神经炎症水平的升高是联合暴露的致损过程。该研究结果为进一步揭示PM2.5和FA联合暴露对ASD病变的影响提供了一定的参考。
[1] Gyawali S, Patra B N. Autism spectrum disorder: Trends in research exploring etiopathogenesis [J]. Psychiatry and Clinical Neurosciences, 2019, 73(8): 466-475
[2] Bölte S, Girdler S, Marschik P B. The contribution of environmental exposure to the etiology of autism spectrum disorder [J].Cellular and Molecular Life Sciences, 2019, 76(7): 1275-1297
[3] 田宇, 徐晨露, 黄丹妮, 等. 交通空气污染对大鼠子代发育及社交行为的影响[J]. 生态毒理学报, 2020, 15(2): 104-112
Tian Y, Xu C L, Huang D N, et al. Effects of traffic-related air pollution on development and social behavior of offspring rats [J]. Asian Journal of Ecotoxicology, 2020, 15(2): 104-112 (in Chinese)
[4] Block M L, Calderón-Garcidue as L. Air pollution: Mechanisms of neuroinflammation and CNS disease [J]. Trends in Neurosciences, 2009, 32(9): 506-516
as L. Air pollution: Mechanisms of neuroinflammation and CNS disease [J]. Trends in Neurosciences, 2009, 32(9): 506-516
[5] Underwood E. The polluted brain [J]. Science, 2017, 355(6323): 342-345
[6] Becerra T A, Wilhelm M, Olsen J, et al. Ambient air pollution and autism in Los Angeles County, California [J]. Environmental Health Perspectives, 2013, 121(3): 380-386
[7] Talbott E O, Arena V C, Rager J R, et al. Fine particulate matter and the risk of autism spectrum disorder [J]. Environmental Research, 2015, 140: 414-420
[8] Liu X D, Zhang Y C, Luo C, et al. At seeming safe concentrations, synergistic effects of PM2.5 and formaldehyde co-exposure induces Alzheimer-like changes in mouse brain [J]. Oncotarget, 2017, 8(58): 98567-98579
[9] Marques G, Pitarma R. An indoor monitoring system for ambient assisted living based on Internet of Things architecture [J]. International Journal of Environmental Research and Public Health, 2016, 13(11): 1152
[10] Dutheil F, Comptour A, Morlon R, et al. Autism spectrum disorder and air pollution: A systematic review and meta-analysis [J]. Environmental Pollution, 2021, 278: 116856
[11] von Ehrenstein O S, Aralis H, Cockburn M, et al. In utero exposure to toxic air pollutants and risk of childhood autism [J]. Epidemiology, 2014, 25(6): 851-858
[12] 吴远双, 孟庆雄, 魏大巧, 等. 空气污染与神经退行性疾病[J]. 生命科学, 2011, 23(8): 784-789
Wu Y S, Meng Q X, Wei D Q, et al. Air pollution and neurodegenerative diseases [J]. Chinese Bulletin of Life Sciences, 2011, 23(8): 784-789 (in Chinese)
[13] Siniscalco D, Schultz S, Brigida A L, et al. Inflammation and neuro-immune dysregulations in autism spectrum disorders [J]. Pharmaceuticals, 2018, 11(2): E56
[14] Pangrazzi L, Balasco L, Bozzi Y. Oxidative stress and immune system dysfunction in autism spectrum disorders [J]. International Journal of Molecular Sciences, 2020, 21(9): E3293
[15] Vithayathil J, Pucilowska J, Landreth G E. ERK/MAPK signaling and autism spectrum disorders [J]. Progress in Brain Research, 2018, 241: 63-112
[16] Liu X D, Zhang Y C, Yang X. Vitamin E reduces the extent of mouse brain damage induced by combined exposure to formaldehyde and PM2.5 [J]. Ecotoxicology and Environmental Safety, 2019, 172: 33-39
[17] 李才. 人类疾病动物模型的复制[M]. 北京: 人民卫生出版社, 2008: 60-62
[18] Crawley J N. Designing mouse behavioral tasks relevant to autistic-like behaviors [J]. Mental Retardation and Developmental Disabilities Research Reviews, 2004, 10(4): 248-258
[19] Dixit P V, Sahu R, Mishra D K. Marble-burying behavior test as a murine model of compulsive-like behavior [J]. Journal of Pharmacological and Toxicological Methods, 2020, 102: 106676
[20] Davis M M, Olausson P, Greengard P, et al. Regulator of calmodulin signaling knockout mice display anxiety-like behavior and motivational deficits [J]. The European Journal of Neuroscience, 2012, 35(2): 300-308
[21] Yoshida M, Watanabe C, Honda A, et al. Emergence of delayed behavioral effects in offspring mice exposed to low levels of mercury vapor during the lactation period [J]. The Journal of Toxicological Sciences, 2013, 38(1): 1-6
[22] Wu Y, You H H, Ma P, et al. Role of transient receptor potential ion channels and evoked levels of neuropeptides in a formaldehyde-induced model of asthma in BALB/c mice [J]. PLoS One, 2013, 8(5): e62827
[23] Bhatt D P, Puig K L, Gorr M W, et al. A pilot study to assess effects of long-term inhalation of airborne particulate matter on early Alzheimer-like changes in the mouse brain [J]. PLoS One, 2015, 10(5): e0127102
[24] 罗雨商, 杨斌, 张霖, 等. 邻苯二甲酸二丁酯诱导小鼠神经行为学改变及相关生理生化指标分析[J]. 环境科学学报, 2019, 39(7): 2384-2391
Luo Y S, Yang B, Zhang L, et al. Dibutyl phthalate induces neurobehavioral changes in mice and its relationship with physiological and biochemical indexes [J]. Acta Scientiae Circumstantiae, 2019, 39(7): 2384-2391 (in Chinese)
[25] Vignal C, Pichavant M, Alleman L Y, et al. Effects of urban coarse particles inhalation on oxidative and inflammatory parameters in the mouse lung and colon [J]. Particle and Fibre Toxicology, 2017, 14(1): 46
[26] Xiao G G, Wang M Y, Li N, et al. Use of proteomics to demonstrate a hierarchical oxidative stress response to diesel exhaust particle chemicals in a macrophage cell line [J]. The Journal of Biological Chemistry, 2003, 278(50): 50781-50790
[27] 郭壮, 周利君. 星形胶质细胞-小胶质细胞的交互对话在神经炎症中的双重作用[J]. 实用医学杂志, 2021, 37(18): 2432-2436
Guo Z, Zhou L J. Dual role of astrocyte-microglia crosstalk in neuroinflammation [J]. The Journal of Practical Medicine, 2021, 37(18): 2432-2436 (in Chinese)
[28] 刘婷婷, 张淑萍, 覃筱燕, 等. MAPK信号转导通路与神经损伤研究进展[J]. 中国公共卫生, 2016, 32(2): 248-254
Liu T T, Zhang S P, Qin X Y, et al. Progress in studies on MAPK signal transduction pathway and nerve injury [J]. Chinese Journal of Public Health, 2016, 32(2): 248-254 (in Chinese)