随着工业化和城市化的进程,新的环境问题也随之而来,重金属污染就是其中之一。研究表明,人类赖以生存的水资源正面临重金属的严重威胁,如Islam等[1]在孟加拉国博格拉的城区河流中检测到超于世界卫生组织(WHO)饮用水标准的砷(As):46 μg·L-1、镉(Cd):11 μg·L-1、铬(Cr):83 μg·L-1。Lin等[2]在调查渤海沿岸水污染时采集了150个样本,发现约45%的采样点中,铅(Pb)的浓度>1.0 μg·L-1,即超过了中国海水质量标准的I级限值;35%的采样点中,锌(Zn)浓度超过I级限值(20 μg·L-1);约27%的采样点中,汞(Hg)的浓度超过I级限值(0.05 μg·L-1)。土壤重金属污染同样是世界许多地区所面临的严重问题,如Hu等[3]发现湖北省北部土壤中铜(Cu)、Zn和Cd含量大多超过二级土壤质量阈值,Pb、Cr、镍(Ni)和钴(Co)含量也高于土壤背景值。Marrugo-Negrete等[4]在哥伦比亚西努河流域附近的土壤发现Zn、Cu、Ni和Hg等重金属含量高于土壤环境背景值。环境中超量重金属的污染不可避免地会引起健康方面的担忧,过去发生的多起公害事件,如日本的水俣病[5]、中国镉大米事件[6]等,都与重金属污染有着密不可分的关系,使得相关问题被全球公众和学界广泛关注。
目前,毒理学研究多倾向于单一重金属对生物体的影响,而在环境介质中,多种重金属共存的现象极为普遍,比如在多种环境介质中均能检测到Pb、Cu、Zn、Hg、Cd和Cr等重金属,并且这些重金属也经常与其他无机、有机污染物(如邻苯二甲酸二辛酯(DOP))和微塑料等共存[7-12]。随着表征手段的发展及毒理学研究的不断深入,多种重金属共存、重金属与其他污染物共存下的毒理学效应及生态健康风险已引起广泛关注。由于与其他污染物的相互作用,共暴露的重金属毒性常表现出与单一暴露差异显著的复杂毒理现象。从暴露的毒性效应结果来看,可表现为拮抗效应(指2种或2种以上的污染物共同存在时产生的毒性小于单一存在时的毒性)、协同效应(指2种或2种以上的污染物共同存在时产生的毒性作用大于单一存在时产生的毒性)及相加效应(指2种或2种以上的污染物存在时产生的毒性等于单一存在时的毒性)等(图1)[13-14]。本文通过对比不同类型重金属复合暴露特征,系统总结复合暴露重金属类型、暴露时间和模式生物等与其毒性效应的内在关联,阐释复合暴露毒性作用的物理化学及生物学机制,为理清复杂环境介质中重金属污染物复合暴露对生态系统及健康的危害提供科学依据。
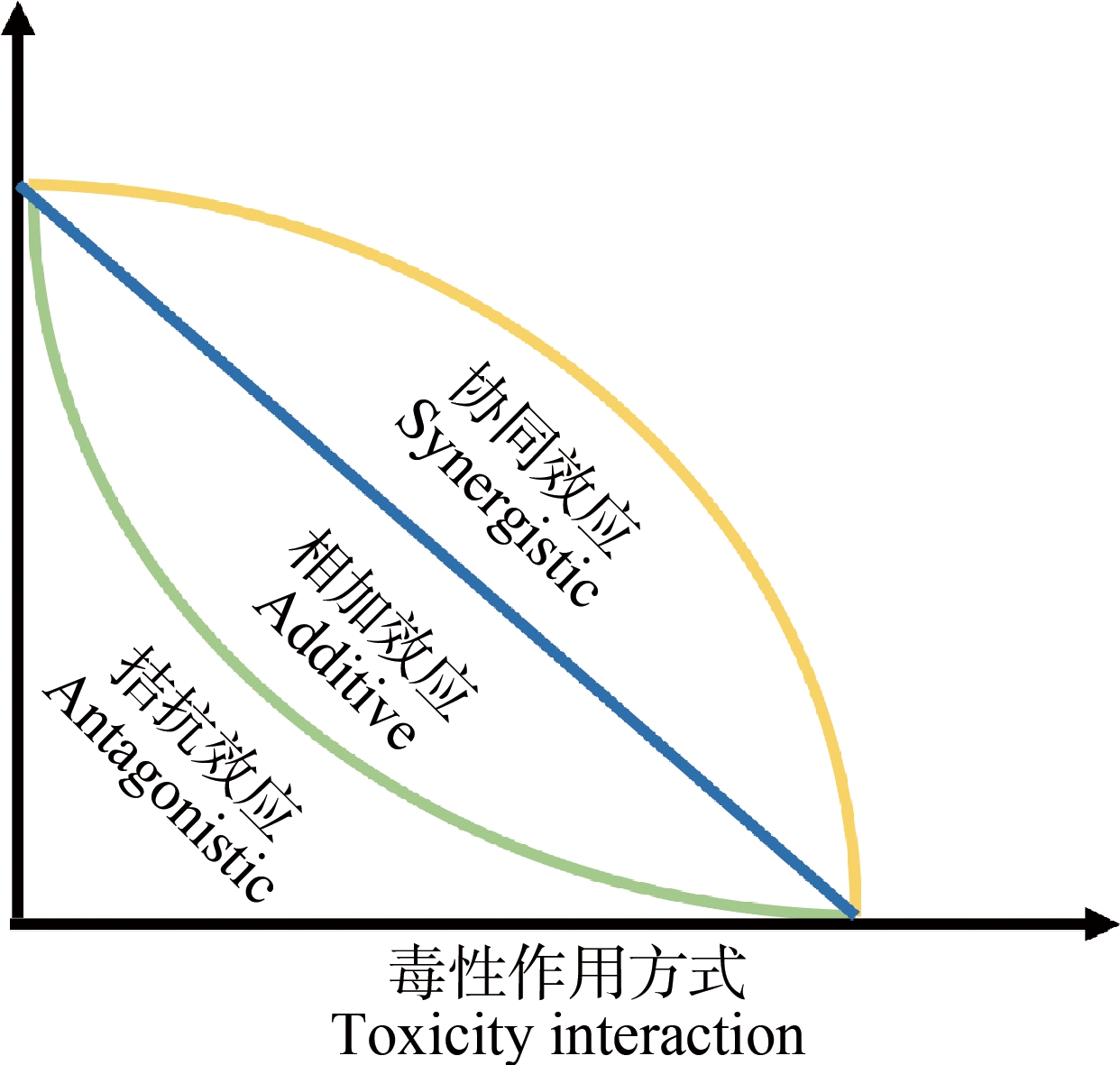
图1 复合污染物的相互作用方式[15]
Fig. 1 Interaction mode of heavy metal co-exposure[15]
1 重金属复合暴露的流行病学调查(Epidemiological investigation of compound exposure to heavy metals)
针对重金属复合暴露的流行病学研究已多有报道,西班牙研究人员在探索妊娠期间的环境暴露及饮食习惯对胎儿的影响时发现Cd、Cr和Hg等重金属可以越过胎盘屏障进入胎儿体内,影响其生长及神经系统发育,孕妇体内重金属含量过高还会造成流产或早产的情况[16]。在“电子垃圾之都”贵屿,研究人员在孕妇血液中检测到高浓度的Pb、Cr和Cd等重金属,进一步的跟踪调查发现婴儿的头围相比其他地区较小[17]。Moody等[18]在乌干达坎帕拉(以社区为基础的97名6~59个月儿童)调查重金属与儿童发育关系时也发现,有22名儿童发育迟缓,进一步研究发现这与血液中高浓度的Pb和硒(Se)有关。研究人员在墨西哥研究重金属与儿童神经发育关系时同样发现,Cu、Pb等会影响儿童神经发![]() ńska等[20]在波兰索斯诺维茨和卡托维兹地区的儿童血液和尿液中检测到Pb和多环芳烃等物质,进一步研究发现接触这些物质会改变微核和姐妹染色体交换度,引起DNA损伤。对于成年人而言,Dudka等[21]在研究冶炼厂工人的代谢水平时发现,长期接触Pb、Cd和As等重金属会造成脂质和能量代谢的紊乱。Wang等[22]在中国太原调查重金属与妊娠期糖尿病的关系时发现,Hg、Ni、Pb和As等会增加孕妇患糖尿病的风险。Duan等[23]在分析美国1990—2014年26 000多个人体的血液和尿液中重金属含量与健康关系时发现,血液中的Pb、Cd会增加患心血管疾病、患癌风险和死亡率;尿液中检测到的Cd、锑(Sb)与死亡率成正相关。综上所述,从健康效应来看,多种重金属的共暴露在不同的年龄阶段中均会对人体造成不同程度的损伤。这些研究表明重金属复合影响人体健康,虽然没有探索相应的致毒机理,但相关数据的积累依然是开展重金属复合暴露健康效应相关工作的基础。
ńska等[20]在波兰索斯诺维茨和卡托维兹地区的儿童血液和尿液中检测到Pb和多环芳烃等物质,进一步研究发现接触这些物质会改变微核和姐妹染色体交换度,引起DNA损伤。对于成年人而言,Dudka等[21]在研究冶炼厂工人的代谢水平时发现,长期接触Pb、Cd和As等重金属会造成脂质和能量代谢的紊乱。Wang等[22]在中国太原调查重金属与妊娠期糖尿病的关系时发现,Hg、Ni、Pb和As等会增加孕妇患糖尿病的风险。Duan等[23]在分析美国1990—2014年26 000多个人体的血液和尿液中重金属含量与健康关系时发现,血液中的Pb、Cd会增加患心血管疾病、患癌风险和死亡率;尿液中检测到的Cd、锑(Sb)与死亡率成正相关。综上所述,从健康效应来看,多种重金属的共暴露在不同的年龄阶段中均会对人体造成不同程度的损伤。这些研究表明重金属复合影响人体健康,虽然没有探索相应的致毒机理,但相关数据的积累依然是开展重金属复合暴露健康效应相关工作的基础。
2 重金属复合暴露对于动物的毒理效应(Toxicological effects of heavy metal compound exposure on animals)
2.1 哺乳动物模型
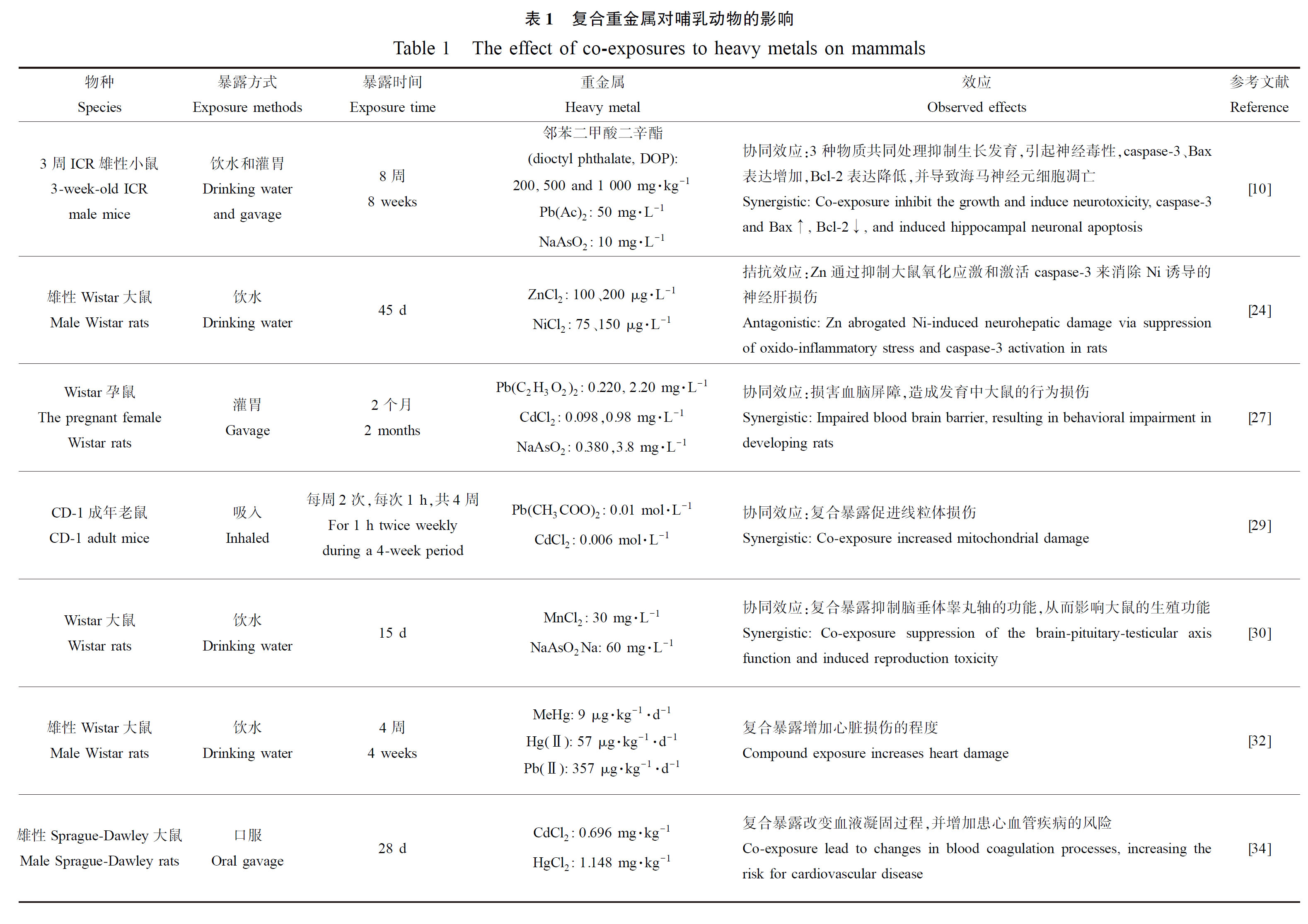
以哺乳动物(如鼠)为模型的重金属复合毒性研究表明,重金属会在动物体内累积,造成生长发育迟滞,神经及心血管损伤,影响其代谢乃至繁殖过程。根据受试物种、重金属类别、暴露时间和暴露终点等,我们将重金属复合暴露对哺乳动物的影响整理至表1。
重金属暴露会造成动物神经系统的损伤,但特定重金属复合也会产生拮抗效应。Adedara等[24]研究环境浓度下Ni(75 μg·L-1和150 μg·L-1)和Zn(100 μg·L-1和200 μg·L-1)对大鼠的神经和行为的影响时发现Zn能显著减轻Ni对大鼠造成的运动障碍,原因在于Zn可以通过抑制氧化应激和激活casepase-3来减轻Ni诱导的神经性肝损伤。有研究表明大鼠在经As和Pb共暴露后,添加Zn、钙(Ca)和单异戊基二巯基丁二酸(MiADMSA)可以减轻复合暴露的氧化损伤,并缓解了复合暴露引起的神经损伤[25-26]。然而,更多的研究发现多种金属复合暴露会产生协同效应。Feng等[10]报道了暴露于Pb、As、邻苯二甲酸二辛酯(DOP)混合物的幼鼠脑中出现重金属累积现象,并表现出协同效应,可抑制小鼠的生长发育,造成大脑损伤,引起神经毒性并诱导海马神经元凋亡。Rai等[27]发现幼鼠经As、Cd和Pb灌胃处理后,出现学习记忆缺陷、过度运动等行为障碍,进一步检测发现脑部金属累积量呈剂量依赖式增加,并且这3种重金属联合处理诱导的凋亡表现出协同效应。另外,有研究表明在Pb、Cd、As和Hg联合暴露小鼠后造成包括大脑、肝脏、睾丸和肾脏在内的多个脏器病理损伤,并引起神经毒性,损伤神经系统,也呈现出协同效应[28]。
重金属复合暴露会对生长发育产生影响,破坏生殖系统。Bizarro等[29]的研究表明,CD-1小鼠暴露于0.01 mol·L-1的Pb(CH3COO)2和0.006 mol·L-1 CdCl2混合物中,呈现出协同效应,与单一暴露相比,复合暴露导致小鼠睾丸中支持细胞线粒体损伤加重,并呈现出时间依赖性,还会破坏精子的产生,造成生殖障碍。Adedara等[30]报道小鼠暴露于As(60 mg·L-1)和锰(Mn 30 mg·L-1)的混合物,抑制了小鼠体质量的增长;与单独暴露相比,混合暴露会引起氧化损伤并出现明显的病变,如大脑神经元的变形坏死和曲细精管的明显变性等,严重影响了神经元的功能以及精子数量和质量。Száková等[31]的研究显示As和Cd复合暴露,与单一暴露组相比,复合暴露会显著抑制大鼠体质量的增长,在饲料中加入As可以促进Cd在睾丸中的累积;饲料中Cd增加肝脏和肾脏中As的含量,降低了睾丸中As的累积。另外,有研究发现Pb和As共暴露8周后会影响小鼠日平均摄水量,体质量明显低于正常组,活动力也出现下降,这种现象在Pb、As和DOP共暴露后更明显[10]。
重金属复合暴露还会对动物的心脑血管系统造成影响。Wildemann等[32]用雄性Wistar大鼠研究了Hg2+或甲基汞(MeHg)与Pb联合暴露对心血管系统的影响,研究表明混合暴露可以逆转单独暴露MeHg时血压和脉压升高的现象,但是混合物暴露对心脏电导率产生不利影响,随后他们发现金属混合物引起血压失调、氧化应激和肾脏损伤等现象与肾素-血管紧张素系统(RAS)的激活有关[33]。这些研究表明,复合暴露的毒性作用方式与实验终点相关。Arbi等[34]发现大鼠单独暴露于Hg和Cd会对凝血系统产生显著影响,Hg促进Cd的毒性,影响纤维蛋白纤维网络的形成。另外,有研究发现雄性小鼠暴露在Pb(CH3COO)2中会导致血红蛋白含量降低,但补充含Zn、铁(Fe)元素的混合物可以缓解Pb引起的血红蛋白和超氧化物歧化酶的改变以及心肌线粒体的损伤[35]。
2.2 其他动物模型
与哺乳动物相比,重金属复合对一些非哺乳动物的影响更加复杂多样。重金属种类、剂量的不同会产生不同的影响,但这些毒性机制的研究目前还较为缺乏。
与哺乳动物类似,重金属复合会影响部分动物的神经发育,如表2所示。Bouraoui等[36]发现沙蚕暴露于Cu和苯并芘(BaP)的混合物会引起神经毒性,乙酰胆碱酯酶(AchE)活性受到强烈的抑制;进一步研究发现,混合处理还会影响脂质过氧化等过程,导致抗氧化酶活性和丙二醛(MDA)含量上升等现象。Wu和Wang[37]探讨Cu和Cd毒性时发现,当贝类接触Cu和Cd混合物时,呈现出协同效应,表现在谷氨酸-谷氨酰胺代谢紊乱、乳酸含量增加、ATP合成减少并造成能量代谢紊乱和氧化应激反应,引起神经毒性。Lu等[38]发现与Mn处理相比,Pb和Mn混合暴露促进秀丽线虫的神经毒性,导致DA神经元缺陷、神经元分支异常和细胞体萎缩等现象,导致运动行为障碍。而Tang等[39]随后以秀丽线虫为模型研究Cd、Pb和Mn混合物的毒性效应,也发现Pb+Mn呈现出协同作用,会引起多巴胺神经元的异常,如在转基因品系BY250中,Pb和Mn混合会诱导神经退行性反应,此外,他们的研究还发现Mn可以缓解Cd引起的毒性作用。Heffern等[40]发现重金属复合暴露会引起斑马鱼基于嗅觉的行为发生改变,其中暴露于Cd和Zn的二元混合物时,低浓度的Zn对Cd的毒性有保护作用。
表2 重金属对神经系统的影响
Table 2 The effects of heavy metals on the nervous system
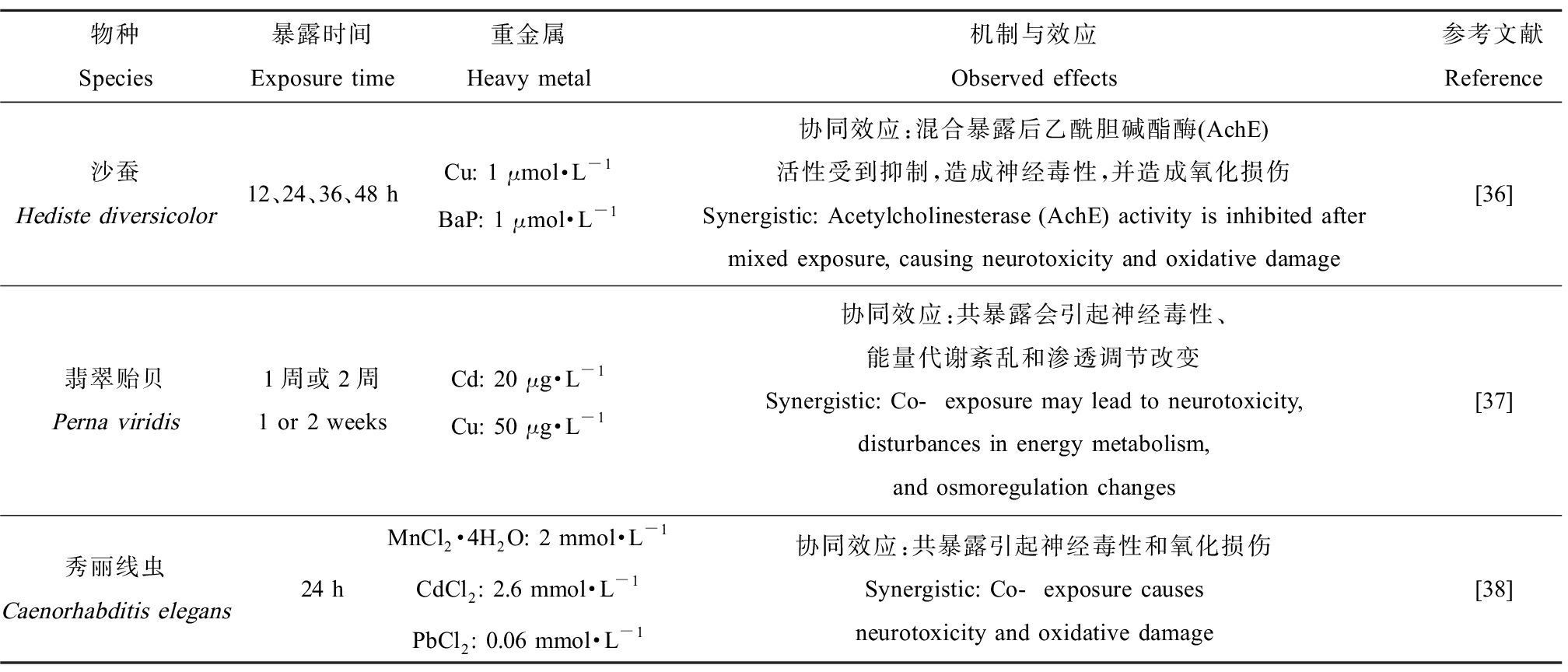
物种Species暴露时间Exposure time重金属Heavy metal机制与效应Observed effects参考文献Reference沙蚕Hediste diversicolor12、24、36、48 hCu: 1 μmol·L-1BaP: 1 μmol·L-1协同效应:混合暴露后乙酰胆碱酯酶(AchE)活性受到抑制,造成神经毒性,并造成氧化损伤Synergistic: Acetylcholinesterase (AchE) activity is inhibited after mixed exposure, causing neurotoxicity and oxidative damage[36]翡翠贻贝Perna viridis1周或2周1 or 2 weeksCd: 20 μg·L-1Cu: 50 μg·L-1协同效应:共暴露会引起神经毒性、能量代谢紊乱和渗透调节改变Synergistic: Co-exposure may lead to neurotoxicity, disturbances in energy metabolism, and osmoregulation changes[37]秀丽线虫Caenorhabditis elegans24 hMnCl2·4H2O: 2 mmol·L-1CdCl2: 2.6 mmol·L-1PbCl2: 0.06 mmol·L-1协同效应:共暴露引起神经毒性和氧化损伤Synergistic: Co-exposure causes neurotoxicity and oxidative damage[38]
复合重金属会对生长发育和生殖产生影响,如表3所示。研究发现重金属复合暴露的浓度、处理时间会显著影响其复合毒性。Driessnack等[41]发现单独暴露CdCl2(7 μg·L-1)、ZnCl2(170 μg·L-1)对黑头软口鲦的繁殖无显著影响,但是混合暴露后繁殖率下降50%,并且雌二醇的含量显著降低、肝雌激素受体和卵黄蛋白原基因表达也有所下降,长期暴露于Cd和Zn的混合物中可能会破坏鱼类中雌激素介导的功能,在生殖系统中引起协同效应。进一步研究发现混合暴露,Zn降低Cd在鳃和肝脏中的累积量,这可能是由于Cd和Zn竞争结合位点造成的。而Arini等[42]研究Cd和Zn对斑马鱼的组织损伤时,发现Zn可以缓解Cd引起的毒性作用。这可能是由于他们在复合暴露使用的Cd和Zn的浓度比(1∶35)低于Driessnack使用的浓度比。因此,复合暴露的金属浓度会显著影响复合毒性。Pérez和Hoang[43]在水瘙模型中发现低浓度的Ni可以拮抗Cd的毒性作用,主要表现在死亡率、生长发育等终点上,但是高浓度的Ni会促进Cd的毒性。Moyson等[44]研究Zn、Cu和Cd的LC20浓度在线虫体内的混合毒性时发现三元金属混合物处理24 h后出现相加效应,但是处理48 h后出现拮抗效应,二元或三元的金属混合物处理都会导致线虫运动力下降。后续研究发现金属毒性与浓度、暴露时间和混合物成分有关,暴露于LC20水平的Cd、Cu+Zn、Cu+Cd、Zn+Cu+Cd等单一或多元复合物的线虫种群数量急剧下降,而在LC5水平下,所有种群数量呈上升趋势[45]。
表3 重金属对生长与生殖的影响
Table 3 The effects of heavy metals on growth and reproduction
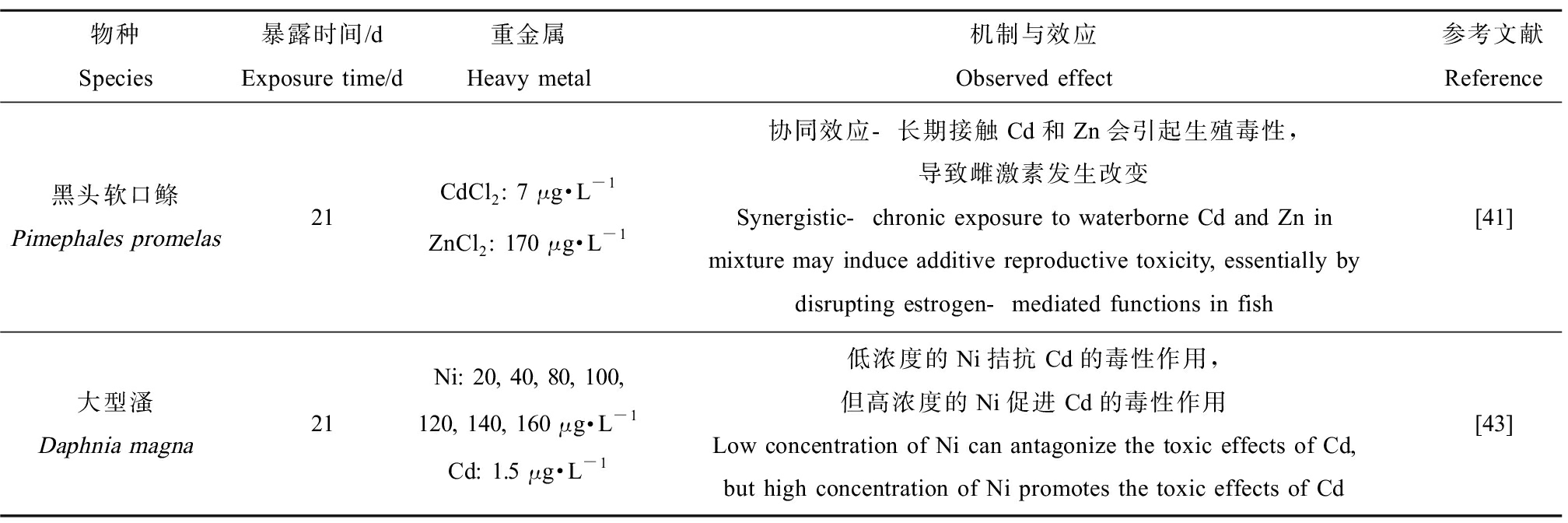
物种Species暴露时间/dExposure time/d重金属Heavy metal机制与效应Observed effect参考文献Reference黑头软口鲦Pimephales promelas21CdCl2: 7 μg·L-1ZnCl2: 170 μg·L-1协同效应-长期接触Cd和Zn会引起生殖毒性,导致雌激素发生改变Synergistic-chronic exposure to waterborne Cd and Zn in mixture may induce additive reproductive toxicity, essentially by disrupting estrogen-mediated functions in fish[41]大型溞Daphnia magna21Ni: 20, 40, 80, 100, 120, 140, 160 μg·L-1Cd: 1.5 μg·L-1低浓度的Ni拮抗Cd的毒性作用,但高浓度的Ni促进Cd的毒性作用Low concentration of Ni can antagonize the toxic effects of Cd, but high concentration of Ni promotes the toxic effects of Cd[43]
重金属会对部分动物的应激与代谢产生影响。Lu等[38]利用秀丽线虫研究重金属复合毒性时发现不同的实验终点的响应并不一致。如在亚致死剂量的实验中,与单一Mn、Pb暴露相比,Mn和Pb复合暴露对生殖和寿命都有相加效应,这种效应可能是因为Pb和Mn都会影响氧化应激反应,复合加重了对氧化应激反应和对某些必需金属离子(如Zn、Fe和Ca)等的干扰;与单一Mn、Cd暴露相比,Mn和Cd的复合暴露对寿命有相加效应,但对生殖无显著影响,有研究表明Mn和Cd有相同的转运体即二价金属转运体(DTM-1)[46],与金属转运蛋白的结合可能是引起这种效应的原因。Castaldo等[47]利用鲤鱼研究Cu和Cd单一和混合毒性时发现,Cu对Cd的吸收有抑制作用,但高浓度的Cu会促进Cd的积累;2种重金属的存在导致总Na+、K+和Ca2+的流失,但鲤鱼可以通过诱导Na+/K+-ATP酶和H+-ATP酶基因的表达来弥补Na+的流失;此外还发现与单一Cu、Cd暴露相比,复合暴露会诱导金属硫蛋白和抗氧化系统基因的表达,以减少金属在机体中的积累和氧化损伤。Cobbina等[48]以斑马鱼为模型,研究Pb(0.01 mg·L-1)、Hg(0.001 mg·L-1)、As(0.01 mg·L-1)和Cd(0.005 mg·L-1)的复合毒性时,发现金属混合物会在调节免疫基因时表现出不同的反应,但普遍上调了IFNγ的表达。不同的重金属组合暴露对基因表达的影响不同,与单一暴露组相比,IL1β基因在Pb和As混合暴露时显著上调,在Pb、Hg和Cd混合暴露中受到抑制,呈现出拮抗效应。此外,重金属复合暴露时,抗氧化基因也受到影响,过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)的表达量普遍上升,超氧化物歧化酶(SOD)降低。多因素分析表明,单一金属暴露对先天免疫基因的调节有很大影响,而重金属复合暴露则影响抗氧化基因的表达。
3 重金属复合暴露对于植物的毒理效应(Toxicological effects of heavy metal compound exposure on plants)
重金属广泛存在于土壤及水环境中,土壤中的金属离子及其他物质会被植物体吸收,从而对植物体造成影响。研究表明,复合重金属对植物体的毒性作用与金属暴露时间、浓度等有关。
重金属复合暴露不仅会影响植物根系的吸收,也会影响植物体的生长发育。Lanier等[49]利用食用甘蓝和白三叶草为模型研究Cd和Pb的慢性毒性作用时,发现复合暴露减缓白三叶草植物根部的生长,并且对DNA造成损伤,这种DNA损伤随着暴露时间的不同而呈现出差异性:短时间暴露时,金属二元复合物在白三叶草中对DNA的损伤表现出协同效应;在10 d后开始表现出拮抗效应;而在56 d后,DNA的损伤率显著低于单独暴露Cd时的损伤率,这可能是由于长期暴露后金属之间会相互竞争结合位点,出现补偿机制。在以宽叶香蒲为模型的研究中[50],也发现Cd和Pb复合暴露处理后的协同作用。Israr等[51]研究Cu、Pb、Ni和Zn对田菁属植物(S. drummondii)的影响时发现,金属混合物显著抑制植物的生长,并且植物根部的金属浓度大于芽;根系中金属吸收的顺序为Pb>Cu>Zn>Ni,而芽中金属吸收的顺序为Pb>Zn>Cu>Ni,与单一金属处理相比,复合暴露会显著提高植物抗氧化物酶的活性,表明金属共存会增加氧化应激反应。以上研究显示重金属复合毒性对植物根系损伤作用相较于单一重金属毒性来说更为复杂,暴露时会受到多种因素的干扰,尤其是暴露时间的影响。
此外,重金属在植物中的复合毒性会受到重金属浓度的影响。Martinez等[52]利用浮萍研究了Cd和Zn的单一及复合毒性,Zn在低浓度(2.3 mg·L-1)时对浮萍有促进作用,但是随着浓度的升高,这种促进作用会变成抑制作用。该研究应用浓度加和模型(CA)模型来评估了Cd+Zn二元复合物的相互作用,结果显示金属复合物浓度的增加会不断抑制植物的生长,并且发现CAT、抗坏血酸过氧化氢酶(APOX)和愈创木酚过氧化物酶(GPOX)的活性显著高于对照组,当Zn在混合物中的浓度低于50 mg·L-1时会产生协同作用,而在较高的Zn浓度下,这种协同作用相对较弱。赵晓祥等[53]发现Zn和Cd的对番茄幼苗的复合效应与其质量比有关,低Zn质量比对植物生长具有促进作用,能一定程度上缓解植物的膜脂过氧化,表现为拮抗作用,但随施加质量比增加,Zn与Cd产生协同作用。季冬雪等[54]探讨不同浓度配比的Cu-Cd、Zn-Cd和Cu-Zn对水稻根相对伸长毒性及元素吸收的影响时发现,不同浓度Zn的加入均抑制水稻对Cd的吸收,高浓度的Cu可以抑制水稻对Zn的吸收,呈现出拮抗作用。但在相同毒性效应浓度下,Cu-Cd对水稻毒性因浓度配比不同而呈现出协同、相加和拮抗等不同作用,而Zn-Cd和Cu-Zn对水稻根系毒性均表现出拮抗作用。
4 机制研究(Mechanism studies)
对于重金属的复合毒性研究多数停留在个体及组织器官等水平上,近年来才逐渐深入到细胞及分子层面上,目前的机制研究如图2所示,重金属会在机体内累积,尤其是肝、肾等部位,并进一步影响生物体的生长发育、基础代谢,甚至造成机体的死亡。致毒机制研究主要在于重金属复合会引起机体的氧化应激反应,进一步造成组织器官等的损伤,部分研究还发现重金属复合会造成DNA损伤,影响基因表达。
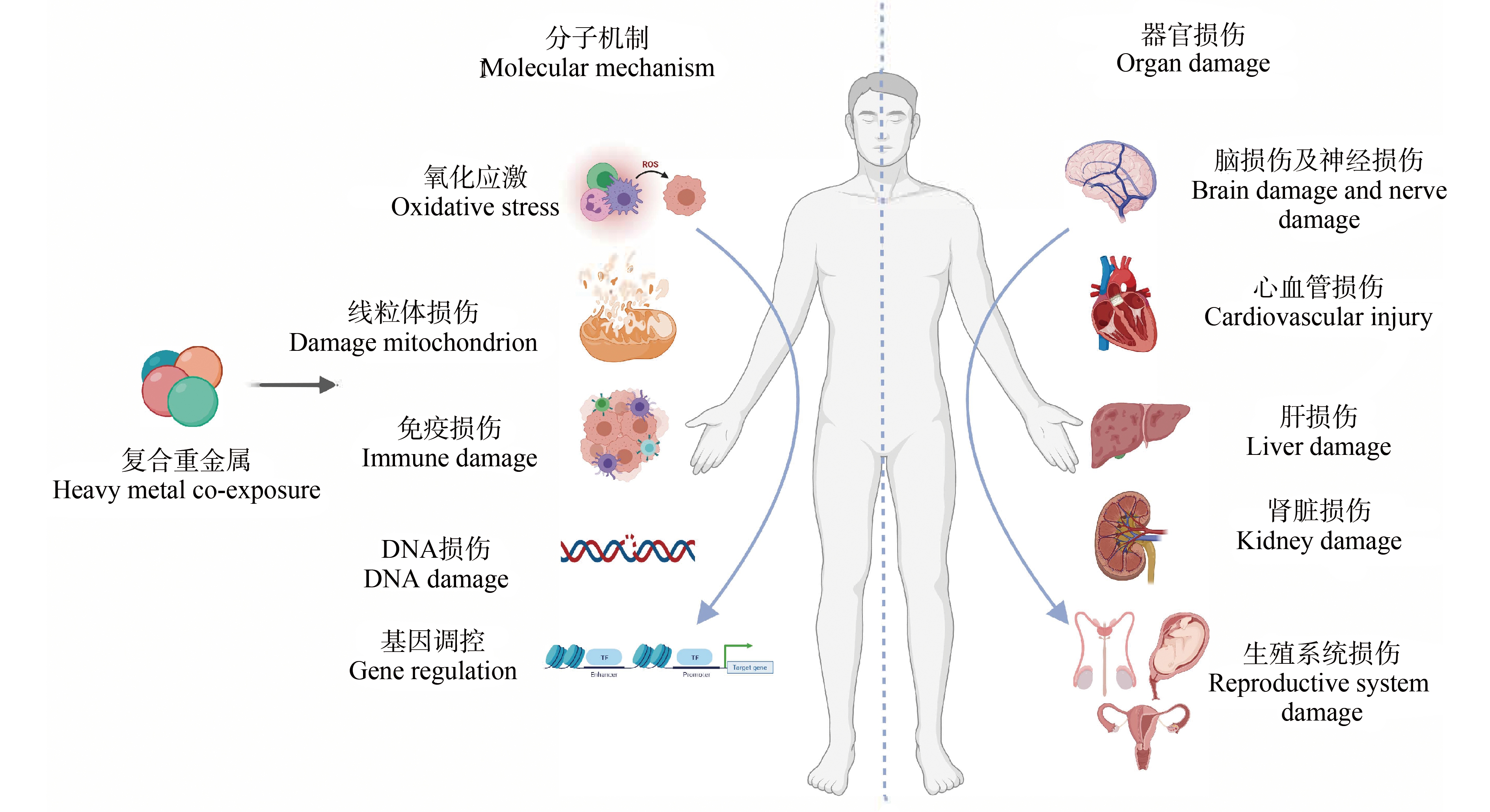
图2 复合重金属暴露的损伤与机制
Fig. 2 Damage and mechanism of heavy metal co-exposure
4.1 氧化应激
氧化应激是体内氧化与抗氧化失衡,偏向于氧化的一种状态。活性氧的形成最终会引起脂质过氧化,造成细胞甚至DNA损伤。研究表明氧化应激反应与糖尿病、神经退行性疾病及心血管等疾病有关。动植物及流行病学研究均揭示重金属会导致机体产生过多的活性氧从而引起氧化应激反应,但是不同的重金属复合会产生不同的影响,部分重金属之间相互作用产生协同或加和作用,但是也有重金属复合之后产生拮抗作用。
Domingo-Relloso等[55]发现尿液中Cd、Cr、钼(Mo)和Zn等金属含量的增加与成年人氧化应激标志物增加有关,如谷胱甘肽比(GSSG/GSH)受Cr影响最大,MDA和8-oxo-dG受Zn驱动,这一发现表明氧化应激与人体健康有着密切的联系。Rai等[27]利用大鼠研究发现As、Cd和Pb复合处理会促使活性氧(ROS)产生,胞内Ca2+浓度升高,诱发氧化应激反应,并促使星形胶质细胞凋亡,造成神经损伤,呈现出协同效应。Davuljigari和Gottipolu等[56]发现小鼠接触Pb会降低SOD、硫氧还蛋白氧化还原酶(TrxR)等抗氧化酶的活性,但是MDA含量在年长的小鼠中显著升高。但是在添加营养物质,如金属混合物(Ca、Zn和Fe)后,这种现象得到显著改善,进一步发现补充营养物质有助于恢复酶中的金属辅助因子,并防止自由基的增加。Cobbina等[48]发现低浓度的Pb、Hg、As和Cd复合暴露斑马鱼时,与单一暴露组相比,4种重金属复合暴露后,SOD和GPx活性显著提高。Huang等[57]利用中华蟾蜍研究Cu和Cr单一及混合毒性时发现,重金属复合处理比单一处理对胚胎发育表现出更明显的抑制作用,显著缩短胚胎的长度及发育时间,并致使胚胎畸形,呈现出协同作用。研究还发现,与对照组相比,混合暴露导致氧化应激相关基因(如hsp90、sod和gpx)和脂肪酸β氧化相关基因(acoxl、echs1和scp)表达量上升;相反,脂质合成相关的mRNA基因表达量降低,其中,Cr和Cu的混合物对脂质代谢基因表达的影响最大。Castaldo等[47]利用鲤鱼研究Cu和Cd混合毒性时发现,与单一暴露组相比,重金属混合物处理会诱导金属硫蛋白和抗氧化系统基因的表达,以减少金属在机体中的积累和氧化损伤。刘祥等[58]研究不同浓度的Cd和Pb单一及联合暴露对日本沼虾的氧化损伤及交互作用时发现,Cd对虾的致死浓度为1 mg·L-1,当其与同浓度Pb联合时,致死毒性增强;在0.01 mg·L-1和0.1 mg·L-1下联合时对SOD、CAT和MDA等活性或含量均表现为拮抗作用。Martinez等[52]利用浮萍研究Cd和Zn的单一及复合毒性时发现,金属复合物浓度的逐渐增加会抑制植物的生长,且CAT、APOX和GPOX的活性显著高于对照组。Zhang等[59]利用通过细胞实验证明Se可以拮抗Cd造成的肝毒性,减少细胞死亡和细胞形态变化。研究表明Cd通过扰乱内质网驻留的Se蛋白转录并触发内质网应激和未折叠的蛋白反应而诱导肝毒性,补充Se可以调节内质网驻留的Se蛋白转录来抑制内质网应激,从而显著减轻肝细胞的损伤;同时Se还可以通过减少ROS的产生、降低谷胱甘肽水平及增加GPx活性来缓解Cd引起的氧化应激。Wang等[60]发现重金属复合(Zn、Mn、Pb、Cu、Cd、Hg、Cr和Ni)会引起ROS的产生,脂质过氧化并导致HL7702细胞中三磷酸腺苷水平降低,同时以剂量依赖的形式诱导细胞凋亡,但是加入20 μmol·L-1木犀草素会通过下调ROS激活线粒体途径缓解复合重金属对细胞造成的伤害。
4.2 DNA损伤
DNA损伤是指核苷酸序列发生改变从而造成的功能改变遗传给后代的一种机制。研究表明很多重金属都会导致DNA损伤,如Cd、Hg、Pb和As等,但是复合重金属造成的损伤存在差异。
Wu等[61]发现Cd的浓度会影响Pb和Cd复合对蚯蚓的毒性,低浓度的Cd中加入Pb会增加DNA的损伤,但是在高浓度的Cd中加入Pb会降低对DNA的损伤,这可能是因为这2种金属在土壤中相互作用引起的。de Oliveira等[62]发现淡水鱼接触Zn、Mn和Fe等重金属会引起氧化应激反应,Mn和Fe会造成细胞的氧化损伤和DNA损伤,3种重金属混合暴露增强了这些损伤效应,这可能是金属在体内的累积增加造成的。Boukadida等[63]发现温度会影响金(Au)、Cu对紫贻贝的毒性,共同暴露于金属和较高温度下,贻贝幼虫的DNA损伤显著增加,并且氧化损伤更加严重。当幼虫暴露于单个重金属刺激下,与DNA修复和DNA复制的基因(p53,DNA连接酶Ⅱ和拓扑异构酶Ⅱ)等表达上升,但在多重刺激下,参与细胞凋亡途径的caspase-3被过表达。张迎梅等[64]的研究结果也表明Cd会增加Pb或Zn对泥鳅的DNA损伤,并且呈时间和剂量依赖式效应。Lanier等[49]利用食用甘蓝和白三叶草为模型研究Cd和Pb的慢毒性作用时发现,复合暴露会对DNA造成损伤,并且这种DNA损伤呈现出时间依赖性。
4.3 其他机制
总体来说,氧化应激及DNA损伤是研究较为深入的分子机制,除此以外,金属硫蛋白及表观遗传等也有报道。金属硫蛋白存在于生物体内,富含半胱氨酸,与金属有高亲和力,负责维持机体内的金属平衡,还可以缓解低剂量的重金属对机体的损伤,尤其是可以清除氧化自由基。Driessnack等[65]发现Cu和Ni复合暴露后会引起鱼的肝中金属硫蛋白含量上升,损害卵巢,破坏能量代谢,并引起生殖毒性,进一步研究发现复合暴露会增加每种金属在组织内的累积,进而加重对鱼类的损伤。他们[41]还发现Zn与Cd复合暴露后,Zn减少Cd在鳃和肝脏中的累积。与单独暴露相比,复合暴露严重影响雌性激素的表达,并造成生殖毒性。在Castaldo等[66]的研究中发现鲤鱼暴露在Cu、Zn和Cd的混合金属中,金属硫蛋白的表达比对照组显著上升,但是在Cd和Cu的共同存在下,金属硫蛋白会增强与Cu和Cd的亲和力,缓解复合重金属对机体造成的氧化损伤。张融等[67]发现Cd和Zn单独暴露会导致大型蚤体内金属硫蛋白含量随金属浓度升高而升高,而复合暴露后,蚤体内金属硫蛋白含量随浓度升高呈现出先上升后下降的趋势,在较低浓度时表现为协同作用,中等浓度时表现为相加作用,而较高浓度时表现为拮抗作用,这可能是相互竞争结合位点导致的。Martínez-Pacheco等[68]发现As、Cd和Pb等重金属混合后会引起小鼠成纤维细胞miRNA和mRNA的表达发生变化,进一步研究发现这些基因与炎症、癌症的发生和发展有关,部分还与细胞的增殖分化及死亡有关。
5 总结与展望(Conclusion and prospect)
围绕重金属污染物单一暴露的毒性效应及机制已开展深入研究,复合暴露及毒性效应研究相对起步较晚,在生物机体中的作用并不明确。近年来,研究人员通过多种体内外实验模型,探究了典型重金属污染物如As、Hg等在小鼠中累积、分布及毒性响应特征。大量研究表明,重金属复合会引起机体的氧化应激反应、动物的神经损伤和生长与生殖毒性,甚至会对DNA造成严重损伤,还会影响表观遗传。但目前的研究大部分只是停留在机体的现象上,对于分子水平的研究较少,没有形成完整的体系。
单一重金属对于生物体的毒性呈现浓度依赖效应,而重金属的种类也会对机体产生不同的影响,这导致多种重金属的复合毒性研究十分复杂。暴露的重金属种类、浓度和时间不同会在机体内产生不同的效应,部分重金属之间会产生相互作用,从而影响生物体的吸收和累积,机体不同部位对于重金属的累积量也会不同,影响其最终的毒理效应。重金属复合毒性还受到温度等外界因素的影响,部分重金属会在机体内竞争与蛋白的结合位点从而影响复合毒性作用。另外,评估重金属复合毒性时,不同的生物模型对重金属的评价可能会有所差异,导致重金属复合毒性的机制研究存在诸多的不确定性。
重金属复合暴露毒理学实验设计的环境相关性近年来已受到人们的关注,特别是基于典型污染区域的调查进行生物模型、重金属剂量和重金属种类等关键要素的选择以及低剂量长期暴露对于不同生物模型的毒理学效应。在不同环境条件(如温度、氧化还原环境和pH值等)下,复合重金属之间的相互作用及其对受试生物毒性产生的影响,挖掘毒理学现象背后的物理化学机制目前尚处起步阶段,亟待引入新的技术和检测手段,通过实时动态监测重金属在活体模型生物各个器官、组织内的累积量及赋存状态,对重金属进行修饰或标记以追踪其与生物分子相互作用等,推进重金属复合毒性在组织细胞及分子水平上的机制研究。此外,效应相加模型(ES)、CA和独立作用模型(IA)等统计模型并不能全面评估环境中各种重金属的毒性,因此需要结合基因组学、蛋白组学和代谢组学等生物信息学手段进行一体化分析。
[1] Islam M S, Ahmed M K, Raknuzzaman M, et al. Heavy metal pollution in surface water and sediment: A preliminary assessment of an urban river in a developing country [J]. Ecological Indicators, 2015, 48: 282-291
[2] Lin H S, Li H J, Yang X L, et al. Comprehensive investigation and assessment of nutrient and heavy metal contamination in the surface water of coastal Bohai Sea in China [J]. Journal of Ocean University of China, 2020, 19(4): 843-852
[3] Hu X F, Jiang Y, Shu Y, et al. Effects of mining wastewater discharges on heavy metal pollution and soil enzyme activity of the paddy fields [J]. Journal of Geochemical Exploration, 2014, 147: 139-150
[4] Marrugo-Negrete J, Pinedo-Hernández J, Díez S. Assessment of heavy metal pollution, spatial distribution and origin in agricultural soils along the Sinú River Basin, Colombia [J]. Environmental Research, 2017, 154: 380-388
[5] Harada M. Minamata disease: Methylmercury poisoning in Japan caused by environmental pollution [J]. Critical Reviews in Toxicology, 1995, 25(1): 1-24
[6] Holdaway J, Wang W Y. From soil pollution to “cadmium rice” to public health impacts: An interdisciplinary analysis of influencing factors and possible responses [J]. Journal of Resources and Ecology, 2018, 9(1): 1
[7] Chai B W, Wei Q, She Y Z, et al. Soil microplastic pollution in an e-waste dismantling zone of China [J]. Waste Management, 2020, 118: 291-301
[8] Iordache A M, Nechita C, Pluhacek T, et al. Past and present anthropic environmental stress reflect high susceptibility of natural freshwater ecosystems in Romania [J]. Environmental Pollution, 2020, 267: 115505
[9] Huang W J, Pang Y T, Luo X S, et al. The cytotoxicity and genotoxicity of PM2.5 during a snowfall event in different functional areas of a megacity [J]. The Science of the Total Environment, 2020, 741: 140267
[10] Feng W W, Wu X S, Mao G H, et al. Neurological effects of subchronic exposure to dioctyl phthalate (DOP), lead, and arsenic, individual and mixtures, in immature mice [J]. Environmental Science and Pollution Research International, 2020, 27(9): 9247-9260
[11] 马青清, 王博, 张责研, 等. 太湖北部表层沉积物重金属污染及其生物毒性研究[J]. 生态毒理学报, 2016, 11(3): 204-210
Ma Q Q, Wang B, Zhang Z Y, et al. Study on heavy metals pollution in sediments from north of Taihu Lake and its biological toxicity [J]. Asian Journal of Ecotoxicology, 2016, 11(3): 204-210 (in Chinese)
[12] 张明兴, 王莹, 王立军, 等. 重金属和聚苯乙烯微球对卤虫的复合毒性效应研究[J]. 生态毒理学报, 2019, 14(1): 99-105
Zhang M X, Wang Y, Wang L J, et al. Combined toxicity of polystyrene microplastics and heavy metals to brine shrimp (Artemia parthenogenetica) [J]. Asian Journal of Ecotoxicology, 2019, 14(1): 99-105 (in Chinese)
[13] Martin O, Scholze M, Ermler S, et al. Ten years of research on synergisms and antagonisms in chemical mixtures: A systematic review and quantitative reappraisal of mixture studies [J]. Environment International, 2021, 146: 106206
[14] Wang Z J, Liu S S, Feng L, et al. BNNmix: A new approach for predicting the mixture toxicity of multiple components based on the back-propagation neural network [J]. Science of the Total Environment, 2020, 738: 140317
[15] Bhagat J, Nishimura N, Shimada Y. Toxicological interactions of microplastics/nanoplastics and environmental contaminants: Current knowledge and future perspectives [J]. Journal of Hazardous Materials, 2021, 405: 123913
[16] Freire C, Amaya E, Gil F, et al. Placental metal concentrations and birth outcomes: The Environment and Childhood (INMA) project [J]. International Journal of Hygiene and Environmental Health, 2019, 222(3): 468-478
[17] Kim S S, Xu X J, Zhang Y L, et al. Birth outcomes associated with maternal exposure to metals from informal electronic waste recycling in Guiyu, China [J]. Environment International, 2020, 137: 105580
[18] Moody E C, Colicino E, Wright R O, et al. Environmental exposure to metal mixtures and linear growth in healthy Ugandan children [J]. PLoS One, 2020, 15(5): e0233108
[19] Liu S H, Bobb J F, Claus Henn B, et al. Bayesian varying coefficient kernel machine regression to assess neurodevelopmental trajectories associated with exposure to complex mixtures [J]. Statistics in Medicine, 2018, 37(30): 4680-4694
[20] ![]() ńska D, Siwińska E, Kapka L, et al. The influence of environmental exposure to complex mixtures including PAHs and lead on genotoxic effects in children living in Upper Silesia, Poland [J]. Mutagenesis, 2006, 21(5): 295-304
ńska D, Siwińska E, Kapka L, et al. The influence of environmental exposure to complex mixtures including PAHs and lead on genotoxic effects in children living in Upper Silesia, Poland [J]. Mutagenesis, 2006, 21(5): 295-304
[21] Dudka I, Kossowska B, Senhadri H, et al. Metabonomic analysis of serum of workers occupationally exposed to arsenic, cadmium and lead for biomarker research: A preliminary study [J]. Environment International, 2014, 68: 71-81
[22] Wang Y, Zhang P, Chen X, et al. Multiple metal concentrations and gestational diabetes mellitus in Taiyuan, China [J]. Chemosphere, 2019, 237: 124412
[23] Duan W W, Xu C, Liu Q, et al. Levels of a mixture of heavy metals in blood and urine and all-cause, cardiovascular disease and cancer mortality: A population-based cohort study [J]. Environmental Pollution, 2020, 263(Pt A): 114630
[24] Adedara I A, Adegbosin A N, Abiola M A, et al. Neurobehavioural and biochemical responses associated with exposure to binary waterborne mixtures of zinc and nickel in rats [J]. Environmental Toxicology and Pharmacology, 2020, 73: 103294
[25] Kadeyala P K, Sannadi S, Gottipolu R R. Alterations in apoptotic caspases and antioxidant enzymes in arsenic exposed rat brain regions: Reversal effect of essential metals and a chelating agent [J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 1150-1166
[26] Saritha S, Davuljigari C B, Kumar K P, et al. Effects of combined arsenic and lead exposure on the brain monoaminergic system and behavioral functions in rats: Reversal effect of MiADMSA [J]. Toxicology and Industrial Health, 2019, 35(2): 89-108
[27] Rai A, Maurya S K, Khare P, et al. Characterization of developmental neurotoxicity of As, Cd, and Pb mixture: Synergistic action of metal mixture in glial and neuronal functions [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2010, 118(2): 586-601
[28] Zhou F K, Xie J, Zhang S Y, et al. Lead, cadmium, arsenic, and mercury combined exposure disrupted synaptic homeostasis through activating the Snk-SPAR pathway [J]. Ecotoxicology and Environmental Safety, 2018, 163: 674-684
[29] Bizarro P, Acevedo S, Ni o-Cabrera G, et al. Ultrastructural modifications in the mitochondrion of mouse Sertoli cells after inhalation of lead, cadmium or lead-cadmium mixture [J]. Reproductive Toxicology, 2003, 17(5): 561-566
o-Cabrera G, et al. Ultrastructural modifications in the mitochondrion of mouse Sertoli cells after inhalation of lead, cadmium or lead-cadmium mixture [J]. Reproductive Toxicology, 2003, 17(5): 561-566
[30] Adedara I A, Abolaji A O, Awogbindin I O, et al. Suppression of the brain-pituitary-testicular axis function following acute arsenic and manganese co-exposure and withdrawal in rats [J]. Journal of Trace Elements in Medicine and Biology: Organ of the Society for Minerals and Trace Elements (GMS), 2017, 39: 21-29
[31] Száková J, Zídek V, Miholová D. Influence of elevated content of cadmium and arsenic in diet containing feeding yeast on organisms of rats [J]. Czech Journal of Animal Science, 2009, 54(1): 1-9
[32] Wildemann T M, Weber L P, Siciliano S D. Combined exposure to lead, inorganic mercury and methylmercury shows deviation from additivity for cardiovascular toxicity in rats [J]. Journal of Applied Toxicology: JAT, 2015, 35(8): 918-926
[33] Wildemann T M, Siciliano S D, Weber L P. The mechanisms associated with the development of hypertension after exposure to lead, mercury species or their mixtures differs with the metal and the mixture ratio [J]. Toxicology, 2016, 339: 1-8
[34] Arbi S, Oberholzer H M, van Rooy M J, et al. Effects of chronic exposure to mercury and cadmium alone and in combination on the coagulation system of Sprague-Dawley rats [J]. Ultrastructural Pathology, 2017, 41(4): 275-283
[35] Basha D C, Basha S S, Reddy G R. Lead-induced cardiac and hematological alterations in aging Wistar male rats: Alleviating effects of nutrient metal mixture [J]. Biogerontology, 2012, 13(4): 359-368
[36] Bouraoui Z, Banni M, Ghedira J, et al. Evaluation of enzymatic biomarkers and lipoperoxidation level in Hediste diversicolor exposed to copper and benzo[a]pyrene [J]. Ecotoxicology and Environmental Safety, 2009, 72(7): 1893-1898
[37] Wu H F, Wang W X. NMR-based metabolomic studies on the toxicological effects of cadmium and copper on green mussels Perna viridis [J]. Aquatic Toxicology, 2010, 100(4): 339-345
[38] Lu C L, Svoboda K R, Lenz K A, et al. Toxicity interactions between manganese (Mn) and lead (Pb) or cadmium (Cd) in a model organism the nematode C. elegans [J]. Environmental Science and Pollution Research International, 2018, 25(16): 15378-15389
[39] Tang B W, Tong P, Xue K S, et al. High-throughput assessment of toxic effects of metal mixtures of cadmium (Cd), lead (Pb), and manganese (Mn) in nematode Caenorhabditis elegans [J]. Chemosphere, 2019, 234: 232-241
[40] Heffern K, Tierney K, Gallagher E P. Comparative effects of cadmium, zinc, arsenic and chromium on olfactory-mediated neurobehavior and gene expression in larval zebrafish (Danio rerio) [J]. Aquatic Toxicology, 2018, 201: 83-90
[41] Driessnack M K, Jamwal A, Niyogi S. Effects of chronic waterborne cadmium and zinc interactions on tissue-specific metal accumulation and reproduction in fathead minnow (Pimephales promelas) [J]. Ecotoxicology and Environmental Safety, 2017, 140: 65-75
[42] Arini A, Gourves P Y, Gonzalez P, et al. Metal detoxification and gene expression regulation after a Cd and Zn contamination: An experimental study on Danio rerio [J]. Chemosphere, 2015, 128: 125-133
[43] Pérez E, Hoang T C. Responses of Daphnia magna to chronic exposure of cadmium and nickel mixtures [J]. Chemosphere, 2018, 208: 991-1001
[44] Moyson S, Vissenberg K, Fransen E, et al. Mixture effects of copper, cadmium, and zinc on mortality and behavior of Caenorhabditis elegans [J]. Environmental Toxicology and Chemistry, 2018, 37(1): 145-159
[45] Moyson S, Town R M, Vissenberg K, et al. The effect of metal mixture composition on toxicity to C. elegans at individual and population levels [J]. PLoS One, 2019, 14(6): e0218929
[46] Garrick M D, Dolan K G, Horbinski C, et al. DMT1: A mammalian transporter for multiple metals [J]. BioMetals, 2003, 16(1): 41-54
[47] Castaldo G, Flipkens G, Pillet M, et al. Antagonistic bioaccumulation of waterborne Cu(Ⅱ) and Cd(Ⅱ) in common carp (Cyprinus carpio) and effects on ion-homeostasis and defensive mechanisms [J]. Aquatic Toxicology, 2020, 226: 105561
[48] Cobbina S J, Xu H, Zhao T, et al. A multivariate assessment of innate immune-related gene expressions due to exposure to low concentration individual and mixtures of four kinds of heavy metals on zebrafish (Danio rerio) embryos [J]. Fish & Shellfish Immunology, 2015, 47(2): 1032-1042
[49] Lanier C, Bernard F, Dumez S, et al. Combined toxic effects and DNA damage to two plant species exposed to binary metal mixtures (Cd/Pb) [J]. Ecotoxicology and Environmental Safety, 2019, 167: 278-287
[50] Alonso-Castro A J, Carranza-Alvarez C, Alfaro-De la Torre M C, et al. Removal and accumulation of cadmium and lead by Typha latifolia exposed to single and mixed metal solutions [J]. Archives of Environmental Contamination and Toxicology, 2009, 57(4): 688-696
[51] Israr M, Jewell A, Kumar D, et al. Interactive effects of lead, copper, nickel and zinc on growth, metal uptake and antioxidative metabolism of Sesbania drummondii [J]. Journal of Hazardous Materials, 2011, 186(2-3): 1520-1526
[52] Martinez S, Sáenz M E, Alberdi J L, et al. Comparative ecotoxicity of single and binary mixtures exposures of cadmium and zinc on growth and biomarkers of Lemna gibba [J]. Ecotoxicology, 2020, 29(5): 571-583
[53] 赵晓祥, 冯璐, 王宇晖. 锌、镉单一及复合胁迫下番茄幼苗生理响应及联合毒性的研究[J]. 安全与环境学报, 2020, 20(3): 1176-1184
Zhao X X, Feng L, Wang Y H. Physiological responses and joint toxicity of tomato seedlings under single and combined stress of zinc and cadmium [J]. Journal of Safety and Environment, 2020, 20(3): 1176-1184 (in Chinese)
[54] 季冬雪, 华珞, 王学东, 等. Cu-Cd、Zn-Cd、Cu-Zn复合污染对水稻毒性和重金属吸收的影响[J]. 环境污染与防治, 2018, 40(10): 1141-1146
Ji D X, Hua L, Wang X D, et al. The effects of combined heavy metals (Cu-Cd, Zn-Cd, Cu-Zn) on the toxicity and uptake of metal elements in rice [J]. Environmental Pollution & Control, 2018, 40(10): 1141-1146 (in Chinese)
[55] Domingo-Relloso A, Grau-Perez M, Galan-Chilet I, et al. Urinary metals and metal mixtures and oxidative stress biomarkers in an adult population from Spain: The Hortega Study [J]. Environment International, 2019, 123: 171-180
[56] Davuljigari C B, Gottipolu R R. Late-life cardiac injury in rats following early life exposure to lead: Reversal effect of nutrient metal mixture [J].Cardiovascular Toxicology, 2020, 20(3): 249-260
[57] Huang M Y, Duan R Y, Yin J W, et al. Individual and mixture toxicity of chromium and copper in development, oxidative stress, lipid metabolism and apoptosis of Bufo gargarizans embryos [J]. Aquatic Toxicology, 2020, 229: 105671
[58] 刘祥, 王敏, 陈求稳, 等. 典型重金属胁迫对日本沼虾的氧化损伤及交互作用[J]. 生态毒理学报, 2017, 12(6): 116-126
Liu X, Wang M, Chen Q W, et al. Oxidative damage and interaction induced by typical heavy metals in waters on the Macrobranchium nipponense [J]. Asian Journal of Ecotoxicology, 2017, 12(6): 116-126 (in Chinese)
[59] Zhang C, Ge J, Lv M W, et al. Selenium prevent cadmium-induced hepatotoxicity through modulation of endoplasmic reticulum-resident selenoproteins and attenuation of endoplasmic reticulum stress [J]. Environmental Pollution, 2020, 260: 113873
[60] Wang Y F, Su H, Song X, et al. Luteolin inhibits multi-heavy metal mixture-induced HL7702 cell apoptosis through downregulation of ROS-activated mitochondrial pathway [J]. International Journal of Molecular Medicine, 2018, 41(1): 233-241
[61] Wu B, Liu Z T, Xu Y, et al. Combined toxicity of cadmium and lead on the earthworm Eisenia fetida (Annelida, Oligochaeta) [J]. Ecotoxicology and Environmental Safety, 2012, 81: 122-126
[62] de Oliveira L F, Santos C, Risso W E, et al. Triple-mixture of Zn, Mn, and Fe increases bioaccumulation and causes oxidative stress in freshwater neotropical fish [J]. Environmental Toxicology and Chemistry, 2018, 37(6): 1749-1756
[63] Boukadida K, Cachot J, Morin B, et al. Moderate temperature elevation increase susceptibility of early-life stage of the Mediterranean mussel, Mytilus galloprovincialis to metal-induced genotoxicity [J]. The Science of the Total Environment, 2019, 663: 351-360
[64] 张迎梅, 王叶菁, 虞闰六, 等. 重金属Cd2+、Pb2+和Zn2+对泥鳅DNA损伤的研究[J]. 水生生物学报, 2006, 30(4): 399-403
Zhang Y M, Wang Y J, Yu R L, et al. Effects of heavy metals Cd2+, Pb2+ and Zn2+ on DNA damage of loach Misgurnus anguillicandatus [J]. Acta Hydrobiologica Sinica, 2006, 30(4): 399-403 (in Chinese)
[65] Driessnack M K, Jamwal A, Niyogi S. Effects of chronic exposure to waterborne copper and nickel in binary mixture on tissue-specific metal accumulation and reproduction in fathead minnow (Pimephales promelas) [J]. Chemosphere, 2017, 185: 964-974
[66] Castaldo G, Pillet M, Slootmaekers B, et al. Investigating the effects of a sub-lethal metal mixture of Cu, Zn and Cd on bioaccumulation and ionoregulation in common carp, Cyprinus carpio [J]. Aquatic Toxicology, 2020, 218: 105363
[67] 张融, 范文宏, 唐戈, 等. 水体中重金属镉和锌对大型蚤联合毒性效应的初步研究[J]. 生态毒理学报, 2008, 3(3): 286-290
Zhang R, Fan W H, Tang G, et al. A preliminary study on joint toxic effects of Cd and Zn on Daphnia magna [J]. Asian Journal of Ecotoxicology, 2008, 3(3): 286-290 (in Chinese)
[68] Martínez-Pacheco M, Hidalgo-Miranda A, Romero-Córdoba S, et al. MRNA and miRNA expression patterns associated to pathways linked to metal mixture health effects [J]. Gene, 2014, 533(2): 508-514