纳米材料由于具有尺寸效应、表面效应、界面效应和量子效应等常规尺寸材料所不具有的独特物理化学性质,其相关领域发展迅速。各种纳米材料大量涌现,人们接触纳米材料的机会亦随之增加。纳米颗粒物一旦摄入,会严重影响细胞和蛋白质的生理活性,甚至造成细胞死亡。这就引发了人们对纳米颗粒健康风险的关注和讨论[1-2]。
纳米碳酸钙是目前用途最广的无机化工产品之一,通常指颗粒直径在1~100 nm之间的超细粉末碳酸钙,其主要来源于海底有机骨架材料的残余物,极少量是钙盐与二氧化碳的反应产物。与普通碳酸钙产品相比,它具有粒子细、比表面积大、表面活化率高和白度高等特点,在多个行业均有着广泛的应用[3]。例如,纳米碳酸钙常代替钛白粉被用于化妆品中;代替部分陶土以提高纸的白度和不透明度;还用于耐火保温材料、补钙剂等生产中。这些产品的使用会使大量的纳米碳酸钙进入环境介质(如大气环境、水环境和土壤环境等),并进行复杂的迁移转化过程[4],转化前后的纳米碳酸钙可能会被生物体吸收积累,进而通过不同途径进入人体[5]。它们进入人体后,将与体液、免疫系统、细胞膜以及细胞内环境相互作用,这些作用可能产生不良影响[6],最直接的体现就是其在细胞层上聚集和沉积,导致极高的局部颗粒浓度和颗粒摄取,并与细胞发生一系列复杂反应,如细胞吞噬后产生活性氧(reactive oxygen species, ROS),破坏细胞的DNA复制,造成细胞凋亡和坏死,并最终导致机体或器官受损[7],具有一定毒性[8]。研究发现,纳米材料甚至能跨过血脑屏障等生物屏障[9],并能通过嗅觉神经进入人体大脑中,使得人体脑部、肺部、心血管系统和免疫系统受到一定的损伤。
目前国内外关于纳米材料毒性的报道很多,为了使人们了解环境中普遍存在的纳米碳酸钙的生物毒性及其潜在健康风险,本文基于已有的纳米碳酸钙相关研究,将从纳米碳酸钙的不同人体暴露途径出发,系统地总结纳米碳酸钙对机体和器官的潜在毒性及其作用机制。
1 纳米碳酸钙的人体暴露途径及体内转运代谢(Human exposure pathways and in vivo transport and metabolism of nano-calcium carbonate)
纳米碳酸钙的摄入途径与人类接触的机会有关,人类接触纳米碳酸钙的机会主要来源于生产企业的职业接触和环境逸散物[10]。这些物质会通过呼吸道、消化道和皮肤进入人体,进行复杂的转运代谢过程。
1.1 呼吸道摄入及清除
对于在矿业中接触碳酸钙粉尘或涉及碳酸钙材料机械加工的工人来说,纳米碳酸钙主要通过呼吸道进入肺部。肺由气道(气管、支气管和细支气管)和肺泡(气体交换区)组成。气道上皮细胞具有大量起保护作用的黏液,纳米颗粒难以通过。然而,肺泡壁和动脉血管之间的气血屏障则非常薄,这为纳米颗粒进入肺组织提供了生理学基础[11]。颗粒吸入后沉积的部位、程度和效率主要受其尺寸的影响,尺寸越小,其在肺部的扩散迁移率越大,肺部各区域的沉积也随之增加[12-13]。研究表明,相比于粒径更大的矽尘,纳米碳酸钙更容易到达并沉积于肺泡,造成肺泡细胞膜损伤或细胞死亡[14]。
吸入的大颗粒物(>1 μm)可被黏膜纤毛运动、肺泡巨噬细胞的吞噬作用清除[15-16]。而纳米碳酸钙尺寸较小,当它在呼吸道沉积后,更容易通过胞吞转运作用穿过肺泡上皮细胞到达间质空间,并由此进入血液或淋巴循环,甚至通过血脑屏障等普通微米颗粒不易通过的生物屏障,而分布于全身[17]。胡博骅[18]利用多光谱活体荧光分子影像成像系统观察到裸鼠从鼻腔摄入的纳米碳酸钙首先在肺部积聚,随后经肺入血,进入脑、肝、脾、肾等其他组织器官。因此,即使吸入的纳米碳酸钙浓度不高,但由于其粒径小、数量大,且易于进入肺脏深部,甚至循环系统、脑等其他重要部位,这就为纳米碳酸钙引发肺、心血管和脑部等疾病提供了可能。
1.2 消化道摄入及肠道转运
除了补钙剂,纳米碳酸钙还存在于硬水烧开冷却的过程[19],人们可通过口服直接摄入。纳米碳酸钙由口腔进入胃部,在胃部酸性条件下发生部分溶解。溶解的纳米碳酸钙特性完全丧失,它们仅以离子形式存在[7];而未溶解纳米碳酸钙的形态大小几乎保持不变[20],它们经胃进入肠道,与覆盖在肠道表面的黏液层接触[21]。穿透黏液的颗粒到达肠细胞后的摄取是由受体和非受体介导的内吞作用启动的,还与微细胞增多和吸附介导的转运有关。目前报道的关于口服纳米颗粒胃肠道吸收途径如图1所示,包括细胞旁路通道转运、肠道上皮细胞跨胞摄取和经回肠内集合淋巴结的微皱褶细胞(M细胞)吞噬,这些机制在某种程度上可同时运转。其中,M细胞吞噬被确定为纳米碳酸钙的重要肠道吸收途径,表现出明显的能量依赖性[22]。纳米碳酸钙进入细胞后进行复杂的胞内转运,通过胞吐机制被释放到细胞外,或通过内溶酶体转运在细胞内降解[23]。
穿透肠细胞的纳米碳酸钙可以进入淋巴系统和毛细血管,然后到达各个器官。Lee等[20]在口服给药大鼠后评估了纳米碳酸钙的吸收和组织分布,结果表明,14 d反复口服给药后,纳米碳酸钙在肾脏、肺和脾脏均有积累,且在脾脏中观察到总钙浓度增加显著。虽然纳米碳酸钙在胃部会有部分溶解,但是存在穿过肠上皮细胞进入其他器官的可能,增加了人类健康风险。
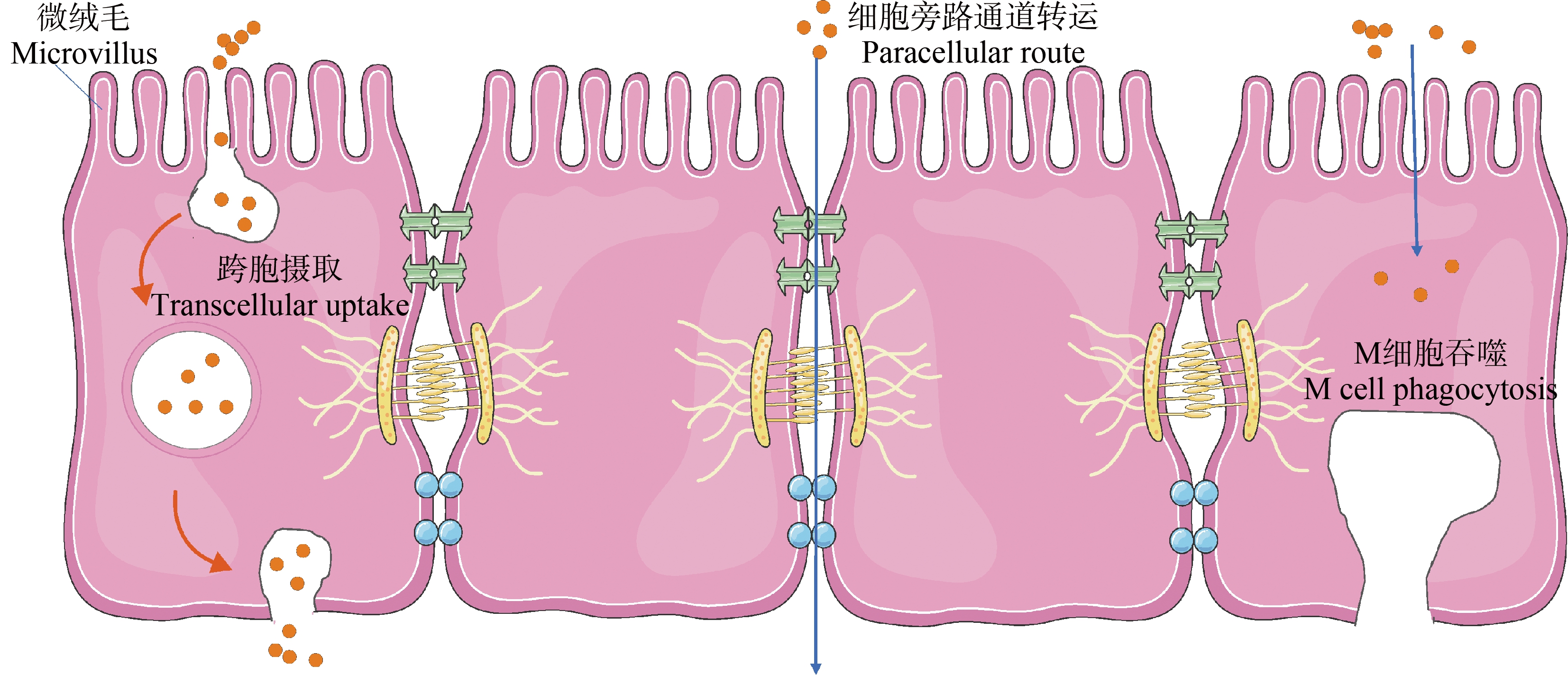
图1 纳米颗粒的胃肠道吸收途径
Fig. 1 Gastrointestinal absorption pathway of nanoparticles
1.3 皮肤接触及易位
皮肤表皮是由角质层、刺状细胞层和基底细胞层组成的紧密保护层[17]。纳米颗粒渗透皮肤的能力取决于皮肤的损伤程度和颗粒直径。对于健康完整的皮肤,纳米颗粒几乎无法穿透表皮层,通常停留在发囊或者皮肤褶皱里,被生物体正常的皮脂代谢清除[24]。Parayanthala Valappil等[25]用磷酸钙纳米颗粒(<50 nm)处理大鼠皮肤28 d,未观察到明显的不良反应,说明健康皮肤是对抗纳米颗粒的有效屏障。而纳米碳酸钙作为一种常见的无机化合物,可能和其他纳米颗粒一样,穿透健康皮肤的深度不会超过几毫米[26]。
但当皮肤破损或纳米颗粒的粒径减小时,它可穿过毛囊渗透到真皮层[27]。Monteiro-Riviere等[28]在研究纳米颗粒对由紫外线造成损伤的皮肤渗透作用时,发现其可渗透到上皮浅层。将离体无毛小鼠皮肤固定在渗透扩散装置中,计算得出纳米级珍珠粉中碳酸钙皮肤渗透速率及渗透累积量均高于微米级珍珠粉[29]。纳米碳酸钙进入真皮层后,会通过淋巴吸收、真皮内血液循环和感觉神经的密集网络进入血液和周围组织。在血液中,它们将被蛋白质迅速覆盖(形成蛋白质电晕)[30-31]。因此,纳米碳酸钙经皮摄入的暴露途径也不能忽视。
2 纳米碳酸钙的体内外毒性及流行病学研究(Toxicity and epidemiology of nano-calcium carbonate in vitro and in vivo)
纳米碳酸钙能够通过不同途径进入生物体内,并转运、分布到重要的组织器官,所以研究其对生物体的毒性作用就十分有必要。目前纳米碳酸钙的毒性研究主要集中在细胞体外实验、动物体内实验以及流行病学研究,它们通过不同的研究对象确定纳米碳酸钙在体内外不同程度的毒性影响,如图2所示。
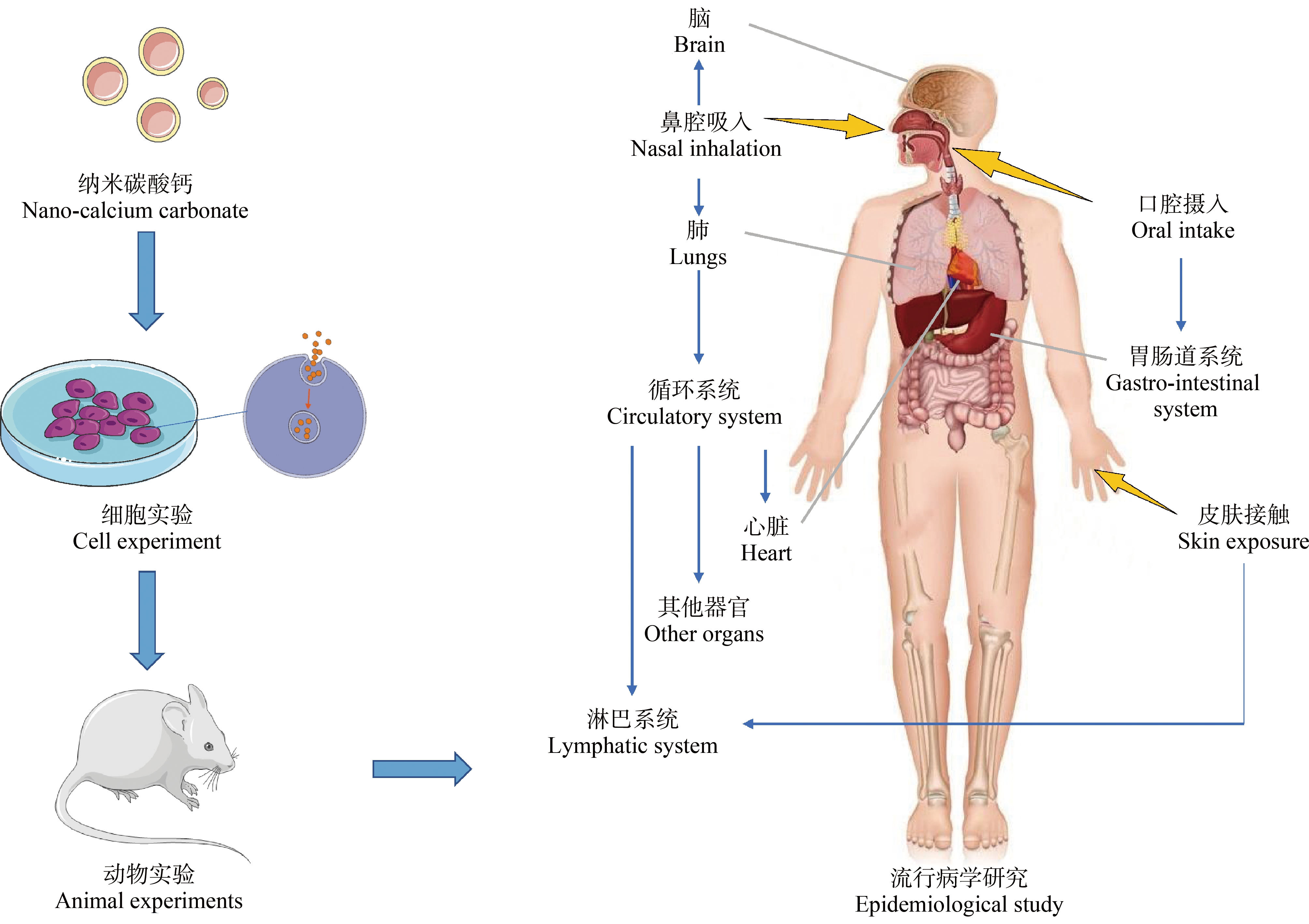
图2 纳米碳酸钙的毒性研究方法示意图
Fig. 2 The schematic diagram of toxicity study methods of nano-calcium carbonate
2.1 体外毒性
细胞体外实验成本低、耗时短、效率高,是评价生物材料毒性的首选。细胞毒性评价的方法有很多,通常采用多种方法同时使用以获得更多与材料毒性本质相关的生物学信息。首先是细胞活性检测,可利用MTT法[32]、MTS法[33]、XTT法[34]、乳酸脱氢酶(lactate dehydrogenase, LDH)释放[35]以及ROS的产生[33]等方法,直接或间接评价细胞活性。此外,还可以利用流式细胞仪定量分析细胞的凋亡和坏死[36]。其次是细胞形态检测,一般通过丫啶橙、台盼蓝等染色后利用荧光显微镜[35]、激光共聚焦显微镜[37]等多种显微技术观察细胞与材料间的相互作用。细胞功能检测主要通过测定某些细胞因子的释放水平[38-39],以评价材料的生物相容性。表1列出了纳米碳酸钙体外毒性实验及所用的检测方法[22,40-44]。
宋秋坤[45]培养大鼠肺泡巨噬细胞(NR8383)并将其暴露于纳米碳酸钙,24 h后细胞形态发生改变,且随着染毒剂量的升高,细胞存活率下降,细胞膜通透性增加,细胞抗氧化和吞噬能力下降,细胞超微结构也发生了改变。纳米碳酸钙对人表皮细胞(HaCaT)的增殖抑制作用明显,但是在半数致死浓度条件下,纳米碳酸钙对HaCaT细胞内谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase, SOD)活力、丙二醛(malondialdehyde, MDA)活力和BAX蛋白表达无显著影响,说明纳米碳酸钙对HaCaT细胞氧化应激和凋亡作用不显著[42]。Kim等[22]评估了食品级纳米碳酸钙对人肠上皮细胞(INT-407)的毒性影响,即使在最高浓度1 000 μg·mL-1下培养24 h,也未发现纳米碳酸钙对细胞增殖的影响,表明它们的细胞毒性较低,但ROS和LDH显著增加,说明其可以损伤细胞膜。而d’Amora等[43]的实验证明纳米碳酸钙对正常细胞(NIH-3T3)和癌症细胞(MCF-7)的细胞活力无影响,在高浓度下也未显示遗传毒性。可见,对于不同的细胞,纳米碳酸钙显示出不同程度的毒性影响[46]。
表1 纳米碳酸钙的体外毒性研究
Table 1 In vitro toxicity of nano-calcium carbonate
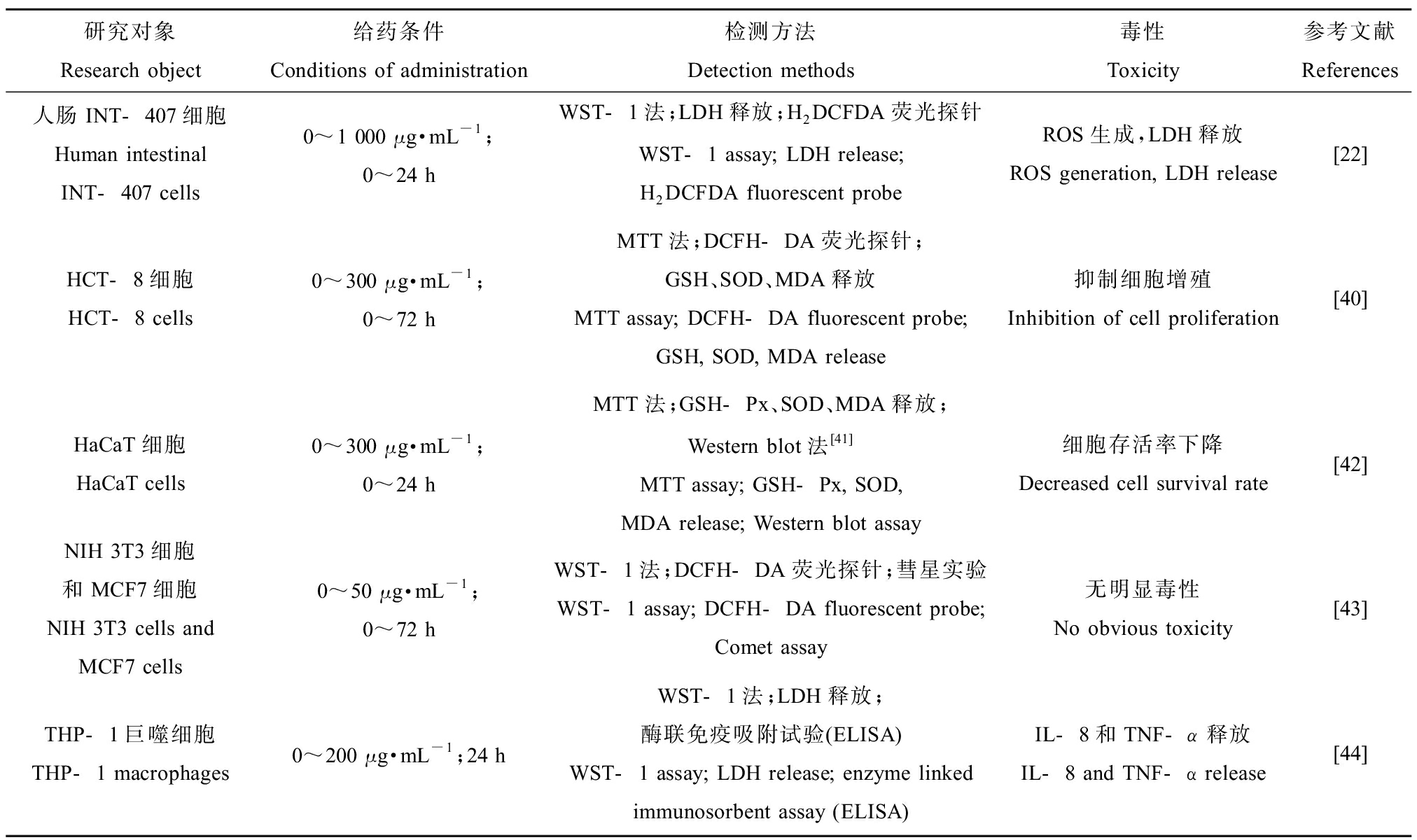
研究对象Research object给药条件Conditions of administration检测方法Detection methods毒性Toxicity参考文献References人肠INT-407细胞Human intestinalINT-407 cells0~1 000 μg·mL-1;0~24 h WST-1法;LDH释放;H2DCFDA荧光探针WST-1 assay; LDH release; H2DCFDA fluorescent probeROS生成,LDH释放ROS generation, LDH release[22]HCT-8细胞HCT-8 cells0~300 μg·mL-1;0~72 hMTT法;DCFH-DA荧光探针;GSH、SOD、MDA释放MTT assay; DCFH-DA fluorescent probe; GSH, SOD, MDA release抑制细胞增殖Inhibition of cell proliferation[40]HaCaT细胞HaCaT cells0~300 μg·mL-1;0~24 hMTT法;GSH-Px、SOD、MDA释放;Western blot法[41]MTT assay; GSH-Px, SOD, MDA release; Western blot assay细胞存活率下降Decreased cell survival rate[42]NIH 3T3细胞和MCF7细胞NIH 3T3 cells and MCF7 cells0~50 μg·mL-1;0~72 hWST-1法;DCFH-DA荧光探针;彗星实验WST-1 assay; DCFH-DA fluorescent probe; Comet assay无明显毒性No obvious toxicity[43]THP-1巨噬细胞THP-1 macrophages0~200 μg·mL-1;24 hWST-1法;LDH释放;酶联免疫吸附试验(ELISA)WST-1 assay; LDH release; enzyme linked immunosorbent assay (ELISA)IL-8和TNF-α释放IL-8 and TNF-α release[44]
2.2 体内毒性
体内试验可得到纳米颗粒与体内多种细胞、血液、蛋白、酶类和激素的反应情况。因此,选择合适的动物模型进行体内毒性评价非常必要,评价方式主要包括血液生化指标和组织学分析。有关纳米碳酸钙毒性的体内研究如表2所示[47-53]。
2.2.1 对呼吸系统的影响
纳米颗粒吸入后可穿过肺泡上皮在肺间隙部位沉积,影响肺的正常功能。仇玉兰等[54]用气管注入法对Wistar大鼠进行染毒,5周后发现大鼠肺泡灌洗液中LDH活性和血液酸性磷酸酶(acid phosphatase, ACP)活性均随染毒剂量升高而增加;病理组织学检查也发现纳米碳酸钙染毒大鼠支气管和肺泡均有不同程度损伤,表明纳米碳酸钙会对肺实质和膜性组织造成损伤。用滴鼻法对SD大鼠染毒后发现大鼠肺泡壁充血水肿,局部肺不张,部分小血管出现玻璃样变;支气管黏膜萎缩、剥脱,大量炎性细胞浸润[52]。王慧等[55]的实验也发现了类似的结果,即纳米碳酸钙可引起大鼠肺脏急慢性炎症、充血、出血,以及肺泡结构破坏。
2.2.2 对血液循环系统的影响
纳米碳酸钙经各种途径吸收后,可能会对血液循环系统造成一定的影响。有研究表明[49],皮下注射纳米碳酸钙的大鼠的血清生化指标中丙氨酸氨基转移酶、碱性磷酸酶、天冬氨酸转氨酶、总胆红素、肌酐和尿素等显著升高(P<0.05);红细胞水平、血红蛋白等显著下降(P<0.01)。尾静脉注射纳米碳酸钙的大鼠心脏切片显示:低剂量组大鼠心脏切片有轻度的炎性浸润;中剂量组大鼠心肌细胞间质中有明显扩张的充血血管,红细胞外渗和中度炎性浸润;高剂量组心肌纤维肿胀、断裂甚至坏死,伴有严重的淋巴细胞浸润[56]。
2.2.3 对泌尿系统的影响
有研究认为,长期或大量摄入碳酸钙后,可能出现肾功能不全、组织钙化等不良反应,甚至对泌尿系统结石的形成有促进作用[57]。亚慢性染毒纳米碳酸钙大鼠组织病理学研究发现,大鼠肾小球充血肿大,囊间隙缩窄;高剂量组甚至可以观察到肾间质灶状淋巴细胞浸润,部分肾小球囊间隙消失[52]。钱怡[53]将染毒后的大鼠处死后取肾脏组织测定其氧化损伤程度,发现MDA含量高于对照组,且随着剂量的增高总体呈上升趋势(P<0.05)。邵春燕和付文亮[56]在中高剂量下也观察到肾小球出现萎缩和裂隙,同时发现动脉管壁增厚。
表2 纳米碳酸钙的体内毒性研究
Table 2 In vivo toxicity of nano-calcium carbonate

研究对象Research object给药方式Administration method给药条件Conditions of administration检测方法Detection methods毒性Toxicity参考文献ReferencesSD大鼠SD rats灌胃给药Intragastric administration0~1 000 mg·kg-1;每天1次,连续给药90 d0~1 000 mg·kg-1;once a day, for 90 d血液分析;血液生化分析;尸体剖检Hematology; Blood biochemistry; Necropsy血液中Ca2+含量升高,肾脏出现多灶性囊肿Elevated calcium ions levels in the blood, emergence of multifocal cysts in the kidneys[47]ICR小鼠ICR mice灌胃给药Intragastric administration7 d急性毒性(1.3 g·kg-1);28 d亚慢性毒性(1.3、0.13和0.013 g·kg-1 )7-day acute toxicity (1.3 g·kg-1); 28-day sub-chronic toxicity (1.3, 0.13, 0.013 g·kg-1)临床观察;血清钙浓度检测Clinical observations; Serum calcium concentration detection血钙浓度增加Elevated serum calcium concentrations[48]SD大鼠SD rats皮下注射Subcutaneous injection14 d急性毒性(1 770、11 800 mg·m-2);28 d亚慢性毒性(59、590和5 900 mg·m-2)14-day acute toxicity (1 770, 11 800 mg·m-2); 28-day sub-chronic toxicity (59, 590, 5 900 mg·m-2)临床观察;血液学和血清生化;组织病理学检测Clinical observations; Haematology and serum biochemistry; Histopathology注射部位水肿,红细胞水平下降,肝脏颗粒状病变,心脏和肾脏充血等Oedema at the site of injection, decreased red blood cells, granular lesions in the liver, congestion of the heart and the kidneys[49]Wistar大鼠Wistar rats气管注入Tracheal injection0.8、4和20 mg·mL-1;每周染毒1次,连续5周0.8, 4, 20 mg·mL-1; once a week, for 5 weeks彗星实验;精子畸形试验Comet assay; Sperm deformity testDNA损伤DNA damage[50]SD大鼠SD rats滴鼻法Nasal drip12.5、50和200 mg·kg-1;每周5次,连续12周12.5, 50, 200 mg·kg-1; five times a week, for 12 weeks旷场试验; Morris 水迷宫试验Open-field test; Morris water maze test精神萎靡Mental fatigue[51]SD大鼠SD rats滴鼻法Nasal drip12.5、50和200 mg·kg-1;每周5次,连续12周12.5, 50, 200 mg·kg-1; five times a week, for 12 weeks血液学和血清生化;组织病理学检测Haematology and serum biochemistry; Histopathology肺泡壁充血水肿,肾小球肿胀Alveolar walls hyperemia and edema, glomerular swelling[52]SD大鼠SD rats滴鼻法Nasal drip12.5、50和200 mg·kg-1;每周5次,连续12周12.5, 50, 200 mg·kg-1; five times a week, for 12 weeks比色法;TBA法;ELISA法Colorimetry; TBA assay; ELISA assay氧化损伤Oxidative damage[53]
2.3 流行病学研究
一般来说,纳米颗粒的生物活性要比同种物质的微米级颗粒强,对机体产生损伤的可能性更大。目前纳米颗粒对人群健康影响的流行病学资料相对较少,且研究结果并不一致。冯涓等[58]对山西某纳米碳酸钙厂129名工人进行常规体检发现,暴露组工人高血压患病率、心率和心电图异常率,血液中血红蛋白、红细胞计数和红细胞压积等指标的异常率均高于对照组(P<0.05),说明纳米碳酸钙对职业暴露人群的血液和心血管系统有一定影响。梁丽红[59]对纳米碳酸钙厂工人的检查结果表明纳米碳酸钙的接触对循环系统、消化系统、免疫系统和血液系统有一定影响,对骨密度和遗传毒性的影响效应不明显。Li等[60]的调查结果表明纳米碳酸钙暴露组工人的血红蛋白、磷酸激酶等水平显著升高,但白色血细胞计数、总蛋白、尿酸和肌氨酸酐均显著降低;肺功能低下的患病率明显较高(P<0.037),肺活量和用力肺活量等指标与纳米碳酸钙质量浓度呈负相关(P<0.05)。Franck等[61]的研究也得到相似的结论。总之,长期和高水平的纳米碳酸钙暴露会对作业人群的健康产生一定的影响。
3 毒性机制(Toxicity mechanism)
目前国内外研究所报道的纳米材料的毒性机制如图3所示[62],主要包括氧化应激和炎症反应。有研究结果表明,自噬也是纳米材料产生毒性的重要方面,且自噬与氧化应激和炎症反应可能存在一定的联系[63]。
3.1 氧化应激反应
氧化应激是指机体有氧代谢过程中产生的ROS增多或机体清除ROS能力下降的状态。Kim等[22]评价了纳米碳酸钙对INT-407细胞的细胞毒性,发现细胞直接接触纳米碳酸钙后产生ROS,造成细胞功能紊乱。ROS是正常氧代谢的副产物,具有很高的反应活性,在细胞信号传导中发挥重要作用,但是过高的ROS水平会破坏细胞内蛋白结构,导致脂质氧化,并影响细胞线粒体功能和细胞的正常代谢,最终产生细胞毒性,造成细胞损伤[64]。
在ROS产生过量的情况下,GSH等抗氧化剂被大量消耗,SOD等抗氧化酶的活性降低,随后,过量的ROS和自由基能攻击生物膜上的多不饱和脂肪酸,引发脂质过氧化,形成MDA等脂质过氧化产物和新的自由基,并通过链式反应放大ROS的损害作用[65]。张淑华等[40]体外观察了不同粒径碳酸钙颗粒对人回盲肠上皮细胞(HCT-8)的细胞毒性和氧化损伤作用,发现微米和纳米碳酸钙颗粒均可导致细胞活力降低、细胞内ROS和MDA产生增多,而SOD活性和GSH含量下降(P<0.05),并呈剂量依赖性。用滴鼻法对小鼠进行纳米碳酸钙染毒后,在血清、肺、肝脏和肾脏中均检测到MDA含量随剂量的升高显著上升,GSH含量随剂量的增加呈下降趋势[53]。宋益娟[66]用纳米碳酸钙处理细胞后,细胞内ROS产生显著增多,GSH被消耗,SOD酶活性降低,脂质氧化产物MDA产量增加,以上均证实了氧化应激可能是纳米碳酸钙造成细胞毒性的原因之一。
3.2 炎症反应
炎症反应本质是为了消除微生物和化学物质等,促进损伤愈合,恢复体内平衡。然而,永久或过度的炎症反应可能压倒机体的代偿能力,最终导致大多数器官衰竭。免疫细胞产生的细胞因子是炎症过程中至关重要的介质,肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)都在手术损伤和创伤中被描述[67]。Tabei等[44]研究了THP-1巨噬细胞对碳酸钙的生物反应,发现THP-1巨噬细胞释放的IL-8和TNF-α增强,证明针状碳酸钙颗粒触发促炎反应。纳米碳酸钙染毒5周后,可导致大鼠肺泡灌洗液中白蛋白、LDH和ACP含量升高,大鼠肺组织出现了充血水肿、炎症细胞浸润等现象,表明纳米碳酸钙能够引起肺组织的炎症反应[45]。因此,纳米碳酸钙诱发的炎性反应可能是组织损伤的主要机制之一,损伤程度与纳米碳酸钙的沉积量有关。
3.3 自噬
细胞自噬是在细胞质中形成双层或多层膜结构的自噬小体通过和溶酶体融合对包裹的内容物进行降解的过程。已有研究证明不同大小和不同组成成分的纳米材料均能激活细胞的自噬系统[68]。自噬在纳米材料毒性机制中具有两面性,一方面作为细胞的自我保护程序,可以增强细胞清除异物的能力[69];另一方面,当纳米材料诱导的细胞自噬不能应对环境改变时会表现为损伤性自噬,导致细胞死亡[70-71]。水溶性纳米珍珠粉的主要成分是碳酸钙,成骨前体细胞(MC3T3-E1)经其处理后显著诱发了自噬标记物(LC3-Ⅱ/Ⅰ、Beclin-1和ATG7)的表达,显著上调丝裂原活化蛋白激酶/细胞外信号调节激酶信号通路[72]。Liu等[73]发现与纳米碳酸钙性质相似的羟基磷灰石纳米颗粒会阻断自噬通量,导致自噬体和自溶酶体在血管平滑肌细胞中积累,转化为更多含钙的外泌体释放到细胞外基质中,从而加速血管钙化。
目前的研究表明,纳米材料主要是通过ROS的产生触发自噬激活。线粒体是细胞中产生最多ROS的细胞器,当纳米颗粒与线粒体相互作用时,可引起线粒体膜损伤。受损的线粒体可诱导细胞自噬,去除功能失调的细胞器以维持体内细胞质的平衡[74]。但当细胞暴露于过多的ROS,自噬功能受损,导致受损的细胞器累积,从而导致氧化应激、炎症和DNA损伤,最终造成细胞凋亡或自噬性细胞死亡[75]。大鼠注射钙化性纳米微粒后,细胞自噬激活,细胞膜损伤,产生大量氧自由基和炎症因子,发生氧化、炎症反应;Beclin-1、LC3表达增强,诱导细胞自噬活动增强,加重细胞损伤,形成恶性循环[76]。Wang等[77]也证明纳米碳酸钙及其释放的CO2会破坏溶酶体,在破裂的溶酶体周围出现完整的自噬体,且Beclin-1和LC3-Ⅱ表达上调。

图3 纳米颗粒对细胞的毒性机理示意图
注:NP表示纳米颗粒;1表示NP产生活性氧物质;2表示NP释放金属离子;3表示NP附着在细胞表面;4表示NP通过细胞内陷、膜通道及细胞吞噬作用等进入细胞内部;5表示NP产生的ROS和有毒物质破坏细胞膜;6表示NP通过破坏的细胞膜进入细胞;7表示NP对细胞产生氧化压力并破坏细胞器等;8表示细胞内含物外泄;9表示NP最终导致毒性效应。
Fig. 3 The schematic diagram of cytotoxicity mechanism of nanoparticles on cells
Note: NP stands for nanoparticles; 1 represents that NP produces reactive oxygen species; 2 represents that NP releases metal ions; 3 represents NP adhered to the cell surface; 4 represents that NP enters the cells through cell collapse, membrane channel and cell phagocytosis; 5 represents that ROS and toxic substances produced by NP destroy cell membrane; 6 represents that NP enters cells through damaged cell membrane; 7 represents that NP generates oxidative stress on cells and destroys organelles; 8 represents cell inclusion leakage; 9 represents that NP eventually leads to toxic effects.
4 结论与展望(Conclusion and prospect)
纳米碳酸钙由于其独特的理化性质,展现了巨大的应用潜力,故其对生物体安全性的研究势在必行。吸入、口服和皮肤接触纳米碳酸钙均可能引起不利情况下的颗粒吸收,导致细胞内钙浓度的潜在增加和局部炎症反应。纳米碳酸钙对不同细胞有不同程度的损伤作用,它会影响细胞的增殖和形态,使细胞发生凋亡、坏死;引起细胞DNA损伤及染色体断裂。此外,纳米碳酸钙可在生物体内各组织分布,它可以刺激活性氧物质的产生,引发炎症反应,诱导自噬,最终导致机体受损,如肺部炎症、遗传毒性、肝毒性和神经毒性等。但是,对于纳米碳酸钙的毒理学与安全性问题,目前尚无明确结论,纳米碳酸钙毒性的评估仍然缺乏系统性的方法。因此,需要建立标准、系统、可比较的纳米毒理学研究方法来检测经不同途径摄入的纳米碳酸钙对人类健康和环境的影响,并根据其毒性机制制定出有效的解决措施,从根本上降低纳米材料的潜在健康风险,推进纳米技术的发展。
[1] Prietl B, Meindl C, Roblegg E, et al. Nano-sized and micro-sized polystyrene particles affect phagocyte function [J]. Cell Biology and Toxicology, 2014, 30(1): 1-16
[2] Yao M F, He L L, McClements D J, et al. Uptake of gold nanoparticles by intestinal epithelial cells: Impact of particle size on their absorption, accumulation, and toxicity [J]. Journal of Agricultural and Food Chemistry, 2015, 63(36): 8044-8049
[3] Mishra S, Sonawane S H, Singh R P. Studies on characterization of nano CaCO3 prepared by thein situ deposition technique and its application in PP-nano CaCO3 composites [J]. Journal of Polymer Science Part B: Polymer Physics, 2005, 43(1): 107-113
[4] 陈璇, 章家恩, 危晖. 环境微塑料的迁移转化及生态毒理学研究进展[J]. 生态毒理学报, 2021, 16(6): 70-86
Chen X, Zhang J E, Wei H. Research progress and prospect on transportation, transformation and ecotoxicology of microplastics in environment [J]. Asian Journal of Ecotoxicology, 2021, 16(6): 70-86 (in Chinese)
[5] Blinova I, Ivask A, Heinlaan M, et al. Ecotoxicity of nanoparticles of CuO and ZnO in natural water [J]. Environmental Pollution, 2010, 158(1): 41-47
[6] Feng X L, Chen A J, Zhang Y L, et al. Central nervous system toxicity of metallic nanoparticles [J]. International Journal of Nanomedicine, 2015, 10: 4321-4340
[7] Epple M. Review of potential health risks associated with nanoscopic calcium phosphate [J]. Acta Biomaterialia, 2018, 77: 1-14
[8] Kim T H, Kim M, Park H S, et al. Size-dependent cellular toxicity of silver nanoparticles [J]. Journal of Biomedical Materials Research Part A, 2012, 100A(4): 1033-1043
[9] Voigt N, Henrich-Noack P, Kockentiedt S, et al. Surfactants, not size or zeta-potential influence blood-brain barrier passage of polymeric nanoparticles [J]. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 87(1): 19-29
[10] Tsai C J, Huang C Y, Chen S C, et al. Exposure assessment of nano-sized and respirable particles at different workplaces [J]. Journal of Nanoparticle Research, 2011, 13(9): 4161-4172
[11] Yang W, Peters J I, Williams R O 3rd. Inhaled nanoparticles: A current review [J]. International Journal of Pharmaceutics, 2008, 356(1-2): 239-247
[12] Bakand S, Hayes A, Dechsakulthorn F. Nanoparticles: A review of particle toxicology following inhalation exposure [J]. Inhalation Toxicology, 2012, 24(2): 125-135
[13] Braakhuis H M, Park M V, Gosens I, et al. Physicochemical characteristics of nanomaterials that affect pulmonary inflammation [J]. Particle and Fibre Toxicology, 2014, 11: 18
[14] 李聪, 吴奇峰, 谭玉莲, 等. 纳米碳酸钙与矽尘对作业工人肺功能影响的对比[J]. 中国工业医学杂志, 2016, 29(2): 110-112
Li C, Wu Q F, Tan Y L, et al. A comparative study on pulmonary function of workers exposed to nano-calcium carbonate and silica dusts [J]. Chinese Journal of Industrial Medicine, 2016, 29(2): 110-112 (in Chinese)
[15] Arredouani M, Yang Z P, Ning Y Y, et al. The scavenger receptor MARCO is required for lung defense against pneumococcal pneumonia and inhaled particles [J]. The Journal of Experimental Medicine, 2004, 200(2): 267-272
[16] Gumbleton M. Caveolae as potential macromolecule trafficking compartments within alveolar epithelium [J]. Advanced Drug Delivery Reviews, 2001, 49(3): 281-300
[17] Buzea C, Pacheco I I, Robbie K. Nanomaterials and nanoparticles: Sources and toxicity [J]. Biointerphases, 2007, 2(4): MR17-MR71
[18] 胡博骅. 纳米碳酸钙在裸鼠体内的分布特征及对大鼠脏器损伤的病理学研究[D]. 太原: 山西医科大学, 2014: 6-18
Hu B H. Distribution of nano-CaCO3 in mice and the pathological observation of the mice organs injury [D]. Taiyuan: Shanxi Medical University, 2014: 6-18 (in Chinese)
[19] 卢金锁, 陈诚, 李雄, 等. 饮用水水垢问题辨析[J]. 中国给水排水, 2019, 35(8): 15-19
Lu J S, Chen C, Li X, et al. Analysis of scale problem in drinking water [J]. China Water & Wastewater, 2019, 35(8): 15-19 (in Chinese)
[20] Lee J A, Kim M K, Kim H M, et al. The fate of calcium carbonate nanoparticles administered by oral route: Absorption and their interaction with biological matrices [J]. International Journal of Nanomedicine, 2015, 10: 2273-2293
[21] Hoet P H, Brüske-Hohlfeld I, Salata O V. NPs-known and unknown health risks [J]. Journal of Nanobiotechnology, 2005, 2(1): 12
[22] Kim M K, Lee J A, Jo M R, et al. Cytotoxicity, uptake behaviors, and oral absorption of food grade calcium carbonate nanomaterials [J]. Nanomaterials, 2015, 5(4): 1938-1954
[23] Meng N, Han L, Pan X H, et al. Nano-Mg(OH)2-induced proliferation inhibition and dysfunction of human umbilical vein vascular endothelial cells through caveolin-1-mediated endocytosis [J]. Cell Biology and Toxicology, 2015, 31(1): 15-27
[24] Filipe P, Silva J N, Silva R, et al. Stratum corneum is an effective barrier to TiO2 and ZnO nanoparticle percutaneous absorption [J]. Skin Pharmacology and Physiology, 2009, 22(5): 266-275
[25] Parayanthala Valappil M, Santhakumar S, Arumugam S. Determination of oxidative stress related toxicity on repeated dermal exposure of hydroxyapatite nanoparticles in rats [J]. International Journal of Biomaterials, 2014, 2014: 476942
[26] Vogt A, Rancan F, Ahlberg S, et al. Interaction of dermatologically relevant nanoparticles with skin cells and skin [J]. Beilstein Journal of Nanotechnology, 2014, 5: 2363-2373
[27] Cevc G, Vierl U. Nanotechnology and the transdermal route: A state of the art review and critical appraisal [J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2010, 141(3): 277-299
[28] Monteiro-Riviere N A, Wiench K, Landsiedel R, et al. Safety evaluation of sunscreen formulations containing titanium dioxide and zinc oxide nanoparticles in UVB sunburned skin: An in vitro and in vivo study [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2011, 123(1): 264-280
[29] 柯学, 许颖, 佘佐彦. 纳米级与微米级珍珠粉中碳酸钙对离体小鼠皮肤渗透性的研究[J]. 中国新药与临床杂志, 2006, 25(1): 25-28
Ke X, Xu Y, She Z Y. Study of transdermal permeability on mouse skin in vitro about calcium carbonate in micro and nano pearl powder [J]. Chinese Journal of New Drugs and Clinical Remedies, 2006, 25(1): 25-28 (in Chinese)
[30] Kopp M, Kollenda S, Epple M. Nanoparticle-protein interactions: Therapeutic approaches and supramolecular chemistry [J]. Accounts of Chemical Research, 2017, 50(6): 1383-1390
[31] Treuel L, Brandholt S, Maffre P, et al. Impact of protein modification on the protein corona on nanoparticles and nanoparticle-cell interactions [J]. ACS Nano, 2014, 8(1): 503-513
[32] Sonmez E, Cacciatore I, Bakan F, et al. Toxicity assessment of hydroxyapatite nanoparticles in rat liver cell model in vitro [J]. Human & Experimental Toxicology, 2016, 35(10): 1073-1083
[33] Tada-Oikawa S, Eguchi M, Yasuda M, et al. Functionalized surface-charged SiO2 nanoparticles induce pro-inflammatory responses, but are not lethal to caco-2 cells [J]. Chemical Research in Toxicology, 2020, 33(5): 1226-1236
[34] Hong T K, Tripathy N, Son H J, et al. A comprehensive in vitro and in vivo study of ZnO nanoparticles toxicity [J]. Journal of Materials Chemistry B, 2013, 1(23): 2985-2992
[35] Gossmann R, Spek S, Langer K, et al. Didodecyldimethylammonium bromide (DMAB) stabilized poly(lactic-co-glycolic acid) (PLGA) nanoparticles: Uptake and cytotoxic potential in Caco-2 cells [J]. Journal of Drug Delivery Science and Technology, 2018, 43: 430-438
[36] McCracken C, Zane A, Knight D A, et al. Minimal intestinal epithelial cell toxicity in response to short- and long-term food-relevant inorganic nanoparticle exposure [J]. Chemical Research in Toxicology, 2013, 26(10): 1514-1525
[37] He B, Lin P, Jia Z R, et al. The transport mechanisms of polymer nanoparticles in Caco-2 epithelial cells [J]. Biomaterials, 2013, 34(25): 6082-6098
[38] Schaeublin N M, Braydich-Stolle L K, Schrand A M, et al. Surface charge of gold nanoparticles mediates mechanism of toxicity [J]. Nanoscale, 2011, 3(2): 410-420
[39] 陶一凡, 张小强, 李琪, 等. 纳米二氧化钛对小胶质细胞Notch信号通路及炎症因子分泌水平的影响[J]. 生态毒理学报, 2021, 16(2): 212-218
Tao Y F, Zhang X Q, Li Q, et al. Effects of nano-titanium dioxide on Notch signaling pathway and secretion of inflammatory factors in microglia [J]. Asian Journal of Ecotoxicology, 2021, 16(2): 212-218 (in Chinese)
[40] 张淑华, 王翼飞, 甄亚平, 等. 不同粒径碳酸钙对HCT-8细胞的氧化损伤作用[J]. 毒理学杂志, 2013, 27(6): 427-430
Zhang S H, Wang Y F, Zhen Y P, et al. The oxidative damage caused by different sizes of calcium carbonate particles in HCT-8 cells [J]. Journal of Toxicology, 2013, 27(6): 427-430 (in Chinese)
[41] 程志斌, 刘艳菊, 郭青云, 等. 柴油车尾气亚慢性暴露致小鼠肺部炎症反应、氧化损伤和细胞凋亡的作用研究[J]. 生态毒理学报, 2021, 16(4): 280-291
Cheng Z B, Liu Y J, Guo Q Y, et al. Subchronic exposure to diesel engine exhaust induced pulmonary inflammation response, oxidative stress and cell apoptosis in mice [J]. Asian Journal of Ecotoxicology, 2021, 16(4): 280-291 (in Chinese)
[42] 刘明, 黄振烈, 梁丽红, 等. 纳米碳酸钙对人表皮细胞氧化应激和凋亡的影响[J]. 热带医学杂志, 2016, 16(11): 1353-1357
Liu M, Huang Z L, Liang L H, et al. Oxidative stress and apoptosis of HaCaT induced by nano calcium carbonate [J]. Journal of Tropical Medicine, 2016, 16(11): 1353-1357 (in Chinese)
[43] d’Amora M, Liendo F, Deorsola F A, et al. Toxicological profile of calcium carbonate nanoparticles for industrial applications [J]. Colloids and Surfaces B, Biointerfaces, 2020, 190: 110947
[44] Tabei Y, Sugino S, Eguchi K, et al. Effect of calcium carbonate particle shape on phagocytosis and pro-inflammatory response in differentiated THP-1 macrophages [J]. Biochemical and Biophysical Research Communications, 2017, 490(2): 499-505
[45] 宋秋坤. 纳米碳酸钙肺毒性的实验研究[D]. 太原: 山西医科大学, 2011: 16-30
Song Q K. Study on pulmonary toxicity of nanoparticles of calcium carbonate [D]. Taiyuan: Shanxi Medical University, 2011: 16-30 (in Chinese)
[46] 许伊, 杨士红, 尤国祥, 等. 纳米二氧化铈的潜在生态风险及毒性作用机制研究进展[J]. 生态毒理学报, 2021, 16(1): 43-55
Xu Y, Yang S H, You G X, et al. Review of the potential ecological risks and toxicity mechanisms of nanoceria [J]. Asian Journal of Ecotoxicology, 2021, 16(1): 43-55 (in Chinese)
[47] Sung J H, Park S J, Jeong M S, et al. Physicochemical analysis and repeated-dose 90-days oral toxicity study of nanocalcium carbonate in Sprague-Dawley rats [J]. Nanotoxicology, 2015, 9(5): 603-612
[48] Huang S, Chen J C, Hsu C W, et al. Effects of nano calcium carbonate and nano calcium citrate on toxicity in ICR mice and on bone mineral density in an ovariectomized mice model [J]. Nanotechnology, 2009, 20(37): 375102
[49] Jaji A Z, Zakaria Z A B, Mahmud R, et al. Safety assessments of subcutaneous doses of aragonite calcium carbonate nanocrystals in rats [J]. Journal of Nanoparticle Research: An Interdisciplinary Forum for Nanoscale Science and Technology, 2017, 19(5): 175
[50] 宋秋坤, 王慧, 贺连平, 等. 纳米碳酸钙对大鼠精子畸形和外周血淋巴细胞DNA的影响[J]. 毒理学杂志, 2010, 24(2): 112-115
Song Q K, Wang H, He L P, et al. The effect of nano-CaCO3 on sperm and peripheral blood lymphocytes DNA of rats [J]. Journal of Toxicology, 2010, 24(2): 112-115 (in Chinese)
[51] 刘卫花, 胡博骅, 冯涓, 等. 纳米碳酸钙亚慢性染毒对大鼠神经行为的影响[J]. 环境与职业医学, 2014, 31(5): 373-376
Liu W H, Hu B H, Feng J, et al. Neurobehavior of rats following subchronic exposure to calcium carbonate nanoparticles [J]. Journal of Environmental & Occupational Medicine, 2014, 31(5): 373-376 (in Chinese)
[52] 胡博骅, 刘卫花, 冯涓, 等. 亚慢性染毒纳米碳酸钙大鼠组织病理学研究[J]. 毒理学杂志, 2014, 28(2): 91-94
Hu B H, Liu W H, Feng J, et al. The histopathological change in organs of rats sub-chronic exposed to nano-calcium carbonate [J]. Journal of Toxicology, 2014, 28(2): 91-94 (in Chinese)
[53] 钱怡. 纳米碳酸钙对机体抗氧化系统及炎性细胞因子的影响[D]. 太原: 山西医科大学, 2014: 15-22
Qian Y. Effect of nano-calcium carbonate on the body's antioxidant system and inflammatory cytokines [D]. Taiyuan: Shanxi Medical University, 2014: 15-22 (in Chinese)
[54] 仇玉兰, 宋秋坤, 王慧, 等. 纳米碳酸钙对大鼠亚慢性肺毒性作用[J]. 中国公共卫生, 2011, 27(4): 451-453
Qiu Y L, Song Q K, Wang H, et al. Subchronic pulmonary toxicity of nano-sized calcium carbonate in rats [J]. Chinese Journal of Public Health, 2011, 27(4): 451-453 (in Chinese)
[55] 王慧, 宋秋坤, 刘风琴, 等. 纳米碳酸钙和微米碳酸钙亚急性染毒对大鼠肺组织的毒性作用[J]. 环境与健康杂志, 2011, 28(5): 390-392, 471
Wang H, Song Q K, Liu F Q, et al. Toxic effects of subacute exposure to nano-sized and micro-sized calcium carbonate on lung in rats [J]. Journal of Environment and Health, 2011, 28(5): 390-392, 471 (in Chinese)
[56] 邵春燕, 付文亮, Md Zuki Bin Abu Bakar Zakaria. 海扇壳源性碳酸钙纳米微粒对大鼠的急性毒性作用[J]. 吉林大学学报(医学版), 2019, 45(3): 524-530
Shao C Y, Fu W L, Md Zuki Bin Abu Bakar Zakaria. Acute toxicity of cockle shell-derived calcium carbonate nanoparticles on rats [J]. Journal of Jilin University (Medicine Edition), 2019, 45(3): 524-530 (in Chinese)
[57] 石岩峰. 浅论饮用水中硬度对人体健康的影响[J]. 农业与技术, 2012, 32(2): 193
Shi Y F. Influence of hardness in drinking water on human health [J]. Agriculture and Technology, 2012, 32(2): 193 (in Chinese)
[58] 冯涓, 刘卫花, 钱怡, 等. 纳米碳酸钙对职业暴露人群的血液和心血管系统的影响[J]. 环境与职业医学, 2014, 31(5): 377-380
Feng J, Liu W H, Qian Y, et al. Effects of occupational exposure to nano-CaCO3 on hematological and cardiovascular systems [J]. Journal of Environmental & Occupational Medicine, 2014, 31(5): 377-380 (in Chinese)
[59] 梁丽红. 纳米碳酸钙对作业人群健康影响的初步研究[D]. 广州: 南方医科大学, 2014: 43-50
Liang L H. Preliminary study on the health effects of workers exposed to nano calcium carbonate [D]. Guangzhou: Southern Medical University, 2014: 43-50 (in Chinese)
[60] Li G L, Liang L H, Yang J C, et al. Pulmonary hypofunction due to calcium carbonate nanomaterial exposure in occupational workers: A cross-sectional study [J]. Nanotoxicology, 2018, 12(6): 571-585
[61] Franck U, Odeh S, Wiedensohler A, et al. The effect of particle size on cardiovascular disorders: The smaller the worse [J]. The Science of the Total Environment, 2011, 409(20): 4217-4221
[62] 林道辉, 冀静, 田小利, 等. 纳米材料的环境行为与生物毒性[J]. 科学通报, 2009, 54(23): 3590-3604
Lin D H, Ji J, Tian X L, et al. Environmental behavior and toxicity of engineered nanomaterials [J]. Chinese Science Bulletin, 2009, 54(23): 3590-3604 (in Chinese)
[63] Li Y B, Ju D W. The role of autophagy in nanoparticles-induced toxicity and its related cellular and molecular mechanisms [J]. Advances in Experimental Medicine and Biology, 2018, 1048: 71-84
[64] Devasagayam T P, Tilak J C, Boloor K K, et al. Free radicals and antioxidants in human health: Current status and future prospects [J]. The Journal of the Association of Physicians of India, 2004, 52: 794-804
[65] 周小君, 徐仰辉, 何强, 等. 纳米颗粒对淡水藻类生长的影响: 毒性机制与复合毒性[J]. 生态毒理学报, 2021, 16(3): 128-143
Zhou X J, Xu Y H, He Q, et al. Effects of nanoparticles on growth of freshwater algae: Toxicity mechanism and combined toxicity [J]. Asian Journal of Ecotoxicology, 2021, 16(3): 128-143 (in Chinese)
[66] 宋益娟. 食品包装材料中纳米银对肠上皮细胞(Caco-2)安全性的研究[D]. 杭州: 中国计量学院, 2014: 11-37
Song Y J. Safety assessment of sliver nanoparticles in food packaging materials on human epithelial colorectal adenocarcinoma (caco-2) cells [D]. Hangzhou: China University of Metrology, 2014: 11-37 (in Chinese)
[67] Lin E, Gletsu-Miller N. Surgical stress induces an amplified inflammatory response in patients with type 2 diabetes [J]. ISRN Obesity, 2013, 2013: 910586
[68] Feng Y C, He D, Yao Z Y, et al. The machinery of macroautophagy [J]. Cell Research, 2014, 24(1): 24-41
[69] 何付凡, 陈欢, 张玉彬. 纳米材料诱导细胞自噬的机制和生物学效应[J]. 药学研究, 2017, 36(4): 226-230
He F F, Chen H, Zhang Y B. Nanomaterial-induced autophagy: Underlying mechanisms and functional consequences [J]. Journal of Pharmaceutical Research, 2017, 36(4): 226-230 (in Chinese)
[70] Moosavi M A, Sharifi M, Ghafary S M, et al. Photodynamic N-TiO2 nanoparticle treatment induces controlled ROS-mediated autophagy and terminal differentiation of leukemia cells [J]. Scientific Reports, 2016, 6: 34413
[71] 臧一腾, 张婷. 纳米材料诱导细胞自噬及其“双刃剑”作用[J]. 生态毒理学报, 2019, 14(5): 65-73
Zang Y T, Zhang T. Research progress of autophagy and its function of “double-edged sword” induced by nanomaterials [J]. Asian Journal of Ecotoxicology, 2019, 14(5): 65-73 (in Chinese)
[72] Cheng Y N, Zhang W B, Fan H, et al. Water-soluble nanopearl powder promotes MC3T3-E1 cell differentiation by enhancing autophagy via the MEK/ERK signaling pathway [J]. Molecular Medicine Reports, 2018, 18(1): 993-1000
[73] Liu Q, Luo Y, Zhao Y, et al. Nano-hydroxyapatite accelerates vascular calcification via lysosome impairment and autophagy dysfunction in smooth muscle cells [J]. Bioactive Materials, 2022, 8: 478-493
[74] Ning F, Yang Z H, Xu L S, et al. Targeted tumor therapy by autophagy of nanoparticles [J]. Future Oncology, 2020, 16(12): 793-803
[75] Lee Y H, Cheng F Y, Chiu H W, et al. Cytotoxicity, oxidative stress, apoptosis and the autophagic effects of silver nanoparticles in mouse embryonic fibroblasts [J]. Biomaterials, 2014, 35(16): 4706-4715
[76] 刘鑫, 陈洁, 朱永生, 等. 自噬对钙化性纳米微粒致肾结石形成的作用机制[J]. 医学研究生学报, 2020, 33(1): 44-49
Liu X, Chen J, Zhu Y S, et al. Mechanism of autophagy on the formation of kidney stones caused by calcified nanoparticles [J]. Journal of Medical Postgraduates, 2020, 33(1): 44-49 (in Chinese)
[77] Wang S, Ni D Z, Yue H, et al. Exploration of antigen induced CaCO3 nanoparticles for therapeutic vaccine [J]. Small, 2018, 14(14): e1704272