戊唑醇属于三唑类杀菌剂,因其可以有效抑制P450酶系家族中的羊毛甾醇-14-α-脱甲基酶活性,导致真菌麦角甾醇合成停滞、细胞膜完整性被破坏和真菌生长抑制,从而广泛应用在农业中[1],已然成为销量最大的三唑类杀菌剂。戊唑醇具有高脂溶性,在土壤中的半衰期为49~216 d[2-3],在水果[4]、蔬菜[5]以及中药材[6]中均有检出,已被美国环境保护局列为“潜在人类致癌物”[7]。戊唑醇的广泛应用和环境的持久性,使其对环境和人类健康的潜在影响备受关注。
P450酶系是广泛存在于真核生物体内的一类具有混合功能的血红素氧化酶系,主要负责内源性物质的合成以及外源性物质的代谢[8]。P450酶主要在肝脏中表达,催化大量反应,这些反应调控前列腺素、脂肪酸和胆汁酸等内源性物质的合成[9]。胆汁酸是胆汁中存在的一类胆烷酸的总称,由肝脏内多种P450酶催化合成,对胆固醇代谢、脂质消化、宿主-微生物相互作用等方面具有重要作用[10]。胆汁酸合成总量的改变会引起机体肥胖从而伴生出高血脂、糖尿病等症状[11]。此外,胆汁酸作为信号分子调控着许多信号传导途径,如法尼酯衍生物X受体表达途径等,因此胆汁酸也会间接性与炎症性肠道疾病、代谢综合征和结直肠癌相关[12-14]。
每日允许摄入量(acceptable daily intake, ADI)是一个常用的化合物毒性评价参考值,指人每日摄入食品添加剂、农药等化学物质却不会对机体产生任何已知不良效应的剂量,它主要基于动物实验结果推测获得[15]。目前已有研究证实高剂量的戊唑醇会引起生殖系统与分泌系统的损伤,导致肝肾组织病变[16-17]。以往的这些研究多集中于戊唑醇与P450酶相互作用所带来的内分泌紊乱、氧化应激与外源性物质代谢障碍等[16,18],却很少有关注过其对内源性物质合成的影响。人体可能由于食用或触摸食材、药材或经呼吸吸入悬浮于空气中的戊唑醇液滴从而摄入环境中残留的戊唑醇,因此本研究基于ADI剂量以及人与实验动物间常用安全系数建立戊唑醇口服、吸入、涂布的暴露模型,探讨了戊唑醇长期暴露对机体组织的损伤以及对胆汁酸合成的影响。
1 材料与方法(Materials and methods)
1.1 材料与仪器
戊唑醇,CAS号107534-96-3,纯度98.0%,购自上海源叶生物科技有限公司;乙腈、甲醇和甲酸均为质谱级,纯度99.9%,购自美国Thermo Scientific公司;其余试剂均为分析级;总胆汁酸试剂盒购自南京建成生物工程研究所。
Qtrap5500液质联用仪(美国AB SCIEX公司);Waters Acqutiy UP-C18超高色谱柱(2.1 mm×100 mm, 1.7 μm);5300XR高速冷冻离心机(德国Eppendorf公司);Milli-Q超纯水系统(美国Millipore公司);DM2000荧光倒置显微镜(德国Lecia公司);Multiskan FC全波长酶标仪(美国Thermo Scientific公司)。
1.2 动物
雄性Sprague Dawley大鼠(8周龄,体质量220~240 g),购自安徽医科大学动物实验中心,动物生产许可证编号SCXK苏2017-0003。实验开始前适应性喂养7 d,期间大鼠自由饮食饮水,适应性环境条件为温度(25±2) ℃、湿度(50±10)%,并且伴有12 h的光/暗循环。
1.3 戊唑醇含量测定方法
1.3.1 质谱条件的选择
电喷雾离子源温度500 ℃,喷雾电压4 500 V,气帘气压232.4 kPa,雾化气压344.7 kPa,干燥气压344.7 kPa。在m/z 10~500范围内对戊唑醇进行扫描并确定戊唑醇的母离子,并对母离子进行产物离子扫描获得子离子。在多通道检测模式下对碰撞能量和去簇电压进行参数优化。
1.3.2 色谱条件的选择
流动相为乙腈与0.1%甲酸水溶液,等度洗脱70∶30(乙腈∶0.1%甲酸水溶液)流速0.2 mL·min-1,柱温35 ℃,进样量2 μL,运行时间5 min。
1.3.3 戊唑醇对照品溶液的配制
精确称取2 mg戊唑醇对照品,用1 mL甲醇溶解,得到浓度为0.02 mg·L-1的戊唑醇母液。用甲醇分别稀释至10.00、5.00、2.00、1.00、0.50、0.20、0.10、0.05、0.02和0.01 mg·L-1作为戊唑醇梯度浓度溶液使用,置于4 ℃冰箱保存至使用。
1.3.4 组织样品的前处理
精确称量心、肝、脾、肺、肾、十二指肠、空肠和回肠0.1 g置于1.5 mL匀浆管中,在匀浆管中加入钢珠与500 μL甲醇后匀浆。取200 μL组织匀浆液置于1.5 mL离心管中,在4 ℃下,12 000 r·min-1离心15 min,将上清液过0.22 μm有机滤膜后,待测。
1.3.5 专属性考察
取2份空白大鼠的心、肝、脾、肺、肾、十二指肠、空肠和回肠的空白组织匀浆,其中一份加入一定量的戊唑醇母液,使戊唑醇在匀浆中的浓度为0.1 mg·L-1,后按照1.3.4中的方法处理。另一份空白组织匀浆直接按照1.3.4中的方法处理,按照1.3.2的条件进行分析,记录色谱图。
1.3.6 线性范围考察
取戊唑醇梯度浓度储备液各20 μL,分别加入空白大鼠心、肝、脾、肺、肾和小肠的匀浆,使戊唑醇在空白组织匀浆中的浓度为1.000、0.500、0.200、0.100、0.050、0.020、0.010、0.005、0.002和0.001 mg·L-1,涡旋混匀15 s后按照1.3.4中的方法进行前处理,再按照色谱和质谱的条件进行分析可得不同组织中戊唑醇的线性方程。
1.3.7 精密度考察
以肝组织为代表性基质考察方法的精密度。取5、1.0和0.2 mg·L-1戊唑醇梯度浓度储备液各20 μL,分别加入空白大鼠肝匀浆配制成浓度分别为0.50、0.10和0.02 mg·L-1的质控样品。将质控样品按照1.3.4中的方法进行前处理。将质控样品在同一天进样分析或不同天进样分析,根据线性方程以及方差分析,分别获得戊唑醇样品的日内精密度与日间精密度。
1.3.8 回收率与基质效应考察[19]
以肝组织为代表性基质考察方法的回收率与基质效应。取“1.3.7”中的质控样品进样后,所得的峰面积记为S1。取空白肝组织匀浆,按照1.3.4中的方法进行前处理后,加入戊唑醇梯度浓度储备液配制成浓度分别为0.50、0.10和0.02 mg·L-1的样品,进样后所得的峰面积记为S2;以甲醇代替空白肝匀浆,加入戊唑醇梯度浓度储备液稀释成浓度分别为0.50、0.10和0.02 mg·L-1的样品,进样后所得峰面积记为S3,计算回收率与基质效应,计算公式见式(1)和式(2)。
回收率![]()
(1)
基质效应![]()
(2)
1.3.9 稳定性考察
以肝组织为代表性基质考察样品储藏的稳定性。取1.3.7中的质控样品分别在室温放置24 h,在-20 ℃环境下放置24 h,以及在-20 ℃的环境下反复冻融3次考察样品的储藏稳定性。
1.4 戊唑醇暴露模型的构建
1.4.1 戊唑醇给药剂量的确定[15,20-21]
ADI剂量由大鼠或小鼠的毒性实验证明与换算而来,戊唑醇的ADI剂量为0.03 mg·kg-1。美国环境保护局规定风险参考剂量为ADI剂量与安全系数的乘积。参考粮农组织和美国环境保护局对安全系数的规定,本实验选择安全系数为100,因此戊唑醇的给药剂量为3 mg·kg-1。
1.4.2 给药溶液的配制
称取戊唑醇原料药,以一定体积的二甲基亚砜溶解后,超纯水稀释到3 000 mg·L-1和15 000 mg·L-1用于大鼠的灌胃与滴鼻给药;称取戊唑醇原料药,以一定体积的花生油溶解至3 000 mg·L-1用于大鼠的涂布给药。
1.4.3 戊唑醇长期低剂量口服、吸入及皮肤暴露模型的构建
雄性SD大鼠随机分为对照组、灌胃溶剂组、滴鼻溶剂组、皮肤涂布溶剂组、灌胃组、滴鼻组与皮肤涂布组,每组5只大鼠。灌胃组给药体积为1 mL·(100 g)-1,给药剂量为3 mg·kg-1,使用灌胃针给药;滴鼻组给药体积为200 μL·(100 g)-1,使用微量移液器将戊唑醇溶液在大鼠2个鼻腔中轮换滴入,单次滴注药液的体积在30 μL左右,同一个鼻腔2次滴入药液间隔时长在1 min左右,并根据大鼠呼吸状态实时调整,15 min左右完成滴鼻给药,给药剂量为3 mg·kg-1;皮肤涂布组给药前使用7%的硫化钠对大鼠腹部脱毛,给药时使用棉签将含有戊唑醇的油涂抹在大鼠腹部,给药体积为1 mL·(100 g)-1,给药剂量为3 mg·kg-1;灌胃溶剂组、滴鼻溶剂组和皮肤涂布溶剂组分别以各自给药组的溶剂与给药方式给药;对照组为正常健康SD大鼠,不给药,自由饮食饮水。暴露模型大鼠连续给药30 d,构建模型期间大鼠自由饮食饮水。第30天给药后12 h处死大鼠,取心、肝、脾、肺、肾、十二指肠、空肠和回肠,部分置于中性福尔马林溶液中固定,并进行石蜡包埋切片。余下部分的组织在-20 ℃冰箱保存用于含量测定。
1.5 HE染色检测组织的形态学特征
对包埋切片后的各组织使用二甲苯与梯度乙醇脱水后,置入苏木精染6 min,纯水冲洗后,置入伊红染3 min,梯度乙醇脱水晾干后,中性树胶封片后使用荧光显微镜观察组织形态学变化。
1.6 总胆汁酸试剂盒检测肝组织胆汁酸
取冻存的肝脏组织,于室温下解冻。精密称取0.1 g左右的肝组织,PBS缓冲液反复清洗后,置于2倍体积的PBS冰浴匀浆,取匀浆液置于1.5 mL离心管中,在4 ℃下,3 000 r·min-1离心10 min后取上清液30 μL,加入试剂盒中的试剂一应用液240 μL,混匀37 ℃孵育5 min,读取吸光度,加入试剂二60 μL后混匀37 ℃孵育5 min,再次读取吸光度,根据试剂盒说明,计算肝组织胆汁酸的浓度。
1.7 统计学分析
通过SPSS 23.0软件进行处理,计量资料以![]() 表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果(Results)
2.1 戊唑醇检测方法
2.1.1 戊唑醇的质谱条件
扫描后的戊唑醇二级质谱图如图1(a)所示,戊唑醇m/z [M+H]+308.2 → 70.0,优化后的去簇电压为35.8 eV;碰撞能量为61.0 eV。
2.1.2 专属性考察结果
空白组织匀浆液与含戊唑醇的组织匀浆液的峰图如图1(b)所示,空白匀浆基线稳定,空白基质无干扰峰出现,分离度较高,该方法专属性良好。

图1 戊唑醇二级质谱图与色谱图
Fig. 1 Mass spectrum and chromatogram of tebuconazole
2.1.3 线性考察结果
以戊唑醇浓度为横坐标(x)、戊唑醇峰面积为纵坐标(y)进行线性回归,各组织中戊唑醇的线性方程及相关系数如表1所示,在0.001~1.000 mg·L-1的范围内,各组呈良好的线性关系。
表1 戊唑醇在各组织中线性方程及相关系数
Table 1 Linear equation and correlation coefficient of tebuconazole in tissues

组织 Tissue线性方程Linear equation相关系数(r2)Correlation coefficient (r2)心 Hearty=0.0612x+102.690.991肝 Livery=13.859x+1035.40.992脾 Spleeny=104.63x+7147.80.990肺 Lungy=94.997x-5703.20.994肾 Kidneyy=123.2x-6271.20.990肠 Intestiney=90.616x-1921.30.990
2.1.4 精密度考察结果
精密度考察结果如表2所示,戊唑醇样品的日内精密度和日间精密度的结果均以相对标准偏差(relative standard deviation, RSD)表示,RSD的值均<12%,表明该方法重复性好,符合生物样品分析方法对精密度要求。
表2 戊唑醇日内精密度RSD与日间精密度RSD
Table 2 Intra-day precision RSD and inter-day precision RSD of tebuconazole

药物浓度/(mg·L-1)Drug concentration/(mg·L-1)日内精密度RSD/%Intra-day precision RSD/%日间精密度RSD/%Inter-day precision RSD/%0.508.910.80.105.711.70.029.411.2
注:RSD表示相对标准偏差。
Note: RSD means relative standard deviation.
2.1.5 回收率与基质效应考察结果
回收率与基质效应考察结果如表3所示,各组的基质效应与加标回收率均>75%,且相对标准偏差均<15%,表明该组织样品的处理方法符合一般生物样品的处理要求。
表3 戊唑醇基质效应与加标回收率
Table 3 Matrix effect and extraction recovery rate of tebuconazole
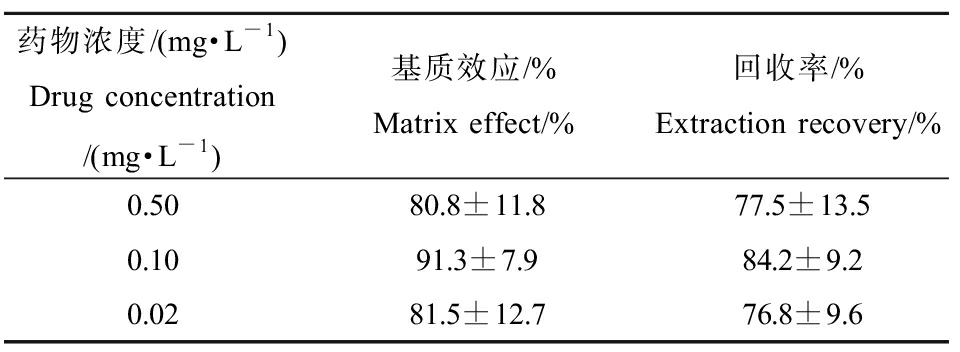
药物浓度/(mg·L-1)Drug concentration/(mg·L-1)基质效应/%Matrix effect/%回收率/%Extraction recovery/%0.5080.8±11.877.5±13.50.1091.3±7.984.2±9.20.0281.5±12.776.8±9.6
2.1.6 样品储存稳定性考察结果
质控样品在室温放置24 h、-20 ℃放置24 h和-20 ℃反复冻融后浓度下降的比率分别为(17.5±4.7)%、(8.0±7.7)%和(19.2±3.5)%。表明戊唑醇储存稳定性良好,符合生物样品测定的要求。
2.2 戊唑醇在大鼠组织中的分布
戊唑醇以ADI剂量分别连续灌胃、滴鼻和皮肤涂布30 d建立戊唑醇低剂量长期口服、吸入和皮肤暴露大鼠模型后,戊唑醇在各组织中的分布状况如图2所示。灌胃组的戊唑醇主要分布在肝和肾,在心脏和十二指肠也有少量分布;滴鼻组的戊唑醇分布在肝和肾;皮肤涂布组的戊唑醇主要分布在肝和肾,在十二指肠、空肠和回肠段少量分布。灌胃组的戊唑醇在肝、肾组织中的含量高于滴鼻组和皮肤涂布组的戊唑醇在肝、肾组织中的含量但是并无显著性差异,灌胃组肾脏中的戊唑醇含量显著高于滴鼻组肾脏中的戊唑醇(P<0.05)。皮肤涂布组与滴鼻组肝肾组织中戊唑醇的含量无显著性差异。

图2 戊唑醇在大鼠各组织中的分布
注:*表示P<0.05,**表示P<0.01。
Fig. 2 Distribution of tebuconazole in various tissues of rat
Notes: *represents P<0.05, and **represents P<0.01.
2.3 戊唑醇对主要器官的组织形态学影响
大鼠各组织HE染色的结果如图3所示,对照组的各主要器官组织形态与各溶剂组对比无显著性差异。灌胃组、滴鼻组与涂布组的心、肝、脾和肾组织纤维结构正常,细胞核清晰排列,肺组织肺泡结构完整,肺叶无肿胀现象,小肠组织肠绒毛结构完整,排列整齐,各组织均无病变现象,与对照组相比并无明显变化。

图3 大鼠各组织HE染色结果图像(×100)
Fig. 3 Representative HE staining images of tissues in tebuconazole exposure rat models (×100)
2.4 戊唑醇对肝脏胆汁酸合成的影响
各组肝脏组织中总胆汁酸的含量如图4所示,对照组的胆汁酸含量与各溶剂组之间无显著性差异(P>0.05);滴鼻组的胆汁酸含量显著低于对照组(P<0.05);灌胃组、涂布组的胆汁酸含量低于对照组,但是并无显著性差异(P>0.05)。上述结果提示,戊唑醇经鼻腔吸收对胆汁酸合成有显著影响。
3 讨论(Discussion)
近年来关于戊唑醇的暴露研究集中在其对内分泌的干扰作用及氧化应激作用。戊唑醇9 mg·kg-1剂量持续对大鼠暴露一个月后,大鼠的超氧化物歧化酶和过氧化氢酶含量显著升高,氧化应激平衡被破坏[22]。以10、25和50 mg·kg-1剂量戊唑醇暴露28 d,雄性大鼠部分器官P450酶活性受到抑制,所有剂量均出现抗激素作用[16]。以8、23和71 mg·kg-1剂量戊唑醇暴露90 d后,71 mg·kg-1的戊唑醇对大鼠的体质量及造血功能产生了显著的抑制作用,其余2种剂量对大鼠的体质量、组织形态及血生化指标均无显著性影响[23]。参考上述研究中对于戊唑醇暴露时间的设定,本研究以ADI剂量戊唑醇对成年大鼠暴露30 d,结果表明其对组织形态并无显著影响,符合近年来相关研究的结论。

图4 戊唑醇对肝脏总胆汁酸的影响
注:Normal代表未经任何处理的空白组,Control代表溶剂组;与溶剂组相比,*表示P<0.05,**表示P<0.01;与对照组相比,# 表示P<0.05,## 表示P<0.01。
Fig. 4 Effects of tebuconazole on total bile acid content in liver tissues
Notes: Normal represents the blank group without any treatment, Control represents the solvent group; to compare with the solvent group, *represents P<0.05, **represents P<0.01; To compare with the control group, # represents P<0.05, ## represents P<0.01.
3种暴露途径的戊唑醇均主要在肝肾组织中分布,由于戊唑醇属于中等富集性农药[24],易在脂肪含量较高的肝肾组织中蓄积,因此3种暴露途径的戊唑醇均主要在肝肾组织中分布。戊唑醇经口进入体内,在胃肠道中被吸收后,由门静脉进入肝组织中代谢,后进入血液循环。经皮给药过程中,戊唑醇以涂布的方式被涂抹在大鼠腹部,戊唑醇透过腹腔黏膜后被肠组织吸收,该过程避免了肝组织的首过吸收效应,因此经皮给药中的戊唑醇在小肠组织各段均有检出。吸入给药过程中,部分戊唑醇在鼻腔中被大鼠咳出,因此被胃肠道吸收的药物浓度低于另外2种给药方式。
肝肠组织中多种P450酶参与了胆汁酸的合成与代谢,其中肝脏组织中的CYP7A1与CYP27A1分别是胆汁酸合成的经典途径与替代的限速酶[25],除此之外,CYP7B1与CYP8B1也会协同催化合成胆汁酸。3种暴露方式均减少了肝组织的胆汁酸含量,可能与戊唑醇对P450酶活性作用相关,戊唑醇结构中的三唑环上的氮原子可以与P450酶结构中卟啉环中的铁原子发生金属配位结合[26],产生对P450酶的抑制作用,因此推测戊唑醇影响了胆汁酸合成限速酶的活性从而影响了胆汁酸的合成,部分研究也以证实了戊唑醇会对P450酶系家族的CYP3A4、CYP19A1等酶的活性产生抑制作用[27-28]。3种暴露途径中仅吸入暴露途径显著降低了肝脏胆汁酸的合成总量,可能与3种暴露途经中戊唑醇的分布相关,戊唑醇经口与经皮给药后在十二指肠均有分布,由于CYP27A1在肝细胞以及各种肝外部位表达[29],部分初级胆汁酸会在小肠中由CYP27A1替代途径合成后进入肠肝循环,经口与经皮给药的戊唑醇抑制了十二指肠分布的CYP27A1的活性,肠道中初级胆汁酸的合成减少,肝组织中的胆汁酸合成增加,因此经口与经皮暴露途径肝组织中的胆汁酸合成与对照组无显著性差异。
戊唑醇的杀菌机制作用会影响机体P450酶的活性或含量,因此多数关于戊唑醇的研究关注点在通过抑制CYP3A酶直接影响药物吸收[27],或是通过抑制P450酶催化产生的自由基,继而破坏氧化应激的平衡从而引起机体内分泌失调[30]。本研究的结果表明,戊唑醇可能会通过抑制CYP7A1与CYP27A1等胆汁酸限速酶的活性,从而抑制机体胆汁酸合成,胆汁酸总量减少会引起机体胆固醇含量升高,出现胆结石等症状[31]。该现象有助于人们意识到环境残留的污染物对机体带来的潜在风险。
[1] Nett J E, Andes D R. Antifungal agents: Spectrum of activity, pharmacology, and clinical indications [J]. Infectious Disease Clinics of North America, 2016, 30(1): 51-83
[2] Cui N, Xu H Y, Yao S J, et al. Chiral triazole fungicide tebuconazole: Enantioselective bioaccumulation, bioactivity, acute toxicity, and dissipation in soils [J]. Environmental Science and Pollution Research International, 2018, 25(25): 25468-25475
[3] Strickland T C, Potter T L, Joo H. Tebuconazole dissipation and metabolism in Tifton loamy sand during laboratory incubationt [J]. Pest Management Science, 2004, 60(7): 703-709
[4] Podbielska M, Szpyrka E, Piechowicz B, et al. Behavior of fluopyram and tebuconazole and some selected pesticides in ripe apples and consumer exposure assessment in the applied crop protection framework [J]. Environmental Monitoring and Assessment, 2017, 189(7): 350
[5] Camara M A, Barba A, Cerme o S, et al. Effect of processing on the disappearance of pesticide residues in fresh-cut lettuce: Bioavailability and dietary risk [J]. Journal of Environmental Science and Health, Part B, 2017, 52(12): 880-886
o S, et al. Effect of processing on the disappearance of pesticide residues in fresh-cut lettuce: Bioavailability and dietary risk [J]. Journal of Environmental Science and Health, Part B, 2017, 52(12): 880-886
[6] He H R, Gao F, Zhang Y H, et al. Effect of processing on the reduction of pesticide residues in a traditional Chinese medicine (TCM) [J]. Food Additives & Contaminants Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2020, 37(7): 1156-1164
[7] Liu N, Dong F S, Xu J, et al. Chiral bioaccumulation behavior of tebuconazole in the zebrafish (Danio rerio) [J]. Ecotoxicology and Environmental Safety, 2016, 126: 78-84
[8] Manikandan P, Nagini S. Cytochrome P450 structure, function and clinical significance: A review [J]. Current Drug Targets, 2018, 19(1): 38-54
[9] Zanger U M, Schwab M. Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation [J]. Pharmacology & Therapeutics, 2013, 138(1): 103-141
[10] 陈超, 李华军. 肠道菌群与胆汁酸的互作在相关疾病中的作用[J]. 中国微生态学杂志, 2018, 30(2): 245-249
Chen C, Li H J. The interaction of intestinal microbiota and bile acid in related diseases [J]. Chinese Journal of Microecology, 2018, 30(2): 245-249 (in Chinese)
[11] 张柳, 牛尚梅, 马慧娟. 胆汁酸与代谢综合征的研究进展[J]. 医学综述, 2016, 22(5): 964-967
Zhang L, Niu S M, Ma H J. The progress of bile acids and metabolic syndrome [J]. Medical Recapitulate, 2016, 22(5): 964-967 (in Chinese)
[12] Marin J J G, Macias R I R, Briz O, et al. Bile acids in physiology, pathology and pharmacology [J]. Current Drug Metabolism, 2015, 17(1): 4-29
[13] Sinha S R, Haileselassie Y, Nguyen L P, et al. Dysbiosis-induced secondary bile acid deficiency promotes intestinal inflammation [J]. Cell Host & Microbe, 2020, 27(4): 659-670.e5
[14] Wang S N, Dong W X, Liu L, et al. Interplay between bile acids and the gut microbiota promotes intestinal carcinogenesis [J]. Molecular Carcinogenesis, 2019, 58(7): 1155-1167
[15] Lu F C. Acceptable daily intake: Inception, evolution, and application [J]. Regulatory Toxicology and Pharmacology, 1988, 8(1): 45-60
[16] Yang J D, Liu S H, Liao M H, et al. Effects of tebuconazole on cytochrome P450 enzymes, oxidative stress, and endocrine disruption in male rats [J]. Environmental Toxicology, 2018, 35(5): 899-907
[17] Tamura K, Inoue K, Takahashi M, et al. Involvement of constitutive androstane receptor in liver hypertrophy and liver tumor development induced by triazole fungicides [J]. Food and Chemical Toxicology, 2015, 78: 86-95
[18] Ferreira D, Motta A C D, Kreutz L C, et al. Assessment of oxidative stress in Rhamdia quelen exposed to agrichemicals [J]. Chemosphere, 2010, 79(9): 914-921
[19] 罗雪琪, 余洋, 来庆娜, 等. 液相色谱-串联质谱法研究氟噻草胺在大鼠体内组织中的分布行为[J]. 农药学学报, 2019, 21(4): 506-513
Luo X Q, Yu Y, Lai Q N, et al. Tissue distribution of flufenacet in rats determined by liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Pesticide Science, 2019, 21(4): 506-513 (in Chinese)
[20] Mathiyalagan S, Mandai B K. A review on assessment of acceptable daily intake for food additives [J]. Biointerface Research in Applied Chemistry, 2020, 10(4): 6033-6038
[21] 中华人民共和国卫生部, 中华人民共和国农业部. 食品中农药最大残留限量: GB 2763—2012[S]. 北京: 中国标准出版社, 2013
[22] Othmène Y B, Hamdi H, Amara I, et al. Tebuconazole induced oxidative stress and histopathological alterations in adult rat heart [J]. Pesticide Biochemistry and Physiology, 2020, 170: 104671
[23] 杨秀鸿, 安飞云, 陆丹. 戊唑醇原药诱变性与亚慢性经口毒性的实验研究[J]. 实用预防医学, 2010, 17(10): 2084-2087
Yang X H, An F Y, Lu D. Experimental study on mutagenicity and subchronic toxicity by oral exposure of tebuconazole TC [J]. Practical Preventive Medicine, 2010, 17(10): 2084-2087 (in Chinese)
[24] 吴迟, 刘新刚, 何明远, 等. 戊唑醇对斑马鱼的急性毒性及生物富集效应[J]. 生态毒理学报, 2017, 12(4): 302-309
Wu C, Liu X G, He M Y, et al. Acute toxicity and bio-concentration of tebuconazole in Brachydanio rerio [J]. Asian Journal of Ecotoxicology, 2017, 12(4): 302-309 (in Chinese)
[25] Chiang J Y L. Bile acids: Regulation of synthesis [J]. Journal of Lipid Research, 2009, 50(10): 1955-1966
[26] Zhang Q Y, Li D, Wei P, et al. Structure-based rational screening of novel hit compounds with structural diversity for cytochrome P450 sterol 14α-demethylase from Penicillium digitatum [J]. Journal of Chemical Information and Modeling, 2010, 50(2): 317-325
[27] Lv X, Pan L M, Wang J Y, et al. Effects of triazole fungicides on androgenic disruption and CYP3A4 enzyme activity [J]. Environmental Pollution, 2017, 222: 504-512
[28] Robinson J F, Tonk E C M, Verhoef A, et al. Triazole induced concentration-related gene signatures in rat whole embryo culture [J]. Reproductive Toxicology, 2012, 34(2): 275-283
[29] Ticho A L, Malhotra P, Dudeja P K, et al. Intestinal absorption of bile acids in health and disease [J]. Comprehensive Physiology, 2019, 10(1): 21-56
[30] Sies H. Oxidative stress: A concept in redox biology and medicine [J]. Redox Biology, 2015, 4: 180-183
[31] 李洪柳, 申元英. 胆固醇胆结石形成机制的研究进展[J]. 中国公共卫生管理, 2020, 36(2): 194-196
Li H L, Shen Y Y. Advances in the mechanism of cholesterol gallstone formation [J]. Chinese Journal of Public Health Management, 2020, 36(2): 194-196 (in Chinese)