微塑料是一种广泛存在的新兴污染物,几乎存在于任何环境介质中,包括海洋、河流、大气和土壤等,已成为全球关注的热点环境问题。对微塑料的广泛定义是:<5 mm的塑料微粒[1]。因其尺寸小、有颜色,很容易被水体中的生物误食,其中密度较低的微塑料可被浮游生物摄食,密度高的微塑料易被底栖生物摄食[2]。生物的摄食行为又会使微塑料从水体迁移和富集至生物体内,并通过食物链在营养级中逐级传递[3]。由于微塑料比一般塑料比表面积大,更容易吸附有毒有害物质,且其本身也可释放出有毒有害物质,会对水生生物产生毒害,对环境造成污染[4]。淡水生物暴露于塑料颗粒,特别是纳米级微塑料(nanoplastics, NP;<1 μm)[5],可导致各种不良反应,包括早期死亡、炎症反应、生长发育受到抑制、摄食活动低下、氧化损伤、免疫和神经传递功能障碍,甚至行为异常[3, 6-8]。此外,对特定物种的毒性伤害取决于暴露时间、颗粒浓度、形状、化学成分和大小,体积越小的颗粒更容易穿过生物屏障,在组织和器官中积累[9]。
起初微塑料的研究主要集中在海洋生态系统,近年来在淡水生态系统中也受到了越来越多的关注。大量研究报道了微塑料在不同环境介质中的丰度情况,许多国家和地区均对此开展了一系列调查工作,各水域微塑料污染状况也随着研究的深入由模糊变得清晰。但微塑料的生态风险评价尚不成熟,只有丰度数据并不能较好地评判和量化环境介质中微塑料的生态风险。由于聚合物材质、形状和粒径的多样性,使得微塑料污染问题本身非常复杂,因此很难评估微塑料对生物群的潜在危害风险[10]。微塑料污染研究是一个相对较新的领域,对微塑料污染的生态风险进行科学评估并非易事,这将是一个复杂而又不断发展的过程。目前有关微塑料对生物群落和生态系统风险的研究较为缺乏,有少数研究使用物种敏感性分布法(species sensitivity distribution, SSD)计算出了海洋生态系统的微塑料安全浓度限值,然后通过风险商法对微塑料在海洋生态系统中的生态风险进行了初步量化[11-12],但鲜有研究关注到淡水生态系统中微塑料的生态风险。本研究着眼于淡水系统,借鉴该方法计算淡水微塑料的安全浓度,并对中国部分淡水水域展开微塑料生态风险评估。
1 生态风险评价方法(Ecological risk assessment methods)
1.1 概念介绍
风险商(risk quotient) 法简单保守且应用广泛,通过将实测或预测的环境污染物暴露浓度与预测无效应浓度相比以获得商值来对风险进行表征[13]。根据商值的大小对风险等级进行划分,比值越大则风险越高,通常认为比值>1,风险较显著[14]。计算公式为:
(1)
当QR为0.1~1.0时,表明污染物存在一定环境风险,需对相关风险源展开跟踪观察;当QR超过1.0时,表明污染物存在较为严重的环境风险,需要采取相应措施使其风险降低[15]。
式中:QR是风险商,PNEC为预测无效应浓度(predicted no effect concentration),PEC为预测环境浓度(predicted environmental concentration),其值一般较难获得,通常以实际检测环境浓度(measured environmental concentration, MEC)来代替PEC进行计算,所以风险商法的主要工作是首先计算出PNEC值。
对于PNEC值可使用物种敏感性分布法来计算。物种敏感性分布法的原理是:假设不同物种对某一污染物的敏感性能够被一个分布所描述,利用累积概率分布函数拟合污染物的毒理学数据,建立其物种敏感性分布曲线,依据不同保护程度获取对应的浓度值作为基准值来估算该分布的PNEC。
1.2 毒理数据的筛选
微塑料对淡水环境的不利影响主要有以下2种:(1)生物接触微塑料产生的直接影响;(2)由于微塑料本身含有或其吸附的化学物质所造成的间接影响。本研究主要针对微塑料暴露的直接影响进行风险评估,在收集数据时回避微塑料与其他化学物质联用所得到的毒性数据。
此外,在毒理数据的筛选时还应遵循“适当性、精确性和可靠性”这3个原则[16]。毒性数据筛选标准如下:(1)必须使用符合标准的毒性试验方法。(2)须有适当的实验条件设定,如暴露周期、暴露方式和媒介等。本研究着眼于淡水生态系统风险评价,故选取淡水水生生物毒性试验结果进行分析。(3)毒性终点的选取。本研究拟对微塑料开展慢性风险评价。慢性毒性以最低有效应浓度/最大无效应浓度(LOEC/NOEC)表征,其效应终点包括进食抑制、发育抑制、生长抑制和生殖抑制等中毒症状。当同一物种有多个慢性毒理数据可用时,选取浓度最低的数据[11],具体筛选标准见表1。
1.3 生物物种的选取
在使用SSD法计算淡水生态系统的微塑料安全浓度时,并未对淡水物种类别及数量有明确规定,通常不同国家有不同的要求,具体如表2所示[16]。本文选取的应用于微塑料风险评估模型的生物物种符合欧盟、荷兰、新西兰的相关标准规范要求,能够代表淡水生态系统的不同营养级、营养类型和生命形式,并且基本都为水环境中的典型生物物种。
表1 构建物种敏感性分布(SSD)曲线的毒性数据标准[17]
Table 1 Toxicity data criteria for construction of species sensitivity distribution (SSD) curves[17]

参数Parameters原则Principles物种Species我国水环境中存在的水生物种及国际推荐模式测试的物种Aquatic species in China’s water environment and species tested by international recommended models暴露媒介Exposure agent淡水Fresh water暴露方式Exposure regime静态、半静态和流水式Static, semi-static and flow生命阶段Life stage早期和成熟阶段Larval, juvenile and adult测试时间Test duration慢性毒性数据:鱼类2~90 d;甲壳类4~30 d;藻类1~10 dChronic toxicity data: Fish 2~90 d; crustaceans 4~30 d; algae 1~10 d毒性终点Toxicity endpoint慢性终点:最大无效应浓度/最低有效应浓度(NOEC/LOEC)Chronic endpoint: No observed effect concentration/Lowest observed effect concentration (NOEC/LOEC)
表2 国际上对SSD法物种数量和物种类别的要求[16]
Table 2 International requirements for the number and category of SSD species[16]

国家或组织Country or organization物种数量和类别要求Species number and category requirements欧盟European Union慢性毒性数据:至少包含8种类群生物的10个毒性值,其中甲壳类动物1科、鱼类1科、脊索动物门中另1科、昆虫1科、节肢动物门和脊索动物门以外的1科、昆虫或其他门类另1科、高等植物1科、藻类1科Chronic toxicity data: At least 10 toxicity values of 8 species groups, including 1 family of crustaceans, 1 family of fishes, another family of chordate, 1 family of insects, 1 family other than the phylum arthropoda and chordate, 1 family of insects or other phyla, 1 family of higher plants, and 1 family of algae美国USA至少含有来自3门8科的水生生物毒性值:浮游甲壳类1科、硬骨鱼纲的鲑科、鱼纲中另1科、脊索动物门中另1科、昆虫1科、节肢动物门和脊索动物门以外的1科、淡水藻类或维管束植物1科、昆虫中的另1科Contains at least 8 families of aquatic organisms from 3 phyla: 1 family of planktoncrustaceans, 1 family of salmon of os-teichthyes, another family of ichthyoid, another family of chordate, 1 family of insects, 1 family other than the phylum ar-thropoda and chordate, 1 family of freshwater algae or vascular plants, and another family of insects荷兰Netherlands慢性毒性数据:至少含4种不同类群的生物毒性值Chronic toxicity data: Biological toxicity values for at least 4 different groups新西兰New Zealand慢性毒性数据:至少包含4种不同类群生物的5个毒性值,其中至少鱼类1科、藻类1科、无脊椎动物2科Chronic toxicity data: Contains at least 5 toxicity values for 4 different groups of organisms, including at least 1 family of fish, 1 family of algae, and 2 families of invertebrates
1.4 毒性数据的处理
目前实验室对微塑料毒性研究采用的浓度单位不一,有μg·mL-1、mg·L-1、n·mL-1和n·L-1,国内外对水体微塑料丰度使用最多的单位为n·m-3。为了便于模型计算及后续对不同地区微塑料生态风险的评估,需将单位转化为n·m-3。对于毒性值以质量/体积表示时,需统一将单位换算为“n·m-3”。值得说明的是,不同浓度单位间的换算会不可避免地使计算结果与真实数值产生一定偏差,从而在一定程度上影响模拟的准确性。但随着微塑料毒理学研究的丰富,相关标准的逐步建立,这种影响将越来越小。
在进行单位换算时,对于在实验中未明确形状的微塑料颗粒,视其为标准的球体,用已知的直径(当微塑料颗粒直径尺寸不一时取其平均值)和特定的微塑料密度可求得一个微粒的质量,再用单位体积下的微塑料总质量除以单个微塑料颗粒质量即可得到单位体积下微塑料的个数,最终可统一换算为以“n·m-3”为单位,公式如下:

(2)
本文全面查阅近10年(2011—2021)国内外相关文献和数据库资料,收集并整理了10项微塑料毒理学实验数据,涉及水生生物共5门7科10种,具体如表3所示。
表3 微塑料对淡水水生生物毒性数据
Table 3 Toxicity data of microplastics to freshwater aquatic organisms
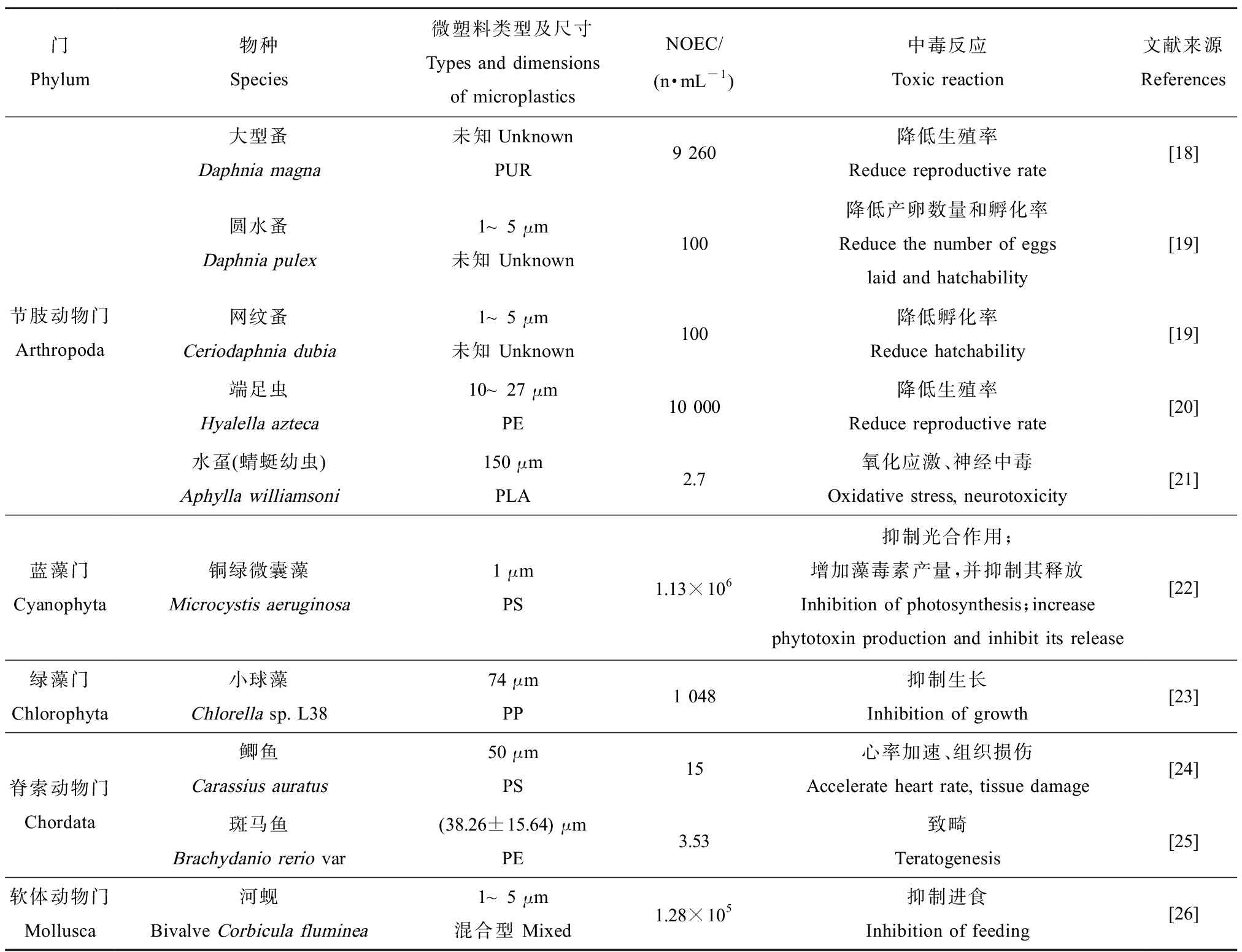
门Phylum物种Species微塑料类型及尺寸Types and dimensions of microplasticsNOEC/(n·mL-1)中毒反应Toxic reaction文献来源References节肢动物门Arthropoda大型蚤Daphnia magna未知UnknownPUR9 260降低生殖率Reduce reproductive rate[18]圆水蚤Daphnia pulex1~5 μm未知 Unknown100降低产卵数量和孵化率Reduce the number of eggs laid and hatchability[19]网纹蚤Ceriodaphnia dubia1~5 μm未知 Unknown100降低孵化率Reduce hatchability[19]端足虫Hyalella azteca10~27 μmPE10 000降低生殖率Reduce reproductive rate[20]水虿(蜻蜓幼虫)Aphylla williamsoni150 μmPLA2.7氧化应激、神经中毒Oxidative stress, neurotoxicity[21]蓝藻门Cyanophyta铜绿微囊藻Microcystis aeruginosa1 μmPS1.13×106抑制光合作用;增加藻毒素产量,并抑制其释放Inhibition of photosynthesis;increase phytotoxin production and inhibit its release[22]绿藻门Chlorophyta小球藻Chlorella sp. L3874 μmPP1 048抑制生长Inhibition of growth[23]脊索动物门Chordata鲫鱼Carassius auratus50 μmPS15心率加速、组织损伤Accelerate heart rate, tissue damage[24]斑马鱼Brachydanio rerio var(38.26±15.64) μmPE3.53致畸Teratogenesis[25]软体动物门Mollusca河蚬Bivalve Corbicula fluminea1~5 μm混合型 Mixed1.28×105抑制进食Inhibition of feeding[26]
注:PUR表示聚氨酯;PE表示聚乙烯;PLA表示聚丙交酯;PS表示聚苯乙烯;PP表示聚丙烯。
Note: PUR stands for polyurethane; PE stands for polyethylene; PLA stands for polylactide; PS stands for polystyrene; PP stands for polypropylene.
2 生态风险评价模型应用(Application of ecological risk assessment model)
2.1 分布模型的选择
物种敏感性分布法可用来比较不同生物类群对环境污染物的敏感性,给出保护物种多样性的风险阈值,以制定针对特定污染物的水质指南。目前,常见且受认可的毒理数据物种敏感性分布模型主要有: Log-logistic、Log-triangular、Log-normal和BurⅢ。物种敏感性分布并不属于某种特定的分布形式,因此可选择不同的曲线进行拟合。本研究采用澳大利亚和新西兰环境质量标准制定与风险评价中推荐使用的BurrⅢ型分布模型进行曲线拟合[17],该分布模型是一种灵活的分布函数,对物种的慢性毒性数据的拟合特性较好。Burr Ⅲ型函数的参数方程为:

(3)
式中:x为环境浓度(μg·L-1),b、c和k为函数的3个不同参数。当k趋于无穷大时,BurrⅢ型分布将变化为Reweibull型分布:
(4)
式中:α和β为函数参数,其他符号释义同前。实际应用中,如果k>100,可应用Weibull分布函数进行拟合[17]。
该分布模型可用BurrlizO 2.0软件进行计算,该软件由澳大利亚联邦科学和工业研究组织(Commonwealth Scientific and Industrial Research Organization, CSIRO)开发。软件可将输入的毒性数据根据样本的实际分布情况自动排列,在BurrⅢ和Weibull分布方程中选择最优化的拟合方式以确保拟合精确度。
2.2 SSD曲线拟合
使用BurrlizO软件对微塑料毒性数据拟合的操作步骤为:(1)统计所有的数据信息,按浓度、物种所属门、毒性类型、物种所属科的顺序进行记录并存入记事本文件;(2)将文件导入软件,根据需求选择合适的尺度形式、置信区间等软件参数,进行数据拟合(本文采用对数尺度、95%置信区间);(3)该软件可将拟合结果以图片、报告或PDF等格式导出,用户根据所需文件类型将其导出即可。图1为软件拟合的淡水水生生物对微塑料的SSD曲线图。
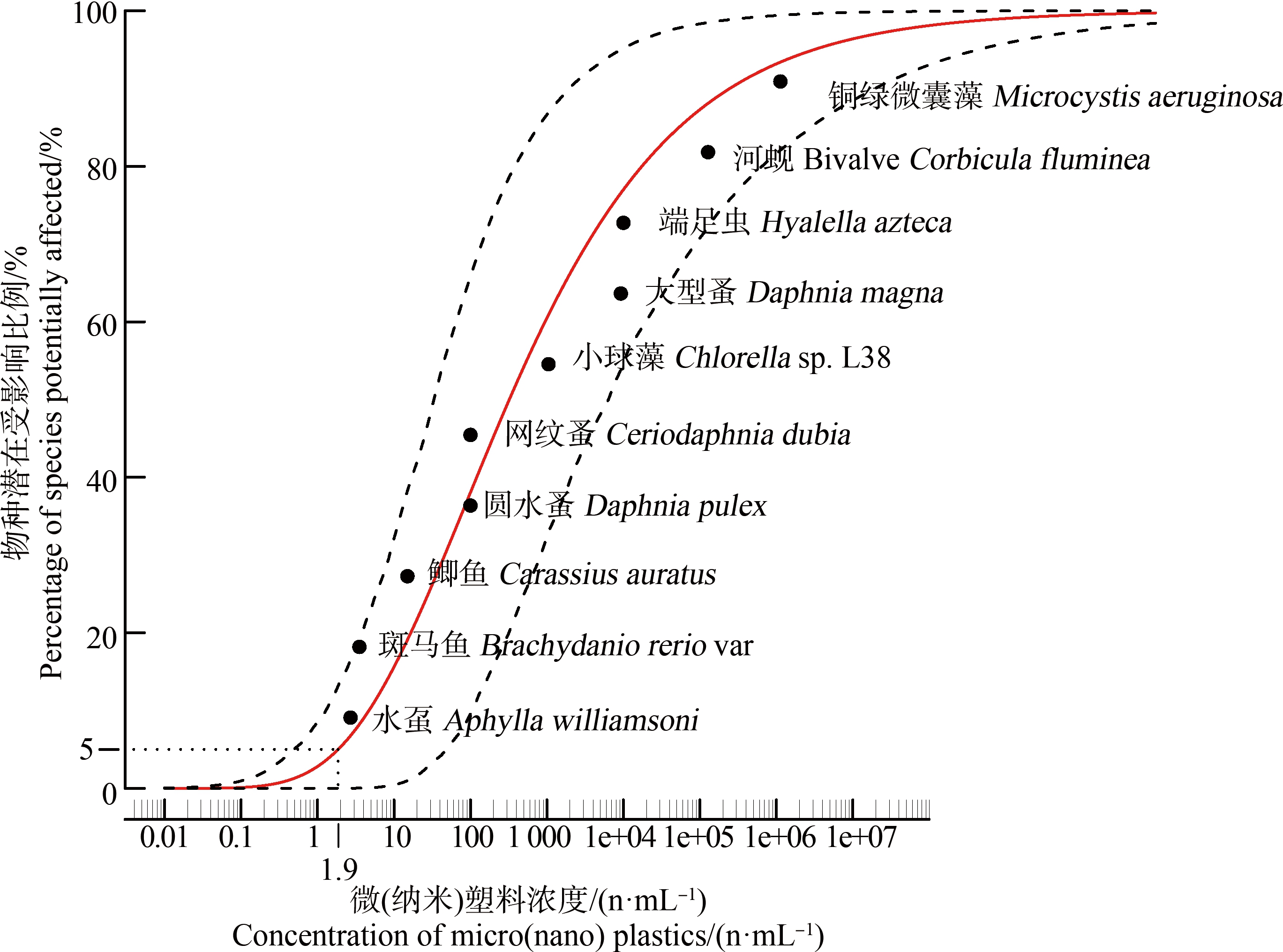
图1 淡水水生生物对微塑料的物种敏感性分布(SSD)曲线图
注:图上红色实线表示实际物种敏感性分布,上、下黑色虚线分别表示上、下置信区间(95%)。
Fig. 1 Distribution of species sensitivity (SSD) of freshwater aquatic organisms to microplastics
Note: In the figure, the solid red line represents the actual species sensitivity distribution, and the upper and lower black dashed lines represent the upper and lower confidence intervals (95%) respectively.
2.3 安全浓度的计算
预测无效应浓度是能够反映水生态风险水平的污染物浓度值,可作为污染物的水生态保护基准值,污染物在该浓度以下被认为对水生态系统是安全的。计算公式为:
(5)
式中:HCP为任一累积概率P对应的浓度;AF为评估因子。
考虑污染物对实际水体的损伤情况,本研究参照美国环境保护局在生态风险评估准则中的规定,选用5%危险浓度(hazardous concentration for 5% of species, HC5)。在生态风险评估中,这个危险浓度也可以衍生为理论上保护特定百分比物种的浓度,即在HC5阈值下可保护95%的物种不受影响[27]。
应用Burr Ⅲ型分布计算HCP的公式为:

(6)
在使用BurrlizO计算软件时,该值可由软件直接计算得出,在图1可直观反映,从图1中可知HC5值即为使5%的物种受影响的污染物浓度值。
评估因子的选择参照欧盟《化学品的注册、评估、授权和限制》法规对危害评估因子的选择方法(表4)。
表4 推导水环境系统预测无效应浓度(PNEC)的数据要求和评估因子[15]
Table 4 The requirements and assessment factors for deriving predicted no observed concentration (PNEC) of water environmental systems[15]

数据要求Data requirement评估因子Evaluation factor3个营养级别生物;每级至少有1项短期LC50(EC50)Three trophic levels of organisms; at least 1 short-term LC50 (EC50) for each level1 0001项长期试验的NOECNOEC in 1 long-term trial1002个营养级别生物且至少含2个物种的长期NOEC2 trophic grade organisms with long-term NOEC of at least 2 species503个营养级别生物且至少含3个物种长期NOEC3 trophic grade organisms with long-term NOEC of at least 3 species10模拟生态系统或野外数据Simulation of ecosystem or field data视情况而定(1~5)As appropriate (1~5)
注:EC50为半数效应浓度;LC50为半数致死浓度;NOEC为最大无影响浓度。
Note: EC50 is half effect concentration; LC50 is the median lethal concentration; NOEC is the chronic no observed effect concentrations.
3 结果分析(Interpretation of results)
图1是对选取的全部物种的SSD曲线拟合结果,结合表3中毒性数据可知:在相同微塑料污染程度上,水虿(蜻蜓幼虫)受微塑料影响程度最大,铜绿微囊藻受微塑料损害程度最低。SSD曲线的置信区间(95%)为:0.55~28 n·mL-1,微塑料对淡水水生生物的HC5为1.9 n·mL-1。对于具有3个营养级别生物至少3个物种的最大无观察效应浓度数据,评价因子采用10。因此本研究中PNEC=0.19 n·mL-1=1.9×105 n·m-3。
在已发表的使用物种敏感性分布法评估微塑料生态风险的文章中(表5),有2篇着眼于海洋系统:Everaert[11]计算出的HC5值为3.33×104 n·m-3,PNEC值为6.65×103 n·m-3;Jung等[12]计算出的HC5值为5.57×104 n·m-3,PNEC值为1.2×104 n·m-3;有2篇未区分海洋和淡水系统:陈锦灿等[28]计算出的HC5值为1.85×105 g·L-1,PNEC值为185 g·L-1;Burns和Boxall[29]只对HC5的值进行了计算,为6.4×104 n·L-1。本文计算的微塑料对淡水生物的HC5值为1.9×106 n·m-3,PNEC值为1.9×105 n·m-3,比海洋系统高1~2个数量级,原因可能是由于淡水微塑料毒性数据相较海洋数量少,模拟准确性相对不足,扩大了计算结果的差距,也可能是淡水生物相比海水生物对微塑料毒性的耐受力更高。
表5 不同文献水生态阈值计算结果
Table 5 Calculated results of water ecological thresholds in different literatures

序号Serial numberHC5PNEC系统System参考文献References13.33×104 n·m-36.65×103 n·m-3海洋 Ocean[11]25.98×104 n·m-31.20×104 n·m-3海洋 Ocean[12]31.85×105 g·L-1185 g·L-1海洋+淡水 Ocean+Fresh water[28]46.40×104 n·L-1———海洋+淡水 Ocean+Fresh water[29]
4 中国典型淡水水域微塑料的生态风险评估(Ecological risk assessment of micro-plastics in typical freshwater waters of China)
为了探究中国淡水水域微塑料生态风险的高低,本文收集了近年来发表的有关中国淡水水域微塑料丰度的文章,在对收集到的文献进行筛选时有2个原则:(1)丰度单位需以“个数/体积”来表示,以便风险商值的计算;(2)尺寸下限应较小,以更接近水体中微塑料的真实丰度(本文选取的尺寸下限为50 μm,岷江[30]除外)。
由表6可知,黄河下游的风险商值为2.616~4.895,>1,存在较为严重的生态风险,需采取相应措施降低微塑料污染以削弱风险;珠江、太湖、鄱阳湖、茅洲河、岷江(成都段)和玛纳斯河有个别采样点风险商>0.1,表明该水域中的微塑料对环境存在一定风险,需对其展开跟踪检测,防止风险进一步增加;其余6条河流风险商均低于0.1,无生态风险。值得注意的是,由于技术限制,尺寸越低的微塑料越难被识别出,在微塑料丰度的研究中通常会明确一个最低尺寸,并未识别出所有微塑料,所以监测的微塑料丰度相较于真实情况是偏低的,从而导致计算出的风险商也会相应偏低,因此对于风险商小于却接近0.1的河流也应给予足够关注。基于以上结果,文中选取的13条中国典型河流的微塑料污染情况基本上不会对水生态系统带来重大风险,但鉴于目前微塑料丰度急剧增加的趋势,未来这些河流的微塑料毒性风险可能将不断提升。
表6 中国典型河流风险商值
Table 6 Risk quotient value of typical rivers in China

序号Serial number地点Site最低尺寸/μmThe minimum size/μm丰度/(n·L-1)Abundance/(n·L-1)风险商Risk quotient value参考文献References1珠江 The Pearl River2019.860.105[31]2太湖 Lake Taihu53.40~25.800.018~0.136[32]3武汉城市河流 Urban rivers of Wuhan501.67~8.930.008~0.047[33]4洞庭湖 Dongting Lake500.90~2.800.005~0.015[34]5洪湖 Honghu Lake501.25~4.650.007~0.024[34]6鄱阳湖 Poyang Lake505~340.026~0.179[35]7长江中下游 The middle and lower reaches of Yangtze River220.50~3.100.002~0.016[36]8三峡水库 The Three Gorges Reservoir481.60~12.610.008~0.066[37]9茅洲河 Maozhou River104.00~25.500.021~0.134[38]10岷江 (成都段) Minjiang River (Chengdu Section)896.11~44.080.032~0.232[30]11黄河下游 Downstream of the Yellow River50497~9302.616~4.895[39]12西藏河流 Tibetan river450.48~0.970.002~0.005[40]13玛纳斯河 Manas River521~490.111~0.258[41]
5 不足与展望(Deficiencies and prospects)
目前针对微塑料的生态风险评价还处于探索起步阶段,尚无一套公认的评价体系,研究人员主要尝试通过借鉴其他污染物评价方法来对微塑料进行风险评价,提出的方法主要有风险指数法、内梅罗污染指数评价法和风险商法[42-43],但其每种方法的科学性都还有待提高。本文通过SSD法计算PNEC并使用风险商法对微塑料污染进行生态风险评估,在研究过程中发现还存在以下不足之处。
(1)毒性数据的缺乏会降低模拟的准确性。目前微塑料对淡水水生生物的毒性数据较少,而毒性数据越多计算的PNEC值将越准确,我们需要有更多的微塑料毒性数据进行补充。希望后期有更多学者关注微塑料毒理学研究,累积更多基础数据。
(2)实验室条件与真实环境有所差别以及实验室实验中使用高暴露浓度,降低了风险评估所需要的生态毒理学数据可靠性。研究人员在进行微塑料毒理学实验时应提高标准,让实验条件和内容更为规范。
(3)有研究指出微塑料的形状不同,毒性也不同,非球状微塑料比球状微塑料对水生生物的毒性更大[44-45]。环境中的实际污染调查显示碎片和纤维状微塑料最为常见,而实验室生物分析的目标微塑料通常采用球状,二者形状上的不匹配,也会限制微塑料生态风险评价的有效性。
(4)在进行微塑料毒性实验时使用的大部分为小尺寸(<75 μm)的微、纳米塑料,而由于尺寸越低的塑料对实验条件要求越严格,难度越大,故在微塑料时空分布的相关研究中鲜有着眼于纳米级微塑料,使得微塑料丰度较真实情况偏低,影响生态风险的评估。后续应关注微塑料提取和鉴别方法的改进,使得越来越多的研究关注到小尺寸微塑料。
在目前对“微塑料”这一新兴污染物所带来的风险不能较好定量分析的研究形势下,使用SSD计算安全浓度并使用风险商对水体中微塑料进行生态风险评估是一个不错的研究思路,其简单明确、具有一定科学性。但该法还存在一些难以避免的问题,用于微塑料风险评估的适用度与准确性还有待提升,这些问题的解决还需要后续研究者们的共同努力。
[1] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838
[2] 蔡立奇. 微塑料在不同环境中的污染特征及其降解行为研究[D]. 广州: 广东工业大学, 2019: 10
Cai L Q. Study on the characteristics of microplastics in different environments and their degradation behaviors [D]. Guangzhou: Guangdong University of Technology, 2019: 10 (in Chinese)
[3] de Sá L C, Luís L G, Guilhermino L. Effects of microplastics on juveniles of the common goby (Pomatoschistus microps): Confusion with prey, reduction of the predatory performance and efficiency, and possible influence of developmental conditions [J]. Environmental Pollution, 2015, 196: 359-362
[4] Xu S, Ma J, Ji R, et al. Microplastics in aquatic environments: Occurrence, accumulation, and biological effects [J]. The Science of the Total Environment, 2020, 703: 134699
[5] Frias J P G L, Nash R. Microplastics: Finding a consensus on the definition [J]. Marine Pollution Bulletin, 2019, 138: 145-147
[6] Nan B X, Su L, Kellar C, et al. Identification of microplastics in surface water and Australian freshwater shrimp Paratya australiensis in Victoria, Australia [J]. Environmental Pollution, 2020, 259: 113865
[7] Rehse S, Kloas W, Zarfl C. Short-term exposure with high concentrations of pristine microplastic particles leads to immobilisation of Daphnia magna [J]. Chemosphere, 2016, 153: 91-99
[8] Ziajahromi S, Kumar A, Neale P A, et al. Environmentally relevant concentrations of polyethylene microplastics negatively impact the survival, growth and emergence of sediment-dwelling invertebrates [J]. Environmental Pollution, 2018, 236: 425-431
[9] Lu Y F, Zhang Y, Deng Y F, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver [J]. Environmental Science & Technology, 2016, 50(7): 4054-4060
[10] Catarino A I, Kramm J, Völker C, et al. Risk posed by microplastics: Scientific evidence and public perception [J]. Current Opinion in Green and Sustainable Chemistry, 2021, 29: 100467
[11] Everaert G, van Cauwenberghe L, de Rijcke M, et al. Risk assessment of microplastics in the ocean: Modelling approach and first conclusions [J]. Environmental Pollution, 2018, 242: 1930-1938
[12] Jung J W, Park J W, Eo S, et al. Ecological risk assessment of microplastics in coastal, shelf, and deep sea waters with a consideration of environmentally relevant size and shape [J]. Environmental Pollution, 2021, 270: 116217
[13] Brain R A, Sanderson H, Sibley P K, et al. Probabilistic ecological hazard assessment: Evaluating pharmaceutical effects on aquatic higher plants as an example [J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 128-135
[14] Brain R A, Johnson D J, Richards S M, et al. Effects of 25 pharmaceutical compounds to Lemna gibba using a seven-day static-renewal test [J]. Environmental Toxicology and Chemistry, 2004, 23(2): 371-382
[15] 张怡婷, 王蕾, 刘济宁, 等. 应用不同毒理学终点评估酚类物质的生态危害和风险[J]. 生态与农村环境学报, 2016, 32(2): 326-331
Zhang Y T, Wang L, Liu J N, et al. Using different toxicological end points to evaluate phenolic compounds for ecological hazard and risk [J]. Journal of Ecology and Rural Environment, 2016, 32(2): 326-331 (in Chinese)
[16] 朱小奕. 水生态的物种敏感性风险评价方法改进及应用[D]. 杭州: 浙江大学, 2017: 4-19
Zhu X Y. Improvement of species sensitivity distributions model for aquatic ecological risk assessment [D]. Hangzhou: Zhejiang University, 2017: 4-19 (in Chinese)
[17] 曾勇, 孙霄, 赖雨薇, 等. 基于物种敏感性分布的多环芳烃水生态系统风险评价方法与应用[J]. 生态毒理学报, 2020, 15(5): 235-243
Zeng Y, Sun X, Lai Y W, et al. Aquatic ecosystem risk assessment of polycyclic aromatic hydrocarbons based on species sensitivity distribution [J]. Asian Journal of Ecotoxicology, 2020, 15(5): 235-243 (in Chinese)
[18] Zimmermann L, Göttlich S, Oehlmann J, et al. What are the drivers of microplastic toxicity? Comparing the toxicity of plastic chemicals and particles to Daphnia magna [J]. Environmental Pollution, 2020, 267: 115392
[19] Jaikumar G, Brun N R, Vijver M G, et al. Reproductive toxicity of primary and secondary microplastics to three cladocerans during chronic exposure [J]. Environmental Pollution, 2019, 249: 638-646
[20] Au S Y, Bruce T F, Bridges W C, et al. Responses of Hyalella azteca to acute and chronic microplastic exposures [J]. Environmental Toxicology and Chemistry, 2015, 34(11): 2564-2572
[21] Chagas T Q, Araújo A P D C, Malafaia G. Biomicroplastics versus conventional microplastics: An insight on the toxicity of these polymers in dragonfly larvae [J]. Science of the Total Environment, 2021, 761: 143231
[22] Wu D, Wang T, Wang J, et al. Size-dependent toxic effects of polystyrene microplastic exposure on Microcystis aeruginosa growth and microcystin production [J]. The Science of the Total Environment, 2021, 761: 143265
[23] Song C F, Liu Z Z, Wang C L, et al. Different interaction performance between microplastics and microalgae: The bio-elimination potential of Chlorella sp. L38 and Phaeodactylum tricornutum MASCC-0025 [J]. Science of the Total Environment, 2020, 723: 138146
[24] Yang H, Xiong H R, Mi K H, et al. Toxicity comparison of nano-sized and micron-sized microplastics to goldfish Carassius auratus larvae [J]. Journal of Hazardous Materials, 2020, 388: 122058
[25] Malafaia G, de Souza A M, Pereira A C, et al. Developmental toxicity in zebrafish exposed to polyethylene microplastics under static and semi-static aquatic systems [J]. The Science of the Total Environment, 2020, 700: 134867
[26] Guilhermino L, Vieira L R, Ribeiro D, et al. Uptake and effects of the antimicrobial florfenicol, microplastics and their mixtures on freshwater exotic invasive bivalve Corbicula fluminea [J]. Science of the Total Environment, 2018, 622-623: 1131-1142
[27] United States Environmental Protection Agency (US EPA). Guidelines ecological risk assessment (EPA/630/R-95/002F) [S]. Washington DC: National Center for Environmental Assessment, 1998
[28] 陈锦灿, 方超, 郑榕辉, 等. 应用物种敏感性分布评估微(纳米)塑料对水生生物的生态风险[J]. 生态毒理学报, 2020, 15(1): 242-255
Chen J C, Fang C, Zheng R H, et al. Assessing ecological risks of micro(nano)plastics to aquatic organisms using species sensitivity distributions [J]. Asian Journal of Ecotoxicology, 2020, 15(1): 242-255 (in Chinese)
[29] Burns E E, Boxall A B A. Microplastics in the aquatic environment: Evidence for or against adverse impacts and major knowledge gaps [J]. Environmental Toxicology and Chemistry, 2018, 37(11): 2776-2796
[30] Li X T, Liang R F, Li Y, et al. Microplastics in inland freshwater environments with different regional functions: A case study on the Chengdu Plain [J]. The Science of the Total Environment, 2021, 789: 147938
[31] Yan M T, Nie H Y, Xu K H, et al. Microplastic abundance, distribution and composition in the Pearl River along Guangzhou City and Pearl River Estuary, China [J]. Chemosphere, 2019, 217: 879-886
[32] Su L, Xue Y G, Li L Y, et al. Microplastics in Taihu Lake, China [J]. Environmental Pollution, 2016, 216: 711-719
[33] Wang W F, Ndungu A W, Li Z, et al. Microplastics pollution in inland freshwaters of China: A case study in urban surface waters of Wuhan, China [J]. Science of the Total Environment, 2017, 575: 1369-1374
[34] Wang W F, Yuan W K, Chen Y L, et al. Microplastics in surface waters of Dongting Lake and Hong Lake, China [J]. The Science of the Total Environment, 2018, 633: 539-545
[35] Yuan W K, Liu X N, Wang W F, et al. Microplastic abundance, distribution and composition in water, sediments, and wild fish from Poyang Lake, China [J]. Ecotoxicology and Environmental Safety, 2019, 170: 180-187
[36] Su L, Cai H W, Kolandhasamy P, et al. Using the Asian clam as an indicator of microplastic pollution in freshwater ecosystems [J]. Environmental Pollution, 2018, 234: 347-355
[37] Di M X, Wang J. Microplastics in surface waters and sediments of the Three Gorges Reservoir, China [J]. Science of the Total Environment, 2018, 616-617: 1620-1627
[38] Wu P F, Tang Y Y, Dang M, et al. Spatial-temporal distribution of microplastics in surface water and sediments of Maozhou River within Guangdong-Hong Kong-Macao Greater Bay Area [J]. The Science of the Total Environment, 2020, 717: 135187
[39] Han M, Niu X R, Tang M, et al. Distribution of microplastics in surface water of the lower Yellow River near estuary [J]. The Science of the Total Environment, 2020, 707: 135601
[40] Jiang C, Yin L, Li Z, et al. Microplastic pollution in the rivers of the Tibet Plateau [J]. Environmental Pollution, 2019, 249: 91-98
[41] Wang G L, Lu J J, Li W J, et al. Seasonal variation and risk assessment of microplastics in surface water of the Manas River Basin, China [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111477
[42] 秦一鸣. 乌梁素海微塑料污染特征及风险评价[D]. 包头: 内蒙古科技大学, 2020: 25-26
Qin Y M. Pollution characteristics and risk assessment of microplastics in Lake Ulansuhai [D]. Baotou: Inner Mongolia University of Science & Technology, 2020: 25-26 (in Chinese)
[43] Peng G Y, Xu P, Zhu B S, et al. Microplastics in freshwater river sediments in Shanghai, China: A case study of risk assessment in mega-cities [J]. Environmental Pollution, 2018, 234: 448-456
[44] Gray A D, Weinstein J E. Size- and shape-dependent effects of microplastic particles on adult daggerblade grass shrimp (Palaemonetes pugio) [J]. Environmental Toxicology and Chemistry, 2017, 36(11): 3074-3080
[45] Ziajahromi S, Kumar A, Neale P A, et al. Impact of microplastic beads and fibers on waterflea (Ceriodaphnia dubia) survival, growth, and reproduction: Implications of single and mixture exposures [J]. Environmental Science & Technology, 2017, 51(22): 13397-13406