纳米材料是指在三维空间中至少有一维处于纳米尺寸(1~100 nm)的材料,根据化学组成可分为纳米颗粒(纳米金属、纳米金属氧化物)、碳纳米材料(富勒烯、碳纳米管和石墨烯)和量子点(半导体晶体纳米材料,包括CdSe、CdTe和ZnSe等)[1]。因具有价格低廉、比表面积大、还原性强、吸附性能高和反应活性佳等优点[1-2],纳米材料可通过不同机制去除典型环境污染物[1-3]。目前关于纳米材料在环境修复领域的应用研究主要集中在2个方面:一是作为新型吸附剂应用于有毒污染物的吸附去除(如抗生素、重金属等)[1];二是作为催化材料氧化还原降解有机污染物(如硝基芳香化合物、内分泌干扰物等)[2-3]。
纳米技术为环境污染修复提供了新的研究机遇,推动了污染修复研究向更深层次发展,然而纳米材料应用于污染治理的生命周期势必进入环境,其给人类健康和生态环境带来的潜在危害不可忽视[4-6]。研究发现,地表淡水中纳米氧化钛(TiO2-NP)、纳米氧化铈(CeO2-NP)和纳米银(Ag-NP)的浓度高达0.7~16、0.1~1和0.03~0.32 μg·L-1[7],此外,莱茵河荷兰段Ag-NP、纳米钛(Ti-NP)和纳米锌(Zn-NP)的浓度分别为0.005、0.4和1.0 μg·L-1[8]。纳米材料作为新兴污染物逐渐在水体中累积,已对水生生态系统构成威胁。
研究表明,纳米材料可通过静电作用、配位作用等方式吸附于生物细胞表面;同时也可以通过吞噬方式或从细胞壁上的小孔和破损处进入细胞,上述吸附和吞噬作用均可引起一系列的生物毒性效应[3]。微藻作为食物链的初级生产者,对于维持水生态系统平衡具有重要意义[9-11],且其个体小、生长周期短、对毒物较为敏感,被广泛用于评估纳米材料的生态毒性[12-14]。本文在总结国内外纳米材料对微藻生态毒性相关研究的基础上,综述了纳米材料对微藻生态毒性效应的影响因素及致毒机理,并对今后的研究方向进行了展望,以期为纳米材料环境毒理学领域的研究提供参考和借鉴。
1 常见纳米材料对微藻的生态毒性(Ecotoxicity of common nanomaterials to microalgae)
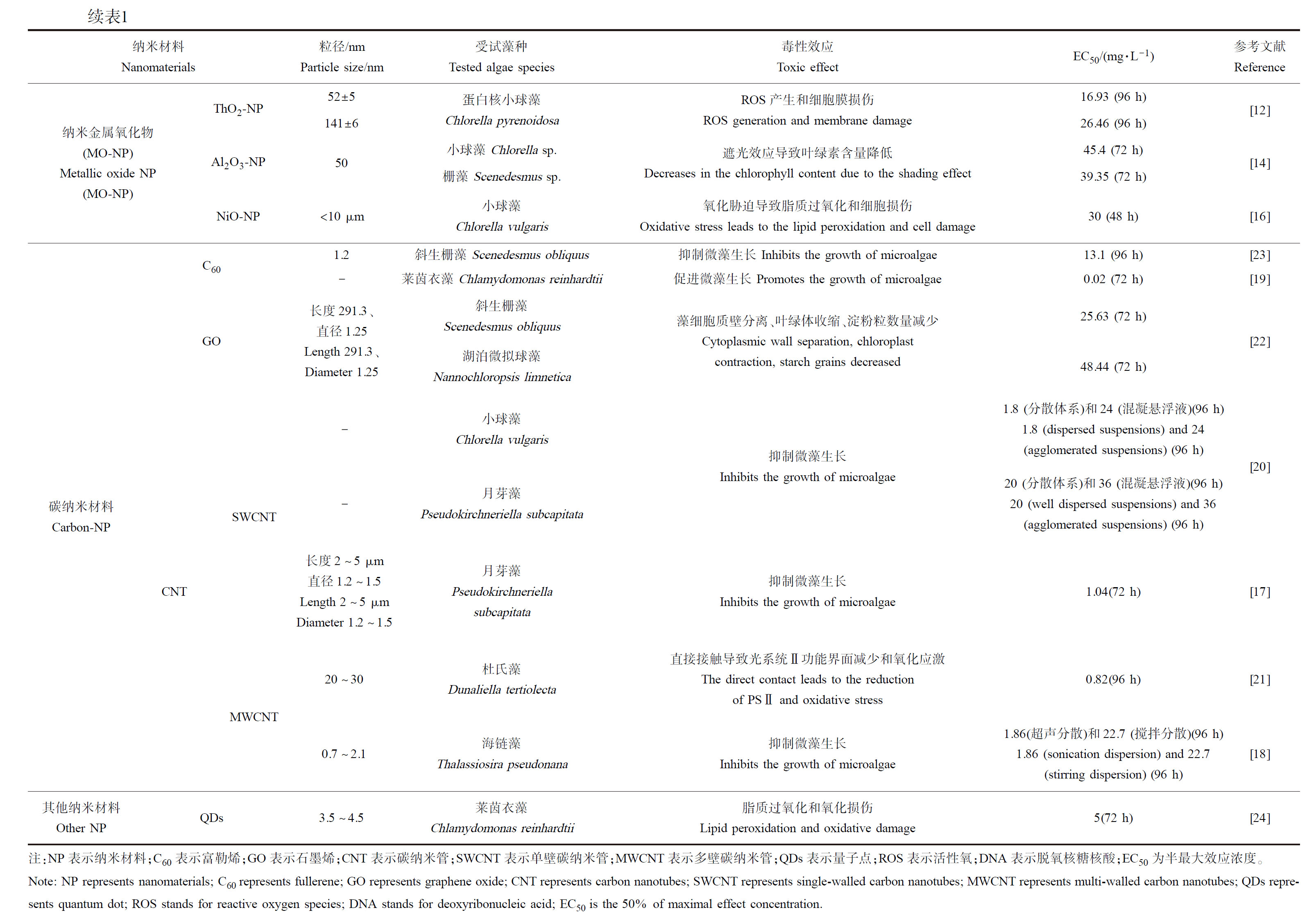
选用微藻作为模型生物评估纳米材料的毒性效应时,可以通过微藻生长状况、叶绿素含量、酶活变化及半最大效应浓度(EC50)等参数进行表征。EC50是药物安全性指标,指引起试验生物产生50%某一特定反应,或抑制某反应一半指标的浓度。目前对微藻生态毒性效应的研究主要包括几种单一纳米材料,如纳米金属(M-NP)[4-6,9]、纳米金属氧化物(MO-NP)[10-16]、碳纳米材料[17-23]及量子点[24]等,不同纳米材料对典型微藻的EC50如表1所示。由表1可知,M-NP、MO-NP和碳纳米材料对微藻的EC50范围分别为0.01~50、1.24~300.59和0.02~36 mg·L-1,其中,Fe-NP对微藻的EC50最高。不同藻种对同一纳米材料表现出的毒性效应不同,如Ag-NP对铜绿微囊藻(Microcystis aeruginosa)的毒性高于小球藻(Chlorella vulgaris)[25],石墨烯纳米复合材料对莱茵衣藻(Chlamydomonas reinhardtii)的生态毒性高于斜生栅藻(Scenedesmus obliquus)[26],ZnO-NP可以显著抑制杜氏藻(Dunaliella tertiolecta)和淡水绿藻(Chlorococcum sp.和Scenedesmus rubescens)的生长,且对杜氏藻的毒性比淡水绿藻更强[27],3种藻在48 h的EC50值分别为1.24、7.99和300.59 mg·L-1,其毒性存在显著差异可能是因为藻细胞结构不同及其应对胁迫环境的特定机制不一[28]。由此可见,不同纳米材料对藻类的生态毒性效应及致毒机理大不相同,因此需对不同纳米材料的毒性机制开展深入研究。

1.1 纳米金属
纳米金属材料因具有界面效应、尺寸效应和隧道效应等独特性质而得到广泛应用,尤其是在国防、化工、催化和医药等领域具有重要的实用价值[1-2]。纳米金属进入水体环境后会对水生生物产生一定毒性,不同纳米金属材料对微藻的生态毒性差异明显[6,9-10,22-24,32]。目前关于纳米金属粒子对微藻的毒性效应研究主要集中于纳米金(Au-NP)、Ag-NP、纳米铜(Cu-NP)以及纳米铁(Fe-NP)等。
Behra等[32]发现Au-NP对莱茵衣藻没有明显的毒性作用,而Iswarya等[5]的研究表明Au-NP对小球藻(Chlorella sp.)的毒性与粒径尺寸有关,即尺寸越小毒性越强。Oukarroum等[29]发现粒径为50 nm的Ag-NP对小球藻和杜氏藻均有抑制效果,具体表现为叶绿素含量下降、活性细胞减少,从而促进体内活性氧(reactive oxygen species, ROS)生成,造成藻细胞的氧化损伤。Qian等[25]比较了Ag-NP对不同藻种的生态毒性,结果表明Ag-NP显著影响微藻生长、光合作用、抗氧化系统及碳水化合物代谢,且对铜绿微囊藻的毒性要高于小球藻。此外,Ag-NP可导致莱茵衣藻腺嘌呤核苷三磷酸和光合作用下降,造成氧化应激损伤,从而抑制微藻的生长[30,33-34]。李芳芳等[6]在考察Cu-NP对中肋骨条藻(Skeletonema costatum)的毒性试验中发现Cu-NP会抑制其生长,且藻密度和叶绿素含量与Cu-NP投加量呈负相关。Nguyen等[35]研究4种含铁复合材料对衣藻(Chlamydomonas sp.)的生态毒性,发现Fe-NP在高浓度(500 mg·L-1)作用2 h后细胞内ROS水平升高,毒性显著增强。
相对而言,纳米金属对蓝藻(铜绿微囊藻)的生态毒性要高于绿藻(小球藻、莱茵衣藻等);不同纳米金属材料中Fe-NP对藻类的毒性较小,浓度达到50 mg·L-1时才会造成藻细胞受损。目前关于纳米金属对藻类生态毒性效应的研究大多只涉及上述几种常见的材料,众多纳米金属对藻类致毒机理分析尚不明确,因此有待进一步探究其他纳米金属对藻类的毒性效应及致毒机理。
1.2 纳米氧化物
纳米粒子及纳米粒子与其他材料之间的相互作用对水体环境中的鱼类、水生植物和微生物等均有不同程度的毒性效应[36]。相比纳米金属,纳米金属氧化物对微藻生态毒性的报道更为常见,主要包括纳米氧化锌(ZnO-NP)、纳米氧化硅(SiO2-NP)、TiO2-NP、纳米氧化铝(Al2O3-NP)、纳米氧化铜(CuO-NP)和CeO2-NP等。
Rodea-Palomares等[37]研究发现CeO2-NP对羊角月芽藻(Pseudokirchneriella subcapitata)24 h的EC50值为0.27~6.3 mg·L-1,且毒性模式是CeO2-NP颗粒包裹藻细胞,破坏其细胞壁和细胞膜。Zhang等[31]比较分析了ZnO-NP和块状ZnO对中肋骨条藻的毒性,96 h时EC50值分别为3.6 mg·L-1和5.5 mg·L-1,说明ZnO-NP的毒性明显大于块状ZnO。寥兴盛等[38]研究了不同浓度TiO2-NP对三角褐指藻(Phaeodactylum tricornutum)的毒性效应,结果表明TiO2-NP对P. tricornutum的毒性效应随着时间的延长而逐渐减弱,推测P. tricornutum对TiO2-NP存在一定的抗性。Hou等[39]考察了不同纳米氧化物对铜绿微囊藻(Microcystis aeruginosa)的生态毒性,结果显示CuO-NP和ZnO-NP可引起藻细胞膜损伤,且CuO-NP和ZnO-NP的毒性明显高于nCeO2。梁长华[16]以小球藻为受试对象研究了NiO-NP的生态毒理,发现NiO-NP对小球藻的生态毒性表现为低浓度刺激效应和高浓度抑制效应。朱小山等[40]发现纳米金属氧化物对斜生栅藻的毒性大小顺序为:ZnO-NP>TiO2-NP>Al2O3-NP;而对月牙藻的毒性大小顺序为:ZnO-NP>CuO-NP>TiO2-NP,且CuO-NP对微藻的毒性作用与释放的Cu2+有关[41]。
在纳米金属氧化物中,不同纳米金属氧化物对微藻的毒性效应不同,ZnO-NP和CuO-NP的毒性较强,TiO2-NP的毒性次之,而Al2O3-NP的毒性较弱;且由于纳米材料对不同微藻的毒性强度不同,可能导致不同微藻对纳米材料的耐受能力不同。
1.3 碳纳米材料
碳纳米材料(包括富勒烯、碳纳米管、石墨烯及其复合材料等)因具有质量小、强度大、导电性强和吸附性好等特点,被广泛应用于电子电气、生物制药、化工涂料和环境修复等领域,其在环境中的潜在生态风险逐渐引起了研究人员的重视,尤其对水生生物的毒性效应备受关注。
富勒烯是一种呈球型、椭球型、柱型或管状且完全由碳组成的中空石墨球,其中因C60价格低廉和易于提纯,被称为富勒烯。研究发现,C60颗粒在水体中溶解度较低,但水体中的C60及其衍生物对底栖生物有一定的毒性效应,同时其对微藻的毒性研究也逐渐得到重视[42]。于叶[42]采用搅拌法制备获得nC60悬浊液并比较分析了其对斜生栅藻、小球藻和铜绿微囊藻的生态毒性效应,结果表明,nC60对3种微藻的毒性效应不同,其对小球藻有促进作用,对斜生栅藻和铜绿微囊藻则有抑制作用,且对斜生栅藻的抑制作用随nC60浓度的增加而加大;Lang等[19]则发现C60浓度为20 μg·L-1时可以促进莱茵衣藻生长。以上研究表明,nC60对微藻的毒性不仅与藻种类别有关,还与nC60的浓度有关,总体趋势是nC60浓度越高,毒性越大。
碳纳米管是由碳原子形成石墨烯片层卷成的管体,可根据石墨烯片层数分为单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs),其对微藻的毒性研究亦有报道。Blaise等[17]发现SWCNTs对月芽藻(Pseudokirchneriella subcapitata)72 h的EC50为1.04 mg·L-1;Schwab等[20]比较了SWCNTs对小球藻和月芽藻在分散体系及混凝悬浮液中的致毒作用,发现小球藻在不同体系中96 h的EC50分别为1.8 mg·L-1和24 mg·L-1,而月芽藻的EC50分别为20 mg·L-1和36 mg·L-1,表明在相同暴露条件下SWCNTs对小球藻的生态毒性要高于月芽藻,且在不同的暴露条件下月芽藻对SWCNTs敏感程度不同。另有研究表明,MWCNTs对杜氏藻96 h的EC50值为0.82 mg·L-1[21],而朱小山等[23]发现SWCNTs和MWCNTs这2种碳纳米材料悬浮液对斜生栅藻96 h的EC50值分别为22.6 mg·L-1和15.5 mg·L-1。综上,碳纳米管对小球藻的毒性高于月球藻,而MWCNTs对绿藻的毒性高于SWCNTs。
石墨烯(GO)是由碳原子紧密堆积而成且具有抗菌活性的新型二维碳纳米材料。研究表明,GO表面的羟基、羰基和羧基等含氧官能团对微藻有显著抑制作用,Wahid等[43]发现GO能有效降低藻细胞的分裂速率,Nogueira等[44]研究结果显示GO对月芽藻96 h的EC50值为20 μg·L-1,而GO对蛋白核小球藻96 h的EC50值为37.3 mg·L-1[45]。Yin等[26]发现莱茵衣藻对石墨烯纳米复合材料的敏感性高于斜生栅藻,其原因是莱茵衣藻细胞表面具有丰富的疏水性成分,可吸附更多的金属离子从而引起藻细胞氧化应激和膜损伤。相比碳纳米管和富勒烯而言,GO毒性更高,其致毒机理原因可能是GO导致藻细胞膜损伤并生成ROS;此外,遮光效应也可能降低藻密度。
1.4 量子点
量子点(QDs)为半导体纳米材料,其在水体环境中的迁移及与浮游植物相互作用的研究尚不多见[46]。Zhang等[46]发现CdSe量子点对海链藻(Thalassiosira pseudonana)产生毒性;Morelli等[47]发现QDs在1~2.5 nmol·L-1浓度范围内可抑制三角褐指藻的生长;相反QDs在0.5~2.0 nmol·L-1范围内对杜氏藻的生长有促进作用。Wang等[24]研究了TiO2-NP和QDs对莱茵衣藻的毒性,发现QDs对C. reinhardtii的毒性约是TiO2-NP毒性的10倍。Lin等[48]发现水溶性CdSe/ZnS QDs对C. reinhardtii亲和力较强,大量QDs吸附在藻细胞的表面阻碍了微藻的光合活性。目前关于QDs对微藻的生态毒性效应研究较少,毒性机制尚不清楚,有待深入探索。
2 纳米材料与其他物质对微藻的联合毒性(Combined toxicity of nanomaterials and other substances to microalgae)
纳米材料的数量和种类随着科技的发展日益增多,其在生命周期过程中必将进入水体和土壤环境中,并与有机物和无机物等发生物理化学或生物反应(图1)[49]。研究单一纳米材料在环境中的毒性存在局限性,联合毒性效应可以更准确、真实地反映纳米材料与其他物质的生态毒性。世界卫生组织将联合毒性效应分为相加作用、协同作用、拮抗作用和独立作用4种,目前联合毒性效应被广泛应用于毒理学研究。简要总结了纳米材料与有机物、重金属及纳米复合材料对藻类的毒理效应。
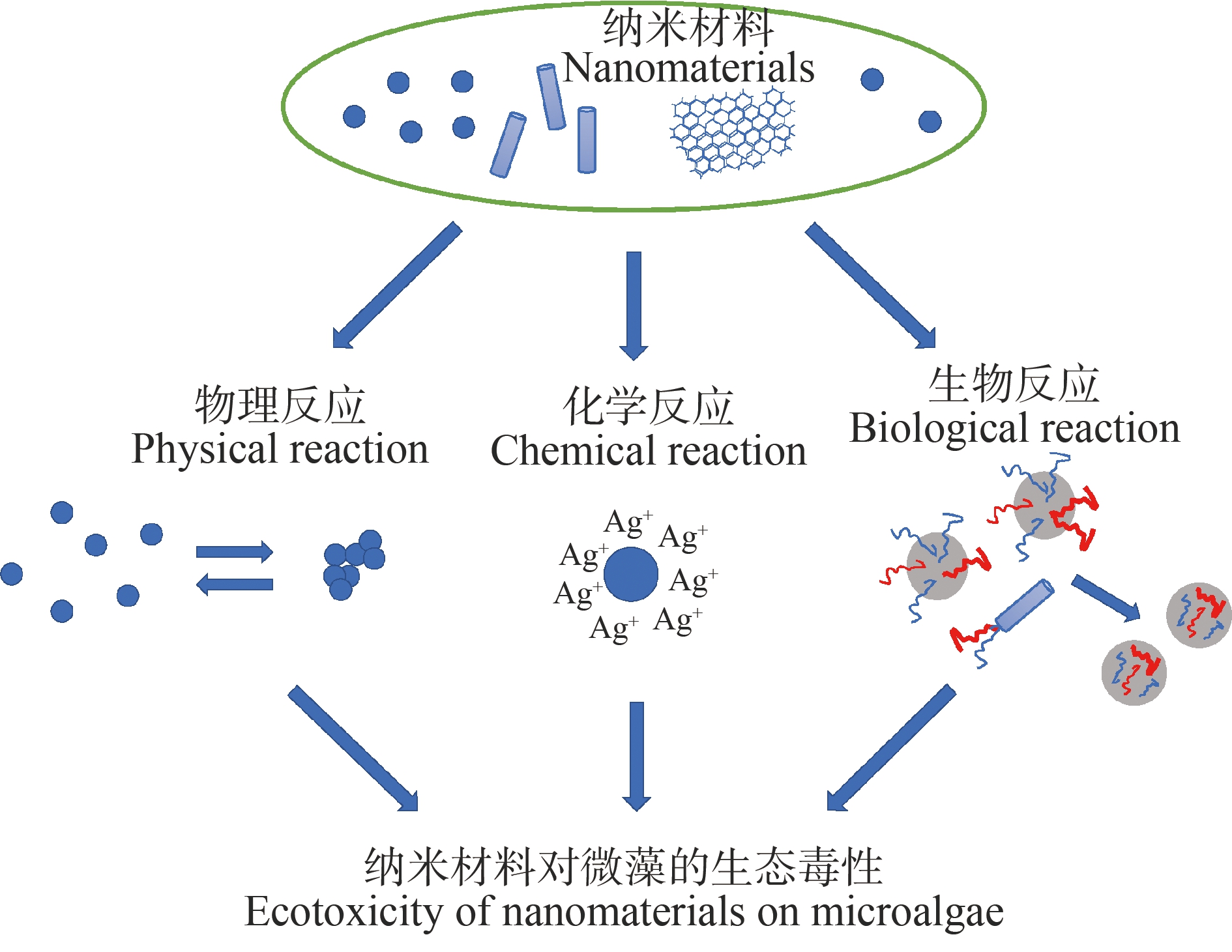
图1 纳米材料与环境中的物质发生反应[49]
Fig. 1 Nanomaterials react with substances in the environment[49]
2.1 纳米材料与有机物
在水体环境中,有机污染物、天然有机质(natural organic matters, NOM)及腐殖酸(humic acids, HA)等与纳米材料相互作用导致纳米材料的分散状态和迁移转化规律发生变化,从而改变纳米材料对微藻的毒性效应[50]。Wang等[51]发现CeO2-NP和TiO2-NP协同氟苯尼考(FLO)可以增强纳米材料的毒性,且CeO2-NP和FLO的联合毒性显著高于TiO2-NP或FLO。Baun等[52]发现C60聚集体存在时,芳香族化合物(菲)对月芽藻的毒性提高了60%,而五氯苯酚与C60的拮抗作用使得其对月芽藻的毒性降低了65.5%。也有研究表明,有机物会降低纳米材料的毒性,Gunasekaran等[53]研究低浓度的ZnO-NP(1 mg·L-1)与微塑料聚苯乙烯(PS)对杜氏藻的联合毒性,发现在PS存在条件下ZnO-NP颗粒对杜氏藻的毒性显著降低。Hall等[54]发现高岭土和低浓度有机碳(1.5 mg·L-1)均会削弱TiO2-NP对月芽藻的毒性,可能是由于高岭土或有机碳与TiO2-NP的拮抗作用所致。
相比于有机污染物而言,NOM和HA更易吸附在纳米材料表面,从而增强纳米材料在水体中的稳定性。Xie等[55]发现NOM使C60晶体在水体中发生解体和聚集,导致C60颗粒大小和形状发生显著变化,进而削弱了C60对微藻的生态毒性。NOM与MWCNTs结合48 h后,MWCNTs对硅藻的生态毒性明显降低,藻细胞分裂速度加快[56]。同样,HA与纳米材料共存时亦可削减纳米材料的生态毒性[57],透射扫描电镜(TEM)结果表明HA通过增加静电斥力阻碍了藻细胞对ZnO-NP的吸附;HA还可降低ZnO-NP和TiO2-NP对月芽藻的抑制作用[58],尤其是当HA和TiO2-NP共存时能显著缓解TiO2-NP对小球藻的毒性[59]。因此,FLO、芳香族化合物等有机污染物可以增加纳米材料对藻类的生物毒性,而五氯苯酚、微塑料、HA和NOM等与碳纳米材料会产生拮抗作用,削减了碳纳米材料对微藻的生态毒性。
2.2 纳米材料与重金属离子
纳米材料进入水体中可与重金属离子结合形成复合污染物,其与重金属离子的联合毒性有2种表现,一是重金属离子的毒性覆盖纳米材料毒性,二是纳米材料使得重金属离子毒性增强或减弱。深入研究纳米材料与重金属离子对微藻的联合毒性效应有助于揭示纳米材料的致毒机制。Tang等[60]研究了GO和Cd2+对铜绿微囊藻的联合毒性,发现低浓度的GO对铜绿微囊藻没有明显毒性,但GO显著增强了Cd2+的毒性,使得Cd2+对铜绿微囊藻96 h的EC50值由(0.51±0.01) mg·L-1降至(0.474±0.01) mg·L-1;SiO2-NP协助中肋骨条藻吸附Hg2+进入其内部并累积,导致藻细胞内部的Hg2+浓度增加从而抑制了藻细胞生长[61]。与之相反,TiO2-NP会吸附Cd2+导致水体中游离态Cd2+浓度降低,从而降低Cd2+对铜绿微囊藻的毒性[62];TiO2-NP还可吸附Cu2+导致二者之间产生拮抗效应,从而显著削弱Cu2+对铜绿微囊藻的毒性效应[63]。GO与Cu2+之间也有明显的拮抗作用,GO在低浓度(1 mg·L-1)时能降低Cu2+对斜生栅藻的生态毒性[64]。此外,不同纳米金属氧化物材料对Cr6+的毒性效应影响不同,如TiO2-NP能降低Cr6+对斜生栅藻的毒性,但Al2O3-NP并不影响Cr6+对斜生栅藻毒性[65]。由此可见,纳米材料与不同重金属离子形成的复合污染物对微藻的毒性效应有所差异。
2.3 纳米复合材料
纳米复合材料是2种或2种以上的固相材料复合而成,其分散性、稳定性、表面活性及与其他物质的相容性均发生了变化,可间接影响纳米材料对微藻的毒性。Saison等[66]考察了核壳式CuO-NP的毒性作用,发现其对莱茵衣藻的毒性比常规CuO-NP更高。聚乙烯吡咯烷酮(PVP)/聚乙烯亚胺包覆Ag-NP形成的复合材料可促进Ag+释放,且对海洋微藻的毒性显著增强[67],纳米零价铁(NZVI)改性后形成的复合材料对藻类的生态毒性亦会显著增强,如氢氧化镁包覆NZVI形成的新型核壳结构纳米粒子对铜绿微囊藻的生态毒性显著高于NZVI[68],采用高浓度的硫化硅改性NZVI后形成的化合物FeSSi导致莱茵衣藻生长滞后且藻细胞数量减少[69]。另有研究表明,纳米复合材料对藻类的生态毒性低于纳米材料本身。如碳基纳米铜复合材料对小球藻有胁迫作用,但毒性低于Cu-NP [70];PVP与三聚磷酸钠合成的Ag-NP复合材料限制了Ag+的还原,同时降低了Ag-NP对小球藻和斜生栅藻的毒性[71];Ag-NP与草本植物叶提取物反应生成的复合银纳米粒子(AR-Ag NPs)具有高稳定性且对小球藻的毒性低于Ag-NP [72]。由此可见,纳米复合材料通过表面包覆作用增加了空间位阻和分散性,致使大多数纳米复合材料对微藻的毒性明显高于单一的纳米材料,但纳米复合材料的高稳定性亦可降低纳米材料的生态毒性。
3 纳米材料毒性效应影响因素(Influencing factors for the toxic effects of nanomaterials)
纳米材料对微藻的生长状况、叶绿素含量、蛋白质含量以及酶活等均产生一定的影响,其毒性效应与纳米材料的形态、尺寸、浓度、化学组成等相关,此外,还取决于水体环境因素(如pH、溶解性有机质等)及受试藻种的细胞结构和生理生化特性。
3.1 颗粒尺寸
颗粒尺寸是影响纳米材料对微藻生态毒性的关键因素之一。纳米颗粒尺寸越小,其比表面积较大,更容易穿透藻细胞壁或吸附到藻细胞表面并与之结合,从而生态毒性越强。Hartmann等[73]研究发现,相比于30 nm和300 nm的TiO2-NP,粒径为10 nm的TiO2-NP对月芽藻表现出更强的抑制作用;同样,Ag-NP对月芽藻的毒性与粒径大小成反比,即粒径越小其毒性越强[74];此外,NZVI粒径越小,其对小球藻的生长抑制作用越强[75]。另有学者的研究结果却不尽相同,如球形ZnO-NP对月芽藻的生态毒性与粒径大小无关,而棒状ZnO-NP对月芽藻的毒性随着尺寸的增加而降低[76];不同长度的纳米银线对莱茵衣藻的毒性差异显著[77],长度越大Ag-NP毒性越高,其原因可能是Ag-NP的晶型不同导致毒性机制差异较大。此外,不同粒径CeO2-NP(14、20和29 nm)对月芽藻的毒性效应显示,CeO2-NP对月芽藻的抑制效果与纳米材料粒径呈正相关[78],其原因可能与NPs对微藻细胞的聚集作用有关。因此,纳米材料的物化性质、形状和聚集程度等均会对微藻产生不同的毒性效应。
3.2 颗粒浓度
诸多研究表明纳米材料对微藻的生态毒性存在剂量-效应关系。Roy等[28]发现TiO2-NP(平均粒径为25 nm)在0.01~1.0 mg·L-1浓度范围内对小球藻和斜生栅藻均有毒性,且毒性随着纳米材料浓度的增加而增强;ZnO-NP和TiO2-NP对斜生栅藻毒性效果的研究表明,纳米材料浓度低于5 mg·L-1时均有显著促进作用,而高浓度(ZnO-NP为50 mg·L-1,TiO2-NP为200 mg·L-1)时2种藻的生长受到明显抑制[79],然而TiO2-NP浓度<12.5 mg·L-1时对近具棘链带藻(Desmodesmus subspicatus)的生长无明显影响[15]。Manier等[80]研究发现,CeO2-NP对月芽藻的毒性效应与纳米材料的浓度呈正比,当CeO2-NP浓度为25 mg·L-1时抑制效果高达93.91%;MWCNTs在低于0.5 mg·L-1时会刺激铜绿微囊藻的生长,而高于50 mg·L-1则会抑制微囊藻的生长[81];SiO2-NP浓度低于25 mg·L-1时对斜生栅藻生长促进作用不明显,而高于50 mg·L-1时藻类生长受到抑制[82]。由此可见,纳米粒子浓度越大,其对藻类的毒性越大,多数纳米材料浓度高于50 mg·L-1时对藻类抑制效果明显。
3.3 化学组成
纳米材料对微藻的毒性不仅受颗粒尺寸和浓度的影响,还与其化学组成相关,如M-NP和MO-NP对微藻的生态毒性可能与溶解释放的金属离子有关。研究发现,CeO2-NP对莱茵衣藻的毒性效应主要是由于其溶解的Ce3+所致[83];Ag-NP溶解释放的Ag+可以显著抑制月牙藻生长[84],纳米材料和微藻的作用时间越长,金属离子释放的浓度越高,微藻生长抑制现象越显著。此外,相同尺度的不同纳米材料毒性强弱不一。ZnO-NP主要通过持续释放金属离子对微藻表现出生态毒性作用,而同等粒径的SiO2-NP和TiO2-NP则通过渗透或吸附在藻细胞表面并破坏藻细胞壁而产生毒性,上述3种MO-NP对杜氏藻的毒性大小顺序为:TiO2-NP>SiO2-NP>ZnO-NP [85]。
3.4 环境因素
纳米材料进入水环境中其存在形式与水体中pH、盐离子强度等无机因素有关,且不同环境因素下纳米材料与有机物的相互作用不一,因此,环境因素最终影响纳米材料对微藻的生态毒性。van Hoecke等[82]发现采用氧化铝涂层的SiO2-NP在低浓度时(<46 mg·L-1)对杜氏藻的毒性效应不明显,而SiO2-NP浓度较高且pH为6.0~6.8时毒性较强;TiO2-NP(5 mg·L-1)在pH为6.0时对铜绿微囊藻毒性作用最强,该情况下藻类光合活性最低,ROS产量最高[86];此外,中性条件下胞外聚合物可以提高Cu-NP的溶解性和稳定性,溶液pH为7时Cu2+含量最高,其对藻类的毒性作用最大[87]。除此之外,溶液中盐离子强度也会影响纳米材料的毒性,如磷酸盐会减小CeO2-NP颗粒的平均粒径并提高Ce3+的释放强度,导致其对莱茵衣藻的毒性增大[83],而NaCl则可削弱TiO2-NP对杜氏藻的毒性,NaCl浓度越高时TiO2-NP毒性作用越弱[88]。综上,溶液pH为中性时纳米材料毒性较大,盐离子存在时纳米材料对藻类的毒性作用不一,主要是由于盐离子浓度导致溶液表面电荷发生变化,进而影响纳米颗粒的聚集和团聚作用。
4 纳米材料对微藻的致毒机理(Toxic mechanisms of nanomaterials on microalgae)
基于纳米材料的特殊结构和性能,不同纳米材料对微藻的毒性机理差异较大。现有研究提出的纳米材料对微藻的致毒机理主要包括金属离子释放、氧化损伤、团聚效应和遮光作用等(图2)[89-90]。

图2 纳米材料的致毒机理[89-90]
注:ROS表示活性氧。
Fig. 2 Toxic mechanism of nanomaterials[89-90]
Note: ROS stands for reactive oxygen species.
4.1 离子释放
众多学者认为纳米金属及其氧化物对微藻的生态毒性主要是由于其释放于水体中的金属离子所致。Franklin等[91]将ZnO-NP对月芽藻的生态毒性归因于溶解释放的Zn2+,Zn2+主要是对藻细胞胁迫产生ROS而使微藻生长受到抑制;ZnO-NP和CuO-NP可直接释放离子引起铜绿微囊藻藻细胞中毒,Al2O3-NP对小球藻的毒性作用是由于Al3+溶解后与藻细胞相互作用引起藻细胞表面官能团发生改变,从而导致藻细胞损伤和氧化应激[92];同理,Ag-NP溶出的Ag+对海链藻有较强的抑制作用,且抑制效果与Ag+的浓度成正比[93]。花文凤等[94]考察了16种纳米金属氧化物对羊角月芽藻(Selenastrum capricornutum)的毒性效应,认为光照强度和溶出金属离子浓度是纳米材料对月芽藻毒性产生的主要原因。另有研究表明,金属离子对微藻的毒性作用并不明显,如ZnO-NP对鱼腥藻的毒性效果与溶解态Zn2+浓度无关[57],CeO2-NP在水体中几乎不释放离子,仅与藻细胞直接接触时才产生毒性作用[39]。综上,不同纳米金属材料对微藻毒性机理不一样,可通过释放金属离子或自身与藻细胞接触而产生毒性效应。
4.2 氧化损伤
微藻为了保护自身抵御氧化损伤而产生氧化应激反应,其是由丙二醛含量(MDA)、超氧化歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等一系列抗氧化酶组成的保护系统。当纳米材料对微藻产生胁迫作用时,微藻体内酶活会增强抵御氧化损伤,随着纳米材料毒性不断增强,最终显著抑制酶活性,而氧化损伤是目前比较认可的一种致毒机制。Qian等[25]研究了Ag-NP对铜绿微囊藻和小球藻的毒性机理,发现2种藻在Ag-NP胁迫96 h后MDA、CAT和ROS均有所增加,小球藻在TiO2-NP胁迫下时ROS增加但SOD降低[28];CuO-NP对其他藻类的胁迫作用研究也有报道,铜绿微囊藻暴露于CuO-NP 48 h后藻细胞内ROS水平上升20%,72 h后出现明显的DNA损伤,最终藻细胞膜破裂[10];莱茵衣藻暴露于CuO-NP和聚合物涂层CuO-NP 6 h后,藻细胞产生ROS且光系统Ⅱ受到抑制[95];小球藻受二氧化钍纳米颗粒(ThO2-NP)胁迫导致ROS产生和藻细胞膜损伤[12]。此外,Zhang等[31]结合TEM阐明了ZnO-NP对中肋骨条藻的毒性机制,ZnO-NP直接进入藻细胞引起藻细胞MDA和ROS增加,进一步导致藻细胞中毒死亡。纳米材料可对藻类产生胁迫导致ROS上升,研究还发现在纳米材料和腐殖酸的联合毒性导致小球藻的MDA和ROS均有所增加[59]。综上,微藻在纳米材料胁迫下发生氧化损伤时,MDA、CAT和ROS等会增加,但SOD会降低。
4.3 团聚效应
纳米材料由于尺寸微小会与微藻发生团聚作用,致使微藻形成自团聚和机械损伤,或纳米材料团聚吸附在藻细胞表面而导致藻细胞壁和细胞膜受损。研究表明,ZnO-NP对淡水小球藻和海洋硅藻的生态毒性均是由于团聚效应所致,纳米材料的聚集作用改变了ZnO-NP的表面积从而使小球藻和硅藻发生团聚效应[96];同理,CeO2-NP对月芽藻的生态毒性是纳米材料的聚集作用[78],MgO-NP与斜生栅藻直接发生团聚效应导致藻细胞质壁分离,进一步引起藻细胞死亡[97]。团聚效应主要是纳米材料在藻细胞表面聚集而改变藻细胞的渗透压引起细胞死亡,部分纳米材料可导致藻类发生团聚效应,但目前仅有纳米氧化物对藻类团聚效应机理的报道,其他纳米材料对藻类的团聚效应还有待深入研究。
4.4 遮光作用
纳米材料吸附于藻细胞表面或与藻细胞发生团聚效应可导致藻类光合作用减弱,从而直接或间接地抑制微藻生长。研究发现,绿藻(小球藻和月芽藻)的生长情况均与碳纳米管的阴影强弱及藻细胞的聚集程度相关,碳纳米管聚集使得绿藻光合作用减弱从而生长受到抑制[20];TEM结果显示SiO2-NP颗粒吸附在月芽藻细胞壁上产生遮光效应从而削弱了藻细胞的光合作用能力[98]。除此之外,离子浓度及多糖类物质等因素可以加速纳米材料的聚集或吸附效果,进而通过遮光作用抑制藻类生长。如海水在碱性条件下可加速NiO-NP对小球藻的聚集效果并通过遮光作用抑制了藻细胞的生长[99];羧基与多糖或糖蛋白的胺基相互作用导致水溶性CdSe/ZnS量子点吸附于莱茵衣藻细胞表面,从而削弱了藻类的光合活性。另有研究表明,纳米材料对藻细胞的遮光作用并非其主要致毒机理,虽然遮光效应存在,但碳纳米管对海链藻的生长抑制效果并不明显[18]。综上,纳米材料对藻类的遮光效应主要是通过吸附作用和聚集作用完成,当纳米材料仅对藻类有遮光作用时,生态毒性较弱。
5 结论与展望(Conclusion and prospect)
随着纳米材料在各个领域的广泛应用,大量纳米材料经迁移、转化后残存于环境中,其对生态环境的影响备受关注,尤其是纳米材料的生态毒性及其致毒机理。不同纳米材料对微藻的毒性与纳米材料的物化性质、形状、粒径及浓度等有关,致毒机理为离子释放、氧化损伤、团聚效应、遮光效应或通过上述效应的联合作用。目前,关于纳米材料对微藻的致毒机理研究已取得初步进展,但在未来仍有以下内容亟待开展:
(1)大量纳米材料进入水体后严重威胁水生态健康,然而国内外尚无纳米材料生态毒性的评估标准。因此,基于微藻生态毒理学研究制定纳米材料毒性评估标准迫在眉睫。
(2)纳米材料的毒性取决于其理化性质、环境因素及水体中可溶性物质种类和浓度,探究多种纳米材料及纳米材料与可溶性物质的联合生态毒性将是微藻生态毒理学的重点研究内容。
(3)纳米材料对微藻生态毒性的研究大多集中于淡水绿藻(小球藻、栅藻)、蓝藻(铜绿微囊藻)及海洋硅藻(海链藻、中肋骨条藻)等几类,对鱼腥藻、束丝藻和颤藻等典型水华蓝藻的生态效应和毒性机理等研究亟待开展;此外,纳米材料胁迫条件下微藻分子水平上的蛋白质组学及基因组学调控机制鲜有报道,因此,未来可采用分子生物学技术进一步揭示纳米材料对微藻的毒性机制。
[1] Khin M M, Nair A S, Babu V J, et al. A review on nanomaterials for environmental remediation [J]. Energy & Environmental Science, 2012, 5(8): 8075-8109
[2] Madima N, Mishra S B, Inamuddin I, et al. Carbon-based nanomaterials for remediation of organic and inorganic pollutants from wastewater [J]. Environmental Chemistry Letters, 2020, 18(4): 1169-1191
[3] Xue L L, Lu B Z, Wu Z S, et al. Synthesis of mesoporous hexagonal boron nitride fibers with high surface area for efficient removal of organic pollutants [J]. Chemical Engineering Journal, 2014, 243: 494-499
[4] Burchardt A D, Carvalho R N, Valente A, et al. Effects of silver nanoparticles in diatom Thalassiosira pseudonana and cyanobacterium Synechococcus sp. [J]. Environmental Science & Technology, 2012, 46(20): 11336-11344
[5] Iswarya V, Manivannan J, De A, et al. Surface capping and size-dependent toxicity of gold nanoparticles on different trophic levels [J]. Environmental Science and Pollution Research, 2016, 23(5): 4844-4858
[6] 李芳芳, 潘容, 张偲, 等. 纳米铜粉对中肋骨条藻的毒性效应[J]. 中国环境科学, 2015, 35(9): 2874-2880
Li F F, Pan R, Zhang C, et al. Inhibition effects of copper nanoparticles on the growth of Skeletonema costatum [J]. China Environmental Science, 2015, 35(9): 2874-2880 (in Chinese)
[7] 丛艺, 穆景利, 王菊英. 纳米材料在水环境中的行为及其对水生生物的毒性效应[J]. 海洋湖沼通报, 2014(3): 112-120
Cong Y, Mu J L, Wang J Y. Behavior and toxicity of nanomaterials in aquatic environment [J]. Transactions of Oceanology and Limnology, 2014(3): 112-120 (in Chinese)
[8] Markus A A, Parsons J R, Roex E W M, et al. Predicting the contribution of nanoparticles (Zn, Ti, Ag) to the annual metal load in the Dutch reaches of the Rhine and Meuse [J]. Science of the Total Environment, 2013, 456-457: 154-160
[9] Marsalek B, Jancula D, Marsalkova E, et al. Multimodal action and selective toxicity of zerovalent iron nanoparticles against cyanobacteria [J]. Environmental Science & Technology, 2012, 46(4): 2316-2323
[10] Wang Z Y, Li J, Zhao J, et al. Toxicity and internalization of CuO nanoparticles to prokaryotic alga Microcystis aeruginosa as affected by dissolved organic matter [J]. Environmental Science & Technology, 2011, 45(14): 6032-6040
[11] 汪苹, 孙志强, 王宇涛, 等. 纳米ZnO对微藻的毒性效应和生物富集的研究[J]. 环境科学与技术, 2018, 41(12): 13-19
Wang P, Sun Z Q, Wang Y T, et al. Toxicity and bioaccumulation of zinc oxide nanoparticles by microalgaes [J]. Environmental Science & Technology, 2018, 41(12): 13-19 (in Chinese)
[12] He X X, Xie C J, Ma Y H, et al. Size-dependent toxicity of ThO2 nanoparticles to green algae Chlorella pyrenoidosa [J]. Aquatic Toxicology, 2019, 209: 113-120
[13] Li F M, Liang Z, Zheng X, et al. Toxicity of nano-TiO2 on algae and the site of reactive oxygen species production [J]. Aquatic Toxicology, 2015, 158: 1-13
[14] Sadiq I M, Pakrashi S, Chandrasekaran N, et al. Studies on toxicity of aluminum oxide (Al2O3) nanoparticles to microalgae species: Scenedesmus sp. [J]. Journal of Nanoparticle Research, 2011, 13(8): 3287-3299
[15] Hund-Rinke K, Simon M. Ecotoxic effect of photocatalytic active nanoparticles (TiO2) on algae and daphnids [J]. Environmental Science and Pollution Research International, 2006, 13(4): 225-232
[16] 梁长华. 纳米NiO对小球藻的生物毒性及致毒机制研究[D]. 大连: 大连海事大学, 2010: 27
Liang C H. Research on biotoxicity and toxic mechanism of NiO nanoparticles on Chlorella vulgaris [D]. Dalian: Dalian Maritime University, 2010: 27 (in Chinese)
[17] Blaise C, Gagné F, Férard J F, et al. Ecotoxicity of selected nano-materials to aquatic organisms [J]. Environmental Toxicology, 2008, 23(5): 591-598
[18] Kwok K W H, Leung K M Y, Flahaut E, et al. Chronic toxicity of double-walled carbon nanotubes to three marine organisms: Influence of different dispersion methods [J]. Nanomedicine, 2010, 5(6): 951-961
[19] Lang J, Melnykova M, Catania M, et al. A water-soluble[60]fullerene-derivative stimulates chlorophyll accumulation and has no toxic effect on Chlamydomonas reinhardtii [J]. Acta Biochimica Polonica, 2019, 66(3): 257-262
[20] Schwab F, Bucheli T D, Lukhele L P, et al. Are carbon nanotube effects on green algae caused by shading and agglomeration?[J]. Environmental Science & Technology, 2011, 45(14): 6136-6144
[21] Wei L P, Thakkar M, Chen Y H, et al. Cytotoxicity effects of water dispersible oxidized multiwalled carbon nanotubes on marine alga, Dunaliella tertiolecta [J]. Aquatic Toxicology, 2010, 100(2): 194-201
[22] 彭晓玲, 孟范平, 张倩, 等. 氧化石墨烯对淡水微藻生长及生物活性物质的影响[J]. 中国环境科学, 2019, 39(11): 4849-4857
Peng X L, Meng F P, Zhang Q, et al. Effects of graphene oxide on the growth and bioactive compounds in freshwater microalgae [J]. China Environmental Science, 2019, 39(11): 4849-4857 (in Chinese)
[23] 朱小山, 朱琳, 田胜艳, 等. 三种碳纳米材料对水生生物的毒性效应[J]. 中国环境科学, 2008, 28(3): 269-273
Zhu X S, Zhu L, Tian S Y, et al. Toxicity effect of three kinds of carbon nanomaterials on aquatic organisms [J]. China Environmental Science, 2008, 28(3): 269-273 (in Chinese)
[24] Wang J X, Zhang X Z, Chen Y S, et al. Toxicity assessment of manufactured nanomaterials using the unicellular green alga Chlamydomonas reinhardtii [J]. Chemosphere, 2008, 73(7): 1121-1128
[25] Qian H F, Zhu K, Lu H P, et al. Contrasting silver nanoparticle toxicity and detoxification strategies in Microcystis aeruginosa and Chlorella vulgaris: New insights from proteomic and physiological analyses [J]. Science of the Total Environment, 2016, 572: 1213-1221
[26] Yin J Y, Dong Z M, Liu Y Y, et al. Toxicity of reduced graphene oxide modified by metals in microalgae: Effect of the surface properties of algal cells and nanomaterials [J]. Carbon, 2020, 169: 182-192
[27] Aravantinou A F, Tsarpali V, Dailianis S, et al. Effect of cultivation media on the toxicity of ZnO nanoparticles to freshwater and marine microalgae [J]. Ecotoxicology and Environmental Safety, 2015, 114: 109-116
[28] Roy R, Parashar A, Bhuvaneshwari M, et al. Differential effects of P25 TiO2 nanoparticles on freshwater green microalgae: Chlorella and Scenedesmus species [J]. Aquatic Toxicology, 2016, 176: 161-171
[29] Oukarroum A, Bras S, Perreault F, et al. Inhibitory effects of silver nanoparticles in two green algae, Chlorella vulgaris and Dunaliella tertiolecta [J]. Ecotoxicology and Environmental Safety, 2012, 78: 80-85
[30] Zhao Z L, Xu L M, Wang Y, et al. Toxicity mechanism of silver nanoparticles to Chlamydomonas reinhardtii: Photosynthesis, oxidative stress, membrane permeability, and ultrastructure analysis [J]. Environmental Science and Pollution Research International, 2021, 28(12): 15032-15042
[31] Zhang C, Wang J T, Tan L J, et al. Toxic effects of nano-ZnO on marine microalgae Skeletonema costatum: Attention to the accumulation of intracellular Zn [J]. Aquatic Toxicology, 2016, 178: 158-164
[32] Behra R, Wagner B, Sgier L, et al. Colloidal stability and toxicity of gold nanoparticles and gold chloride on Chlamydomonas reinhardtii [J]. Aquatic Geochemistry, 2015, 21(2): 331-342
[33] Navarro E, Piccapietra F, Wagner B, et al. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii [J]. Environmental Science & Technology, 2008, 42(23): 8959-8964
[34] Pillai S, Behra R, Nestler H, et al. Linking toxicity and adaptive responses across the transcriptome, proteome, and phenotype of Chlamydomonas reinhardtii exposed to silver [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(9): 3490-3495
[35] Nguyen N H A, von Moos N R, Slaveykova V I, et al. Biological effects of four iron-containing nanoremediation materials on the green alga Chlamydomonas sp. [J]. Ecotoxicology and Environmental Safety, 2018, 154: 36-44
[36] Velzeboer I, Hendriks A J, Ragas A M J, et al. Aquatic ecotoxicity tests of some nanomaterials [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1942-1947
[37] Rodea-Palomares I, Boltes K, Fernández-Pi as F, et al. Physicochemical characterization and ecotoxicological assessment of CeO2 nanoparticles using two aquatic microorganisms [J]. Toxicological Sciences, 2010, 119(1): 135-145
as F, et al. Physicochemical characterization and ecotoxicological assessment of CeO2 nanoparticles using two aquatic microorganisms [J]. Toxicological Sciences, 2010, 119(1): 135-145
[38] 廖兴盛, 王一翔, 陈佐泓, 等. 纳米二氧化钛(nTiO2)对三角褐指藻(Phaeodactylum tricornutum)光合系统的影响[J]. 生态环境学报, 2020, 29(4): 778-785
Liao X S, Wang Y X, Chen Z H, et al. Effects of nano-titanium dioxide on photosystem of Phaeodactylum tricornutum [J]. Ecology and Environmental Sciences, 2020, 29(4): 778-785 (in Chinese)
[39] Hou J, Yang Y Y, Wang P F, et al. Effects of CeO2, CuO, and ZnO nanoparticles on physiological features of Microcystis aeruginosa and the production and composition of extracellular polymeric substances [J]. Environmental Science and Pollution Research International, 2017, 24(1): 226-235
[40] 朱小山, 朱琳, 田胜艳, 等. 三种金属氧化物纳米颗粒的水生态毒性[J]. 生态学报, 2008, 28(8): 3507-3516
Zhu X S, Zhu L, Tian S Y, et al. Aquatic ecotoxicities of nanoscale TiO2, ZnO and Al2O3 water suspensions [J]. Acta Ecologica Sinica, 2008, 28(8): 3507-3516 (in Chinese)
[41] Aruoja V, Dubourguier H C, Kasemets K, et al. Toxicity of nanoparticles of CuO, ZnO and TiO2 to microalgae Pseudokirchneriella subcapitata [J]. The Science of the Total Environment, 2009, 407(4): 1461-1468
[42] 于叶. 水介质中C60纳米颗粒对藻类的作用效应研究[D]. 上海: 上海交通大学, 2016: 52-53
Yu Y. Effects of C60 nanocrystallines on algae in aqueous system [D]. Shanghai: Shanghai Jiao Tong University, 2016: 52-53 (in Chinese)
[43] Wahid M H, Eroglu E, Chen X J, et al. Entrapment of Chlorella vulgaris cells within graphene oxide layers [J]. RSC Advances, 2013, 3(22): 8180-8183
[44] Nogueira P F M, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algae Raphidocelis subcapitata [J]. Aquatic Toxicology, 2015, 166: 29-35
[45] Zhao J, Cao X S, Wang Z Y, et al. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae [J]. Water Research, 2017, 111: 18-27
[46] Zhang S J, Jiang Y L, Chen C S, et al. Ameliorating effects of extracellular polymeric substances excreted by Thalassiosira pseudonana on algal toxicity of CdSe quantum dots [J]. Aquatic Toxicology, 2013, 126: 214-223
[47] Morelli E, Salvadori E, Bizzarri R, et al. Interaction of CdSe/ZnS quantum dots with the marine diatom Phaeodactylum tricornutum and the green alga Dunaliella tertiolecta: A biophysical approach [J]. Biophysical Chemistry, 2013, 182: 4-10
[48] Lin S J, Bhattacharya P, Rajapakse N C, et al. Effects of quantum dots adsorption on algal photosynthesis [J]. The Journal of Physical Chemistry C, 2009, 113(25): 10962-10966
[49] 张盼红, 庞成芳, 赵斌. 纳米材料对底栖动物的毒性效应研究进展[J]. 生态毒理学报, 2020, 15(4): 66-78
Zhang P H, Pang C F, Zhao B. Review on the ecotoxicity of manufactured nanomaterials to the benthic invertebrates [J]. Asian Journal of Ecotoxicology, 2020, 15(4): 66-78 (in Chinese)
[50] Lamelas C, Slaveykova V I. Comparison of Cd(Ⅱ), Cu(Ⅱ), and Pb(Ⅱ) biouptake by green algae in the presence of humic acid [J]. Environmental Science & Technology, 2007, 41(11): 4172-4178
[51] Wang Z, Wang S, Peijnenburg W J G M. Prediction of joint algal toxicity of nano-CeO2/nano-TiO2 and florfenicol: Independent action surpasses concentration addition [J]. Chemosphere, 2016, 156: 8-13
[52] Baun A, Sørensen S N, Rasmussen R F, et al.Toxicity and bioaccumulation of xenobiotic organic compounds in the presence of aqueous suspensions of aggregates of nano-C60 [J]. Aquatic Toxicology, 2008, 86(3): 379-387
[53] Gunasekaran D, Chandrasekaran N, Jenkins D, et al. Plain polystyrene microplastics reduce the toxic effects of ZnO particles on marine microalgae Dunaliella salina [J]. Journal of Environmental Chemical Engineering, 2020, 8(5): 104250
[54] Hall S, Bradley T, Moore J T, et al. Acute and chronic toxicity of nano-scale TiO2 particles to freshwater fish, cladocerans, and green algae, and effects of organic and inorganic substrate on TiO2 toxicity [J]. Nanotoxicology, 2009, 3(2): 91-97
[55] Xie B, Xu Z H, Guo W H, et al. Impact of natural organic matter on the physicochemical properties of aqueous C60 nanoparticles [J]. Environmental Science & Technology, 2008, 42(8): 2853-2859
[56] Verneuil L, Silvestre J, Mouchet F, et al. Multi-walled carbon nanotubes, natural organic matter, and the benthic diatom Nitzschia palea: “a sticky story” [J]. Nanotoxicology, 2015, 9(2): 219-229
[57] Tang Y L, Li S Y, Lu Y, et al. The influence of humic acid on the toxicity of nano-ZnO and Zn2+ to the Anabaena sp. [J]. Environmental Toxicology, 2015, 30(8): 895-903
[58] Neale P A, Jamting  K, O’Malley E, et al. Behaviour of titanium dioxide and zinc oxide nanoparticles in the presence of wastewater-derived organic matter and implications for algal toxicity [J]. Environmental Science: Nano, 2015, 2(1): 86-93
K, O’Malley E, et al. Behaviour of titanium dioxide and zinc oxide nanoparticles in the presence of wastewater-derived organic matter and implications for algal toxicity [J]. Environmental Science: Nano, 2015, 2(1): 86-93
[59] Lin D H, Ji J, Long Z F, et al. The influence of dissolved and surface-bound humic acid on the toxicity of TiO2 nanoparticles to Chlorella sp. [J]. Water Research, 2012, 46(14): 4477-4487
[60] Tang Y L, Tian J L, Li S Y, et al. Combined effects of graphene oxide and Cd on the photosynthetic capacity and survival of Microcystis aeruginosa [J]. Science of the Total Environment, 2015, 532: 154-161
[61] 章哲超, 胡佶, 刘淑霞, 等. 纳米二氧化硅与汞(Hg2+)对中肋骨条藻(Skeletonema costatum)的联合毒性效应[J]. 环境化学, 2018, 37(4): 661-669
Zhang Z C, Hu J, Liu S X, et al. Effect of nano-SiO2 on the toxicity of Hg2+ to Skeletonema costatum [J]. Environmental Chemistry, 2018, 37(4): 661-669 (in Chinese)
[62] 辛元元, 陈金媛, 程艳红, 等. 纳米TiO2与重金属Cd对铜绿微囊藻生物效应的影响[J]. 生态毒理学报, 2013, 8(1): 23-28
Xin Y Y, Chen J Y, Cheng Y H, et al. Biological effects of nano-TiO2 and heavy metal Cd on M. aeruginosa [J]. Asian Journal of Ecotoxicology, 2013, 8(1): 23-28 (in Chinese)
[63] Chen J Y, Qian Y, Li H R, et al. The reduced bioavailability of copper by nano-TiO2 attenuates the toxicity to Microcystis aeruginosa [J]. Environmental Science and Pollution Research, 2015, 22(16): 12407-12414
[64] Hu C W, Hu N T, Li X L, et al. Graphene oxide alleviates the ecotoxicity of copper on the freshwater microalga Scenedesmus obliquus [J]. Ecotoxicology and Environmental Safety, 2016, 132: 360-365
[65] Dalai S, Pakrashi S, Bhuvaneshwari M, et al. Toxic effect of Cr(Ⅵ) in presence of n-TiO2 and n-Al2O3 particles towards freshwater microalgae [J]. Aquatic Toxicology, 2014, 146: 28-37
[66] Saison C, Perreault F, Daigle J C, et al. Effect of core-shell copper oxide nanoparticles on cell culture morphology and photosynthesis (photosystemⅡ energy distribution) in the green alga, Chlamydomonas reinhardtii [J]. Aquatic Toxicology, 2010, 96(2): 109-114
[67] Schiavo S, Duroudier N, Bilbao E, et al. Effects of PVP/PEI coated and uncoated silver NPs and PVP/PEI coating agent on three species of marine microalgae [J]. Science of the Total Environment, 2017, 577: 45-53
[68] Fan J J, Hu Y B, Li X Y. Nanoscale zero-valent iron coated with magnesium hydroxide for effective removal of cyanobacteria from water [J]. ACS Sustainable Chemistry & Engineering, 2018, 6(11): 15135-15142
[69] Adeleye A S, Stevenson L M, Su Y M, et al. Influence of phytoplankton on fate and effects of modified zerovalent iron nanoparticles [J]. Environmental Science & Technology, 2016, 50(11): 5597-5605
[70] 吉喜燕, 唐静懿, 叶璟, 等. 碳基纳米铜复合材料对普通小球藻胁迫作用的研究[J]. 生态环境学报, 2021, 30(3): 578-585
Ji X Y, Tang J Y, Ye J, et al. Stressed effects of C-Cu2O nanoparticles on Chlorella vulgaris [J]. Ecology and Environmental Sciences, 2021, 30(3): 578-585 (in Chinese)
[71] Wang M S, Li H B, Li Y H, et al. Dispersibility and size control of silver nanoparticles with anti-algal potential based on coupling effects of polyvinylpyrrolidone and sodium tripolyphosphate [J]. Nanomaterials, 2020, 10(6): 1042
[72] Khoshnamvand M, Hao Z N, Fadare O O, et al. Toxicity of biosynthesized silver nanoparticles to aquatic organisms of different trophic levels [J]. Chemosphere, 2020, 258: 127346
[73] Hartmann N B, von der Kammer F, Hofmann T, et al. Algal testing of titanium dioxide nanoparticles—Testing considerations, inhibitory effects and modification of cadmium bioavailability [J]. Toxicology, 2010, 269(2-3): 190-197
[74] Ivask A, Kurvet I, Kasemets K, et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro [J]. PLoS One, 2014, 9(7): e102108
[75] Lei C, Zhang L Q, Yang K, et al. Toxicity of iron-based nanoparticles to green algae: Effects of particle size, crystal phase, oxidation state and environmental aging [J]. Environmental Pollution, 2016, 218: 505-512
[76] Samei M, Sarrafzadeh M H, Faramarzi M A. The impact of morphology and size of zinc oxide nanoparticles on its toxicity to the freshwater microalga, Raphidocelis subcapitata [J]. Environmental Science and Pollution Research, 2019, 26(3): 2409-2420
[77] Chae Y, An Y J. Toxicity and transfer of polyvinylpyrrolidone-coated silver nanowires in an aquatic food chain consisting of algae, water fleas, and zebrafish [J]. Aquatic Toxicology, 2016, 173: 94-104
[78] Van Hoecke K, Quik J T K, Mankiewicz-Boczek J, et al. Fate and effects of CeO2 nanoparticles in aquatic ecotoxicity tests [J]. Environmental Science & Technology, 2009, 43(12): 4537-4546
[79] 李雅洁, 王静, 崔益斌, 等. 纳米氧化锌和二氧化钛对斜生栅藻的毒性效应[J]. 农业环境科学学报, 2013, 32(6): 1122-1127
Li Y J, Wang J, Cui Y B, et al. Ecotoxicological effects of ZnO and TiO2 nanoparticles on microalgae Scenedesmus oblignus [J]. Journal of Agro-Environment Science, 2013, 32(6): 1122-1127 (in Chinese)
[80] Manier N, Bado-Nilles A, Delalain P, et al. Ecotoxicity of non-aged and aged CeO2 nanomaterials towards freshwater microalgae [J]. Environmental Pollution, 2013, 180: 63-70
[81] 王应军, 李娜, 罗潇宇, 等. 多壁碳纳米管对铜绿微囊藻生长及生理特征的影响[J]. 生态毒理学报, 2018, 13(6): 316-325
Wang Y J, Li N, Luo X Y, et al. Effects of multi-walled carbon nanotubes on the growth and physiology of Microcystis aeruginosa [J]. Asian Journal of Ecotoxicology, 2018, 13(6): 316-325 (in Chinese)
[82] van Hoecke K, de Schamphelaere K A C, Ramirez-Garcia S, et al. Influence of alumina coating on characteristics and effects of SiO2 nanoparticles in algal growth inhibition assays at various pH and organic matter contents [J]. Environment International, 2011, 37(6): 1118-1125
[83] Röhder L A, Brandt T, Sigg L, et al. Influence of agglomeration of cerium oxide nanoparticles and speciation of cerium(Ⅲ) on short term effects to the green algae Chlamydomonas reinhardtii [J]. Aquatic Toxicology, 2014, 152: 121-130
[84] Sørensen S N, Baun A. Controlling silver nanoparticle exposure in algal toxicity testing:A matter of timing [J]. Nanotoxicology, 2015, 9(2): 201-209
[85] Schiavo S, Oliviero M, Miglietta M, et al. Genotoxic and cytotoxic effects of ZnO nanoparticles for Dunaliella tertiolecta and comparison with SiO2 and TiO2 effects at population growth inhibition levels [J]. The Science of the Total Environment, 2016, 550: 619-627
[86] Zhang J X, Jiang L J, Wu D, et al. Effects of environmental factors on the growth and microcystin production of Microcystis aeruginosa under TiO2 nanoparticles stress [J]. Science of the Total Environment, 2020, 734: 139443
[87] Adeleye A S, Conway J R, Perez T, et al. Influence of extracellular polymeric substances on the long-term fate, dissolution, and speciation of copper-based nanoparticles [J]. Environmental Science & Technology, 2014, 48(21): 12561-12568
[88] Ghazaei F, Shariati M. Effects of titanium nanoparticles on the photosynthesis, respiration, and physiological parameters in Dunaliella salina and Dunaliella tertiolecta [J]. Protoplasma, 2020, 257(1): 75-88
[89] 陈晓华, 张偲, 谭丽菊, 等. 人工纳米材料对海洋微藻的毒性研究进展[J]. 海洋科学, 2017, 41(6): 134-143
Chen X H, Zhang C, Tan L J, et al. Research progress in toxicity of nanomaterials manufactured on microalgae [J]. Marine Sciences, 2017, 41(6): 134-143 (in Chinese)
[90] 王震宇, 赵建, 李娜, 等. 人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J]. 环境科学, 2010, 31(6): 1409-1418
Wang Z Y, Zhao J, Li N, et al. Review of ecotoxicity and mechanism of engineered nanoparticles to aquatic organisms [J]. Environmental Science, 2010, 31(6): 1409-1418 (in Chinese)
[91] Franklin N M, Rogers N J, Apte S C, et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2 to a freshwater microalga (Pseudokirchneriella subcapitata): The importance of particle solubility [J]. Environmental Science & Technology, 2007, 41(24): 8484-8490
[92] Pakrashi S, Dalai S, T C P, et al. Cytotoxicity of aluminium oxide nanoparticles towards fresh water algal isolate at low exposure concentrations [J]. Aquatic Toxicology, 2013, 132-133: 34-45
[93] Miao A J, Schwehr K A, Xu C, et al. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances [J]. Environmental Pollution, 2009, 157(11): 3034-3041
[94] 花文凤, 王大力, 高雅, 等. 纳米金属氧化物对羊角月牙藻的毒性研究[J]. 安全与环境学报, 2014, 14(4): 307-311
Hua W F, Wang D L, Gao Y, et al. Effect of the typical metal oxide nanoparticles on the toxicity of the Selenastrum capricornutum [J]. Journal of Safety and Environment, 2014, 14(4): 307-311 (in Chinese)
[95] Perreault F, Oukarroum A, Melegari S P, et al. Polymer coating of copper oxide nanoparticles increases nanoparticles uptake and toxicity in the greenalga Chlamydomonas reinhardtii [J]. Chemosphere, 2012, 87(11): 1388-1394
[96] Peng X H, Palma S, Fisher N S, et al. Effect of morphology of ZnO nanostructures on their toxicity to marine algae [J]. Aquatic Toxicology, 2011, 102(3-4): 186-196
[97] 吴明珠, 何梅琳, 邹山梅, 等. 纳米MgO对斜生栅藻的毒性效应及致毒机理[J]. 环境化学, 2015, 34(7): 1259-1267
Wu M Z, He M L, Zou S M, et al. Toxicities and mechanisms of MgO nanoparticles to Scenedesmus obliquus [J]. Environmental Chemistry, 2015, 34(7): 1259-1267 (in Chinese)
[98] Van Hoecke K, De Schamphelaere K A C, Van der Meeren P, et al. Ecotoxicity of silica nanoparticles to the green alga Pseudokirchneriella subcapitata: Importance of surface area [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1948-1957
[99] Gong N, Shao K S, Che C, et al. Stability of nickel oxide nanoparticles and its influence on toxicity to marine algae Chlorella vulgaris [J]. Marine Pollution Bulletin, 2019, 149: 110532