随着沿海地区生产生活活动日益加剧,大量污染物持续输入海岸带,生态环境面临着严重威胁[1]。近年来,包括抗生素在内的新污染物备受关注[2]。在我国约1.8万km的海岸线上采取水样,可以检测出7种目标抗生素,总浓度为389~3 302.3 ng·L-1,其中诺氟沙星、罗红霉素和环丙沙星最为常见[3]。并且我国沿海水体及沉积物中多数抗生素的浓度明显高于其他国家和地区[1]。大多数抗生素因具有一定的疏水性和亲脂性不容易被降解[4],从而在环境中持续积累,氟喹诺酮类抗生素在环境中就表现出较强的持久性[5]。虽然水体中抗生素的浓度一般介于ng·L-1~μg·L-1[6],但是细菌长期暴露于低浓度抗生素环境中可以产生耐药性,进一步导致抗生素抗性基因的传播,随着食物链传递将对生态系统平衡与人类身体健康带来很大风险。
微藻位于生物链底端,生物量巨大,在淡水、河口、海洋,乃至陆地环境中均有分布[7-8]。微藻因为细胞体积小,比表面积大,受光面积大,所以与高等植物相比具有更高的光合效率。其生物质可用于生产生物燃料、动物饲料、保健品和化妆品等高价值产品[7]。在绿色经济可持续发展的大背景下,微藻在污水处理中的应用也越来越受关注。微藻能够摄取氮磷营养盐、光合放氧缓解富营养化,在污泥表面形成微藻生物膜防止污泥解体加剧水质恶化,甚至还会减少致病菌的数量[9]。混合营养型微藻在无光环境中以有机碳为碳源能够缓解弱光条件下深色污水光供应不足的问题,并且生长周期短、生物质产量高[10]。将微藻与抗生素的生物降解过程有机结合起来,为生物质的资源化利用和水体中污染物同步有效去除提供了新思路。目前,在利用微藻处理抗生素废水方面已经开展了一些研究。例如,用小球藻去除左氧氟沙星[11]、氟苯尼考[12]、阿莫西林[8]或混合抗生素[13],用衣藻去除环丙沙星[14-15]等。微藻对抗生素废水的净化效果受微藻种类、环境条件和抗生素浓度等多种因素的影响。已有研究多以淡水系统作为研究对象,而海洋环境较淡水环境更为复杂,微藻应用于海水抗生素污染治理的潜力有待探索。
三角褐指藻(Phaeodactylum tricornutum)是典型的硅藻,富含油脂[16],可利用多种有机物作为碳源进行混合营养生长[17]。它也是海洋生态系统中非常重要的初级生产者,可作为水产养殖的优良饵料[17]。然而,常见抗生素对绿藻的研究最多,对硅藻的研究较少[18]。因此,本文选三角褐指藻作为模型微藻。氟喹诺酮类抗生素被广泛用于畜禽养殖业,其中诺氟沙星、环丙沙星(ciprofloxacin, CIP)和氧氟沙星在多种环境介质中均处于相对较高的浓度水平[18-19]。而CIP的杀菌效果高于诺氟沙星[20],在环境中的行为更值得关注。所以,本文以CIP为目标污染物,研究了三角褐指藻对CIP的去除动力学规律。并进一步探究了pH、光照、盐度和抗生素初始浓度等因素对去除效率的影响,为微藻在海洋抗生素污染治理领域的应用提供有价值的参考。
1 材料与方法(Materials and methods)
1.1 实验材料和仪器
实验所用藻种为实验室储备的三角褐指藻。所用海水来自烟台市向海延伸100 m处水域(pH~8.5,盐度~30‰)。CIP(纯度98%)购自上海麦克林生化科技有限公司,其他所有试剂均为分析纯。主要仪器为智能光照培养箱(GXA-380B,宁波江南仪器厂,中国)、超高效液相色谱仪(UPLC)(ACQUITY UPLC H-Class,沃特世科技有限公司,美国)和紫外可见分光光度计(TU-1810PC,北京普析通用仪器有限责任公司,中国)。
1.2 实验方法
1.2.1 CIP母液配制方法
准确称取0.010 g CIP,加入0.1 mL过滤除菌的1 mol·L-1 HCl溶液,加入甲醇溶解并定容至10 mL获得1 g·L-1 CIP母液,4 ℃密封于棕色瓶保存。用0.22 μm醋酸纤维素滤膜过滤后的培养基配制CIP标准溶液供定量检测使用。
1.2.2 培养基制备及微藻培养
实验所用微藻需每个月进行一次传代培养以维持活力。用0.22 μm醋酸纤维素滤膜过滤后的海水,根据Guillard[21]提供的方法配制f/2培养基,121 ℃、高温湿热灭菌20 min,自然冷却至室温后,继续添加过滤除菌的维生素贮备液和Na2SiO3贮备液,充分混匀备用。在超净台中以10%的接种量(藻液和培养基的体积比)将藻种接种到培养基中,放置于光照培养箱中培养。光照培养箱参数设置为光照度33%,光暗周期L∶D=14 h∶10 h,温度20 ℃。每天定时摇瓶3次,防止微藻细胞沉底或贴壁,并保证体系中氧气和二氧化碳的交换。
1.2.3 微藻细胞干质量(DCW)与光密度(OD680)相关关系的测定
微藻培养到生长稳定期时(约40 d),将藻液静置1 d后用移液枪吸取细胞沉淀,取适量f/2培养基将藻液稀释成不同浓度,控制OD680在0.1~1.5。取0.45 μm玻璃纤维滤膜于105 ℃烘干24 h,干燥器内冷却至室温后称量质量。取一定体积稀释后的藻液过滤,再用10 mL 0.5 mol·L-1 NH4HCO3溶液分2次洗涤藻细胞。用镊子收取滤膜,于95 ℃烘干24 h,干燥器内冷却至室温后称量质量。根据公式计算细胞干质量,绘制OD680-DCW标准曲线。
式中:DCW指单位体积细胞干质量(g·L-1);m0指过滤前干燥滤膜的质量(g);m指过滤后干燥滤膜和藻细胞的总质量(g);V指稀释后所取藻液的体积(mL)。
1.2.4 抗生素去除过程的动力学模型拟合
在250 mL三角瓶内加入150 mL培养基,再加入90 μL CIP母液(1 g·L-1),使抗生素初始浓度约为600 μg·L-1。微藻接种量为1%(OD680~1)。培养条件同1.2.1,定时摇瓶3 次·d-1。设置无微藻和微藻121 ℃灭活2个对照组。接种第0~90天间隔取样,将藻液摇匀后取1 mL,12 000 r·min-1离心12 min,取0.8 mL上清液测培养基中残留的CIP浓度;取3 mL藻液测OD680。所用器皿均经过灭菌处理,取样全程无菌操作。
分别用一级动力学和二级动力学模型对三角褐指藻去除CIP的过程进行拟合:
![]() =e-k1t
=e-k1t![]()
式中:c0和ct分别指培养物中CIP的初始浓度和t时刻的浓度(μg·L-1),k1和k2分别指一级动力学和二级动力学降解速率常数(d-1)。
1.2.5 三角褐指藻去除抗生素影响实验
探究pH影响时,f/2培养基灭菌前用1 mol·L-1 HCl或1 mol·L-1 NaOH调节pH为5.5、6.5、7.5、8.5和9.5。设置无微藻和无抗生素2个对照组,其他条件同1.2.3。
探究盐度影响时,海水过滤后先用蒸馏水调节盐度为10‰、20‰和30‰,再用于配制培养基。设置无微藻和无抗生素2个对照组,其他条件同1.2.3。
探究光照强度影响时,根据光照培养箱参数设置光照强度为0、33%、66%和100%。其中光照度为0的实验组用铝箔纸避光作暗处理。设置无微藻和无抗生素2个对照组,其他条件同1.2.3。
探究抗生素初始浓度影响时,向150 mL培养基中分别加入15、30、60、90、120和150 μL CIP母液(1 g·L-1),使抗生素初始浓度约为100、200、400、600、800和1 000 μg·L-1。设置无抗生素对照组,其他条件同1.2.3。经预实验表明,CIP母液中HCl和甲醇对三角褐指藻生长的影响可以忽略。
1.2.6 CIP定量检测
用UPLC检测CIP浓度。UPLC配备C18反相色谱柱,检测器为荧光检测器,进样量2 μL,柱温40 ℃,流动相为0.01 mol·L-1磷草酸/乙腈/甲醇(80/10/10,V∶V),流速0.3 mL·min-1,激发和发射波长分别为280 nm和450 nm,保留时间约为1.7 min。
1.2.7 数据分析
所有实验均做3组平行。采用单因素方差分析(ANOVA)确定主效应的显著性,用Tukey’s test确定水平之间是否具有显著差异。对于所有的统计分析,α值为0.05,P<0.05被认为是显著的概率。所有数据分析和绘图均使用OriginPro 2021完成。
2 结果(Results)
2.1 抗生素去除过程的动力学模型拟合
如图1(a)所示,在整个实验过程中,无微藻对照组(CK1)和微藻灭活对照组(CK2)中CIP的浓度变化趋势一致,说明刚接种的微藻细胞对CIP的吸附作用可忽略不计。对照组中CIP去除率均在5%~15%范围内波动,证明包括水解、光解在内的非生物作用甚微,可见CIP在海水中具有持久性。接种三角褐指藻55 d后,CIP的去除效率逐渐趋于平缓,最终去除率达(60.0±0.94)%。对该过程进行一级和二级动力学模型拟合,拟合参数如表1所示。数据显示,该过程更符合一级动力学模型,半衰期47 d。
因为三角褐指藻的OD680与DCW具有良好的线性相关关系(DCW=0.66586×OD680-0.03154,R2=0.97),所以可以用OD680监测微藻的生长情况。从微藻OD680随时间的变化曲线(图1(b))看,接种41 d后,三角褐指藻进入生长稳定期。三角褐指藻受到CIP长时间的胁迫,仍然保持良好的生长态势,对CIP具有较强的耐受性和去除能力。
2.2 pH影响实验
如图2(a)所示,在不同pH体系中,三角褐指藻对CIP的去除趋势大致相同。pH为5.5时,接种微藻6 d后即有(46.0±3.63)%的CIP被去除。pH为6.5~8.5时,CIP的去除率无明显差别。pH为9.5时,去除率最低(62.4±4.11)%。由图2(b)可知,pH在6.5~9.5之间,三角褐指藻的生长对数期随pH升高而缩短,弱碱性培养基中微藻生长速度更快。pH为5.5时生长周期最长且生物量最高;pH为9.5时生长周期最短且生物量最低,30 d时藻液颜色逐渐变浅。但pH为5.5和9.5时,CIP对三角褐指藻均表现出生长抑制作用,OD680分别降低了(13.0±3.03)%和(18.2±3.85)%。
2.3 盐度影响实验
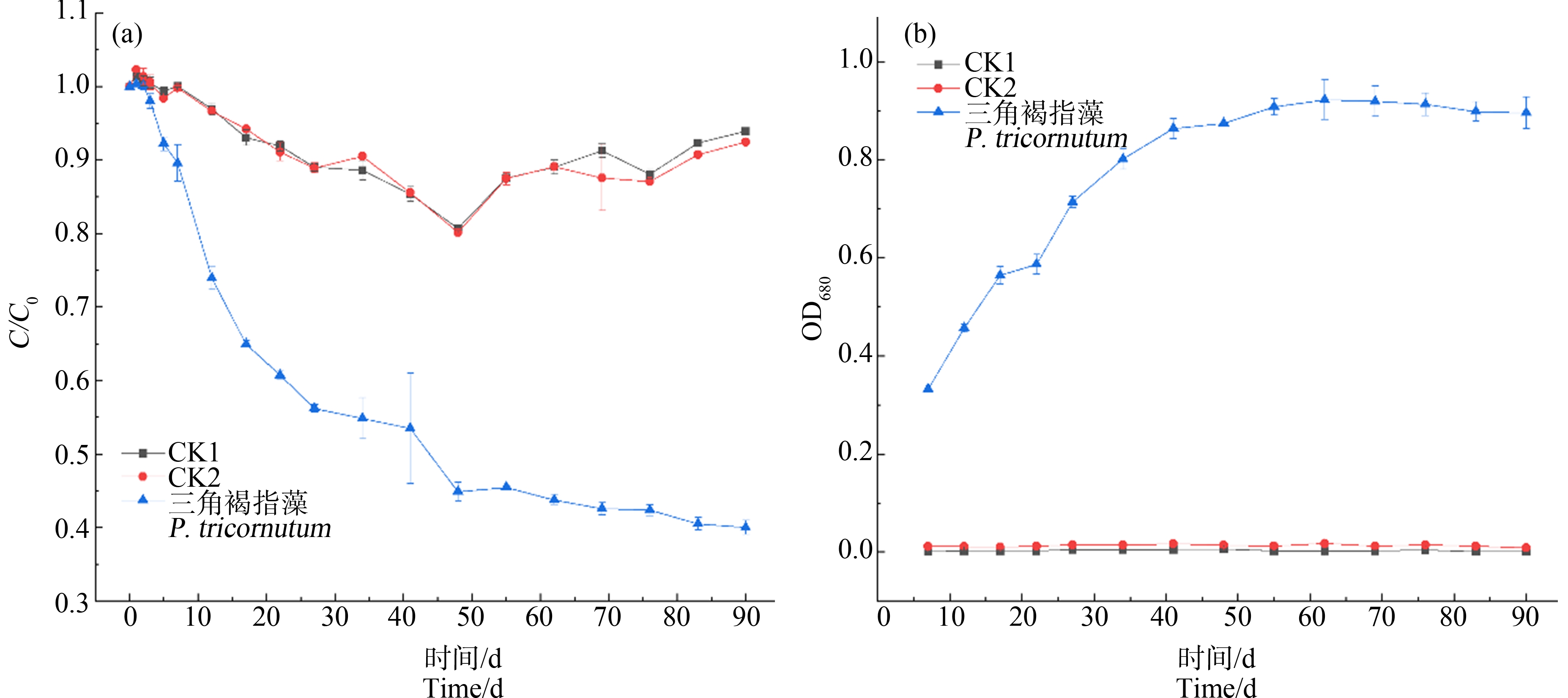
图1 三角褐指藻对环丙沙星(CIP)的去除率(a)和OD680(b)变化
注:CK1为无微藻;CK2为微藻灭活。
Fig. 1 Removal rate of ciprofloxacin (CIP) (a) and OD680(b) of P. tricornutum
Note: CK1 represents group without microalgae; CK2 represents group with microalgae inactivated.
表1 三角褐指藻去除CIP的动力学参数
Table 1 Kinetic parameters of CIP dissipation by P. tricornutum

动力学模型Kinetic modelk/d-1T1/2/dR2一级动力学模型First order model0.0148470.96二级动力学模型Second order model3.99×10-5430.93
注:k是动力学模型速率常数;T1/2是半衰期。
Note: k is kinetic model rate constant; T1/2 is half-lives.
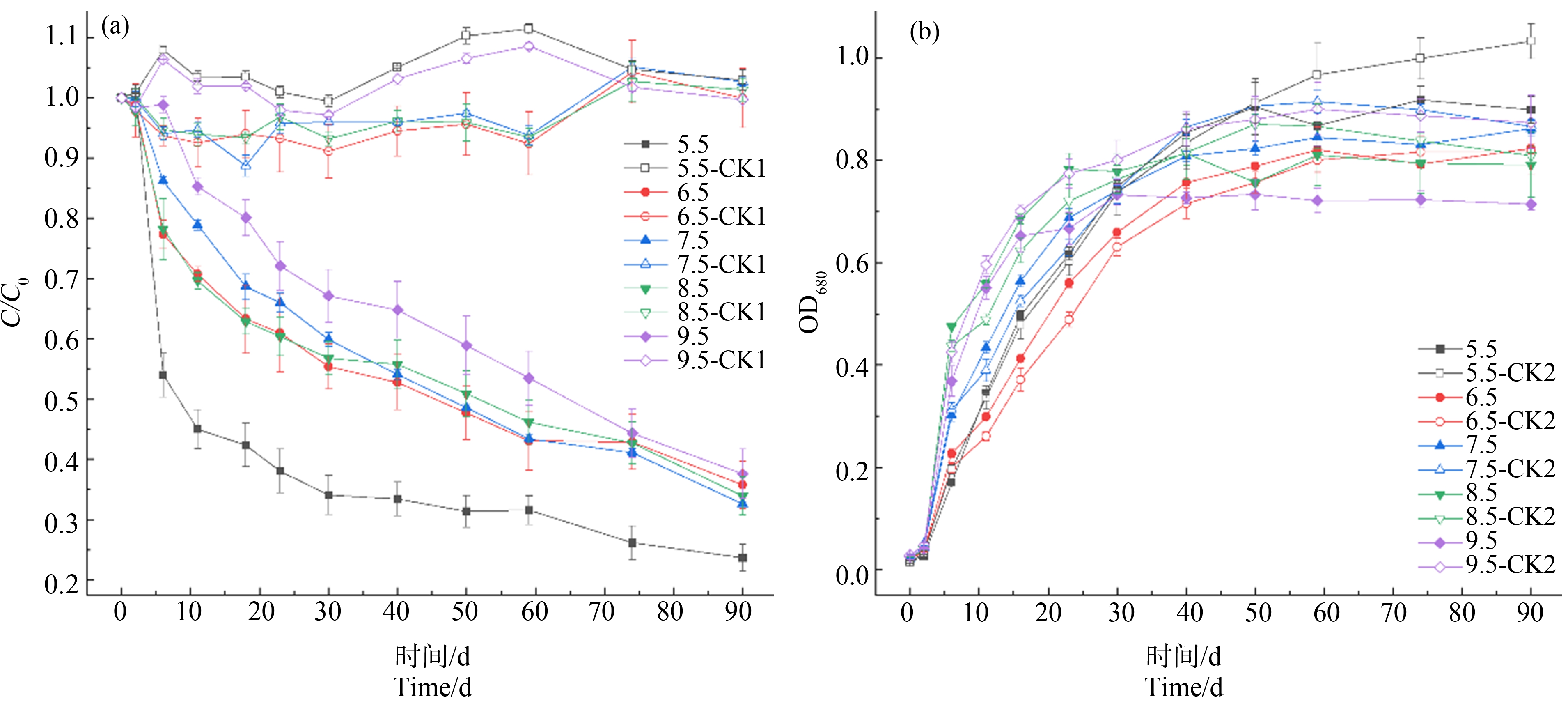
图2 pH对CIP去除率(a)和三角褐指藻OD680(b)的影响
注:CK1为无微藻;CK2为微藻灭活。
Fig. 2 Effects of pH on removal rate of CIP (a) and OD680 of P. tricornutum (b)
Note: CK1 represents group without microalgae; CK2 represents group with microalgae inactivated.
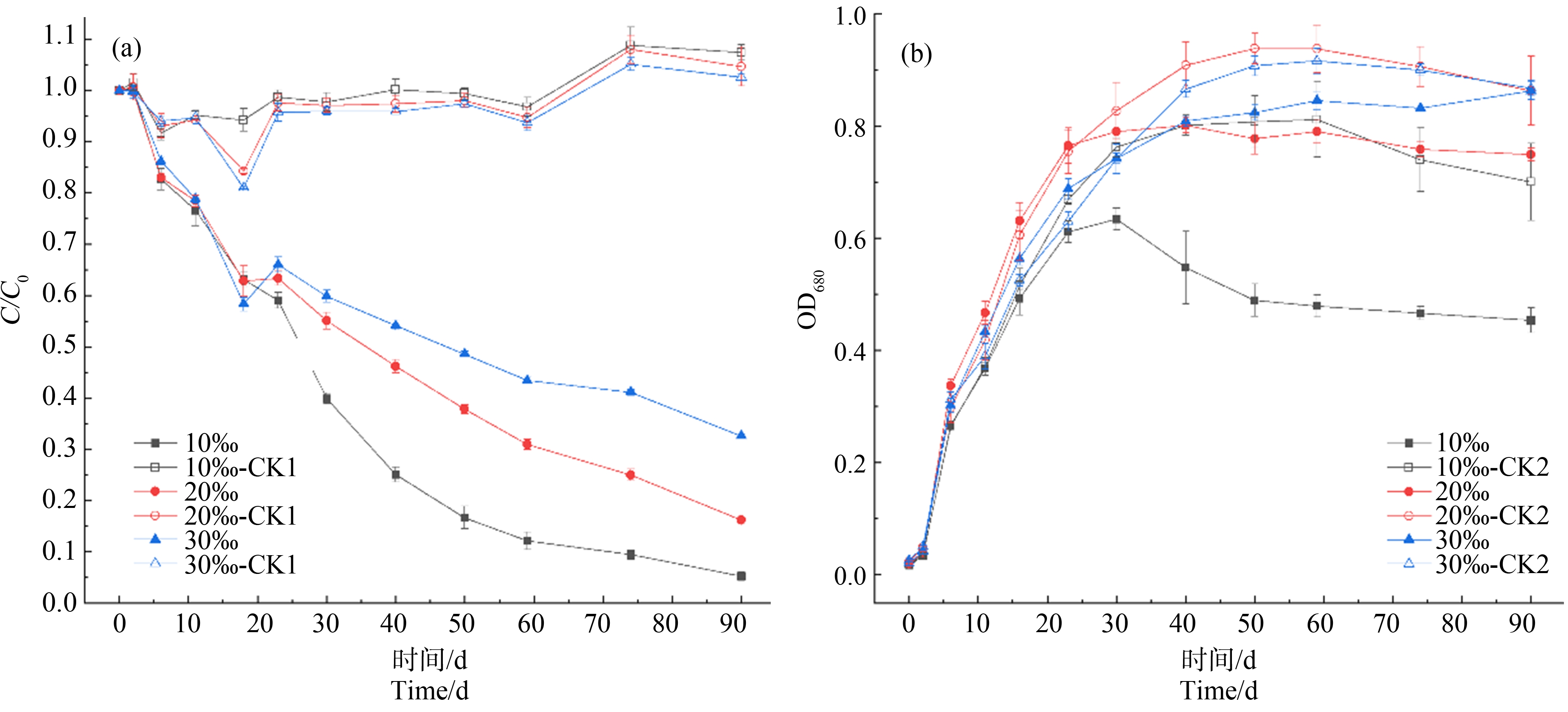
图3 盐度对CIP去除率(a)和三角褐指藻OD680(b)的影响
注:CK1为无微藻;CK2为微藻灭活。
Fig. 3 Effects of salinity on removal rate of CIP (a) and OD680 of P. tricornutum (b)
Note: CK1 represents group without microalgae; CK2 represents group with microalgae inactivated.
如图3(a)所示,接种三角褐指藻23 d后,CIP的去除效果与盐度呈负相关,最终10‰、20‰和30‰盐度下去除率分别为(95.1±0.84)%、(83.8±0.56)%和(67.4±0.29)%。然而,在不含微藻的空白组中CIP的浓度并没有显著变化,说明盐度主要通过影响微藻的生物作用改变CIP的环境行为。由图3(b)可知三角褐指藻在不同盐度条件下的生长情况,其中20‰和30‰盐度下的生长趋势相似,实验组接种第40天后30‰的生长量更高一些;10‰盐度下,实验组生长量以第30天为节点急剧降低,50 d后趋于平缓,稳定在0.5以下。3种盐度水平下,空白组三角褐指藻的生长量均高于实验组,而且空白组都呈现出先增后减的趋势,其中10‰盐度的OD680最低(P<0.05)。因而得知,低盐度不利于三角褐指藻生长。在本实验中30‰盐度时,在CIP作用下,三角褐指藻长势迅速恶化。实验进行30 d后,10‰盐度实验组的藻液由澄清透明变成乳白色浑浊,可能为细胞破碎胞内物质溶出所致。
2.4 光照强度影响实验
培养箱设置的光照强度33%、66%和100%分别大致对应3 000、4 000和7 000 lx。无微藻空白对照组CIP的去除率随光照强度的增加略有增加,光解去除率最高不足5%(图4(a))。在含微藻的处理组中,低光照强度(33%)对CIP的去除率最高为(65.4±0.85)%,中、高光照强度66%和100%去除率分别为(56.0±0.48)%和(56.6±1.66)%。可见,增大光照强度并不会促进三角褐指藻对CIP的降解过程。弱光条件下,CIP对藻细胞生长的抑制作用最明显(图4(b))。不存在CIP时,弱光条件下OD680最高,中等光照强度次之,可能高光照强度抑制了光合作用。暗处理组用铝箔纸完全包裹瓶体,铝箔纸会因为培养基海水蒸发被腐蚀,发现透光后及时更换。所以,暗处理组的微藻缓慢增殖以及CIP的去除率逐渐升高是不可避免的。
2.5 抗生素初始浓度影响实验
三角褐指藻对CIP的去除率(52.7±0.84)%~(71.8±2.05)%随CIP初始浓度的升高而降低(图5(a))。接种微藻10 d,100 μg·L-1 CIP的去除效率比1 000 μg·L-1高3.2倍。至90 d时,高浓度CIP的去除仍未达到平衡。由图5(b)得知,抗生素处理组的生物量均低于空白对照组,不同浓度的CIP对微藻的生长都有抑制作用,OD680降低了(13.1±6.94)%~(19.1±5.52)%。
3 讨论(Discussion)
本文从海水养殖饵料微藻降解处理抗生素的角度,考察了三角褐指藻对CIP的去除过程和不同因素的影响。在不含微藻的空白对照组中CIP去除率非常低,非生物作用有限[14,22]。这可能由于CIP具有疏水特性[15],水解作用甚微。然而,有研究者认为CIP对光敏感,在水环境中半衰期较短,主要靠光解作用被去除[23]。例如,自然光照72 h盐酸环丙沙星在自来水中约去除80%[24];在不含藻的反应液中CIP经紫外照射2 h后的降解率为46.58%[25]。本实验所得现象与前述研究结果有较大差别,可能是因为前者研究的是淡水系统,而本实验是以海水培养基为环境介质。大多数抗生素分子都含有羧基、羟基或氨基等可电离的基团,在水溶液中不同解离形式的有机污染物理化性质和毒性取决于污染物所处的水环境介质的组成[26]。因此,CIP在海水中的环境化学行为可能不同于淡水系统。显然,微藻的生物作用对去除CIP做出了重要贡献。三角褐指藻对CIP的去除过程符合一级动力学模型,同大多数微藻去除抗生素的规律一致[11,14,27]。但是,三角褐指藻并不能快速去除CIP。因此,本文继续探究了pH、光照强度、盐度和抗生素浓度的影响规律。

图4 光照强度对CIP去除率(a)和三角褐指藻OD680(b)的影响
注:CK1为无微藻;CK2为微藻灭活。
Fig. 4 Effects of light intensity on removal rate of CIP (a) and OD680 of P. tricornutum (b)
Note: CK1 represents group without microalgae; CK2 represents group with microalgae inactivated.
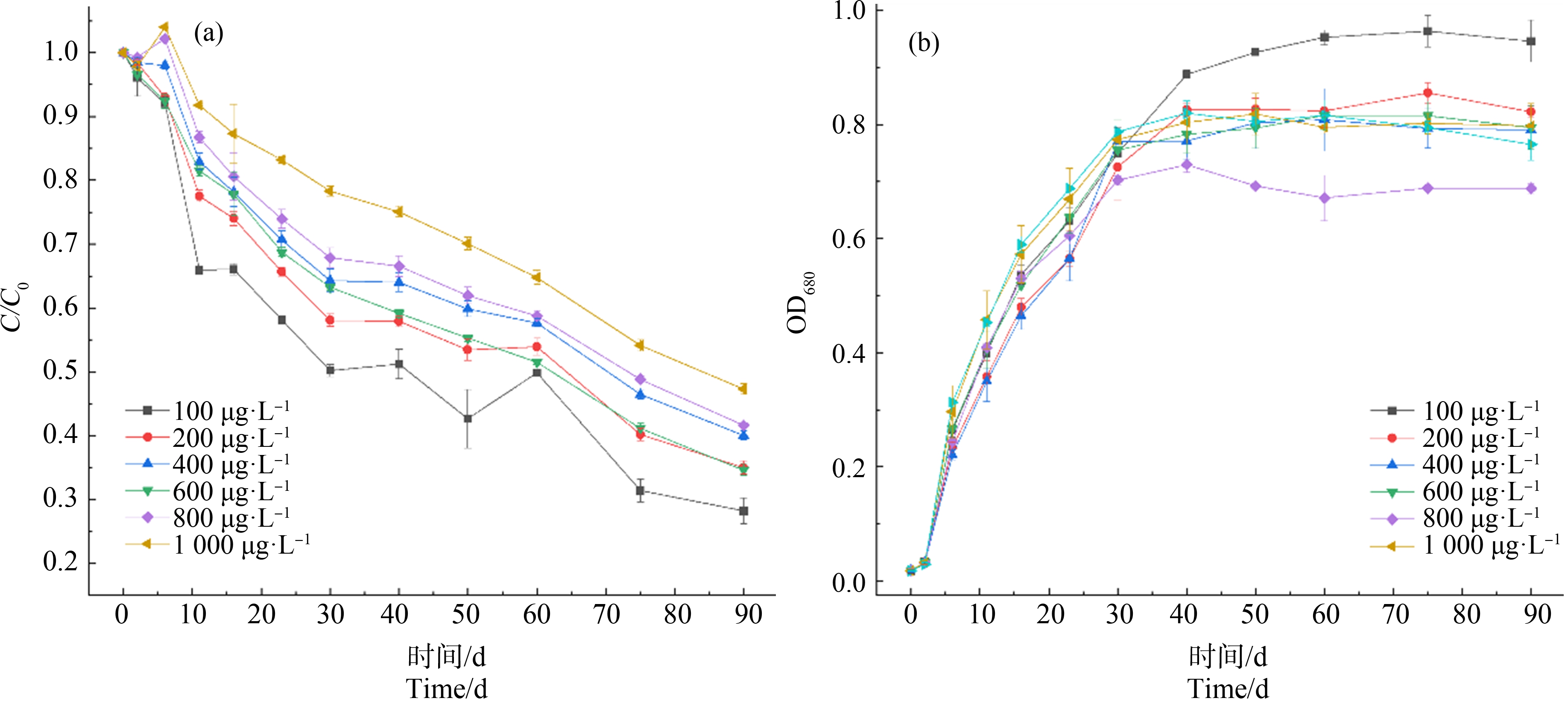
图5 抗生素初始浓度对CIP去除率(a)和三角褐指藻OD680(b)的影响
Fig. 5 Effects of initial antibiotic concentration on removal rate of CIP (a) and OD680 of P. tricornutum (b)
藻类生长体系的pH可介导某些离子抗生素的水解[28]。大多数抗生素具有酸性和/或碱性,其电离状态受溶液pH和酸性解离常数(pKa)控制[29]。CIP含有多个可电离基团,存在4个pKa值:3.0、6.1、8.7和10.6[29]。羧基在pH>6.1时开始解离,氮原子在pH<8.7时开始质子化[23]。在pH为6.5、7.5和8.5时,CIP主要以H2CIP+的形式存在[23]。有研究认为CIP处于两性离子状态最容易发生光解,而在pH为3.0~4.0的溶液中稳定性增加[30-31]。本实验之所以得到不同的结果,可能是因为在pH为6.5~8.5范围内,CIP同时带正电荷和负电荷,削弱了其对微藻细胞的吸附亲和性[23]。而生物过程发挥着主导作用,即使碱性环境利于非生物降解,但无法决定CIP最终的归趋。微藻细胞表面具有呈电负性官能团[32],pH值越低,CIP质子化程度越高,越容易被微藻细胞吸附,进一步加速了CIP的生物降解过程。此外,pH变化对三角褐指藻的生长有着显著影响。据报道,三角褐指藻在低pH环境中,生长速率提高5.2%[33];当pH超过9.0时,比生长速率下降[34]。由此可见,高碱度超出微藻耐受范围后会抑制其生长,弱酸性环境更有利于三角褐指藻降解去除CIP。
盐度胁迫下形成的渗透压会影响微藻细胞对脂质、碳水化合物和蛋白质的合成和积累,改变微藻的生理生化特性以及生长规律[11]。本实验结果证明低盐度不利于三角褐指藻生长。相似的,叶丽等[35]发现,三角褐指藻诱变株MP-2在10‰盐度条件下的生物量明显低于20‰和30‰盐度条件下的生物量。低盐度处理组却得到了最高的CIP的去除率。这可能是因为溶液中的Na+能够与藻细胞表面的羟基结合[11],低盐环境中Na+和CIP之间的竞争吸附作用减弱,从而促进了下一步生物吸收和降解过程的进行。天然海水的盐度一般在30‰右左,根据本实验结果,自然海洋环境不利于三角褐指藻去除CIP。
在光照影响实验中,含抗生素的处理组中,三角褐指藻OD680随光照强度的变化关系为66%>100%>33%。类似的,研究发现随着光照强度的增加,三角褐指藻诱变株MP-2的生物量先增加后降低[35]。抗生素处理组和空白对照组在不同光照强度下的OD680均相差仅0.1左右,体现了三角褐指藻具有较强的光适应机制。据报道,三角褐指藻在光限制条件下可以通过增加叶绿素含量提高光合效率,在广泛光照范围内比生长速率变化不大[36-37],即使光照强度超过光饱和点后,也不会出现明显的光抑制现象[38]。可能因为弱光条件下三角褐指藻的光合作用更强,诱导产生更多的活性氧,所以CIP去除率更高。在空白对照组中,33%光照下生物量最高,与处理组对比可看出弱光条件下CIP对三角褐指藻的生长抑制作用最强。
CIP去除率与初始浓度呈负相关关系,但最低浓度在90 d内也没有完全去除,再次验证了CIP的持久性特点。CIP对多种微藻都表现出毒性效应。Xiong等[14]发现CIP浓度增大会显著抑制衣藻C. mexicana的生长。连鹏等[39]发现高浓度的盐酸环丙沙星对亚心形扁藻的生长有明显的抑制作用,且呈现出浓度-效应关系。刘滨扬[40]发现CIP对羊角月牙藻的生长速率、叶绿素合成、光合系统等生长和生理代谢均有抑制作用。低于1 mg·L-1的CIP对三角褐指藻都表现出生长抑制作用,但生长趋势一致,反映了三角褐指藻对CIP具有较强的耐受能力。
在影响因素实验中,经常检测到无微藻的空白对照组CIP浓度高于初始值,可能是仪器状态产生的系统误差所致,并未对其他处理组CIP浓度的变化趋势产生明显影响。综合pH、盐度、光照和抗生素浓度4个因素对三角褐指藻去除CIP的影响,在改变盐度时,CIP去除率变化幅度最大,且在10‰盐度条件下获得最大去除率为(95.1±0.84)%。由此可见,盐度影响最显著。
根据本文研究,三角褐指藻在弱酸、低盐和弱光环境中才能更高效地去除微浓度CIP。而自然海水呈弱碱性且盐度高,为CIP在海水中稳定存在创造了条件。因此,需要继续探究CIP对三角褐指藻的生长抑制作用,提高三角褐指藻的耐受性和降解能力,探索更高效的CIP生物降解方法。
[1] 吕剑, 骆永明, 章海波. 中国海岸带污染问题与防治措施[J]. 中国科学院院刊, 2016, 31(10): 1175-1181
Lv J, Luo Y M, Zhang H B. Coastal zone pollution and its prevention and treatment measures in China [J]. Bulletin of Chinese Academy of Sciences, 2016, 31(10): 1175-1181 (in Chinese)
[2] 包樱钰, 李菲菲, 温东辉. 我国海水养殖业的抗生素污染现状[J]. 海洋环境科学, 2021, 40(2): 294-302
Bao Y Y, Li F F, Wen D H. Antibiotic contamination in mariculture in China [J]. Marine Environmental Science, 2021, 40(2): 294-302 (in Chinese)
[3] Lu J, Wu J, Zhang C, et al. Occurrence, distribution, and ecological-health risks of selected antibiotics in coastal waters along the coastline of China [J]. Science of the Total Environment, 2018, 644: 1469-1476
[4] Kumar M, Jaiswal S, Sodhi K K, et al. Antibiotics bioremediation: Perspectives on its ecotoxicity and resistance [J]. Environment International, 2019, 124: 448-461
[5] Ao X W, Liu W J, Sun W J, et al. Medium pressure UV-activated peroxymonosulfate for ciprofloxacin degradation: Kinetics, mechanism, and genotoxicity [J]. Chemical Engineering Journal, 2018, 345: 87-97
[6] Xiong Q, Liu Y S, Hu L X, et al. Co-metabolism of sulfamethoxazole by a freshwater microalga Chlorella pyrenoidosa [J]. Water Research, 2020, 175: 115656
[7] Xiong J Q, Kurade M B, Jeon B H. Can microalgae remove pharmaceutical contaminants from water? [J]. Trends in Biotechnology, 2018, 36(1): 30-44
[8] Shi X Q, Yeap T S, Huang S J, et al. Pretreatment of saline antibiotic wastewater using marine microalga [J]. Bioresource Technology, 2018, 258: 240-246
[9] Chen F F, Xiao Y, Wu X W, et al. Replacement of feed by fresh microalgae as a novel technology to alleviate water deterioration in aquaculture [J]. RSC Advances, 2020, 10(35): 20794-20800
[10] Patel A K, Choi Y Y, Sim S J. Emerging prospects of mixotrophic microalgae: Way forward to sustainable bioprocess for environmental remediation and cost-effective biofuels [J]. Bioresource Technology, 2020, 300: 122741
[11] Xiong J Q, Kurade M B, Jeon B H. Biodegradation of levofloxacin by an acclimated freshwater microalga, Chlorella vulgaris [J]. Chemical Engineering Journal, 2017, 313: 1251-1257
[12] Song C F, Wei Y L, Qiu Y T, et al. Biodegradability and mechanism of florfenicol via Chlorella sp. UTEX1602 and L38: Experimental study [J]. Bioresource Technology, 2019, 272: 529-534
[13] 王桂祥, 张琼, 匡少平, 等. 环境浓度下的混合抗生素对普通小球藻的联合毒性[J]. 生态毒理学报, 2019, 14(2): 122-128
Wang G X, Zhang Q, Kuang S P, et al. The joint toxicity of mixed antibiotics on Chlorella vulgaris at normal environmental concentration [J]. Asian Journal of Ecotoxicology, 2019, 14(2): 122-128 (in Chinese)
[14] Xiong J Q, Kurade M B, Kim J R, et al. Ciprofloxacin toxicity and its co-metabolic removal by a freshwater microalga Chlamydomonas mexicana [J]. Journal of Hazardous Materials, 2017, 323: 212-219
[15] Xie P, Chen C, Zhang C F, et al. Revealing the role of adsorption in ciprofloxacin and sulfadiazine elimination routes in microalgae [J]. Water Research, 2020, 172: 115475
[16] Jiang H M, Gao K S. Effects of lowering temperature during culture on the production of polyunsaturated fatty acids in the marine diatom Phaeodactylum tricornutum (Bacillariophyceae) 1 [J]. Journal of Phycology, 2004, 40(4): 651-654
[17] 潘瑾, 俞建中, 马晓磊, 等. 温度影响三角褐指藻生长和脂肪酸组成的初步探讨[J]. 渔业科学进展, 2010, 31(6): 90-94
Pan J, Yu J Z, Ma X L, et al. Effect of temperature on the growth and fatty acid composition of Phaeodactylum tricornutum [J]. Progress in Fishery Sciences, 2010, 31(6): 90-94 (in Chinese)
[18] 洪喻, 郝立翀, 陈足音. 新兴污染物对微藻的毒性作用与机制研究进展[J]. 生态毒理学报, 2019, 14(5): 22-45
Hong Y, Hao L C, Chen Z Y. Research progress on the toxic effects of emerging pollutants on microalgae and the mechanisms [J]. Asian Journal of Ecotoxicology, 2019, 14(5): 22-45 (in Chinese)
[19] 孟磊, 杨兵, 薛南冬. 氟喹诺酮类抗生素环境行为及其生态毒理研究进展[J]. 生态毒理学报, 2015, 10(2): 76-88
Meng L, Yang B, Xue N D. A review on environmental behaviors and ecotoxicology of fluoroquinolone antibiotics [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 76-88 (in Chinese)
[20] 邹高龙, 刘志文, 董洁平, 等. 环丙沙星在污水处理过程中的迁移转化及对污水生物处理的影响[J]. 环境科学学报, 2019, 39(2): 308-317
Zou G L, Liu Z W, Dong J P, et al. The transformation of ciprofloxacin in wastewater treatment and its impact on wastewater treatment [J]. Acta Scientiae Circumstantiae, 2019, 39(2): 308-317 (in Chinese)
[21] Guillard R. Culture of Phytoplankton for Feeding Marine Invertebrates [M]// Smith W L, Chanley M H. Culture of Marine Invertebrate Animals. New York: Plenum Press, 1975: 29-60
[22] Amorim C L, Moreira I S, Maia A S, et al. Biodegradation of ofloxacin, norfloxacin, and ciprofloxacin as single and mixed substrates by Labrys portucalensis F11 [J]. Applied Microbiology and Biotechnology, 2014, 98(7): 3181-3190
[23] Bai X L, Acharya K. Algae-mediated removal of selected pharmaceutical and personal care products (PPCPs) from Lake Mead water [J]. The Science of the Total Environment, 2017, 581-582: 734-740
[24] 李霞, 陈菊芳, 聂湘平, 等. 盐酸环丙沙星在不同模拟水体中的降解与残留[J]. 中山大学学报: 自然科学版, 2010, 49(3): 102-106
Li X, Chen J F, Nie X P, et al. Degradation and residue of ciprofloxacin in different simulated water bodies [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010, 49(3): 102-106 (in Chinese)
[25] 朱小燕, 傅大放, 邓琳, 等. 小球藻引发水中环丙沙星的光降解效能研究[J]. 中国环境科学, 2013, 33(4): 663-668
Zhu X Y, Fu D F, Deng L, et al. Efficiency of ciprofloxacin photodegradation induced by chlorella in aqueous solutions [J]. China Environmental Science, 2013, 33(4): 663-668 (in Chinese)
[26] Wei X X, Chen J W, Xie Q, et al. Distinct photolytic mechanisms and products for different dissociation species of ciprofloxacin [J]. Environmental Science & Technology, 2013, 47(9): 4284-4290
[27] Chen Q H, Zhang L, Han Y H, et al. Degradation and metabolic pathways of sulfamethazine and enrofloxacin in Chlorella vulgaris and Scenedesmus obliquus treatment systems [J]. Environmental Science and Pollution Research, 2020, 27(22): 28198-28208
[28] Leng L J, Wei L, Xiong Q, et al. Use of microalgae based technology for the removal of antibiotics from wastewater: A review [J]. Chemosphere, 2020, 238: 124680
[29] Qiang Z M, Adams C. Potentiometric determination of acid dissociation constants (pKa) for human and veterinary antibiotics [J]. Water Research, 2004, 38(12): 2874-2890
[30] Torniainen K, Tammilehto S, Ulvi V. The effect of pH, buffer type and drug concentration on the photodegradation of ciprofloxacin [J]. International Journal of Pharmaceutics, 1996, 132(1-2): 53-61
[31] Salma A, Thoröe-Boveleth S, Schmidt T C, et al. Dependence of transformation product formation on pH during photolytic and photocatalytic degradation of ciprofloxacin [J]. Journal of Hazardous Materials, 2016, 313: 49-59
[32] Tran N A T, Seymour J R, Siboni N, et al. Photosynthetic carbon uptake induces autoflocculation of the marine microalga Nannochloropsis oculata [J]. Algal Research, 2017, 26: 302-311
[33] Wu Y, Gao K, Riebesell U. CO2-induced seawater acidification affects physiological performance of the marine diatom Phaeodactylum tricornutum [J]. Biogeosciences, 2010, 7(73): 2915-2923
[34] Bitaubé Pérez E, Caro Pina I, Pérez Rodríguez L. Kinetic model for growth of Phaeodactylum tricornutum in intensive culture photobioreactor [J]. Biochemical Engineering Journal, 2008, 40(3): 520-525
[35] 叶丽, 蒋霞敏, 毛欣欣, 等. 温、光、盐对三角褐指藻紫外诱变株生长、总脂及脂肪酸的影响[J]. 生态学杂志, 2015, 34(2): 454-462
Ye L, Jiang X M, Mao X X, et al. Effects of temperature, light intensity and salinity on the growth, total lipid and fatty acid of Phaeodactylum tricornutum mutant [J]. Chinese Journal of Ecology, 2015, 34(2): 454-462 (in Chinese)
[36] Lepetit B, Gélin G, Lepetit M, et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis [J]. The New Phytologist, 2017, 214(1): 205-218
[37] Geider R J, Osbonie B A, Raven J A. Growth, photosynthesis and maintenance metabolic cost in the diatom Phaeodactylum tricornutum at very low light levels 1 [J]. Journal of Phycology, 1986, 22(1): 39-48
[38] Nur M M A, Muizelaar W, Boelen P, et al. Environmental and nutrient conditions influence fucoxanthin productivity of the marine diatom Phaeodactylum tricornutum grown on palm oil mill effluent [J]. Journal of Applied Phycology, 2019, 31(1): 111-122
[39] 连鹏, 葛利云, 邓欢欢, 等. 两种喹诺酮类抗生素对亚心形扁藻的毒性效应研究[J]. 环境科学与管理, 2014, 39(5): 46-48
Lian P, Ge L Y, Deng H H, et al. Toxic effects of two quinolone antibiotics on Platymonas subcordiformis [J]. Environmental Science and Management, 2014, 39(5): 46-48 (in Chinese)
[40] 刘滨扬. 红霉素、环丙沙星和磺胺甲噁唑对羊角月牙藻的毒性效应及其作用机理[D]. 广州: 暨南大学, 2011: 71
Liu B Y. Toxic effects and its mechanism of erythromycin, ciprofloxacin and sulfamethoxazole to Selenastrum capricornutum [D]. Guangzhou: Jinan University, 2011: 71 (in Chinese)