近年来,随着经济的快速发展,人们对磷化工产品的需求日益增加,磷化工已成为我国国民经济的重要支柱产业。然而,磷化工在生产过程中产生的磷(P)、氟(F)、砷(As)和镉(Cd)等污染物易经大气沉降、废水排放及地表径流等途径进入周边水环境,致使区域水环境质量恶化,并对水生生物构成潜在威胁[1-2]。因此,开展磷化工区水环境的生物毒性效应评估对正确认识磷化工污染的生态风险具有重要意义。
斑马鱼(Danio rerio)属于辐鳍亚纲(Actinopterygii)、鲤形目(Cypriniformes)、鲤科(Cyprinidae)、短担尼鱼属(Danio),是一种小型热带淡水硬骨鱼类。具有产卵量大、易饲养、对毒物刺激较敏感、基因与人类高度同源等特点,是国际标准化组织(International Organization for Standardization, ISO)推荐的生态环境测试模式生物,广泛应用于环境毒性评价研究中[3]。
当生物受到环境污染物胁迫时,体内自由基产生增多,进而引起氧化应激和氧化损伤。因此,可将生物体内抗氧化酶、抗氧化小分子和脂质过氧化产物等作为反映生物氧化应激的标志物,有效预测环境中污染物的生物效应及毒理学特征[4]。但由于不同生物标志物对环境污染物的敏感程度存在差异,且对污染物胁迫的响应并不同步,因此,采用单一生物标志物评价污染物毒性效应存在一定局限性[5]。整合生物标志物响应指数(integrated biomarker response, IBR)可将不同生物标志物进行综合分析,能更有效地评价水环境的毒性作用[6],已被广泛应用于工业污染对鱼类毒性效应评估的研究[7-9],但关于采用IBR综合评估磷化工区水环境污染对鱼类毒性影响的研究未见报道。
基于此,本研究以某磷化工厂周边溪流水体为研究对象,以斑马鱼为受试生物,探讨在该溪流水体不同暴露时间下斑马鱼肝脏、鳃组织中超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD)活性及丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)含量变化情况,并运用IBR模型综合评价该溪流水体对斑马鱼的毒性效应,以期为区域水环境污染及风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料与仪器
1.1.1 实验生物及其驯养
斑马鱼购于贵阳某花鸟市场,体长为(2±1) cm,体质量为(0.3±0.1) g。将斑马鱼置于玻璃水族箱中驯养14 d,驯养期间斑马鱼死亡率低于5%。驯养与实验各项条件保持一致,用水均为充分曝气的自来水,pH值7±0.5,温度(23±1) ℃,溶解氧(DO)≥4 mg·L-1;光暗周期为t(光)∶t(暗)=12 h∶12 h;每天早晚喂食2次,及时清除粪便及食物残渣。驯养结束后随机挑选身体健壮、反应灵敏、大小基本一致且无明显疾病和畸形的斑马鱼用于实验。
1.1.2 仪器与试剂
多功能酶标仪(Multiskan GO,美国Thermo Scientific公司);微量高速冷冻型离心机(Z216MK,德国HERMLE Labortechnik GmbH公司);超声细胞破碎仪(JXFSTPRP-64,上海净信实业发展有限公司,中国)考马斯亮蓝总蛋白(TP)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、过氧化物酶(POD)试剂盒、丙二醛(MDA)试剂盒和谷胱甘肽(GSH)试剂盒均购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 水样暴露实验
实验分为空白对照组(充分曝气的自来水)和处理组(4 ℃保存的磷化工区溪流原水样),每组随机放入驯养后斑马鱼60尾,每组设3个平行。选用体积为10 L的玻璃鱼缸,每个鱼缸溶液总体积为8 L。试验期间24 h连续曝气,水温为22~24 ℃。每24 h更换试验液1次,每天早晚喂食2次。
1.2.2 样品的制备
实验开始后,分别于7、14、21和28 d在每组随机选取数尾鱼冷冻麻醉后进行解剖,迅速取出肝脏和鳃并去除表面附带的结缔组织,在4 ℃生理盐水中漂洗干净,用滤纸拭干表面水分,称取约0.1 g组织样品,按1∶9质量体积比(m∶V)加入预冷生理盐水作为匀浆介质,在冰水浴条件下,用匀浆器制成10%组织匀浆液。在4 ℃、2 500 r·min-1下离心10 min,取上清液用于酶活性测定。
1.2.3 生化指标的测定
SOD通过黄嚷吟及黄嚷吟氧化酶反应产生超氧阴离子自由基,后者与胺盐可形成亚硝酸盐,在显色剂的作用下呈现紫红色,在450 nm处可测定其吸光度值。SOD酶活性单位为U·mg-1protein。
CAT分解H2O2的反应可通过钼酸铵而中止,剩余的H2O2与钼酸铵作用产生淡黄色的络合物,可在405 nm处测定其生成量,由此计算H2O2的反应量,计算CAT活性。CAT酶活性单位为U·mg-1protein。
POD通过催化H2O2的反应,测定420 nm处吸光度的变化得出其酶活性。POD酶活性单位为U·mg-1protein。
MDA与硫代巴比妥酸(TBA)反应生成红棕色产物,在532 nm处有最大吸收峰,可测定此波长处吸光度值,计算得出MDA含量。MDA含量单位为nmol·mg-1protein。
GSH利用二硫代二硝基苯甲酸与巯基化合物反应时能产生一种黄色化合物,在420 nm处通过比色定量测定其吸光度值,计算得出GSH含量。GSH含量单位为mg·g-1protein。
测试步骤严格按照各试剂盒说明书进行。试验中每组每个指标测定设3个重复。
1.3 IBR指数评价
计算某一指标在某一时间点的平均值(xi)及某一指标在所有时间点的总平均值![]() 和标准差(s),最后采用公式
和标准差(s),最后采用公式![]() 对每个时间点的平均值(xi)进行均一化处理。
对每个时间点的平均值(xi)进行均一化处理。
根据污染胁迫后该标志物的生物活性是否被激活,若是,令Z=Y,反之,令Z=-Y。|Xmin|表示每个时间点中该标志物均一化数据最小值的绝对值。每个时间点的生物标志物得分(S)计算公式为S=Z+|Xmin|。
绘制星状图,计算其面积:星状图中各辐射线的长度即为每个指标的Si值,每一组别的IBR为所构成星状图面积(即图中由相邻指标的辐射线所构成的三角形面积(Ai)之和),计算见式(1)~(3):
(1)
(2)
(3)
式中:n为所选用的生物标志物总数,∂为相邻两辐射线的夹角,∂=2π/n,Sn+1=S1。
1.4 数据处理与分析
应用SPSS 22.0软件对数据进行统计分析。若数据服从正态分布,采用独立样本T检验对处理组和对照组进行差异分析,反之,采用非参数检验进行分析,P<0.05、P<0.01表明差异显著。采用Origin 8.0软件进行图形绘制。
2 结果(Results)
2.1 溪流水体对斑马鱼肝脏、鳃SOD活性的影响
如图1所示,斑马鱼暴露7 d时,与对照组相比,处理组肝脏SOD活性显著升高(P<0.01),此时肝脏SOD活性达最大,是对照组的1.26倍,随着暴露时间的持续,肝脏SOD活性的上调作用有所缓解。鳃SOD活性变化趋势与肝脏相似,与对照组相比,在第7天时处理组鳃SOD活性显著升高(P<0.01),是对照组的1.72倍,随着暴露时间的延长,鳃SOD活性的上调作用有所缓解。
2.2 溪流水体对斑马鱼肝脏、鳃CAT活性的影响
如图2所示,斑马鱼暴露7 d时,与对照组相比,处理组肝脏CAT活性显著升高(P<0.01),此时肝脏CAT活性达最大,是对照组的1.82倍,随着暴露时间的持续,肝脏CAT活性的促进效应有所降低,但仍高于对照组水平(P<0.01)。鳃CAT活性变化趋势与肝脏较为相似,与对照组相比,在第7天时处理组鳃CAT活性显著升高(P<0.01),是对照组的2.67倍,随着暴露时间的延长,鳃CAT活性的促进效应有所降低,但仍高于对照组水平(P<0.05)。
2.3 溪流水体对斑马鱼肝脏、鳃POD活性的影响
如图3所示,斑马鱼暴露7 d后,与对照组相比,处理组肝脏POD活性升高,但差异不显著(P>0.05);随着暴露时间的持续,肝脏POD活性的促进效应有所降低,在第28天时处理组肝脏POD活性较对照组显著性降低(P<0.05),此时,POD活性水平下降至对照组的26.92%。鳃POD活性变化趋势与肝脏较为相似,与对照组相比,在第7天时处理组鳃POD活性显著升高(P<0.01),是对照组的2.17倍,随着暴露时间的延长,鳃POD活性的促进效应有所降低,但仍高于对照组水平(P<0.01)。
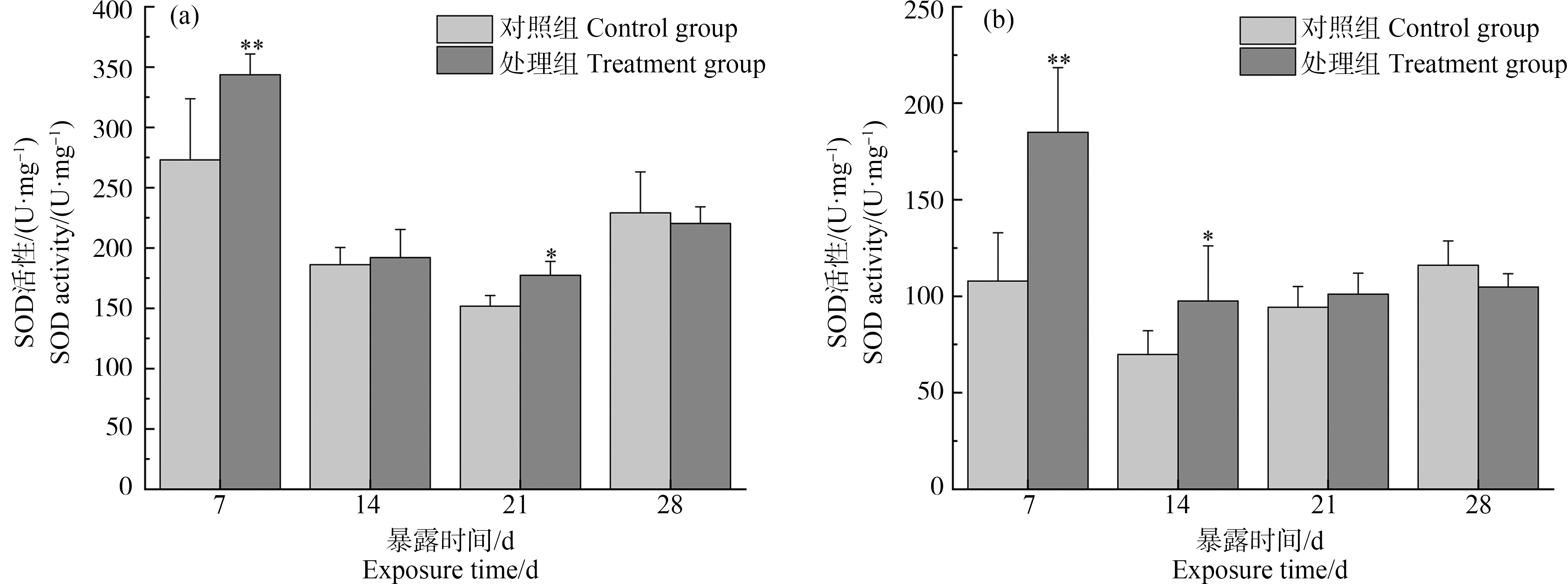
图1 斑马鱼肝脏(a)、鳃(b)超氧化物歧化酶(SOD)活性变化情况
注:与对照组相比(*P<0.05,**P<0.01)。
Fig. 1 Changes of superoxide dismutase (SOD) activity in liver (a) and gill (b) of zebrafish
Note: Compare with the control (*P<0.05, **P<0.01).
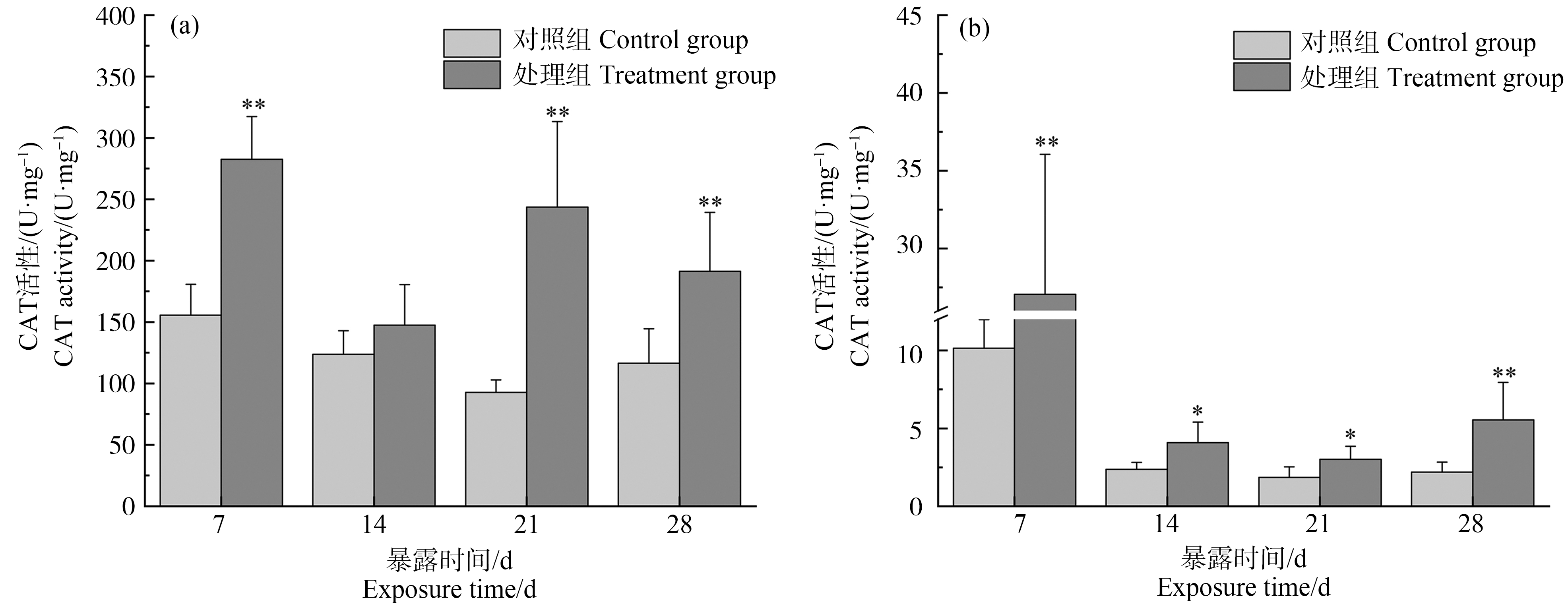
图2 斑马鱼肝脏(a)、鳃(b)过氧化氢酶(CAT)活性变化情况
注:与对照组相比(*P<0.05,**P<0.01)。
Fig. 2 Changes of catalase (CAT) activity in liver (a) and gill (b) of zebrafish
Note: Compare with the control (*P<0.05, **P<0.01).
2.4 溪流水体对斑马鱼肝脏、鳃MDA含量的影响
如图4所示,暴露7 d后,与对照组相比,处理组肝脏MDA含量出现显著性降低(P<0.05),此时,MDA含量水平下降至对照组的16.43%,随着暴露时间的持续,肝脏MDA含量逐渐恢复到对照组水平。暴露7 d后,与对照组相比,处理组鳃MDA含量显著升高(P<0.05),此时鳃中MDA含量达最大,是对照组的1.26倍,随着暴露时间的延长,鳃中MDA含量逐渐呈现降低趋势。
2.5 溪流水体对斑马鱼肝脏、鳃GSH含量的影响
如图5所示,暴露7 d后,与对照组相比,处理组肝脏GSH含量无显著变化(P>0.05),随着暴露时间的持续,GSH含量出现一定降低,直到第28天有所回升,但仍低于对照组水平(P<0.05)。暴露7 d后,与对照组相比,处理组鳃GSH含量显著升高(P<0.01),是对照组的1.93倍,随着暴露时间的延长,GSH含量逐渐下降,直到第28天时显著低于对照组水平(P<0.05),此时,GSH含量水平下降至对照组的23.62%。

图3 斑马鱼肝脏(a)、鳃(b)过氧化物酶(POD)活性的变化
注:与对照组相比(*P<0.05,**P<0.01)。
Fig. 3 Changes of peroxidase (POD) activity in liver (a) and gill (b) of zebrafish
Note: Compare with the control (*P<0.05, **P<0.01).
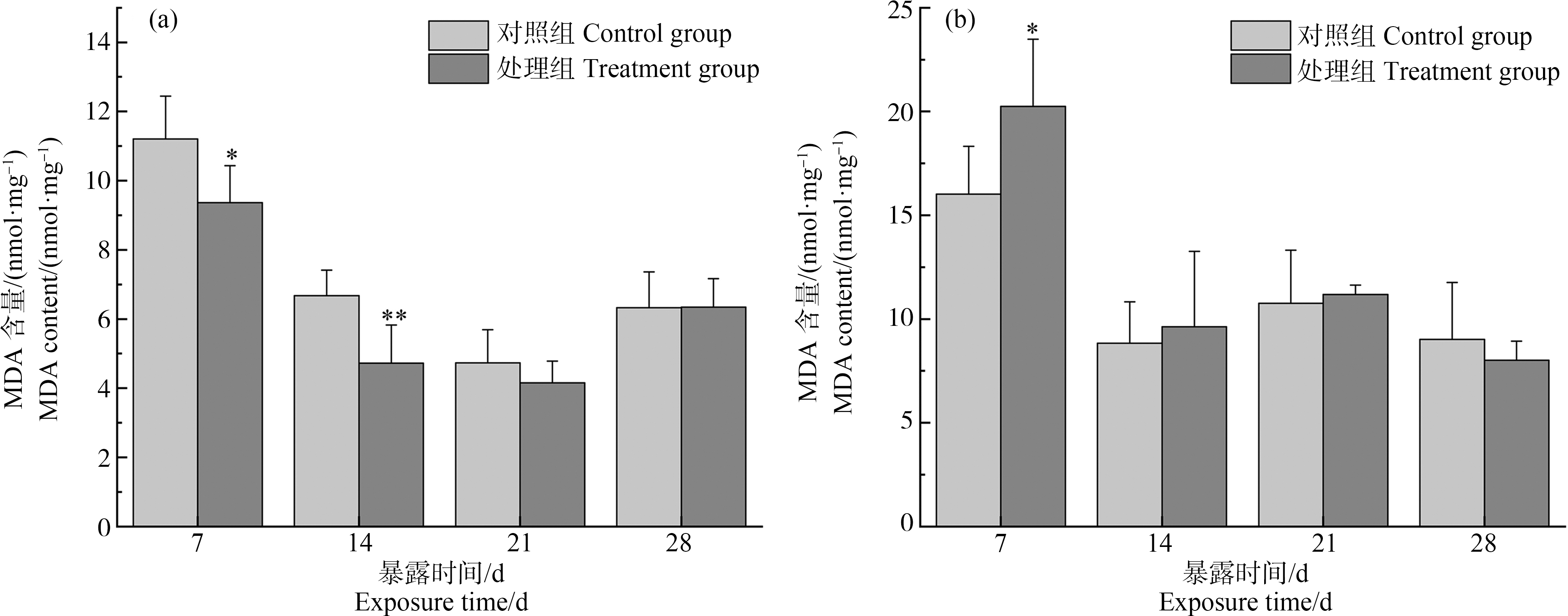
图4 斑马鱼肝脏(a)、鳃(b)丙二醛(MDA)含量的变化
注:与对照组相比(*P<0.05,**P<0.01)。
Fig. 4 Changes of malondialdehyde (MDA) content in liver (a) and gill (b) of zebrafish
Note: Compare with the control (*P<0.05, **P<0.01).
2.6 IBR指数
在溪流水体胁迫下,不同暴露时间点的斑马鱼肝脏、鳃的IBR分析结果如图6和图7所示。星状图中5个方向轴分别代表5种生物标志物(SOD、CAT、POD、MDA和GSH),该5种生物标志物的响应所构成的星状图面积即为IBR值。星状图面积越大,表明污染物对生物体的毒性效应越大。在不同暴露时间,处理组肝脏、鳃组织中5种生物标志物受到诱导或抑制。结合IBR模型分析可见:与对照组相比,处理组肝脏组织在7 d和14 d时星状图覆盖面积更大,鳃组织在7 d和28 d时星状图覆盖面积更大,提示溪流水体不同时间胁迫对肝脏、鳃组织产生的毒性存在差异,表明在磷化工区溪流水体胁迫下,不同时间点斑马鱼肝脏、鳃对外界刺激产生防御应激的敏感性不同。
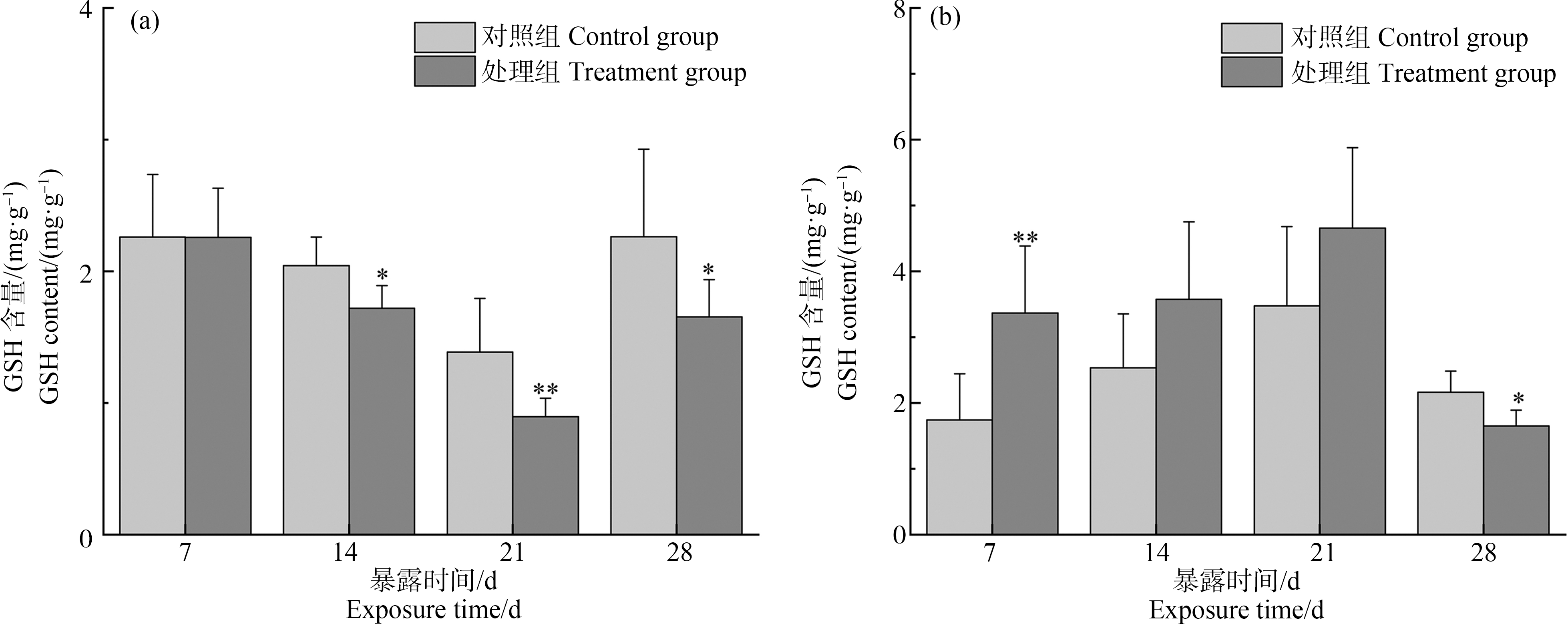
图5 斑马鱼肝脏(a)、鳃(b)谷胱甘肽(GSH)含量的变化
注:与对照组相比(*P<0.05,**P<0.01)。
Fig. 5 Changes of glutathione (GSH) content in liver (a) and gill (b) of zebrafish
Note: Compare with the control (*P<0.05, **P<0.01).

图6 溪流水体胁迫下斑马鱼肝脏整合生物标志物响应指数(IBR)星状图
Fig. 6 Integrated biomarker response (IBR) index of zebrafish liver under stream water stress
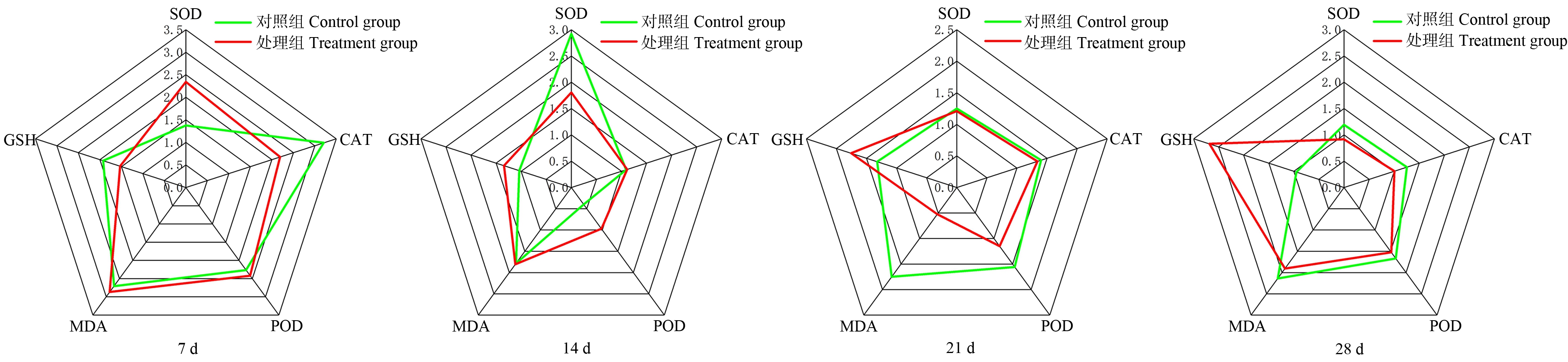
图7 溪流水体胁迫下斑马鱼鳃IBR星状图
Fig. 7 IBR of zebrafish gill under stream water stress
从时间-效应分析(图8)可知,与对照组相比,处理组斑马鱼肝脏组织IBR值总体呈现先升高后降低的变化趋势,在7 d时达到峰值,为14.76;处理组鳃组织IBR值总体呈现先降低后升高的变化趋势,在7 d时达到峰值,为13.82,表明当磷化工区溪流水体胁迫至7 d时,对斑马鱼肝脏、鳃组织的毒性作用最强。就不同组织来看(图9),磷化工区溪流水体对5种生物标志物的影响具有组织器官特异性,处理组肝脏IBR值为33.98,鳃IBR值为30.6,表现为肝脏>鳃,表明磷化工区溪流水体对斑马鱼肝脏产生的影响大于鳃。
3 讨论(Discussion)
当生物体受到污染物胁迫时,机体正常代谢中活性氧自由基(ROS)的动态平衡被打破,产生大量超氧阴离子自由基![]() 过氧化氢(H2O2)和羟自由基(·OH),机体产生氧化应激,SOD、CAT、POD和GSH等酶类及小分子做出迅速响应并通过联合作用组成机体的抗氧化防御系统,对产生的过量ROS进行清除[10-11]。此外,MDA作为脂质过氧化产物,当机体内ROS过量积累时,过量ROS会对组织造成氧化损伤,MDA含量也会随之升高或降低[12]。因此,这些物质常作为环境污染的早期诊断生物标志物[13]。
过氧化氢(H2O2)和羟自由基(·OH),机体产生氧化应激,SOD、CAT、POD和GSH等酶类及小分子做出迅速响应并通过联合作用组成机体的抗氧化防御系统,对产生的过量ROS进行清除[10-11]。此外,MDA作为脂质过氧化产物,当机体内ROS过量积累时,过量ROS会对组织造成氧化损伤,MDA含量也会随之升高或降低[12]。因此,这些物质常作为环境污染的早期诊断生物标志物[13]。

图8 溪流水体胁迫下斑马鱼肝脏(a)和鳃(b)的IBR随时间的变化
Fig. 8 Changes of IBR with time in the liver (a) and gill (b) of zebrafish under stream water stress
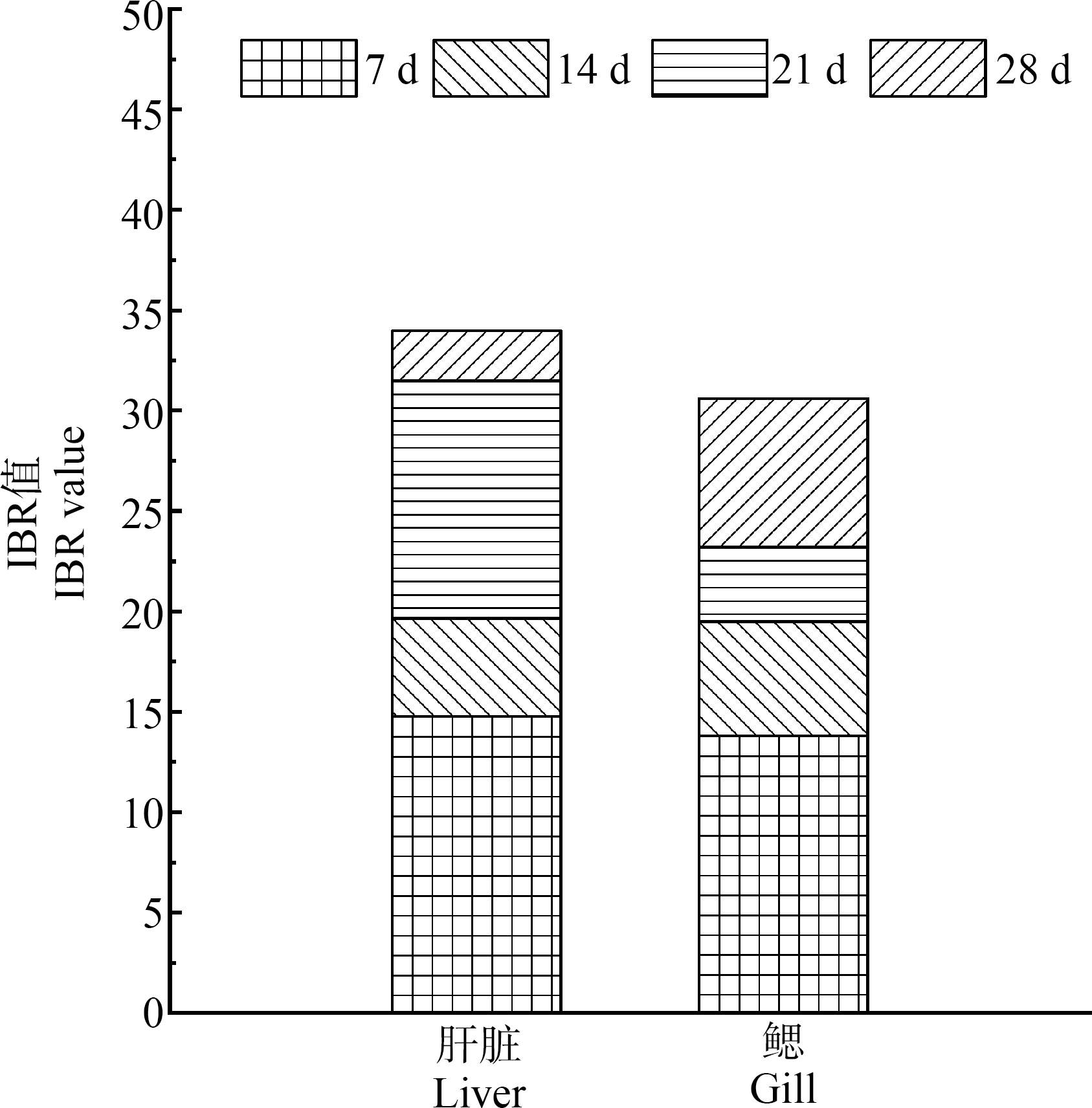
图9 溪流水体不同胁迫时间下处理组斑马
鱼肝脏和鳃的IBR
Fig. 9 The IBR value in the liver and gill of zebrafish under stream water stress after different time
SOD是机体内重要的抗氧化酶,其能将![]() 歧化成H2O2和O2,从而有效清除
歧化成H2O2和O2,从而有效清除![]() 降低自由基对蛋白质、脂质和DNA等生物大分子的损伤,并加强机体内过量脂质过氧化物的分解,是机体抗氧化系统的第一道防线[14-15]。本研究中斑马鱼肝脏和鳃组织中SOD活性先迅速升高后恢复到正常水平,说明斑马鱼暴露于磷化工区溪流水体后,作为机体抗氧化系统第一道防线的SOD快速响应,SOD活性迅速升高,阻止过量的自由基对机体造成损伤;但随着暴露时间的延长,斑马鱼抗氧化防御系统其他成分介入,机体调控系统发挥作用使其恢复至正常水平[16]。这种先升高后降低的现象与武晨虹[17]的研究结果一致。
降低自由基对蛋白质、脂质和DNA等生物大分子的损伤,并加强机体内过量脂质过氧化物的分解,是机体抗氧化系统的第一道防线[14-15]。本研究中斑马鱼肝脏和鳃组织中SOD活性先迅速升高后恢复到正常水平,说明斑马鱼暴露于磷化工区溪流水体后,作为机体抗氧化系统第一道防线的SOD快速响应,SOD活性迅速升高,阻止过量的自由基对机体造成损伤;但随着暴露时间的延长,斑马鱼抗氧化防御系统其他成分介入,机体调控系统发挥作用使其恢复至正常水平[16]。这种先升高后降低的现象与武晨虹[17]的研究结果一致。
CAT可促使SOD歧化产生的H2O2进一步分解为O2和H2O,阻止·OH的生成,是使生物体内细胞免受H2O2毒害的一类抗氧化酶[18]。本研究中,处理组斑马鱼肝脏、鳃组织CAT活性呈现先显著性升高后降低的趋势,符合Stebbing[19]提出的“毒物兴奋效应”,即短暂的溪流水体胁迫后,刺激了机体的抗氧化系统,使其发挥功能从而清除体内的H2O2,但随着胁迫时间的延长,生物体内蓄积污染物增多,抗氧化系统受到损伤,CAT活性的促进效应有所降低[20-21]。
POD通常以同功酶的形式参与机体的抗氧化防御作用,其能催化H2O2与氢供给体之间的氧化反应,从而分解有毒物质H2O2,具有比CAT更高的H2O2亲和力,是提高机体免疫解毒能力的重要因子[22]。本研究结果显示,肝脏、鳃组织中POD活性整体呈现先升高后降低的变化趋势,与王庆伟[23]研究重金属及三苯基锡(TPT)、五氯酚(PCP)对斑马鱼POD活性影响趋势一致。有研究表明,在生物体受到轻度污染胁迫时,会诱导POD活性升高来抵御外界刺激,但在污染胁迫超过生物体抵御能力,POD活性会受到抑制[24]。本研究中,斑马鱼体内污染物的蓄积量随着在磷化工区溪流水中暴露时间的延长而增加。因此,随着斑马鱼体内污染物含量的增加,POD活性表现为先升高后降低的趋势。
MDA是脂质过氧化作用最终代谢产物之一,可导致细胞凋亡甚至损害器官功能。生物体内MDA含量可反映机体内脂质过氧化的程度,是细胞膜系统受损伤的指标之一[25]。本研究结果显示,在磷化工区溪流水体暴露早期,与对照组相比,斑马鱼鳃中MDA含量显著升高,而肝脏MDA含量显著降低,其可能是由于肝脏作为解毒器官,响应更加迅速,在暴露早期,抗氧化系统其他组分增强对ROS的清除能力,未明显造成肝脏组织脂质过氧化程度加深[26-27]。
GSH是生物体内广泛存在的一种过氧化物分解酶,是重要的ROS清除剂,其含量变化与酶类抗氧化剂的活性紧密相关。在生物体受到污染物胁迫时,GSH活性与抗氧化酶一样,可呈现出诱导或抑制现象[28]。本研究中,肝脏、鳃组织中GSH变化趋势与MDA类似,这可能除与肝脏的解毒作用有关外,另一方面可能因为GSH可同时与谷胱甘肽转移酶(GST)、谷胱甘肽过氧化物酶(GPX)等其他抗氧化酶相互协调共同调控机体氧化应激状态[29-30],当鳃组织中利用GSH作为还原性底物来清除H2O2的抗氧化活性被显著抑制时,GSH消耗量减少。这与余晓玲[31]的研究结果一致。
外源污染物胁迫对各种酶活性抑制或诱导效应表现不一,且不同酶对污染物刺激的敏感程度存在差异,时间响应不同步。若仅考虑单一酶活性,尚不能很好地定量评价其毒性效应。IBR模型可将不同生物指标的联合生物效应进行量化,通过将各种酶以及其他生物标志物结合分析,能较准确客观地评估水环境的毒性作用[17],从而弥补单一酶活性不能定量直观评价等缺点[5,15],已被广泛应用于定量评价污染胁迫对生物的综合影响研究中[7, 32]。本研究采用IBR模型评价方法对斑马鱼肝脏和鳃组织中SOD、CAT、POD、MDA和GSH 5个指标进行整合分析,发现在磷化工区溪流水体胁迫下,斑马鱼肝脏、鳃组织产生了明显的应激响应,且斑马鱼不同组织在不同暴露时间对该水体的毒性响应存在差异。就整体的时间效应来看,肝脏组织、鳃组织IBR指数峰值均出现在第7天,说明抗氧化系统相关酶类和小分子是较为敏感的生物标志物,后期大部分生物标志物活性逐渐恢复或接近对照水平,IBR指数出现一定幅度的下降。这一趋势与蒋玫等[4]利用IBR模型评价0号柴油对黑鲷的毒性效应中IBR值变化规律一致。就不同组织来看,总体上IBR值表现为肝脏大于鳃,说明磷化工区溪流水体对肝脏的影响更大,这可能是由于与鳃组织相比,肝脏组织是生物体受到污染时的主要解毒和代谢器官,也是有毒有害物质的首要靶器官[33]。综上可见,斑马鱼体内SOD、CAT、POD、MDA和GSH等氧化应激生物标志物在磷化工区溪流水体胁迫下出现应答,表明磷化工区溪流水体具有一定生物毒性,磷化工污染的水生生态风险应受到关注。
[1] 程馨, 施泽明, 张成江, 等. 贵州开阳磷矿开采对洋水河水体重金属污染与评价[J]. 中国环境监测, 2015, 31(2): 78-83
Cheng X, Shi Z M, Zhang C J, et al. Evaluation of heavy metals pollution to Yangshui River in mining of phosphate rock of Kaiyang phosphate mine in Guizhou [J]. Environmental Monitoring in China, 2015, 31(2): 78-83 (in Chinese)
[2] 王萍, 刘静, 朱健, 等. 岩溶山区磷石膏堆场重金属迁移对耕地质量的影响及污染风险管控[J]. 水土保持通报, 2019, 39(4): 294-299
Wang P, Liu J, Zhu J, et al. Impacts of heavy metal migration on quality of cultivated land and control of pollution risk in phosphogypsum yard in Karst Mountain area [J]. Bulletin of Soil and Water Conservation, 2019, 39(4): 294-299 (in Chinese)
[3] Jia W, Mao L G, Zhang L, et al. Effects of two strobilurins (azoxystrobin and picoxystrobin) on embryonic development and enzyme activities in juveniles and adult fish livers of zebrafish (Danio rerio) [J]. Chemosphere, 2018, 207: 573-580
[4] 蒋玫, 李磊, 沈新强, 等. 基于整合生物标志物响应指数评价0号柴油对黑鲷(Sparusmacrocephalus)的毒性效应[J]. 生态与农村环境学报, 2015, 31(2): 230-237
Jiang M, Li L, Shen X Q, et al. IBR index-based assessment of toxicity of No.0 diesel fuel to Sparusmacrocephalus [J]. Journal of Ecology and Rural Environment, 2015, 31(2): 230-237 (in Chinese)
[5] Jiao Y Q, Tao Y, Yang Y, et al. Monobutyl phthalate (MBP) can dysregulate the antioxidant system and induce apoptosis of zebrafish liver [J]. Environmental Pollution, 2020, 257: 113517
[6] Zheng Q, Feng M B, Dai Y. Comparative antioxidant responses in liver of Carassiusauratus exposed to phthalates: An integrated biomarker approach [J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 741-749
[7] Samanta P, Im H, Na J, et al. Ecological risk assessment of a contaminated stream using multi-level integrated biomarker response in Carassiusauratus[J]. Environmental Pollution, 2018, 233: 429-438
[8] Oliveira M, Ahmad I, Maria V L, et al. Monitoring pollution of coastal lagoon using Liza aurata kidney oxidative stress and genetic endpoints: An integrated biomarker approach [J]. Ecotoxicology, 2010, 19(4): 643-653
[9] Javed M, Ahmad M I, Usmani N, et al. Multiple biomarker responses (serum biochemistry, oxidative stress, genotoxicity and histopathology) in Channapunctatus exposed to heavy metal loaded waste water [J]. Scientific Reports, 2017, 7(1): 1-11
[10] Stara A, Machova J, Velisek J. Effect of chronic exposure to simazine on oxidative stress and antioxidant response in common carp (Cyprinuscarpio L.) [J]. Environmental Toxicology and Pharmacology, 2012, 33(2): 334-343
[11] Jena K B, Verlecar X N, Chainy G B N. Application of oxidative stress indices in natural populations of Pernaviridis as biomarker of environmental pollution [J]. Marine Pollution Bulletin, 2009, 58(1): 107-113
[12] 罗妮娜. 新型消毒副产物碘代乙酸急性暴露诱导斑马鱼肝脏氧化损伤的机理研究[J]. 环境科学学报, 2016, 36(8): 3088-3094
Luo N N. Oxidative damage mechanism of zebrafish (Danio rerio) liver tissue after acute exposure to iodine acetic acid in vivo [J]. Acta Scientiae Circumstantiae, 2016, 36(8): 3088-3094 (in Chinese)
[13] Broeg K, Lehtonen K K. Indices for the assessment of environmental pollution of the Baltic Sea coasts: Integrated assessment of a multi-biomarker approach [J]. Marine Pollution Bulletin, 2006, 53(8-9): 508-522
[14] Kelly K A, Havrilla C M, Brady T C, et al. Oxidative stress in toxicology: Established mammalian and emerging piscine model systems [J]. Environmental Health Perspectives, 1998, 106(7): 375-384
[15] 迟潇, 陈碧鹃, 孙雪梅, 等. 基于IBR模型研究BDE-47和BDE-153对半滑舌鳎的毒性效应[J]. 生态毒理学报, 2020, 15(4): 192-202
Chi X, Chen B J, Sun X M, et al. Toxic effects of BDE-47 and BDE-153 on Cynoglossussemilaevis Gunther based on IBR model [J]. Asian Journal of Ecotoxicology, 2020, 15(4): 192-202 (in Chinese)
[16] 张景飞, 王晓蓉. 2,4-二氯苯酚低浓度长期暴露对鲫鱼肝脏抗氧化系统的影响[J]. 环境科学, 2003, 24(5): 136-140
Zhang J F, Wang X R. Effects of long-term exposure of low-level 2,4-dichlorophenol on the antioxidant defense system in liver of Carassiusauratus [J]. Environmental Science, 2003, 24(5): 136-140 (in Chinese)
[17] 武晨虹. 生物标志物法判别抗生素废水毒性及其生态风险评价研究[D]. 石家庄: 河北科技大学, 2013:17-21
Wu C H. Study on the toxicity and ecological risk assessment of antibiotic wastewater using biomarkers [D]. Shijiazhuang: Hebei University of Science and Technology, 2013:17-21 (in Chinese)
[18] 于德玲, 王昌留. 过氧化氢酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(2): 189-194
Yu D L, Wang C L. Progresses in the research of catalase [J]. Chinese Journal of Histochemistry and Cytochemistry, 2016, 25(2): 189-194 (in Chinese)
[19] Stebbing A R D. Hormesis: The stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(3): 213-234
[20] 刘迎, 姜蕾, 潘波, 等. 丙草胺对斑马鱼抗氧化酶系统的影响[J]. 农药, 2017, 56(4): 285-287
Liu Y, Jiang L, Pan B, et al. Effects of pretilachlor on the antioxidant enzyme system of zebrafish [J]. Agrochemicals, 2017, 56(4): 285-287 (in Chinese)
[21] 沙婧婧, 王悠,王鸿, 等. 2种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫单一和联合毒性效应研究[J]. 中国海洋大学学报: 自然科学版, 2015, 45(9): 69-77
Sha J J, Wang Y, Wang H, et al. Study on single and joint toxic effects of two PBDEs (BDE-47, BDE-209)on rotifer Brachionusplicatilis[J]. Periodical of Ocean University of China, 2015, 45(9): 69-77 (in Chinese)
[22] Jovanovic Z S, Milosevic J D, Radovic S R. Antioxidative enzymes in the response of buckwheat (Fagopyrumesculentum Moench) to ultraviolet B radiation [J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9472-9478
[23] 王庆伟. 重金属、TPT和PCP对斑马鱼单一和联合毒性作用[D]. 青岛: 青岛科技大学, 2011:51-53
Wang Q W. Single and joint toxicity effects of heavy metals, TPT and PCP on Brachydaniorerio (zebrafish) [D]. Qingdao: Qingdao University of Science & Technology, 2011:51-53 (in Chinese)
[24] 焦传珍. 铈对镉染毒泥鳅肝胰脏中超氧化物歧化酶和过氧化物酶活性的影响[J]. 水产科学, 2009, 28(12): 786-788
Jiao C Z. The effect of cerium on SOD and POD activities in hepatopancreas of oriental weatherfish (Misgurnusanguillicaudatus) stressed by cadmium [J]. Fisheries Science, 2009, 28(12): 786-788 (in Chinese)
[25] Al-Bairuty G A, Shaw B J, Handy R D, et al. Histopathological effects of waterborne copper nanoparticles and copper sulphate on the organs of rainbow trout (Oncorhynchus mykiss) [J]. Aquatic Toxicology, 2013, 126: 104-115
[26] Ni H, Peng L, Gao X G, et al. Effects of maduramicin on adult zebrafish (Danio rerio): Acute toxicity, tissue damage and oxidative stress [J]. Ecotoxicology and Environmental Safety, 2019, 168: 249-259
[27] Sun H J, Zhao W J, Teng X Q, et al. Antioxidant responses and pathological changes in the gill of zebrafish (Danio rerio) after chronic exposure to arsenite at its reference dose [J]. Ecotoxicology and Environmental Safety, 2020, 200: 110743
[28] di Giulio R T, Washburn P C, Wenning R J, et al. Biochemical responses in aquatic animals: A review of determinants of oxidative stress [J]. Environmental Toxicology and Chemistry, 1989, 8(12): 1103-1123
[29] Srikanth K, Pereira E, Duarte A C, et al. Glutathione and its dependent enzymes’ modulatory responses to toxic metals and metalloids in fish: A review [J]. Environmental Science and Pollution Research International, 2013, 20(4): 2133-2149
[30] Jin Y X, Zhang X X, Shu L J, et al. Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish (Danio rerio) [J]. Chemosphere, 2010, 78(7): 846-852
[31] 余晓玲. 猪场废水中四环素类抗生素对斑马鱼抗氧化效应毒理研究[D]. 南昌: 南昌大学, 2019:38-43
Yu X L. Toxicological study on antioxidant effects of tetracycline antibiotics on zebrafish in swine wastewater [D]. Nanchang: Nanchang University, 2019:38-43 (in Chinese)
[32] 陈海刚, 巩秀玉, 张喆, 等. 六溴环十二烷暴露对红鳍笛鲷脑乙酰胆碱酯酶和组织氧化应激的影响及评价[J]. 生态毒理学报, 2016, 11(3): 243-250
Chen H G, Gong X Y, Zhang Z, et al. Evaluation on effects of hexabromocyclododecane on acetylcholinesterase and oxidative stress in the brain of juvenile crimson snapper (Lutjanuserythopterus) [J]. Asian Journal of Ecotoxicology, 2016, 11(3): 243-250 (in Chinese)
[33] Dane H,  i
i man T. Histopathological changes in gill and liver of Capoetacapoeta living in the Karasu River, Erzurum [J]. Environmental Toxicology, 2015, 30(8): 904-917
man T. Histopathological changes in gill and liver of Capoetacapoeta living in the Karasu River, Erzurum [J]. Environmental Toxicology, 2015, 30(8): 904-917