草甘膦是一种内吸传导型广谱灭生性有机磷类除草剂,在农业生产及市政养护中应用较广。田间果园杀灭杂草时,每公顷用10%草甘膦水剂7.5~22.5 kg,兑水300~450 kg。河道清障(如清除水葫芦及芦苇)时,每公顷用10%草甘膦水剂15 kg兑水1 125 kg[1]或10%草甘膦水剂45 kg兑水600 kg[2]。经配制,施药时药液中草甘膦的浓度约为1.3~7.5 g·L-1。草甘膦等农药可通过地表径流、喷雾漂移等方式进入地表水。在我国云南哈尼梯田稻鱼共作系统中,水体草甘膦残留浓度为6.55~153.82 μg·L-1,检出率为100%[3]。江苏省太湖水域草甘膦最大残留浓度为19.097 μg·L-1,检出率为22.2%[4]。浙江省饮用水源中草甘膦最大残留浓度为5.930 μg·L-1,检出率为27.6%[5]。草甘膦在农业及非农业区域的广泛使用对水生生态系统存在潜在风险。研究发现,草甘膦可影响浮游动物卵库孵化[6]、改变大型溞的行为[7]、增加日本青鳉鱼鱼苗的发育异常率[8]。此外,草甘膦可降低浮萍(Lemna minor)生长速率,抑制叶绿素a、叶绿素b和类胡萝卜素的合成[9],减少槐叶苹(Salvinia cucullata)过氧化氢酶活性及根系活力[10],对藻类生长存在毒物兴奋效应[11]等。
目前,草甘膦水生生物毒性的研究对象主要为鱼类、溞类和藻类等,草甘膦沉水植物毒性方面的研究较少[12]。沉水植物是水生态系统的初级生产者,在维持湖泊清水稳态和改善养殖池塘水质中具有重要作用,已被越来越多地应用于水域生态修复、园林造景和水产养殖等方面。池塘、沟渠和湖泊沿岸等“浅水系统”是沉水植物的主要生境,也是较易受到农药污染的区域。为了解草甘膦除草剂对沉水植物的毒性效应,以常见沉水植物苦草为受试对象,研究了草甘膦对苦草种子萌发及幼苗生长的影响。
1 材料与方法(Materials and methods)
1.1 试验材料
供试苦草种子(纯度≥98%)购自湖北鑫大叶牧草种业有限公司,试验用草甘膦(纯度≥95%)购自南京杜莱生物技术有限公司。主要仪器:上海尤尼柯4802 UV/VIS紫外可见分光光度计,广东珠江牌LRH-300G光照培养箱,上海安亭飞鸽LXJ-IIB离心机,宁波新芝S10型手提式高速匀浆机等。
1.2 试验设计
按几何级差设置7个草甘膦处理组(0.05、0.20、0.80、3.20、12.80、51.20和204.80 mg·L-1)及1个对照组,每组设3个平行。筛选大小一致,颗粒饱满的苦草种子,用蒸馏水荡洗数次,在塑料组培瓶中加入500 mL由10%(V∶V)霍格兰营养液配制的草甘膦溶液,每组放置种子100粒,于恒温光照培养箱(光照周期L∶D=12 h∶12 h、温度20 ℃)中培养21 d。以种子在组培瓶中培养24 h记为第1天,前14 d每日固定时间以胚根露白为准记录发芽数,第21天记录幼苗成活数及幼苗形态特征,对幼苗根长、叶长、鲜质量、可溶性蛋白质含量、总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性、丙二醛(MDA)含量和叶绿体色素含量进行测定。
1.3 测定方法
发芽率=发芽种子数/供试种子总数×100%;成活率=幼苗成活数/发芽种子数×100%;抑制率=(对照值-处理值)/对照值×100%。草甘膦对苦草幼苗根长、叶长、鲜质量的半数抑制浓度由线性刻度坐标,以抑制率为纵坐标,草甘膦浓度为横坐标,采用直线内插法[13]计算。
苦草幼苗抗氧化酶(SOD、CAT、POD)活性和MDA含量的测定参考林静雯等[14]的方法,采用95%乙醇浸提法[15]测定幼苗叶片叶绿体色素含量,考马斯亮蓝G-250染色法[16]测定幼苗可溶性蛋白质含量。
1.4 数据处理
试验数据以平均值±标准差表示,采用Microsoft Excel 2016和Origin 2019b进行数据处理及绘图,采用SPSS 26.0进行单因素方差分析和多重比较。
2 结果(Results)
2.1 草甘膦对苦草种子萌发及幼苗生长的影响
如图1所示,草甘膦处理组苦草种子发芽率在第1天和第2天时略低于对照组,但第3天时51.20 mg·L-1和204.80 mg·L-1草甘膦处理组发芽率明显升高,且高于对照组。第7天至第9天,草甘膦处理组与对照组间发芽率的差异开始显现,除12.80 mg·L-1处理组外,其他处理组的发芽率均高于对照组。随着培养时间的延长,苦草种子发芽率增长速率逐渐减缓并趋于稳定,第14天时各组发芽率大小依次为处理组51.20 mg·L-1>0.80 mg·L-1>3.20 mg·L-1>12.80 mg·L-1>0.20 mg·L-1>0.05 mg·L-1>204.80 mg·L-1>对照组,其中51.20 mg·L-1处理组发芽率显著高于对照组(P<0.05)。

图1 草甘膦对苦草种子发芽率的影响
Fig. 1 Effects of glyphosate on germination rate of Vallisneria natans seed
如图2所示,处理21 d后,0.05~12.8 mg·L-1草甘膦处理组幼苗平均成活率均>80.0%,与对照组相比差异不显著(P>0.05),但51.20 mg·L-1和204.80 mg·L-1草甘膦处理组幼苗成活率分别为(2.1±1.8)%和0.0%,显著低于对照组(P<0.05)。
由图3和图4可知,苦草幼苗叶长、根长和鲜质量随草甘膦浓度的增加总体呈先升高后降低的趋势。草甘膦对苦草幼苗生长存在低剂量促进和高剂量抑制的双相剂量效应。0.05~12.80 mg·L-1草甘膦处理组苦草幼苗均有真叶形成,其中0.05~3.20 mg·L-1草甘膦处理组幼苗根长、叶长与对照组差异不显著(P>0.05),0.8 mg·L-1处理组幼苗鲜质量显著高于对照组(P<0.05),当草甘膦浓度为12.80 mg·L-1时幼苗生长受到抑制,出现主根变短症状,根长显著低于对照组(P<0.05)。随着草甘膦浓度的升高,幼苗生长受到严重抑制,51.20 mg·L-1草甘膦处理组苦草幼苗仅形成短小的子叶和根,204.80 mg·L-1草甘膦处理组种子仅露出胚根且种皮未脱落。采用直线内插法,由抑制率曲线求得草甘膦处理21 d后苦草幼苗根长、叶长和鲜质量的半数抑制浓度分别为13.28、25.57和35.53 mg·L-1,根长对草甘膦胁迫最为敏感。

图2 草甘膦对苦草幼苗成活率的影响
注:采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 2 Effects of glyphosate on survival rate ofVallisneria natans seedling
Note: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
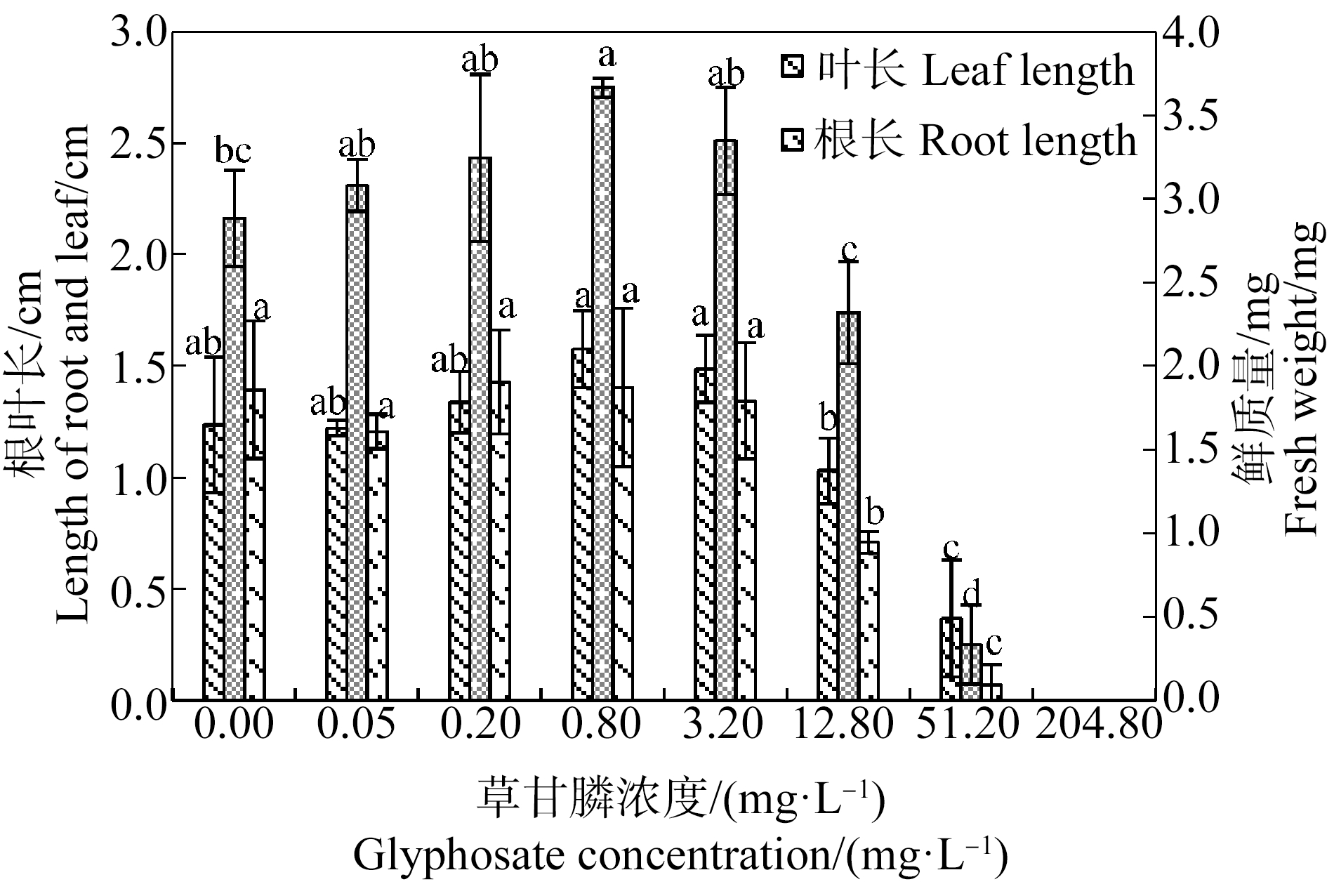
图3 草甘膦对苦草幼苗根长、叶长和鲜质量的影响
注:采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 3 Effects of glyphosate on root length, leaf length and fresh weight of Vallisneria natans seedling
Note: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).

图4 第21天时对照组和草甘膦处理组苦草幼苗形态
注:(a) 对照组;(b) 0.05 mg·L-1;(c) 0.20 mg·L-1;(d) 0.80 mg·L-1;(e) 0.32 mg·L-1;(f) 12.80 mg·L-1;(g) 51.20 mg·L-1;(h) 204.80 mg·L-1。
Fig. 4 Seedling morphology of Vallisneria natans in control and treatment group on the 21st day
Note: (a) Control group; (b) 0.05 mg·L-1; (c) 0.20 mg·L-1; (d) 0.80 mg·L-1; (e) 0.32 mg·L-1; (f) 12.80 mg·L-1; (g) 51.20mg·L-1; (h) 204.80 mg·L-1.
2.2 草甘膦对苦草幼苗可溶性蛋白质的影响
可溶性蛋白质是植物体内重要的渗透调节物质,有助于维持细胞正常代谢,促进细胞渗透势和功能蛋白数量的增加,提高植物的抗逆性[17]。如图5所示,对照组和处理组间苦草幼苗可溶性蛋白质含量无显著差异,但随草甘膦浓度的增加其含量有升高趋势。
2.3 草甘膦对苦草幼苗抗氧化酶活性及丙二醛含量的影响
SOD、CAT和POD是植物体内的保护酶,可清除植物细胞内的活性氧(ROS),减少细胞的氧化损伤[16]。如图6所示,处理21 d后草甘膦处理组SOD总活性与对照组间差异不显著,3.2 mg·L-1和12.8 mg·L-1处理组SOD总活性显著高于0.8 mg·L-1草甘膦处理组(P<0.05)。CAT活性随处理组草甘膦浓度的升高有上升趋势,但处理组和对照组间无显著差异。除0.20 mg·L-1草甘膦处理组POD活性显著低于对照组(P<0.05)外,其他处理组POD活性与对照组差异不显著。MDA是细胞膜脂质过氧化产物,其含量可反映植物遭受逆境伤害的程度[16]。由图7可知,0.05、0.20和3.20 mg·L-1草甘膦处理组MDA含量显著低于对照组,0.80 mg·L-1和12.80 mg·L-1草甘膦处理组MDA含量与对照组差异不显著。总体上,处理21 d后苦草幼苗抗氧化酶(SOD、CAT、POD)活性及MDA含量在草甘膦胁迫下与对照组相比未见显著升高,植物细胞膜未受到明显的氧化损伤。
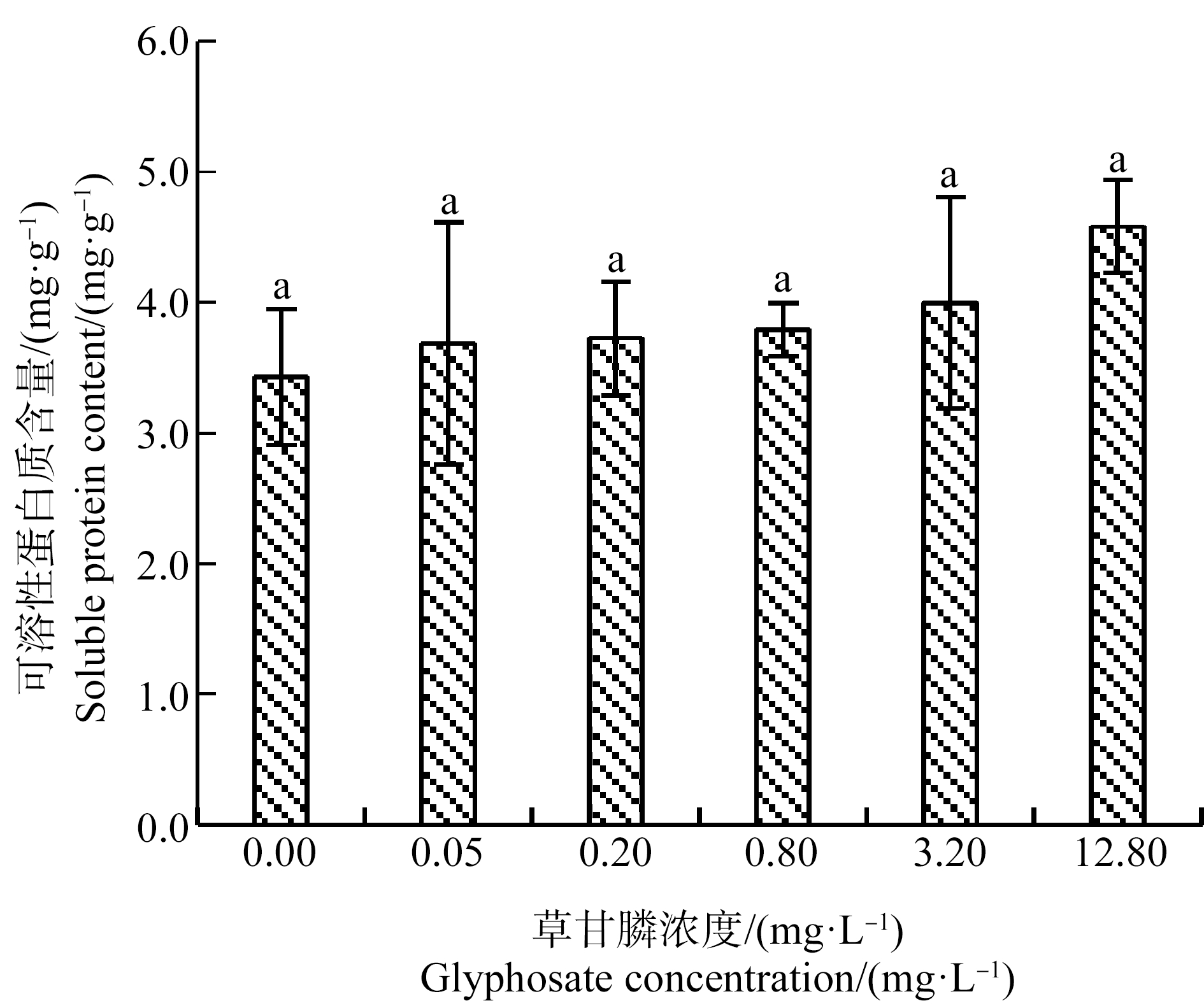
图5 草甘膦对苦草幼苗可溶性蛋白质含量的影响
注:采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 5 Effect of glyphosate on soluble protein content ofVallisneria natans seedling
Note: Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).

图6 草甘膦对苦草幼苗抗氧化酶活性的影响
注:SOD、CAT和POD分别表示超氧化物歧化酶、过氧化氢酶和过氧化物酶;采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 6 Effects of glyphosate on antioxidant enzyme activities of Vallisneria natans seedling
Note: SOD, CAT and POD are abbreviations of superoxide dismutase, catalase and peroxidase respectively, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).

图7 草甘膦对苦草幼苗MDA含量的影响
注:MDA表示丙二醛;采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 7 Effect of glyphosate on MDA content ofVallisneria natans seedling
Note: MDA is the abbreviation of malondialdehyde, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
2.5 草甘膦对苦草幼苗叶绿体色素含量的影响
草甘膦对苦草幼苗叶绿体色素含量存在低剂量促进作用。如图8所示,苦草幼苗叶绿体色素含量总体随草甘膦浓度的增加呈先上升后下降的趋势。0.20 mg·L-1草甘膦处理组叶绿素a和叶绿素b含量较高,显著高于0.05、3.20和12.80 mg·L-1草甘膦处理组(P<0.05)。0.80 mg·L-1草甘膦处理组类胡萝卜素含量较高,显著高于对照组以及0.05 mg·L-1和12.80 mg·L-1草甘膦处理组(P<0.05)。除12.80 mg·L-1草甘膦处理组叶绿素a含量显著低于对照组(P<0.05)外,其他处理组叶绿体色素含量与对照组差异不显著(P>0.05)。

图8 草甘膦对苦草幼苗叶片叶绿体色素含量的影响
注:Chla、Chlb和Car分别表示叶绿素a、叶绿素b和类胡萝卜素;采用Duncan法进行多重比较,标有相同字母者表示该指标组间差异不显著(P>0.05),标有不同字母者表示组间差异显著(P<0.05)。
Fig. 8 Effects of glyphosate on chloroplast pigment content of Vallisneria natans seedling
Note: Chla, Chlb and Car are abbreviations of chlorophyll a, chlorophyll b and carotenoid respectively, and Duncan method was used for multiple comparisons; the same letters indicated no significant difference between groups (P>0.05), while different letters indicated significant difference between groups (P<0.05).
3 讨论(Discussion)
生物体具有生理调节功能,暴露于低剂量毒物时,能保持机体的相对稳定。随着暴露水平的提高,生物体处于代偿状态,机体结构和功能发生变化。当剂量超出生物体的代偿能力,可导致代偿失调,引起病理性损伤,剂量继续升高则可导致生物体死亡[18]。研究发现,草甘膦可刺激苦草种子萌发,第14天时草甘膦处理组苦草种子发芽率均高于对照组,其中51.20 mg·L-1处理组发芽率显著高于对照组(P<0.05)。草甘膦可能通过影响苦草线粒体电子传递链,诱导体内过氧化氢(H2O2)累积,间接刺激苦草种子的萌发。Gomes和Juneau[19]研究发现草甘膦可抑制线粒体电子传递链中电子在复合体Ⅲ上的传递,引起浮萍(Lemna minor L.)体内H2O2的积累。H2O2是ROS的一种,有很强的氧化能力,高浓度ROS对生物功能分子有破坏作用,低浓度ROS可作为信号分子,参与细胞增殖、分化、凋亡以及对逆境的适应[20]。文景锜等[21]研究发现,外源添加H2O2可促进燕麦种子萌发。ROS对种子萌发的促进作用与其参与种子胚乳弱化、休眠解除等生理过程有关[22]。
处理21 d后,0.05~12.40 mg·L-1草甘膦处理组幼苗成活率与对照组差异不显著(P>0.05),但51.20 mg·L-1和204.80 mg·L-1草甘膦处理组幼苗成活率显著低于对照组(P<0.05)。草甘膦对幼苗的生长抑制及其导致的植物自养失败可能是51.20 mg·L-1和204.80 mg·L-1草甘膦处理组幼苗死亡的原因。种子萌发经历从异养到自养的过程。萌发时,种子中贮藏的有机物在酶的作用下水解为糖、氨基酸等营养物质供幼胚(苗)生长。随着幼苗叶片的形成,植物通过光合作用制造自身所需的物质进行自养[20]。草甘膦可抑制5-烯醇丙酮莽草酸-3-磷酸合酶(EPSPS)的活性,使莽草酸途径中芳香族氨基酸合成受阻,干扰植物生长所需的蛋白质的合成[23]。如图4所示,51.20 mg·L-1和204.80 mg·L-1草甘膦处理组苦草幼苗生长受到抑制,未能发育出可以进行光合作用的叶片,种子中贮藏的有机物耗尽后,无法通过光合作用进行自养,最终因缺乏营养物质而死亡。
草甘膦对苦草幼苗叶长、鲜质量和叶绿体色素含量存在低剂量促进、高剂量抑制的双相剂量效应,即毒物兴奋效应(hormesis)。草甘膦是一种广谱灭生性除草剂,但其在低剂量下多表现出对植物的生长刺激[24]。Xu等[25]研究发现,铜绿微囊藻的生长速率和光合作用活性在草甘膦暴露下呈现出典型的毒物兴奋效应,低剂量草甘膦胁迫下铜绿微囊藻光合作用相关蛋白上调,光合活性增加。Khan等[26]研究发现,低剂量草甘膦可诱导番茄幼苗叶片中叶绿体的伸长,提高幼苗光合作用速率,对幼苗苗高和干质量有促进作用。低剂量草甘膦胁迫下,苦草幼苗可能通过增加叶绿体色素含量,提高光合作用速率,促进植株生长。此外,Agathokleous等[27]研究认为,外源性压力对植物产生的hormesis效应可能与植物内源性双相压力机制有关。植物体内的ROS具有双相剂量效应,ROS水平的少量增加在维持生理功能时可起到信号分子的作用,并参与氧化还原生物学过程,但高水平的ROS会引起氧化应激造成脂质、蛋白质和DNA的损伤[28]。Choudhary等[29]研究发现,ROS可促进细胞的增殖和分化,调控植物的生长和发育过程。由于草甘膦会抑制线粒体电子传递导致H2O2的积累[18],低剂量草甘膦对苦草幼苗叶长、鲜质量和叶绿体色素含量的促进作用可能与植物体内ROS的调控有关。
0.05~12.80 mg·L-1草甘膦处理组苦草幼苗可溶性蛋白质含量与对照组无显著差异,但随草甘膦浓度的升高有上升趋势。植物可通过积累可溶性蛋白质增强对草甘膦胁迫的适应能力和抗性[17]。逆境胁迫下抗氧化酶系统会产生适应性诱导反应以清除机体内过量的ROS。当ROS的产生超出抗氧化酶系统的清除能力,抗氧化酶活性会受到抑制,过量的ROS会导致膜脂质过氧化产物MDA的累积,并引起细胞的氧化损伤[20]。处理21 d后,0.05~12.80 mg·L-1草甘膦处理组苦草幼苗抗氧化酶(SOD、CAT、POD)活性和MDA含量与对照组相比未见显著升高。有研究发现,随着草甘膦处理时间的延长,马唐抗氧化酶活性及MDA含量呈先升高后降低的趋势,第12天时,450、900和1 800 g·hm-2草甘膦处理组马唐MDA含量和POD活性均降至对照水平[30]。在抗草甘膦大豆幼苗中也观察到类似现象,处理17 d后,在正常水分条件下,0.00~0.92 kg·hm-2草甘膦处理组和对照组间抗草甘膦大豆幼苗抗氧化酶活性差异不显著(P>0.05)[31]。这表明,一定浓度下草甘膦对植物造成的氧化胁迫可随处理时间的延长得到缓解。苦草幼苗可能通过生理调节如增加光合作用速率和积累可溶性蛋白等渗透调节物质缓解逆境胁迫,提高了幼苗对草甘膦的耐受性。
本研究中,苦草幼苗根长、叶长和鲜质量的21 d半数抑制浓度分别为13.28、25.57和35.53 mg·L-1,草甘膦浓度为51.2 mg·L-1和204.80 mg·L-1时可显著降低幼苗成活率。由于草甘膦田间施药时药液中草甘膦的浓度约为1.3~7.5 g·L-1,在近岸或直接向水体施用草甘膦可能对苦草生长存在潜在风险。Geng等[32]对我国甘肃、广西、河北、吉林、江苏、辽宁、内蒙古和四川8个省(自治区)的76个地点共196个地表水样品进行了检测,草甘膦的检出率为14.3%,最大残留浓度32.49 μg·L-1。此外,草甘膦在云南哈尼梯田鱼稻共作系统[3]、江苏太湖[4]、浙江饮用水源地[5]的最大残留浓度分别为153.82、19.10和5.93 μg·L-1。研究发现,0.05~3.20 mg·L-1草甘膦处理组苦草种子发芽率、幼苗成活率、幼苗根长、叶长与对照组差异不显著,并观察到低剂量草甘膦对苦草幼苗叶长、鲜质量和叶绿素含量存在促进作用。鉴于我国地表水中草甘膦残留水平普遍低于0.20 mg·L-1,草甘膦对苦草的毒性效应以低剂量促进作用为主,其对沉水植物苦草的生态风险可以接受。一些研究发现,草甘膦对藻类也存在“低促高抑”现象。暴露于质量浓度为10~1 000 μg·L-1草甘膦制剂下的金藻在指数生长期具有较高的丰度[33]。草甘膦浓度为2.4~228.2 μg·L-1时对四尾栅藻细胞密度和最大光能转化效率(Fv/Fm)表现出显著的刺激作用[34]。水环境中低剂量草甘膦可能促使藻类大量繁殖形成水华,对水生态系统存在潜在风险。由于苦草在低剂量草甘膦暴露下生长状况良好,或可通过种植苦草等沉水植物以营养竞争的方式抑制藻类生长。
综上所述,本研究结果表明,草甘膦对苦草种子萌发有一定的促进作用,但高剂量草甘膦可抑制幼苗生长,影响叶片发育,降低幼苗存活率。草甘膦对幼苗根长、叶长和鲜质量的21 d半数抑制浓度分别为13.28、25.57和35.53 mg·L-1,根长对草甘膦胁迫较为敏感。草甘膦对苦草生长及叶绿体色素含量存在低剂量促进、高剂量抑制的双相剂量效应。一定程度上,苦草幼苗可通过生理调节缓解草甘膦胁迫。
[1] 杨登友, 李克才, 叶小富, 等. 除草剂可杀灭河道水葫芦[J]. 新农村, 2003(9): 10
[2] 辛华荣. 草甘膦灭除行洪河道芦苇障碍浅析[J]. 江苏水利科技, 1994(2): 57-59
[3] 张石云, 宋超, 张敬卫, 等. 哈尼梯田稻鱼共作系统中除草剂的污染特征[J]. 环境科学与技术, 2018, 41(S1): 184-192
Zhang S Y, Song C, Zhang J W, et al. Occurrence of herbicides in rice fish system at Honghe Hani Terrace fields [J]. Environmental Science& Technology, 2018, 41(S1): 184-192 (in Chinese)
[4] 范瑾煜. 水环境中低浓度草甘膦及制剂对鲫鱼的毒性效应研究[D]. 南京: 南京大学, 2013: 54-56
Fan J Y. The toxicological effects of low concentration of glyphosate and its Roundup formulation in aquatic environment on Carassius auratus [D]. Nanjing: Nanjing University, 2013: 54-56 (in Chinese)
[5] 王静, 刘铮铮, 许行义, 等. 浙江省饮用水源有机毒物污染特征及健康风险研究[J]. 环境污染与防治, 2010, 32(7): 29-33
Wang J, Liu Z Z, Xu X Y, et al. Study on pollution pattern and health risk of organic toxicants in Zhejiang source water [J]. Environmental Pollution& Control, 2010, 32(7): 29-33 (in Chinese)
[6] Gutierrez M F, Battauz Y, Caisso B. Disruption of the hatching dynamics of zooplankton egg banks due to glyphosate application [J]. Chemosphere, 2017, 171: 644-653
[7] Hansen L R, Roslev P. Behavioral responses of juvenile Daphnia magna after exposure to glyphosate and glyphosate-copper complexes [J]. Aquatic Toxicology, 2016, 179: 36-43
[8] Smith C M, Vera M K M, Bhandari R K. Developmental and epigenetic effects of Roundup and glyphosate exposure on Japanese medaka (Oryzias latipes) [J]. Aquatic Toxicology, 2019, 210: 215-226
[9] Sikorski  , Baciak M,
, Baciak M, ![]() A, et al. The effects of glyphosate-based herbicide formulations on Lemna minor, a non-target species [J]. Aquatic Toxicology, 2019, 209: 70-80
A, et al. The effects of glyphosate-based herbicide formulations on Lemna minor, a non-target species [J]. Aquatic Toxicology, 2019, 209: 70-80
[10] Yu H W, Peng J F, Cao X F, et al. Effects of microplastics and glyphosate on growth rate, morphological plasticity, photosynthesis, and oxidative stress in the aquatic species Salvinia cucullata [J]. Environmental Pollution, 2021, 279: 116900
[11] 张哲, 王江涛, 谭丽菊. 草甘膦对旋链角毛藻和盐生杜氏藻的毒性兴奋效应[J]. 生态毒理学报, 2010, 5(5): 685-691
Zhang Z, Wang J T, Tan L J. Stimulation effect of glyphosate on Chaetoceros curvisetus and Dunallelia salina [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 685-691 (in Chinese)
[12] 沈路遥, 彭自然, 戴智. 草甘膦水生生物毒性、环境行为、检测方法研究进展[J]. 农药, 2020, 59(1): 6-10, 33
Shen L Y, Peng Z R, Dai Z. Advances in aquatic biotoxicity, environmental behavior and detection of glyphosate [J]. Agrochemicals, 2020, 59(1): 6-10, 33 (in Chinese)
[13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 化学农药环境安全评价试验准则 第14部分: 藻类生长抑制试验: GB/T 31270.14—2014 [S]. 北京: 中国标准出版社, 2014
State General Administration of the People’s Republic of China for Quality Supervision and Inspection and Quarantine, Standardization Administration of the People’s Republic of China. Test Guidelines on Environmental Safety Assessment for Chemical Pesticides-Part14: Alga Growth Inhibition Test: GB/T 31270.14—2014 [S]. Beijing: Standards Press of China, 2014 (in Chinese)
[14] 林静雯, 李莹, 罗洁文, 等. 草甘膦对杉木种子萌发及幼苗生长的毒性效应[J]. 江西农业大学学报, 2015, 37(5): 843-848, 858
Lin J W, Li Y, Luo J W, et al. Toxic effect of glyphosate on seed germination and seedling growth of Chinese fir [J]. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(5): 843-848, 858 (in Chinese)
[15] 刘念. 草甘膦和铜单一及联合胁迫对漂浮植物槐叶萍的毒性效应研究[D]. 武汉: 武汉大学, 2019: 11
Liu N. Separate and combined effects of glyphosate and copper on growth and antioxidative enzymes in Salvinia natans [D]. Wuhan: Wuhan University, 2019: 11 (in Chinese)
[16] 张治安, 陈展宇. 植物生理学实验技术[M]. 长春: 吉林大学出版社, 2008: 110-111
[17] 易冕, 张饮江, 董悦, 等. 3种沉水植物对镉的生理特性响应[J]. 安全与环境学报, 2013, 13(1): 9-14
Yi M, Zhang Y J, Dong Y, et al. Physiological response of the three submerged macrophytes to the five cadmium concentrations [J]. Journal of Safety and Environment, 2013, 13(1): 9-14 (in Chinese)
[18] 何增耀, 叶兆杰, 吴方正, 等. 农业环境科学概论[M]. 上海: 上海科学技术出版社, 1991: 435
[19] Gomes M P, Juneau P. Oxidative stress in duckweed (Lemna minor L.) induced by glyphosate: Is the mitochondrial electron transport chain a target of this herbicide? [J]. Environmental Pollution, 2016, 218: 402-409
[20] 潘瑞炽. 植物生理学[M]. 7版. 北京: 高等教育出版社, 2012: 237-323
[21] 文景锜, 陈仕勇, 柏晓玲, 等. H2O2处理对3种高寒燕麦种子萌发和幼苗生长的影响[J]. 种子, 2020, 39(10): 86-88, 93
Wen J Q, Chen S Y, Bai X L, et al. Effects of H2O2 treatment on seed germination and seedling growth of three kinds of alpine oat [J]. Seed, 2020, 39(10): 86-88, 93 (in Chinese)
[22] 强妮花, 惠伟. 活性氮、活性氧及植物激素在种子休眠解除中的作用及相互关系研究进展[J]. 植物生理学报, 2011, 47(7): 655-660
Qiang N H, Hui W. Research progress on the role and correlations of reactive nitrogen species (RNS), reactive oxygen species(ROS) and plant hormones in seed dormancy [J]. Plant Physiology Journal, 2011, 47(7): 655-660 (in Chinese)
[23] 陈世国, 强胜, 毛婵娟. 草甘膦作用机制和抗性研究进展[J]. 植物保护, 2017, 43(2): 17-24
Chen S G, Qiang S, Mao C J. Mechanism of action of glyphosate and research advances in glyphosate resistance [J]. Plant Protection, 2017, 43(2): 17-24 (in Chinese)
[24] Brito I P, Tropaldi L, Carbonari C A, et al. Hormetic effects of glyphosate on plants [J]. Pest Management Science, 2018, 74(5): 1064-1070
[25] Xu S J, Liu Y, Zhang J, et al. Proteomic mechanisms for the combined stimulatory effects of glyphosate and antibiotic contaminants on Microcystis aeruginosa [J]. Chemosphere, 2021, 267: 129244
[26] Khan S, Zhou J L, Ren L, et al. Effects of glyphosate on germination, photosynthesis and chloroplast morphology in tomato [J]. Chemosphere, 2020, 258: 127350
[27] Agathokleous E, Kitao M, Calabrese E J. Hormesis: A compelling platform for sophisticated plant science [J]. Trends in Plant Science, 2019, 24(4): 318-327
[28] Mittler R. ROS are good [J]. Trends in Plant Science, 2017, 22(1): 11-19
[29] Choudhary A, Kumar A, Kaur N. ROS and oxidative burst: Roots in plant development [J]. Plant Diversity, 2020, 42(1): 33-43
[30] 夏爱莲, 金晨钟, 胡一鸿, 等. 草甘膦胁迫对马唐抗氧化酶系及丙二醛含量的影响研究[J]. 湖南农业科学, 2016(11): 24-26, 30
Xia A L, Jin C Z, Hu Y H, et al. Influences of herbicide glyphosate on antioxidant enzyme system and MDA content of Digitaria sanguinalis [J]. Hunan Agricultural Sciences, 2016(11): 24-26, 30 (in Chinese)
[31] 原向阳, 郭平毅, 张丽光, 等. 干旱胁迫下草甘膦对抗草甘膦大豆幼苗保护酶活性及脂质过氧化作用的影响[J]. 中国农业科学, 2010, 43(4): 698-705
Yuan X Y, Guo P Y, Zhang L G, et al. Glyphosate and post-drought rewatering on protective enzyme activities and membrane lipid peroxidation in leaves of glyphosate-resistant soybean [Glycine max (L.) merr.] seedlings [J]. Scientia Agricultura Sinica, 2010, 43(4): 698-705 (in Chinese)
[32] Geng Y, Jiang L J, Zhang D Y, et al. Glyphosate, aminomethylphosphonic acid, and glufosinate ammonium in agricultural groundwater and surface water in China from 2017 to 2018: Occurrence, main drivers, and environmental risk assessment [J]. The Science of the Total Environment, 2021, 769: 144396
[33] 孙凯峰, 王娜, 刘莉莉, 等. 基于四尾栅藻响应的有机磷农药生态风险评估[J]. 中国环境科学, 2013, 33(5): 868-873
Sun K F, Wang N, Liu L L, et al. Ecological risks assessment of organophosphorus pesticides based on response of Scenedesmus quadricanda [J]. China Environmental Science, 2013, 33(5): 868-873 (in Chinese)
[34] Dabney B L, Pati o R. Low-dose stimulation of growth of the harmful alga, Prymnesium parvum, by glyphosate and glyphosate-based herbicides [J]. Harmful Algae, 2018, 80: 130-139
o R. Low-dose stimulation of growth of the harmful alga, Prymnesium parvum, by glyphosate and glyphosate-based herbicides [J]. Harmful Algae, 2018, 80: 130-139