近年来,随着药物在农业、水产养殖业和人类医疗中大量频繁地使用[1-2],自然水体中药物污染物对非目标水生生物的生态风险引起社会各界的广泛关注。卡马西平(carbamazepine,CBZ)是临床上治疗癫痫、双向情感障碍和三叉神经痛的常用药物[3],在我国的年消费量可达78 t[4]。由于CBZ的大量使用,且在大多数污水处理厂中的去除率较低(<10%)[5-6],CBZ在地表水中广泛被检出。目前,CBZ在地表水和污水中的浓度水平为ng·L-1~μg·L-1[7-10],我国长江三角洲地区的苏州河中CBZ的浓度高达1.09 μg·L-1[8],而在希腊圣托里尼岛的Kamari污水处理厂入水中CBZ的浓度高达6.82 μg·L-1[9]。此外,CBZ在水环境中的半衰期较长((82±11) d)[11-12],且能够持续不断地进入水体环境中,具有环境持久性。
迄今为止,已有多篇文献报道了CBZ能够对非目标水生生物产生不良影响。例如,在0.03~30 μg·L-1 CBZ中暴露21 d后,同形溞(Daphnia similis)的蜕皮受到显著抑制,生殖力显著降低[13]。中华绒螯蟹(Eriocheir sinensis)在1 μg·L-1和10 μg·L-1 CBZ中暴露40 d后,其蜕皮和生长受到显著抑制[14]。河蚬(Corbicula fluminea)在0.5~50 μg·L-1 CBZ中暴露30 d后,其鳃和消化腺内产生氧化应激效应,虹吸行为减弱[6]。斑马鱼(Danio rerio)胚胎(受精后4 h)暴露在1~5 μg·L-1 CBZ中92 h后,其生长发育显著加速[15]。斑马鱼成鱼在10 μg·L-1 CBZ中暴露63 d后,其摄食行为显著减慢、受精卵的成活率显著降低,头部的乙酰胆碱酯酶(acetylcholinesterase,AChE)活性显著升高,肝脏和腮内产生氧化应激效应[16]。此外,CBZ对鱼类具有类雌激素效应,能够干扰鱼类的内分泌系统[11],然而目前有关环境相关浓度下的CBZ对鱼类的慢性毒性效应十分有限,尤其是发育阶段的鱼类。
本研究选择斑马鱼幼鱼为受试生物,研究环境相关浓度下CBZ的慢性暴露对鱼类抗氧化系统和神经递质系统的影响。将斑马鱼幼鱼(~2月龄)暴露在2种环境相关浓度的CBZ(1 μg·L-1和10 μg·L-1)中28 d,首先对斑马鱼幼鱼的体长和体质量进行测定,评估CBZ对斑马鱼幼鱼生长发育的影响,其次对斑马鱼幼鱼脑组织和肝脏中的超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase,CAT)活性和丙二醛(malonic dialdehyde,MDA)浓度进行测定,评估CBZ对斑马鱼幼鱼抗氧化系统的影响,最后对斑马鱼幼鱼脑组织中的AChE活性、γ-氨基丁酸(γ-aminobutyric acid,GABA)浓度和谷氨酸(glutamate,Glu)浓度进行测定,评估CBZ对斑马鱼幼鱼神经递质系统的影响。
1 材料与方法(Materials and methods)
1.1 实验动物
斑马鱼幼鱼(野生AB型,~2月龄)购自费曦生物(上海,中国),并驯养在实验室养殖系统内。养殖系统的光/暗周期设置为14 h∶10 h,养殖用水的温度为(28±1) ℃,pH为7.2±0.1,电导率为(500±50) μS·cm-1,每天定时投喂鱼饲料和刚孵化的丰年虾(Artemia naupli)各一次。暴露实验开始前1 d停止喂食。
1.2 实验材料及仪器
所用试剂:CBZ(CAS号:298-46-4,纯度>97%,梯希爱,日本)、二甲亚砜(dimethylsulfoxide,DMSO;CAS号:67-68-5,纯度>99%,Sigma,美国)、磷酸缓冲溶液(phosphate buffered saline,PBS;碧云天,中国)、总蛋白测定试剂盒(南京建成,中国)、SOD测定试剂盒(南京建成,中国)、CAT测定试剂盒(南京建成,中国)、MDA测定试剂盒(南京建成,中国)、AChE测定试剂盒(酶免,中国)、GABA测定试剂盒(酶免,中国)和Glu测定试剂盒(酶免,中国)。
所用仪器:金属浴(SCILOGEX HC 110-PRO,SCILOGEX,美国)、匀浆仪(OSE-Y30,TIANGEN,中国)、漩涡混匀仪(SCILOGEX MX-S,SCILOGEX,美国)、离心机(Eppendorf 5804R,Eppendorf,德国)、恒温培养箱(JYC-412,HENGZWELL,中国)、酶标仪(BioTek Synergy HTX,BioTek,美国)和超高效液相色谱质谱联用仪(ACQUITY H-class UPLC,Xevo TQD,Waters,美国)。
1.3 实验方法
1.3.1 暴露液配制
将0.2 g CBZ溶解到0.01 L DMSO中制备20 g·L-1的CBZ母液,随后将CBZ母液进行梯度稀释配制成0.02 g·L-1和0.2 g·L-1的CBZ储备液,最后将0.02 g·L-1和0.2 g·L-1 CBZ储备液分别用养殖水稀释得到1 μg·L-1和10 μg·L-1的CBZ暴露液。实验以0.005% DMSO(1∶20 000,V/V)为溶剂对照组。
1.3.2 斑马鱼暴露
实验室驯化2周后,随机选取180条斑马鱼幼鱼(体长为(2.93±0.16) cm,体质量为(0.25±0.14) g)进行暴露实验。暴露容器为3 L烧杯,分别设置对照组(0.005% DMSO)和2个处理组(1 μg·L-1和10 μg·L-1 CBZ),每个组设置3个平行,每个平行随机放入20条斑马鱼幼鱼于3 L实验溶液中。采用半静态暴露方法,暴露周期为28 d,每天更换50%实验溶液,光照条件、温度和投喂方法等其他条件同驯化条件一致。暴露实验结束后,将幼鱼放置在冰水中进行麻醉,测量幼鱼的体长和体质量。在每个平行中随机选取4~5只幼鱼,分别解剖出脑组织和肝脏混合作为一个样品放置在1.5 mL离心管里,置于液氮快速冷冻后转移到-80 ℃冰箱保存备用。
1.3.3 暴露液浓度测定
暴露液测定方法参考本课题组之前的研究[6,14]。暴露实验结束后,从每个组中取1.5 mL暴露液,暴露液通过0.22 μm针筒式过滤器过滤后置于2 mL棕色玻璃瓶中收集。收集后的暴露液用超高效液相色谱质谱联用仪检测。每个组测定的暴露液样品共3个(n=3)。色谱条件:色谱柱ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm,Waters,美国)温度为40 ℃,流动相A为0.1%甲酸水溶液,流动相B为乙腈,进样量为5 μL,流速为0.4 mL·min-1。药品洗脱程序:0.5 min,5% B;0.5~6 min,5% B升至70% B;6.0~7.0 min,70% B升至95% B,7.1 min降至5% B。质谱条件:离子源为电喷雾电离源正离子模式,检测方式为多离子反应监测,离子源温度为150 ℃,毛细管电压为2.0 kV,脱溶剂温度为450 ℃,锥孔气流量为50 L·h-1。采用外标法测定暴露液中的CBZ浓度,准确配制浓度为0.5、1、5、10、50、100和150 μg·L-1的标准溶液,绘制标准曲线。方法检出限和定量限分别为0.01 ng·L-1和0.02 ng·L-1。每个组检测到的暴露液浓度如表1所示(本文全篇使用CBZ的名义浓度)。
表1 卡马西平(CBZ)暴露液实际浓度
Table 1 The carbamazepine (CBZ) concentration measured in the exposure solutions

条件Conditions对照组Control1 μg·L-1 CBZ10 μg·L-1 CBZ名义浓度/(μg·L-1)Nominal concentration/(μg·L-1)0110实际浓度/(μg·L-1)Measured concentration/(μg·L-1)ND0.83±0.038.2±0.36
注:ND表示未检测出,数据以平均值±标准误差表示。
Note:ND stands for not detected,and the data are expressed as mean±SEM.
1.3.4 抗氧化系统及神经递质系统相关物质测定
准确称量幼鱼的脑组织或肝脏并放置在新的1.5 mL离心管中,按照质量(g)∶体积(mL)=1∶9的比例,将1×PBS添加到不同的幼鱼样品(脑组织样品和肝脏样品)中,随后将样品放置在金属浴(-2 ℃~2 ℃)中进行匀浆,最后将匀浆后的样品进行离心(4 ℃,2 500 r·min-1条件下离心10 min),取上清液备用(根据所测定的物质对上清液稀释不同的倍数)。每个组测定的脑组织和肝脏样品共3个(n=3)。根据不同的试剂盒说明书测定幼鱼体内的总蛋白浓度、SOD活性、CAT活性、MDA浓度、AChE活性、GABA浓度和Glu浓度。
1.4 数据分析
使用GraphPad Prism 6.0软件进行实验数据的分析和制图。采用Kolmogorov-Smirnov和Levene分别检验实验数据的正态性和方差齐性。处理组和对照组之间的显著性检验采用单因素方差分析(One-way ANOVA)和Holm-Sidak多重比较检验。实验数据均以平均值±标准误差(mean±SEM)表示。处理组和对照组之间的显著性水平为P<0.05。
2 结果(Results)
2.1 CBZ对斑马鱼生长发育的影响
在暴露28 d后,测定了斑马鱼幼鱼的体长和体质量(图1)。结果显示,与对照组相比,1 μg·L-1 CBZ处理组中的幼鱼体长未出现显著性变化(图1(a)),10 μg·L-1 CBZ处理组中的幼鱼体长显著增加(P=0.0257) (图1(a)),1 μg·L-1和10 μg·L-1 CBZ处理组中的幼鱼体质量未出现显著性变化(图1(b)),表明10 μg·L-1 CBZ的慢性暴露能够促进斑马鱼幼鱼的生长发育。
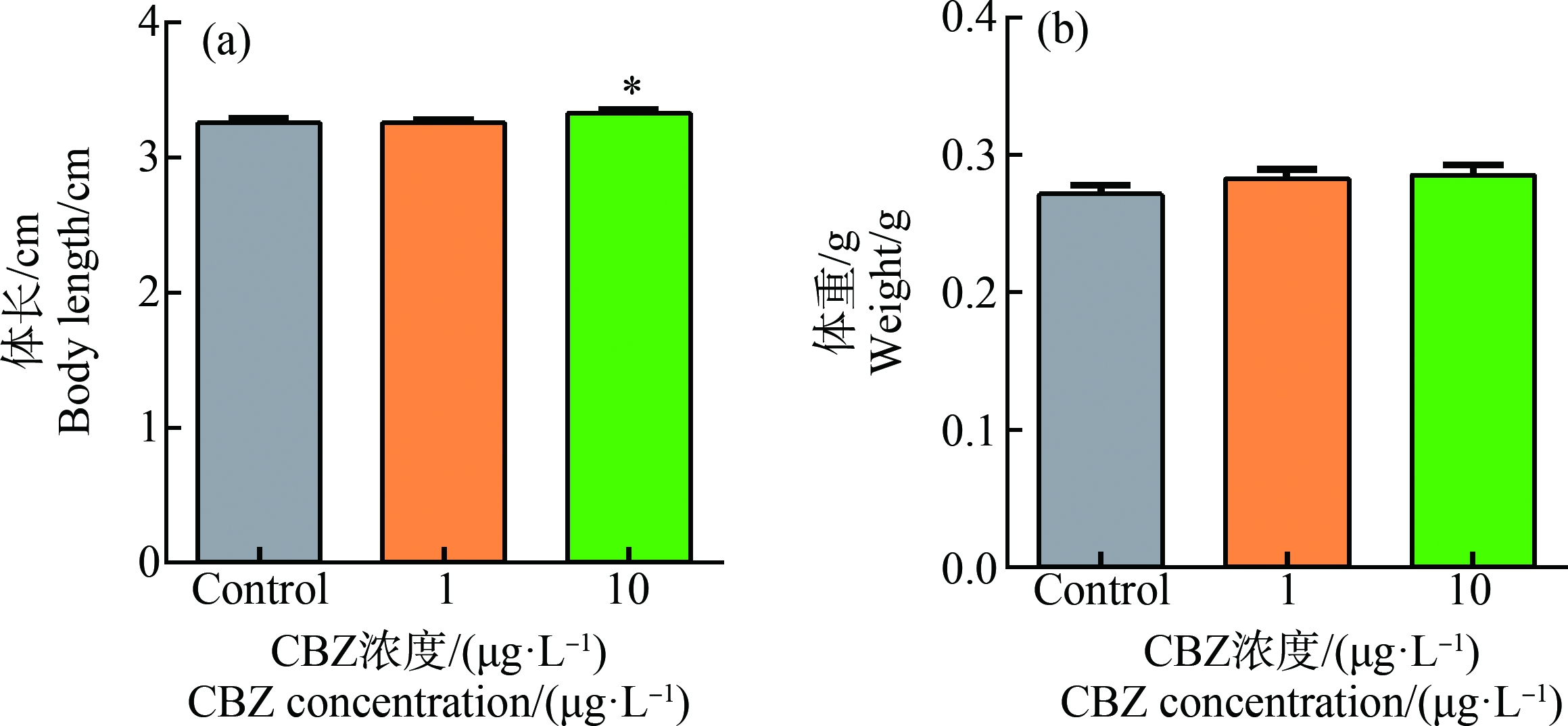
图1 CBZ暴露对斑马鱼幼鱼生长发育的影响
注:斑马鱼幼鱼暴露在对照组(Control)、1、10 μg·L-1 CBZ中28 d,幼鱼的体长(a)和体质量(b)变化;数据以平均值±标准误差表示,星号表示处理组与对照组之间有显著性差异(*P<0.05)。
Fig.1 Effects of CBZ exposure on the growth and development of juvenile zebrafish
Note:The body length (a) and body mass (b) of juvenile zebrafish exposed to Control,1,10 μg·L-1 CBZ for 28 d;the data are expressed as mean±SEM,and asterisk denote significant differences (*P<0.05) between treatments and controls.
2.2 CBZ对斑马鱼抗氧化系统的影响
在暴露28 d后,测定了斑马鱼幼鱼脑组织和肝脏中的SOD活性、CAT活性和MDA浓度(图2)。结果显示,与对照组相比,1 μg·L-1 CBZ暴露下,幼鱼脑内的SOD活性(P=0.0129)和CAT活性(P=0.0301)显著增加(图2(a)和(b)),肝脏中的SOD活性(P=0.0365)显著降低,CAT活性(P=0.0026)和MDA浓度(P=0.0009)显著增加(图2(d)、(e)和(f))。与对照组相比,10 μg·L-1 CBZ暴露下,幼鱼脑内的SOD活性(P=0.0187)显著增加(图2(a)),肝脏中的CAT活性(P=0.0184)和MDA浓度(P=0.0004)显著增加(图2(e)和(f))。实验结果表明,1 μg·L-1和10 μg·L-1 CBZ的慢性暴露能够干扰斑马鱼幼鱼脑组织和肝脏中的抗氧化系统,诱导幼鱼脑组织和肝脏产生氧化应激效应。
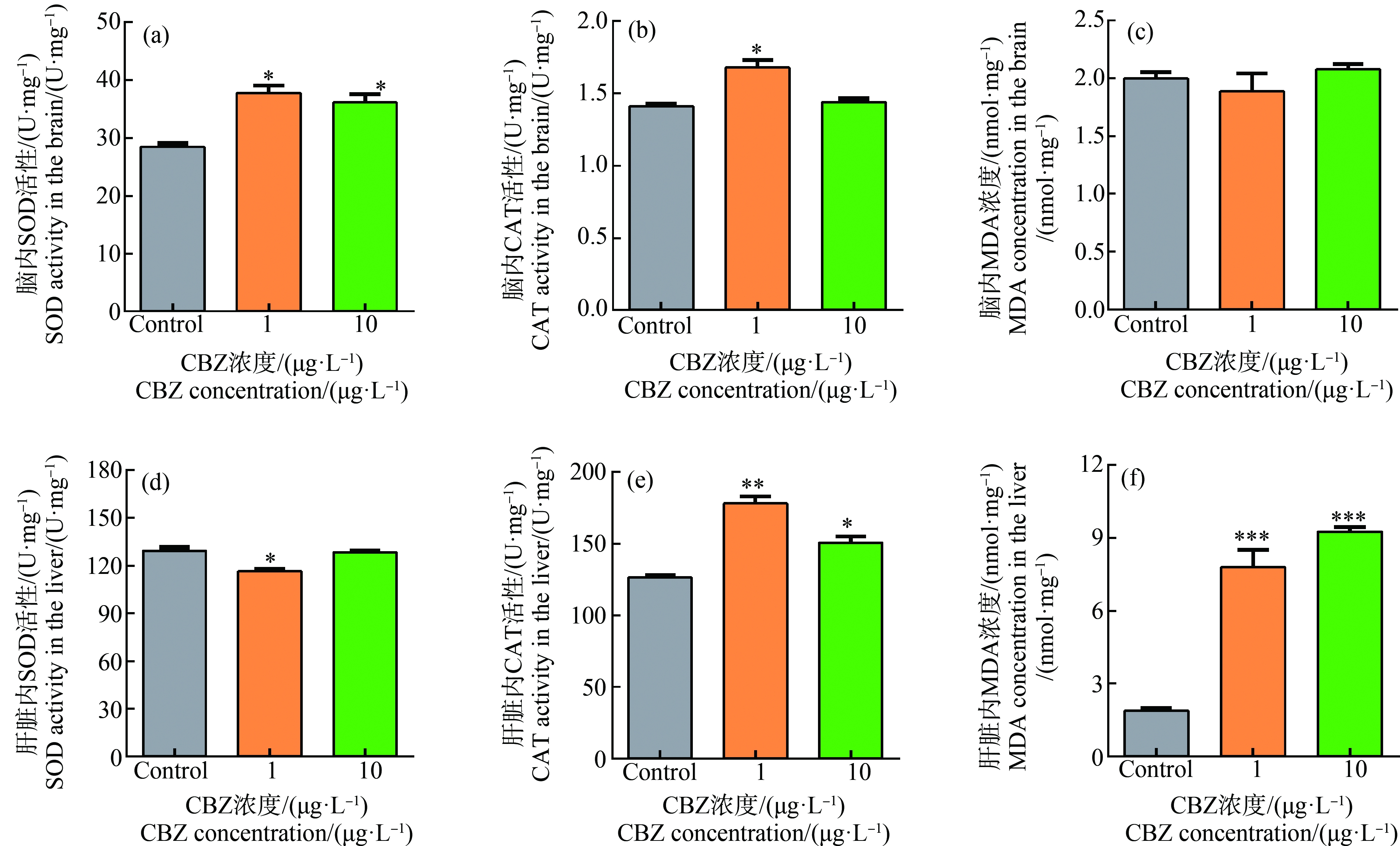
图2 CBZ暴露对斑马鱼幼鱼脑组织和肝脏中抗氧化系统的影响
注:斑马鱼幼鱼暴露在对照组(Control)、1、10 μg·L-1 CBZ中28 d;SOD表示超氧化物歧化酶,CAT表示过氧化氢酶,MDA表示丙二醛;数据以平均值±标准误差表示,星号表示处理组与对照组之间有显著性差异(*P<0.05,**P<0.01,***P<0.001)。
Fig.2 Effects of CBZ exposure on the antioxidation system in the brain and liver of juvenile zebrafish
Note:Juvenile zebrafish exposed to Control,1,10 μg·L-1 CBZ for 28 d;SOD stands for superoxide dismutase,CAT stands for catalase,and MDA stands for malonic dialdehyde;the data are expressed as mean±SEM,and asterisk denote significant differences (*P<0.05,**P<0.01,***P<0.001) between treatments and controls.
2.3 CBZ对斑马鱼神经递质系统的影响
在暴露28 d后,测定了斑马鱼幼鱼脑组织中的AChE活性、GABA浓度和Glu浓度(图3)。结果显示,与对照组相比,10 μg·L-1 CBZ暴露能够显著抑制幼鱼脑组织中的AChE活性(P=0.033) (图3(a)),1 μg·L-1 (P=0.0001)和10 μg·L-1 (P=0.0001)CBZ暴露能够显著提高幼鱼脑组织中的GABA浓度(图3(b)),而幼鱼脑组织中的Glu浓度在1 μg·L-1和10 μg·L-1 CBZ暴露后未出现显著性变化(图3(c))。实验结果表明,1 μg·L-1和10 μg·L-1 CBZ的慢性暴露能够干扰斑马鱼幼鱼脑组织中的神经递质系统,产生神经毒性。
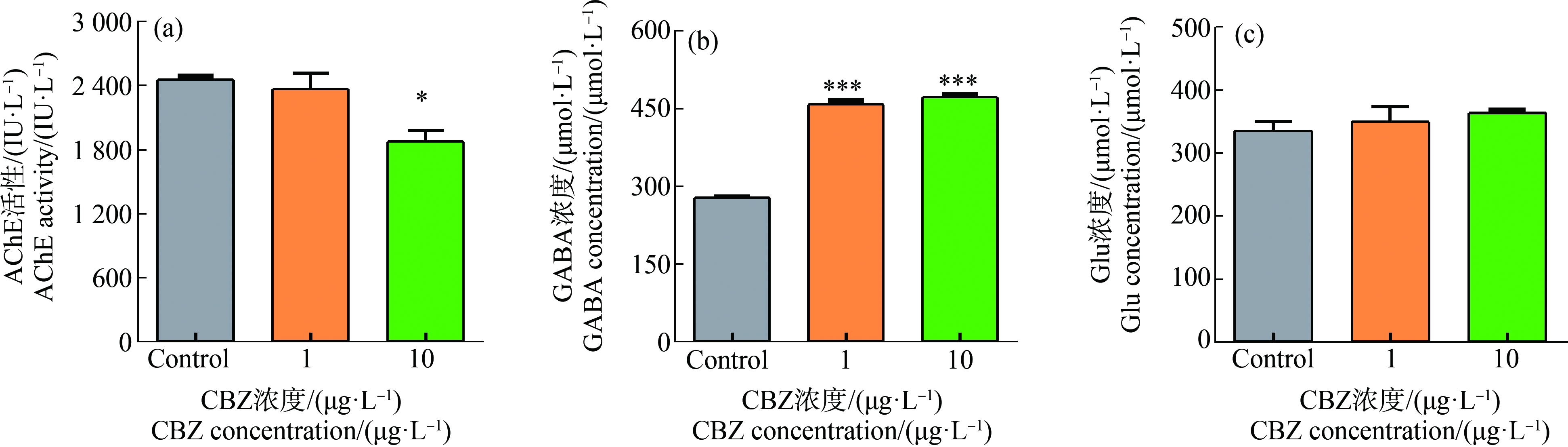
图3 CBZ暴露对斑马鱼幼鱼脑组织中神经递质系统的影响
注:斑马鱼幼鱼暴露在对照组(Control)、1、10 μg·L-1 CBZ中28 d;AChE表示乙酰胆碱酯酶,GABA表示γ-氨基丁酸,Glu表示谷氨酸;数据以平均值±标准误差表示,星号表示处理组与对照组之间有显著性差异(*P<0.05,***P<0.001)。
Fig.3 Effects of CBZ exposure on the neurotransmitter systems in the brain of juvenile zebrafish
Note:Juvenile zebrafish exposed to Control,1,10 μg·L-1 CBZ for 28 d;AChE stands for acetylcholinesterase,GABA stands for γ-aminobutyric acid,and Glu stands for glutamate;the data are expressed as mean±SEM,and asterisk denote significant differences (*P<0.05,***P<0.001) between treatments and controls.
3 讨论(Discussion)
Qiang等[15]报道了1~5 μg·L-1 CBZ的急性暴露(92 h)能够导致斑马鱼仔鱼的体长增加、卵黄囊面积减少和鱼鳔发育迅速,表明CBZ能够加速斑马鱼仔鱼的生长发育。在本研究中,10 μg·L-1 CBZ的慢性暴露能够导致斑马鱼幼鱼的体长显著增加,表明CBZ促进了幼鱼的生长发育。CBZ是对鱼类能够产生类雌激素效应的药物[11]。性激素能够促进生物体的食欲和生物体内蛋白质的合成,从而促进生物体的生长[17-18]。因此,10 μg·L-1 CBZ处理组中斑马鱼幼鱼体长的增加可能与CBZ的类雌激素效应有关。作为一种精神类药物,CBZ能够提高细胞外的血清素(serotonin,5-HT)浓度,增强5-HT能系统的神经传递[19]。5-HT在调节鱼类发育方面发挥着重要作用[20-22]。例如,Barreiro-Iglesias等[20]报道了5-HT能够促进斑马鱼脊髓运动神经元的发育和再生。Bashammakh等[21]研究发现5-HT在斑马鱼的咽弓形态形成过程中发挥着重要作用。Airhart等[22]报道了5-HT水平的减少能够对斑马鱼早期发育阶段的体长和脊索形态等造成不良影响。因此,10 μg·L-1 CBZ处理组中斑马鱼幼鱼体长的增加可能与其体内5-HT能系统神经传递的异常有关。由于物种生长发育的加速可能会对其产生不利的影响,因此今后还需要进一步的研究CBZ加速斑马鱼生长发育的具体机制。
在正常的生理条件下,生物体内活性氧(reactive oxygen species,ROS)的产生和清除处于一种动态平衡状态,而一旦这种平衡被打破(ROS过量生成),就会导致氧化应激[23-24]。生物体抗氧化系统中的抗氧化酶和抗氧化剂在清除ROS方面具有重要作用[25],而抗氧化酶活性和抗氧化剂含量的改变能够诱导氧化损伤[26]。其中,SOD和CAT在生物体抗氧化系统防御氧化应激过程中发挥着重要作用,前者负责将细胞内氧自由基(O2-)转化为过氧化氢(H2O2)和分子氧(O2),后者随后将H2O2转化为水(H2O)和O2[23-24]。SOD和CAT活性的增加表明这2种酶能够清除机体产生的过量ROS,而SOD和CAT的活性降低表明机体的蛋白质结构受到了损伤[24,27-28]。脂质过氧化是ROS在机体内引起的最常见的细胞损伤,被认为是氧化应激的主要生物指标之一[23,25-26]。当生物体内的ROS含量超过抗氧化酶的清除能力时,过量的ROS就会刺激MDA的产生[6,29]。MDA是生物体内O2-与多不饱和脂肪酸发生过氧化反应后形成的脂质过氧化产物,其浓度水平可作为机体脂质过氧化的指标[23,25-26]。
在本研究中,斑马鱼幼鱼脑内的SOD活性在1 μg·L-1和10 μg·L-1 CBZ暴露下均显著增加,CAT活性仅在1 μg·L-1 CBZ暴露下显著增加,但是2种浓度的CBZ暴露均未引起斑马鱼幼鱼脑组织中MDA水平出现显著性变化,表明2种CBZ浓度暴露下的斑马鱼幼鱼脑组织受到了轻微的氧化损伤,而幼鱼脑组织中的抗氧化系统能够通过提高抗氧化酶的活性减弱氧化损伤。另外,斑马鱼幼鱼肝脏中的SOD活性仅在1 μg·L-1 CBZ暴露下显著降低,幼鱼肝脏中CAT活性和MDA含量在1 μg·L-1和10 μg·L-1 CBZ暴露下均显著增加,表明2种CBZ浓度暴露下的斑马鱼幼鱼肝脏均受到了严重的氧化损伤。肝脏是生物体排毒的主要器官,具有高度的代谢活性[30-31],可能比其他组织暴露在更高水平的药品中,因此斑马鱼的肝脏受到的氧化损伤相比于脑组织更加严重。根据已有报道,生物体内抗氧化防御系统的激活与化合物诱导的神经毒性的降低有关[32-33]。因此,本研究中1 μg·L-1和10 μg·L-1 CBZ处理组对斑马鱼脑组织和肝脏引起的氧化损伤可能与2种浓度的CBZ诱导的神经毒性效应有关,这需要进一步的研究。由于斑马鱼幼鱼的肝脏受到了严重的氧化应激,引起ROS在肝脏中积累,可能对蛋白质、核酸和脂质等生物大分子造成损伤,从而影响斑马鱼幼鱼肝脏的正常生理功能[25,34]。此外,已有相关文献也报道了环境相关浓度的CBZ对斑马鱼的氧化应激效应[16,32]。例如,da Silva Santos等[16]发现10 μg·L-1 CBZ的慢性暴露(63 d)能够引起斑马鱼成鱼腮、肠道和肝脏中的抗氧化酶(CAT和谷胱甘肽S-转移酶)活性显著改变[16]。不仅如此,CBZ也能够引起其他的水生生物产生氧化应激效应[6,35]。例如,Chen等[6]报道了0.5~50 μg·L-1 CBZ的慢性暴露(30 d)能够引起河蚬(Corbicula fluminea)腮和消化腺中的抗氧化酶(SOD、CAT和谷胱甘肽还原酶)活性和氧化产物(MDA)浓度改变。此外,本研究中10 μg·L-1 CBZ的慢性暴露(28 d)能够显著诱导斑马鱼幼鱼肝脏内的CAT活性,但da Silva Santos等[16]发现10 μg·L-1 CBZ的慢性暴露(63 d)能够显著抑制斑马鱼成鱼肝脏内的CAT活性,笔者推测这可能与较长时间的CBZ暴露导致斑马鱼肝脏内氧化损伤(ROS产生过量所致)的加重有关,CAT受到损伤(活性降低)无法发挥正常的作用。综上所述,本研究结果表明,1 μg·L-1和10 μg·L-1 CBZ的慢性暴露均导致斑马鱼幼鱼的脑组织和肝脏产生了氧化应激,但是斑马鱼幼鱼的肝脏产生的氧化应激效应相比于脑组织更为严重,可能会对斑马鱼幼鱼产生一些不利的影响。
AChE能够降解突触间隙中的神经递质乙酰胆碱,在生物体内神经信号传递过程中发挥着重要作用,被广泛用作神经毒性检测的生化标记物[36-37]。在本研究中10 μg·L-1 CBZ的慢性暴露能够显著抑制斑马鱼幼鱼脑内的AChE活性,表明10 μg·L-1 CBZ能够干扰幼鱼脑内的胆碱能系统,产生神经毒性效应。另外,已有相关文献也报道了环境相关浓度的CBZ暴露(急性暴露)对水生生物体内AChE活性的抑制作用[38-39]。例如Juhel等[39]发现0.096 μg·L-1 CBZ的急性暴露(7 d)能够显著抑制贻贝(Perna viridis)无细胞血淋巴中的AChE活性。然而,da Silva Santos等[16]报道了10 μg·L-1 CBZ的慢性暴露(63 d)能够引起斑马鱼成鱼头部的AChE活性增加。笔者推测da Silva Santos等的结果与本文研究结果不一致的原因可能与不同时长CBZ暴露下对斑马鱼体内胆碱能系统的毒性效应有关,即不同时长的CBZ暴露在斑马鱼体内的毒性作用可能存在差异。例如,Rhee等[40]将朝鲜臂尾轮虫(Brachionus koreanus)暴露在100 μg·L-1和1 000 μg·L-1 CBZ中12 h和24 h,发现2种浓度的CBZ仅在暴露24 h后对轮虫体内的AChE活性具有抑制效应。在本研究中,10 μg·L-1 CBZ引起斑马鱼幼鱼脑内AChE活性降低,可能导致乙酰胆碱在脑内的积累和胆碱能受体的过度刺激[41]。由于乙酰胆碱在调节生物体的运动、学习和记忆等方面发挥着重要作用[41-43],因此10 μg·L-1 CBZ可能对幼鱼产生不利的影响。
Glu和GABA分别是脊椎动物中枢神经系统的兴奋性神经递质和抑制性神经递质,前者能够介导生物体内兴奋性突触传递,后者能够介导生物体内抑制性突触传递[44-46]。兴奋性(Glu)和抑制性(GABA)神经递质的平衡对生物体运动的调节和生物体内外周信号的整合具有重要作用[45,47]。目前,CBZ的作用机制仍不清楚,可能与电子门控钠离子通道相互作用,增强GABA的抑制作用,从而引起神经细胞的兴奋性降低[48-49]。在本研究中,1 μg·L-1和10 μg·L-1 CBZ均引起斑马鱼幼鱼脑内的GABA浓度显著增加,但脑内的Glu浓度未出现显著性变化,能够导致幼鱼脑内兴奋性和抑制性神经传递的不平衡,这可能与CBZ的作用机制有关。本研究结果表明,环境相关浓度下CBZ的慢性暴露能够干扰幼鱼脑内的GABA能系统,产生神经毒性。类似地,Chen等[50]发现0.5~50 μg·L-1 CBZ的慢性暴露(30 d)能够干扰河蚬(Corbicula fluminea)体内(外套膜组织、腮、性腺和消化腺)的GABA能系统。由于GABA在调节脊椎动物的生殖[51-52]和运动[45-46]方面发挥着重要作用,因此1 μg·L-1和10 μg·L-1 CBZ可能会对斑马鱼幼鱼产生不利的影响。
综上所述,环境相关浓度(1 μg·L-1和10 μg·L-1)CBZ的慢性暴露能够促进斑马鱼幼鱼的生长发育,诱导幼鱼的脑组织和肝脏产生氧化应激效应,且肝脏产生的氧化应激效应相比于脑组织更为显著,同时CBZ暴露能够干扰幼鱼脑组织的胆碱能系统和GABA能系统,产生神经毒性效应。
[1] Almeida  ,Calisto V,Domingues M R M,et al.Comparison of the toxicological impacts of carbamazepine and a mixture of its photodegradation products in Scrobicularia plana [J].Journal of Hazardous Materials,2017,323:220-232
,Calisto V,Domingues M R M,et al.Comparison of the toxicological impacts of carbamazepine and a mixture of its photodegradation products in Scrobicularia plana [J].Journal of Hazardous Materials,2017,323:220-232
[2] Heberer T.Occurrence,fate,and removal of pharmaceutical residues in the aquatic environment:A review of recent research data [J].Toxicology Letters,2002,131(1-2):5-17
[3] Yan S H,Wang M,Liang X F,et al.Environmentally relevant concentrations of carbamazepine induce liver histopathological changes and a gender-specific response in hepatic proteome of Chinese rare minnows (Gobiocypris rarus) [J].Environmental Pollution,2018,243:480-491
[4] Li Y,Zhang L Y,Liu X S,et al.Ranking and prioritizing pharmaceuticals in the aquatic environment of China [J].Science of the Total Environment,2019,658:333-342
[5] Zhang Y J,Geißen S U,Gal C.Carbamazepine and diclofenac:Removal in wastewater treatment plants and occurrence in water bodies [J].Chemosphere,2008,73(8):1151-1161
[6] Chen H H,Zha J M,Liang X F,et al.Effects of the human antiepileptic drug carbamazepine on the behavior,biomarkers,and heat shock proteins in the Asian clam Corbicula fluminea [J].Aquatic Toxicology,2014,155:1-8
[7] Arnnok P,Singh R R,Burakham R,et al.Selective uptake and bioaccumulation of antidepressants in fish from effluent-impacted Niagara River [J].Environmental Science &Technology,2017,51(18):10652-10662
[8] Zhou X F,Dai C M,Zhang Y L,et al.A preliminary study on the occurrence and behavior of carbamazepine (CBZ) in aquatic environment of Yangtze River Delta,China [J].Environmental Monitoring and Assessment,2011,173(1):45-53
[9] Borova V L,Maragou N C,Gago-Ferrero P,et al.Highly sensitive determination of 68 psychoactive pharmaceuticals,illicit drugs,and related human metabolites in wastewater by liquid chromatography-tandem mass spectrometry [J].Analytical and Bioanalytical Chemistry,2014,406(17):4273-4285
[10] Nakada N,Hanamoto S,Jürgens M D,et al.Assessing the population equivalent and performance of wastewater treatment through the ratios of pharmaceuticals and personal care products present in a river basin:Application to the River Thames basin,UK [J].Science of the Total Environment,2017,575:1100-1108
[11] Yan S H,Wang M,Zha J M,et al.Environmentally relevant concentrations of carbamazepine caused endocrine-disrupting effects on nontarget organisms,Chinese rare minnows (Gobiocypris rarus) [J].Environmental Science &Technology,2018,52(2):886-894
[12] Barra Caracciolo A,Topp E,Grenni P.Pharmaceuticals in the environment:Biodegradation and effects on natural microbial communities.A review [J].Journal of Pharmaceutical and Biomedical Analysis,2015,106:25-36
[13] Chen H H,Gu X H,Zeng Q F,et al.Acute and chronic toxicity of carbamazepine on the release of chitobiase,molting,and reproduction in Daphnia similis [J].International Journal of Environmental Research and Public Health,2019,16(2):209
[14] Chen H H,Gu X H,Zeng Q F,et al.Carbamazepine disrupts molting hormone signaling and inhibits molting and growth of Eriocheir sinensis at environmentally relevant concentrations [J].Aquatic Toxicology,2019,208:138-145
[15] Qiang L Y,Cheng J P,Yi J,et al.Environmental concentration of carbamazepine accelerates fish embryonic development and disturbs larvae behavior [J].Ecotoxicology,2016,25(7):1426-1437
[16] da Silva Santos N,Oliveira R,Lisboa C A,et al.Chronic effects of carbamazepine on zebrafish:Behavioral,reproductive and biochemical endpoints [J].Ecotoxicology and Environmental Safety,2018,164:297-304
[17] Chen J F,Wang X T,Ge X Q,et al.Chronic perfluorooctanesulphonic acid (PFOS) exposure produces estrogenic effects in zebrafish [J].Environmental Pollution,2016,218:702-708
[18] Michopoulos V,Wilson M E.Body weight decreases induced by estradiol in female rhesus monkeys are dependent upon social status [J].Physiology &Behavior,2011,102(3-4):382-388
[19] Ambrósio A F,Soares-Da-Silva P,Carvalho C M,et al.Mechanisms of action of carbamazepine and its derivatives,oxcarbazepine,BIA 2-093,and BIA 2-024 [J].Neurochemical Research,2002,27(1-2):121-130
[20] Barreiro-Iglesias A,Mysiak K S,Scott A L,et al.Serotonin promotes development and regeneration of spinal motor neurons in zebrafish [J].Cell Reports,2015,13(5):924-932
[21] Bashammakh S,Würtele M,Kotnik K,et al.Serotonin is required for pharyngeal arch morphogenesis in zebrafish [J].ScienceOpen Research,2014:1
[22] Airhart M J,Lee D H,Wilson T D,et al.Adverse effects of serotonin depletion in developing zebrafish [J].Neurotoxicology and Teratology,2012,34(1):152-160
[23] Maharajan K,Muthulakshmi S,Nataraj B,et al.Toxicity assessment of pyriproxyfen in vertebrate model zebrafish embryos (Danio rerio):A multi biomarker study [J].Aquatic Toxicology,2018,196:132-145
[24] Wang C X,Harwood J D,Zhang Q M.Oxidative stress and DNA damage in common carp (Cyprinus carpio) exposed to the herbicide mesotrione [J].Chemosphere,2018,193:1080-1086
[25] Li Y H,Wei L,Cao J R,et al.Oxidative stress,DNA damage and antioxidant enzyme activities in the Pacific white shrimp (Litopenaeus vannamei) when exposed to hypoxia and reoxygenation [J].Chemosphere,2016,144:234-240
[26] Wang G H,Xiong D M,Wu M N,et al.Induction of time- and dose-dependent oxidative stress of triazophos to brain and liver in zebrafish (Danio rerio) [J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2020,228:108640
[27] Zhang Q M,Zhang G L,Yin P J,et al.Toxicological effects of soil contaminated with spirotetramat to the earthworm Eisenia fetida [J].Chemosphere,2015,139:138-145
[28] Ojha A,Yaduvanshi S K,Srivastava N.Effect of combined exposure of commonly used organophosphate pesticides on lipid peroxidation and antioxidant enzymes in rat tissues [J].Pesticide Biochemistry and Physiology,2011,99(2):148-156
[29] Lushchak V I.Environmentally induced oxidative stress in aquatic animals [J].Aquatic Toxicology,2011,101(1):13-30
[30] Zhang D L,Liu S Y,Zhang J,et al.Antioxidative responses in zebrafish liver exposed to sublethal doses Aphanizomenon flos-aquae DC-1 aphantoxins [J].Ecotoxicology and Environmental Safety,2015,113:425-432
[31] Shin S M,Yang J H,Ki S H.Role of the Nrf2-ARE pathway in liver diseases [J].Oxidative Medicine and Cellular Longevity,2013,2013:763257
[32] Jia D T,Li X W,Du S,et al.Single and combined effects of carbamazepine and copper on nervous and antioxidant systems of zebrafish (Danio rerio) [J].Environmental Toxicology,2020,35(10):1091-1099
[33] Oyagbemi A A,Omobowale T O,Saba A B,et al.Gallic acid ameliorates cyclophosphamide-induced neurotoxicity in Wistar rats through free radical scavenging activity and improvement in antioxidant defense system [J].Journal of Dietary Supplements,2016,13(4):402-419
[34] Sabatini S E,Juárez A B,Eppis M R,et al.Oxidative stress and antioxidant defenses in two green microalgae exposed to copper [J].Ecotoxicology and Environmental Safety,2009,72(4):1200-1206
[35] Martin-Diaz L,Franzellitti S,Buratti S,et al.Effects of environmental concentrations of the antiepilectic drug carbamazepine on biomarkers and cAMP-mediated cell signaling in the mussel Mytilus galloprovincialis [J].Aquatic Toxicology,2009,94(3):177-185
[36] Xie Z X,Lu G H,Li S,et al.Behavioral and biochemical responses in freshwater fish Carassius auratus exposed to sertraline [J].Chemosphere,2015,135:146-155
[37] de Farias N O,Oliveira R,Sousa-Moura D,et al.Exposure to low concentration of fluoxetine affects development,behaviour and acetylcholinesterase activity of zebrafish embryos [J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2019,215:1-8
[38] Shi C H,He Y D,Liu J X,et al.Ecotoxicological effect of single and combined exposure of carbamazepine and cadmium on female Danio rerio:A multibiomarker study [J].Applied Sciences,2019,9(7):1362
[39] Juhel G,Bayen S,Goh C,et al.Use of a suite of biomarkers to assess the effects of carbamazepine,bisphenol A,atrazine,and their mixtures on green mussels,Perna viridis [J].Environmental Toxicology and Chemistry,2017,36(2):429-441
[40] Rhee J S,Kim B M,Jeong C B,et al.Effect of pharmaceuticals exposure on acetylcholinesterase (AchE) activity and on the expression of AchE gene in the monogonont rotifer,Brachionus koreanus [J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2013,158(4):216-224
[41] Pereira V M,Bortolotto J W,Kist L W,et al.Endosulfan exposure inhibits brain AChE activity and impairs swimming performance in adult zebrafish (Danio rerio) [J].Neurotoxicology,2012,33(3):469-475
[42] Altenhofen S,Nabinger D D,Wiprich M T,et al.Tebuconazole alters morphological,behavioral and neurochemical parameters in larvae and adult zebrafish (Danio rerio) [J].Chemosphere,2017,180:483-490
[43] Hasselmo M E.The role of acetylcholine in learning and memory [J].Current Opinion in Neurobiology,2006,16(6):710-715
[44] Yang J L,Sykora P,Wilson D MⅢ,et al.The excitatory neurotransmitter glutamate stimulates DNA repair to increase neuronal resiliency [J].Mechanisms of Ageing and Development,2011,132(8-9):405-411
[45] Yan W,Li L,Li G Y,et al.Microcystin-LR induces changes in the GABA neurotransmitter system of zebrafish [J].Aquatic Toxicology,2017,188:170-176
[46] Saint-Amant L,Drapeau P.Motoneuron activity patterns related to the earliest behavior of the zebrafish embryo [J].The Journal of Neuroscience:The Official Journal of the Society for Neuroscience,2000,20(11):3964-3972
[47] Prange O,Wong T P,Gerrow K,et al.A balance between excitatory and inhibitory synapses is controlled by PSD-95 and neuroligin [J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(38):13915-13920
[48] Bai Z H,Jia K,Chen G L,et al.Carbamazepine induces hepatotoxicity in zebrafish by inhibition of the Wnt/β-catenin signaling pathway [J].Environmental Pollution,2021,276:116688
[49] Thorn C F,Leckband S G,Kelsoe J,et al.PharmGKB summary:Carbamazepine pathway [J].Pharmacogenetics and Genomics,2011,21(12):906-910
[50] Chen H H,Gu X H,Zeng Q F,et al.Characterization of the GABAergic system in Asian clam Corbicula fluminea:Phylogenetic analysis,tissue distribution,and response to the aquatic contaminant carbamazepine [J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2021,239:108896
[51] Yu M,Feng Y L,Zhang X N,et al.Semicarbazide disturbs the reproductive system of male zebrafish (Danio rerio) through the GABAergic system [J].Reproductive Toxicology,2017,73:149-157
[52] Zohar Y,Mu oz-Cueto J A,Elizur A,et al.Neuroendocrinology of reproduction in teleost fish [J].General and Comparative Endocrinology,2010,165(3):438-455
oz-Cueto J A,Elizur A,et al.Neuroendocrinology of reproduction in teleost fish [J].General and Comparative Endocrinology,2010,165(3):438-455