五氯苯酚(pentachlorophenol,PCP)由于具有良好的抑菌特性,广泛用作除草剂、杀菌剂、防腐剂和防霉剂等,其生产和使用过程中不可避免地会释放到环境中,在各种环境介质中被高频检出[1]。水环境是污染物的最终归宿地,PCP主要是通过农业污水、生活污水以及径流方式排放到水体中。有研究对中国七大流域水体中PCP进行全面调查,在600多个采样点地表水中有85.4%检测出PCP,浓度中位数为50 ng·L-1,其中洞庭湖水体PCP的浓度最高,为103.7 μg·L-1;与此同时水体沉积物中检测出PCP浓度范围为0.01~178.19 ng·g-1 (以干质量计) [2]。在美国的一个木材加工厂附近地表水和地下水中检测出PCP浓度可达0.07~31.9 μg·L-1和3~23 μg·L-1 [3]。所以PCP对于水生生物的危害不可忽视。先前的研究主要关注PCP对于鱼类的富集和毒性效应,例如Li等[4]在底特律河附近的多种远洋鱼类血浆中检出PCP,其浓度范围为0.21~1.62 ng·g-1(以湿质量计)。有研究发现在0.1~1 000 μg·L-1 PCP暴露下,斑马鱼(Danio rerio)的突触素Ⅰ (synaptophysin,SYN)、碘甲腺原氨酸脱碘酶Ⅲ型(recombinant deiodinase,iodothyronine,type Ⅲ,DIO3)、甲状腺激素受体α(thyroid hormone receptor α,Thr-α)和甲状腺激素受体β(thyroid hormone receptor β,Thr-β)的相对mRNA表达量增加,这表明,PCP暴露可能会影响鱼类中枢神经系统发育的时间和协调性,并通过干扰甲状腺激素调节途径改变甲状腺激素水平[5]。鱼类处于水生食物网的顶端,属于高级消费者,然而现有研究鲜有关注PCP对于水生态系统初级消费者的影响。并且,目前PCP在全球自然水体中的浓度通常从几ng·L-1到几十μg·L-1不等[6-7],而现有关于PCP对水生生物毒理学的研究大都采用高浓度暴露,环境浓度毒理学研究相对匮乏。因此,急需开展环境相关浓度PCP对低营养级水生生物的毒性评估研究。
大型溞(Daphnia magna)是一种典型的浮游甲壳动物,在水生态系统中广泛分布,作为初级消费者,其在水生食物网中占据重要位置,并且拥有重要的生态位,由于其对环境污染物比较敏感,已被用作生态毒理学研究中的模式生物[8-13]。先前有学者开展了PCP对于大型溞的毒性研究,发现0.0002~0.02 μmol·L-1 PCP暴露大型溞21 d后,其可以显著影响大型溞的母代和子代体长,说明其对大型溞可能具有发育毒性及生殖毒性[14]。但是水生生物终生生活在水中,所以其应该一直处于暴露当中,但是部分生命周期的暴露实验,无法更加真实、准确、全面地反映污染物对水生生物的毒性效应,以至于在污染物评价中由于暴露时间不够而忽视了污染物的生态风险。基于大型溞寿命较短(50~80 d)的特点,本研究尝试开展大型溞的全生命周期PCP暴露实验,最终探究环境相关浓度PCP对于大型溞的影响。
综上所述,本研究以模式生物大型溞为受试物种,在环境相关浓度PCP暴露条件下,探寻对大型溞存活、生长、生殖、心率、行为和基因表达的影响,并比较大型溞部分生命周期暴露和全生命周期暴露的毒性效应。
1 材料与方法(Materials and methods)
1.1 实验试剂
五氯酚钠(sodium pentachlorophenol,PCP-Na)购自Ehrenstorfer公司(德国),纯度99.9%。二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma-Aldrich公司(美国),纯度99.9%。TRIzol试剂、反转录试剂盒和SYBR荧光定量试剂盒购自Takara公司(中国)。本研究中使用的其他试剂均为分析纯级。
1.2 PCP暴露液的配制
用万分之一天平准确称取一定量的PCP于玻璃瓶内,记录质量,溶于DMSO,配制成母液,随后使用DMSO将母液按照梯度稀释的方法,依次稀释得到1 500、150、15和1.5 mg·L-1的母液。分别取10 μL母液加入到100 mL的暴露液中,即可分别得到PCP暴露浓度为150、15、1.5和0.15 μg·L-1的暴露体系,对照组中加入等体积的DMSO作溶剂对照,每个浓度设置3个平行暴露装置。DMSO在暴露液中体积占比为0.01%。
1.3 大型溞的实验室培养
大型溞的培养方法基于先前文献报道[15]。简言之,大型溞在温度(22±1) ℃,光照周期为16 h光照∶8 h黑暗的恒温培养箱中培养。大型溞养殖水为连续曝气48 h以上的过滤自来水。自来水的过滤系统使用安吉尔J1205-ROB12型净水器(中国)。用小球藻(Chlorella vulgaris)和斜生栅藻(Scenedesmus obliquus)混合饲喂大型溞。大型溞开始生殖前的喂食密度为2.5×106 cells·mL-1(培养液),开始生殖后喂食密度增加至5.0×106 cells·mL-1(培养液)。在本实验的培养条件下,大型溞只营孤雌生殖。细胞密度的统计采用的是Nexcelom Cellometer全自动细胞计数仪(美国)。大型溞每天饲喂1次,每隔1 d更换1次养殖水。
1.4 PCP全生命周期暴露及取样
本研究使用环境浓度的PCP开展暴露实验,浓度分别为0、0.15、1.5、15和150 μg·L-1,以溶剂对照作为空白对照,每个浓度设置3个平行暴露装置。每个平行50只出生时间<12 h的幼溞,养殖密度为50 个·L-1。每天上午喂食新鲜的小球藻与斜生栅藻的混合液,每次换水完成后在培养箱内随机摆放烧杯的位置,以排除光照不匀等因素对实验造成的误差。每天记录每个烧杯幼溞的存活个体数,计算累积产溞数和存活率。由于PCP的暴露导致了大型溞的死亡,累积产溞数用大型溞的存活个体数进行修正。基于先前大型溞全生命周期的化学品发育生殖毒性评估方法[16],将其全生命周期分为出生、生长、生殖和衰亡4个生命阶段,由于第62天时其种群基本消亡,而第46天时大型溞的存活率开始下降,因此选择在大型溞的生长阶段(第21天)、生殖阶段(第32天)和衰亡阶段(第46天)测量其体长、心率和平均游泳速度,并在暴露的第32天和第46天时收集大型溞样品,并加入TRIzol试剂,然后匀浆,并置于-80 ℃下保存以用于基因表达的分析。用Leica DMIRB型显微镜(德国)测量体长。将Camtasia Studio与Leica DMIRB连接,通过录制视频(50 fps)来测定大型溞的心率,通过用慢速度播放视频,统计60 s内大型溞的心率。平均游泳速度参数使用NOLDUS公司的Ethovision XT 13软件(荷兰)测量,监测大型溞1 h内的游泳活动,并对其平均速度进行分析。
1.5 水样中PCP含量的测定
在暴露实验的中间阶段采集水样,以确定PCP的暴露浓度。在换水前后的每个暴露组和对照组中收集暴露液。前处理方法为:将1 mL水样与10 μL甲酸混合,加入二氯甲烷萃取,然后将收集的有机层溶液转移到2 mL棕色进样瓶中。重复上述操作,将收集的有机层溶液合并,并使用氮气将其吹干。最后将样品重新溶解在200 μL色谱纯甲醇中[17]。使用Waters公司的超高效液相色谱串联三重四级杆质谱联用仪(Acquity UPLC I-Class Plus/Xevo TQ-XS MS) (美国)进行定量分析。色谱柱为ACQUITY UPLC®C18 (粒径1.8 μm,2.1 mm×100 mm) (美国),流动相为10 mmol·L-1醋酸铵(A)和甲醇(B),流速为0.3 mL·min-1。负极模式下ESI源如下:离子喷雾(ion spray,IS)电压为-4 500 V,气帘气体(curtain gas,CUR)为137 895 Pa,氮气碰撞气体(nitrogen collision gas,CAD)为55 158 Pa,雾化气体(nebulizer gas,GS1)为275 790 Pa,辅助气体(auxiliary gas,GS2)为275 790 Pa,离子源温度为400 ℃,PCP的检出限为1.92 μg·L-1,信噪比为3。
1.6 基因表达检测
根据先前建立的大型溞阶段特异性PCR array,探究可能的致毒机制,其中包含调控大型溞生殖的5条关键代谢通路的24个基因,调控大型溞衰亡的5条关键代谢通路的17个基因[16]。本研究分别用PCP暴露第32天和第46天所取得的样品来探究PCP对大型溞生殖阶段和衰亡阶段关键代谢通路中基因表达的影响。这10条代谢通路名称及包含的基因如表1所示。
表1 大型溞的阶段特异性PCR array包含的代谢通路和基因
Table 1 List of genes and corresponding pathways in the stage-specific PCR array of D. magna
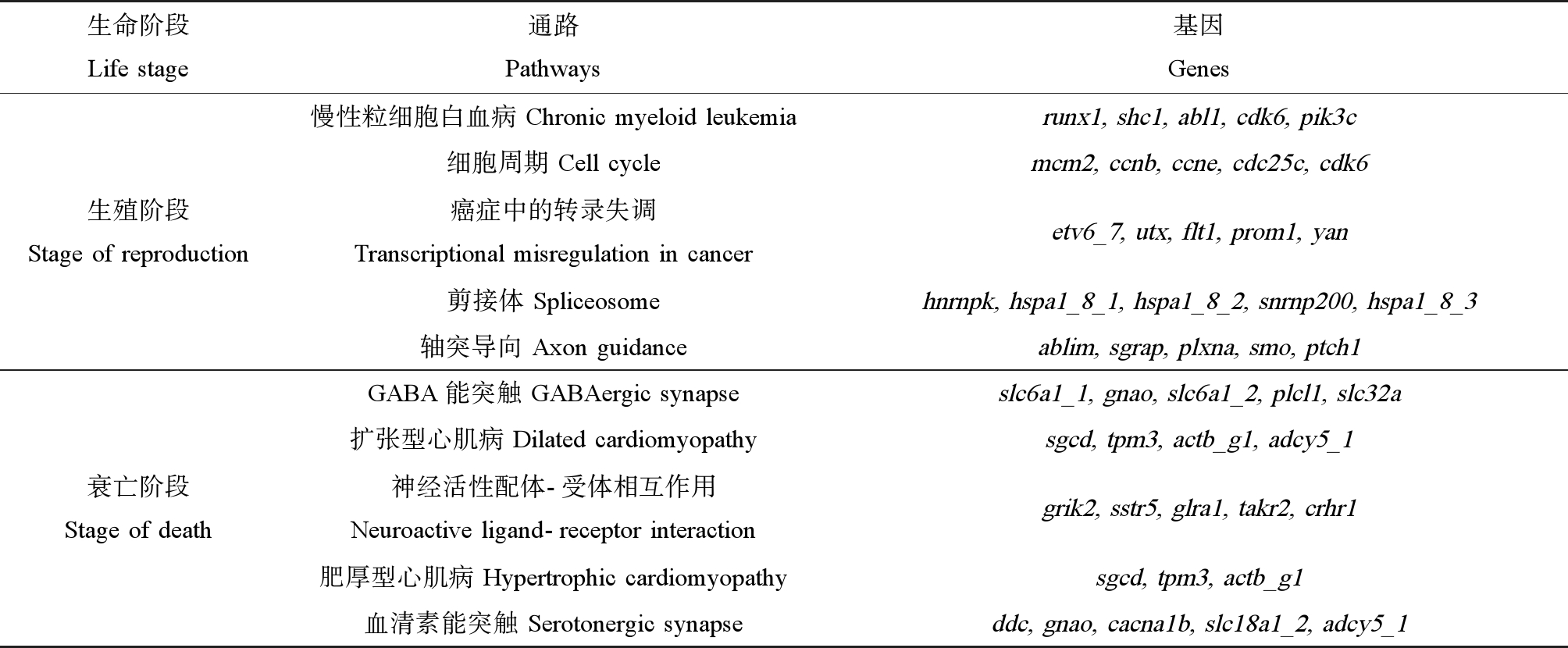
生命阶段Life stage通路Pathways基因Genes生殖阶段Stage of reproduction慢性粒细胞白血病 Chronic myeloid leukemiarunx1, shc1, abl1, cdk6, pik3c细胞周期 Cell cyclemcm2, ccnb, ccne, cdc25c, cdk6癌症中的转录失调Transcriptional misregulation in canceretv6_7, utx, flt1, prom1, yan剪接体 Spliceosomehnrnpk, hspa1_8_1, hspa1_8_2, snrnp200, hspa1_8_3轴突导向 Axon guidanceablim, sgrap, plxna, smo, ptch1衰亡阶段Stage of deathGABA能突触 GABAergic synapseslc6a1_1, gnao, slc6a1_2, plcl1, slc32a扩张型心肌病 Dilated cardiomyopathysgcd, tpm3, actb_g1, adcy5_1神经活性配体-受体相互作用Neuroactive ligand-receptor interactiongrik2, sstr5, glra1, takr2, crhr1肥厚型心肌病 Hypertrophic cardiomyopathysgcd, tpm3, actb_g1血清素能突触 Serotonergic synapseddc, gnao, cacna1b, slc18a1_2, adcy5_1
使用Takara公司的TRIzol试剂盒,并按照使用说明分离样品的总RNA。检测RNA的纯度和浓度,提取总RNA 500 ng,使用Takara公司的Prime Script RT试剂盒进行逆转录。cDNA合成后,使用Takara公司的SYBR Green PreMix Ex TaqII试剂盒进行实时定量PCR。用熔解曲线和标准曲线分别评价PCR反应的质量保证(quantity assurance,QA)和质量控制(quality control,QC)。基因bal2 (蛋白DAPPUDRAFT2_311135)在大型溞不同发育阶段和不同暴露组中表达稳定,因此作为内参基因使用[16]。使用Primer Premier 6软件(加拿大)设计基因的引物序列。本研究中使用的所有引物的扩增效率为95%~103%[16]。RT-qPCR反应扩增程序为:95 ℃,2 min;95 ℃、15 s,60 ℃、1 min,共扩增40个循环;60 ℃、10 min。目的基因的表达分析采用2-ΔΔCT法进行相对表达量的分析[18]。每个浓度设置3个平行组。
1.7 数据分析
数据统计使用的软件是SPSS 25.0(美国,纽约,阿蒙克),数据的正态分布和同质性分别使用Kolmogorov-Smirnov和Levene’s检验,在必要时将数据进行对数转换。暴露组与对照组之间差异性的检验使用的是单因素方差分析法(one-way analysis of variance,ANOVA),相关性分析采用Spearman分析法。在本实验中所有分析的显著性水平设置为P<0.05。使用GraphPad Prism 8.0(美国,加利福尼亚,圣地亚哥)绘制统计图。
2 结果(Results)
2.1 暴露液中PCP的含量测定
PCP的名义浓度分别为0、0.15、1.5、15和150 μg·L-1。实测中,换水前不同暴露组PCP浓度分别为(0.01±0.01)、(0.17±0.02)、(1.75±0.01)、(17.39±0.78)和(166.22±8.47) μg·L-1,换水后不同暴露组PCP浓度分别为(0.01±0.01)、(0.17±0.01)、(1.72±0.07)、(16.29±1.30)和(165.95±14.66) μg·L-1。在换水前后没有观察到PCP的严重损失,PCP的平均浓度分别是(0.01±0.01)、(0.17±0.02)、(1.74±0.05)、(16.84±1.13)和(166.11±9.47) μg·L-1 (图1)。
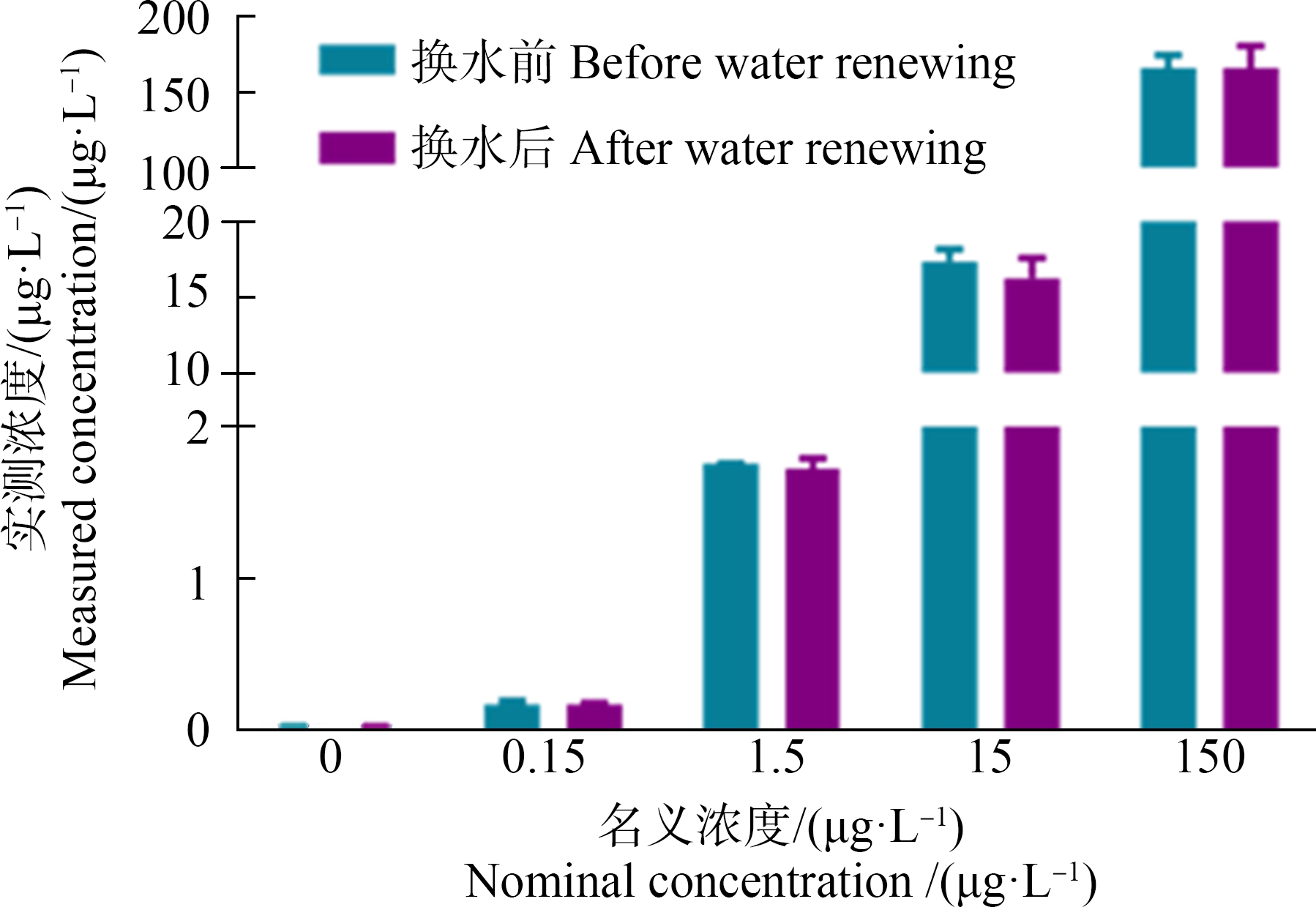
图1 换水前后暴露体系中五氯苯酚(PCP)的名义浓度和实测浓度
注:所有数据表示平均值±标准差,每个浓度有3个平行组。
Fig.1 Nominal and measured concentrations of pentachlorophenol (PCP) in the exposure medium before and after water renewing
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks.
2.2 PCP全生命周期暴露对大型溞存活、生长和生殖的影响
PCP暴露对大型溞存活的影响如图2所示。(166.11±9.47) μg·L-1的PCP暴露后第42天,大型溞的存活率显著下降,第63天时大型溞种群消亡,而对照组和其他暴露组在第70天时大型溞才出现全部死亡的情况。该结果表明随着暴露时间的延长,环境相关浓度PCP暴露使大型溞的寿命显著缩短。
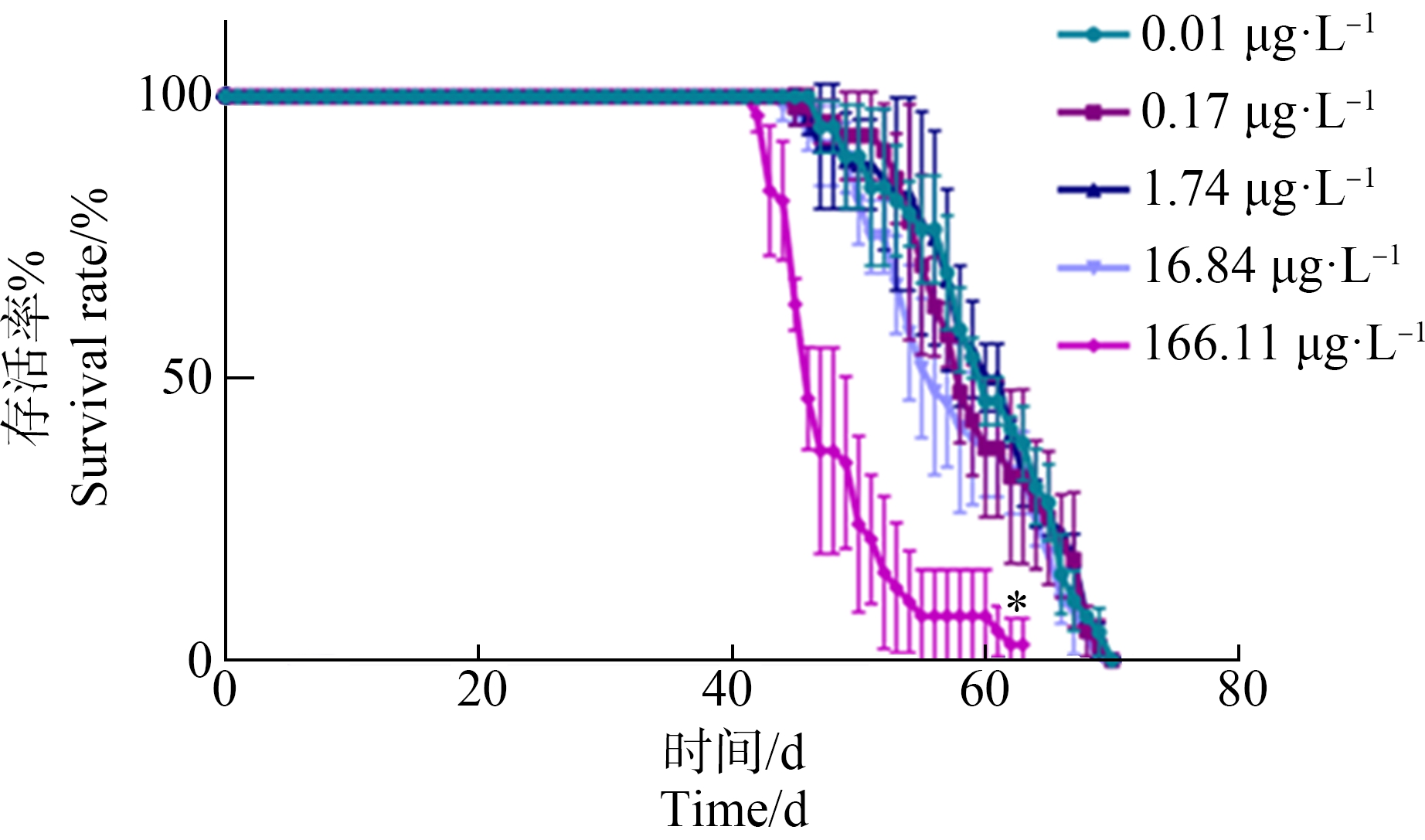
图2 不同浓度PCP全生命周期暴露对大型溞存活率的影响
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.2 Effects of different concentrations of PCP on survival rate of D. magna after the whole-life-stage exposure
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
环境相关浓度PCP全生命周期暴露显著抑制了大型溞的生长。在第32天和第46天,大型溞的体长在(166.11±9.47) μg·L-1的PCP暴露组与对照组相比出现显著降低,分别降低至(2.845±0.042) mm和(2.985±0.032) mm。而(1.74±0.05) μg·L-1和(0.17±0.02) μg·L-1的PCP暴露对其第21天的体长没有显著影响。PCP暴露对大型溞生长的LOEC在第
32天和第46天均为(166.11±9.47) μg·L-1 (图3)。本研究发现环境相关浓度PCP暴露对大型溞具有一定的发育毒性。
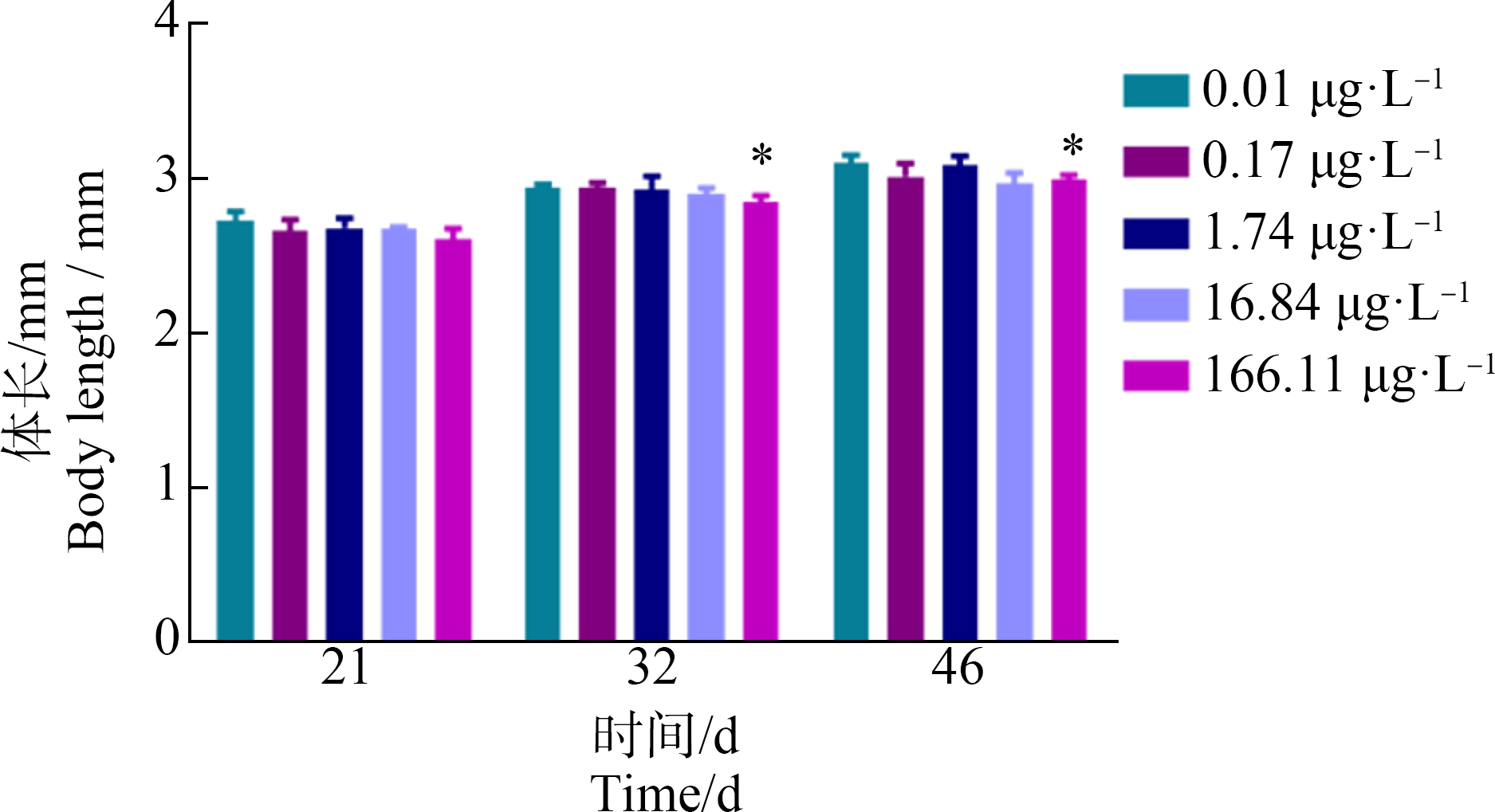
图3 不同浓度PCP全生命周期暴露对大型溞体长的影响
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.3 Effects of different concentrations of PCP on body length of D. magna after the whole-life-stage exposure
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
环境相关浓度的PCP暴露除了对大型溞的存活和生长具有抑制作用外,同时也能显著抑制其生殖。暴露于不同浓度的PCP并没有显著改变大型溞的累积产溞数(图4(a)),但(166.11±9.47) μg·L-1的PCP暴露显著降低大型溞子代的体长,在暴露的第21天,大型溞子代体长从对照组的(0.828±0.006) mm降至(0.733±0.019) mm;在第32天,其子代体长从对照组的(0.839±0.033) mm降至(0.771±0.018) mm;在第46天,其子代体长从对照组的(0.844±0.013) mm降至(0.780±0.014) mm (图4(b))。此外,PCP暴露对幼溞体长的LOEC由第21天和第32天的(166.11±9.47) μg·L-1降至第46天的(16.84±1.13) μg·L-1。该结果说明环境相关浓度PCP暴露能对大型溞造成一定生殖毒性。
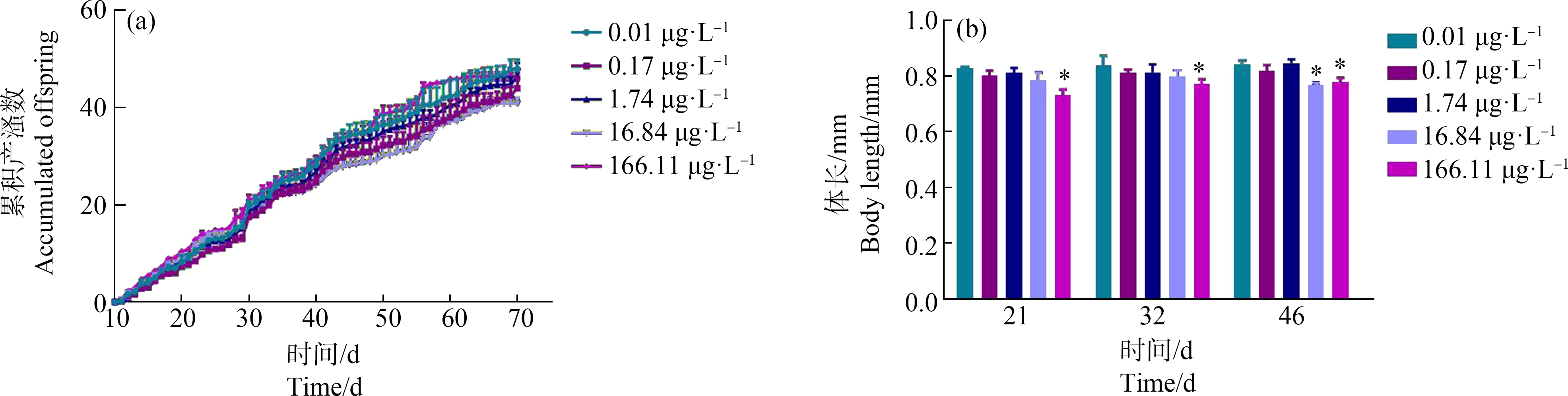
图4 PCP全生命周期暴露对大型溞生殖的影响:大型溞全生命周期的累积产溞数(a)和子代体长(b)
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.4 Effects of PCP on reproduction of D. magna after the whole-life-stage exposure:The accumulated offspring number (a) and neonate body length (b)
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
2.3 PCP全生命周期暴露对大型溞心率和游泳行为的影响
在心率方面,环境相关浓度PCP暴露对不同生命阶段大型溞的心率影响不同。在生长阶段(第21天)和生殖阶段(第32天),不同浓度的PCP暴露均能显著促进其心率上升;而在衰亡阶段(第46天),对照组的心率为(312.31±7.416) beat·min-1,(16.84±1.13) μg·L-1和(166.11±9.47) μg·L-1的PCP暴露对其心率产生显著的抑制效应,心率分别为(290.07±5.882) beat·min-1和(276.91±6.000) beat·min-1 (图5)。
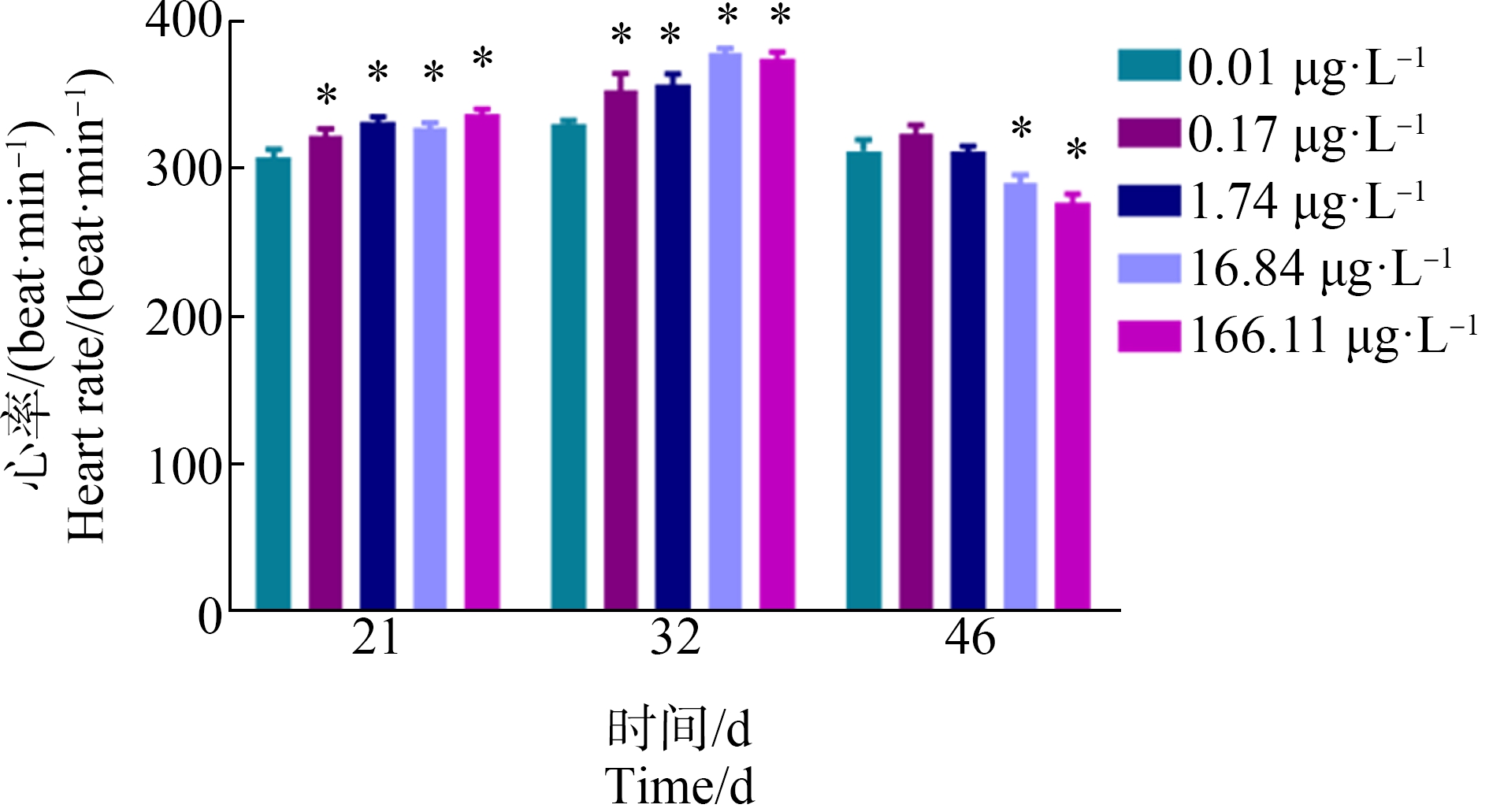
图5 不同浓度PCP全生命周期暴露对大型溞心率的影响
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.5 Effects of different concentrations of PCP on heart rate of D. magna after the whole-life-stage exposure
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
对于大型溞的游泳行为,(1.74±0.05) μg·L-1和(166.11±9.47) μg·L-1的PCP暴露显著降低了大型溞各取样时间点的平均游泳速度,而暴露于(16.84±1.13) μg·L-1 PCP组的大型溞的平均游泳速度仅在第21天和第46天出现显著降低。各取样时间点的LOEC均为(1.74±0.05) μg·L-1 (图6)。本研究的结果表明,环境相关浓度PCP暴露能够对大型溞的游泳行为造成一定的抑制作用。
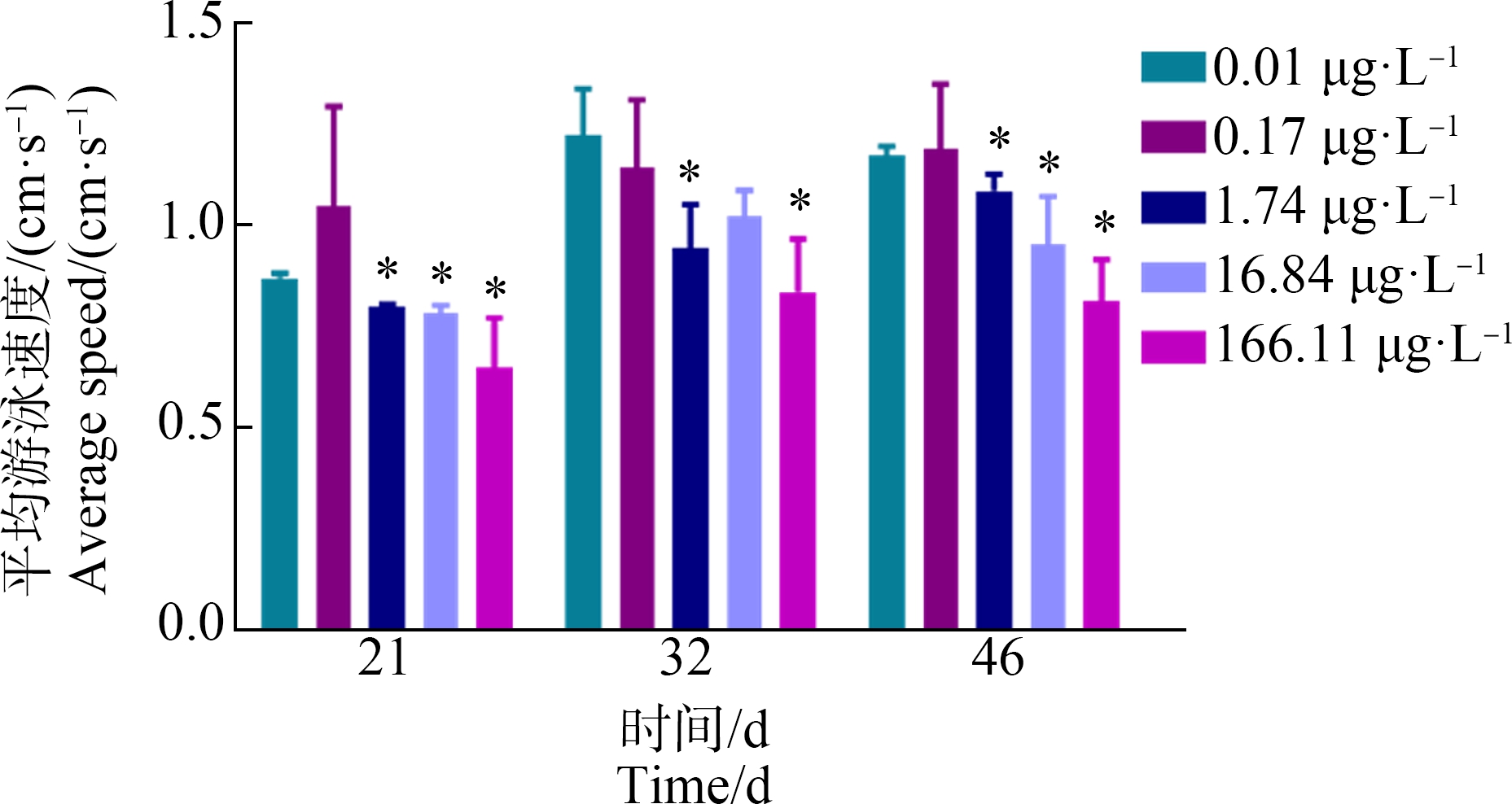
图6 不同浓度PCP全生命周期暴露对大型溞平均游泳速度的影响
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.6 Effects of different concentrations of PCP on average swim speed of D. magna after the whole-life-stage exposure
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
2.4 PCP全生命周期暴露对大型溞基因表达的影响
调控大型溞生殖阶段的5条关键代谢通路包含的24个基因,在PCP暴露的第32天,并没有引起大型溞相关基因的表达量发生显著性变化(图7)。调控大型溞衰亡阶段的5条关键代谢通路包含的17个基因,在暴露的第46天,(166.11±9.47) μg·L-1的PCP暴露引起大型溞衰亡阶段的13个基因表达量显著上调,其中基因主要富集在γ-氨基丁酸(γ-aminobutyric acid,GABA)能突触、扩张型心肌病、神经活性配体-受体相互作用和血清素能突触4条通路上。较低浓度组(16.84±1.13)、(1.74±0.05)和(0.17±0.02) μg·L-1的PCP暴露并没有引起大型溞衰亡阶段相关基因的表达量发生显著性变化(图8)。
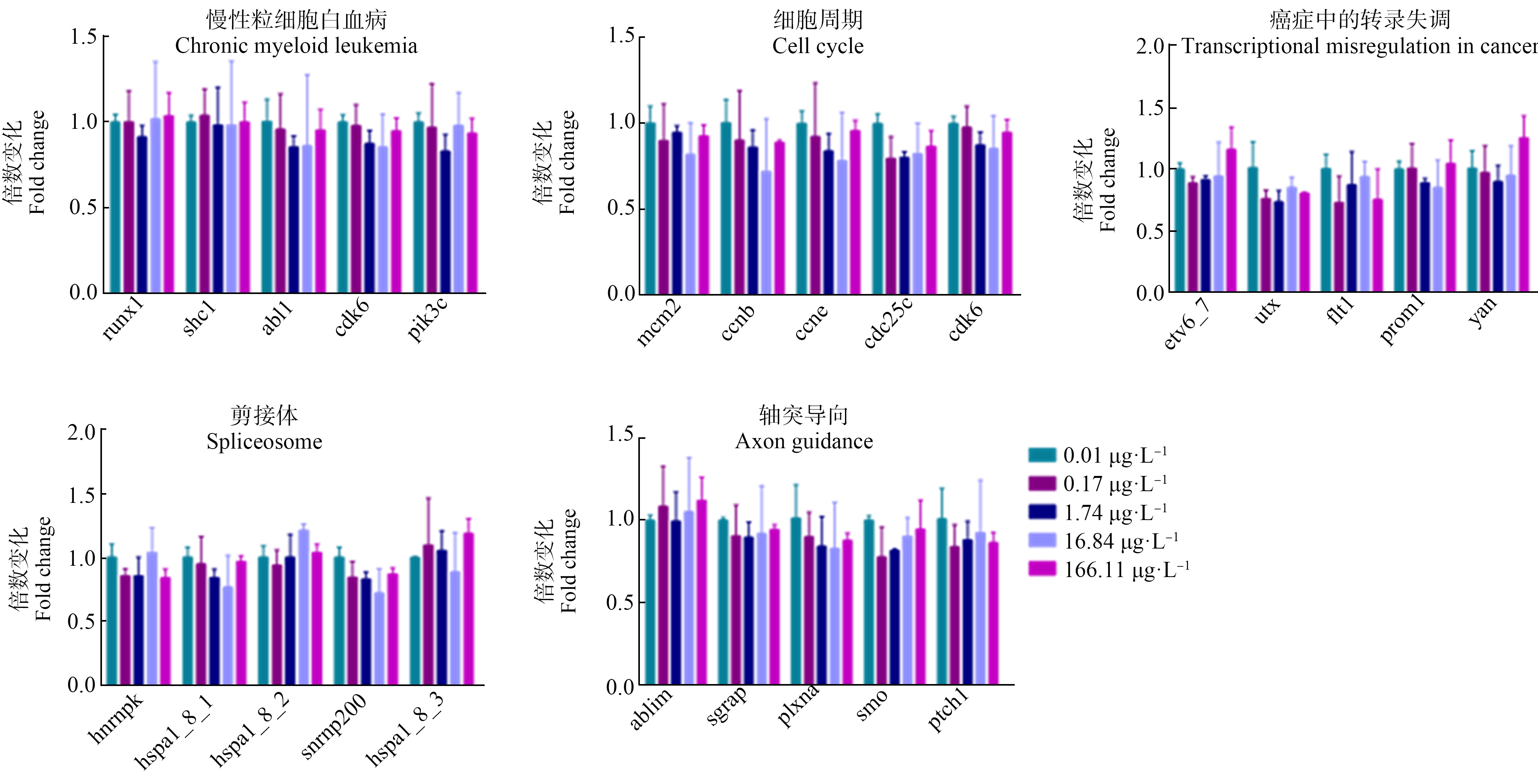
图7 不同浓度的PCP暴露32 d后,大型溞生殖阶段关键代谢通路中基因的表达量
注:所有数据表示平均值±标准差,每个浓度有3个平行组;*代表P<0.05,表示与对照组相比有显著差异。
Fig.7 Effects of different concentrations of PCP on the expression of genes selected at the reproduction stage of D. magna after exposure for 32 d
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks;* represented that the exposure group had significant difference at P<0.05 level when compared with control.
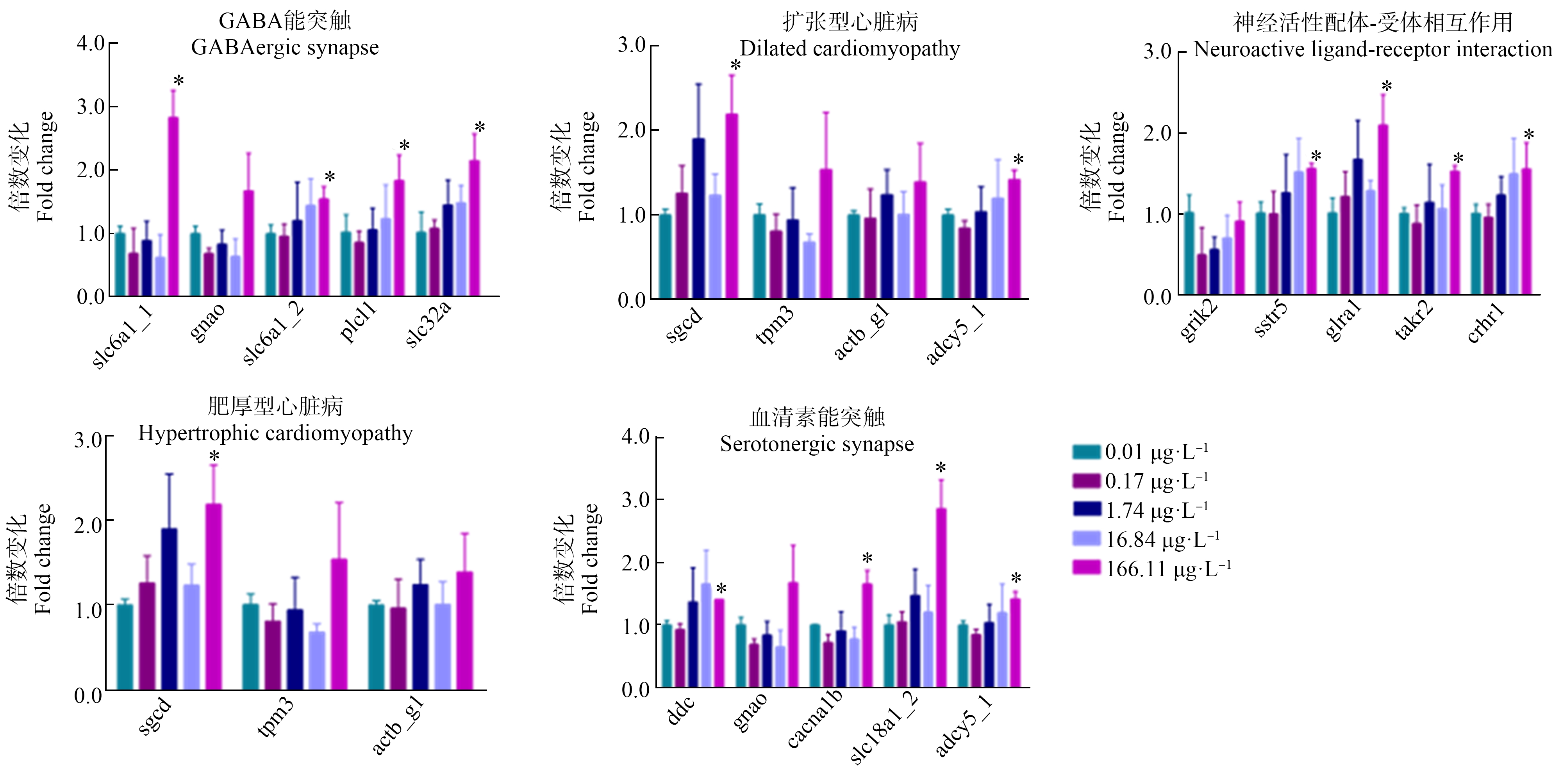
图8 不同浓度的PCP暴露46 d后,大型溞衰亡阶段关键代谢通路中基因的表达量
注:所有数据表示平均值±标准差,每个浓度有3个平行组。
Fig.8 Effects of different concentrations of PCP on the expression of genes selected at the death stage of D. magna after exposure for 46 d
Note:Values are expressed as mean±SD,and each concentration group had three replicate tanks.
2.5 相关分析
通过分析大型溞衰亡阶段的心率、平均游泳速度和基因表达量的相关性(表2),发现与大型溞衰亡阶段有关的13个显著上调的基因中有8个与心率和平均游泳速度显著相关(P<0.05)。并且,平均游泳速度与心率呈显著相关(P<0.01)。
表2 大型溞衰亡阶段心率、平均游泳速度和基因表达量的Spearman相关分析
Table 2 Spearman correlation analysis of heart rate,average swimming speed and gene expression in the stage of death of Daphnia magna
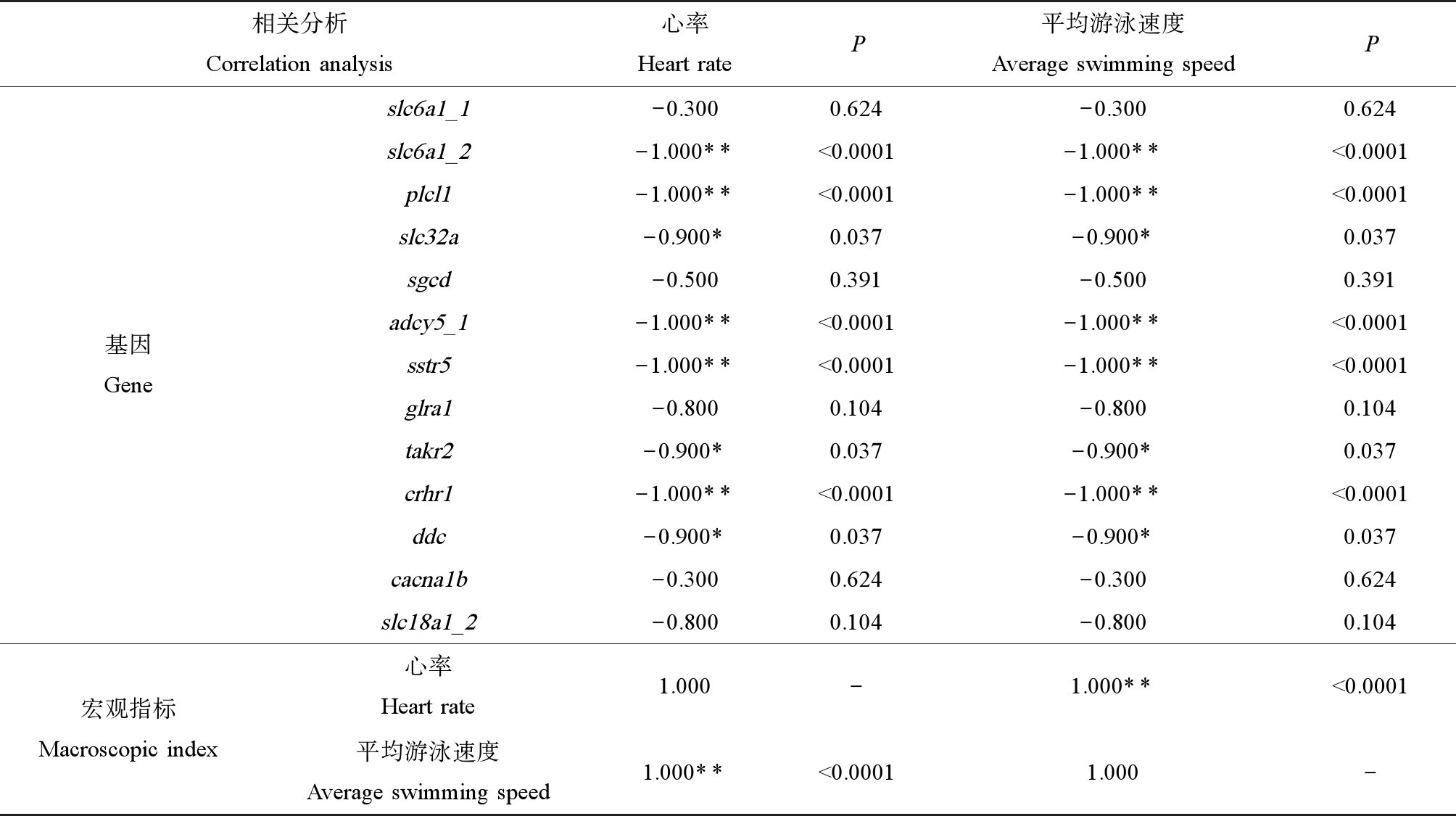
相关分析Correlation analysis心率Heart rateP平均游泳速度Average swimming speedP基因Geneslc6a1_1-0.3000.624-0.3000.624slc6a1_2-1.000**<0.0001-1.000**<0.0001plcl1-1.000**<0.0001-1.000**<0.0001slc32a-0.900*0.037-0.900*0.037sgcd-0.5000.391-0.5000.391adcy5_1-1.000**<0.0001-1.000**<0.0001sstr5-1.000**<0.0001-1.000**<0.0001glra1-0.8000.104-0.8000.104takr2-0.900*0.037-0.900*0.037crhr1-1.000**<0.0001-1.000**<0.0001ddc-0.900*0.037-0.900*0.037cacna1b-0.3000.624-0.3000.624slc18a1_2-0.8000.104-0.8000.104宏观指标Macroscopic index心率Heart rate1.000-1.000**<0.0001平均游泳速度Average swimming speed1.000**<0.00011.000-
注:*代表0.05水平相关性显著(双尾);**代表0.01水平相关性显著(双尾)。
Note:* represented that correlation is significant at the 0.05 level (2-tailed);** represented that correlation is significant at the 0.01 level (2-tailed).
3 讨论(Discussion)
本研究中,采用的PCP暴露浓度均为环境相关浓度,在换水前后PCP的暴露浓度没有发生显著变化,说明PCP基本没有发生降解,暴露体系是可靠的。环境相关浓度的PCP暴露导致了大型溞群体的过早死亡。相比之下,一项研究表明,暴露于746 μg·L-1的PCP也显著降低了大型溞的存活率,使其寿命缩短[19]。此外,本研究发现环境相关浓度PCP暴露显著抑制了大型溞的体长。先前有研究报道PCP的发育毒性,Chen等[20]发现532.66 μg·L-1或更高浓度的PCP 21 d暴露显著降低了大型溞的体长。值得注意的是,在本研究中PCP在第21天的暴露后才对大型溞的生长造成了抑制,而不是在快速生长阶段(0~12 d)产生抑制,这可能是由于PCP对大型溞蜕皮过程的抑制所致,蜕皮是控制大型溞生长发育的重要生理过程,发生在其全生命周期中[21]。另外,最近的研究表明,PCP可以显著下调土壤跳虫白符跳(Folsomia candida)蜕皮相关基因的表达量[22],但PCP对大型溞生长的抑制作用是否与其蜕皮过程有关,有待进一步研究。本研究发现环境相关浓度PCP的暴露显著抑制了大型溞的子代体长,而没有显著改变子代的数量,推测可能是大型溞在抵御PCP暴露的压力上投入了更多的能量,而分配给生殖的能量较少,从而产生了较小的幼溞。这一假设得到了前人研究的支持[23-25]。例如,由于能量资源重新分配带来的负反馈适应结果,在长期镉(Cd)暴露后,大型溞的子代数量显著下降。同时,上述结果也表明,在大型溞的生殖指标中,生殖质量可能比生殖数量更加敏感,这与先前的研究结果相一致[15]。综上所述,环境相关浓度的PCP暴露对大型溞的生长和存活率有显著抑制作用,且随着暴露时间的延长,PCP暴露对大型溞造成发育毒性、生殖毒性和存活率的LOEC出现降低,与部分生命周期暴露相比,环境相关浓度PCP暴露对其全生命周期生长、生殖和存活率影响更加明显,这与先前关于环境相关浓度磷酸三(1,3-二氯异丙基)酯(TDCIPP)对大型溞生长、生殖和存活率影响的结果相一致[15-16],以上结果说明了天然水域中PCP可能会对寿命短并且全生命周期生活于自然水体中的浮游动物造成潜在风险。
据报道,大型溞的肌源性心脏结构与人类心脏较为相似,对外源化学物质的反应与人类心脏也有相似之处,在一些研究中,大型溞的心率常被用作生理效应的指标[26-28]。有研究发现,大量的外源化学物质会对大型溞的心率产生显著影响[29-31]。心率的变化可能反映了污染物对水生动物能量代谢和血液循环系统的影响[29]。而化学物质对大型溞心率的影响并不总是一致的。例如,在20 mg·L-1甲醛和25 mg·L-1四氢嘧啶的混合暴露体系中,随着暴露时间的增加,大型溞的心率显著降低[32]。而暴露于0.1 mmol·L-1尼古丁会导致其心率显著增加[33]。在本研究中,心率是一个相对敏感的参数,PCP暴露对大型溞心率的LOEC为(0.17±0.02) μg·L-1,这表明暴露于环境相关浓度的PCP对大型溞的心率具有显著影响,因此,推测大型溞的心率可能对PCP较为敏感。游泳速度在浮游动物中是一个重要的行为参数。先前的研究表明,PCP能够改变浮游动物的游泳行为[34-36]。最近的一项研究表明,暴露于0.8 mg·L-1的PCP 3 h可剂量依赖性地抑制大型溞的趋光行为[34],而暴露于190 mg·L-1的PCP 48 h可导致淡水轮虫的游泳速度受到抑制[35]。此外,在污染物PCP的胁迫下,蚤状溞(Daphnia pulex)的游动速度也有所下降[36]。这些结果与本研究结果是一致的。此外,有研究发现大型溞的游泳速度随体型的不同而不同,任何影响其体型的因素都会对游泳速度产生影响[13,37]。这与本研究中PCP暴露影响大型溞平均游泳速度与体长的关系结果一致,证实了其体型与游泳速度的直接关系。同时,大型溞的游动行为改变也影响着其捕食行为,从而可能增加其一定的饥饿死亡风险[38]。综上所述,环境相关浓度PCP暴露对大型溞的心率和游泳行为产生显著影响,虽然与部分生命周期暴露相比,随着暴露时间的延长,LOEC没有出现降低的趋势,但相较于生长和生殖指标LOEC显示出更低的趋势,这表明,大型溞的心率和游泳行为指标可能相比生长和生殖指标更为敏感。
在本研究中,(166.11±9.47) μg·L-1的PCP暴露没有显著改变大型溞生殖阶段多条关键信号通路中相关基因的表达,但是使大型溞衰亡阶段多条关键信号通路中相关基因的表达量显著上调,说明PCP可能会显著影响大型溞死亡的基因调控,而对其生殖的调控较弱。与上述宏观指标对比后也发现大型溞不同生命阶段对PCP的敏感性有所不同,可能对其衰亡阶段的影响更大。有研究显示,扩张型心肌病是引起肌源性心脏功能紊乱导致心力衰竭的最常见原因,并能造成大型溞群体的过早死亡[39-41],本研究中PCP的暴露显著上调了大型溞扩张型心脏病通路相关基因的表达,进而可能造成其心脏功能紊乱,心率下降,最终导致其群体死亡时间提前,这也与大型溞存活率指标的结果相一致,但与其存活率下降的具体联系仍需进一步研究。GABA是动物中枢神经系统中含量最丰富的抑制性神经递质[35]。在无脊椎动物中,GABA介导的神经控制周围肌肉,而且总GABA的增加会导致心血管活动的减少,造成无脊椎动物的运动能力下降甚至死亡[36,42]。同形溞(Daphnia similis)暴露于阿维菌素可导致其与GABA受体结合,激活突触后膜上的氯离子通道,导致不可逆转的超极化,从而抑制神经冲动的传递[43]。血清素(serotonin)水平过高与动物心脏和肺部疾病有关,血清素能突触在动物感知疼痛、运动和内分泌等生理功能中发挥重要作用[37]。在甲壳类动物中,血清素能神经元(serotonergic neuron)参与控制行为和代谢,有研究指出,通过增加大型溞体内血清素水平,会导致其耐低氧能力降低、更加强烈的趋光行为以及基础运动能力的减退,这不利于大型溞的捕食[44-45]。本研究中,PCP暴露导致大型溞GABA能突触和血清素能突触通路相关基因上调,可能干扰两者突触的功能,进而使大型溞GABA和血清素体内水平上升,抑制了与其运动相关的神经元活动,最终导致大型溞游泳距离的下降,但具体机制有待进一步研究。本研究将大型溞衰亡阶段显著上调的基因与心率、平均游泳速度进行了相关性分析,发现呈彼此呈显著负相关关系,说明与大型溞心脏病和神经递质相关的通路在衰亡阶段确实与心率下降和游泳速度下降有关,但具体关联机制需要进一步研究。因此,本实验推测由于环境相关浓度PCP暴露导致与大型溞扩张型心肌病、血清素能突触和GABA通路相关基因的表达量显著上调,大型溞在衰亡阶段心率下降可能与心脏功能障碍有关,引发其心力衰竭,加速其过早死亡;并且大型溞游泳运动能力下降可能与其神经活动抑制有关,造成其捕食效率和躲避天敌的能力下降,最终两者可能共同导致其种群发生过早消亡的情况。此外,神经活性配体-受体相互作用通路中相关基因表达量也出现显著上调,仍需要进一步研究其与大型溞存活率下降的关系。
综上所述,本研究利用先前建立的基于大型溞全生命周期的化学品毒性评估方法[16],研究PCP对大型溞暴露的毒性效应。结果表明,环境相关浓度PCP暴露对大型溞的生殖、生长、存活、心率和游泳行为产生了负面影响,并且对大型溞心率和游泳行为负面影响更为明显,这可能会导致大型溞引发心脏疾病,并且抑制运动相关的神经元,造成其平均寿命的缩短以及基础活动的减弱,使其群体过早死亡,致使大型溞种群衰退,最终对淡水生态系统生物多样性造成一定影响,推测可能的原因是大型溞衰亡阶段关键通路的相关基因上调致使其心脏功能障碍并抑制了其神经活动。此外,随着暴露时间的延长,上述部分生理指标的LOEC呈下降趋势,这表明,全生命周期暴露相较部分生命周期暴露显示出更显著的毒性效应,因此全生命周期的毒性评估方法具有更好的环境风险评价优势。
[1] Zheng W W,Wang X,Yu H,et al.Global trends and diversity in pentachlorophenol levels in the environment and in humans:A meta-analysis [J].Environmental Science &Technology,2011,45(11):4668-4675
[2] Zheng W W,Yu H,Wang X,et al.Systematic review of pentachlorophenol occurrence in the environment and in humans in China:Not a negligible health risk due to the re-emergence of schistosomiasis [J].Environment International,2012,42:105-116
[3] Zha J M,Wang Z J,Schlenk D.Effects of pentachlorophenol on the reproduction of Japanese medaka (Oryzias latipes) [J].Chemico-Biological Interactions,2006,161(1):26-36
[4] Li H X,Drouillard K G,Bennett E,et al.Plasma-associated halogenated phenolic contaminants in benthic and pelagic fish species from the Detroit River [J].Environmental Science &Technology,2003,37(5):832-839
[5] Cheng Y,Ekker M,Chan H M.Relative developmental toxicities of pentachloroanisole and pentachlorophenol in a zebrafish model (Danio rerio) [J].Ecotoxicology and Environmental Safety,2015,112:7-14
[6] Muir J,Eduljee G.PCP in the freshwater and marine environment of the European Union [J].The Science of the Total Environment,1999,236(1-3):41-56
[7] Gifford J S,Buckland S J,Judd M C,et al.Pentachlorophenol (PCP),PCDD,PCDF and pesticide concentrations in a freshwater lake catchment [J].Chemosphere,1996,32(11):2097-2113
[8] Anderson B G,Jenkins J C.A time study of events in the life span of Daphnia magna [J].The Biological Bulletin,1942,83(2):260-272
[9] Adema D M M.Daphnia magna as a test animal in acute and chronic toxicity tests [J].Hydrobiologia,1978,59(2):125-134
[10] Schechter V.Effect of heparin and of vitamin K on the life span of Daphnia magna [J].Proceedings of the Society for Experimental Biology and Medicine Society for Experimental Biology and Medicine,1950,74(4):747-748
[11] Crosby D G,Tucker R K,Aharonson N.The detection of acute toxicity with Daphnia magna [J].Food and Cosmetics Toxicology,1966,4:503-514
[12] Postmes T J,Nacken G,Nelissen R G.An electronic method for measuring the heart frequency of the waterflea:Daphnia pulex [J].Experientia,1974,30(12):1478-1480
[13] Stollewerk A.The water flea Daphnia—A ‘new’ model system for ecology and evolution?[J].Journal of Biology,2010,9(2):21
[14] Chen Y,Huang J,Xing L Q,et al.Effects of multigenerational exposures of D. magna to environmentally relevant concentrations of pentachlorophenol [J].Environmental Science and Pollution Research,2014,21(1):234-243
[15] Li H,Su G Y,Zou M,et al.Effects of tris(1,3-dichloro-2-propyl) phosphate on growth,reproduction,and gene transcription of Daphnia magna at environmentally relevant concentrations [J].Environmental Science &Technology,2015,49(21):12975-12983
[16] Li H,Yuan S L,Su G Y,et al.Whole-life-stage characterization in the basic biology of Daphnia magna and effects of TDCIPP on growth,reproduction,survival,and transcription of genes [J].Environmental Science &Technology,2017,51(23):13967-13975
[17] Jiang H P,Zhang Y H,Chen X G,et al.Simultaneous determination of pentachlorophenol,niclosamide and fenpropathrin in fishpond water using an LC-MS/MS method for forensic investigation [J].Analytical Methods,2013,5(1):111-115
[18] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J].Methods,2001,25(4):402-408
[19] Sánchez P,Alonso C,Fernández C,et al.Evaluation of a multi-species test system for assessing acute and chronic toxicity of sediments and water to aquatic invertebrates:Effects of pentachlorophenol on Daphnia magna and Chironomus prasinus (6 pp) [J].Journal of Soils and Sediments,2005,5(1):53-58
[20] Chen Y,Huang J,Xing L Q,et al.Effects of multigenerational exposures of D. magna to environmentally relevant concentrations of pentachlorophenol [J].Environmental Science and Pollution Research International,2014,21(1):234-243
[21] Martin-Creuzburg D,Westerlund S A,Hoffmann K H.Ecdysteroid levels in Daphnia magna during a molt cycle:Determination by radioimmunoassay (RIA) and liquid chromatography-mass spectrometry (LC-MS) [J].General and Comparative Endocrinology,2007,151(1):66-71
[22] 张倩倩,乔敏.五氯酚对土壤跳虫代谢转化酶基因和蜕皮相关基因表达的影响[J].生态毒理学报,2017,12(5):72-78
Zhang Q Q,Qiao M.Effects of pentachlorophenol on expression of metabolic enzyme genes and molt-related genes of soil collembolan [J].Asian Journal of Ecotoxicology,2017,12(5):72-78 (in Chinese)
[23] Levitan D R.Density-dependent size regulation and negative growth in the sea urchin Diadema antillarum Philippi [J].Oecologia,1988,76(4):627-629
[24] Muyssen B T A,Messiaen M,Janssen C R.Combined cadmium and temperature acclimation in Daphnia magna:Physiological and sub-cellular effects [J].Ecotoxicology and Environmental Safety,2010,73(5):735-742
[25] Knops M,Altenburger R,Segner H.Alterations of physiological energetics,growth and reproduction of Daphnia magna under toxicant stress [J].Aquatic Toxicology,2001,53(2):79-90
[26] Ream R A,Theriot J A,Somero G N.Influences of thermal acclimation and acute temperature change on the motility of epithelial wound-healing cells (keratocytes) of tropical,temperate and Antarctic fish [J].The Journal of Experimental Biology,2003,206(Pt 24):4539-4551
[27] Bekker J M,Krijgsman B J.Physiological investigations into the heart function of Daphnia [J].The Journal of Physiology,1951,115(3):249-257
[28] Pirtle T J,Carr T L,Khurana T,et al.ZD7288 and mibefradil inhibit the myogenic heartbeat in Daphnia magna indicating its dependency on HCN and T-type calcium ion channels [J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2018,222:36-42
[29] Villegas-Navarro A,Rosas-L E,Reyes J L.The heart of Daphnia magna:Effects of four cardioactive drugs [J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2003,136(2):127-134
[30] Podosinovikova N P,Ezhov N F,Saǐkina N A,et al.Heart rate in Daphnia magna as a functional test for assessing efficacy of chemical agents [J].Eksperimental’Naia i Klinicheskaia Farmakologiia,2008,71(3):54-56
[31] Clemedson C,Ekwall B.Overview of the final MEIC results:Ⅰ.the In vitro—In vitro evaluation [J].Toxicology in Vitro,1999,13(4-5):657-663
[32] Bownik A,Stępniewska Z.Ectoine alleviates behavioural,physiological and biochemical changes in Daphnia magna subjected to formaldehyde [J].Environmental Science and Pollution Research,2015,22(20):15549-15562
[33] Corotto F,Ceballos D,Lee A,et al.Making the most of the Daphnia heart rate lab:Optimizing the use of ethanol,nicotine &caffeine [J].The American Biology Teacher,2010,72(3):176-179
[34] Yuan L,Michels E,De Meester L.Changes in phototactic behavior of Daphnia magna clone C1 242 in response to copper,cadmium and pentachlorophenol [J].Journal of Environmental Sciences (China),2003,15(6):841-847
[35] Preston B L,Snell T W,Dusenbery D B.The effects of sublethal pentachlorophenol exposure on predation risk in freshwater rotifer species [J].Aquatic Toxicology,1999,47(2):93-105
[36] Yu G,Kong D,Li B.Study on swimming behavior change of Daphnia pulex under stress of four toxic substances [J].Environmental Science &Technology,2019,42(1):112-118
[37] Baillieul M,Blust R.Analysis of the swimming velocity of cadmium-stressed Daphnia magna [J].Aquatic Toxicology,1999,44(4):245-254
[38] Lovern S B,Strickler J R,Klaper R.Behavioral and physiological changes in Daphnia magna when exposed to nanoparticle suspensions (titanium dioxide,nano-C60,and C60HxC70Hx) [J].Environmental Science &Technology,2007,41(12):4465-4470
[39] Towbin J A,Lorts A.Arrhythmias and dilated cardiomyopathy common pathogenetic pathways?[J].Journal of the American College of Cardiology,2011,57(21):2169-2171
[40] Araco M,Merlo M,Carr-White G,et al.Genetic bases of dilated cardiomyopathy [J].Journal of Cardiovascular Medicine,2017,18(3):123-130
[41] Davili Z,Johar S,Hughes C,et al.Succinate dehydrogenase deficiency associated with dilated cardiomyopathy and ventricular noncompaction [J].European Journal of Pediatrics,2007,166(8):867-870
[42] Lopes C,Charles S,Vollat B,et al.Toxicity of ivermectin on cladocerans:Comparison of toxic effects on Daphnia and Ceriodaphnia species [J].Environmental Toxicology and Chemistry,2009,28(10):2160-2166
[43] Novelli A,Vieira B H,Cordeiro D,et al.Lethal effects of abamectin on the aquatic organisms Daphnia similis,Chironomus xanthus and Danio rerio [J].Chemosphere,2012,86(1):36-40
[44] Rivetti C,Campos B,Pi a B,et al.Tryptophan hydroxylase (TRH) loss of function mutations induce growth and behavioral defects in Daphnia magna [J].Scientific Reports,2018,8:1518
a B,et al.Tryptophan hydroxylase (TRH) loss of function mutations induce growth and behavioral defects in Daphnia magna [J].Scientific Reports,2018,8:1518
[45] Bellot M,Faria M,Gómez-Canela C,et al.Pharmacological modulation of behaviour,serotonin and dopamine levels in Daphnia magna exposed to the monoamine oxidase inhibitor deprenyl [J].Toxics,2021,9(8):187