塑料制品因其轻便耐腐蚀以及生产成本低而广泛应用于日常生活中,尤其是2020年新型冠状病毒在全球流行期间使用的个人防护用品,如全球每月大约使用1.290×1011个口罩和6.50×1010只手套,这些仍未得到人们重视和妥善处理的塑料制品,终将进入到自然环境中[1-3]。环境中的塑料垃圾几乎不会自然降解,只会在物理、化学或微生物作用下分解成越来越小的碎片,人们通常将直径<5 mm的碎片称为微塑料[4-5]。微塑料广泛分布于环境中的各个角落,包括最偏远的南极与北极,珠穆朗玛峰顶与马里亚纳海沟[6-9]。微塑料具有电负性和较大的比表面积,会吸附环境中的重金属与有机物等污染物,增加对生物体的影响[10]。目前我国淡水中的微塑料数量约为0.55×105~3.42×107 microspheres·km-2 (即个·km-2,本文均使用microspheres表示微塑料个数)[11],也有学者提出水环境中的微塑料浓度为1×106 microspheres·L-1[12-14]。研究表明,水中的微塑料颗粒可以被水生生物摄取,通过食物链富集,最终到达人类体内[15]。因此,水体中存在的微塑料不容忽视。
微塑料的形状和颜色与浮游动物相似,导致其非常容易被鱼类当作食物摄入[16]。有研究发现,摄入的微塑料会在鱼类的鳃和肠道中积累,甚至通过循环系统积累在肝脏和大脑中[17],对这些组织造成物理磨损等影响,导致鱼类的生理生化以及行为发生改变[18],主要表现为减少游泳速度和活动范围,减弱摄食能力与摄食速度,降低能量储备与营养成分,最终导致生长速度和繁殖产量受到影响[12,19]。此外,研究表明生物体内积累的微塑料会造成诸多影响,例如内分泌紊乱[4]、氧化损伤和神经毒性[20]、酶活性降低[21]、肠道菌群改变[22]、细胞坏死[23]和存活率降低[24]。此外,微塑料还导致鱼类代谢紊乱,主要表现在干扰其能量代谢[25]、糖代谢和脂代谢[26]。但不同粒径不同浓度以及暴露时间的不同对鱼类肝脏代谢的干扰可能会不同。微塑料暴露120 h会导致斑马鱼幼鱼的行为和视觉基因的表达产生影响[27],而暴露7 d后则会干扰斑马鱼幼鱼的代谢谱,主要表现为能量代谢和糖脂代谢受到干扰[28]。目前微塑料的急性暴露大多是关于幼鱼的研究,对成鱼肝脏具体代谢机制的影响研究仍不充分,需进行相关方面的研究来补充。因此选择成年剑尾鱼暴露时间为72 h,来探讨微塑料短期暴露是否对成鱼肝脏造成干扰。
剑尾鱼(Xiphophorus helleri)是一种小型、卵胎生和易喂养的花鳉科鱼类,因其具备繁殖世代时间短(1~1.5个月)、易区分雌雄、对环境变化敏感和便于在实验室条件下进行纯化培养等特点,被用作水生实验动物的模式生物[29]。在本研究中,将成年剑尾鱼暴露在直径5 μm不同浓度的聚苯乙烯微塑料中72 h,检测急性暴露是否会诱导剑尾鱼肝脏氧化应激和代谢失调,以探讨微塑料对水生生物的潜在毒性与干扰机理,为微塑料对水生生物造成的潜在健康风险提供新的见解。在此,本研究有以下2个目的:(1) 随着环境中塑料垃圾的剧增,未来短期内剧增的微塑料颗粒是否会加深对鱼类的影响?(2) 目前微塑料暴露对鱼类的已知影响是否会在肝脏代谢水平上有所体现?
1 材料与方法(Materials and methods)
1.1 实验材料与实验用鱼
本研究中使用的5 μm球形单分散绿色荧光微塑料颗粒购自天津市倍思乐色谱技术开发中心,微塑料基质为聚苯乙烯塑料,可以均匀分散于水中,最大激发和发射波长为470 nm和526 nm。本次实验动物为雄性红眼红体剑尾鱼,购于陕西红剑鱼养殖基地。选择5月龄、规格相近、体表无伤痕、鳞片完整、体色鲜艳且体质健壮的红剑尾鱼作为实验鱼。正式实验前,对剑尾鱼进行为期2周的驯化,水温(26±0.5) ℃,溶解氧≥5 mg·L-1,24 h曝气,14 h光/10 h暗周期,每天投喂2次(上午9:00和下午17:00),投喂的饲料为寸金牌商品饲料,每天投喂量为鱼体质量的3%,每3天更换1次水。
1.2 实验设计与组织样本处理
实验分为3个组,分别为对照组(无微塑料颗粒)、1×106 microspheres·L-1、1×107 microspheres·L-1,每组3个平行,每个平行中25条剑尾鱼。暴露前配制各组微塑料溶液,并进行超声波处理,确保微塑料颗粒均匀分布在水中,并记录水位,每天加入曝气后的自来水至刻度线,防止水分蒸发带来的实验误差,暴露期间的环境与驯养时保持一致,72 h暴露后使用鱼用麻醉剂进行麻醉,在超净工作台内用蒸馏水冲洗鱼体3次后置于冰上进行解剖取肝脏,组内随机选6条鱼的肝脏混合为一个样本,每组3个重复,置于液氮中保存,随后进行代谢组学实验。
代谢组学实验开始前,取肝脏样本在液氮中研磨,每样称取100 mg,加入200 μL预冷水和800 μL预冷的甲醛/乙腈(1∶1,V∶V),混匀,冰浴中超声60 min,-20 ℃孵育1 h沉淀蛋白,于4 ℃、16 000 r·min-1离心20 min,取上清。上清在高速真空浓缩离心机挥干。质谱检测时加入100 μL乙腈-水溶液(1∶1,V∶V)复溶,于4 ℃、14 000 r·min-1离心15 min,取上清液进样分析。
1.3 代谢物提取与液相色谱-质谱联用仪(LC-MS)分析
整个分析过程中样品置于4 ℃自动进样器中,样品采用超高效液相色谱(UPLC)系统(美国Agilent公司,Agilent 1290 Infinity LC)使用HILIC色谱柱进行分离,进样量5 μL,柱温25 ℃,流速0.3 mL·min-1;色谱流动相A为水+25 mmol·L-1乙酸铵+25 mmol·L-1氨水,B为乙腈;色谱梯度洗脱程序如下:0~0.5 min,95%乙腈;0.5~7 min,乙腈从95%线性变化至65%;7~9 min,乙腈从65%线性变化至40%;9~10 min,乙腈维持在40%;10~11.1 min,乙腈从40%线性变化至95%;11.1~16 min,乙腈维持在95%。样本队列中插入质控(QC)样品,用于监测和评价系统的稳定性及实验数据的可靠性。每例样品分别采用电喷雾电离(ESI)进行正离子和负离子模式检测。样品经UPLC分离后用Triple-TOF 5600质谱仪(AB SCIEX)进行质谱分析。
1.4 数据预处理与代谢物识别
代谢组学原始数据经Abf Converter转换成abf格式,然后采用MSDIAL程序中的XCMS进行峰对齐、保留时间校正和提取峰面积。对提取得到的数据,删除缺失值>50%的离子峰,整合正负离子峰并应用软件SIMCA-P14.1进行模式识别,数据经Pareto-scaling预处理后,将正负离子合在一起进行多维统计分析,包括无监督主成分分析(PCA),有监督的正交偏最小二乘法判别分析(OPLS-DA)。代谢物结构鉴定采用精确质量数匹配(<25 ppm)和二级谱图匹配的方式,检索Mass Bank公共数据库。差异代谢物通过单变量分析中的差异倍数(fold change)和P值进行筛选,选择FC>1.5或FC<0.667且P<0.05的代谢物作为差异代谢物。
2 结果(Results)
2.1 微塑料暴露后剑尾鱼肝脏代谢物谱图分析
对1×106 microspheres·L-1组与对照组和1×107 microspheres·L-1组与对照组之间进行PCA分析与OPLS-DA分析,判别各组间是否具有统计学差异,每组6个样本。PCA分析结果显示,1×106 microspheres·L-1和1×107 microspheres·L-1浓度组与对照组均未呈现出明显的分散趋势(图1(a)和(b)),说明微塑料对肝脏代谢具有一定潜在影响。因而引入有监督的多元统计分析方法,即OPLS-DA分析(图1(c)和(d),图1(c) R2X=0.426,Q2=0.0558;图1(d) R2X=0.391,Q2=0.314,R2表示模型累计方差值,反映该模型的拟合程度,Q2表示累计交叉的有效性,反映该模型的预测能力),由于R2<0.5和Q2<0.5,模型的稳定性较差,无法使用OPLS-DA模型进行差异代谢物的筛选,因此使用单变量分析以筛选差异代谢物,实验中所有数据均处于95%置信区间内。
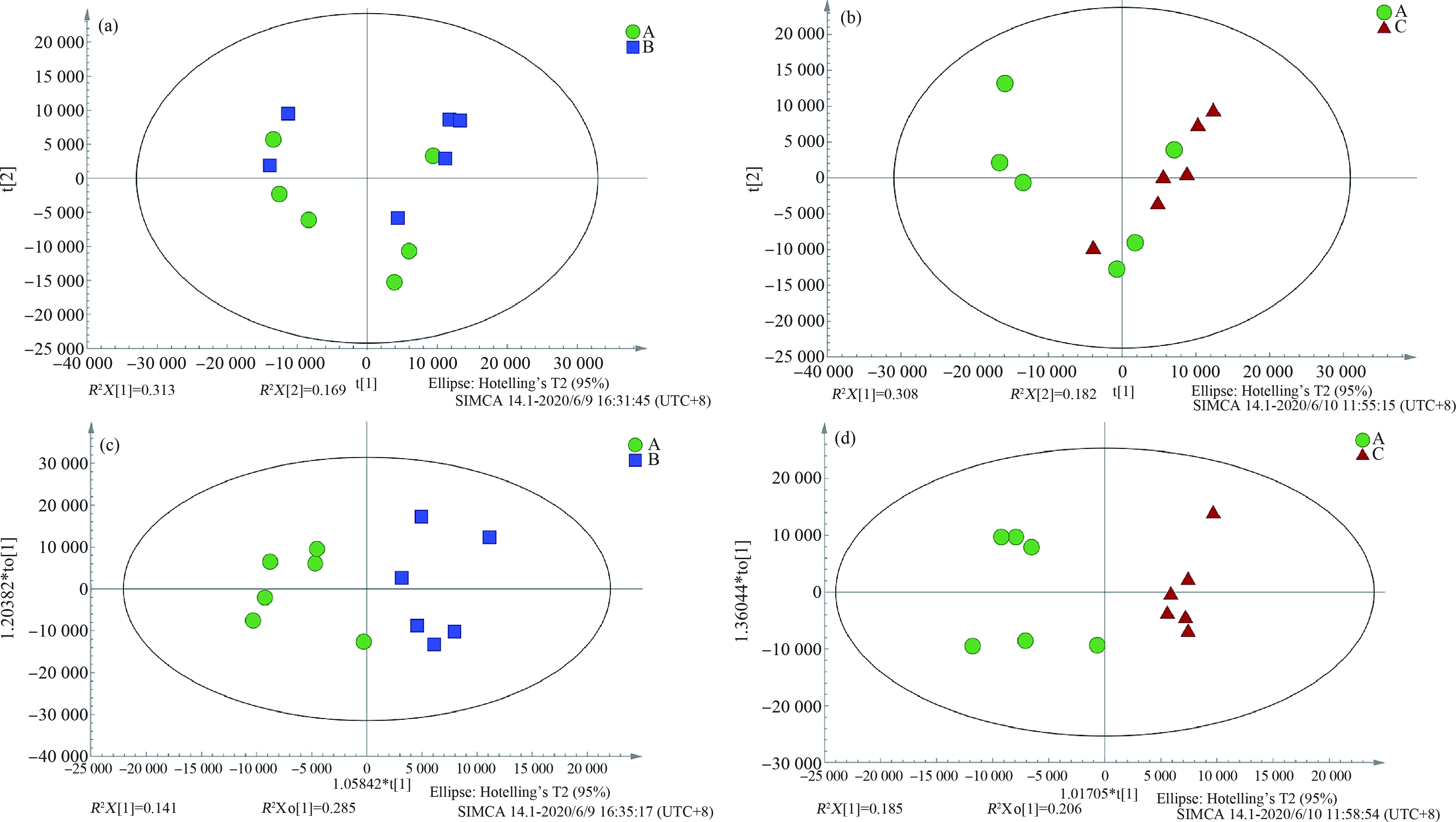
图1 微塑料暴露后对照组与实验组之间的PCA与OPLS-DA得分图
注:(a)和(b)代表1×106 microspheres·L-1组和1×107 microspheres·L-1与对照组之间的PCA图,(c)和(d)代表1×106 microspheres·L-1组和1×107 microspheres·L-1组与对照组之间的OPLS-DA图;图中A代表对照组,B代表1×106 microspheres·L-1组,C代表1×107 microspheres·L-1组,下同。
Fig.1 After the microplastics exposure,the PCA and OPLS-DA scores between the control group and the 1×106 microspheres·L-1 experimental group and the 1×107 microspheres·L-1 experimental group
Note:(a),(b) represent the PCA chart between the 1×106 microspheres·L-1 group,the 1×107 microspheres·L-1 group and the control group,(c),(d) represent the OPLS-DA chart between the 1×106 microspheres·L-1,the 1×107 microspheres·L-1 group and the control group;in the figure,A represents the control group,B represents the 1×106 microspheres·L-1 group,and C represents the 1×107 microspheres·L-1 group;the same below.
2.2 微塑料暴露后剑尾鱼肝脏中差异代谢物的鉴定与筛选
在1×106 microspheres·L-1组中共鉴定出585种代谢物,在1×107 microspheres·L-1组中共鉴定出583种代谢物。从上述代谢物中筛选出FC>1.5或FC<0.667且P<0.05的代谢物作为显著差异代谢物。1×106 microspheres·L-1组与对照组相比,筛选出28种显著差异代谢物,其中3种代谢物显著上调,25种代谢物显著下调(图2(a))。对这28种显著代谢物进行聚类分析,如图3(a)所示。这28种差异代谢物中有6种代谢物在KEGG网站上可以查询到对应的KEGG ID(表1)。1×107 microspheres·L-1组与对照组相比,筛选出26种显著差异代谢物,其中11种代谢物显著上调,15种代谢物显著下调(图2(b)),之后对这26种显著差异代谢物进行聚类分析,如图3(b)所示。26种显著差异代谢物中有8种代谢物在KEGG网站上可以查询到对应的KEGG ID(表1)。

图2 微塑料暴露后对照组与实验组之间差异代谢物火山图
Fig. 2 The difference metabolite volcano diagram between the control group and the 1×106 microspheres·L-1 and 1×107 microspheres·L-1 experimental group
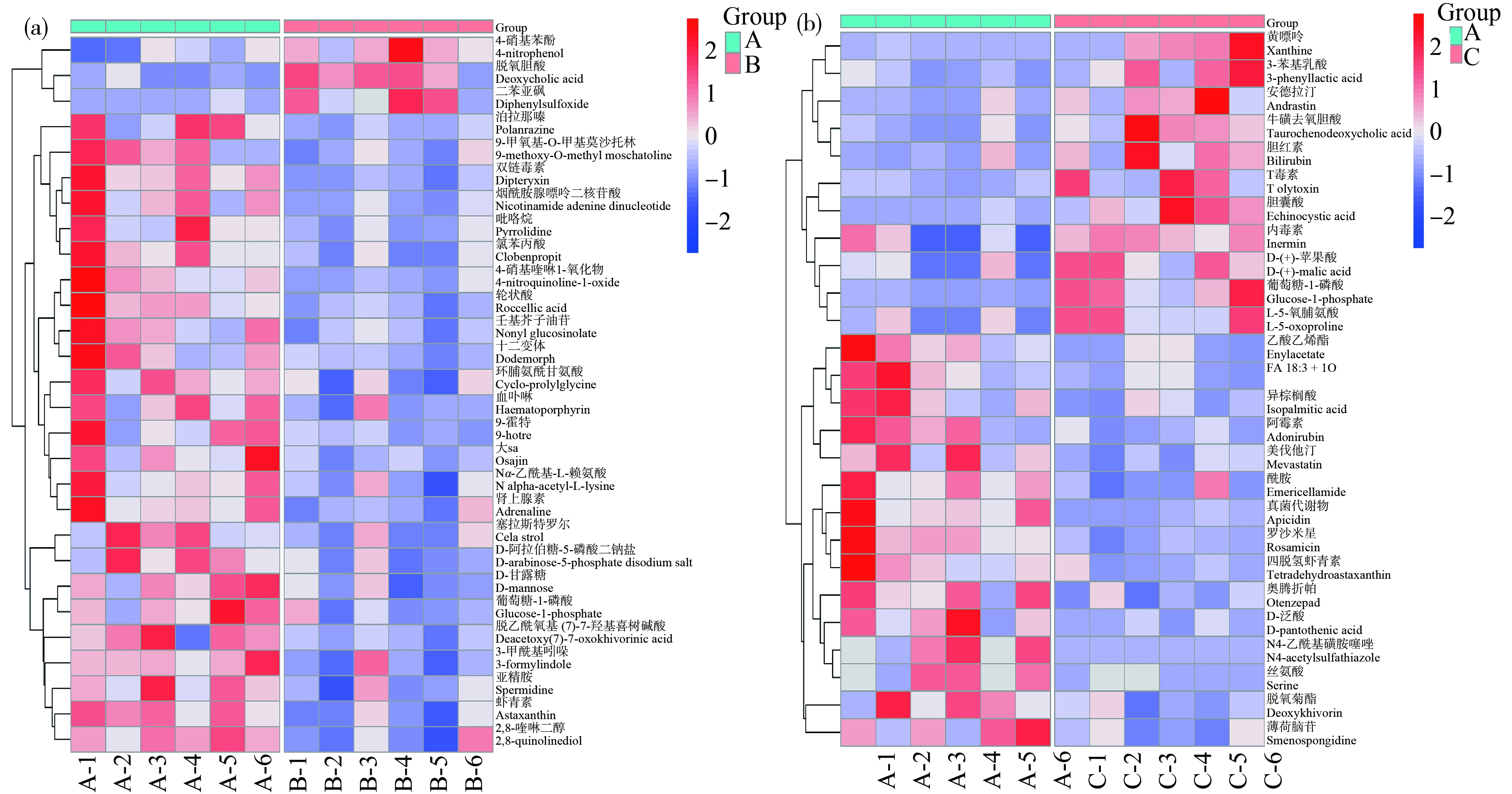
图3 微塑料暴露后对照组与实验组之间显著差异物的聚类分析
注:颜色尺度代表代谢物表达水平,红色和蓝色分别表示上调和下调,(a)和(b)分别代表1×106 microspheres·L-1组和1×107 microspheres·L-1组与对照组之间的聚类分析。
Fig.3 Cluster analysis of significant differences between the control group and the 1×106 microspheres·L-1 and 1×107 microspheres·L-1 experimental group
Note:The color scale represents the expression level of metabolites,and red and blue indicate up-regulation and down-regulation respectively,(a) and (b) represent the cluster analysis 1×106 microspheres·L-1 group vs control group and 1×107 microspheres·L-1 group vs control group.
表1 不同浓度微塑料暴露后剑尾鱼肝脏中的显著性差异代谢物
Table 1 Significantly different metabolites in the liver of swordtail fish after exposure to different concentrations of microplastics
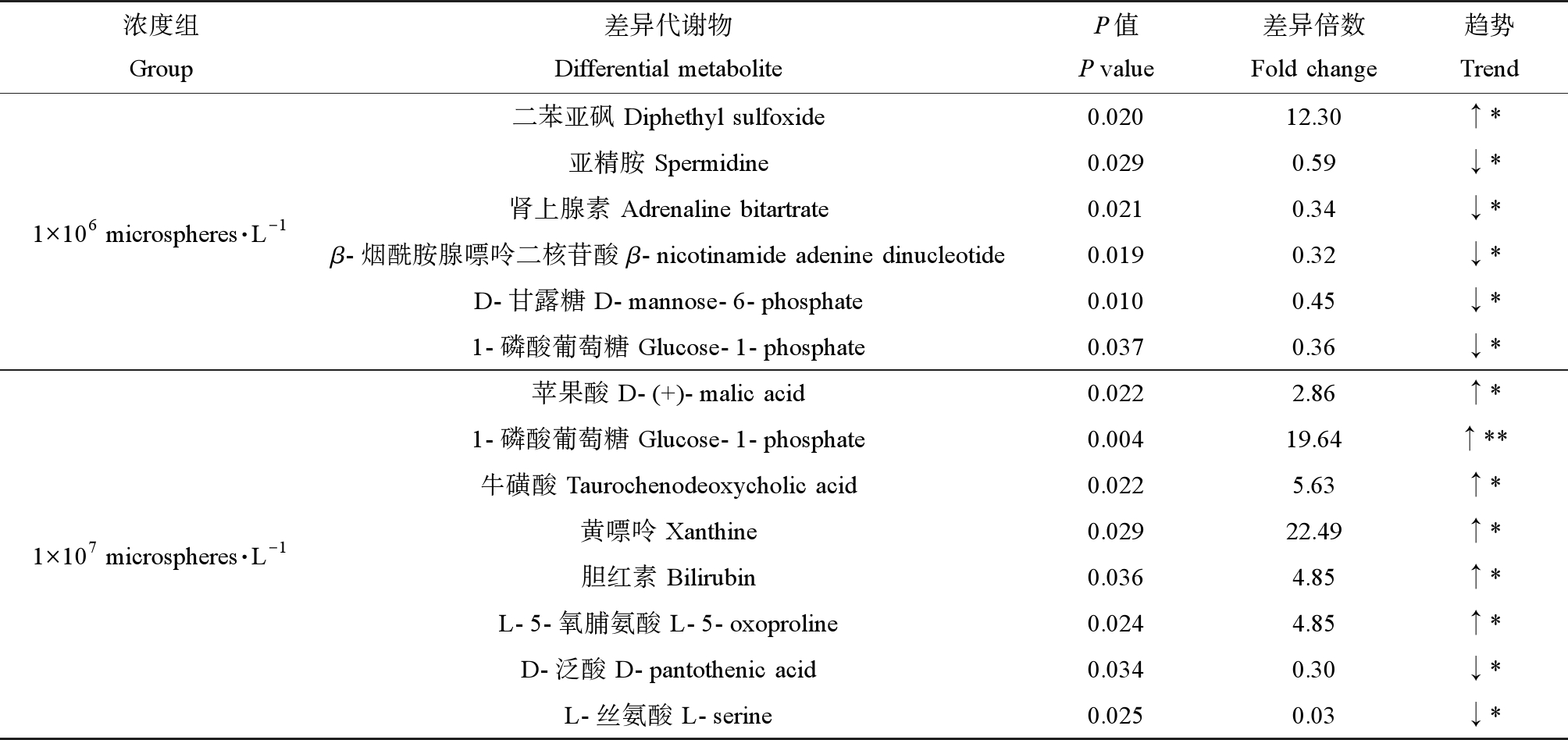
浓度组Group差异代谢物Differential metaboliteP值P value差异倍数Fold change趋势Trend1×106 microspheres·L-1二苯亚砜 Diphethyl sulfoxide0.02012.30↑*亚精胺 Spermidine0.0290.59↓*肾上腺素 Adrenaline bitartrate0.0210.34↓*β-烟酰胺腺嘌呤二核苷酸 β-nicotinamide adenine dinucleotide0.0190.32↓*D-甘露糖 D-mannose-6-phosphate0.0100.45↓*1-磷酸葡萄糖 Glucose-1-phosphate0.0370.36↓*1×107 microspheres·L-1苹果酸 D-(+)-malic acid0.0222.86↑*1-磷酸葡萄糖 Glucose-1-phosphate0.00419.64↑**牛磺酸 Taurochenodeoxycholic acid0.0225.63↑*黄嘌呤 Xanthine0.02922.49↑*胆红素 Bilirubin0.0364.85↑*L-5-氧脯氨酸 L-5-oxoproline0.0244.85↑*D-泛酸 D-pantothenic acid0.0340.30↓*L-丝氨酸 L-serine0.0250.03↓*
注:*表示差异显著(P<0.05),**表示差异显著(P<0.01)。
Note:*means the difference is significant (P<0.05),**means the difference is significant (P<0.01).
2.3 微塑料暴露后剑尾鱼肝脏中差异代谢物的代谢途径分析
为了解微塑料暴露对剑尾鱼肝脏代谢通路的影响,将筛选出具有代谢通路的显著差异代谢物输入KEGG数据库中进行代谢通路富集,在1×106 microspheres·L-1组中,共富集出16条代谢通路,在1×107 microspheres·L-1组中,富集出19条代谢通路,在这里,选取富集排名前10位的代谢通路制作成气泡图(图4),在1×106 microspheres·L-1组中排名前10位的代谢通路分别是硫胺素代谢、硫代谢、氧化磷酸化、溶酶体、谷胱甘肽代谢、半乳糖代谢、药物代谢、β-丙氨酸代谢、氨基糖和核苷酸糖代谢、心肌细胞中肾上腺素能信号(图4(a))。在1×107 microspheres·L-1组中富集排名前10位的代谢通路分别是硫代谢、鞘脂代谢、初级胆酸汁生物合成、泛酸与辅酶A的生物合成、甘氨酸,丝氨酸和苏氨酸代谢、谷胱甘肽代谢、半乳糖代谢、咖啡因代谢、丁酸代谢和β-丙氨酸代谢(图4(b))。
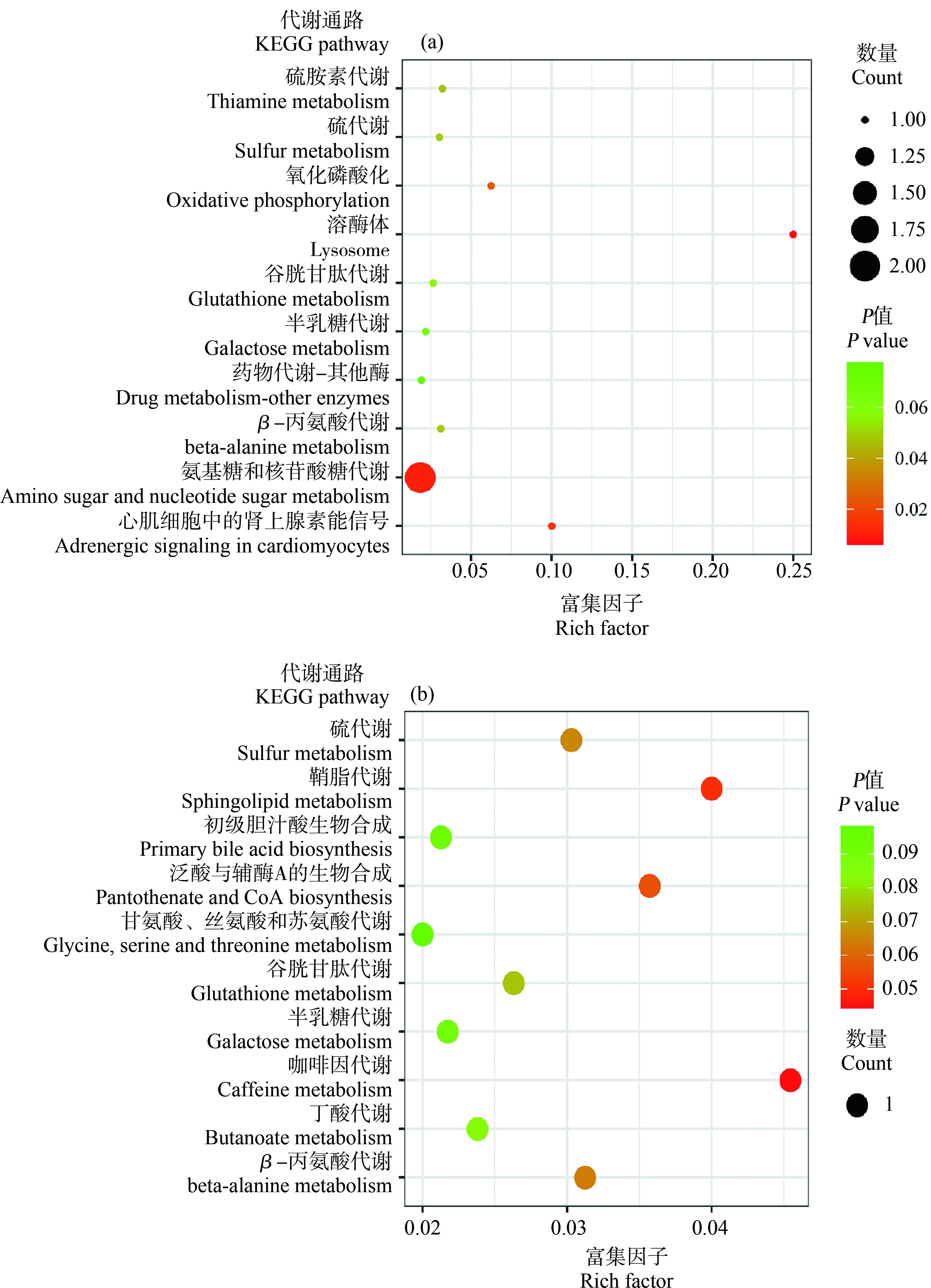
图4 各实验组显著差异物的代谢通路富集分析图
注:(a) 在1×106 microspheres·L-1组中富集前10位的代谢通路,(b) 在1×107 microspheres·L-1组中富集前10位的代谢通路,每个图形为一个代谢通路,纵坐标代表通路名称,横坐标表示富集率,公式为(富集率=代谢物数量/代谢物总数量),图形越大表示差异代谢物的数目越多;颜色表示富集的显著性即P值,红色越深表示该通路越显著富集,右侧颜色梯度表示P值。
Fig.4 Metabolic pathway enrichment of differential metabolites
Note:(a) The top 10 metabolic pathways enriched in the 1×106 microspheres·L-1 group,(b) The top 10 metabolic pathways enriched in the 1×107 microspheres·L-1 group;each dot figure is a metabolic pathway,and the ordinate represents the name of the pathway;the abscissa represents the rich factor,and the formula is (Rich factor = Metabolite count/Pathway pop hits);the larger the dot,the larger the number of different metabolites;the color indicates the significance of enrichment,that is,the P value;the darker the red,the more the pathway is significantly enriched,and the color gradient on the right represents the P value.
3 讨论(Discussion)
随着塑料垃圾的剧增,环境中的微塑料数量将会随之剧增,已有研究表明微塑料会对水生生物造成诸多不良影响。在本实验中,发现即便是72 h的微塑料暴露同样对剑尾鱼肝脏的代谢水平造成影响。
在对剑尾鱼肝脏的代谢物的测定中,发现1×106 microspheres·L-1组中筛选出的代谢物主要包括糖类和氨基酸等6种代谢物,共涉及16条代谢通路。表达水平受到干扰的代谢物主要是关于细胞能量代谢、糖代谢、氨基酸代谢、炎症反应和氧化应激反应。在1×107 microspheres·L-1组中,筛选出8种代谢物涉及19条代谢通路,这些代谢物主要是关于能量代谢、糖代谢、氨基酸代谢、炎症反应、氧化应激、脂代谢和神经毒性。
目前已有研究发现微塑料会诱导代谢失衡,例如,微塑料会诱导与氧化应激[29-31]、能量代谢与糖代谢[20,32]、氨基酸和脂代谢[26,33]有关代谢物的代谢图谱发生改变。在本实验中,1×106 microspheres·L-1组中的二苯亚砜和亚精胺,1×107 microspheres·L-1组中的胆红素、黄嘌呤、牛磺酸和l-5-氧脯氨酸这些均属于抗氧化应激类代谢物,说明微塑料暴露对剑尾鱼肝脏产生了氧化应激,这一结果在抗氧化酶活性测定的结果中也有所体现。此外,1×106 microspheres·L-1组中D-甘露糖、1-磷酸葡萄糖、肾上腺素和β-烟酰胺腺嘌呤二核苷酸,1×107 microspheres·L-1组中的苹果酸、1-磷酸葡萄糖和牛磺酸这些物质均属于能量代谢与糖代谢,据此推测微塑料对剑尾鱼肝脏中的糖代谢与能量代谢造成了干扰,微塑料干扰糖代谢与能量代谢主要有3种原因,第1种是Ory等[34]在研究中发现的水体中的微塑料被鱼类误食,占据了消化系统中原有食物的空间,然后微塑料以“假粪”的形式排出体外,间接造成了饥饿营养不良的现象。第2种是Yin等[12]研究发现微塑料导致了鱼类行为发生改变,减少了摄食量,进而影响了营养储备与能量代谢。第3种是微塑料改变了鱼类的肠道微生物,最终导致了能量代谢发生改变[28]。这里我们更倾向于第1种解释,因为在本研究结果中发现,1×106 microspheres·L-1组中1-磷酸葡萄糖在肝脏中显著下调,但是在1×107 microspheres·L-1组中的表达变为显著上调(P<0.01),这有可能是1×107 microspheres·L-1组中剑尾鱼过多误食了微塑料,导致短时间饥饿现象,激活了葡萄糖合成基因的表达,进而导致肝脏中1-磷酸葡萄糖表达显著上调[35],但是仍需进一步实验来进行验证我们的猜测。值得注意的是,在1×107 microspheres·L-1组中牛磺酸和D-泛酸这2种代谢物受到干扰,牛磺酸在肝脏中的主要作用是与胆汁酸结合形成脂肪吸收所必须的牛黄胆酸[36],而D-泛酸(维生素B5)属于维生素代谢,是生物体内合成辅酶A的原料,而辅酶A是动物糖代谢、蛋白质代谢与脂代谢必不可少的物质[37],牛磺酸与D-泛酸代谢受到干扰或许会间接干扰剑尾鱼肝脏的脂代谢。此外发现1×107 microspheres·L-1组中的L-丝氨酸显著下调,L-丝氨酸属于丝氨酸代谢中的代谢物,而L-丝氨酸可能与牛磺酸对鲤鱼体内神经元的保护有关[38],另有研究表明L-丝氨酸缺乏会导致神经毒性[39],从代谢物角度推测,微塑料可能会通过L-丝氨酸的下调引起神经毒性,但是已有的研究表明,微塑料造成脂质氧化与干扰乙酰胆碱酶是诱导神经毒性的原因[20,32]。因此仍需进一步验证微塑料导致L-丝氨酸的下调是否会导致神经毒性。
本研究对不同浓度微塑料暴露72 h后的剑尾鱼肝脏中抗氧化酶活性与代谢物进行测定,发现微塑料干扰了剑尾鱼肝脏中抗氧化酶活性。从生物信息学角度对剑尾鱼肝脏中显著差异代谢物分析发现,1×106 microspheres·L-1的微塑料干扰了剑尾鱼肝脏中的能量代谢、糖代谢、氨基酸代谢、炎症反应和氧化应激反应。1×107 microspheres·L-1的微塑料干扰了剑尾鱼的能量代谢、糖代谢、氨基酸代谢、炎症反应、氧化应激、脂代谢并有可能引起剑尾鱼神经毒性。根据筛选出的差异代谢物的数量以及富集到的代谢通路数量可以看出,1×107 microspheres·L-1的微塑料对剑尾鱼肝脏造成了更严重的干扰。因此,环境中增加的塑料垃圾更应引起人们的重视并加以治理。
[1] Rochman C M,Browne M A,Halpern B S,et al.Policy:Classify plastic waste as hazardous [J].Nature,2013,494(7436):169-171
[2] de Sá L C,Oliveira M,Ribeiro F,et al.Studies of the effects of microplastics on aquatic organisms:What do we know and where should we focus our efforts in the future?[J].The Science of the Total Environment,2018,645:1029-1039
[3] Prata J C,Silva A L P,Walker T R,et al.COVID-19 pandemic repercussions on the use and management of plastics [J].Environmental Science &Technology,2020,54(13):7760-7765
[4] Andrady A L.Microplastics in the marine environment [J].Marine Pollution Bulletin,2011,62(8):1596-1605
[5] Thompson R C,Moore C J,vom Saal F S,et al.Plastics,the environment and human health:Current consensus and future trends [J].Philosophical Transactions of the Royal Society of London Series B,Biological Sciences,2009,364(1526):2153-2166
[6] Takahashi K,Hosie G,Kitchener J,et al.Report on the Southern Ocean continuous plankton recorder (SO-CPR) standards workshop:SCAR expert group on CPR research [J].Antarctic Record,2011,55(3):279-286
[7] Kanhai D K,Gårdfeldt K,Lyashevska O,et al.Microplastics in sub-surface waters of the Arctic Central Basin [J].Marine Pollution Bulletin,2018,130:8-18
[8] Jamieson A J,Brooks L S R,Reid W D K,et al.Microplastics and synthetic particles ingested by deep-sea amphipods in six of the deepest marine ecosystems on Earth [J].Royal Society Open Science,2019,6(2):180667
[9] Napper I E,Davies B F R,Clifford H,et al.Reaching new heights in plastic pollution:Preliminary findings of microplastics on mount Everest [J].One Earth,2020,3(5):621-630
[10] Yang W F,Gao X X,Wu Y X,et al.The combined toxicity influence of microplastics and nonylphenol on microalgae Chlorella pyrenoidosa [J].Ecotoxicology and Environmental Safety,2020,195:110484
[11] 李爱峰,李方晓,邱江兵,等.水环境中微塑料的污染现状、生物毒性及控制对策[J].中国海洋大学学报:自然科学版,2019,49(10):88-100
Li A F,Li F X,Qiu J B,et al.Pollution status,biological toxicity and control strategy of microplastics in water environments:A review [J].Periodical of Ocean University of China,2019,49(10):88-100 (in Chinese)
[12] Yin L Y,Chen B J,Xia B,et al.Polystyrene microplastics alter the behavior,energy reserve and nutritional composition of marine jacopever (Sebastes schlegelii) [J].Journal of Hazardous Materials,2018,360:97-105
[13] Watts A J R,Lewis C,Goodhead R M,et al.Uptake and retention of microplastics by the shore crab Carcinus maenas [J].Environmental Science &Technology,2014,48(15):8823-8830
[14] Watts A J,Urbina M A,Goodhead R,et al.Effect of microplastic on the gills of the shore crab Carcinus maenas [J].Environmental Science &Technology,2016,50(10):5364-5369
[15] Pannetier P,Morin B,le Bihanic F,et al.Environmental samples of microplastics induce significant toxic effects in fish larvae [J].Environment International,2020,134:105047
[16] Lima A R A,Barletta M,Costa M F.Seasonal distribution and interactions between plankton and microplastics in a tropical estuary [J].Estuarine,Coastal and Shelf Science,2015,165:213-225
[17] Ding J N,Zhang S S,Razanajatovo R M,et al.Accumulation,tissue distribution,and biochemical effects of polystyrene microplastics in the freshwater fish red tilapia (Oreochromis niloticus) [J].Environmental Pollution,2018,238:1-9
[18] Qiang L Y,Cheng J P.Exposure to microplastics decreases swimming competence in larval zebrafish (Danio rerio) [J].Ecotoxicology and Environmental Safety,2019,176:226-233
[19] Chen Q Q,Lackmann C,Wang W Y,et al.Microplastics lead to hyperactive swimming behaviour in adult zebrafish [J].Aquatic Toxicology,2020,224:105521
[20] Barboza L G A,Lopes C,Oliveira P,et al.Microplastics in wild fish from North East Atlantic Ocean and its potential for causing neurotoxic effects,lipid oxidative damage,and human health risks associated with ingestion exposure [J].The Science of the Total Environment,2020,717:134625
[21] Teuten E L,Saquing J M,Knappe D R U,et al.Transport and release of chemicals from plastics to the environment and to wildlife [J].Philosophical Transactions of the Royal Society of London Series B,Biological Sciences,2009,364(1526):2027-2045
[22] Qiao R X,Deng Y F,Zhang S H,et al.Accumulation of different shapes of microplastics initiates intestinal injury and gut microbiota dysbiosis in the gut of zebrafish [J].Chemosphere,2019,236:124334
[23] Mazurais D,Ernande B,Quazuguel P,et al.Evaluation of the impact of polyethylene microbeads ingestion in European Sea bass (Dicentrarchus labrax) larvae [J].Marine Environmental Research,2015,112(Pt A):78-85
[24] Jabeen K,Li B W,Chen Q Q,et al.Effects of virgin microplastics on goldfish (Carassius auratus) [J].Chemosphere,2018,213:323-332
[25] Wen B,Zhang N,Jin S R,et al.Microplastics have a more profound impact than elevated temperatures on the predatory performance,digestion and energy metabolism of an Amazonian cichlid [J].Aquatic Toxicology,2018,195:67-76
[26] Bhagat J,Zang L Q,Nishimura N,et al.Zebrafish:An emerging model to study microplastic and nanoplastic toxicity [J].The Science of the Total Environment,2020,728:138707
[27] Chen Q Q,Gundlach M,Yang S Y,et al.Quantitative investigation of the mechanisms of microplastics and nanoplastics toward zebrafish larvae locomotor activity [J].The Science of the Total Environment,2017,584-585:1022-1031
[28] Wan Z Q,Wang C Y,Zhou J J,et al.Effects of polystyrene microplastics on the composition of the microbiome and metabolism in larval zebrafish [J].Chemosphere,2019,217:646-658
[29] Han J,Fang Z Q.Estrogenic effects,reproductive impairment and developmental toxicity in ovoviparous swordtail fish (Xiphophorus helleri) exposed to perfluorooctane sulfonate (PFOS) [J].Aquatic Toxicology,2010,99(2):281-290
[30] Wilhelm F D.Fish antioxidant defenses:A comparative approach [J].Brazilian Journal of Medical and Biological Research,1996,29(12):1735-1742
[31] Capó X,Company J J,Alomar C,et al.Long-term exposure to virgin and seawater exposed microplastic enriched-diet causes liver oxidative stress and inflammation in gilthead seabream Sparus aurata,Linnaeus 1758 [J].The Science of the Total Environment,2021,767:144976
[32] Zhao Y,Bao Z W,Wan Z Q,et al.Polystyrene microplastic exposure disturbs hepatic glycolipid metabolism at the physiological,biochemical,and transcriptomic levels in adult zebrafish [J].The Science of the Total Environment,2020,710:136279
[33] Wan Z Q,Wang C Y,Zhou J J,et al.Effects of polystyrene microplastics on the composition of the microbiome and metabolism in larval zebrafish [J].Chemosphere,2019,217:646-658
[34] Ory N C,Gallardo C,Lenz M,et al.Capture,swallowing,and egestion of microplastics by a planktivorous juvenile fish [J].Environmental Pollution,2018,240:566-573
[35] Tian J,He G,Mai K S,et al.Effects of postprandial starvation on mRNA expression of endocrine-,amino acid and peptide transporter-,and metabolic enzyme-related genes in zebrafish (Danio rerio) [J].Fish Physiology and Biochemistry,2015,41(3):773-787
[36] 姚丹,吴昊,江敏.全氟辛烷磺酸对斑马鱼肝脏影响机制的代谢组学研究[J].生态毒理学报,2018,13(6):97-106
Yao D,Wu H,Jiang M.Effects of perfluorooctane sulfonate on the liver metabolism of Danio rerio [J].Asian Journal of Ecotoxicology,2018,13(6):97-106 (in Chinese)
[37] Tahiliani A G,Beinlich C J.Pantothenic acid in health and disease [J].Vitamins &Hormones,1991,46:165-228
[38] Tabatabaie L,Klomp L W,Berger R,et al.L-serine synthesis in the central nervous system:A review on serine deficiency disorders [J].Molecular Genetics and Metabolism,2010,99(3):256-262
[39] de Koning T J,Snell K,Duran M,et al.L-serine in disease and development [J].The Biochemical Journal,2003,371(Pt 3):653-661