金属纳米颗粒被大量使用在抗菌剂、袜子、枕头、口罩、清洁剂和洗发水等个人护理产品中[1]。纳米氧化锌(ZnO-NPs)在消费产品使用的金属纳米颗粒中排名前3位,估计全球年产量在550~33 400 t之间[2]。这些工程化纳米粒子的加速生产和使用可能导致其在环境中释放,并促进与生态系统中生物和非生物成分的频繁相互作用,具有潜在的生物毒性效应[3]。据报道,ZnO-NPs颗粒与细菌细胞壁或甲壳类动物肠道之间的紧密接触会导致接触区域附近的微环境发生变化,生成可能损坏细胞膜的活性氧自由基(ROS)[4]。ZnO-NPs能进入大型溞的基底质膜和肠道肌肉中,且可与大型溞的质膜相互作用,并能穿过上皮屏障进入大型溞细胞内[5]。斑马鱼胚胎暴露在ZnO-NPs中,会造成胚胎孵化率降低,鱼鳔缺损,引起斑马鱼的氧化应激,还会通过影响细胞发育周期过程抑制斑马鱼的正常生长发育和其他生命活动,甚至导致其死亡[6-7]。然而目前许多研究都是针对纳米粒子的单一因素影响,未考虑自然水体中各种非生物因素对纳米粒子的迁移转化及生物毒性的影响。
天然有机物(natural organic matter,NOM)是在水体中广泛存在的有机混合物,其丰富的羧基和酚羟基等官能团可作为金属、纳米颗粒和其他有机污染物结合的活性位点[8],增强溶液中纳米粒子的分散性和稳定性[9]。水体中的NOM大部分是由腐殖酸(humic acid,HA)组成的。HA是天然水体和供水系统中可溶性有机物的主要成分[10],在水体中的浓度比纳米粒子的浓度高出几个数量级,可从几毫克到数百毫克每升[11-12],对水体中纳米粒子的迁移转化、生物利用度和毒性起着重要作用[13]。Shang等[14]发现NOM的存在使细胞内ROS生成浓度降低,从而降低MoS2 NPs对大肠杆菌的光毒性。Dai等[15]证实HA可以吸附到ZnO-NPs表面,从而减轻ZnO-NPs对大型溞抗氧化系统的损害。Kteeba等[16]表明加入HA不仅可降低ZnO-NPs诱导的斑马鱼孵化率和存活率降低等毒性效应;而且会缓解ZnO-NPs诱导的发育毒性[17]。但目前许多研究并未对HA加入后,HA-ZnO-NPs杂化物的物化性质改变及HA缓解ZnO-NPs致斑马鱼毒性效应的作用机理做出系统的解释。
斑马鱼作为一种模式物种,其胚胎有着体积小,透明度高,易于获取和维护以及与哺乳动物基因高度同源的优点,被广泛用于药物和化学物质的生态毒理学测试的研究中[18]。因此,本研究选用斑马鱼胚胎作为模型生物,以ZnO-NPs及HA作为研究对象,研究了斑马鱼胚胎的存活状况,并从ZnO-NPs与HA-ZnO-NPs的物化性质和斑马鱼胚胎抗氧化酶活性变化等方面来阐释ZnO-NPs对斑马鱼的毒性效应及HA对ZnO-NPs致斑马鱼胚胎毒性的缓解机理。
1 材料与方法(Materials and methods)
1.1 斑马鱼培养及胚胎收集
成年斑马鱼(来自广东省实验动物研究所)在实验室中驯养超过2个月,自循环水箱中的水温控制在(28±2) ℃,光照周期为14 h/10 h,每日喂食2次丰年虾。产卵前一天停止喂食,将健康的雌、雄鱼挑出放在产卵盒中,第2天上午去除隔板并开启光照,使雌雄成鱼在光刺激下产卵受精。受精过程结束后立即收取鱼卵,剔除未受精的鱼卵后用培养液清洗胚胎。健康鱼卵放在培养液中培育,用于实验。
1.2 实验药品的制备及表征
1.2.1 培养液的制备
准确称取KCl 0.23 g、MgSO4·7H2O 4.93 g、CaCl2·2H2O 11.76 g和NaHCO3 2.59 g(天津市大茂化学试剂厂,分析纯)。用超纯水溶解并稀释至1 L储备。培养液参照文献[7]制备,使用前取25 mL,用纯水稀释至1 L作为培养液。培养液取用前充分曝气,并调节pH值至7.8±0.2。
1.2.2 ZnO-NPs悬浮液的配制与表征
ZnO-NPs(上海麦克林公司,纯度99.9%),干燥粉末状,粒径为(30±10) nm。称取ZnO-NPs 0.01 g 加入100 mL培养液中,搅拌并超声(SB-5200,宁波新芝生物科技股份有限公司)30 min,获得0.1 g·L-1的ZnO-NPs悬浮液,现配现用,并按需要稀释悬浮液。用纳米粒度及Zeta电位分析仪(Zetasizer NANO ZS,英国Malvern)测定ZnO-NPs的分散状况与Zeta电位值。
1.2.3 HA-ZnO-NPs杂化物的物化性质检测
HA(上海源叶生物公司),干燥黑色粉末状,用傅里叶红外光谱仪(Nicolet IS50,美国Thermofisher)对其进行表征。0.1 g的HA粉末溶于500 mL pH 11.4的纯水中,搅拌2 h。用0.45 μm的聚四氟乙烯滤膜过滤,将溶液pH调至7.8±0.2,定容至1 L后得到0.1 g·L-1的HA储备液,用总有机碳分析仪(TOC-L CPH,日本岛津)检测得到其有机碳含量为60 mg·L-1,即HA储备液浓度为60 mg·L-1(以碳计)。
取HA储备液100 mL,加入ZnO-NPs粉末0.01 g,超声30 min,搅拌24 h。3 500 g离心30 min,真空抽滤泵过0.22 μm的滤膜抽滤。抽滤后用纯水冲下滤膜上的粉末,冷冻干燥,得到HA与ZnO-NPs的杂化物(HA-ZnO-NPs),并用傅里叶红外光谱仪(FTIR)表征,用纳米粒度及Zeta电位分析仪测定其水动力直径及Zeta电位值。
1.3 胚胎染毒及指标观察
在六孔板中放置健康胚胎,每孔20枚,每组3组平行,暴露周期为0~96 hpf。用体视显微镜(SMZ-745T,尼康)观察胚胎的生长状况,并记录存活率等指标。实验所用稀释液均为培养液,暴露实验分为以下组别。(1)ZnO-NPs暴露:超声处理后的ZnO-NPs悬浮液按照浓度梯度法,稀释为1、5、10和20 mg·L-1,并以配制好的培养液作为对照组暴露,以探究ZnO-NPs对斑马鱼胚胎的毒性影响。(2)ZnO-NPs和HA暴露:选择20 mg·L-1的ZnO-NPs悬浮液与0、3、6、12和24 mg·L-1(以碳计)的HA对胚胎进行联合暴露,以探究HA对ZnO-NPs毒性的缓解作用。
1.4 氧化应激酶活性测试
将收集洗净的胚胎放入培养皿中(每个培养皿100枚胚胎),按实验组别分别加入ZnO-NPs和HA试验液,每个浓度设置3组平行。待暴露24 h后,每个培养皿取60枚左右的胚胎,加入生理盐水中冰匀浆,8 000 r·min-1离心10 min取上清液,并按照试剂盒(南京建成工程研究所)所述试验方法测定超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。
1.5 数据统计分析
在体式显微镜下观察胚胎发育,拍照记录,统计胚胎存活率等毒理学终点指标。使用SPSS 20.0进行回归计算,得出LC50;组间比较采用单因素方差分析法(One Way ANOVA)分析,并以Tukeys做多重比较,*表示P<0.05,**表示P<0.01;并用Origin 8.5进行作图。
2 结果(Results)
2.1 ZnO-NPs与HA的相互作用的FTIR光谱图
HA具有丰富的亲水基团,易于被纳米材料吸附,使得纳米材料在水中稳定性得到提高。使用傅里叶红外光谱仪对HA、ZnO-NPs和HA-ZnO-NPs的表面官能团进行检测,结果如图1所示。
由图1可知,HA在不同波数处有强吸收峰。其中3 400 cm-1处为表面水形成的—OH基团伸缩振动,1 600 cm-1处代表芳香族C![]() C骨架振动,1 380 cm-1处代表COO—基团的反对称伸缩,1 125 cm-1处代表醇羟基的C—O伸展[19]。ZnO-NPs在3 400 cm-1处有羟基的振动伸缩,1 600~1 330 cm-1左右处为O—H键和C—O键的弯曲振动吸收峰,且在480 cm-1左右出现了氧化锌的特征峰[20]。HA-ZnO-NPs的检测结果显示,在添加HA后,氧化锌的特征峰位置并没有发生改变,3 400 cm-1和1 125 cm-1左右处为HA的酚羟基和醇羟基在ZnO-NPs表面吸附后形成的配合物的特征峰。
C骨架振动,1 380 cm-1处代表COO—基团的反对称伸缩,1 125 cm-1处代表醇羟基的C—O伸展[19]。ZnO-NPs在3 400 cm-1处有羟基的振动伸缩,1 600~1 330 cm-1左右处为O—H键和C—O键的弯曲振动吸收峰,且在480 cm-1左右出现了氧化锌的特征峰[20]。HA-ZnO-NPs的检测结果显示,在添加HA后,氧化锌的特征峰位置并没有发生改变,3 400 cm-1和1 125 cm-1左右处为HA的酚羟基和醇羟基在ZnO-NPs表面吸附后形成的配合物的特征峰。
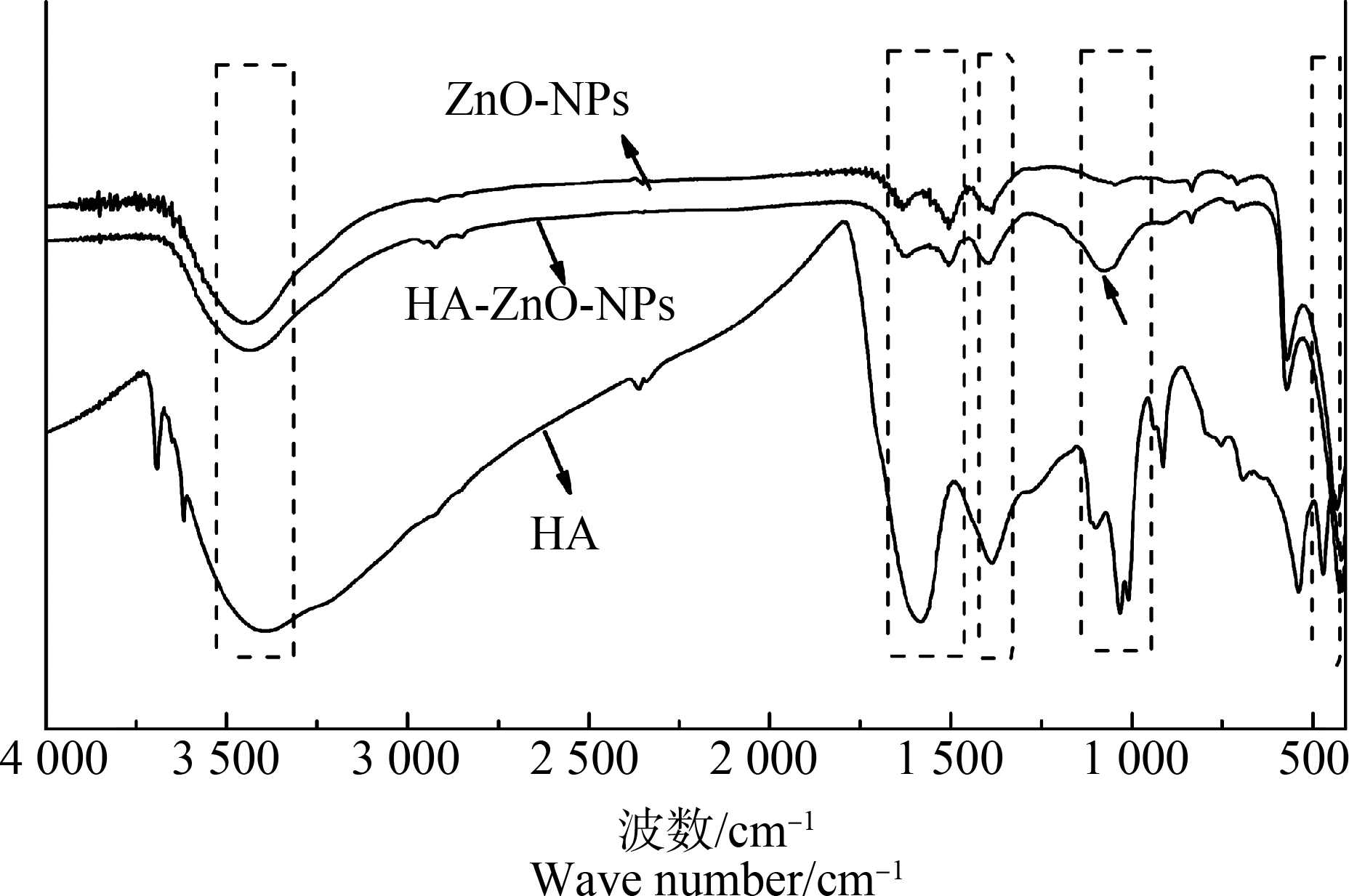
图1 ZnO-NPs、HA和HA-ZnO-NPs的FTIR光谱图
注:ZnO-NPs表示纳米氧化锌;HA表示腐殖酸;HA-ZnO-NPs表示HA与ZnO-NPs的杂化物。
Fig.1 FTIR spectra of ZnO-NPs,HA and HA-ZnO-NPs
Note:ZnO-NPs stands for ZnO nanoparticles;HA stands for humic acid;HA-ZnO-NPs stands for mixed compound of HA and ZnO-NPs.
2.2 HA-ZnO-NPs的稳定性分析
动态光散射是通过测量样品散射光强的变化来分析样品颗粒大小和稳定性信息的一种技术,常应用于表征悬浮液中纳米颗粒的尺寸。对不同浓度的ZnO-NPs和HA-ZnO-NPs进行Zeta电位及DLS测试,结果如图2所示。
研究证实Zeta电位绝对值的大小与悬浮液的稳定性和分散性相关,当Zeta电位绝对值>30 mV时认为悬浮液具有良好的稳定性[21]。ZnO-NPs的Zeta电位值均为负值,表明ZnO-NPs带有一定的弱负电荷。由图2(a)可知,悬浮液的Zeta电位绝对值随着ZnO-NPs浓度的增加而减少,且Zeta电位绝对值均低于22 mV。这表明ZnO-NPs悬浮液稳定性较差。从悬浮液中ZnO-NPs的水动力直径可见,随着ZnO-NPs浓度增大,其水动力直径增大,表明ZnO-NPs在溶液中有聚集倾向,呈现一定的剂量-效应关系。聚集到一定程度悬浮液的稳定性降低,这与Zeta电位的结果一致。
由图2(b)可知,在20 mg·L-1的ZnO-NPs中加入HA后,ZnO-NPs表面负电荷增加,悬浮液Zeta电位绝对值均增大,且随着HA浓度增大Zeta电位绝对值增大。当HA浓度>3 mg·L-1时,各组的Zeta电位绝对值均>30 mV。从水动力直径与HA浓度之间的关系可见,随着HA浓度增大,悬浮液颗粒物的水动力直径减少。由结果可知,在ZnO-NPs溶液中加入HA后,悬浮液中大颗粒数量减少,Zeta电位绝对值增大,ZnO-NPs的分散性良好,表明HA增加了ZnO-NPs悬浮液的稳定性。
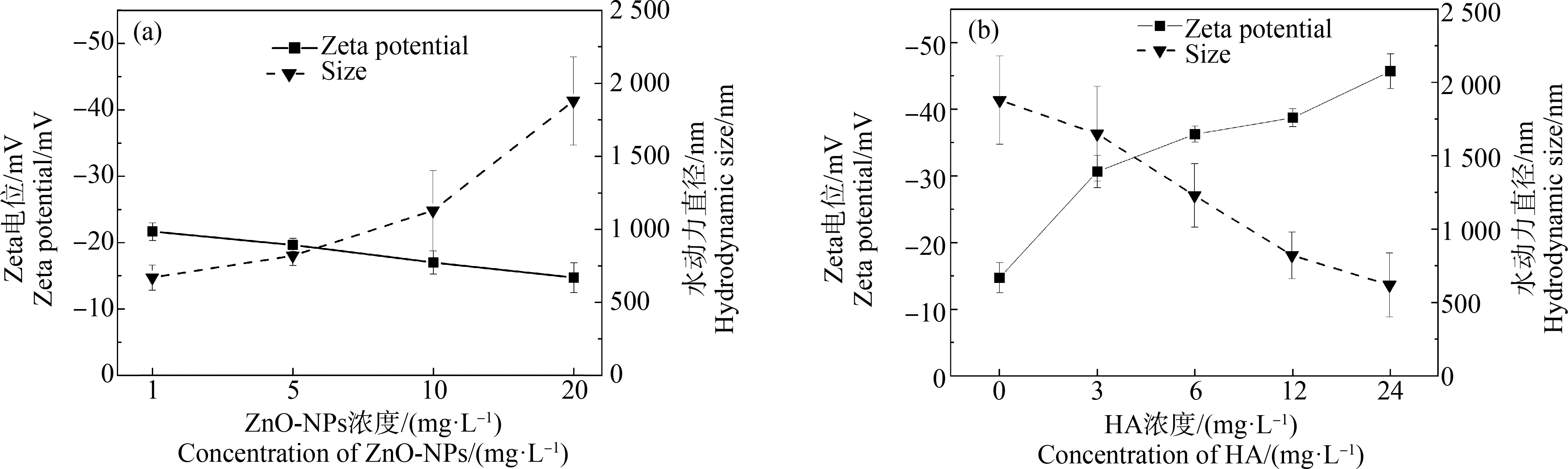
图2 不同暴露组水动力直径与Zeta电位变化
注:(a) ZnO-NPs;(b) ZnO-NPs (20 mg·L-1)+HA。
Fig.2 Hydrodynamic diameters and Zeta potential change of different exposure groups
Note:(a) ZnO-NPs;(b) ZnO-NPs (20 mg·L-1)+HA.
2.3 ZnO-NPs和HA-ZnO-NPs对斑马鱼胚胎的存活率的影响
用不同浓度的ZnO-NPs和HA-ZnO-NPs对斑马鱼胚胎进行暴露,96 hpf内的存活率如图3所示。
由图3(a)可知,ZnO-NPs对斑马鱼胚胎暴露染毒后,胚胎的存活率随着ZnO-NPs的浓度升高而下降,且暴露时间越长,胚胎存活率越低。根据概率单位法计算得到,ZnO-NPs对斑马鱼的半数致死浓度(LC50)约为3.86 mg·L-1。除1 mg·L-1组外,各实验组96 hpf的胚胎存活率均低于40%,与对照组相比,有显著的统计学下降(P<0.01),尤其ZnO-NPs为20 mg·L-1处理组的胚胎96 hpf存活率仅3%左右。由图3(b)可知,在ZnO-NPs中加入HA后,斑马鱼胚胎存活率升高,且在相同ZnO-NPs(20 mg·L-1)的处理下,斑马鱼的存活率随着HA浓度增高而增高。在HA浓度达到6 mg·L-1以上,各实验组的96 hpf胚胎存活率高于80%,当24 mg·L-1时,斑马鱼胚胎存活率几乎与对照组相当。这表明HA对ZnO-NPs引起的胚胎存活率影响有一定的缓解作用。
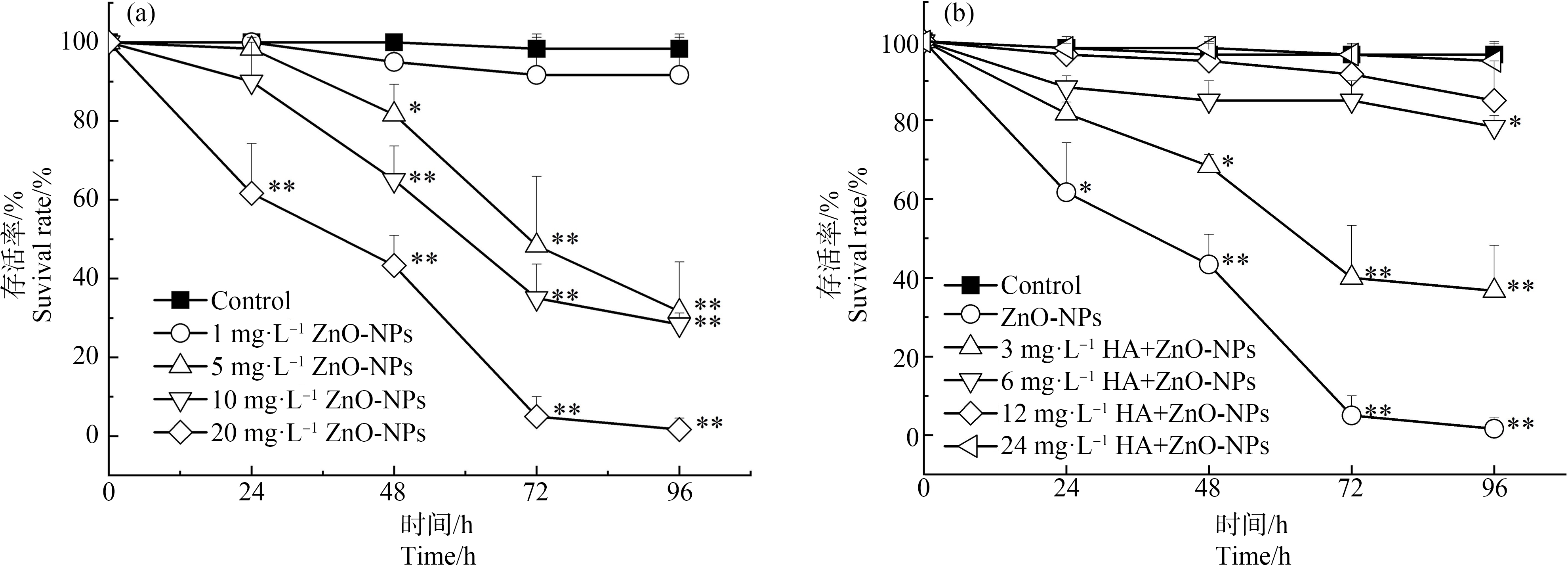
图3 不同浓度组斑马鱼胚胎存活率
注:(a) ZnO-NPs,(b) ZnO-NPs (20 mg·L-1)+HA;*表示P<0.05,**表示P<0.01。
Fig.3 Survival rate of zebrafish exposed to different concentrations of ZnO-NPs and HA
Note:(a) ZnO-NPs,(b) ZnO-NPs (20 mg·L-1)+HA;*represents P<0.05,**represents P<0.01.
2.4 HA对ZnO-NPs致斑马鱼胚胎表面附着情况的影响
对ZnO-NPs和HA-ZnO-NPs培养液中斑马鱼胚胎的表面结构进行显微镜观察,结果如图4所示。
由图4可知,暴露在ZnO-NPs悬浮液中的斑马鱼胚胎(图4(a)~4(c))表面绒毛膜上附着了许多团聚物,这些团聚物随着时间的增长而有所增多,在48 hpf的胚胎绒毛膜上各实验组几乎都发现了附着超过1 μm的团聚物。而在HA-ZnO-NPs处理组中,悬浮液中ZnO-NPs分布均匀,在斑马鱼胚胎的表面也未看见明显的团聚物附着(图4(d)~4(f)),在48 hpf后的斑马鱼胚胎表面绒毛膜上只有少量的聚集粒子。在刘倩等[22]的研究中,发现ZnO-NPs在大型溞表面的附着,并造成了大型溞体表的损伤。纳米颗粒在生物体表面的粘附对其毒性起着至关重要的作用[23]。在斑马鱼胚胎发育早期,胚胎尚未从绒毛膜中孵化,主要沉于容器的底部。由于ZnO-NPs在水中的易沉聚特性导致了纳米颗粒团聚物在容器底部聚集,增加了胚胎与纳米颗粒的接触概率,增强了其毒性。在加入HA后,ZnO-NPs的Zeta电位绝对值升高至30 mV以上,且水动力直径减少,表明纳米颗粒在水中变得更稳定,聚集现象减少,从而减少了纳米颗粒在胚胎表面的附着。
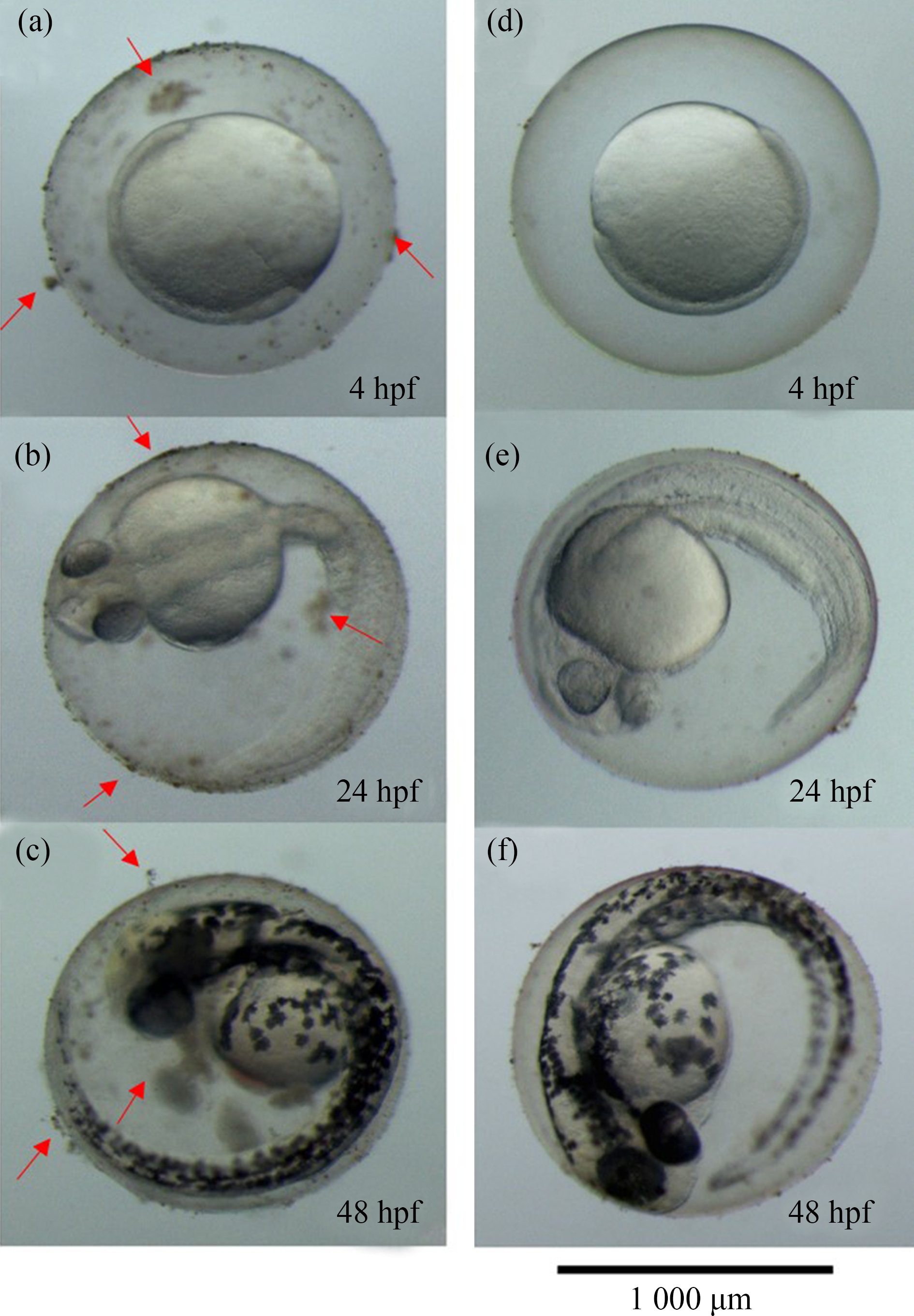
图4 ZnO-NPs在斑马鱼胚胎表面的附着
注:(a)~(c) ZnO-NPs 10 mg·L-1;(d)~(f) HA (24 mg·L-1)+ZnO-NPs (20 mg·L-1)。
Fig.4 ZnO-NPs adhere on embryo surface of zebrafish
Note:(a)~(c) ZnO-NPs 10 mg·L-1;(d)~(f) HA (24 mg·L-1)+ZnO-NPs (20 mg·L-1).
2.5 HA对ZnO-NPs导致的胚胎发育氧化应激的缓解作用
金属氧化物纳米颗粒通常会诱导生物体内产生过量的ROS,体内产生的ROS若不及时清除,会导致生物体氧化损伤[24]。据报道,ZnO-NPs除了因在斑马鱼胚胎表面聚集而导致胚胎毒性外,对生物体的另一毒性机制主要是导致生物体内ROS的产生[25]。通常,细胞中ROS的产生和清除处于动态平衡中,抗氧化酶(CAT、SOD等)对清除体内自由基、维持ROS的平衡和激活生物体氧化应激起着重要的作用[26]。因此对ZnO-NPs和HA-ZnO-NPs暴露条件下斑马鱼胚胎的CAT与SOD酶活性进行测定,结果如图5所示。
由图5(a)可知,暴露于ZnO-NPs处理的各组中斑马鱼胚胎体内CAT和SOD酶活性均升高,呈现先升高后降低的趋势。CAT与SOD均在10 mg·L-1的ZnO-NPs组中酶活性最高。与对照组相比,5、10和20 mg·L-1的ZnO-NPs实验组呈现显著性差异(P<0.01)。由图5(b)可知,在加入HA的实验组中,与20 mg·L-1 ZnO-NPs处理组相比,CAT和SOD酶活性水平随HA浓度增加呈下降趋势,在HA为12 mg·L-1和24 mg·L-1的实验组中,CAT与SOD酶活水平回落,与对照组相比,无显著性差异。从实际应用角度出发,12 mg·L-1的HA为最佳处理浓度。
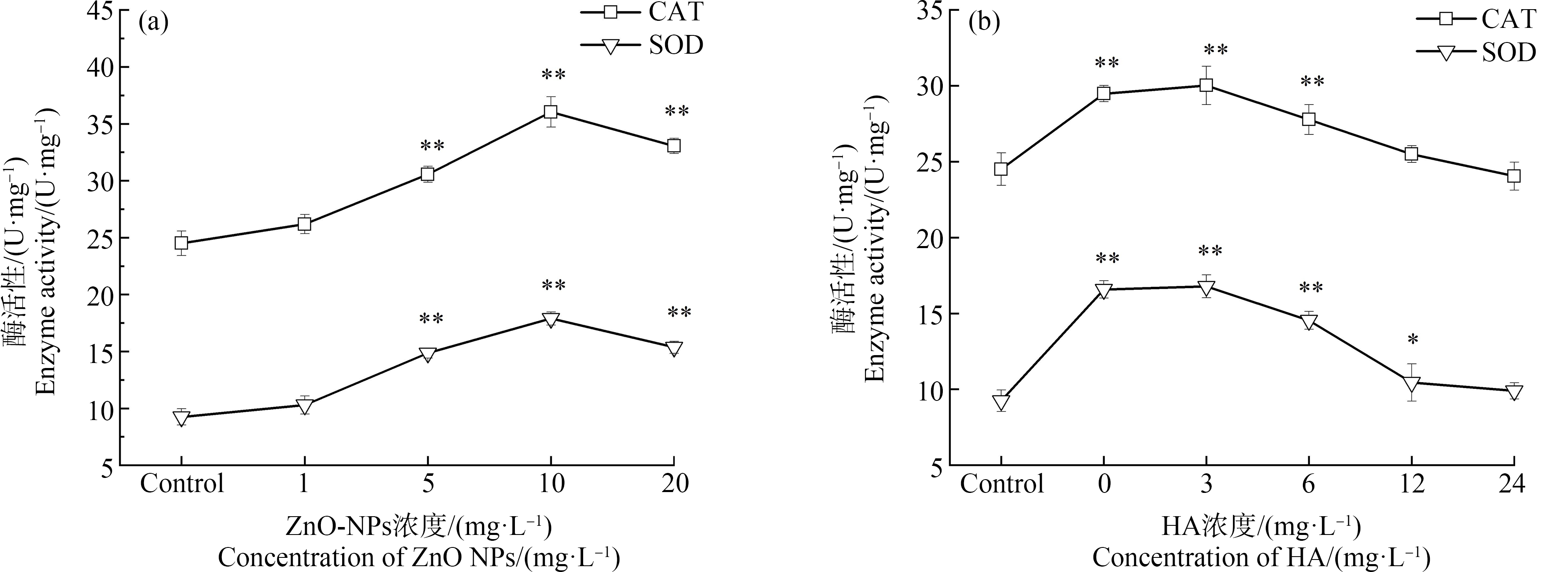
图5 斑马鱼胚胎暴露于ZnO-NPs(a)和HA-ZnO-NPs(b)的过氧化氢酶(CAT)与超氧化物歧化酶(SOD)活性
注:*表示P<0.05,**表示P<0.01。
Fig.5 Catalase (CAT) and superoxide dismutase (SOD) enzyme activities of zebrafish exposed to ZnO-NPs (a) and HA-ZnO-NPs (b)
Note:*represents P<0.05,**represents P<0.01.
3 讨论(Discussion)
水体中广泛存在的天然有机物,如HA,含有丰富的羧基和酚羟基等官能团,可与进入水体的各种污染物发生反应。关于金属纳米粒子与水体中HA反应及作用机理尚不清晰。据报道,自然界中存在的HA对纳米粒子的迁移转化途径有着不可忽视的影响,这些影响往往改变了纳米粒子的物理化学性质,从而导致其对水生生物的毒性影响发生改变。本研究证实ZnO-NPs在水中极不稳定,易团聚成大颗粒。在ZnO-NPs悬浮液中加入HA后,悬浮液中大颗粒数量减少,Zeta电位绝对值增大,水动力直径减少,增加了ZnO-NPs的稳定性。
以不同浓度的ZnO-NPs对斑马鱼胚胎进行暴露后,斑马鱼胚胎的存活率与ZnO-NPs的浓度存在
一定的剂量-效应关系。经计算ZnO-NPs对斑马鱼的LC50约为3.86 mg·L-1。20 mg·L-1的ZnO-NPs处理下胚胎96 hpf存活率仅3%左右。斑马鱼胚胎暴露于ZnO-NPs中,还诱发了一系列发育畸形效应,如尾部畸形、脊柱弯曲等,这与Nasrallah等[27]和Suriyaprabha等[28]的研究结果相似。这表明ZnO-NPs对斑马鱼胚胎具有早期阶段发育毒性。以不同浓度的HA加入20 mg·L-1的ZnO-NPs悬浮液中,随着HA浓度(0~24 mg·L-1)的升高,斑马鱼的存活率升高,当HA浓度>6 mg·L-1,胚胎96 hpf的存活率高于80%。这表明HA可以降低ZnO-NPs对斑马鱼胚胎的毒性。Kteeba等[16]的研究也发现,不同种类的NOM中,HA对纳米粒子致斑马鱼胚胎毒性的缓解作用最明显。为进一步探讨HA缓解ZnO-NPs致斑马鱼胚胎毒性作用的机理,本研究通过显微观察发现,ZnO-NPs的实验组中斑马鱼胚胎绒毛膜表面均附着了许多ZnO-NPs的团聚体。纳米颗粒的粘附不仅会造成生物有机体的表体损伤,还会堵塞斑马鱼胚胎绒毛膜表面的孔隙,使胚胎内部环境的氧浓度降低[29]。斑马鱼胚胎绒毛膜的孔隙直径为0.7 μm左右[30],这便使得水动力直径<0.7 μm的ZnO-NPs与HA-ZnO-NPs粒子都有机会通过胚胎绒毛膜的孔隙进入胚胎内部。但是斑马鱼胚胎的绒毛膜具有化学反应活性,可以调控纳米粒子进入胚胎的方式[31],所以不能简单地视其为胚胎外层的物理屏障。纳米粒子附着在胚胎绒毛膜上,会对斑马鱼胚胎绒毛膜造成损伤,进而破坏绒毛膜的调控能力[29]。而加入HA之后,斑马鱼胚胎绒毛膜表面团聚体明显减少,这与Zeta电位和水动力直径的研究结果一致,表明HA的加入使ZnO-NPs稳定地分散在悬浮液中,减少了其团聚并沉积到容器底部的几率,进一步减少了沉在容器底部的斑马鱼胚胎与ZnO-NPs的接触。HA减少了纳米粒子在胚胎绒毛膜表面的粘附,则减轻了ZnO-NPs对绒毛膜的损伤,从而使纳米粒子的生物利用率降低,毒性得到缓解[32]。
在前期研究中,ZnO-NPs会诱导生物体内产生过量的ROS[33],导致斑马鱼胚胎的抗氧化酶活性的增加[22]。ROS的增加会对有机体造成伤害,而SOD和CAT是维持体内氧化还原平衡的关键抗氧化酶。SOD将体内增加的ROS歧化为过氧化氢,再由CAT催化过氧化氢,降解或还原为水和氧分子[34]。本研究中,ZnO-NPs各实验组均提高了斑马鱼胚胎的SOD、CAT酶活,除1 mg·L-1的ZnO-NPs实验组外,各组酶活性与对照组相比均呈现显著性差异(P<0.01),这表明ZnO-NPs激发了斑马鱼胚胎产生氧化应激。HA的加入可以使CAT与SOD酶活性水平回落,在加入12 mg·L-1与24 mg·L-1 HA的实验组中,斑马鱼体内的CAT与SOD酶活性水平与对照组相比均无显著性差异;此时,HA的浓度虽成倍增加,但斑马鱼体内的抗氧化酶活性水平无显著差异,所以从实际应用角度考虑,12 mg·L-1的HA为最佳处理浓度。当ZnO-NPs导致机体内产生过量ROS时,生物体内CAT与SOD酶活性会升高,以清除过量的ROS[19]。而HA可以作为抗氧化剂与细胞内ROS发生反应,显著降低生物有机体内的自由基水平,使生物体内的抗氧化防御系统恢复平衡[29],因此,氧化应激的SOD与CAT活性逐渐恢复正常,这与Zhang等[19]的研究结果一致。
总之,悬浮液中HA的存在对ZnO-NPs致斑马鱼胚胎毒性有一定的缓解作用,在研究纳米粒子的生物毒性时,除考虑浓度的累积效应外,还应把环境中的其他生态因子的影响纳入考虑,进行全面评估,可避免对其在环境中的潜在毒性造成过高或过低的评价。
[1] Mahana A,Guliy O I,Mehta S K.Accumulation and cellular toxicity of engineered metallic nanoparticle in freshwater microalgae:Current status and future challenges [J].Ecotoxicology and Environmental Safety,2021,208:111662
[2] Du J J,Zhang Y Y,Guo R L,et al.Harmful effect of nanoparticles on the functions of freshwater ecosystems:Insight into nanoZnO-polluted stream [J].Chemosphere,2019,214:830-838
[3] Bhatt I,Tripathi B N.Interaction of engineered nanoparticles with various components of the environment and possible strategies for their risk assessment [J].Chemosphere,2011,82(3):308-317
[4] Heinlaan M,Ivask A,Blinova I,et al.Toxicity of nanosized and bulk ZnO,CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus [J].Chemosphere,2008,71(7):1308-1316
[5] Santo N,Fascio U,Torres F,et al.Toxic effects and ultrastructural damages to Daphnia magna of two differently sized ZnO nanoparticles:Does size matter?[J].Water Research,2014,53:339-350
[6] Hou J,Liu H Q,Zhang S Y,et al.Mechanism of toxic effects of Nano-ZnO on cell cycle of zebrafish (Danio rerio) [J].Chemosphere,2019,229:206-213
[7] 刘涛,杜青平,秦春怡,等.nano-ZnO对斑马鱼鱼鳔发育毒性效应研究[J].环境科学学报,2020,40(1):290-298
Liu T,Du Q P,Qin C Y,et al.Study on developmental toxic effects on the swim bladder of zebrafish exposed to nano-ZnO [J].Acta Scientiae Circumstantiae,2020,40(1):290-298 (in Chinese)
[8] Wu J Y,Jiang R F,Liu Q L,et al.Impact of different modes of adsorption of natural organic matter on the environmental fate of nanoplastics [J].Chemosphere,2021,263:127967
[9] Slomberg D L,Ollivier P,Miche H,et al.Nanoparticle stability in lake water shaped by natural organic matter properties and presence of particulate matter [J].The Science of the Total Environment,2019,656:338-346
[10] Islam M A,Morton D W,Johnson B B,et al.Adsorption of humic and fulvic acids onto a range of adsorbents in aqueous systems,and their effect on the adsorption of other species:A review [J].Separation and Purification Technology,2020,247:116949
[11] Wall N A,Choppin G R.Humic acids coagulation:Influence of divalent cations [J].Applied Geochemistry,2003,18(10):1573-1582
[12] 刘振宇,刘彬,王丹,等.纳米材料在水生环境中的行为和转化[J].海河水利,2015(2):67-70
Liu Z Y,Liu B,Wang D,et al.Behavior and conversion of nanomaterials in the aquatic environment [J].Haihe Water Resources,2015(2):67-70 (in Chinese)
[13] Xiao B W,Wang X L,Yang J,et al.Bioaccumulation kinetics and tissue distribution of silver nanoparticles in zebrafish:The mechanisms and influence of natural organic matter [J].Ecotoxicology and Environmental Safety,2020,194:110454
[14] Shang E X,Li Y,Niu J F,et al.Relative importance of humic and fulvic acid on ROS generation,dissolution,and toxicity of sulfide nanoparticles [J].Water Research,2017,124:595-604
[15] Dai H L,Sun T S,Han T,et al.Aggregation behavior of zinc oxide nanoparticles and their biotoxicity to Daphnia magna:Influence of humic acid and sodium alginate [J].Environmental Research,2020,191:110086
[16] Kteeba S M,El-Adawi H I,El-Rayis O A,et al.Zinc oxide nanoparticle toxicity in embryonic zebrafish:Mitigation with different natural organic matter [J].Environmental Pollution,2017,230:1125-1140
[17] Kteeba S M,El-Ghobashy A E,El-Adawi H I,et al.Exposure to ZnO nanoparticles alters neuronal and vascular development in zebrafish:Acute and transgenerational effects mitigated with dissolved organic matter [J].Environmental Pollution,2018,242:433-448
[18] Jia M,Teng M M,Tian S N,et al.Developmental toxicity and neurotoxicity of penconazole enantiomers exposure on zebrafish (Danio rerio) [J].Environmental Pollution,2020,267:115450
[19] Zhang Y,Meng T T,Guo X,et al.Humic acid alleviates the ecotoxicity of graphene-family materials on the freshwater microalgae Scenedesmus obliquus [J].Chemosphere,2018,197:749-758
[20] Keattanong P,Wasukan N,Kuno M,et al.Synthesis,structural characterization,computational studies and stability evaluations of metal ions and ZnONPs complexes with dimercaptosuccinic acid [J].Heliyon,2021,7(1):e05962
[21] Wu Q,Li G Y,Huo T B,et al.Mechanisms of parental co-exposure to polystyrene nanoplastics and microcystin-LR aggravated hatching inhibition of zebrafish offspring [J].The Science of the Total Environment,2021,774:145766
[22] 刘倩,杜青平,刘涛,等.纳米氧化锌致大型溞的毒性效应特征[J].环境科学学报,2019,39(4):1332-1339
Liu Q,Du Q P,Liu T,et al.Study on the toxicity effects of nanometer zinc oxide on Daphnia magna [J].Acta Scientiae Circumstantiae,2019,39(4):1332-1339 (in Chinese)
[23] Peng X H,Palma S,Fisher N S,et al.Effect of morphology of ZnO nanostructures on their toxicity to marine algae [J].Aquatic Toxicology,2011,102(3-4):186-196
[24] Du W C,Tan W J,Peralta-Videa J R,et al.Interaction of metal oxide nanoparticles with higher terrestrial plants:Physiological and biochemical aspects [J].Plant Physiology and Biochemistry,2017,110:210-225
[25] Molnár  ,Rónavári A,Bélteky P,et al.ZnO nanoparticles induce cell wall remodeling and modify ROS/RNS signalling in roots of Brassica seedlings [J].Ecotoxicology and Environmental Safety,2020,206:111158
,Rónavári A,Bélteky P,et al.ZnO nanoparticles induce cell wall remodeling and modify ROS/RNS signalling in roots of Brassica seedlings [J].Ecotoxicology and Environmental Safety,2020,206:111158
[26] Xiong D W,Fang T,Yu L P,et al.Effects of nano-scale TiO2,ZnO and their bulk counterparts on zebrafish:Acute toxicity,oxidative stress and oxidative damage [J].The Science of the Total Environment,2011,409(8):1444-1452
[27] Nasrallah G K,Salem R,Da’as S,et al.Biocompatibility and toxicity of novel iron chelator starch-deferoxamine (S-DFO) compared to zinc oxide nanoparticles to zebrafish embryo:An oxidative stress based apoptosis,physicochemical and neurological study profile [J].Neurotoxicology and Teratology,2019,72:29-38
[28] Suriyaprabha R,Balu K S,Karthik S,et al.A sensitive refining of in vitro and in vivo toxicological behavior of green synthesized ZnO nanoparticles from the shells of Jatropha curcas for multifunctional biomaterials development [J].Ecotoxicology and Environmental Safety,2019,184:109621
[29] Chen Y M,Ren C X,Ouyang S H,et al.Mitigation in multiple effects of graphene oxide toxicity in zebrafish embryogenesis driven by humic acid [J].Environmental Science &Technology,2015,49(16):10147-10154
[30] Rawson D M,Zhang T,Kalicharan D,et al.Field emission scanning electron microscopy and transmission electron microscopy studies of the chorion,plasma membrane and syncytial layers of the gastrula-stage embryo of the zebrafish Brachydanio rerio:A consideration of the structural and functional [J].Aquaculture Research,2000,31(3):325-336
[31] Auffan M,Matson C W,Rose J,et al.Salinity-dependent silver nanoparticle uptake and transformation by Atlantic killifish (Fundulus heteroclitus) embryos [J].Nanotoxicology,2014,8(Suppl.1):167-176
[32] Kansara K,Kumar A,Karakoti A S.Combination of humic acid and clay reduce the ecotoxic effect of TiO2 NPs:A combined physico-chemical and genetic study using zebrafish embryo [J].Science of the Total Environment,2020,698:134133
[33] Zhao X S,Ren X,Zhu R,et al.Zinc oxide nanoparticles induce oxidative DNA damage and ROS-triggered mitochondria-mediated apoptosis in zebrafish embryos [J].Aquatic Toxicology,2016,180:56-70
[34] Ighodaro O M,Akinloye O A.First line defence antioxidants-superoxide dismutase (SOD),catalase (CAT) and glutathione peroxidase (GPX):Their fundamental role in the entire antioxidant defence grid [J].Alexandria Journal of Medicine,2018,54(4):287-293