粪肠球菌是一种在自然环境中广泛存在的革兰氏阳性细菌。由于其特殊的耐药机制及高频率的耐药基因转移方式,导致了环境中耐药粪肠球菌的广泛传播。抗生素抗性基因在细菌中的广泛传播,已严重威胁到人类的健康[1-2]。基因在细菌间的水平转移主要分为转化、转导和接合3种方式,其中接合是指通过细菌间接触从而转移质粒的方式,其转移质粒的频率和效率最高[3]。在肠球菌属的接合转移中存在一类信息素应答质粒介导的接合转移,其接合转移频率高达10-1(接合子数量/供体菌数量),且携带抗生素抗性基因,使得耐药现状更加严峻[4-5]。信息素调控质粒编码了一种利用多肽信息素作为信号分子的特殊接合转移机制。粪肠球菌中的信息素通常是由7~8个氨基酸组成的多肽,这种多肽在无质粒的细菌细胞(受体)中产生和释放,并在含有质粒的细菌细胞(供体)中诱导质粒发生转移[6-9]。
医院和养殖场废水排放等人类活动,自然水体可能被抗生素污染[10],而抗生素残留给细菌带来的选择性压力是抗生素抗性基因的广泛传播的原因之一[11]。但研究者证明非抗生素因素(如纳米材料、重金属离子和消毒剂等)也能够造成耐药基因广泛传播[12-14]。
双酚A(BPA, 4,4’-dihydroxy-2,2-diphenylpropane;CAS:80-05-7)是一种自然水体中常见的环境雌激素类污染物。双酚A是世界上生产量最高的化学原料之一[15],工业上常使用双酚A作为单体合成环氧树脂等聚合物,用于制造多种生活用品[16]。双酚A的核心结构类似于天然的17β-雌二醇,因此具有雌激素效应,经广泛证实是一种内分泌干扰物[17-20]。强酸、强碱和高温等条件会加剧连接双酚A单体的酯键的水解,使得双酚A单体通过垃圾填埋场渗出液、工业废水等途径进入环境[19, 21-22]。在自然水体中双酚A的含量也相对较高,通常可用μg·L-1来计量[23]。双酚A的化学构象及穿膜方式与信息素类似[24],又与携带抗生素抗性基因的细菌在空间上产生交集,如果其能够促进耐药基因的接合转移,将使耐药基因扩散形势更加严峻。
本文选择了最具代表性的信息素调控质粒pCF10质粒作为研究对象,通过建立肠球菌间耐药基因接合转移模型研究了双酚A浓度及作用时间对pCF10质粒接合转移的影响规律;并利用荧光定量PCR技术测定了双酚A对调控信息素产生的相关基因表达的影响,初步揭示双酚A促进pCF10质粒接合转移的机制。本研究为全面了解环境中双酚A的生物效应提供了新的科学依据,也为环境中耐药基因扩散防控和生态安全提供理论指导。
1 材料与方法(Materials and methods)
1.1 菌株、质粒培养条件及接合转移实验
本研究中使用的细菌均来源于粪肠球菌OG1RF(ATCC47077)。信息素调控质粒pCF10[25]携带编码四环素抗性的抗性基因,由美国明尼苏达大学Gary Dunny教授惠赠。供体菌OGlRF(pCF10)为肠球菌OGlRF携带pCF10质粒,能够耐受0.01 g·L-1四环素;受体菌OGlRS是肠球菌OG1RF经本实验室诱导获得链霉素抗性的肠球菌,能够耐受3 g·L-1链霉素;接合子OG1RS(pCF10)为受体菌OG1RS获得pCF10质粒,能够耐受0.01 g·L-1四环素和3 g·L-1链霉素。供体菌OG1RF(pCF10)和受体菌OG1RS分别接种于含有对应浓度抗生素的脑心浸出液肉汤培养基(BHI)(北京酷来搏科技有限公司,中国)中,37 ℃条件下培养10 h后将菌液按1∶10的比例转接至新鲜的含相应抗生素的BHI培养基中,置于37 ℃恒温恒湿培养箱中5 h生长至对数期。在冷冻离心机(5408R,Eppendorf,德国)4 ℃、4 629 g、5 min条件下,利用磷酸缓冲盐溶液(PBS,北京索莱宝科技有限公司,中国)离心洗涤3次后用LB肉汤培养基(Becton,Dickinson公司,美国)重悬菌液并调整OG1RF(pCF10)和OG1RS菌液浓度至1×108 CFU·mL-1。随后将供、受体菌按照1∶1的比例混合组成接合转移体系,在37 ℃条件下培养一定时间后,取100 μL菌液利用含2 mmol·L-1乙二胺四乙酸(EDTA)(纯度≥99.5%,上海麦克林生化科技有限公司,中国)的PBS缓冲液进行梯度稀释。取稀释2个梯度和3个梯度的10 μL菌液分别滴在含有0.01 g·L-1四环素和3 g·L-1的链霉素的双抗BHI琼脂培养基上筛选接合子;取稀释4个梯度和5个梯度的10 μL菌液滴在只含有3 g·L-1链霉素或只含有0.01 g·L-1四环素的BHI琼脂培养基上分别筛选受体菌或供体菌。待菌液被充分吸收后,倒置放入37 ℃恒温恒湿培养箱,培养36 h左右计数形成的单菌落。
1.2 双酚A浓度对pCF10接合转移影响实验
双酚A(纯度≥99%,Sigma-Aldrich公司,美国)溶于二甲基亚砜(DMSO)(纯度≥99.7%,Sigma-Aldrich公司,美国),制成浓度为1 mmol·L-1的储备液。按照1.1中制备接合转移体系的方法制备7份体积相同接合菌液,其中5份分别加入浓度为1×10-2、1×10-1、1、10和100 nmol·L-1的双酚A,其余2份分别加入等体积的灭菌双蒸水和终浓度为1.1×10-2 g·L-1的DMSO作对照。菌液混匀后置于37 ℃恒温恒湿培养箱培养4 h后,按照1.1中的方法分别计数供体菌、受体菌和接合子数量。本实验至少重复3次。
1.3 双酚A作用时间对pCF10接合转移影响实验
按照1.1中的方法制备3份接合转移菌液,其中一份加入终浓度为1 nmol·L-1的双酚A,另外2份分别加入等体积的灭菌双蒸水和DMSO作为对照。同时制备供体菌和受体菌菌液,按照以上方法加入双酚A、双蒸水和DMSO,进行双酚A对供、受体菌生长的影响实验。所有菌液混匀后置于37 ℃恒温恒湿培养箱培养,分别在1、2、4、6和8 h取出100 μL菌液按照1.1中的方法分别计数供体菌、受体菌和接合子数量。本实验至少重复3次。
1.4 活性氧检测
按照1.1中的方法制备供体菌、受体菌和接合转移菌液各3份。在供、受体菌和接合转移菌液中各取一份加入1 nmol·L-1的双酚A处理4 h,另外2份加入灭菌双蒸水和活性氧检测试剂盒提供的阳性对照Rosup分别作为阴性对照和阳性对照。取双酚A和Rosup处理4 h后的接合转移菌液各100 μL进行接合子计数,剩余菌液用于测定活性氧(reactive oxygen species, ROS)含量。ROS的测定参照活性氧检测试剂盒(CA1410,北京索莱宝科技有限公司,中国)的使用说明进行。具体步骤如下:1 mL细胞悬液加入1 μL(终浓度为10 μmol·L-1)新鲜制备的DCFH-DA荧光探针。混合物在37 °C条件下静置20 min,每5 min振荡颠倒混匀一次。在4 ℃、4 629 g、5 min条件下,用PBS离心清洗3次以去除多余的荧光探针。使用酶标仪(SpectraMax M5,Molecular Devices公司,美国)在激发光488 nm、发射光525 nm测定荧光值。
1.5 细菌总RNA的提取
按照1.1中的方法制备接合转移菌液,加入终浓度1 nmol·L-1的双酚A(等体积的双蒸水作为对照)在37 ℃恒温恒湿培养箱培养4 h后,迅速回收细菌细胞,置于-80 ℃低温冰箱保存备用。解冻后在4 ℃、9 700 g、2 min条件下离心完全去除上清,细菌沉淀用于提取总RNA。使用细菌总RNA提取试剂盒(DP430,天根生化科技有限公司,中国)提取细菌总RNA,具体操作过程按照试剂盒说明书进行。利用微量分光光度计(ND-ONE-W,Thermo Fisher公司,美国)测定RNA浓度后,利用FastKing cDNA第一链合成试剂盒(KR116-02,天根生化科技有限公司,中国)将总RNA反转录合成cDNA。反转录的操作按照试剂盒说明书进行,所用的引物为试剂盒提供的FQ-RT Primer Mix。cDNA置于-80 ℃低温冰箱保存,用于后面的荧光定量PCR实验。
1.6 细菌基因组DNA的提取
按照1.1中的方法制备接合转移菌液,加入终浓度1 nmol·L-1的双酚A(等体积的双蒸水作为对照)在37 ℃恒温恒湿培养箱培养4 h后,迅速回收细菌细胞。使用细菌基因组DNA提取试剂盒(DP302,天根生化科技有限公司,中国)分别提取双酚A处理组和对照组的细菌基因组DNA。提取的DNA置于-80 ℃低温冰箱保存,用于后面的荧光定量PCR实验。
1.7 荧光定量PCR实验
荧光定量PCR实验中所用的引物利用软件DNASTAR V7.1进行设计,由生工生物工程(上海)股份有限公司合成。相关基因引物序列及扩增产物片段长度如表1所示。
荧光定量PCR反应体系为20 μL,包括SYBR Green预混液(A25742,Thermo Fisher公司,美国) 10 μL,上下游引物(终浓度为5×10-2 nmol·L-1)各1 μL,cDNA模板1 μL,双蒸水7 μL。每个样品至少做3个复孔。荧光定量PCR实验在美国Bio-Rad公司型号为CFX96的荧光定量PCR仪上完成,所用软件为Bio-Rad CFX Maestro。PCR的扩增程序为95 ℃预变性5min,然后进行40个循环的95 ℃变性10 s、60 ℃退火30 s和72 ℃延伸10 s。最后进行熔解曲线测定,程序为:65 °C 5 s,升高至95 °C变性DNA产物。
利用绝对定量的方法计算样品目的基因拷贝值,以内参基因16S rRNA校正PCR模板的拷贝数。研究中的基因扩增标准曲线如图1所示。
1.8 信息素的测定方法
按照1.1中方法制备接合菌液2份,其中1份加入终浓度为1 nmol·L-1的双酚A,另1份加入等体积的双蒸水作为对照。接合菌液放置于37 ℃恒温恒湿培养箱中培养4 h,迅速取出并放置于冰上20 min。离心机在12 857 g、4 ℃条件下离心10 min,保留上清液,然后用0.22 μm孔径的一次性针头式滤器(SLGP033RB,Millipore公司,美国)过滤上清。取800 μL过滤后的上清液加入100 μL乙腈(纯度≥99.9%,上海麦克林生化科技有限公司,中国)和100 μL氢氧化铵(纯度≥25%,上海阿拉丁生化科技股份有限公司,中国),室温1 400 r·min-1混匀15 min后,在21 ℃、20 000 g条件下离心15 min。取600 μL上清液与600 μL 10%氢氧化铵水溶液(V∶V)混合,短暂离心后使用C18固相萃取柱(广州翔博生物科技有限公司,中国)进行萃取。首先分别将5 mL乙腈和5 mL水通过固相萃取柱,使其活化。然后将1 mL样品通过固相萃取柱,依次用5 mL 5%乙腈水溶液(V∶V)、0.75 mL和0.5 mL 30%乙腈水溶液(V∶V)进行洗脱,收集第2次和第3次洗脱样品在液相色谱-三重四级杆质谱联用仪(H CLASS_XEVO TQ-S micro,Waters公司,美国)上进行检测。
表1 引物序列
Table 1 Sequence of primers
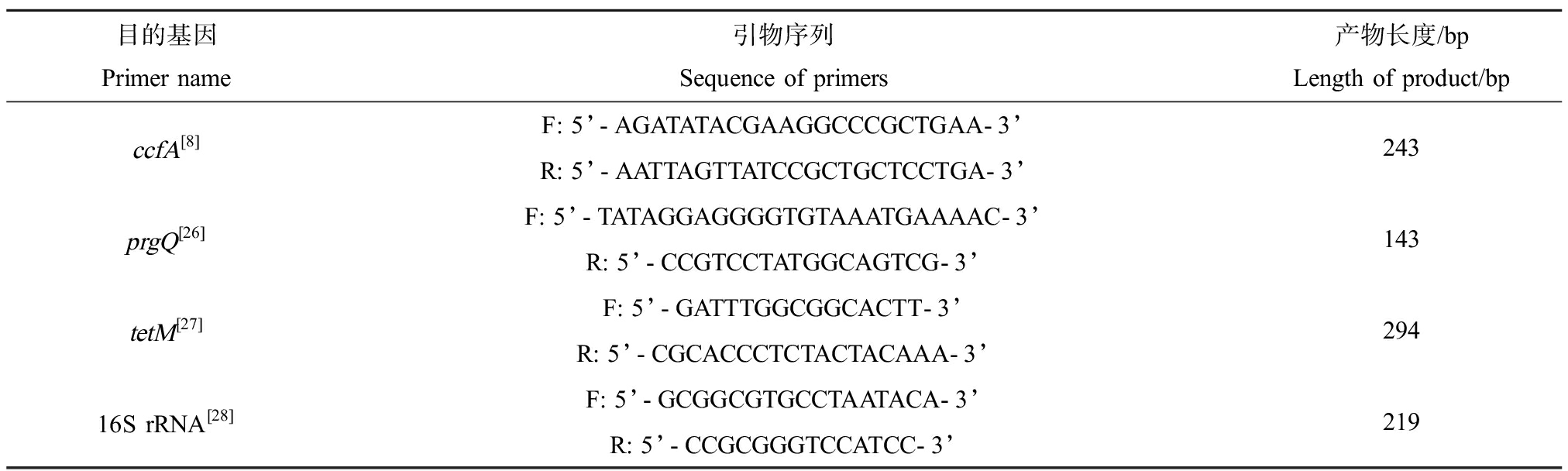
目的基因Primer name引物序列Sequence of primers产物长度/bpLength of product/bpccfA[8]F: 5’-AGATATACGAAGGCCCGCTGAA-3’R: 5’-AATTAGTTATCCGCTGCTCCTGA-3’243prgQ[26]F: 5’-TATAGGAGGGGTGTAAATGAAAAC-3’R: 5’-CCGTCCTATGGCAGTCG-3’143tetM[27]F: 5’-GATTTGGCGGCACTT-3’R: 5’-CGCACCCTCTACTACAAA-3’29416S rRNA[28]F: 5’-GCGGCGTGCCTAATACA-3’R: 5’-CCGCGGGTCCATCC-3’219

图1 不同基因拷贝数的对数值与扩增循环数的对应关系标准曲线
Fig. 1 Standard curve corresponding to the log of the copy number of each primer gene and cycle threshold
超高效液相条件:C18 (1.7 μm,2.1 mm×50 mm,Waters公司,美国)色谱柱,流动相:乙腈(A),0.1%甲酸(纯度≥99.5%,上海麦克林生化科技有限公司,中国)、5 mmol·L-1乙酸铵的水溶液(B)。体积流量0.3 mL·min-1,柱温35 ℃,进样量5 μL。梯度洗脱程序:0~0.5 min,96%A;0.5~1.5 min,40%A;1.5~2.5 min,40%A;2.5~3 min,96%A;3~5 min,96%A。
质谱条件:选择ESI正离子模式,其余条件如表2所示。
表2 质谱条件参数
Table 2 Mass spectrum parameters
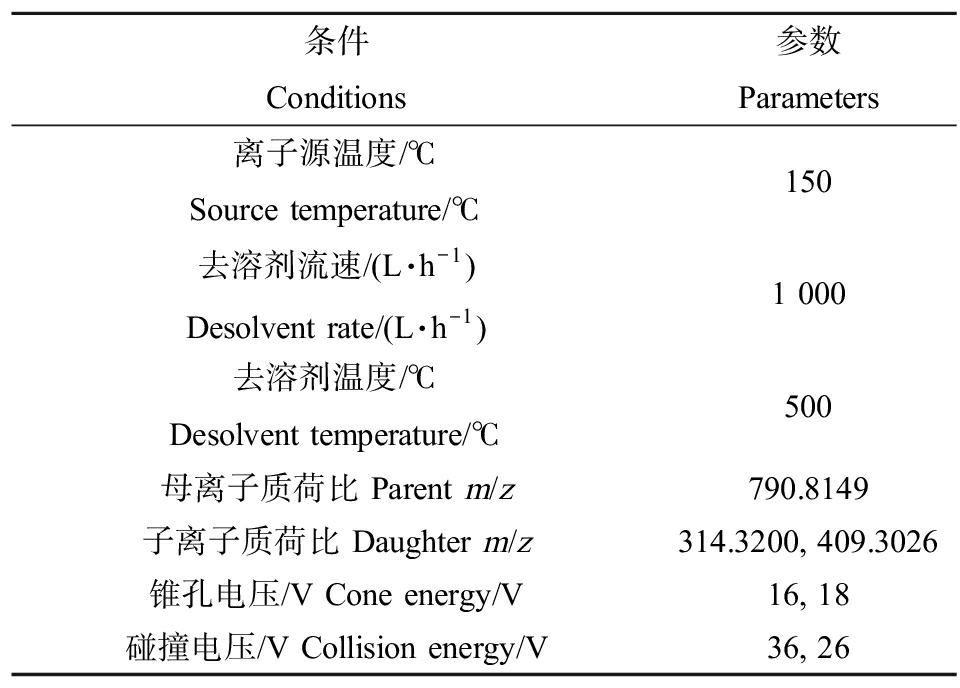
条件Conditions参数Parameters离子源温度/℃Source temperature/℃150去溶剂流速/(L·h-1)Desolvent rate/(L·h-1)1 000去溶剂温度/℃Desolvent temperature/℃500母离子质荷比 Parent m/z790.8149子离子质荷比 Daughter m/z314.3200, 409.3026锥孔电压/V Cone energy/V16, 18碰撞电压/V Collision energy/V36, 26
1.9 统计学分析
采用GraphPad Prism 8.3.0软件进行数据处理,并利用SPSS 26.0软件对多因素影响接合子数量、测定ROS水平的相关实验数据进行单因素方差分析,对测定基因转录水平和信息素含量等相关实验数据进行t检验分析,P<0.05被认为有显著的统计学差异。
2 结果(Results)
2.1 双酚A浓度对粪肠球菌耐药基因接合转移的影响
双酚A浓度对粪肠球菌耐药基因接合转移的影响如图2所示。供体菌和受体菌初始浓度均为1×108 CFU·mL-1,接合转移4 h条件下,自然状态下形成接合子数量约为6.61×105 CFU·mL-1(Control组)。同时在1.1×10-2 g·L-1的DMSO作用下,接合子数量为6.27×105 CFU·mL-1,与空白对照组相比无统计学差异(one-way ANOVA,P>0.05),说明溶剂DMSO对pCF10质粒介导的接合转移无影响。接合体系在1 nmol·L-1双酚A作用4 h后接合子数量约为1.37×106 CFU·mL-1,可达对照组的2倍左右。在1×10-1 nmol·L-1和1×10-2 nmol·L-1的双酚A作用下,接合体系中接合子的数量也有明显的提升(1.12~1.19×106 CFU·mL-1)。1、10-1和10-2 nmol·L-1的双酚A显著地提高了接合子的数量,经统计学分析具有显著性差异(one-way ANOVA,P<0.05)。而在10 nmol·L-1和100 nmol·L-1浓度的双酚A作用下,接合子数量在6.11×105 CFU·mL-1,与对照组相比无明显差异(one-way ANOVA,P>0.05)。这一结果表明,在1×10-2~1 nmol·L-1的浓度范围内,双酚A对pCF10质粒介导的接合转移具有促进作用,并且这一影响与双酚A浓度相关。
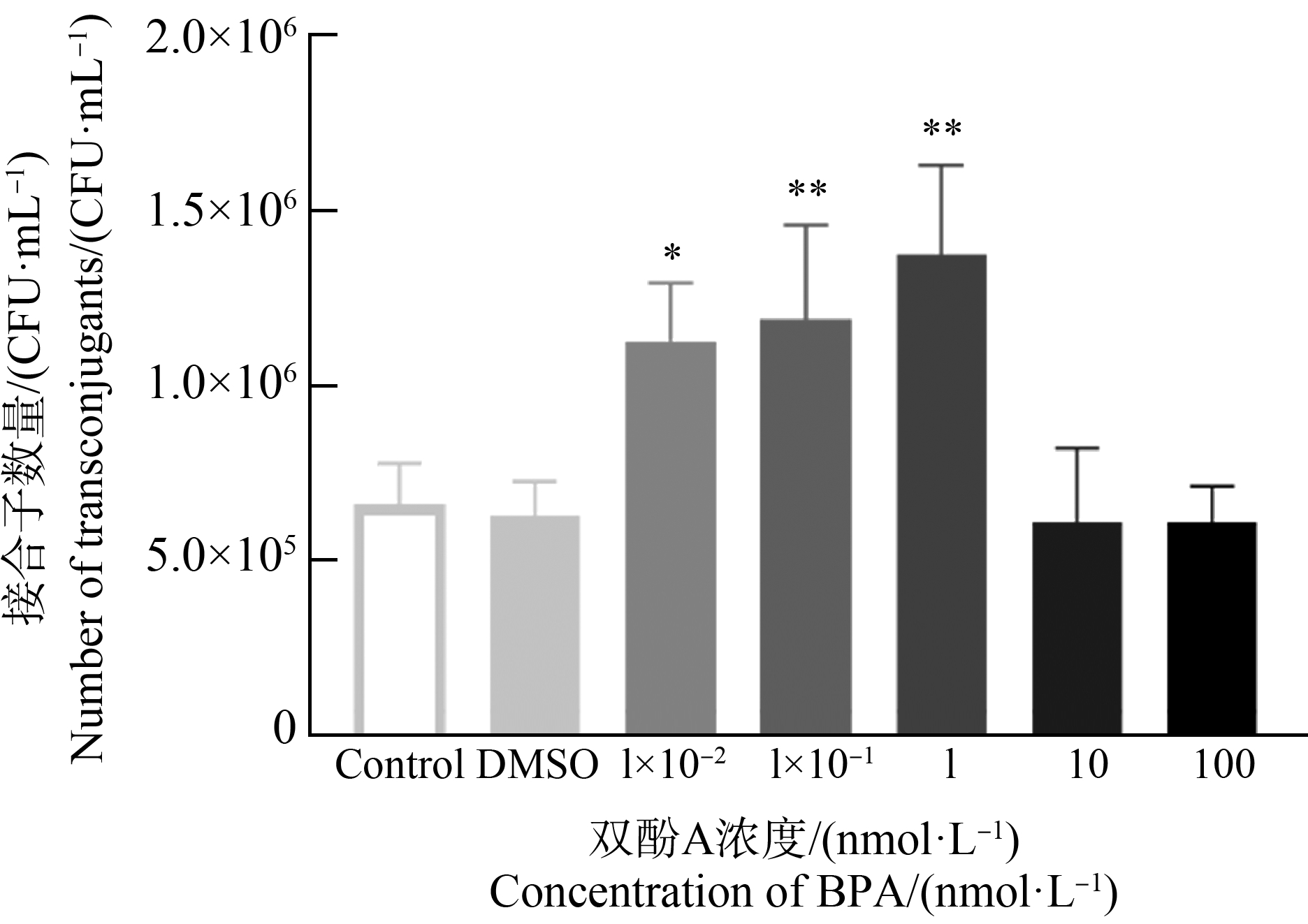
图2 双酚A(BPA)浓度对接合转移的影响
(*P<0.05、**P<0.01)
注:DMSO表示该组为加入终浓度为1.1×10-2 g·L-1的
二甲基亚砜(DMSO)的对照组。
Fig. 2 Effect of bisphenol A (BPA) concentration on
conjugative transfer (*P<0.05, **P<0.01)
Note: DMSO indicates that the group added with a final concentration
of 1.1×10-2 g·L-1 of dimethyl sulfoxide (DMSO) as a control.
为了进一步确定双酚A能够促进接合转移体系中耐药基因tetM丰度的增加,利用荧光定量PCR的方法测定了tetM基因在接合转移前后的丰度。如图3所示,在接合开始时实验组与对照组的tetM基因相对丰度均在5×10-3左右。当接合时间达到4 h时,1 nmol·L-1双酚A作用后的接合体系中tetM基因相对丰度可达1.2×10-1左右,而自然状态下发生接合转移的体系中tetM基因相对丰度仅为8×10-2左右,经统计学分析具有显著性差异(t-test,P<0.01)。在双酚A作用下,耐药基因tetM的相对基因丰度可提高1.5倍。这一结果表明,双酚A可以通过接合转移的方式使耐药基因的相对丰度显著提高。
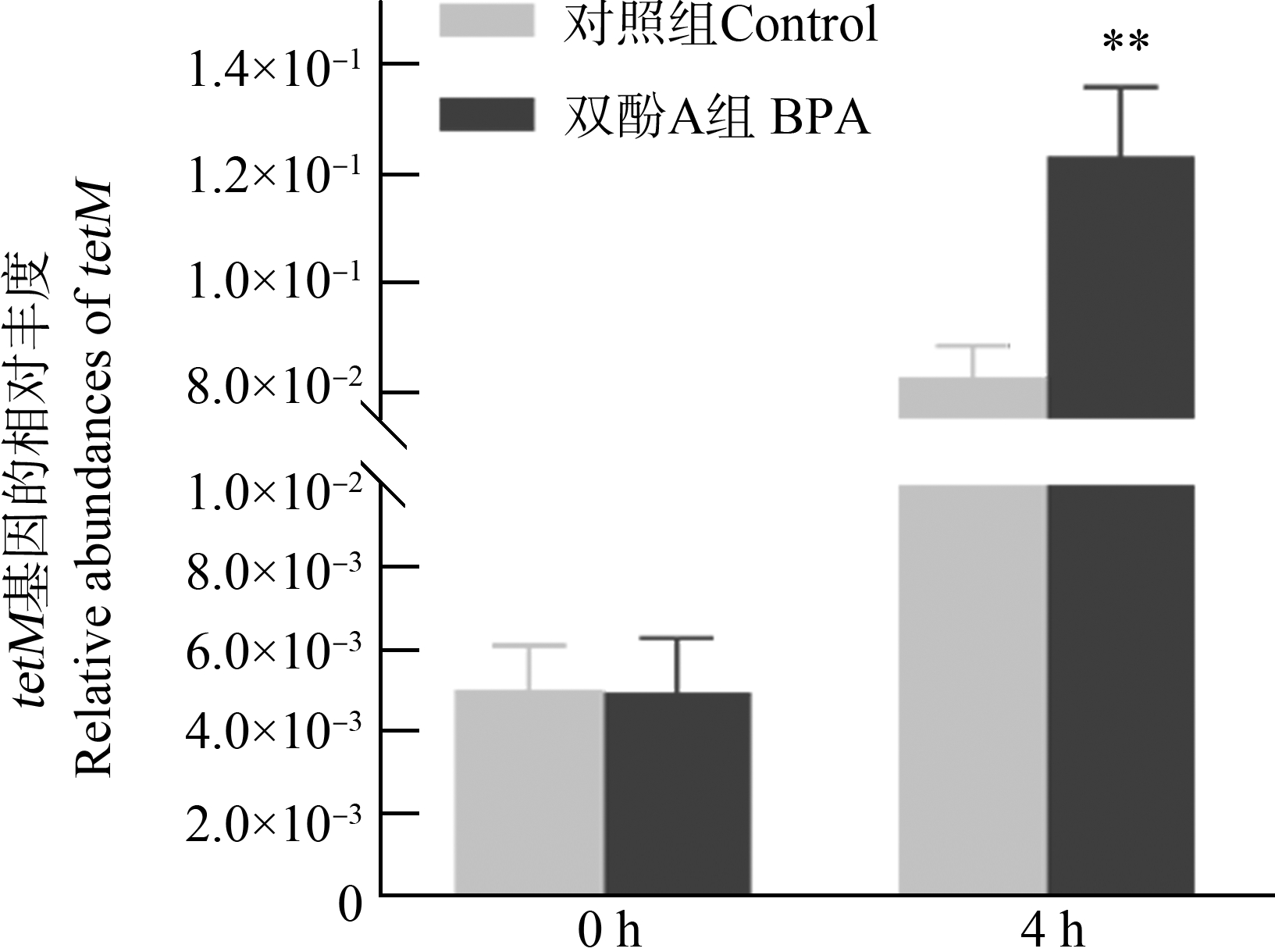
图3 双酚A作用下,tetM基因相对丰度的变化
(**P<0.01)
Fig. 3 Changes in the relative abundance of tetM under
the effect of BPA (**P<0.01)
2.2 双酚A作用时间对粪肠球菌耐药基因接合转移的影响
双酚A作用时间对粪肠球菌耐药基因接合转移的影响如图4所示。在自然状态下(Control组),pCF10质粒的接合子数量在接合时间0~4 h内随作用时间的延长而增加,在接合4 h时接合子数量在9.3×105 CFU·mL-1左右,达到最高点。在接合4 h后,接合子数量呈现下降趋势。同时在1.1×10-2 g·L-1的DMSO作用下,在作用时间1~8 h内接合子数量与空白对照组相比经统计学分析无明显差异(one-way ANOVA,P>0.05),说明溶剂DMSO对pCF10质粒介导的接合转移无显著影响。在1 nmol·L-1双酚A作用于接合体系4~6 h后,接合子数量相较于空白对照组有明显的增加,其中双酚A作用4 h后,接合子数量可由8.6×105 CFU·mL-1升至1.5×106 CFU·mL-1,经统计学分析具有显著性差异(one-way ANOVA,P<0.05)。结果表明,在双酚A作用下,接合子数量随时间的变化趋势与自然状态下类似,均呈现出随着作用时间的延长,接合子数量先增加后降低的规律。接合时间在4~6 h时,双酚A对pCF10质粒介导的接合转移具有促进作用,且在接合4 h时,双酚A对接合转移的促进作用最明显。
通过进一步观察供受体菌的生长情况可以发现(图5),接合转移过程中双酚A作用下的供受体菌数量与对照组相比均无明显变化。这一结果表明,双酚A不是通过影响供受体菌数量从而影响接合子数量的。

图4 双酚A作用下,接合时间对接合转移的影响
(**P<0.01)
Fig. 4 Effect of treatment time on conjugative transfer
in the presence of BPA (**P<0.01)
2.3 双酚A对细菌氧化应激的影响
许多研究表明,ROS的产生会促进RP4、RK2等质粒的接合转接[12, 29],但是双酚A是否也是通过促使肠球菌产生ROS进而影响pCF10质粒的接合转移还未可知。本文研究了双酚A对粪肠球菌ROS产生的影响及ROS的产生对pCF10质粒接合转移的影响。研究结果表明,在作用4 h后双酚A虽然能够显著促进pCF10质粒接合转移,但在该时刻供、受体菌和接合体系细菌细胞中的ROS含量与对照组相比均无明显差异(图6(a),one-way ANOVA,P>0.05),说明双酚A促进pCF10接合转移过程并未影响细菌的ROS的产生。为了进一步确证双酚A对本接合转移体系中ROS产生的影响,我们将其作用时间延长至24 h,发现其作用下ROS水平与对照组比较有了明显的升高(图6(b)),但是我们使用ROS阳性对照Rosup处理接合细菌4 h后进行接合子计数(图6(c))后发现,Rosup处理组的接合子数量相较于对照组并无明显差异(约在5×105 CFU·mL-1)。这些结果表明,双酚A促进粪肠球菌中的耐药基因接合转移不是通过影响细菌产生氧化应激这一途径实现的。

图5 双酚A对接合转移过程中供体菌的影响(a)和双酚A对接合转移过程中受体菌的影响(b)
Fig. 5 Effect of BPA on donor bacteria during conjugative transfer (a) and effect of BPA on receptor
bacteria during conjugative transfer (b)

图6 双酚A对活性氧(ROS)水平及接合转移的影响
注:(a)接合4 h后受体菌、供体菌及接合体系中的ROS水平;(b)接合24 h后接合体系中的ROS水平;
(c)双酚A及ROS阳性对照Rosup对接合转移的影响;**P<0.01。
Fig. 6 Effect of BPA on reactive oxygen species (ROS) levels and conjugative transfer
Note: (a) ROS levels in recipient bacteria, donor bacteria, and conjugation after 4 h of conjugation initiation; (b) ROS levels in conjugation
after 24 h of conjugation initiation; (c) Effect of BPA and ROS control Rosup on conjugative transfer; **P<0.01.
2.4 双酚A对信息素编码基因表达和信息素生成的影响
pCF10系统中,ccfA基因编码正调控信息素cCF10[30],prgQ基因编码负调控信息素iCF10[26],2种信息素互为拮抗作用,更高效地调控接合转移过程。我们研究了双酚A对调控信息素编码基因ccfA和prgQ的mRNA表达的影响。在双酚A的作用下,ccfA基因的表达量由对照组的3.5×10-3 copies·(16S)-1升高至6×10-3 copies·(16S)-1,prgQ基因的表达量由对照组的1.5×10-2 copies·(16S)-1升高至2.5×10-2 copies·(16S)-1,均具有显著性差异(t-test, P<0.05)(图7)。我们进一步检测了接合体系上清液中信息素cCF10的含量,实验结果表明,在双酚A作用下,接合体系上清液中信息素浓度由0.33 ng·mL-1提高至0.84 ng·mL-1,升高了2倍左右(图8)。在双酚A作用下,翻译后水解形成成熟的信息素cCF10的浓度显著升高,这也与ccfA基因的转录水平显著提高相对应。双酚A通过调控生成信息素基因的mRNA表达,进而促进信息素的生成可能是双酚A促进pCF10质粒接合转移的重要机制。
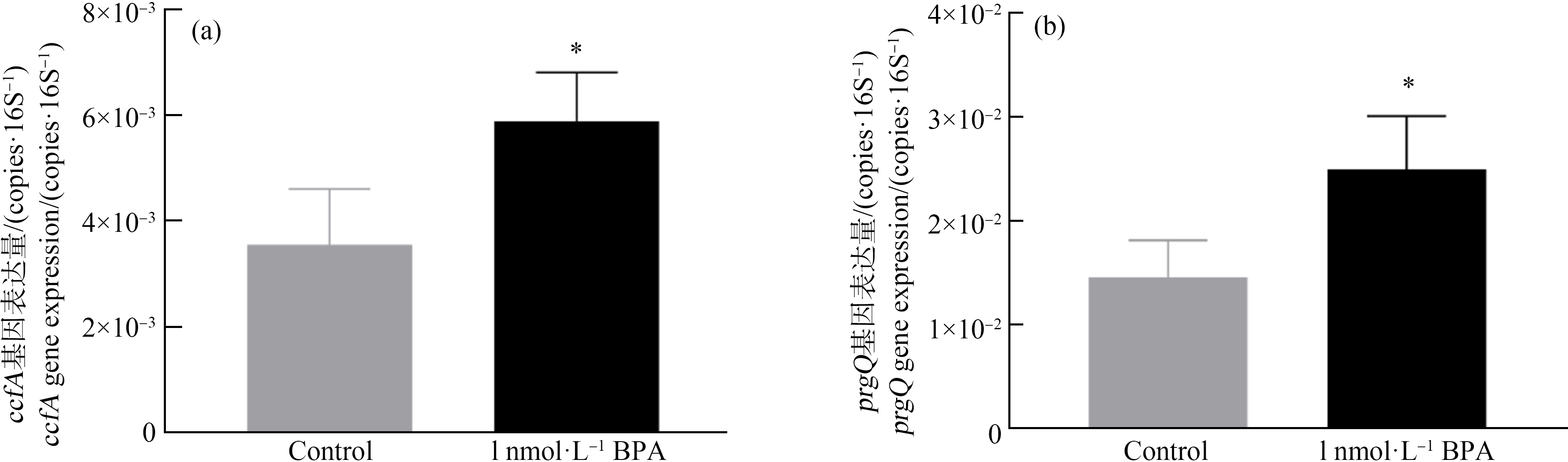
图7 双酚A对信息素编码基因表达的影响
注:*P<0.05。
Fig. 7 Effect of BPA on the expression of pheromone-encoded genes
Note: *P<0.05.
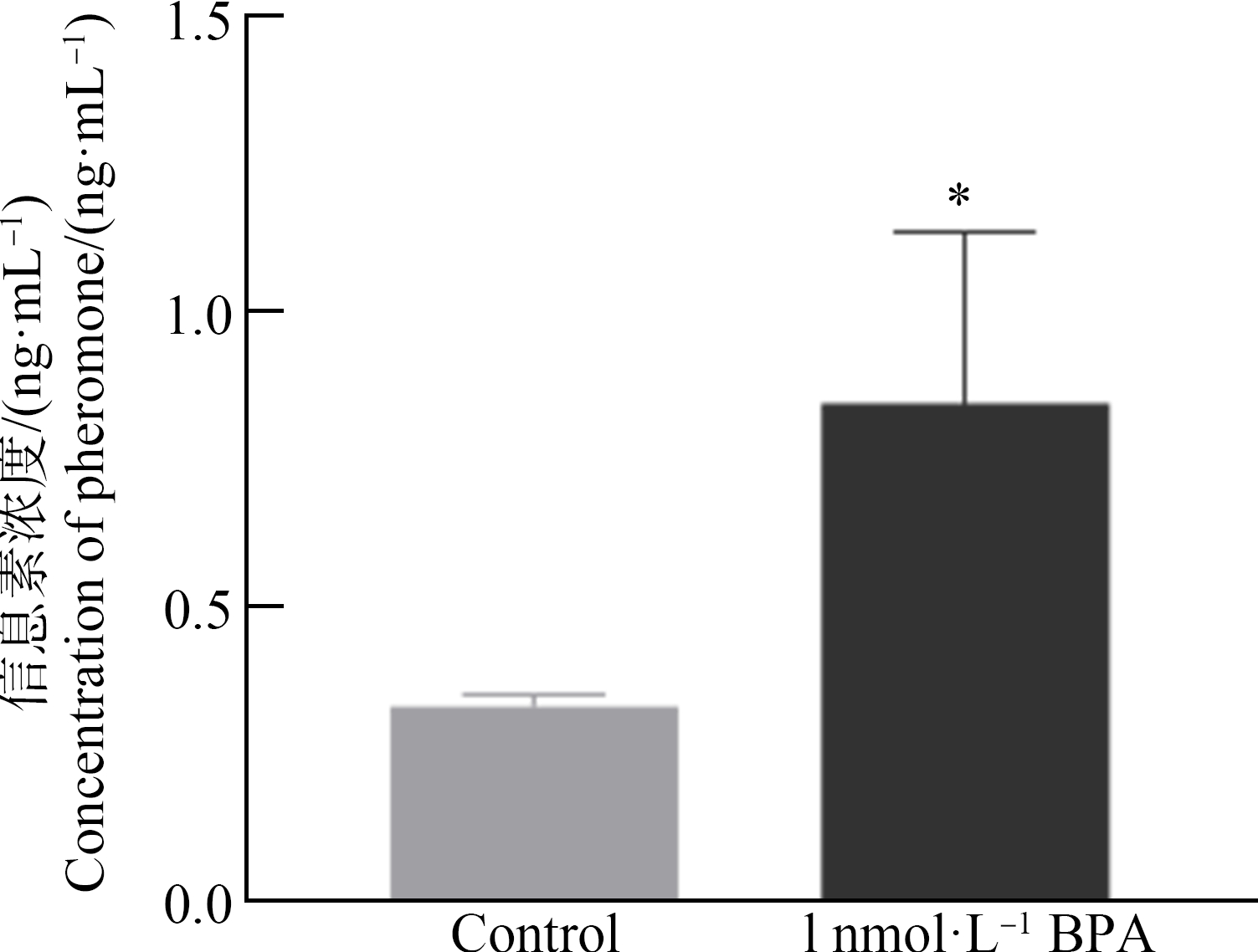
图8 双酚A作用下,接合体系上清液中信息素含量的变化
注:*P<0.05。
Fig. 8 Changes in the pheromone concentration in the
supernatant of the conjugative system under the effect of BPA
Note: *P<0.05.
3 讨论(Discussion)
内分泌干扰物双酚A在环境中的污染问题一直广受关注,其在自然水体中大量分布[31-32],对人体健康构成的严重威胁也不容小觑[21, 33-34]。尤其是双酚A对生殖健康的影响已有不少研究报道[35-36],但关于双酚A对耐药基因水平转移的影响和机制却鲜有报道。粪肠球菌不但具有较强的天然耐药性[37],且极易被诱导而发生高效的耐药基因水平转移[38]。本文揭示了耐药基因水平转移的新途径,同时也提示我们关注环境污染物的生物效应形式和机制,重新认识其在环境中的作用和行为,对生态安全领域具有重要意义。
双酚A对pCF10质粒介导的接合转移具有促进作用且与双酚A浓度相关(图2),即在一定浓度范围内具有促进作用。当双酚A浓度在1×10-2~1 nmol·L-1的范围内时,双酚A具有促进pCF10质粒接合转移的效应,且在1 nmol·L-1时促进效果最强。双酚A浓度影响细胞生理活动的研究不胜枚举,如双酚A影响精原细胞增殖时,剂量-效应曲线呈倒U型,当双酚A浓度超过特定范围时促进细胞增殖的效应显著下降[39]。有研究报道,一些微生物可以通过活跃的化学外排或化学降解抵抗因双酚A暴露浓度增加而升高的毒性[40]。在本研究中出现剂量-效应曲线为倒U型的现象推测是由于高浓度双酚A作用下,细菌的外排能力或降解能力已达到极限。过量的双酚A对细菌产生毒性,从而影响了细菌接合转移的能力。
细菌对抗生素的耐药性通常是通过可移动的遗传元件如接合质粒或接合转座子等获得的,使接合转移发生在病原菌或共生菌之间[41-42]。在pCF10质粒中,四环素抗性基因tetM存在于接合转座子Tn916中[43]。通过基因的水平转移,四环素抗性基因可以随转座子扩散到其他细菌中,使其也对抗生素产生耐药性。在双酚A作用下,由粪肠球菌组成的接合体系中耐药基因的相对丰度显著提升(图3),意味着双酚A能够使体系中含有耐药基因tetM的细菌与细菌总量的比例从8%提高到>1%。粪肠球菌作为广泛分布于人体肠道内,且易于在环境中存活的指示微生物,已被证明其存在与自然水体游泳者患胃肠疾病相关[44]。而每年全世界消费双酚A的体量也不容忽视,在自然水环境中,双酚A含量一般在1 ng·L-1~1 μg·L-1的范围内[21, 23, 45],与本研究中双酚A影响耐药基因转移的浓度范围基本重合。当粪肠球菌与双酚A在时间和空间上发生重叠,便极大地增加了耐药基因扩散的环境风险,对人类健康造成严重影响,也对生态安全构成了极大的威胁。
双酚A对pCF10质粒接合转移的促进作用与双酚A作用下的接合时间相关(图4)。在双酚A作用下,接合时间为4 h时,接合子数量达到最高点。当接合时间超过4 h后,接合子数量随时间的延长逐渐下降。多肽信息素属于革兰氏阳性菌的群体感应信号分子[46],胞外的信号分子随着培养时间的延长而累积,从而产生群感效应以调节细菌的群体行为[47]。接合子数量在达到接合终点后随时间推移而降低,我们分析该现象是由于群感效应中细胞自身的程序性自杀机制激活了细胞死亡,接合子数量逐渐回归初始水平。
细菌细胞中的ROS主要包括超氧阴离子自由基(O2·-)、·OH和H2O2[48]。当ROS含量超过自身可以承载的水平时就会引起细菌的氧化应激,从而损害细菌的各种生物大分子,例如核酸、脂质和蛋白质等[49]。目前有研究证明了细菌耐药性与ROS的产生存在一定相关性。研究者发现ROS可以造成细菌DNA的突变或筛选出抗氧化能力较强的菌株,进而增加耐药菌株产生的概率[50-51]。在细菌接合转移的相关研究中,也有很多研究者认为细菌产生氧化应激是其接合转移升高的原因之一[12, 14]。因细菌中ROS主要在细胞膜上产生,过量的ROS会对细胞膜蛋白造成影响,继而改变其通透性,使得质粒的转移增加[52-53]。大量实验证明,在RP4质粒介导的接合转移体系中,多种影响因素如纳米材料[12]、非营养性甜味剂[54]以及非阿片类止痛药[55]等都可以通过产生ROS,诱导细菌的氧化应激,从而促进质粒在革兰氏阴性细菌大肠杆菌中的接合转移。本研究中双酚A作用4 h时未引起粪肠球菌中ROS含量升高(图6(a)),可能是由于其作为革兰氏阳性细菌细胞壁较厚,双酚A刺激在在短时间内未能引起细菌细胞反应。也有实验证明双酚A作用24 h后可以刺激细胞中ROS的产生,引起氧化应激[56]。本文通过实验证明双酚A作用于接合体系24 h后可以引起细菌细胞内ROS含量的升高(图6(b)),但由于接合转移反应较为迅速,还未达到产生较强ROS的时刻,接合转移已经完成。接下来通过进一步实验证明,在产生大量ROS的Rosup作用下,接合转移并未发生显著提升(图6(c))。故得出结论双酚A促进粪肠球菌中的耐药基因接合转移不是通过影响细菌产生氧化应激这一途径实现的。
本研究主要从双酚A对信息素编码基因的mRNA表达和信息素的生成等方面初步探讨了双酚A影响pCF10介导的耐药基因接合转移的机制。粪肠球菌OG1RF中ccfA基因编码一种名为CcfA的脂蛋白前体,成熟的多肽信息素是由CcfA经蛋白水解加工而成的[8]。为了防止信息素造成的自体诱导,供体细菌分泌抑制肽iCF10作为cCF10的竞争性抑制剂。抑制肽iCF10由pCF10质粒上的prgQ基因编码。双酚A可以促进编码信息素cCF10的ccfA基因的表达(图7(a)),同时诱发了接合体系中的prgQ基因高表达。通过测定双酚A处理后接合体系上清液中信息素浓度显著升高(图8),进一步证明双酚A可以通过促进信息素编码基因ccfA表达,继而促进信息素的生成,最终促进接合转移的高频发生。
综上所述,本研究初步证实了自然水体环境浓度下的双酚A能够促进信息素调控质粒pCF10介导的耐药基因接合转移,并对双酚A影响pCF10质粒接合转移的机制进行了初步探讨。目前关于双酚A成为内分泌干扰物的研究已有一些进展,但多局限于临床领域。而双酚A作为环境雌激素类污染物在环境中的行为和影响抗生素抗性基因扩散的机制尚缺乏系统研究。本研究证明双酚A除对人类健康造成直接影响外,还会影响环境中耐药基因的丰度,使抗生素抗性基因扩散形势更为严峻。本研究将增强社会对环境雌激素污染物生物效应的认识和理解,填补双酚A这一传统环境污染物在生态安全领域的研究空缺。为人类与生态环境和谐共处提供理论基础,或将为实现对双酚A和抗生素抗性基因传播元件的监测和控制这一最终目标提供技术支持。本研究对双酚A影响耐药基因扩散的机制进行了初步的探索,但对于它的深层机制仍亟需进一步研究。信息素调控质粒介导的接合转移过程需要通过一个相对复杂的系统进行调控,如供、受体细菌间的粘附、质粒的切割、组装及跨膜转运等过程。双酚A是否对这些调控过程产生影响从而对质粒的接合转移造成影响,还有待于我们进一步研究。
通讯作者简介:邱志刚(1979—),男,博士,研究员,主要研究方向细菌耐药性的产生、发展与控制。
[1] World Health Organization (WHO). Antimicrobial resistance: Global report on surveillance [R]. Geneva: WHO, 2014
[2] Wallace M J, Fishbein S R S, Dantas G. Antimicrobial resistance in enteric bacteria: Current state and next-generation solutions [J]. Gut Microbes, 2020, 12(1): 1799654
[3] Smillie C, Garcillán-Barcia M P, Francia M V, et al. Mobility of plasmids [J]. Microbiology and Molecular Biology Reviews, 2010, 74(3): 434-452
[4] Hirt H, Schlievert P M, Dunny G M. In vivo induction of virulence and antibiotic resistance transfer in Enterococcus faecalis mediated by the sex pheromone-sensing system of pCF10 [J]. Infection and Immunity, 2002, 70(2): 716-723
[5] Sterling A J, Snelling W J, Naughton P J, et al. Competent but complex communication: The phenomena of pheromone-responsive plasmids [J]. PLoS Pathogens, 2020, 16(4): e1008310
[6] Waters C M, Bassler B L. Quorum sensing: Cell-to-cell communication in bacteria [J]. Annual Review of Cell and Developmental Biology, 2005, 21: 319-346
[7] Wardal E, Sadowy E, Hryniewicz W. Complex nature of enterococcal pheromone-responsive plasmids [J]. Polish Journal of Microbiology, 2010, 59(2): 79-87
[8] Antiporta M H, Dunny G M. ccfA, the genetic determinant for the cCF10 peptide pheromone in Enterococcus faecalis OG1RF [J]. Journal of Bacteriology, 2002, 184(4): 1155-1162
[9] Varahan S, Harms N, Gilmore M S, et al. An ABC transporter is required for secretion of peptide sex pheromones in Enterococcus faecalis [J]. mBio, 2014, 5(5): e01726-e01714
[10] Berglund B. Environmental dissemination of antibiotic resistance genes and correlation to anthropogenic contamination with antibiotics [J]. Infection Ecology & Epidemiology, 2015, 5(1): 28564
[11] Berendonk T U, Manaia C M, Merlin C, et al. Tackling antibiotic resistance: The environmental framework [J]. Nature Reviews Microbiology, 2015, 13(5): 310-317
[12] Qiu Z G, Yu Y M, Chen Z L, et al. Nanoalumina promotes the horizontal transfer of multiresistance genes mediated by plasmids across genera [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(13): 4944-4949
[13] Zhang Y, Gu A Z, He M, et al. Subinhibitory concentrations of disinfectants promote the horizontal transfer of multidrug resistance genes within and across genera [J]. Environmental Science & Technology, 2017, 51(1): 570-580
[14] Pu Q, Fan X T, Li H, et al. Cadmium enhances conjugative plasmid transfer to a fresh water microbial community [J]. Environmental Pollution, 2021, 268(Pt B): 115903
[15] Kundakovic M, Champagne F A. Epigenetic perspective on the developmental effects of bisphenol A [J]. Brain, Behavior, and Immunity, 2011, 25(6): 1084-1093
[16] Geens T, Goeyens L, Covaci A. Are potential sources for human exposure to bisphenol-A overlooked? [J]. International Journal of Hygiene and Environmental Health, 2011, 214(5): 339-347
[17] Chapin R E, Adams J, Boekelheide K, et al. NTP-CERHR expert panel report on the reproductive and developmental toxicity of bisphenol A [J]. Birth Defects Research Part B: Developmental and Reproductive Toxicology, 2008, 83(3): 157-395
[18] Clayton E M, Todd M, Dowd J B, et al. The impact of bisphenol A and triclosan on immune parameters in the US population, NHANES 2003-2006 [J]. Environmental Health Perspectives, 2011, 119(3): 390-396
[19] Richter C A, Birnbaum L S, Farabollini F, et al. In vivo effects of bisphenol A in laboratory rodent studies [J]. Reproductive Toxicology, 2007, 24(2): 199-224
[20] Sheng Z G, Zhu B Z. Low concentrations of bisphenol A induce mouse spermatogonial cell proliferation by G protein-coupled receptor 30 and estrogen receptor-Α [J]. Environmental Health Perspectives, 2011, 119(12): 1775-1780
[21] Huang Y Q, Wong C K, Zheng J S, et al. Bisphenol A (BPA) in China: A review of sources, environmental levels, and potential human health impacts [J]. Environment International, 2012, 42: 91-99
[22] Catenza C J, Farooq A, Shubear N S, et al. A targeted review on fate, occurrence, risk and health implications of bisphenol analogues [J]. Chemosphere, 2021, 268: 129273
[23] Yamazaki E, Yamashita N, Taniyasu S, et al. Bisphenol A and other bisphenol analogues including BPS and BPF in surface water samples from Japan, China, Korea and India [J]. Ecotoxicology and Environmental Safety, 2015, 122: 565-572
[24] Prossnitz E R, Barton M. Estrogen biology: New insights into GPER function and clinical opportunities [J]. Molecular and Cellular Endocrinology, 2014, 389(1-2): 71-83
[25] Christie P J, Dunny G M. Identification of regions of the Streptococcus faecalis plasmid pCF-10 that encode antibiotic resistance and pheromone response functions [J]. Plasmid, 1986, 15(3): 230-241
[26] Nakayama J, Ruhfel R E, Dunny G M, et al. The prgQ gene of the Enterococcus faecalis tetracycline resistance plasmid pCF10 encodes a peptide inhibitor, iCF10 [J]. Journal of Bacteriology, 1994, 176(23): 7405-7408
[27] Flannagan S E, Zitzow L A, Su Y A, et al. Nucleotide sequence of the 18-kb conjugative transposon Tn916 from Enterococcus faecalis [J]. Plasmid, 1994, 32(3): 350-354
[28] Suzuki M T, Taylor L T, DeLong E F. Quantitative analysis of small-subunit rRNA genes in mixed microbial populations via 5’-nuclease assays [J]. Applied and Environmental Microbiology, 2000, 66(11): 4605-4614
[29] Jiang Q, Feng M B, Ye C S, et al. Effects and relevant mechanisms of non-antibiotic factors on the horizontal transfer of antibiotic resistance genes in water environments: A review [J]. The Science of the Total Environment, 2022, 806(Pt 3): 150568
[30] Dunny G M, Craig R A, Carron R L, et al. Plasmid transfer in Streptococcus faecalis: Production of multiple sex pheromones by recipients [J]. Plasmid, 1979, 2(3): 454-465
[31] Zhang H F, Zhang Y P, Li J B, et al. Occurrence and exposure assessment of bisphenol analogues in source water and drinking water in China [J]. The Science of the Total Environment, 2019, 655: 607-613
[32] Yan Z Y, Liu Y H, Yan K, et al. Bisphenol analogues in surface water and sediment from the shallow Chinese freshwater lakes: Occurrence, distribution, source apportionment, and ecological and human health risk [J]. Chemosphere, 2017, 184: 318-328
[33] Moreman J, Lee O, Trznadel M, et al. Acute toxicity, teratogenic, and estrogenic effects of bisphenol A and its alternative replacements bisphenol S, bisphenol F, and bisphenol AF in zebrafish embryo-larvae [J]. Environmental Science & Technology, 2017, 51(21): 12796-12805
[34] 任文娟, 汪贞, 王蕾, 等. 双酚A及其类似物对斑马鱼胚胎及幼鱼的毒性效应[J]. 生态毒理学报, 2017, 12(1): 184-192
Ren W J, Wang Z, Wang L, et al. Effects of bisphenol A and its analogues on zebrafish embryos and larvae [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 184-192 (in Chinese)
[35] Fan H J, Fernando S R, Jiang L H, et al. Bisphenol A analogues suppress spheroid attachment on human endometrial epithelial cells through modulation of steroid hormone receptors signaling pathway [J]. Cells, 2021, 10(11): 2882
[36] Desdoits-Lethimonier C, Lesné L, Gaudriault P, et al. Parallel assessment of the effects of bisphenol A and several of its analogs on the adult human testis [J]. Human Reproduction, 2017, 32(7): 1465-1473
[37] Alipour M, Hajiesmaili R, Talebjannat M, et al. Identification and antimicrobial resistance of Enterococcus spp. isolated from the river and coastal waters in northern Iran [J]. The Scientific World Journal, 2014, 2014: 287458
[38] Hirt H, Greenwood-Quaintance K E, Karau M J, et al. Enterococcus faecalis sex pheromone cCF10 enhances conjugative plasmid transfer in vivo [J]. mBio, 2018, 9(1): e00037-e00018
[39] Bouskine A, Nebout M, Brücker-Davis F, et al. Low doses of bisphenol A promote human seminoma cell proliferation by activating PKA and PKG via a membrane G-protein-coupled estrogen receptor [J]. Environmental Health Perspectives, 2009, 117(7): 1053-1058
[40] Catron T R, Keely S P, Brinkman N E, et al. Host developmental toxicity of BPA and BPA alternatives is inversely related to microbiota disruption in zebrafish [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2019, 167(2): 468-483
[41] Jasni A S, Mullany P, Hussain H, et al. Demonstration of conjugative transposon (Tn5397)-mediated horizontal gene transfer between Clostridium difficile and Enterococcus faecalis [J]. Antimicrobial Agents and Chemotherapy, 2010, 54(11): 4924-4926
[42] Weigel L M, Clewell D B, Gill S R, et al. Genetic analysis of a high-level vancomycin-resistant isolate of Staphylococcus aureus [J]. Science, 2003, 302(5650): 1569-1571
[43] Christie P J, Korman R Z, Zahler S A, et al. Two conjugation systems associated with Streptococcus faecalis plasmid pCF10: Identification of a conjugative transposon that transfers between S. faecalis and Bacillus subtilis [J]. Journal of Bacteriology, 1987, 169(6): 2529-2536
[44] Prüss A. Review of epidemiological studies on health effects from exposure to recreational water [J]. International Journal of Epidemiology, 1998, 27(1): 1-9
[45] Kang J H, Asai D, Katayama Y. Bisphenol A in the aquatic environment and its endocrine-disruptive effects on aquatic organisms [J]. Critical Reviews in Toxicology, 2007, 37(7): 607-625
[46] Kleerebezem M, Quadri L E N, Kuipers O P, et al. Quorum sensing by peptide pheromones and two-component signal-transduction systems in Gram-positive bacteria [J]. Molecular Microbiology, 1997, 24(5): 895-904
[47] Nasser W, Reverchon S. New insights into the regulatory mechanisms of the LuxR family of quorum sensing regulators [J]. Analytical and Bioanalytical Chemistry, 2007, 387(2): 381-390
[48] 马丽娜, 米宏霏, 薛云新, 等. ROS在细菌耐药及抗生素杀菌中的作用机制[J]. 遗传, 2016, 38(10): 902-909
Ma L N, Mi H F, Xue Y X, et al. The mechanism of ROS regulation of antibiotic resistance and antimicrobial lethality [J]. Hereditas, 2016, 38(10): 902-909 (in Chinese)
[49] 刘武康, 吴淑燕, 陈国薇, 等. 细菌产生的活性氧及其功能[J]. 微生物学杂志, 2016, 36(1): 89-95
Liu W K, Wu S Y, Chen G W, et al. The reactive oxygen species generated by bacteria and its functions [J]. Journal of Microbiology, 2016, 36(1): 89-95 (in Chinese)
[50] Boles B R, Singh P K. Endogenous oxidative stress produces diversity and adaptability in biofilm communities [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(34): 12503-12508
[51] Aiassa V, Barnes A I, Albesa I. Resistance to ciprofloxacin by enhancement of antioxidant defenses in biofilm and planktonic Proteus mirabilis [J]. Biochemical and Biophysical Research Communications, 2010, 393(1): 84-88
[52] van Acker H, Coenye T. The role of reactive oxygen species in antibiotic-mediated killing of bacteria [J]. Trends in Microbiology, 2017, 25(6): 456-466
[53] Cabiscol E, Tamarit J, Ros J. Oxidative stress in bacteria and protein damage by reactive oxygen species [J]. International Microbiology, 2000, 3(1): 3-8
[54] Yu Z G, Wang Y, Lu J, et al. Nonnutritive sweeteners can promote the dissemination of antibiotic resistance through conjugative gene transfer [J]. The ISME Journal, 2021, 15(7): 2117-2130
[55] Jia Y Q, Wang Z Q, Fang D, et al. Acetaminophen promotes horizontal transfer of plasmid-borne multiple antibiotic resistance genes [J]. Science of the Total Environment, 2021, 782: 146916
[56] Huang M Q, Liu S, Fu L, et al. Bisphenol A and its analogues bisphenol S, bisphenol F and bisphenol AF induce oxidative stress and biomacromolecular damage in human granulosa KGN cells [J]. Chemosphere, 2020, 253: 126707