-
新型溴代阻燃剂四溴双酚S(tetrabromobisphenol S, TBBPS) 具有与四溴双酚A(tetrabromobisphenol A, TBBPA)相似的化学结构,因此也具有类似的理化性质,其含有的砜基可能会降低其毒性,具有良好的耐热、耐光、耐氧化等优越性能,目前已逐渐成为TBBPA的替代品,在电子产品、塑料制品、家具建材等不同领域被广泛添加[1 − 4]. TBBPS在其生产和应用过程中不可避免地会释放到环境中,环境安全和人类健康因此可能会受到威胁. 目前已在水体、大气、土壤和生物体等不同介质中检出[5 − 6] TBBPS及其衍生物. 土壤是地球上有机污染物的主要“汇”聚地之一[7]. 目前TBBPS及衍生物、代谢物已经被在世界范围内多地的表层土壤中检出,如在中国某化工业园区土壤样品中检测出多种TBBPS及衍生物且最高含量达12.9 ng·g−1 dw[8]. 在日本一个海湾的河流淤泥中检测到了TBBPS及其衍生物,含量范围高达22—140 μg·kg−1 [9]. 已有的研究表明,环境中TBBPS可以通过营养级的传递富集到生物体中[10 − 11],对生态和人体健康产生潜在威胁. 因此,TBBPS及其衍生物成为具有潜在生物富集能力和环境危害的一类污染物.
土壤是植物赖以生存的基础,植物作为生态系统的初级生产者,在陆地生态系统物质和能量流动循环中扮演重要角色,是污染物进入陆生食物网的第一步. 首先,TBBPS及其衍生物属于卤代阻燃剂中的一类物质,卤代阻燃剂的亲脂性和在水体中的溶解度决定着植物对其吸收能力和转运能力,土壤环境中的卤代阻燃剂释放到土壤溶液中,植物根部在吸收土壤水分时会将其转移并吸附到根系表皮上,通过被动吸收过程进入植物体[12]. 已有研究检测发现,市场上售卖的萝卜植株体内存在溴代阻燃剂TBBPA,表明土壤中的溴代阻燃剂容易被植物体吸收[13]. 进入植物体根部的卤代阻燃剂,可与植物根部的脂质结合固定在植物根部,也可通过质外体或者共质体途径进入植物根部的内部组织,在植物蒸腾拉力的作用下转运至植物的地上部分[14]. White等[15]研究发现,一些南瓜品种能够将卤代有机化合物从根部转运到茎叶部分,证实了卤代有机化合物能够被植物从地下部分转运到地上部分. 对于植物体吸收富集卤代有机污染物的量来说,不仅与卤代有机污染物的性质有关,而且与植物体内脂质含量有关[12],如大麦根系从土壤中吸收有机污染物的量与污染物的正辛醇-水分配系数(Kow)值和根系中脂肪含量呈显著正相关[16]. 也有研究者指出,由于卤代有机化合物在植物体内会存在挥发、降解、植物代谢等耗散作用,因而卤代有机化合物可能在植物体内发生生物转化过程,并产生代谢物[17]. 有研究发现通过高分辨质谱在胡萝卜细胞萃取液中检测到并鉴定出2,4-DBP的8种代谢产物,说明溴代阻燃剂可在植物体内易发生生物代谢[18]. 同时,有研究证明,植物体内的过氧化物酶对卤代阻燃剂的代谢转化起重要的作用[19]. 作为一种溴代阻燃剂,TBBPS及其衍生物因其具有较高的生物累积性,也可能被环境中的植物吸收富集,进而通过食物链传递、累积到更高的营养级生物,给环境和生物健康带来风险. 因此研究TBBPS及其衍生物在土壤-植物系统内的吸收、富集和代谢转化行为对评估其生态风险至关重要.
TBBPS及其衍生物主要被添加于塑料制品中,且随着产品的使用和处置会释放到环境中,因此塑料制品常年堆放的土壤可能成为TBBPS及其衍生物的汇集场所. 本论文以TBBPS及其衍生物为研究对象,采集某塑料垃圾堆放地表层污染土壤,选用油菜和大豆为模式植物,进行室内盆栽种植培养实验. 研究不同植物对污染物的动力学吸收富集过程,揭示TBBPS及其衍生物在不同植物体内的吸收、富集特征和迁移转化规律,并在对代谢产物初步定性及定量分析的基础上,推测其在植物体内可能的代谢转化过程. 研究结果为评估TBBPS在植物以及人体通过食用植物摄入污染物的暴露量提供基础数据,为TBBPS及其衍生物的安全性评价提供科学数据.
-
大豆种子(中黄37)、油菜种子(京冠一号),购置于内蒙古自治区农牧业科学院. 实验用土壤采集于呼和浩特市周边某塑料垃圾处理(堆放)厂污染土壤,取0—20 cm表层土,去除腐叶和杂质,经风干、磨碎、过2 mm孔径筛. 测定土壤基本理化性质和污染物含量(表1)
-
标准样品四溴双酚S(TBBPS,纯度>98.8%),TBBPS-BDBPE(纯度>96.2%),TBBPA(纯度>99.0%),BPS(纯度>98.5%),TBBPS-BME(纯度>98.9%),2-BPM(纯度>97.2%),4-BPM(纯度>96.7%)均购于上海百灵威科技有限公司. 标准品TBBPS-MAE(纯度>99%)购于青岛金杰毅生物科技有限公司.
-
实验采用室内盆栽培养. 选发育整齐一致且饱满的大豆和油菜种子,用10%的双氧水溶液消毒20 min后,蒸馏水冲洗3—5次,将种子置于培养皿中的湿润滤纸上,在生化培养箱中进行暗培养. 将处理好的污染土壤装入直径24 cm,高18 cm塑料花盆中,每盆1.5 kg土,加去离子水保证其含水量为田间持水量的60%. 待种子种皮破裂,出现绿色小芽时,移栽入盆中,每盆10株,每组5个平行. 然后在种子上再覆盖50 g风干的土壤. 同时设置盆内只装污染土壤不种植植物处理为实验对照组. 将所有花盆转入人工气候室培养,控制室内温度20—25 ℃,光暗比12 h/12 h,湿度60%—70%. 保持各处理水分条件一致,定期移动花盆位置,采用称重法每隔3 d补充水分至土壤田间持水量的60%—70%. 分别在种植3 d、7 d、15 d、25 d、40 d后收获植物,同时采集植物根际土壤.
-
土壤样品去除腐叶、石块等杂质,用去离子水充分冲洗植物样品粘附的泥土等污物2-3次,沥干水分,放入冻干机干-50 ℃下冻干,然后将土壤、植物样品粉碎过80目筛,−50℃下密封冷藏保存. 样品采用快速溶剂萃取仪(瑞士,步琦 E 914)进行萃取,分别准确称取土壤样品5 g、植物地下部分(根系)3 g、植物地上部分(茎+叶)3 g于萃取柱,同时加入内标物质TBBPA,然后加入正己烷/二氯甲烷(1:1,V:V)混合液40 mL(提取条件:温度100 ℃;压力100 bar;加热时间5 min;萃取时间14 min;吹扫时间1 min;循环2次),收集洗脱液,进一步净化.
合并提取液于35 ℃旋转蒸发至大约5 mL. 提取液经复合硅胶柱净化,复合硅胶柱内径为10 mm,从下到上分别填充3%活化硅胶6 g 、 2%活化中性氧化铝4 g、无水硫酸钠5 g. 用50 mL正己烷预淋洗柱子,转移浓缩后的提取液于净化柱中,分别用10 mL、20 mL、20 mL的正乙烷/二氯甲烷(4:1,V:V)混合液对柱子进行洗脱,收集洗脱液. 再于35 ℃旋转蒸发至大约5 mL,氮吹至干[20],转溶于甲醇中,定容至0.5 mL,然后过0.22 µm的有机滤膜于棕色样品瓶中,存于-20 ℃冰箱中待测. 经超高效液相色谱-三重四极杆质谱联用仪(HPLC-MS-MS,美国,TSQ Quantum Access MAX)分析测定.
-
色谱条件:液相色谱柱为ZORBAXODS column(150 mm×3.0 mm, 5 μm particle size, Hypersil),流动相为乙腈/醋酸铵水(1 mmol·L−1). 柱温40 ℃;样品室温度10 ℃;进样体积为10 μL,液相洗脱选择乙腈(A)、醋酸铵水(1 mmol·L−1,D)、甲酸水(V/V 0.02%,B)作为流动相,醋酸铵水用于缓冲作用,甲酸水在整个流动相中的比例为0.004%,用于液相色谱柱的平衡;流速0.8 mL·min−1;总的测定时间13 min.
质谱条件:离子源为ESI源,负电离模式. 对待测物母离子的优化是在全扫m/z 50到
1000 的范围内,扫描时间为1 s,扫描延迟时间为0.1 s的条件下. 子离子以Ar作为二级碰撞气体,气流为0.25 mL·min−1,逐个优化子离子的碰撞能量. 最终优化后的条件为;毛细管电压2.5 kV;离子源温度110 ℃;溶解温度450 ℃;辅助气气压10 bar;雾化气压30 bar;驻留时间0.3 s. -
本实验在对样品中目标物质进行提取时全部使用玻璃仪器并在使用后用二氯甲烷超声清洗30 min,再放入马弗炉中400 ℃下烘烤4 h备用. 每组样品设置4个平行,以确保相对标准偏差低于20%[13],保证回收率,回收率样品的检测与实际样品的分析过程一致. 目标化合物的回收率保持在75%—110%之间. 仪器检出限(IDLs)和仪器定量限(IQLs)通过3/1和10/1信噪比(S/N)来确定. 方法检出限和方法定量限使用空白大豆植物样品及不种植植物土壤品,在1—5倍的IDLs和IQLs的浓度水平上进行加标重复测定(n=8)得到的. IDLs、IQLs、回收率见表2. 实验设置不种植植物为空白对照组,其它条件不变,定期移动盆栽位置,以便于排除实验组中非测试因素对实验结果的干扰.
-
实验数据采用Microsoft Excel 2020和Origin 2021 software (OriginLab Corporation) 分析、整理和作图.
富集因子计算: RCF=C根/C土. 其中,RCF为根富集因子,C根为根(干重)中污染物浓度,C土为土壤(干重)中污染物的浓度.
传输因子计算: TF=C地上部/C根. 其中,TF为植物传输因子,C根为根(干重)中污染物的浓度,C地上部为茎和叶(干重)中污染物的浓度.
-
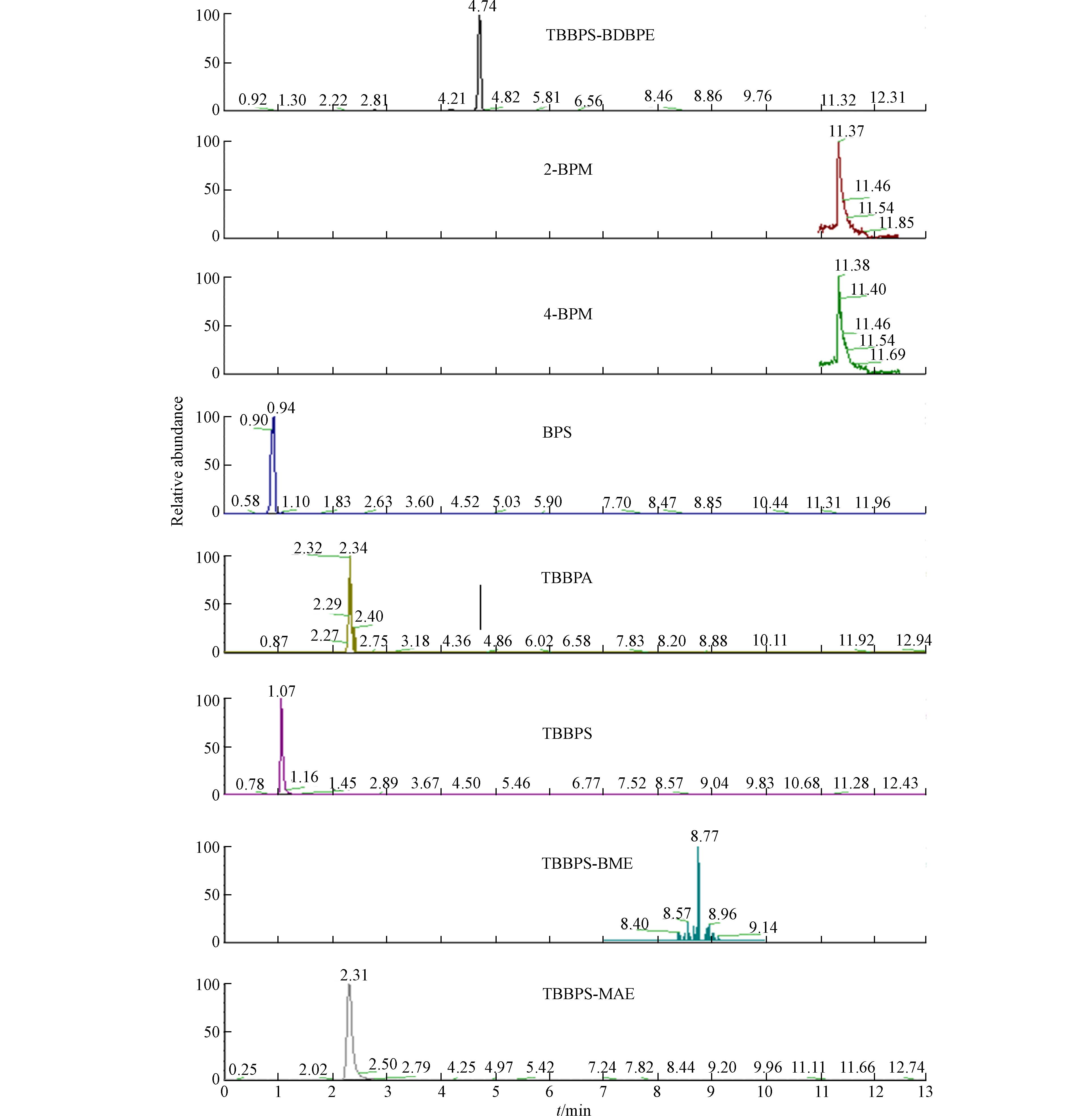
目前已有的TBBPS及其衍生物的检测方法具有一定的局限性,有报道表明,利用气相色谱质谱(GC-MS)进行TBBPS及其衍生物分析时,由于此类化合物的热稳定性差,很难获得好的分子离子峰;而高效液相色谱-二极管阵列(HPLC-DAD)检测法则易受基质干扰,不适用于痕量物质的分析[12,21]. 高效液相色谱串联质谱(UPLC-MS/MS)能有效减小植物样品在分析过程中植物色素产生的影响以及过程繁琐的衍生化过程带来的基质效应. UPLC-MS/MS是近几年测定有机污染物的新方法,结合色谱的高分离性能及质谱的高灵敏度特性,有较高的检测灵敏度[22],能实现多种有机污染物的同时检测. 本实验建立了一种基于快速溶剂萃取-UPLC-MS/MS检测的植物中TBBPS及其衍生物的分析方法. 使用ZORBAXODS column色谱柱,流动相为乙腈/醋酸铵水,优化洗脱程序后,得到液相洗脱条件为: 0—1 min:70/30的乙腈(A)/醋酸铵水(1 mmol·L−1,D);1—2.5 min:增加到90% A;2.5—3 min:90/20的A/D;3—3.5 min:增加到100%的A;3.5—6.5 min:100%A;6.5—13 min:降低为80/20 A/甲酸水(V/V 0.02%,B),实现了土壤及植物中TBBPS及其衍生物等6种化合物在13 min内完全分离,本方法不仅可用于同时分析和检测植物中6种TBBPS及其衍生物物质(TBBPS-MAE、TBBPS-BDBPE、TBBPS-BME、BPS、2-BPM、4-BPM),也大大提高所获得的分析数据的质量,定量限在0.08—21.98 pg·g−1 dw之间,目标化合物的回收率保持在75%—110%之间,标准曲线R2均在0.99以上,提高了实验效率,简化了实验过程,减少了有机溶剂的体积. 图1为TBBPS及其衍生物、代谢物标准物质的质谱图. 实验结果表明,在ESI-MS/MS负电离模式下,仪器对TBBPS及其衍生物检测的灵敏度较高. 通过信号强度选择合适的母离子和子离子,经过优化鞘气气压和辅助气压等仪器分析条件选择出信号强度最高的子离子当作定量离子,挑选丰度较高的子离子m/z 564.516、m/z 604.521、m/z 764.319、m/z 540.632、m/z 248.915、m/z 592.573、m/z 232.879、m/z 232.855作为TBBPS、TBBPS-MAE、TBBPS-BDBPE、TBBPA、BPS、TBBPS-BME、2-BPM、4-BPM的定性离子,表3列出了在ESI负电离模式下几种化合物质谱分析的最终优化参数.
-
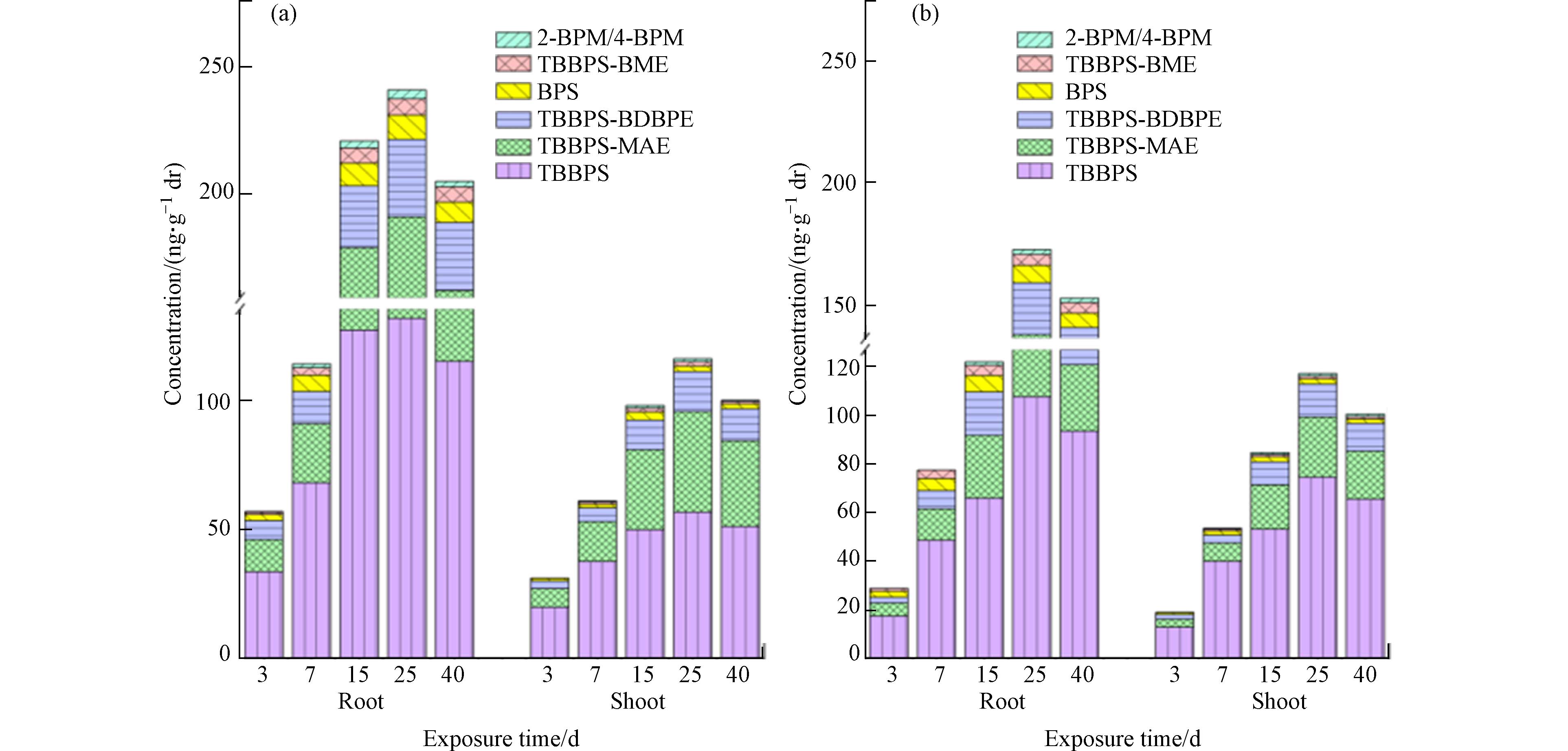
由图2a可知,大豆对TBBPS、TBBPS-MAE、TBBPS-BDBPE等化合物的吸收富集量随着暴露时间呈先增高后降低的趋势,并且在第25天时各化合物的富集量达到最高值. 不同化合物在大豆体内的累积量表现为TBBPS>TBBPS-MAE>TBBPS-BDBPE>BPS>TBBPS-BME>2-BPM/4-BPM,其中大豆对TBBPS累积量最多,在第25天时为188.06 ng·g−1 干重. 而TBBPS及其衍生物、代谢物在植物组织中的分布主要由其自身的性质所决定的,由于其具有与有机化合物相似的理化性质,容易富集在脂质含量较高的地方,脂质含量较高的植物根系吸收有机污染物的能力就会增加. 本实验中,TBBPS、TBBPS-MAE、TBBPS-BDBPE等化合物在大豆植物体根部的富集量,在暴露初始阶段快速增加,地下富集量明显高于地上部分,随暴露时间的增加,地下部分中的富集量占植株总富集量的60%—96%. 表明TBBPS及其衍生物易富集在脂质含量更高的大豆植物体根部,这与相关研究结果类似[16]. 而在25 d后植物体中TBBPS及其衍生物的吸收富集量随暴露时间增加而降低,这可能归结于污染物在植物细胞内发生代谢作用和植物生长稀释作用.
相比于大豆,油菜(图2b)对TBBPS及其衍生物等化合物的吸收富集的量低于大豆;且TBBPS、TBBPS-MAE、TBBPS-BDBPE等化合物在油菜体内的累积特征也与在大豆体内相似,对母体化合物TBBPS的累积量在第25天时达到最大值182.17 ng·g−1干重. 但与大豆不同的是,大豆吸收、富集TBBPS、TBBPS-MAE、TBBPS-BDBPE主要集中在7—15 d,油菜集中在15—25 d,表明TBBPS及其衍生物在不同植物体内吸收富集特征不同. 油菜地下部分与地上部分吸收富集TBBPS、TBBPS-MAE的量相差较小,地下部分中的富集量占植株总富集量的55%—65%,间接说明油菜地上部分对其吸收、富集的量与地下部分相当. 而对TBBPS-BDBPE吸收、富集的量相差较大,地下部分中的富集量占植株总富集量的在60%—70%之间,说明油菜地下部分对TBBPS-BDBPE的吸收、富集的量明显高于地上部分. TBBPS及其衍生物在大豆、油菜体内分布存在差异,可能是由于油菜根比表面积小于大豆,且油菜根系脂质含量低于大豆,吸收富集能力相对较弱,这点通过根富集因子(RCF)评价得到证实,因此油菜吸收富集这类物质不仅速率慢而且总量较少,而大豆对TBBPS及其衍生物等化合物具有更强的富集能力.
为进一步研究植物对TBBPS及其衍生物的吸收富集能力,分别计算了化合物在不同植物体内的根富集因子(root concentration factor,RCF)和传输因子(transport factor,TF)(表4). 本实验根据化合物在根中的浓度(nmol·g−1)与在污染土壤中的浓度(nmol·g−1)之比计算了不同化合物的根富集因子. 实验结果发现,大豆对不同化合物的富集趋势都呈先增高后降低,在第25天时RCF达到最大值,大豆对TBBPS-BME的RCF最高,达4.638. 而油菜与大豆吸收、富集趋势类似,RCF最大的是BPS,为4.440. 大豆对不同化合物的RCF的大小顺序是:TBBPS-BME > BPS > TBBPS > TBBPS-MAE > TBBPS-BDBPE > 2-BPM/4-BPM,油菜对不同化合物的RCF的大小顺序是BPS > TBBPS-BME > TBBPS > TBBPS-MAE > TBBPS-BDBPE > 2-BPM/4-BPM,说明大豆、油菜对TBBPS及其衍生物、代谢物的富集能力存在差异,而代谢物BPS、TBBPS-BME的RCF较TBBPS及其他衍生物高,表明代谢物更易被植物体吸收富集,可能给生物及生态健康造成更大的危害.
传输因子代表了污染物从植物根系向植物地上部分转移的能力[23]. 实验发现TBBPS及其衍生物、代谢物在大豆、油菜的地上部分被检出,说明化合物被根吸收后均可以在大豆、油菜体内发生自下而上的茎向传输. 本实验中,TBBPS及其衍生物、代谢物在大豆、油菜的传输因子均小于1,表明TBBPS及其衍生物、代谢物均较难从地下部分向地上部分转运,这也与樊芸等在玉米、花生体内HOCs的浓度特征研究结果相同[24]. 而研究结果显示,相较于大豆,TBBPS及其衍生物、代谢物在油菜中的TF值更大,说明在油菜对TBBPS及其衍生物、代谢物的转运能力较大豆强,这可能受植物的蒸腾作用及生长稀释作用等影响[25]. 其中在大豆体内,对TBBPS-MAE的TF最高,最高值为0.692,说明TBBPS-MAE易从大豆地下部分转运到地上,可推出大豆对TBBPS-MAE的转运能力最强. 而在油菜体内,对TBBPS的TF值最大,最高值为0.821,说明油菜对TBBPS的转运能力最强. 而就不同化合物而言,TBBPS、TBBPS-MAE、TBBPS-BDBPE、BPS、TBBPS-BME、2-BPM、4-BPM在大豆、油菜体内的TF值均<1,这表明TBBPS及其衍生物、代谢物均较难从植物地下部分向地上部分转运. 其中大豆体内不同化合物的TF值大小顺序为TBBPS-MAE > TBBPS > TBBPS-BDBPE > TBBPS-BME > BPS > 2-BPM/4-BPM,油菜体内不同化合物的TF值大小顺序为TBBPS > TBBPS-MAE > TBBPS-BDBPE > 2-BPM/4-BPM > BPS > TBBPS-BME,对比发现大豆、油菜植物体对TBBPS及其衍生物的转运量大于代谢物,表明TBBPS及其衍生物的代谢转化主要发生在植物地下部分,且代谢物较TBBPS及其衍生物更难向地上部分转运.
早期有研究发现[26],疏水性有机污染物(lgKow>3.0)易被根部吸附,不易迁移至茎叶(地上部分),亲水性较强的污染物也不易实现径向传输,而中等亲水性污染物则容易实现污染物的径向传输. 因此,随着lgKow的增大,其径向传输能力呈现出先增大后减小的分布. 俞帅等研究胡萝卜对溴酚类化合物的吸收实验中其径向传输能力也表现为先增大后减小[13],这与本研究一致.
以上研究结果表明环境中的TBBPS及其衍生物、代谢物能快速地被植物体吸收并向植物地上部分运输,导致其易通过植物随食物链传递,危害更高营养级生物,值得引起人们的关注.
-
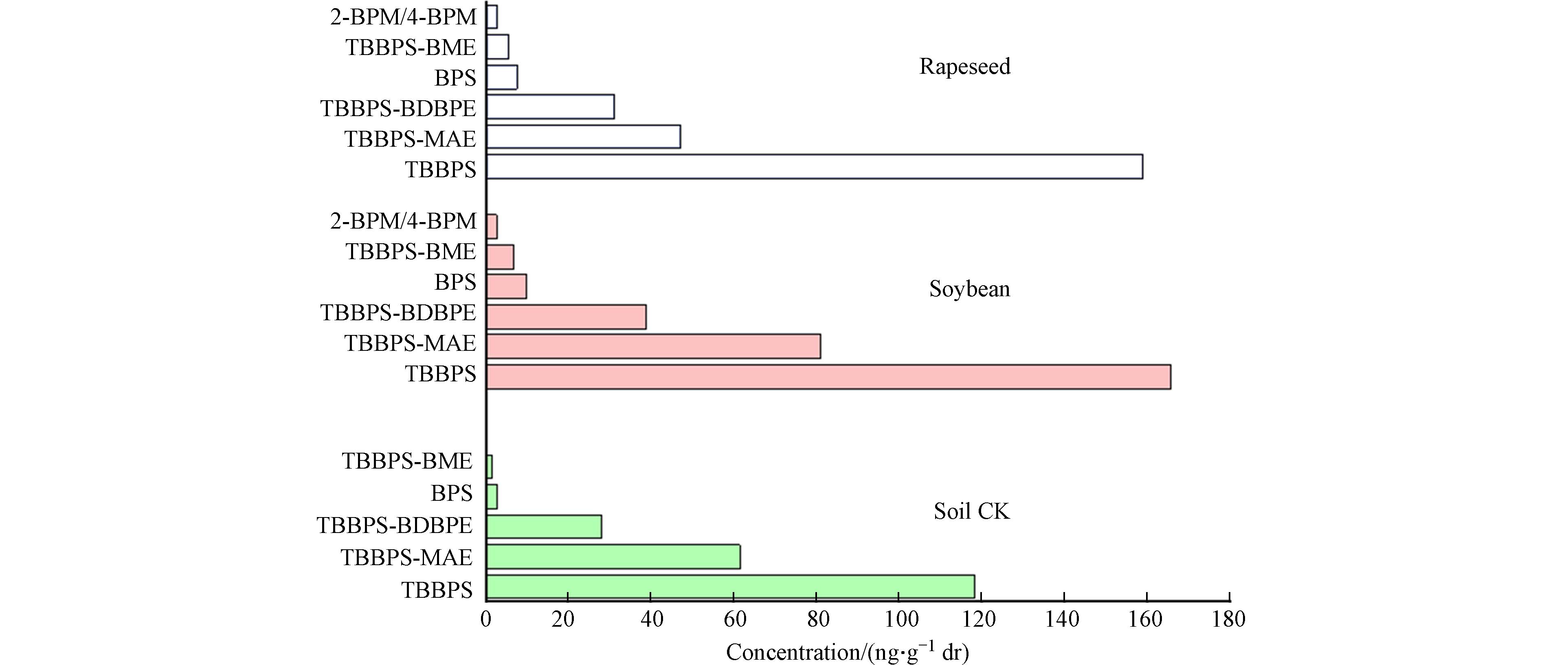
在植物体内,溴代有机物分子受到激活,会发生一系列化学反应,一项针对胡萝卜的研究表明,糖基转移酶参与了胡萝卜植株体内的代谢反应,其活性与溴酚呲喃葡萄糖苷的生成呈正相关[18],说明溴代有机物易在植物体内发生生物转化. 观察发现,与无植物种植土壤(土壤CK)相比,种植植物实验组在大豆、油菜植物体内除检测出与其相同代谢物TBBPS-BME、BPS外,还检测到2-BPM、4-BPM两种物质产生(图3),这些物质在油菜、大豆体内的含量均呈先增加后降低的趋势,并在第25天时达到最大值.
说明2-BPM、4-BPM这两种物质主要在植物体内代谢产生,同时说明TBBPS及其衍生物易在植物体内发生生物转化产生新的代谢物. 而在不同植物体内,TBBPS及其衍生物的生物转化的程度不同,大豆体内TBBPS-BME、BPS产生量是在土壤中的4.3倍和3.4倍,TBBPS-MAE、TBBPS-BDBPE的含量略有增加;油菜体内TBBPS-BME、BPS产生量约是在土壤中的3.4倍和2.6倍,同时,相比之下,大豆对TBBPS及其衍生物的代谢产物量明显高于油菜,说明油菜对TBBPS及其衍生物的生物转化能力低于大豆. 这与PCB-52在杨树、柳枝稷植物体内的主要降解产物不同的实验结果类似[27]. 由于本实验中在植物体中检测到的原土中没有的新物质只有2-BPM和4-BPM,其他的化合物在原土中有相当的浓度,因此无法解释植物体中TBBPS、TBBPS-MAE、TBBPS-BDBPE和BPS是否有化合物代谢转化的贡献及其在植物体内代谢路径是什么,这需要通过实验来进一步验证.
-
通过对TBBPS及其衍生物在土壤-植物系统的吸收富集、迁移和转化的动力学过程研究,可得到以下结论:
(1)本研究建立了快速溶剂萃取-超高效液相色谱-三重四极杆质谱联用仪检测的植物体中TBBPS及其衍生物、代谢物多种化合物同时定性、定量分析方法,为环境中此类新型溴代化合物的环境行为评估提供了技术支持.
(2)土培实验表明,大豆和油菜对TBBPS及其衍生物等化合物的吸收、富集量随着暴露时间的增加呈先增高后降低的趋势,相比之下化合物在植物地下部分累积量高于地上部分,且大豆富集化合物的总量明显高于油菜.
(3)TBBPS及其衍生物可以在大豆和油菜体内发生生物转化,产生BPS、TBBPS-BME、2-BPM和4-BPM等代谢产物.
四溴双酚S(TBBPS)及其衍生物的植物吸收、传输和生物转化
Plant uptake, translocation and biotransformation of tetrabromobisphenol S (TBBPS) and its derivatives
-
摘要: 新型溴代阻燃剂四溴双酚S(tetrabromobisphenol S,TBBPS) 作为四溴双酚A(tetrabromobisphenol A,TBBPA)的一种替代品,在生产和产品使用、回收处置过程中易释放到环境中,并发生代谢转化产生衍生物、代谢物,对人类健康和生态环境造成潜在的危害. 因此,探究TBBPS及其衍生物在土壤-植物系统中的吸收、传输和生物转化的过程,对于认识环境中TBBPS及其衍生物的归趋,评估其生态风险具有十分重要的意义. 本研究选用常种植的油菜和大豆作为模式植物,利用温室土培实验,探究TBBPS及其衍生物在两种植物体内的吸收、富集特征以及传输和生物转化规律. 主要研究结论如下:建立了基于快速溶剂萃取-超高效液相色谱-三重四极杆质谱联用(UPLC-MS/MS)的方法能成功实现TBBPS及其多种衍生物的分离和测定,具有较高的灵敏度和较低的检测限. 土培实验结果表明,随着暴露时间的增加,大豆、油菜对TBBPS及其衍生物、代谢物的吸收富集量呈先增高后降低的趋势,并在第25天时富集量达到最大值. 化合物在大豆体内的传输因子均低于油菜,说明化合物在油菜体内的转运能力更强. 对比不同化合物,大豆体内TBBPS-MAE的传输因子最高,即茎向传输能力最强,油菜体内则表现为TBBPS的传输能力最强,但总体传输因子均<1,且衍生物的转运量大于代谢物,表明代谢物相对于衍生物更难转移至地上部. TBBPS及其衍生物在大豆、油菜体内通过代谢转化生成BPS、TBBPS-BME、2-BPM和4-BPM等代谢产物并富集,植物体内代谢物总量随着暴露时间增加呈先增加后降低的趋势. 与无植物种植空白处理相比,代谢物2-BPM/4-BPM只在植物体内代谢产生. 研究结果为综合评价TBBPS及其衍生物的环境分布、迁移、转化规律和生态危害性提供了科学数据和技术支持.Abstract: The new brominated flame retardant tetrabromobisphenol S (TBBPS), as a substitute for tetrabromobisphenol A (TBBPA), is easily released into the environment during production, product use, recycling and disposal, and undergoes metabolic transformation to produce derivatives and metabolites, posing potential hazards to human health and the ecological environment. Therefore, it is of great significance to investigate the process of uptake, translocation and biotransformation of TBBPS and its derivatives in the soil-plant system in order to understand the fate of TBBPS and its derivatives in the environment and to assess their ecological risks. In this study, commonly grown rapeseed .and soybean were selected as model plants to investigate the uptake and enrichment characteristics as well as the translocation and biotransformation patterns of TBBPS and its derivatives in the two plants using greenhouse soil culture experiments. The main results are as follows: A method based on rapid solvent extraction coupled with ultra-high performance liquid chromatography triple quadrupole mass spectrometry (UPLC-MS/MS) was developed for the successful separation and determination of TBBPS and its various derivatives, with high sensitivity and low detection limits. The results of soil cultivation experiment showed that the uptake and enrichment of TBBPS, its derivatives and metabolites in soybean and rapeseed showed a trendency of first increasing and then decreasing with the increase of exposure time, and the enrichment reached its maximum value on the 25th day. The transport factors of the compounds were all lower in soybean than in rapeseed, indicating that the compounds were better transported in rapeseed. Comparing the different compounds, TBBPS-MAE in soybean had the highest transport factor, indicating the strongest stemward transport capacity. In rapeseed, TBBPS had the strongest transport capacity, but overall transport factors were less than 1, and the transport capacity of derivatives was greater than that of metabolites, indicating that metabolites were more difficult to be transferred to the aboveground parts compared to derivatives. TBBPS and its derivatives were metabolically transformed to produce metabolites such as BPS, TBBPS-BME, 2-BPM and 4-BPM and enriched in soybean and rapeseed, and the total amount of metabolites in the plants showed a tendency of first increasing and then decreasing with the increase of exposure time. Compared with the blank treatment without plant cultivation, metabolites 2-BPM/4-BPM were only produced in plants. The research results provide scientific data and technical support for the comprehensive evaluation of the environmental distribution, migration, transformation patterns, and ecological hazards of TBBPS and its derivatives.
-
Key words:
- tetrabromobisphenol S /
- plants /
- biological uptake /
- translocation /
- biotransformation.
-

-
表 1 污染土壤理化性质及污染物含量
Table 1. Physicochemical properties and pollutant content of contaminated soil
土壤理化性质指标
Physical and chemical property indicators数值
Numerical value污染物
Pollutant数值/( ng·g−1)
Numerical value阳离子交换量/(cmol·kg−1) 14.39 TBBPS 537.1 TBBPS-MAE 272.3 有机质含量/(mg·kg−1) 11.44 TBBPS-BDBPE 148.6 BPS 3.128 pH 8.58 TBBPS-BME 1.729 2-BPM/4-BPM ND 表 2 TBBPS及其衍生物、代谢物、内标物质样品加标回收率
Table 2. Recovery rates of TBBPS and its derivatives, metabolites, and internal standard substance samples after spiking
标准曲线(100— 5000 ng·mL−1)
StandardR2 回收率/%
Rate of recovery 10 ng·g−1(n=3)检出限/(ng·mL−1)
Detection limit定量限/(ng·mL−1)
Limit of quantitationTBBPS Y = − 8434.600 +298.685X0.999 82±12 0.065 0.216 TBBPS-MAE Y = 1.26619 +006+4931.270 X0.995 85±9 0.047 0.158 TBBPS-BDBPE Y = 63254.500 +173.483X0.990 78±13 0.054 0.179 TBBPA(内标) Y = −284.612+3.152X 0.991 88±5 0.025 0.082 BPS Y = − 27568.800 +2139.660 X0.999 83±10 0.041 0.138 TBBPS-BME Y = − 5.91497 +0.015X0.991 85±4 13.529 45.096 2-BPM Y = 194214 +142.666X0.992 75±7 6.586 21.987 4-BPM Y = 170868 +180.270X0.998 70±6 20.747 69.156 表 3 优化的ESI-MS/MS(负电离模式)参数
Table 3. Optimized ESI-MS/MS (Negative Ionization Mode) Parameters
化合物
Chemical compound管透镜电压/V
Cone定量离子(m/z)
Quantitative ion碰撞电压/eV
Coll Energy定性离子(m/z)
Qualitative ions碰撞电压/eV
Coll EnergyTBBPS −102 564.516→249.400 45 564.516→563.800 14 TBBPS-MAE −75 604.521→523.800 18 604.521→563.200 24 TBBPS-BDBPE −135 764.319→563.100 33 764.319→564.900 39 TBBPA(内标) −91 542.632→419.450 39 540.632→445.560 33 BPS −84 248.915→91.900 32 248.915→108.100 33 TBBPS-BME −72 592.573→78.900 62 592.573→80.900 16 2-BPM −48 232.876→78.800 19 232.879→78.900 19 4-BPM −55 232.891→97.000 20 232.855→164.700 20 表 4 大豆、油菜中TBBPS及其衍生物的根富集因子及传输因子
Table 4. Root concentration factors and transport factors of TBBPS and its derivatives in soybean and rapeseed
化合物
Chemical compound土培时间
Soil cultivation time大豆RCF
Soybean RCF大豆TF
Soybean TF油菜RCF
Rapeseed RCF油菜TF
Rapeseed TFTBBPS 3 d 0.099 0.590 0.056 0.737 7 d 0.196 0.551 0.165 0.821 15 d 0.329 0.392 0.222 0.806 25 d 0.375 0.430 0.340 0.753 40 d 0.309 0.444 0.296 0.701 TBBPS-MAE 3 d 0.072 0.578 0.052 0.601 7 d 0.140 0.675 0.124 0.583 15 d 0.306 0.590 0.267 0.705 25 d 0.362 0.649 0.331 0.729 40 d 0.297 0.692 0.285 0.703 TBBPS-BDBPE 3 d 0.070 0.398 0.037 0.462 7 d 0.120 0.427 0.090 0.488 15 d 0.238 0.477 0.230 0.613 25 d 0.306 0.516 0.294 0.636 40 d 0.261 0.469 0.262 0.584 BPS 3 d 1.066 0.457 1.577 0.323 7 d 2.491 0.227 3.214 0.340 15 d 3.810 0.356 4.236 0.303 25 d 3.676 0.222 4.440 0.291 40 d 3.147 0.248 3.683 0.291 TBBPS-BME 3 d 0.628 0.154 0.815 0.103 7 d 2.140 0.312 2.724 0.212 15 d 4.280 0.269 3.374 0.235 25 d 4.638 0.275 3.668 0.258 40 d 3.969 0.159 3.473 0.251 2-BPM/4-BPM 3 d ND 0.048 ND 0.182 7 d ND 0.282 ND 0.504 15 d ND 0.371 ND 0.625 25 d ND 0.343 ND 0.525 40 d ND 0.196 ND 0.505 -
[1] YU Y J, TIAN J L, ZHENG T, et al. Perturbation of lipid metabolism in 3T3-L1 at different stages of preadipocyte differentiation and new insights into the association between changed metabolites and adipogenesis promoted by TBBPA or TBBPS[J]. Journal of Hazardous Materials, 2024, 465: 133183. doi: 10.1016/j.jhazmat.2023.133183 [2] WŁUKA A, WOŹNIAK A, WOŹNIAK E, et al. Tetrabromobisphenol A, terabromobisphenol S and other bromophenolic flame retardants cause cytotoxic effects and induce oxidative stress in human peripheral blood mononuclear cells (in vitro study)[J]. Chemosphere, 2020, 261: 127705. doi: 10.1016/j.chemosphere.2020.127705 [3] LIU A F, TIAN Y, YIN N Y, et al. Characterization of three tetrabromobisphenol-S derivatives in mollusks from Chinese Bohai Sea: A strategy for novel brominated contaminants identification[J]. Scientific Reports, 2015, 5: 11741. doi: 10.1038/srep11741 [4] LIAO C Y, LIU F, ALOMIRAH H, et al. Bisphenol S in urine from the United States and seven Asian countries: Occurrence and human exposures[J]. Environmental Science & Technology, 2012, 46(12): 6860-6866. [5] NYHOLM J R, GRABIC R, ARP H P H, et al. Environmental occurrence of emerging and legacy brominated flame retardants near suspected sources in Norway[J]. Science of the Total Environment, 2013, 443: 307-314. doi: 10.1016/j.scitotenv.2012.10.081 [6] 杨慧, 罗孝俊, 何家卓, 等. 四溴双酚A/S及其8种衍生物在清远土壤样品中的污染特征及生态风险评估[J]. 地球化学, 2023, 52(1): 1-8. YANG H, LUO X J, HE J Z, et al. Occurrence and ecological risk assessment of tetrabromobisphenol A/S and their eight derivatives in soil samples from Qingyuan[J]. Geochemistry, 2023, 52(1): 1-8 (in Chinese).
[7] 孙盼盼. 滇北小流域土壤和沉积物中持久性有机污染物的地球化学特征[D]. 南京: 南京师范大学, 2017. SUN P P. Geochemical characteristics of POPs in soils and sediments from small watersheds in the north of Dianchi watershed[D]. Nanjing: Nanjing Normal University, 2017 (in Chinese).
[8] LIU A F, SHI J B, SHEN Z S, et al. Identification of unknown brominated bisphenol s congeners in contaminated soils as the transformation products of tetrabromobisphenol S derivatives[J]. Environmental Science & Technology, 2018, 52(18): 10480-10489. [9] Cynthia A D W. An overview of brominated flame retardants in the environment[J]. Chemosphere, 2002, 46(5): 583-624. doi: 10.1016/S0045-6535(01)00225-9 [10] LI A J, ZHUANG T F, SHI W, et al. Serum concentration of bisphenol analogues in pregnant women in China[J]. Science of the Total Environment, 2020, 707: 136100. doi: 10.1016/j.scitotenv.2019.136100 [11] LIU A F, QU G B, YU M, et al. Tetrabromobisphenol-A/S and Nine Novel Analogs in Biological Samples from the Chinese Bohai Sea: Implications for Trophic Transfer[J]. Environmental Science & Technology, 2016, 50(8): 4203-4211. [12] 刘爱风. 新型四溴双酚 A/S类污染物的发现 及其环境行为研究[J]. 北京: 中国科学院研究生院, 2016. LIU A F. Discovery of new tetrabromobisphenol A/S pollutants and study on their environmental behavior[D]. Beijing: University of the Chinese Academy of Sciences, 2016 (in Chinese).
[13] 俞帅. 植物对水相中四溴双酚A和2, 4-二溴酚的吸收与转化[D]. 杭州: 浙江工业大学, 2017. YU S. Absorption and transformation of Tetrabromobisphenol A and 2, 4-dibromophenol in aqueous by plants[D]. Hangzhou: Zhejiang University of Technology, 2017 (in Chinese).
[14] 江秀兰. 卤代阻燃剂和镉污染的土壤对水稻幼苗毒性的研究[D]. 泰安: 山东农业大学, 2020. JIANG X L. Study on the toxicity of soil polluted with halogenated flame retardants and cadmium to rice seedlings[D]. Taian: Shandong Agricultural University, 2020 (in Chinese).
[15] WHITE J C, WANG X P, GENT M P N, et al. Subspecies-level variation in the phytoextraction of weathered p, p'-DDE by Cucurbita pepo[J]. Environmental Science & Technology, 2003, 37(19): 4368-4373. [16] 林庆祺, 蔡信德, 王诗忠, 等. 植物吸收、迁移和代谢有机污染物的机理及影响因素[J]. 农业环境科学学报, 2013, 32(4): 661-667. LIN Q Q, CAI X D, WANG S Z, et al. Uptake, translocation and metabolism of organic pollutants by plants: Mechanisms and affecting factors[J]. Journal of Agro-Environment Science, 2013, 32(4): 661-667 (in Chinese).
[17] 卢绘, 张银龙, 吴永波. 植物叶面吸收污染物机制研究进展[J]. 环境化学, 2020, 39(12): 3371-3383. LU H, ZHANG Y L, WU Y B. Research progress on foliar absorption mechanism of pollutants[J]. Environmental Chemistry, 2020, 39(12): 3371-3383 (in Chinese).
[18] SUN J Q, CHEN Q, QIAN Z X, et al. Plant uptake and metabolism of 2, 4-dibromophenol in carrot: In vitro enzymatic direct conjugation[J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4328-4335. doi: 10.1021/acs.jafc.8b00543 [19] CHROMA L, MACKOVA M, KUCEROVA P, et al. Enzymes in plant metabolism of PCBs and PAHs[J]. Acta Biotechnologica, 2002, 22(1-2): 35-41. doi: 10.1002/1521-3846(200205)22:1/2<35::AID-ABIO35>3.0.CO;2-U [20] 张宇飞, 许学慧, 李俊文, 等. 内蒙古林草交错带有机氯农药的多介质分布特征及风险评价[J]. 环境化学, 2023, 42(2): 446-455. doi: 10.7524/j.issn.0254-6108.2021100701 ZHANG Y F, XU X H, LI J W, et al. Multi-medium distribution characteristics and risk assessment of organochlorine pesticides in forest-grass ecotone in Inner Mongolia[J]. Environmental Chemistry, 2023, 42(2): 446-455 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021100701
[21] 黄韵竹, 王小平. 环境中四溴双酚S的检测方法研究进展[J]. 应用化工, 2022, 51(6): 1825-1828,1832. doi: 10.3969/j.issn.1671-3206.2022.06.055 HUANG Y Z, WANG X P. Research progress on detection methods of tetrabromobisphenol S in environment[J]. Applied Chemical Industry, 2022, 51(6): 1825-1828,1832 (in Chinese). doi: 10.3969/j.issn.1671-3206.2022.06.055
[22] XU X H, HAN W. Analysis of tetrabromobisphenol A and bisphenol A in plant sample-method optimization and identification of the derivatives[J]. Environmental Science And Pollution Research International, 2023, 30(34): 82770-82779. doi: 10.1007/s11356-023-28241-1 [23] BRIGGS G G, BROMILOW R H, EVANS A A. Relationships between lipophilicity and root uptake and translocation of non-ionised chemicals by barley[J]. Pesticide Science, 1982, 13(5): 495-504. doi: 10.1002/ps.2780130506 [24] 樊芸. 两种植物生命周期内对疏水性有机污染物的吸收及累积[D]. 广州: 中国科学院大学(中国科学院广州地球化学研究所), 2021. FAN Y. Uptake and accumulation of hydrophobic organic contaminants into two plants during the whole life[D]. Guangzhou: Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, 2021 (in Chinese).
[25] DODGEN L K, UEDA A, WU X Q, et al. Effect of transpiration on plant accumulation and translocation of PPCP/EDCs[J]. Environmental Pollution, 2015, 198: 144-153. doi: 10.1016/j.envpol.2015.01.002 [26] SCHNOOR J L, LICHT L A, McCUTCHEON S C, et al. Phytoremediation of organic and nutrient contaminants[J]. Environmental Science & Technology, 1995, 29(7): 318A-23A. [27] MEGGO R E, SCHNOOR J L, HU D F. Dechlorination of PCBs in the rhizosphere of switchgrass and poplar[J]. Environmental Pollution, 2013, 178: 312-321. doi: 10.1016/j.envpol.2013.02.035 -



 下载:
下载: