-
随着“双碳”目标的提出,磷酸铁锂电池由于其长循环寿命、高安全性和低成本等特性[1-2],在新能源汽车和5G基站储能等方面展现出蓬勃的市场活力。据统计,2022年全球动力电池装机量达到517.9 GWh,同比增长71.8%;其中,我国动力电池企业合计市场份额达60.4%[3]。然而,新能源汽车的动力电池寿命通常仅为3~5年[4],未来必将出现爆发式的磷酸铁锂电池的报废潮,因此高效经济地回收磷酸铁锂电池成为了社会各界关注的热点话题。退役磷酸铁锂电池的处理方式包括进行梯次利用[5]、高温固相修复利用[6]以及湿法回收有价金属[7]。一般来说,动力电池的容量衰减至80%时,需从电动车上退役;容量在80%~30%之间时,可以在其他领域进行梯次利用[8];而容量衰减至30%以下时则需要结合物理、化学等方法进行拆解回收[9]。修复再利用[10]是指采用物理或电化学等方法,对拆解分离后磷酸铁锂材料的结构和性能进行修复,得到可再次投入使用的电极材料或前驱体。湿法回收主要通过酸浸或者碱浸提取回收磷酸铁锂正极材料中的有价金属[11]。锂由于自身的高价值属性,通常会被优先选择性提取[12],一般采用湿法将磷酸铁锂正极材料中的锂资源转化为锂盐溶液,并将其以碳酸锂的形式回收[13]。提锂后产生的铁磷渣中含有包括铝钛在内的多种其他杂质,由于铁磷与铝分离困难[14],难以得到有效回收,造成资源浪费[15]。
目前针对提锂渣的回收,已涌现诸多尝试性技术,如磁选法、酸浸法、熔融法、微生物法。但是磁选法只适用于含铁量较高的渣样,且回收效果较差[16]。而酸浸过程耗酸量大[17],铁磷的浸出效果不理想,且浸出液中Al3+和Fe3+分离困难,影响磷酸铁的制备。熔融法通过将载体与固样混合后进行加热熔融,再将熔融物冷却形成固体分散体[18],为提锂渣的回收提供了一种思路,使Fe、P等元素进入熔渣相,进一步进行回收。该法具有较高的回收率和较少的废酸、废水产生,但对设备要求较高,能耗较大。微生物法通过利用微生物的生物代谢作用来回收有价金属,是一个复杂的氧化还原过程[19-21]。该法在回收铁的同时还可以产生电能,可以降低部分运行成本[22]。但提锂渣处理后多用作建筑原材料,无法充分发挥铁磷的高价值属性,造成资源浪费[23]。目前提锂渣回收的主要难点在于Al3+和Fe3+的分离。传统湿法工艺中的铁粉还原无法将Fe3+完全还原为Fe2+,因此提锂渣的资源化利用一直未能寻找到最有效的途径。考虑到提锂渣的主要成分为FePO4,尽管存在Fe2O3、Al2O3、SiO2等杂质[24-26],但是只要能有效分离,便能将提锂渣中的铁磷以电池级磷酸铁前驱体的形式回收,从而促进磷酸铁锂电池行业的可持续发展。
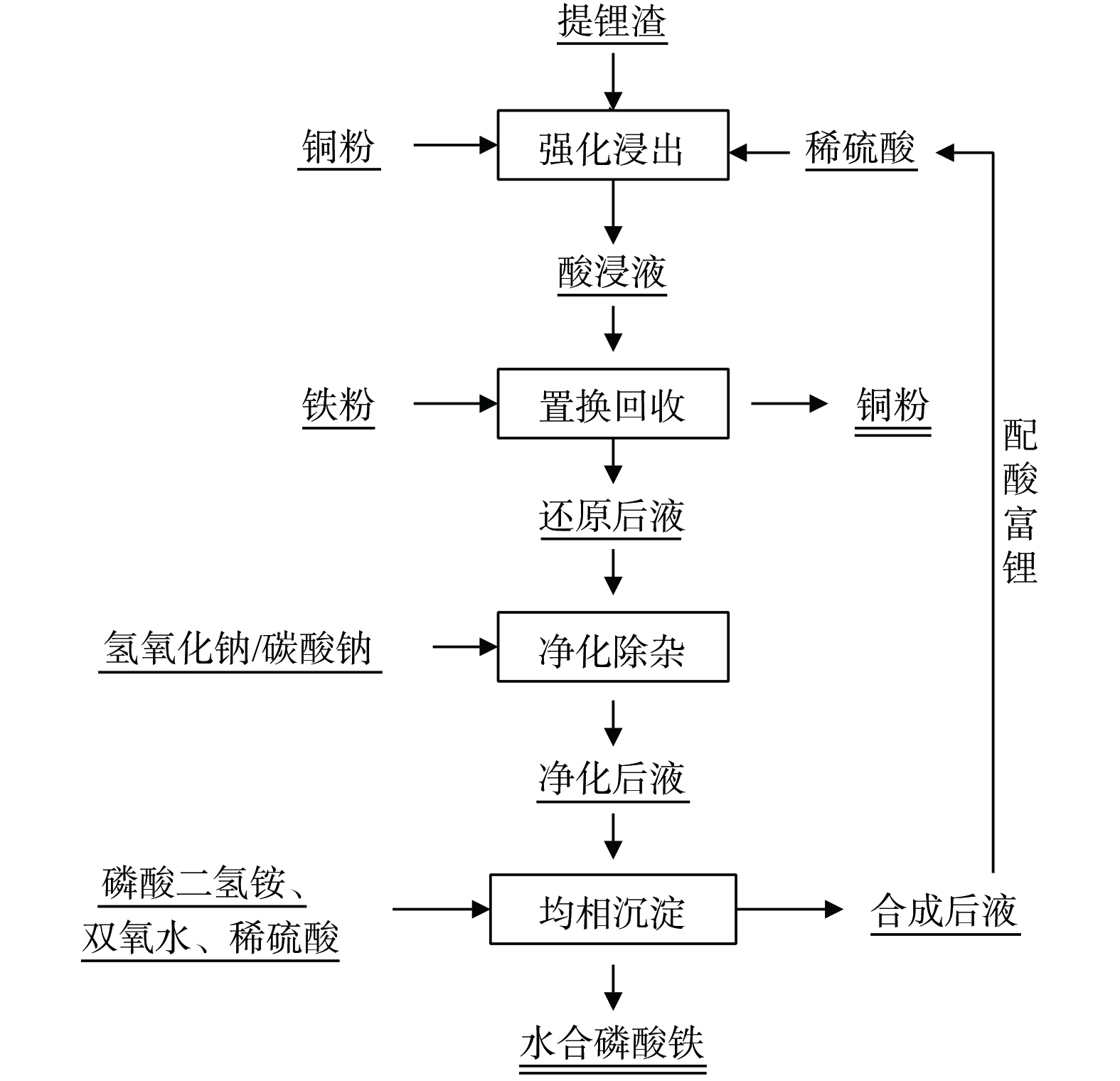
铜粉还原Fe3+的化学反应标准电势为1 V,铁粉置换Cu2+的化学反应标准电势为0.78 V[27]。由此可知,铜粉还原以及铁粉置换铜都可以自发进行。因此可以考虑采用铜还原Fe3+。本研究采用湿法冶金回收,以磷酸铁锂正极材料提锂渣为原料,在浸出过程中加入铜粉,有效降低酸度,减少了酸耗以及后续碱的消耗,同时也促进铁磷的浸出,后续通过加入铁粉将铜离子置换为铜单质再利用的同时,将Fe3+还原为Fe2+,解决了Al3+和Fe3+分离困难的问题。本研究对提锂渣的处理流程如下:铜粉强化浸出、铁粉还原并回收铜、净化除杂和制备电池级磷酸铁。实现了废磷酸铁锂粉料提锂渣中铁和磷的高值化回收利用,促进了磷酸铁锂行业的稳健发展。
-
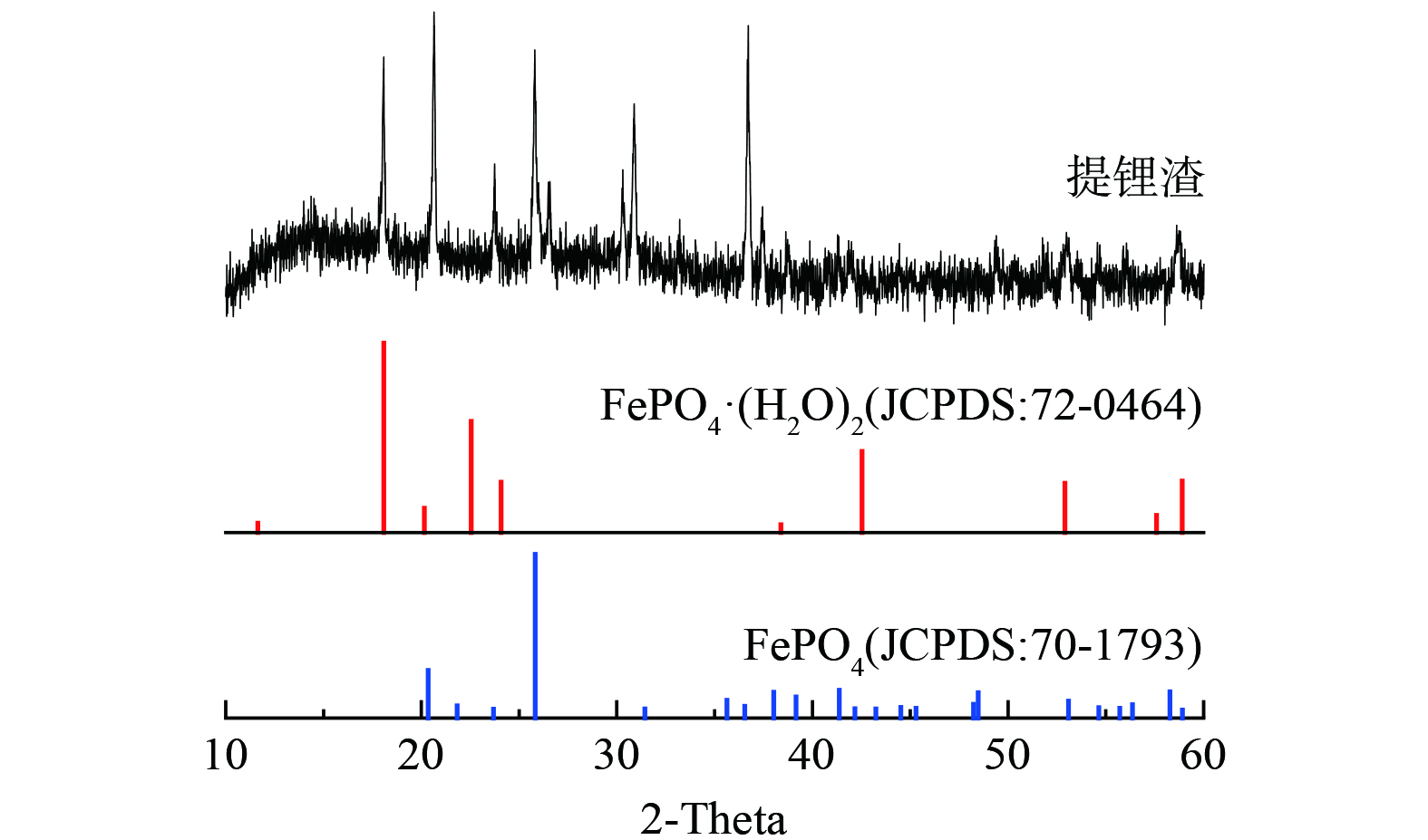
废旧磷酸铁锂正极粉料提锂后铁磷渣 (以下简称提锂渣) 是由中国江西省赣锋锂业有限公司提供。提锂渣的含水率为43.7%,烘干后提锂渣的主要成分为铁、磷、铝、铜、钛、碳,其含量 (wt.%) 分别为 27.9%、15.7%、0.25%、0.11%、0.15%、5.34%。提锂渣的物相组成如图1所示,主要为磷酸铁物相。从提锂渣的SEM-EDS图像 (图2) 可以看出,Fe、P、O的分布相似,共同构成磷酸铁,而Al呈弥散性分布,说明Al与磷酸铁主要为物理性混合。分析级硫酸 (H2SO4,98%)、铜粉 (Cu)、铁粉 (Fe)、氢氧化钠 (NaOH)、磷酸二氢铵 (NH4H2PO4) 和过氧化氢 (H2O2,30wt%) 购于国药集团化学试剂有限公司。在整个实验过程中使用去离子水。
实验仪器包括数显恒温水浴锅 (SHJ-6型,常州金坛精达仪器制造有限公司)、电子分析天平 (AL204型,梅特勒-托利多仪器 (上海) 有限公司)、智能恒温油浴锅 (ZKYY,上海凌科实业发展有限公司)、去离子水制水机 (DBW-50L,东莞东博水处理设备有限公司)、以及干燥箱 (101-2DB,天津市泰斯特仪器有限公司) 等。
-
实验流程如图3所示。
1) 铜粉强化浸出。首先,将50 g提锂渣与一定量的H2SO4溶液于锥形烧瓶混合,再加入适量铜粉。随后,将烧瓶置于多重磁力搅拌器中,转速设置为300 r·min−1,25 ℃下反应一段时间后过滤,并测量滤液中各元素的浓度。硫酸用量按如下反应方程式(1)所示。
元素的浸出效率 (μi) 计算如式(2)所示。
式中:ci为浸出液和提锂渣中元素i的浓度,g·L−1;ωi为浸出液和提锂渣中元素i的含量,%;V是浸出液的体积,L;m是提锂渣的质量,g;43.7%为提锂渣的含水量。
2) 置换回收。量取100 mL酸浸液于锥形烧瓶中,加入一定量的还原铁粉,并将烧瓶置于多重磁力搅拌器中,转速设置为300 r·min−1,25 ℃下反应一段时间。利用铜离子对三价铁离子的强还原作用以及铁单质对铜离子的置换作用,使溶液中的Fe3+完全被还原为Fe2+。反应原理如式(3)、(4)所示。
反应完成后过滤,测量滤液中各元素的浓度,对滤渣进行洗涤、干燥和称重,计算铜粉的回收率。计算如式(5)所示。
式中:CCu是浸出液中铜的浓度,g·L−1;ωCu是滤渣中铜的含量,%;V是浸出液的体积,L;m是滤渣的质量,g。
3) 净化除杂。量取100 mL还原后液于锥形烧瓶中,加入铁粉调节pH后,置于多重磁力搅拌器中,转速设置为300 r·min−1,70 ℃下反应一段时间。反应结束后过滤得到净化液,分析净化液中的元素含量。
相应元素的去除率 (Ri) 计算如式(6)所示。
式中:ci是净化液和还原后液中元素i的浓度,g·L−1;Ci是净化液和还原后液中元素i的浓度,g·L−1;V1和V2分别是净化液和还原后液的体积,L。
4) 制备水合磷酸铁。量取100 mL净化液加入锥形烧瓶中,调控pH后按照理论量1.2倍加入过氧化氢 (30wt%) ,旨在溶液体系中的Fe(Ⅱ)氧化为Fe(Ⅲ),随后移入95 ℃油浴锅中反应8 h,生成水合磷酸铁[28]。反应完成后,通过真空过滤将混合物分离。沉淀物用去离子水洗涤两次,并在真空烘箱中干燥。
-
通过电感耦合等离子体原子发射光谱法 (ICP-AES,Thermo Scientific ICAP7400 Radial) 测量元素的浓度。通过X射线衍射 (XRD,D/max
2500 v/pc,Cu Kα辐射) 定物质的物相组成。扫描电子显微镜 (SEM,MIRA3-LMH) 确定物质微观形态以及元素分布情况。 -
基于铜粉对三价铁离子的强还原作用,研究了铜粉添加量对提锂渣浸出过程的影响,结果如图4(a)所示。显然,铜粉的加入可以有效促进提锂渣中铁磷的浸出,铜粉添加量为4.5 g·L−1时,铁磷的浸出率已经达到99%以上。由于浸出液中铁浓度过高不利于后续还原过程,因此将浸出液与浸出渣的洗水混合以降低铁离子浓度。同时混合溶液中的铜离子浓度也会降低,为了保证后续铁铜还原的顺利进行,将浸出过程中铜粉添加量设置为9 g·L−1。
硫酸用量对浸出过程的影响见图4(b)。当硫酸用量控制在理论用量的70%时,铁磷浸出率分别为99.46%和99.28%,此时溶液的pH=0.34,相对于理论硫酸用量下的终点pH=0.05有了显著提升,从而减少后续调节pH的耗碱量。因此,硫酸用量选择为理论用量的70%。液固比对提锂渣浸出行为的影响结果如图4(c)所示。当液固比从2.0 mL·g−1上升至4.0 mL·g−1时,铁磷的浸出率呈现先上升再下降的趋势,且pH从0.24增长到0.46。其中,当液固比为2.5 mL·g−1时,铁磷的浸出效果最好。在硫酸用量不变的情况下,液固比越高,溶液的pH越高,酸度也就越低,越不利于磷酸铁的浸出。但是液固比太低,溶液粘稠,不利于传质。综合考虑浸出体系酸度以及铁磷的浸出效果,将液固比设置为2.5 mL·g−1。
在上述优化条件下对浸出时间和浸出温度进行了优化,结果分别如图4(d)和图4(e)所示。浸出在3 h达到平衡。当温度为25 ℃时,铁磷的浸出率分别为97.39%和98.51%。随着温度上升至70 ℃,铁磷的浸出率仍然保持相对稳定,均在99%以上。当温度继续上升至85 ℃时,铁磷的浸出率突然呈断崖式下降,铁磷的浸出率分别降至23.33%和26.41%,这是因为溶液体系中铁磷重新反应生成了磷酸铁。综合考虑能耗和浸出率,后续实验将浸出温度设置为25 ℃。
综上所述,得到铜粉强化浸出过程的最佳浸出条件:铜粉用量为9 g·L−1,H2SO4用量设置为理论用量的70%,液固比为2.5 mL·g−1,浸出时间为3 h,温度为25 ℃。
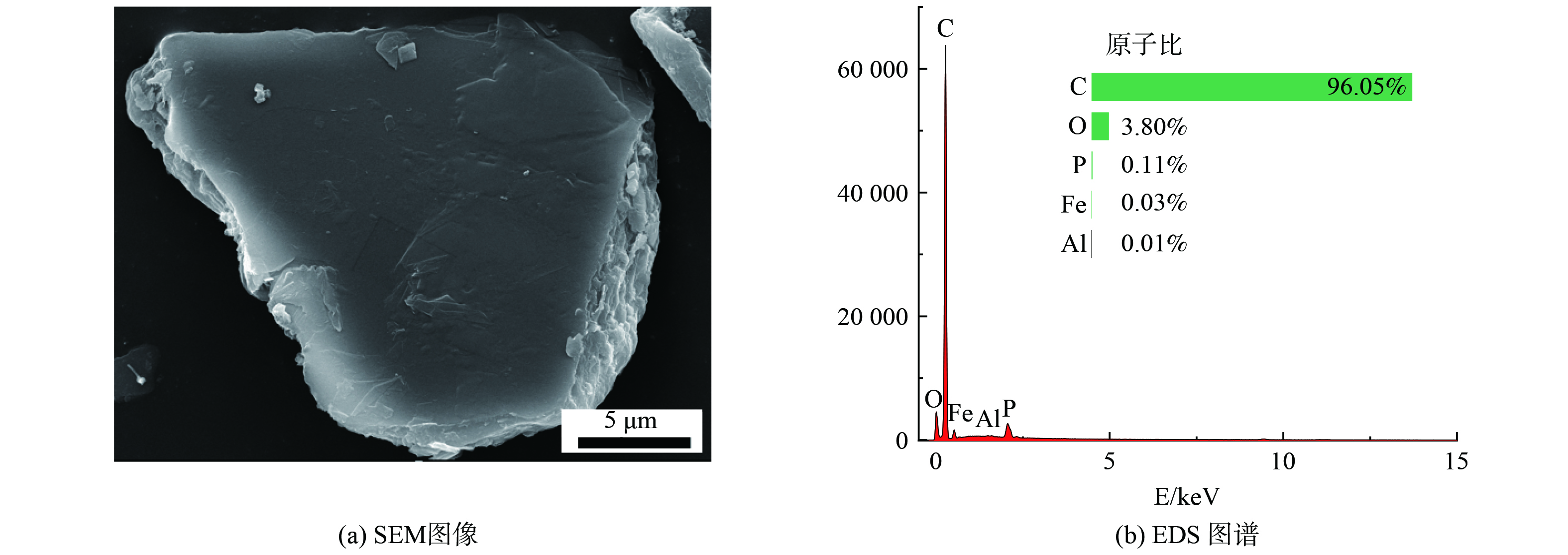
浸出残渣的XRD图谱如图4(f)所示,其特征衍射峰与C (JCPDS:75-0444) 的标准峰基本一致,说明浸出渣的主要成分为C。图5(b)的元素能谱进一步验证了浸出渣的元素分布,说明浸出过程比较充分,铁磷基本上被全部转移至液相中,便于后续处理。从SEM图 (图5(a)) 可以看出浸出渣的结构为多层叠合体,与石墨结构一致。
-
提锂渣在硫酸浸出过程中生成了硫酸铁和磷酸,反应可分3步进行:硫酸自液相主体扩散至提锂渣表面;硫酸与提锂渣在液固接触面发生反应;生成产物自反应表面扩散至液相主体[29]。为进一步明确硫酸浸出提锂渣的机理,对不同温度下浸出过程的浸出动力学展开了探究,结果如图6所示。随着温度的升高,铁的浸出率慢慢升高,但是当温度到达85 ℃时,由于体系中生成了磷酸铁,会导致浸出的铁离子再次沉淀,从而使沉降率下降。在3 h左右,铁浸出率基本不发生变化。在该体系中,可以看出磷的浸出行为与铁基本一致 (图6(b)) ,这是由于提锂渣的铁磷以磷酸铁的形式存在,通过反应(1)的进行同时从固相中释放出来的缘故。 铝浸出率的变化趋势与铁磷相似 (图6(c)) ,从25 ℃上升至70 ℃时,浸出率上升,在85 ℃时下降,这可能是由于磷酸铁生成时裹挟铝离子一起沉降所致。钛的浸出率随温度升高而升高 (图6(d)) ,并且到达一定平衡,当温度为55 ℃时,钛离子在1 h左右就基本达到浸出平衡,此时浸出率为97%。但继续升高温度至70 ℃时,钛离子会迅速沉淀,在2 h的浸出率仅为3.95%。这是由于钛离子高温易水解沉淀[30],这也为后续净化除杂过程中高温除钛提供了理论依据。
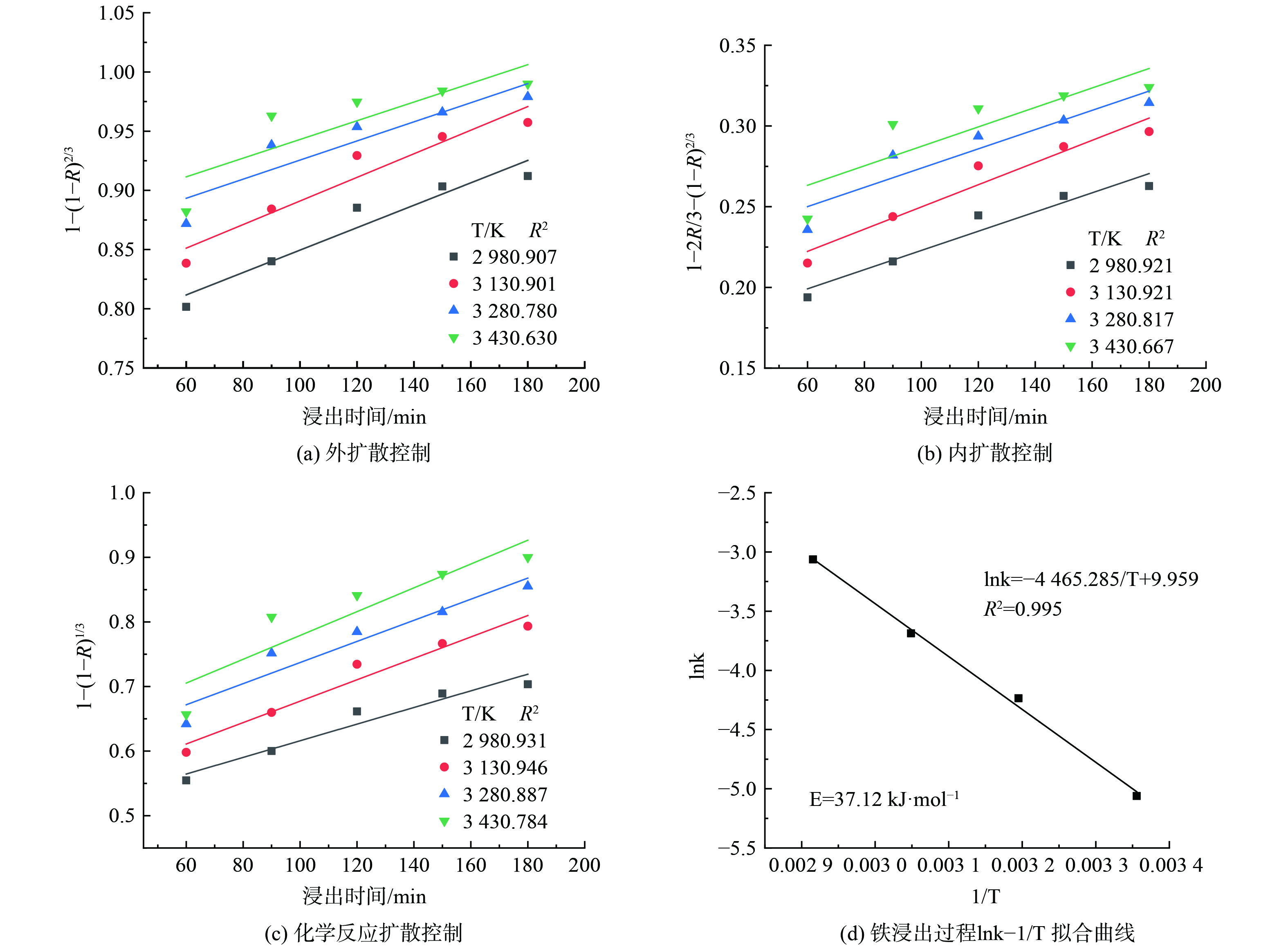
该体系中铁磷的浸出速率基本一致,浸出率曲线基本重合,说明铁磷的浸出行为基本一致,因此以下动力学分析以铁为代表。采用以下四种模型[31]进行了数据拟合,结果如图7、8所示。
外扩散控制模型公式如图(7)所示。
内扩散控制模型公式如图(8)所示。
化学反应扩散控制模型公式如图(9)所示。
混合扩散控制模型公式如图(10)所示。
式中:R为元素的浸出率,%;ka、kb、kc和kd分别为外扩散控制、内扩散控制、化学反应控制和混合扩散控制的反应速率常数。
由图7、8相关性R2可以看出,混合扩散控制 (图7) 模型更适用于提锂渣中铁的浸出过程,其线性相关系数均在0.963及以上。随着温度的升高,拟合曲线的斜率增大,即反应速率常数增大,这是因为浸出反应过程中吸热,升高温度有助于反应进行。
根据Arrhenius方程计算反应的表观活化能,见公式(11)。
式中:k表示反应速率常数;E表示表观活化能,J·mol−1;T表示热力学温度,K;R表示理想气体常数,8.314 J·(mol·K)−1;A表示指前因子。
按混合扩散控制模型对不同热力学温度下提锂渣中铁浸出过程的lnk与1/T 作图并拟合,结果如图8(d)所示。铁浸出反应的表观活化能为37.12 kJ·mol−1,在可接受的范围内 (20~42 kJ·mol−1) [31]。因此,提锂渣的浸出过程是由通过溶液边界层的扩散和界面处的化学反应控制共同控制。
-
由《兰氏化学手册》[27]得知,在25 ℃时,式(3)的化学反应标准电势为1 V,式(4)的化学反应标准电势为0.78 V 。此时Cu对Fe3+的还原反应以及Fe与Cu2+的置换反应都能顺利自发进行,将该阶段的反应温度设置为25 ℃。采用Cu2+和Fe3+浓度分别为7.59 g·L−1以及58.79 g·L−1的浸出液进行实验。铁粉用量对铜铁置换效率的影响见图9(a)。随着铁粉用量的不断增加,溶液中Cu2+与Fe3+的浓度不断下降。当铁粉用量为理论用量的115%时,溶液体系中未检测出Cu2+与Fe3+。因此,确定铁粉用量为理论用量的115%。见图9(b),当反应时间为0.8 h时,Fe3+被全部还原为Fe2+,此时溶液中Cu2+的浓度为560 mg·L−1,随着反应继续进行至1.5 h,Cu2+全部被置换出来。因此将反应时间设置为1.5 h。
得到置换回收过程中的优化条件:铁粉用量为理论用量的115%,反应时间为1.5 h。在此优化条件下进行2组平行实验,实验结果如表1。两组实验的溶液中Fe3+基本上被还原为Fe2+,并且Cu的回收率均在99.99%以上。
-
调节反应体系至合适的pH,Al3+会与OH−以及少量PO4−分别结合,生成沉淀,从而从溶液中分离。磷酸铁产品中Al的含量大于0.1%会对所制电池性能造成影响[32-33],因此将Al3+的去除率以及溶液中剩余Al3+浓度作为净化除杂效果的主要依据。为此,探究了初始铁浓度、平衡pH、反应温度、反应时间及铁粉添加量对分离酸浸液中铝杂质的影响。
当铁浓度过高时,会直接与PO4−反应,造成铁磷的大量损失,因此探究了铁浓度对除铝行为的影响进行研究 (图10(a)) 。随着溶液中铁浓度从55 g·L−1上升至95 g·L−1,除铝效果逐渐降低,同时铁磷的损失率相对增加。当溶液中铁浓度为65 g·L−1时,可将溶液中Al3+和Ti4+分别降低至41 mg·L−1和5 mg·L−1,同时可以将铁磷的损失控制在20%以下。因此将除杂过程的铁浓度确定为65 g·L−1。
另外,pH是影响Al3+在溶液中存在形态的重要因素。当pH小于3时,其主要存在形态是Al3+,当pH 大于3时,其主要形态是Al(OH)3。以此特性作为依据,研究了平衡pH对分离Al3+效果的影响 (图10(b)) 。对于本研究体系而言,随着平衡pH 的升高,除铝效果越明显,当平衡pH从2.32提升至2.90时,铝的沉淀率从0%上升至88.7%。但同时铁磷损失率也不断升高,分别从0%上升至48%,从0.8%上升至64.2%。为有效减少铁磷的损失,将终点pH控制在2.63,此时铁磷的损失率分别为15%以及17%,除铝效果较好的同时保证了钛的去除效率。
温度对分离酸浸液中铝杂质的影响结果如图10(c)所示。反应温度从60 ℃增加到70 ℃,铝沉淀率从57.43%增加至89.65%,进一步增加反应温度至80 ℃,铝的沉淀率下降至80.43%。推测温度过高,溶液中以Fe2+被氧化后与PO4−结合生成FePO4的反应为主。由此确定反应温度为70 ℃,此时钛的沉淀率为99%。基于以上优化条件,探究反应时间对除铝效果的影响 (图10(d)) 。当反应进行至4 h时,反应基本达到平衡。
除杂过程中调控pH时需要缓慢控制,若pH局部上升过快,会直接生成磷酸亚铁沉淀。在不引入杂质离子的前提下,选择铁粉作为本体系的pH调节剂,以缓慢提升反应过程中的pH,实验结果见图10e。铁粉投加量从7 g·L−1增加至9 g·L−1时,铝的沉降率从44.36%上升至85.16%,溶液中Al3+从265 mg·L−1降低至71 mg·L−1。当铁粉投加量从10 g·L−1增加至11 g·L−1时,除铝效果变化不明显,这是因为pH上升至一定程度后铁粉不再继续与溶液中H+发生反应。在保证除铝效率且不浪费铁粉的前提下,最终确定调控反应终点pH为2.63时,投加铁粉量为10 g·L−1。
综上,得到净化除杂过程优化反应条件:铁浓度65 g·L−1、终点pH2.63、70 ℃、4 h、投加铁粉10 g·L−1。对除杂过程中产生的渣样烘干经煅烧后进行XRD分析,结果如图10(f)所示。煅烧后除铝渣的特征峰与标准卡片JCPDS:31-0029完全吻合,由此可以得出溶液中的Al3+基本上以AlPO4的形式沉淀从而得到分离。由于体系中Ti4+含量过低,因此XRD图谱中未得到相关特征峰。
-
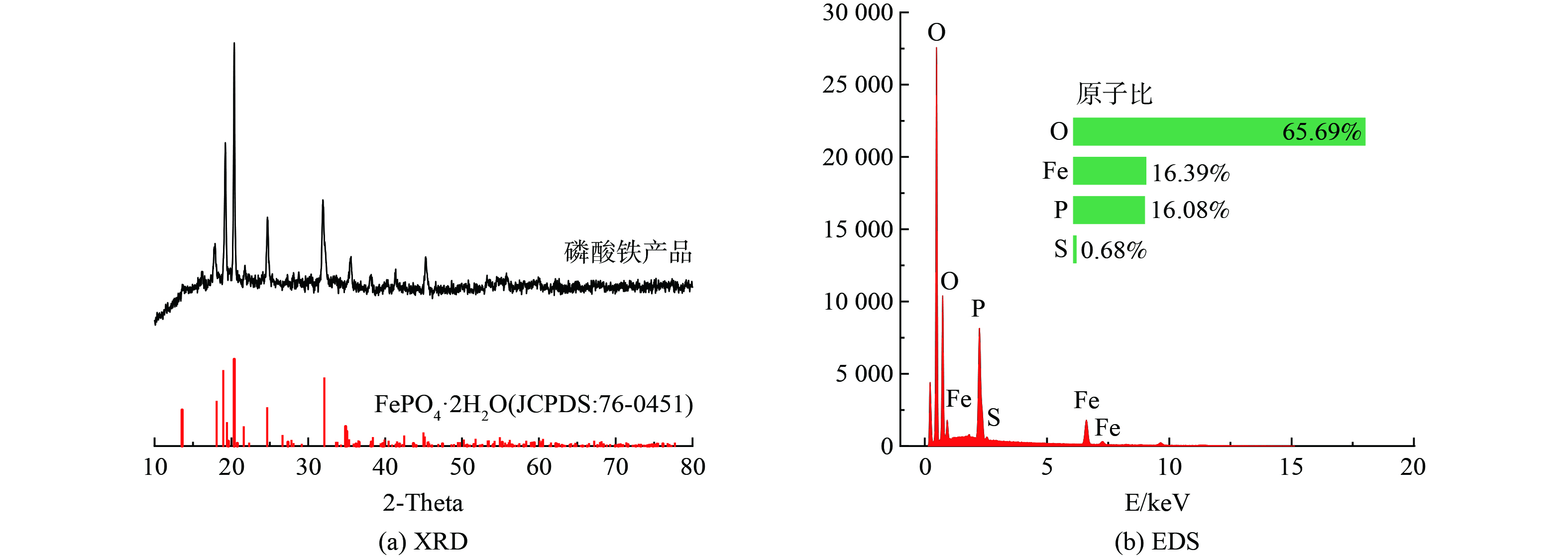
1) 产品物相及形貌。对用净化后液制备的磷酸铁进行XRD以及SEM-EDS分析,结果如图11、12所示。由图11(a)可知,制得产品的XRD谱图各特征衍射峰与FePO4·2H2O (JCPDS:76-0451) 的标准图谱基本一致,未观测到其他明显的杂相衍射峰。对产品进行EDS面扫描,所得结果如图11(b),其中主要元素的原子比Fe∶P∶O=1∶1∶6,结合图12可知Fe、P、O三元素的分布均匀,基本一致,说明该产品为磷酸铁。该磷酸铁由多个片状晶体团聚结合,形成球状,有利于后续磷酸铁锂的制备。
2) 产品纯度。将制备的磷酸铁粉体溶解进行ICP-AES检测各金属元素成分,粉体中各元素含量见表2。可知制备的磷酸铁粉体符合电池级磷酸铁标准 (HG_T4701-2021D电池用磷酸铁) [33]的成分要求,可用于工业回收再利用。
-
研究了利用“铜粉强化硫酸浸出-铁粉置换-选择性分铝”的方法从含铝的废旧磷酸铁锂正极材料提锂渣再生电池级磷酸铁的各优化参数,得到结论如下:
1) 强化浸出提锂渣的优化工艺参数为:铜粉用量为9 g·L−1,H2SO4用量设置为理论用量70%,液固比为2.5 mL·g−1,温度为25 ℃,浸出时间为3 h,在此条件下,铁磷浸出率分别为99.46%和99.28%。
2) 该浸出过程是由通过溶液边界层的扩散和界面处的化学反应控制共同控制,表观活化能为37.12 kJ·mol−1。
3) 铁粉置换回收铜的优化工艺参数为:铁粉用量为理论用量的115%,反应时间为1.5 h。在此条件下,溶液中Fe3+基本上被还原为Fe2+,Cu的回收率在99.99%以上。
4) 净化除杂工艺参数为:铁浓度65 g·L−1、终点pH为2.63、70 ℃、4 h、投加铁粉10 g·L−1。此时,除铝效率为89.65%,体系中Al3+可以控制在41 mg·L−1,铁磷的损失率分别为15%以及17%。
5) 使用净化液制备的磷酸铁符合电池行业标准,可作为前驱体制备磷酸铁锂电池。
废旧磷酸铁锂正极材料提锂渣再生电池级磷酸铁
Regeneration of battery-grade iron phosphate from lithium extraction slag of spent lithium iron phosphate cathode material
-
摘要: 针对目前废旧磷酸铁锂电池正极材料回收中仅局限于高经济价值的锂元素提取,由于铝杂质分离困难而导致提锂渣利用率低的问题,提出了一种基于“铜粉强化硫酸浸出-铁粉置换-选择性分铝”策略的湿法工艺,旨在从提锂渣中高效再生磷酸铁。通过对铜粉强化硫酸过程进行优化及动力学研究,着重考察了铜粉用量、硫酸用量、液固比、反应温度及反应时间等参数的影响,确定了铁粉置换回收铜和选择性分铝过程的相关优化参数。研究结果表明,铜粉强化提锂渣硫酸浸出过程符合混合扩散控制模型,其表观活化能为37.12 kJ·mol−1,主要受溶液边界层的扩散和界面处的化学反应共同控制。此外,经过净化处理后,溶液中铜和铝的浓度分别降至小于1、41 mg·L−1,可直接用于电池级磷酸铁的制备。本研究为磷酸铁锂提锂渣的回收利用提供了一种新思路。Abstract: In addressing the complexities inherent in the current recycling process of waste lithium iron phosphate (LiFePO4) battery cathode materials, characterized by selective lithium extraction, leaving behind a lithium extraction slag with limited utility due to challenges associated with aluminum impurity separation, this study proposed a wet process based on "copper powder-enhanced sulfuric acid leaching-iron powder replacement-selective aluminum separation" strategy to regenerate iron phosphate from the lithium extraction slag. The study involved the optimization and kinetic analysis of the copper powder-enhanced sulfuric acid leaching, focusing on the impacts of parameters such as copper powder dosage, sulfuric acid dosage, liquid-solid ratio, reaction temperature, and reaction time. In addition, the optimization parameters governing the iron powder replacement process for copper retrieval and selective aluminum separation were delineated. The results indicated that the sulfuric acid leaching process of lithium extraction slag were enhanced by copper reduction conformed to the mixed diffusion control model, with an apparent activation energy of 37.12 kJ·mol−1. This indicated that the process was controlled by diffusion through the boundary layer of the solution and the chemical reaction at the interface. Moreover, the concentrations of copper and aluminum in the purified solution were lower than 1 and 41 mg·L−1, respectively, making it suitable for deployment in the synthesis of battery-grade iron phosphate. This study provides a novel approach for the recycling and utilization of lithium extraction slag.
-
Key words:
- ferric phosphate /
- lithium extraction slag /
- cathode materials /
- reductive leaching /
- kinetic modeling /
- regeneration
-

-
表 1 优化条件下置换回收阶段平行实验结果
Table 1. Parallel experimental results of the displacement recovery stage under optimized conditions
实验
编号溶液中Cu2+浓度/
(mg·L−1)溶液中Fe3+浓度/
(mg·L−1)Cu回收率/% 1 2 未检出 99.999 5 2 1 未检出 99.999 8 表 2 磷酸铁的品质指标
Table 2. Quality indicators of iron phosphate
元素 磷酸铁产品 行业标准 w(Fe)/% 29.56 28.5~30.0 w(P)/% 16.76 16.2~17.2 n(Fe)∶n(P) 0.976 0.96~1.02 w(Al)/% 0.02 ≤0.03 w(Cu)/% 0 ≤0.005 w(Ti)/% 0.01 ≤0.15 -
[1] 何利华. 磷酸铁锂正极材料的合成与改性研究[D]. 长沙: 中南大学, 2013. [2] 詹伟杰, 钱凯程, 谢欢, 等. 磷酸铁锂电池循环寿命的加速试验验证方法[J]. 汽车与新动力, 2023, 6(5): 48-52. [3] 张维佳. 2022年全球动力电池装机量大增71.8%中国厂商占六成市场[N]. 中国电子报, 2023-02-21(5). [4] 黎华玲, 陈永珍, 文吉, 等. 湿法回收退役三元锂离子电池有价金属的研究进展[J]. 化工进展, 2019, 38(2): 921-932. [5] 许弈飞, 曹新雅. 动力电池梯级利用回收模式与应用研究[J]. 科技与创新, 2018(9): 111-112. [6] 刘桐, 焦芬, 钟雪虎等. 废旧锂电池正负极材料修复再生技术[J]. 电源技术, 2019, 43(4): 699-701. [7] 姚家涛, 张勇, 韩培林, 等. 基于磷酸铁锂提锂渣的电池级磷酸铁制备工艺研究[J]. 化工矿物与加工, 2023, 52(9): 1-5. [8] 刘梦宁, 李晓强. 退役磷酸铁锂电池的梯次利用和正极材料回收方法现状[J]. 人工晶体学报, 2021, 50(11): 2192-2203. [9] 戚彩. 退役磷酸铁锂电池正极材料的衰减机制与修复技术研究[D]. 南京: 南京信息工程大学, 2023. [10] 王伟, 李海涛, 罗军, 等. 退役磷酸铁锂电池的回收现状和湿法回收工艺介绍[J]. 广东化工, 2023, 50(17): 106-108. [11] LI H, XING S Z, LIU Y. Recovery of lithium, iron, and phosphorus from spent LiFePO4 batteries using stoichiometric sulfuric acid leaching system[J]. ACS Sustainable Chemistry &. Engineering, 2017, 5(9): 8017-8024. [12] YANG Y, MENG X, CAO H, et al. Selective recovery of lithium from spent lithium iron phosphate batteries: a sustainable process [J]. Green Chemistry. 2018, 20(13): 3121-3133. [13] 郭浩. 废旧三元锂离子电池正极材料中有价金属的回收研究[D]. 镇江: 江苏大学, 2023. [14] 吴玉红, 姜瑞琪. 中国工业固废治理政策嬗变研究[J]. 黑龙江环境通报, 2023, 36(7): 127-129. [15] 郭世杰. 基于磁选法的尾矿再选加工工艺研究[J]. 世界有色金属, 2021(13): 60-61. [16] 中国科学院过程工程研究所. 一种废磷酸铁锂正极材料提锂渣再生磷酸铁的方法: CN202110806701.4[P]. 2023-01-17. [17] 申升. 固体分散体技术在制剂开发中的研究进展[J]. 山东化工, 2023, 52(11): 86-88. [18] 吕飞龙, 李江, 等. 微生物冶金在矿物开采中的应用进展[J]. 化学工程与装备, 2012, 5(3): 131-133. [19] LEFEBVRE O, NECULITA C M, YUE X. Bioelectrochemical treatment of acid mine drainage dominated with iron[J]. Journal of Hazardous Materials, 2012, 212: 411-417. [20] LIANG F, WU R, ZHAO F, et al. Research on extracellular electron transfer of Acidithiobacillus Ferrooxidans[J]. Chemistry Multidisciplinary, 2014, 35: 372-376. [21] 聂鹏飞. 采用微生物燃料电池从尾矿中回收铁的技术研究[D]. 镇江: 江南大学, 2017. [22] 刘庆生, 喻修远, 肖浩, 等. 磷酸铁锂电池废料提锂尾渣的回收及磷酸铁的制备[J]. 稀有金属与硬质合金, 2022, 50(4): 17-23+38. [23] 米雪, 许海青, 刘春力, 等. 退役锂电池电解液高效热解气化与选择性提锂研究[J]. 中南大学学报(自然科学版), 2023, 54(2): 694-701. [24] 王猛, 张家靓, 陈永强, 等. 退役磷酸铁锂电池回收技术综述[J]. 有色金属(冶炼部分), 2023(5): 100-110. [25] 马毅, 沈文喆, 袁梅梅, 等. 磷铁渣制备电池级纳米磷酸铁[J]. 化工进展, 2019, 38(11): 5015-5023. [26] 黄铿齐, 李立平, 肖炜彬, 等. 废旧磷酸铁锂正极粉脱锂后的磷铁渣经硝酸浸出除铝的研究[J]. 化工技术与开发, 2023, 52(4): 66-70. [27] 迪安. 兰氏化学手册[M]. 魏俊发, 等. 译. 2版. 北京: 科学出版社, 2003: 8.124-8.127. [28] 江洋. 钛白副产硫酸亚铁均相沉淀制备电池级磷酸铁[D]. 长沙: 中南大学, 2022. [29] 胡佛明. 稀土矿泥中稀土的酸浸及其浸出动力学研究[D]. 昆明: 昆明理工大学, 2017. [30] WU Y H Z, ZHOU K G, ZHANG X K, et al. Al/Ti Removal from the Sulfate Leachate of the Spent LiFePO4/C Powder through High-Temperature Co-precipitation Triggered by Fe(III)[J]. Industrial & Engineering Chemistry Research, 2023, 62: 35,13902-13910. [31] DENG R R, XIE Z M, LIU Z H, et al. Leaching kinetics of vanadium catalyzed by electric field coupling with sodium persulfate[J]. Journal of Electroanalytical Chemistry, 2019, 854: 113542. doi: 10.1016/j.jelechem.2019.113542 [32] 北京资源强制回收环保产业技术创新战略联盟团体. 无水磷酸铁: T/ATCRR 18-2020[S]. 北京: 中国标准出版社, 2020. [33] 中华人民共和国工业和信息化部. 电池用磷酸铁: HG/T4701-2021[S]. 北京: 中国标准出版社, 2021. -



 下载:
下载: