-
镉 (Cd) 是一种广泛存在的有毒重金属,其在土壤中易于被农作物吸收,通过食物链对人体健康造成严重威胁[1-3]。人体长期暴露于Cd导致多种健康问题,主要表现在肾功能的损害,也与骨质疏松等骨骼疾病有关[4-6]。小麦是我国主要的粮食作物之一,主要种植在北方地区[7]。研究显示我国北方地区小麦籽粒Cd严重超标,居民通过食用当地小麦存在较高的健康风险[8-9]。模拟和预测膳食Cd在人体内的动力学行为及其对人体健康影响,是制定区域小麦Cd污染防治策略的重要依据。
农作物健康风险是近年来研究者关注的热点,美国环境保护局 (USEPA) 提出的健康风险评估 (HRA) 模型[10]已用于多项研究。REN等[11]研究发现食用大米摄入重金属As对研究区成人和儿童存在严重的致癌和非致癌风险。YANG等[12]研究表明研究区34.1%小麦籽粒被Cd污染,食用小麦籽粒给当地居民带来重大健康风险。XU等[13]研究显示研究区土壤-小麦系统中主要的污染物是Cd,Cd影响了从土壤到小麦根部的Cu、Mn和Pb的转移,食用小麦Cd存在显著的人体健康风险。然而使用该模型评估的健康风险结果忽略了人体组织中Cd浓度的变化[14]。基于生理学的毒代动力学 (PBTK) 模型模拟了Cd在人体各个区室 (血浆、红细胞、金属硫蛋白、肝脏、肾脏、其他组织、粪便和尿液排泄) 的吸收、分布、代谢和排泄过程[14-16]。肾脏对Cd具有高度敏感性,是其主要的靶器官。Cd在人体内的半衰期为10~30年,人体接触Cd后,有一部分在肾皮质中积累[17-18]。基于人群的研究表明,U-Cd含量与肾皮质中的Cd积累量成正比,因此U-Cd可作为评估长期Cd暴露的有效的生物标志物[17-19]。在进行U-Cd含量预测时,通常采用PBTK模型和毒代动力学 (TK) 模型。TK模型结构简单,参数较少,但无法准确描述Cd在体内不同器官和组织中的分布和代谢过程[20]。PBTK模型的优势在于,在短期和长期Cd暴露后,模型可计算8个隔室 (包括血液和尿液) 中Cd浓度之间的关系[15]。PBTK模型能够准确预测长期膳食Cd暴露后的尿镉 (U-Cd) 含量。但在数据有限的地区,如何获取足够的环境暴露数据以校准和验证模型,是一个主要挑战。此外,不同地区的环境特征和人群生活习惯的差异,也可能影响模型的预测准确性和适用性。
本研究旨在利用PBTK模型,运用Monte Carlo随机模拟的方法,对北方某小麦主产区居民由于食用受Cd污染的食物而可能出现的U-Cd水平进行预测。使用PBTK模型可以准确地评估Cd在人体内的动态变化和积累情况,从而评估长期暴露于Cd污染环境中的健康风险。PBTK模型的应用不仅提供了一个量化工具来评估个体和群体的Cd暴露水平,且为制定基于证据的区域健康风险管理策略提供科学依据。
-
研究区位于华北平原小麦主产区,总面积近2 000 km2,属于亚热带季风气候,年平均降雨量和温度分别为650 mm和14.6 °C[21-22]。土壤类型主要为潮土和褐土,主要农作物为小麦和玉米,土壤pH处于6.07~8.16范围[23]。研究区是我国重要的小麦产区,也是全国知名的铅锌加工基地。铅锌矿的开采和冶炼活动导致该地区土壤长期累积Pb和Cd等重金属。LI等[24]研究揭示该地区土壤Cd超标率高达74.1%,56.6%的小麦样本Cd含量超出安全标准。该地区土壤Cd污染问题严峻,造成了严重的Cd污染问题,对小麦的安全生产及居民健康造成影响[24-25]。
-
采用大面积野外调查及样点布设,通过手持GPS进行精确定位。本研究在研究区内收集了206个土壤-小麦样本,对各采样的表层土壤 (0~20 cm) 混合采样,每个采样点获取的土壤样本经过均匀混合后使用四分法取出1.0~1.5 kg装入自封袋中,各采样点均采集5~10株对应小麦样品,同时采集132个农产品样本,随后将其放入密封袋中,样本密封后贴上标签带回实验室处理。
将土壤样品风干、研磨并通过0.20 mm筛孔筛选后,放入自封袋中储存。小麦样本经清洗除泥和籽粒分离,使用去离子水清洗3次,在150 ℃下使用烘干箱烘烤30 min,再以60 ℃烘干至恒重。最后,样本去壳、研磨成粉末并储存在密封袋中。农产品样品使用去离子水洗净,在80 ℃的条件下进行烘干处理,研磨成粉后置于干燥器皿中。土壤样品使用四酸法消解,小麦和农产品样品均采用硝酸-高氯酸法进行消解处理[25]。
应用ICP-MS (Agilent 7500a,USA) 测定样品中Cd的含量。测定过程使用国家标准物质进行质量控制,测得的空白加标回收率在87%~106%之间。
-
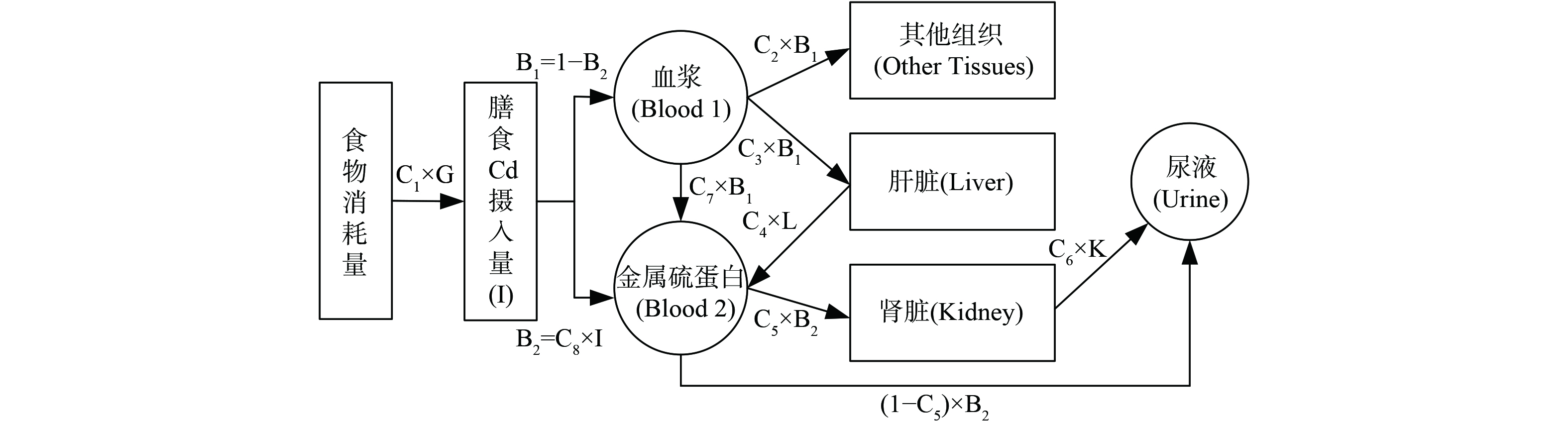
本研究使用PBTK模型模拟Cd元素的肠道吸收过程[14-15]。原始PBTK模型中血液隔室B3 (血细胞) 中Cd的动态变化和粪便Cd含量不是研究重点,本研究的模拟过程只考虑两个血液隔室B1 (血浆) 和B2 (金属硫蛋白) 中Cd的动态变化以及U-Cd含量。优化后的模型模拟了Cd元素的肠道吸收,即从镉元素吸收开始,经过血液、肝脏、肾脏,以尿镉的形式排泄的过程,如图1所示。模型参数值 (C1-C8) 的初始范围和最终值如表1所示。PBTK模型由下述微分方程式(1)~(8)所示。
模型在Python 3.8中编程并迭代运行。模型输入的是根据公式(9)计算出的研究区居民食用小麦、玉米、蔬菜、水果和坚果摄入Cd的含量(ADD) (μg·(kg·d)−1) ,时间单位是天,模型的最终输出结果是预测的U-Cd含量。
PBTK模型基于估算的研究区居民日均暴露Cd量,使用健康风险评估日均暴露量模型评估食用本地生产的小麦以及其他膳食对人体暴露于重金属Cd的风险[26],计算公式见(9)。
式中:ADDi为研究区居民膳食 (小麦,玉米,水果,蔬菜,坚果) Cd日均暴露剂量,μg·(kg·d−1),Ci为实验测量的小麦籽粒与其他食物Cd含量,mg·kg−1。式(9)其他参数含义及取值见表2。
在进行健康风险分析时,参数的选取对结果影响较大,采用确定性方法进行评估可能会导致结果具有不确定性[29-30]。Monte Carlo模拟在健康风险评估中的应用是通过从符合概率分布的变量中随机选取样本作为参数,代入变量函数模型,并输出仿真结果的概率分布[31]。在本研究中,随机模拟的迭代次数设定为10 000次,以获取区域人群膳食Cd暴露风险的概率分布。居民的IRwheat和BW数据源于研究区膳食习惯调查问卷和当地疾病预防控制中心进行的第三次国民体质调查。
-
本研究的样本数据和相关分析使用SPSS 27.0软件,数据可视化处理使用Origin 2021软件,Python 3.8软件进行PBTK模拟。Monte Carlo随机模拟应用Oracle Crystal Ball 11.1.2.4 (Oracle,USA) 软件实现,模拟次数在10 000时结果趋于稳定。
-
研究区土壤与食物Cd含量特征如表3所示。由表3可知,土壤ω (Cd) 平均值为1.52 mg·kg−1,72.3%的土壤样品Cd含量超标 (0.6 mg·kg−1) [25],土壤Cd的总浓度变化很大,变异系数的高值反映了这一点 (CV:144.53%) 。小麦ω (Cd) 变化范围较广,分布在0.02~1.63 mg·kg−1之间,且变异系数 (CV) 高达102%,这表明该地区小麦籽粒中Cd含量的变异性极高。小麦籽粒ω (Cd) 平均值为 (0.20±0.20) mg·kg−1,这一数值远高于《食品安全国家标准食品中污染物限量》 (GB
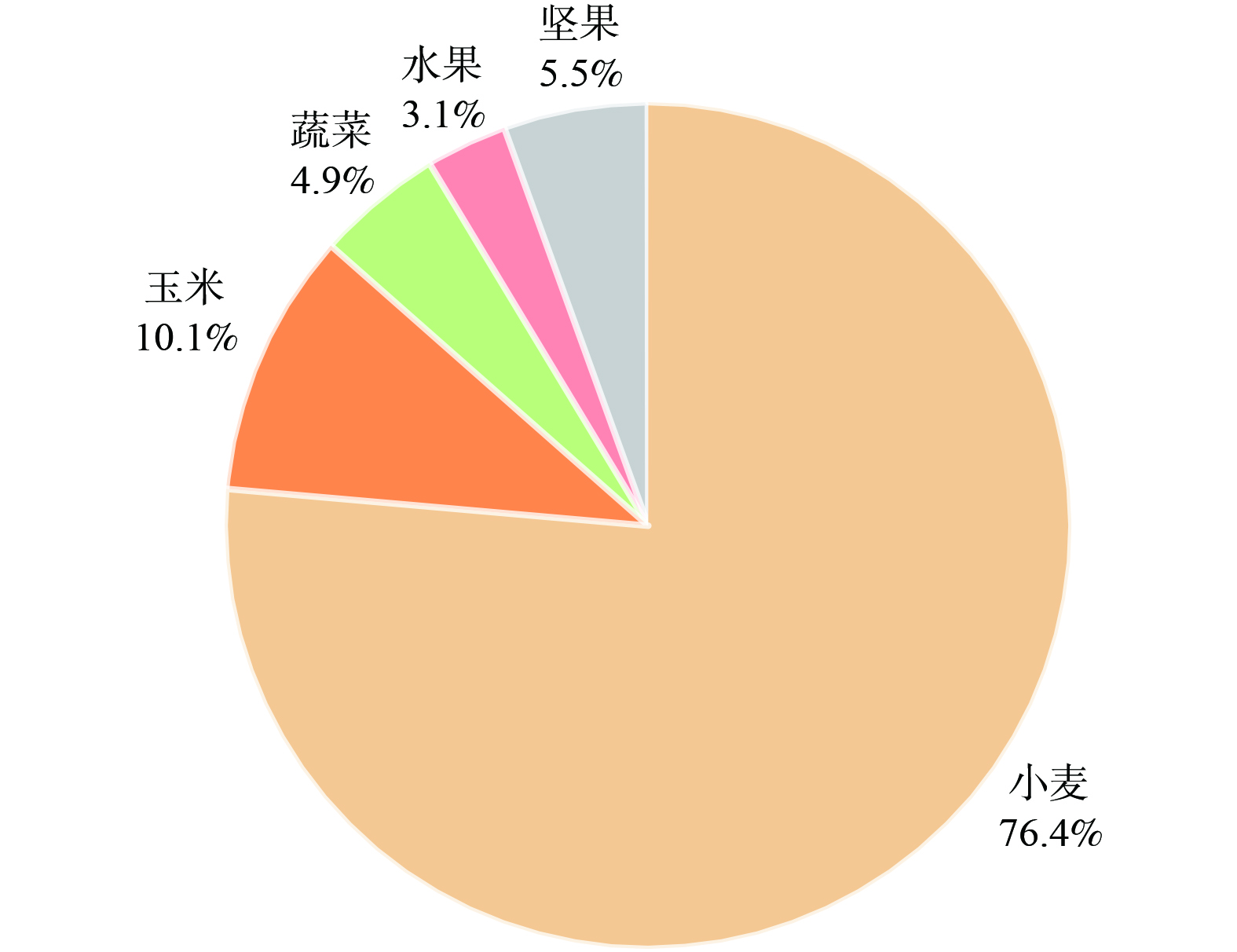
2762 -2022) [32]规定的0.1 mg·kg−1的限值。超过半数的小麦籽粒样品 (57.8%) Cd含量超标,说明研究区小麦籽粒普遍存在Cd富集问题,且Cd超标情况较为严重。根据环境保护部的调查,华北平原地区的居民超过90%依赖本地生产的小麦作为主要食物来源[27]。这一数据表明,因长期食用含Cd的小麦可能会对研究区居民的健康造成不利影响。表3呈现了研究区内各类食物的Cd含量,其中玉米、蔬菜、水果和坚果的Cd平均值分别为0.006、0.24、0.007和0.018 mg·kg−1,对应的变异系数分别为4.17%、1.17%、0.86%和1.39%。这些较低的变异系数表明,除小麦之外的食物表现出Cd含量的较高稳定性。在日常饮食中,这些食物对人体总摄入Cd的贡献相对较小,因此,在研究区食品安全的大环境中,它们不是主要的风险来源。图2展示了膳食摄取Cd的来源,据图2,小麦Cd占膳食摄入Cd的76.4%,这一比例远高于其他食物,凸显了小麦在整体膳食Cd暴露中的主导地位,也说明小麦是Cd暴露的主要食物来源。鉴于该区域居民对小麦的 高度依赖性,这种情况可能会对居民的健康构成潜在风险,需引起重视。
-
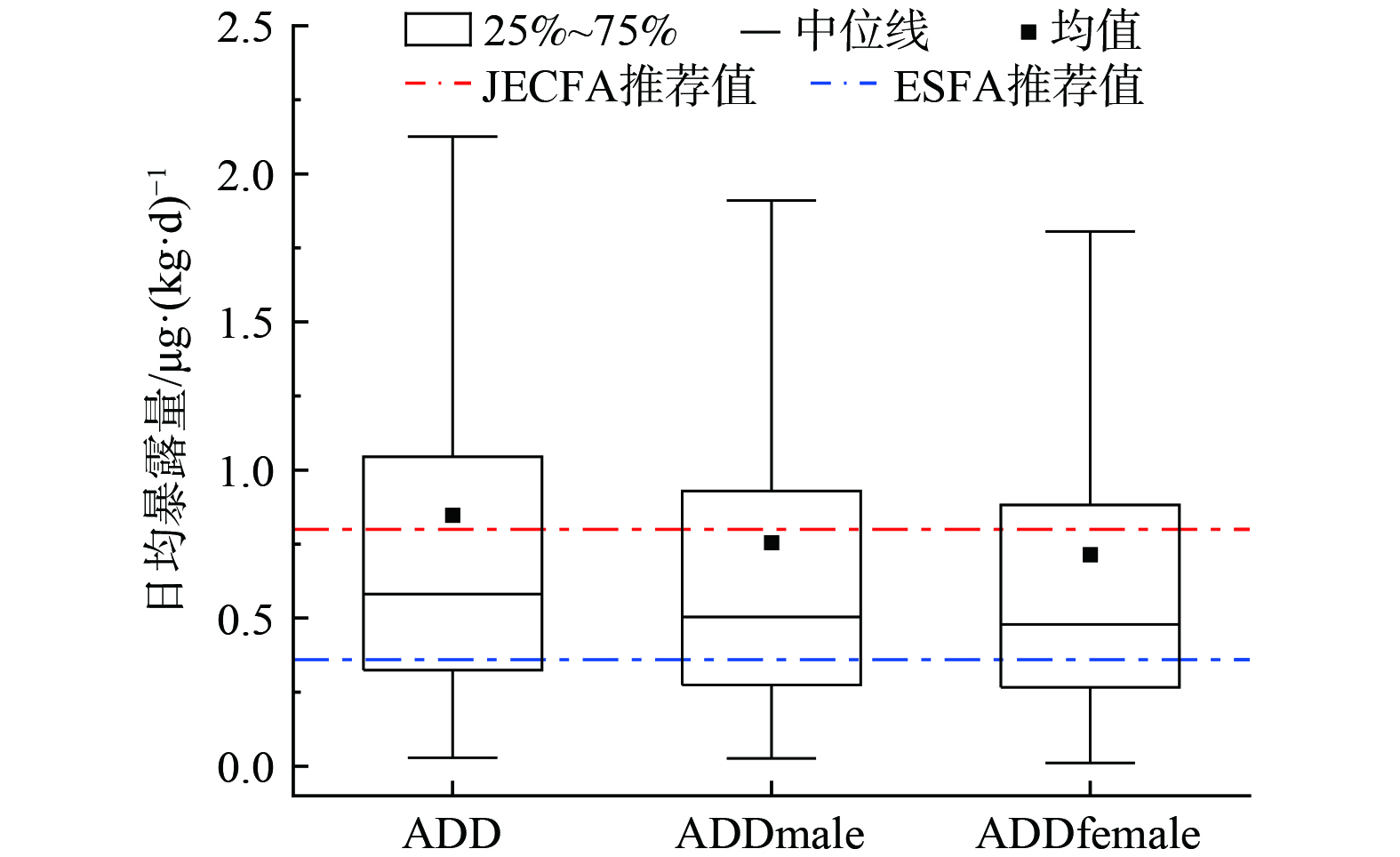
根据暴露风险公式(9)结合Monte Carlo随机模拟方法,对居民通过饮食而暴露于Cd的日均摄入量进行评估,模拟结果展示了Cd膳食日均暴露量以及男性与女性日均暴露量的分布情况 (图3) 。分析结果显示,ADD值主要分布在0.32~1.04 μg·(kg·d−1) (25%和75%分位值) 之间,中位数为0.58 μg·(kg·d−1),而平均ADD为0.84 μg·(kg·d−1),高于国际食品添加剂专家委员会 (JECFA) 推荐值[33] (0.8 μg·(kg·d−1)) (以BW计) ,且明显高于欧洲食品安全局(ESFA)推荐值[34] (0.36 μg·(kg·d−1)) (以BW计) 。在区域人群中,约有35.1%的个体Cd摄入量超过JECFA的推荐安全值,而高达70.8%的个体超过EFSA的推荐值。
对于性别差异的分析,男性的平均日均暴露量为0.75 μg·(kg·d−1),而女性为0.71 μg·(kg·d−1),男性略高于女性,这种差异可能与饮食习惯、体重及生物利用度等因素相关。性别差异在Cd暴露评估中是一个重要的考虑因素。尽管男性的平均暴露量略高,但两性的暴露水平都超过了国际安全标准,这需要引起相关部门的关注。考虑到Cd是一种有毒的重金属,能够在人体内积累,并可能导致多种健康问题,包括肾脏损害和骨骼疾病[35-36]。因此,作为Cd暴露的主要原因之一,膳食Cd应受到更多关注。
-
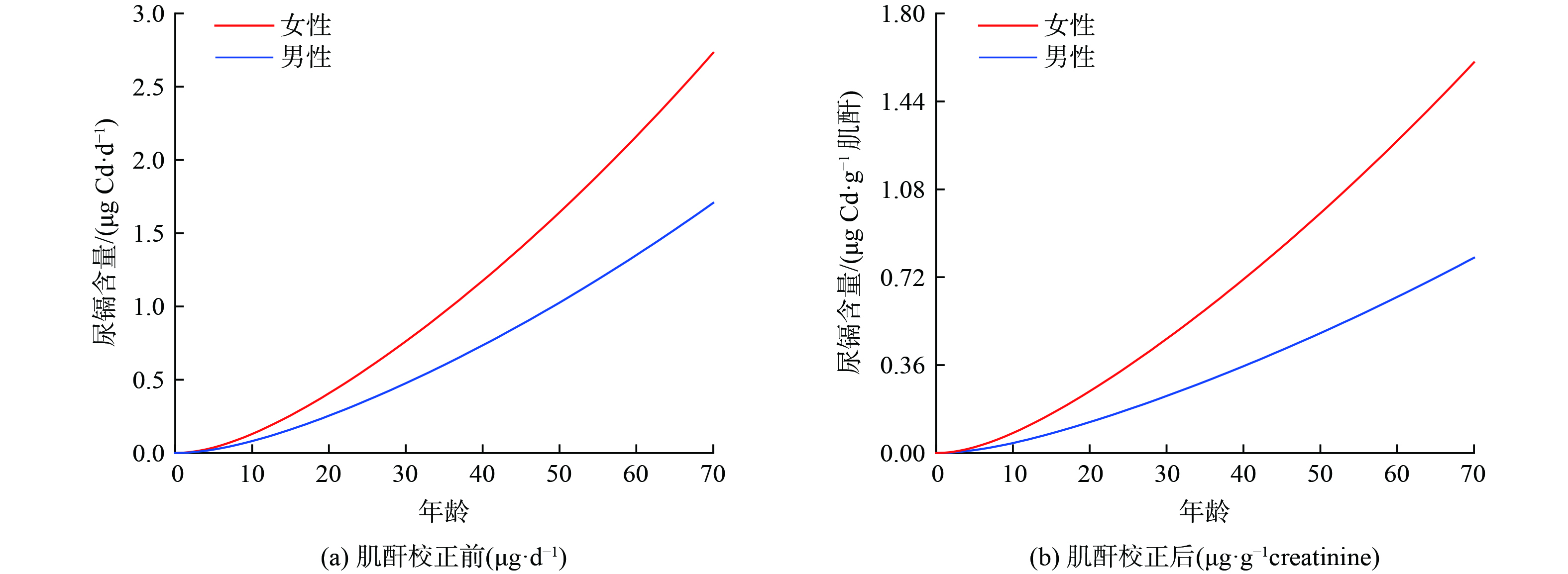
图4展示了PBTK模型预测的研究区0至70岁居民U-Cd含量的变化趋势。根据图4的模型计算结果,预测的0至70岁男性和女性U-Cd含量几何均值分别为0.29和0.59 μg·g−1肌酐。不同年龄段的男性和女性U-Cd的几何均值均呈现出随年龄增长而递增的趋势。具体来说,男性在年龄分别为小于30岁、30至40岁、40至50岁、50至60岁以及60至70岁时,U-Cd的几何均值分别为0.08、0.30、0.43、0.57和0.73 ug·g−1肌酐,女性对应的值则分别为0.16、0.60、0.86、1.14和1.45 ug·g−1肌酐。这一增长趋势可能与Cd的生物半衰期长达10至30年有关[37-39]。此外,随着年龄的增长,肾脏功能可能出现衰退,特别是肾小管对Cd的再吸收能力降低,进而导致U-Cd水平的升高[38,40]。
在对70岁年龄组的男性和女性进行U-Cd含量分析时,发现男性的U-Cd含量最高可达0.80 μg·g−1肌酐,每天通过尿液排泄的Cd含量为1.70 μg·d−1。而女性则可达1.60 μg·g−1肌酐,每天通过尿液排泄的Cd含量为2.73 μg·d−1。70岁男性U-Cd含量接近EFSA推荐的安全限值 (1 μg·g−1肌酐) [41],相应的女性U-Cd含量是EFSA推荐的安全限值的1.6倍。由图3可知,男性膳食Cd日均暴露量略高于女性,而女性的U-Cd含量大约是男性的两倍。这可能是因为女性胃肠道对Cd的吸收能力比男性更强,也可能与女性相对较低的体内铁储量有关[39,42]。据报道,铁的转运蛋白同时可以运输Cd,缺铁状态下,铁的转运蛋白表达水平上升,从而可能增加Cd的吸收[38,43]。预测的研究区居民70岁U-Cd含量均低于世界卫生组织 (WHO) 推荐的安全限值 (5.24 μg·g−1肌酐) [44]。即使是低水平的Cd暴露,相关的健康风险仍然需要关注。众多流行病学研究揭示,长期的低剂量Cd暴露会对健康产生负面影响[20,45]。
由图4(b)可知,在20至60岁的成年人群中,体内Cd的积累速度加快,而在20岁以下和60岁以上的人群中,Cd的积累速度相对较慢。这可能是因为在20至60岁的人群中,由于职业活动、环境因素以及生活方式的影响导致体内Cd摄入增加以及积累。此外,随着年龄的增长,体内Cd从膀胱到尿液的转移速率可能会下降,导致Cd在体内的累积[42]。因此,针对20至60岁这一特定年龄段的人群,其Cd暴露风险应引起重视。青少年群体的生理参数 (20岁以下) ,如器官大小、代谢速率等,通常与成年人有所不同。由于这些参数可能随着年龄而变化,针对青少年的准确数据相对较少。本研究采用成年人的生理代谢参数值进行研究区U-Cd预测,因此该群体的预测结果不确定性较大。ZHANG等[46]和LI等[47]研究表明,相较于成年人,青少年在面对相同水平的重金属暴露时,会经历更严重的健康影响。因此,未来的研究应优化青少年人群的Cd暴露模型,特别是对准确估算青少年群体的尿液中Cd含量方面。
-
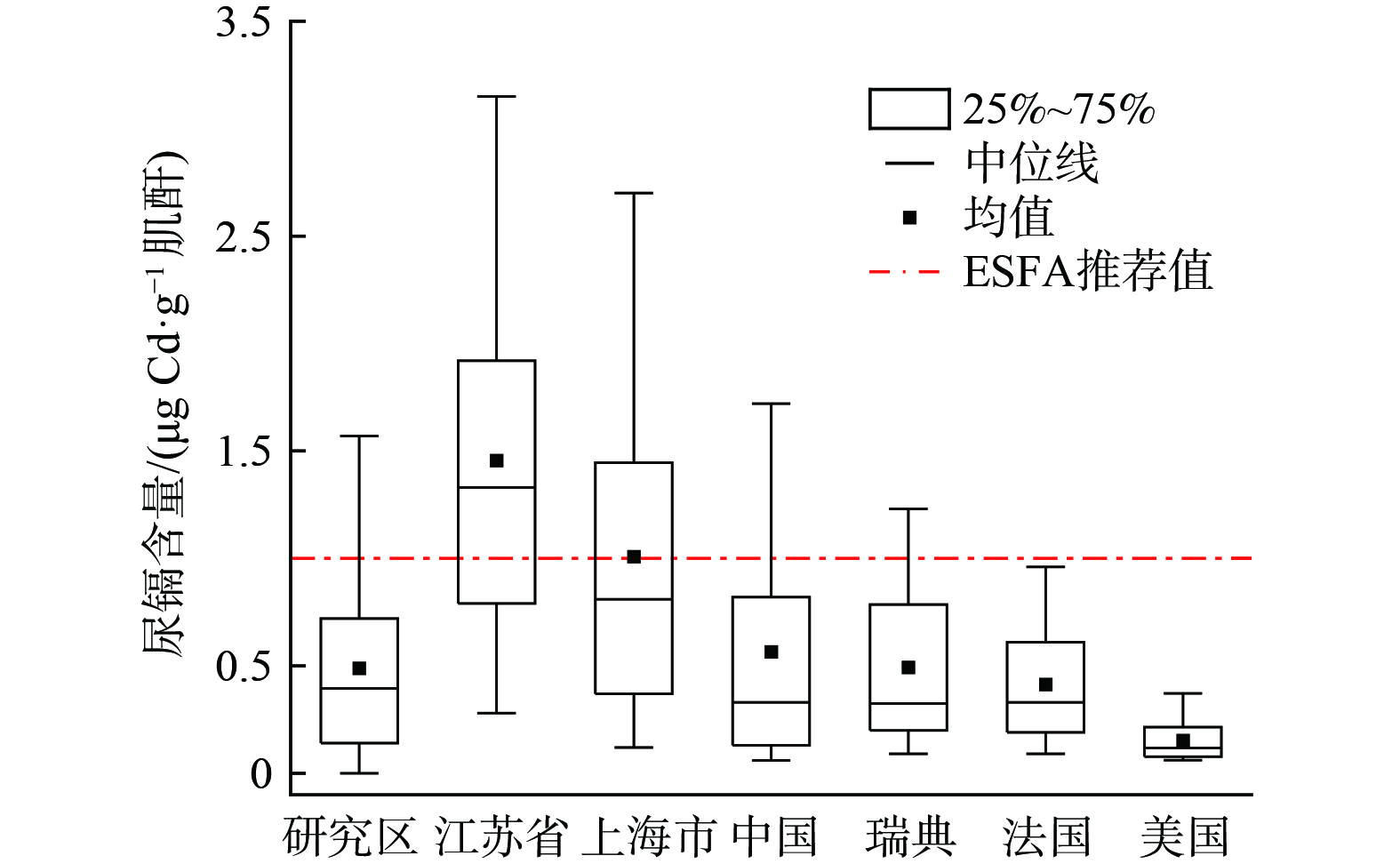
图5展示了模型预测的U-Cd含量 (研究区) 与实际观测U-Cd含量 (江苏省、上海市、中国、瑞典、法国和美国) 的对比。研究区预测的女性和男性U-Cd含量范围分别0.13~1.60 μg·g−1肌酐与0.07~0.80 μg·g−1肌酐,几何平均值分别为0.59 μg·g−1肌酐与0.29 μg·g−1肌酐,低于国内南方地区与国内总体人群U-Cd这些差异可能源于多种因素。研究区位于我国北方地区,人群主食主要为小麦,南方人群多以大米为主食,而大米是膳食Cd暴露主要贡献者[48]。值得注意的是,预测的研究区U-Cd含量高于欧美国家人群的相应水平。这可能与该地区频繁的工业活动,尤其是是矿产开采和冶炼作业有关,这些活动使环境中Cd含量的增加,从而增加居民暴露于Cd的风险。SONG等[48]研究表明,小麦是中国北方居民的主食,其Cd摄入量所占膳食总Cd摄入的 10.5%。相比之下,欧美国家居民的饮食习惯不同,其对应的Cd暴露水平较低。研究区土壤严重受到Cd严重污染,居民通过食用含Cd的小麦长期暴露于Cd污染的食物中。
本研究中预测的U-Cd含量与其他现有文献报道的数据具有一定可比性。WANG等[19]研究了废弃物拆解厂工人的U-Cd含量,发现职业拆解人员和非职业拆解人员U-Cd含量几何平均值分别为0.72 μg·L−1和0.50 μg·L−1。LIU等[14]对研究区居民U-Cd含量进行了预测,在5.34 μg·kg·bw−1·wk−1的Cd暴露下,70岁男性和女性的U-Cd含量最大值分别为0.71、1.53 μg·g−1肌酐。Cao 等[49]对2017-2018年全国大型居民队列的尿液样本进行了调查,结果显示该期间居民尿镉的几何平均值为0.32 μg·g−1肌酐。这些比较显示,尽管存在一定的可比性,但也揭示了不同人群和环境条件下U-Cd含量的差异。本研究的模型预测结果提供了一个评估和理解U-Cd含量的有用框架,同时也强调了收集更全面暴露数据的重要性。
PBTK模型在评估特定化学物质的人体暴露风险中具有广泛应用[14-16]。其通过模拟不同暴露情境下的生物代谢动态,可以预测化学物质在人体内的浓度变化和潜在毒性效应[15]。对于环境和职业暴露研究,PBTK模型可以提供定量分析,帮助理解不同暴露情境下的人体健康风险[50]。然而PBTK模型对输入数据的质量要求较高,包括生理参数、化学物质的动力学参数等[51]。缺乏准确的输入数据可能限制模型的精度和可靠性。模型通常基于平均生理参数和代谢速率,而实际个体之间存在差异,如吸烟行为、饮食模式以及职业暴露历史等,这些差异可能影响模型预测的准确性[16]。饮食是大多数人群暴露于Cd的主要途径,而吸烟则是人体Cd暴露的次要来源。烟草在生长过程中富集Cd,通过吸烟行为进入人体,引发一系列健康问题,对人类健康构成潜在威胁[35]。为了提高模型的准确性和适用性,未来研究应当着重于收集更为详尽的暴露信息。更全面的数据将为模型提供更为坚实的基础,从而更准确地反映U-Cd含量,并为健康风险评估提供更为可靠的支持。
-
本研究将PBTK模型应用到健康风险中,通过模拟Cd元素在体内的分布和排泄过程,并以U-Cd含量作为生物标志物来评估Cd对人体的潜在健康风险。案例分析揭示了研究区域内小麦籽粒Cd含量超标情况较严重,且变异系数大,居民经食用小麦而摄入Cd的风险较高,需引起重视。PBTK模拟结果表明,U-Cd含量随年龄的增长而上升。女性的U-Cd含量是男性的2倍,表明女性面临更高的健康风险,风险管理时应更注意女性群体。PBTK模型的应用不仅增加了我们对体内生物过程的理解,还有助于提高食品安全风险评估水平。该模型的不断发展和完善将为健康风险评估提供更加准确和可靠的工具。
基于PBTK模型评估北方地区膳食镉暴露人体健康风险
Risk assessment of dietary cadmium exposure on human health in northern China based on PBTK model
-
摘要: 镉 (Cd) 是一种有毒重金属,可通过食物链传递到人体,对人体健康构成威胁。基于生理学的毒物动力学 (PBTK) 模型是量化人类暴露于环境元素的有用工具。基于PBTK模型,结合大面积区域调查数据,预测北方某小麦主产区居民因食用受Cd污染的食物而可能出现的尿镉 (U-Cd) 水平。研究结果显示,区域内57.8%小麦籽粒Cd含量超过国家食品安全限量标准 (0.1 mg·kg−1) 。区域人群中约35.1%的个体Cd摄入量超过JECFA的推荐安全值 (0.8 μg·(kg·d−1)) ,高达70.8%的个体超过EFSA的推荐值 (0.36 μg·(kg·d−1)) 。PBTK模型模拟结果显示,随着年龄增长,区域人群U-Cd含量呈上升趋势。70岁女性和男性U-Cd含量分别达到1.60 μg·g−1肌酐和0.80 μg·g−1肌酐。70岁女性U-Cd含量是男性的两倍且超过EFSA推荐的U-Cd含量安全限值 (1 μg·g−1肌酐) 。PBTK模型的应用能够预测不同暴露人群中U-Cd的累积水平,对于制定有效的区域Cd污染防治策略具有重要意义,并为食品安全风险评估提供科学依据。Abstract: Cadmium (Cd) is a toxic heavy metal that poses a threat to human health through food chain contamination. Physiologically Based Toxicokinetic (PBTK) modeling is a valuable tool to quantify human exposure to environmental elements. Based on PBTK modeling, combined with extensive regional survey data, the potential urinary Cd (U-Cd) concentrations due to the consumption of Cd-contaminated food by the inhabitants of a major wheat-producing area in northern China were predicted. Results showed that 57.8% of the wheat grain samples exceeded the national food safety threshold value for Cd (0.1 mg·kg−1). Approximately 44.8% of residents had Cd intake concentrations surpassing the safe limit recommended by Joint FAO/WHO Expert Committee on Food Additives (JECFA) (0.8 μg·(kg·d−1)), while a significant 70.8% surpassed the European Food Safety Authority (EFSA) recommended intake value (0.36 μg·(kg·d−1)) for Cd intake. PBTK modeling showed an increasing trend of U-Cd concentrations with age among the population. The U-Cd concentrations for 70-year-old females and males reached 1.60 μg·g−1 creatinine and 0.80 μg·g−1 creatinine, respectively. The U-Cd concentration for 70-year-old females was twice that of males and exceeded the EFSA recommended safety limit value (1 μg·g−1 creatinine) for U-Cd concentration. The application of the PBTK modeling for forecasting U-Cd accumulation across varied exposure groups is crucial in formulating effective regional measures to mitigate Cd contamination, thereby offering a scientific foundation for food safety risk assessment.
-
Key words:
- cadmium (Cd) /
- dietary exposure /
- urinary cadmium (U-Cd) /
- toxicokinetic modeling /
- health risk
-

-
表 1 PBTK模型中参数的初始范围和最终值
Table 1. Initial ranges of parameter values of multi-compartment PBTK model
参数 定义 最低限 最高限 最终值 参考文献或来源 I 每周膳食Cd摄入量 (μg·(kg·d)−1) 0.21 12.3 5.88 公式(9) C1 胃肠道吸收Cd速率 0.03 0.1 女性0.1,男性0.05 [14] C2 血浆Cd转移到其他组织的速率 0.4 0.5 0.5 [14] C3 血浆Cd转移到肝脏的速率 0.09 0.25 0.094 [14] C4 肝脏Cd转移到金属硫蛋白的速率/Day−1 0.000 1 0.000 3 0.000 14 [14] C5 金属硫蛋白Cd转移到肾脏的速率/Day−1 0.1 0.15 0.13 [14] C6 肾脏Cd转移到尿液的速率 0.000 02 0.002 0.000 022 [14] C7 血浆Cd转移到金属硫蛋白的速率 0.001 0.05 0.04 [16] C8 小麦摄入Cd转移到金属硫蛋白的比例 0.2 0.4 0.25 [16] 表 2 健康风险评估模型参数取值
Table 2. Parameters values of health risk assessment model
参数 含义 单位 成人参考值 点位分布 参考文献或来源 IRwheat 小麦摄入量 g·d−1 310.7±60.5 正态分布 膳食习惯调查问卷 IRcorn 玉米摄入量 g·d−1 37.1 单点分布 [27] IRvegetable 蔬菜摄入量 g·d−1 99.9 单点分布 [27] IRfruit 水果摄入量 g·d−1 45.6 单点分布 [27] IRnuts 坚果摄入量 g·d−1 26.2 单点分布 [27] BW 体重 kg 61.38±11.7 正态分布 国民体质调查 EF 暴露频率 d·a−1 180、345和365 三角分布 [28] ED 暴露年限 a 24 单点分布 [28] AT 平均暴露时间 d ED×365 单点分布 [28] 表 3 研究区土壤和食物Cd含量特征
Table 3. Dietary Cd concentration in the study area
项目 最大值/
(mg·kg−1)最小值/
(mg·kg−1)中位数/
(mg·kg−1)平均值/
(mg·kg−1)标准差/
(mg·kg−1)变异系数/% 土壤 20.67 0.20 0.97 1.52 2.20 144.53 小麦 1.64 0.02 0.12 0.20 0.20 102 玉米 0.22 0.001 0.005 0.006 0.025 4.17 蔬菜 0.62 0.005 0.17 0.24 0.28 1.17 水果 0.02 0.002 0.005 0.007 0.006 0.86 坚果 0.10 0.005 0.009 0.018 0.025 1.39 -
[1] ZHAO F J, MA Y, ZHU Y G, et al. Soil contamination in china: Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759. [2] SATARUG S. Dietary cadmium intake and its effects on kidneys[J]. Toxics, 2018, 6(1): 15. doi: 10.3390/toxics6010015 [3] ZHANG Y, LIU Z, WANG Z, et al. Health risk assessment of cadmium exposure by integration of an in silico physiologically based toxicokinetic model and in vitro tests[J]. Journal of Hazardous Materials, 2023, 443: 130191. doi: 10.1016/j.jhazmat.2022.130191 [4] ÅKESSON A, CHANEY R L. Cadmium exposure in the environment: Dietary exposure, bioavailability and renal effects[J]. Encyclopedia of Environmental Health, 2019, 1: 475-484. [5] SATARUG S, VESEY D A, GOBE G C. Health risk assessment of dietary cadmium intake: Do current guidelines indicate how much is safe?[J]. Environmental Health Perspectives, 2017, 125(3): 284-288. doi: 10.1289/EHP108 [6] CHENG X, NIU Y, DING Q, et al. Cadmium exposure and risk of any fracture: A prisma-compliant systematic review and meta-analysis[J]. Medicine, 2016, 95(10): e2932. doi: 10.1097/MD.0000000000002932 [7] LI H, ZHOU Y, XIN W, et al. Wheat breeding in northern china: Achievements and technical advances[J]. The Crop Journal, 2019, 7(6): 718-729. doi: 10.1016/j.cj.2019.09.003 [8] LIAN M, WANG J, SUN L, et al. Profiles and potential health risks of heavy metals in soil and crops from the watershed of xi river in northeast china[J]. Ecotoxicology and Environmental Safety, 2019, 169: 442-448. doi: 10.1016/j.ecoenv.2018.11.046 [9] ZHANG R, CHEN T, ZHANG Y, et al. Health risk assessment of heavy metals in agricultural soils and identification of main influencing factors in a typical industrial park in northwest china[J]. Chemosphere, 2020, 252: 126591. doi: 10.1016/j.chemosphere.2020.126591 [10] USEPA. Exposure factors handbook: 2011 edition [M]. Washington DC: Office of research and development, 2011. [11] REN Y, LIN M, LIU Q, et al. Contamination assessment, health risk evaluation, and source identification of heavy metals in the soil-rice system of typical agricultural regions on the southeast coast of china[J]. Environmental Science and Pollution Research, 2021, 28: 12870-12880. doi: 10.1007/s11356-020-11229-6 [12] YANG S, FENG W, WANG S, et al. Farmland heavy metals can migrate to deep soil at a regional scale: A case study on a wastewater-irrigated area in china[J]. Environmental Pollution, 2021, 281: 116977. doi: 10.1016/j.envpol.2021.116977 [13] XU J, LI Y, WANG S, et al. Sources, transfers and the fate of heavy metals in soil-wheat systems: The case of lead (pb)/zinc (zn) smelting region[J]. Journal of Hazardous Materials, 2023, 441: 129863. doi: 10.1016/j.jhazmat.2022.129863 [14] LIU X, ZHONG L, MENG J, et al. A multi-medium chain modeling approach to estimate the cumulative effects of cadmium pollution on human health[J]. Environmental Pollution, 2018, 239: 308-317. doi: 10.1016/j.envpol.2018.04.033 [15] KJELLSTRÖM T, NORDBERG G F. A kinetic model of cadmium metabolism in the human being[J]. Environmental Research, 1978, 16(1-3): 248-269. doi: 10.1016/0013-9351(78)90160-3 [16] QING Y, YANG J, ZHANG Q, et al. Bayesian toxicokinetic modeling of cadmium exposure in chinese population[J]. Journal of Hazardous Materials, 2021, 413: 125465. doi: 10.1016/j.jhazmat.2021.125465 [17] NORDBERG G F, FOWLER B A, NORDBERG. Handbook on the toxicology of metals (3rd ed. )[M]. Academic Press, 2007. [18] ZHAO D, WANG P, ZHAO F J. Dietary cadmium exposure, risks to human health and mitigation strategies[J]. Critical Reviews in Environmental Science and Technology, 2023, 53(8): 939-963. doi: 10.1080/10643389.2022.2099192 [19] WANG H, HAN M, YANG S, et al. Urinary heavy metal levels and relevant factors among people exposed to e-waste dismantling[J]. Environment International, 2011, 37(1): 80-85. doi: 10.1016/j.envint.2010.07.005 [20] AMZAL B, JULIN B, VAHTER M, et al. Population toxicokinetic modeling of cadmium for health risk assessment[J]. Environmental Health perspectives, 2009, 117(8): 1293-1301. doi: 10.1289/ehp.0800317 [21] QIU K, XING W, SCHECKEL K G, et al. Temporal and seasonal variations of as, cd and pb atmospheric deposition flux in the vicinity of lead smelters in jiyuan, china[J]. Atmospheric Pollution Research, 2016, 7(1): 170-179. doi: 10.1016/j.apr.2015.09.003 [22] XING W, ZHANG H, SCHECKEL K G, et al. Heavy metal and metalloid concentrations in components of 25 wheat (triticum aestivum) varieties in the vicinity of lead smelters in henan province, china[J]. Environmental Monitoring and Assessment, 2016, 188: 1-10. doi: 10.1007/s10661-015-4999-z [23] 吴小勇, 牛硕, 杨阳, 等. 区域农田镉含量空间变异与综合风险的不确定性评估[J]. 环境工程学报, 2023, 17(9): 3038-3045. doi: 10.12030/j.cjee.202307024 [24] LI Y, CHEN W, YANG Y, et al. Quantifying source-specific intake risks of wheat cadmium by associating source contributions of soil cadmium with human health risk[J]. Ecotoxicology and Environmental Safety, 2021, 228: 112982. doi: 10.1016/j.ecoenv.2021.112982 [25] YANG Y, LI Y, CHEN W, et al. Dynamic interactions between soil cadmium and zinc affect cadmium phytoavailability to rice and wheat: Regional investigation and risk modeling[J]. Environmental Pollution, 2020, 267: 115613. [26] USEPA, Risk assessment guidance for superfund, Volume I: Human health evaluation manual part A[M]. Environmental Protection Agency, Washington, D. C. 1989. [27] 环境保护部. 中国人群暴露参数手册[M]. 北京: 中国环境科学出版社, 2013. [28] UNITED STATES. Environmental protection agency. Office of health, environmental assessment. Exposure assessment group. Exposure factors handbook[M]. Office of Health and Environmental Assessment, US Environmental Protection Agency, 1989. [29] PENG C, WANG M, CHEN W. Modelling cadmium contamination in paddy soils under long-term remediation measures: Model development and stochastic simulations[J]. Environmental Pollution, 2016, 216: 146-155. doi: 10.1016/j.envpol.2016.05.038 [30] YANG Y, NIU S, WANG T, et al. Source-soil-rice-human multi-objective optimization to minimize the cadmium intake risk to consumers of field planting rice[J]. Journal of Hazardous Materials, 2023, 441: 129984. doi: 10.1016/j.jhazmat.2022.129984 [31] 李如忠, 潘成荣, 徐晶晶, 等. 基于Monte Carlo模拟的潜在生态危害指数模型及其应用[J]. 环境科学研究, 2012, 25(12): 1336-1343. [32] GB 2762-2022 食品安全国家标准食品中污染物限量[S]. [33] EFSA. Comparison of the approaches taken by EFSA and JECFA to establish a HBGV for cadmium [EB/OL]. 2006. [2024-05-14]. https://www.efsa.europa.eu/en/efsajournal/pub/2006. [34] FAO/WHO. Evaluation of certain food additives and contaminants (seventy-third report of the joint fao/who expert committee on food additives) [EB/OL]. 2011. [2024-05-14]. https://www.who.int/publications/i/item/9789241209601. [35] SATARUG S, SWADDIWUDHIPONG W, RUANGYUTTIKARN W, et al. Modeling cadmium exposures in low-and high-exposure areas in Thailand[J]. Environmental health perspectives, 2013, 121(5): 531-536. doi: 10.1289/ehp.1104769 [36] YANG L, ZHANG X, ZHAO D, et al. Relative bioavailability of cadmium in rice: Assessment, modeling, and application for risk assessment[J]. Foods, 2023, 12(5): 984. doi: 10.3390/foods12050984 [37] MENKE A, MUNTNER P, SILBERGELD E K, et al. Cadmium levels in urine and mortality among US adults[J]. Environmental health perspectives, 2009, 117(2): 190-196. doi: 10.1289/ehp.11236 [38] ZHAO D, LIU R Y, XIANG P, et al. Applying cadmium relative bioavailability to assess dietary intake from rice to predict cadmium urinary excretion in nonsmokers[J]. Environmental Science & Technology, 2017, 51(12): 6756-6764. [39] JÄRUP L, ÅKESSON A. Current status of cadmium as an environmental health problem[J]. Toxicology and applied pharmacology, 2009, 238(3): 201-208. doi: 10.1016/j.taap.2009.04.020 [40] CHAUMONT A, VOISIN C, DEUMER G, et al. Associations of urinary cadmium with age and urinary proteins: further evidence of physiological variations unrelated to metal accumulation and toxicity[J]. Environmental health perspectives, 2013, 121(9): 1047-1053. doi: 10.1289/ehp.1306607 [41] EFSA PANEL ON CONTAMINANTS IN THE FOOD CHAIN (CONTAM). Statement on tolerable weekly intake for cadmium[J]. EFSA Journal, 2011, 9(2): 1975. [42] VAHTER M, ÅKESSON A, LIDEN C, et al. Gender differences in the disposition and toxicity of metals[J]. Environmental Research, 2007, 104(1): 85-95. doi: 10.1016/j.envres.2006.08.003 [43] ÅKESSON A, BARREGARD L, BERGDAHL I A, et al. Non-renal effects and the risk assessment of environmental cadmium exposure[J]. Environmental Health Perspectives, 2014, 122(5): 431-438. doi: 10.1289/ehp.1307110 [44] SATARUG S, SWADDIWUDHIPONG W, RUANGYUTTIKARN W, et al. Modeling cadmium exposures in low-and high-exposure areas in Thailand[J]. Environmental health perspectives, 2013, 121(5): 531-536. [45] ENGSTRÖM A, MICHAËLSSON K, SUWAZONO Y, et al. Long‐term cadmium exposure and the association with bone mineral density and fractures in a population‐based study among women[J]. Journal of Bone and Mineral Research, 2011, 26(3): 486-495. doi: 10.1002/jbmr.224 [46] ZHANG Y, WANG S, GAO Z, et al. Contamination characteristics, source analysis and health risk assessment of heavy metals in the soil in Shi River Basin in China based on high density sampling[J]. Ecotoxicology and Environmental Safety, 2021, 227: 112926. doi: 10.1016/j.ecoenv.2021.112926 [47] LI Y, ZHOU S, JIA Z, et al. Temporal and spatial distributions and sources of heavy metals in atmospheric deposition in western Taihu Lake, China[J]. Environmental Pollution, 2021, 284: 117465. doi: 10.1016/j.envpol.2021.117465 [48] SONG Y, WANG Y, MAO W, et al. Dietary cadmium exposure assessment among the Chinese population[J]. PloS one, 2017, 12(5): 0177978. [49] CAO Z, LIN S, ZHAO F, et al. Cohort profile: China National Human Biomonitoring (CNHBM)-A nationally representative, prospective cohort in Chinese population[J]. Environment International, 2021, 146: 106252. doi: 10.1016/j.envint.2020.106252 [50] BECHAUX C, BODIN L, CLEMENÇON S, et al. PBPK and population modelling to interpret urine cadmium concentrations of the French population[J]. Toxicology and applied pharmacology, 2014, 279(3): 364-372. doi: 10.1016/j.taap.2014.06.026 [51] POUILLOT R, FARAKOS S S, SPUNGEN J, et al. Cadmium physiologically based pharmacokinetic (PBPK) models for forward and reverse dosimetry: Review, evaluation, and adaptation to the US population[J]. Toxicology Letters, 2022, 367: 67-75. doi: 10.1016/j.toxlet.2022.07.812 -



 下载:
下载: