-
排水管道是收集和传输污水至污水处理厂的重要基础设施。管道中复杂的环境特征,可能会产生CH4、H2S及N2O等气体。传统上,排水管道以重力流为主 (~95%) ,在该环境下管底厌氧与顶空好氧环境并存,故周圈管道壁会形成不同厚度的生物膜。而在特殊情况下 (~5%) ,排水有时会采用压力流方式输送,此时的管道内只存在厌氧环境[1]。重力流排水管道因顶空存在氧 (O2) 而使得管壁形成的生物膜与压力流完全不同,其顶空生物膜往往因氧传质作用而形成外层好氧、中层缺氧、内层厌氧环境,而被水淹没管壁生物膜一般为缺氧或厌氧环境[2]。生物膜厌氧环境会导致甲烷 (CH4) 和硫化氢 (H2S) 气体产生,而好氧环境则会诱发硝化、随后缺氧反硝化,从而导致氧化亚氮 (N2O) 产生[3]。N2O是强温室气体 (温室效应是CO2的265倍) ,大气中N2O质量浓度增加与全球变暖、臭氧层破坏和酸雨三大环境问题密切相关,具有很强的环境破环能力[3];CH4也是强温室气体,其温室效应是CO2的28倍,同时与H2S一样是容易出现安全隐患的有毒、有害、腐蚀性或易爆性气体[3]。面对我国“双碳”目标以及现实中频发的检查井燃爆 (CH4) 与清淤致死 (H2S) 事故,有必要厘清产生这3种有害气体的路径与机理,同时提出控制其产生的策略。
排水管道内生化反应主要发生于管壁生物膜与底部沉积物中,是CH4、H2S及N2O等气体产生的主要位点。而水相与气相生物量作用相对较小,其气体产生概率几乎可以忽略不计[4]。污水中所含有机物 (COD) 、氮 (N) 和硫酸盐 (SO42−) 是产生这些气体的主要根源,产生的气体往往不可控而又常被忽略。本文综述上述各气体产生机理,并基于机理提出相应的气体减排策略,为进一步碳减排提供参考。
-
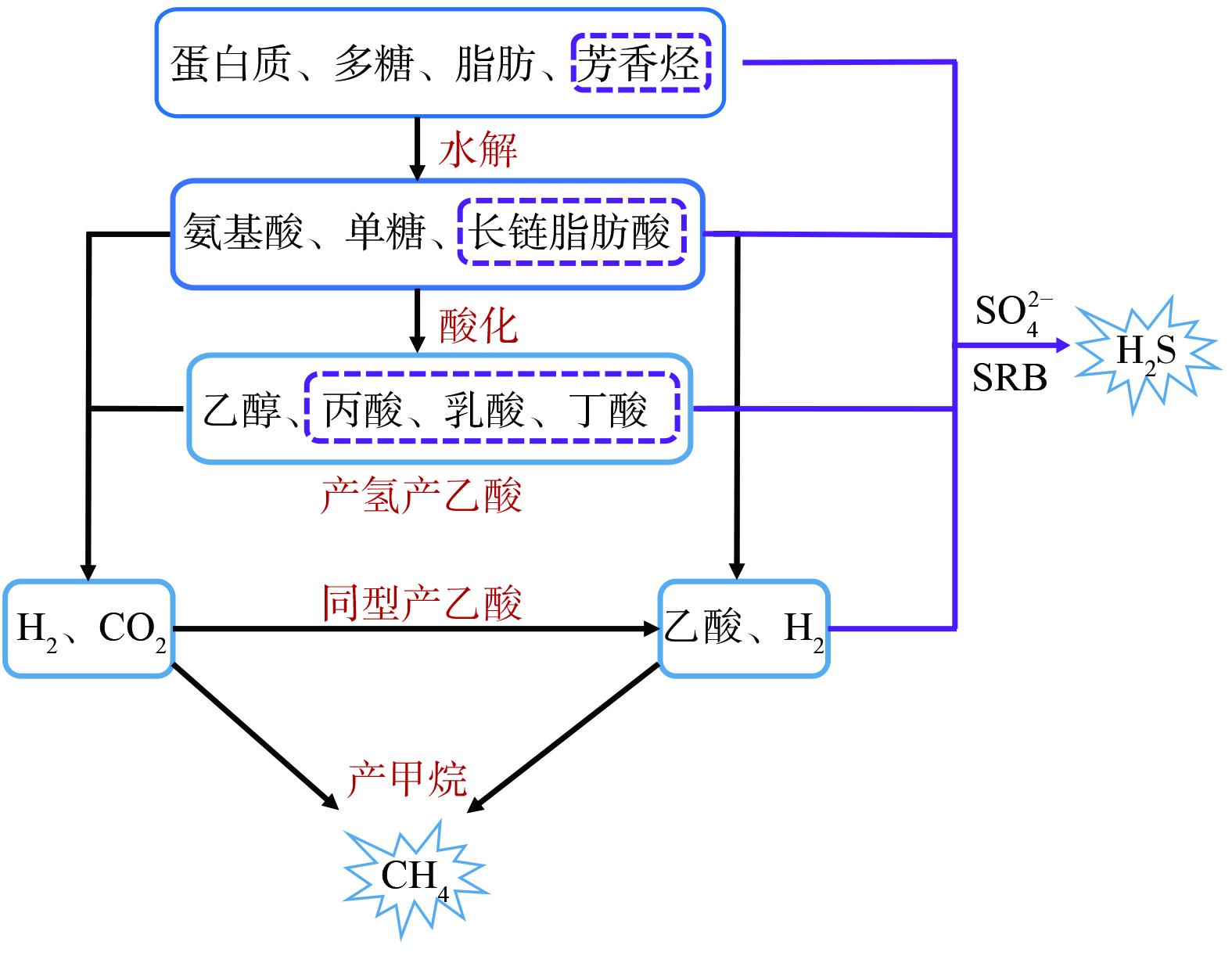
排水管道中所含硫酸盐 (SO42− =40~200 mg·L−1) [5]与充足碳源 (COD=200~500 mg·L−1) [6]可为厌氧的硫酸盐还原菌 (sulfate reducing bacteria,SRB) 和产甲烷菌 (methanogenic archaea,MA) 提供底物,同步以COD或H2作为电子供体产生CH4和H2S;MA产CH4与SRB产H2S过程总结于图1。SO42− 渗透能力有限,所以,SRB往往都位于厌氧生物膜与沉积物表层,只要环境条件具备很容易产生H2S。MA则位于生物膜与沉积物内层,需要与其前端产酸细菌接力方能产生CH4[7]。
-
如图1所示,有机大分子水解乃排水管道厌氧环境产CH4第一步;吸附于微生物表面或分布于水中的胞外水解酶会将蛋白质、多糖、脂肪水解为溶解性单体 (氨基酸、单糖、长链脂肪酸) 。之后,在酸化过程中,溶解性单体有机物在酸化细菌胞内酶催化下,可进一步被转化为挥发性脂肪酸 (volatile fatty acids,VFAs) 与乙醇,VFAs如乳酸、丙酸、丁酸等。接着,产氢产乙酸细菌会在胞内酶催化作用下将VFAs与乙醇转化为乙酸和H2 (伴随CO2产生) 。与此同时,H2与CO2亦能由同型产乙酸菌转化为乙酸。最后,MA从两种途径分别将乙酸 (异养产甲烷菌,~90%) 和H2+CO2 (自养产甲烷菌,~10%) 转化为CH4[7]。
MA是严格的专性厌氧菌,主要位于排水管道沉积物和厌氧生物膜系统内层 (丰度75%) ,而表层MA很少 (丰度3%) [7]。沉积物中MA产CH4水平略高于生物膜,这显然与MA丰度有关,例如,重力流排水管道沉积物CH4平均产率为 (1.56±0.14) g· (m2·d) −1,而压力流排水管道生物膜系统 (一般无沉积物) CH4产率为1.26 g· (m2·d) −1[6]。重力流排水管道因存在顶空,沉积物及生物膜产生的CH4会从液相中溢出,进而排放到顶空气相,所以,液相中CH4质量浓度并不高 (0.1~13.7 mg·L−1) 。雨季时,由于合流制重力流排水管道污水流量增大,有机污染物 (以COD计) 被稀释、流速加快、水力停留时间 (HRT) 变短,使得重力流排水管道沉积物与生物膜系统受到水力冲击负荷,MA丰度降低,CH4质量浓度降低至0.1~11.4 mg·L−1,故液相中CH4质量浓度与HRT呈正相关关系;在旱季时,重力流排水管道液相中CH4质量浓度可高达8~13.7 mg·L−1。压力流排水管道因满管而无顶空,产生的CH4全部存在于液相中,其质量浓度高达3.4~33 mg·L−1,浓度高低取决于HRT、排水管道的面积体积比、管道进水COD及温度,且出现夏季高、冬季低之现象 (温度影响) [3,6]。重力流排水管道液相中的CH4会在水流扰动作用下大多释放于顶空气相,导致检查井中气相CH4质量浓度可达46~35 714 mg·m−3[6],且也呈现出旱季质量浓度高 (9 643~16 429 mg·m−3) 、雨季质量浓度低 (46~13 571 mg·m−3) 的现象[8]。在重力流管道检查井气相中,CH4质量浓度35 714 mg·m−3 已达CH4爆炸下限浓度值[6]。这时若遇上检查井通气孔堵塞等极端情况,聚积的大量CH4遇火星会引发爆炸事故。此外,泵站由于水流较为湍急,其液相释放于气相中的CH4质量浓度亦不可小觑,有研究发现泵站气相中的CH4质量浓度可高达2 000 mg·m−3 [6]。
在生物膜和沉积物中产生的CH4也会在厌氧、缺氧和好氧环境下被微生物所氧化[9]。重力流管道顶空生物膜因氧传质存在溶解氧 (DO) 浓度梯度,会形成外层好氧、中层缺氧、内层厌氧环境;SO42− 和O2能分别作为甲烷氧化细菌厌氧、好氧环境下的末端电子受体,从而完成CH4氧化过程。在缺氧环境下,利用硝酸氮 (NO3−) 作为电子受体的甲烷氧化 (denitrifying anaerobic methane oxidation,DAMO) 过程已经被实验证实[6]。然而,CH4氧化过程十分缓慢,湖泊或海洋沉积物中好氧或厌氧CH4氧化速率仅为0.02 g· (m2·d) −1[6]。
-
SRB是严格的厌氧细菌,生长速率相当缓慢,但有着极强的生存能力。大部分SRB是化能有机营养型 (异养) 细菌,以有机化合物作为电子供体与碳源 (少数自养型SRB亦能以H2作为电子供体、CO2作为碳源) ,将SO42− 还原为S2−;在不同pH条件下,S2−与H+相结合,以HS−或H2S形式存在于水体中。其中,S2−、HS−与H2S三者被统称为硫化物。SRB代谢过程中的电子供体来可来自于有机物芳香烃、三碳以上VFAs、乙酸及H2 [10-11] (图1) 。
SRB在排水管道生物膜系统中占细菌总数9%~16%。其中,发酵细菌为优势菌属[12]。SO42− 渗透能力有限,SRB主要位于厌氧生物膜表层;厌氧生物膜表层SRB丰度可达20%,内层仅为3%[7]。当污水中H2S质量浓度为0.1~0.5 mg·L−1时,混凝土腐蚀微弱;而当H2S质量浓度超过2 mg·L−1时,混凝土则腐蚀严重[5]。混凝土管道腐蚀速率为1.1~10 mm·a−1,可显著缩短下水管道使用寿命[5]。腐蚀致排水管道修复与维护的费用约占污水收集和处理总成本的10%[5]。重力流排水管道上游液相H2S质量浓度普遍低于2 mg·L−1,而下游液相中H2S质量浓度可达2~15 mg·L−1,气相中H2S质量浓度随温度变化较大,一般可达3~40 mg·m−3[13]。排水管道产生的H2S质量浓度与管道进水COD呈显著相关性;压力流管道COD较高时,H2S质量浓度可高达7~12 mg·L−1;而一般情况下,H2S质量浓度为4~7 mg·L−1[3]。另外,无论重力流或压力流排水管道H2S质量浓度峰值多出现于夏季,冬季质量浓度普遍较低[3]。可见,夏季排水管道中因H2S腐蚀管道、异味导致的安全问题最为严重。在排水管道中,除生物膜系统产H2S外,沉积物亦是不可忽视的H2S产生源,产量往往高于生物膜。在厌氧环境中,H2S主要产生于沉积物表层,但当水体中存在NO3−、Fe3+及DO时,产生区会迁移至更深层[1]。化粪池附近下游管道的检查井是不容忽视的H2S排放源,其气相中H2S质量浓度可高达152~607 mg·m−3[14]。 当排水管道气相中H2S质量浓度为15~76 mg·m−3 时,便会致人头晕与呼吸困难;超过152 mg·m−3 时则会令人窒息而死亡[14]。因此,工人在化粪池或排水管道作业时务必装备安全防护措施,以免发生不幸。
排水管道生物膜与沉积物中产生的H2S可分别在好氧与厌氧环境下,被专性化能自养型与光营养型微生物硫氧化细菌 (sulphide oxidizing bacteria,SOB) 氧化成单质S或SO42− 。重力流排水管道生物种属较为丰富,在顶空气相中,H2S和少量O2可被黏附于管道顶部的SOB所吸附,H2S则会被氧化为SO42− [11]。当污水中DO为0.03~0.3 mg·L−1时,H2S氧化速率极快,会被完全氧化为SO42−,甚至没有中间产物单质S形成[10]。管道内壁生物膜内存在着S微循环。当H2S气体负荷高于0.5 g S· (m3·h) −1时,生物膜对H2S的氧化速率保持不变,氧化产物为单质S。而当温度较高时,H2S氧化速率有所提高 (25 ℃时为20 ℃时的1.15倍) [10]。此外,H2S氧化生成的SO42− 通过与可腐蚀化合物 (水泥与金属) 发生反应从而破坏排水管道混泥土结构。SO42− 亦会与含钙化合物发生反应,生成CaSO4。又因硫酸钙具有膨胀性能,容易引起混泥土内部开裂和点蚀,从而降低混凝土承重能力,甚至可能导致排水管道坍塌[5]。
-
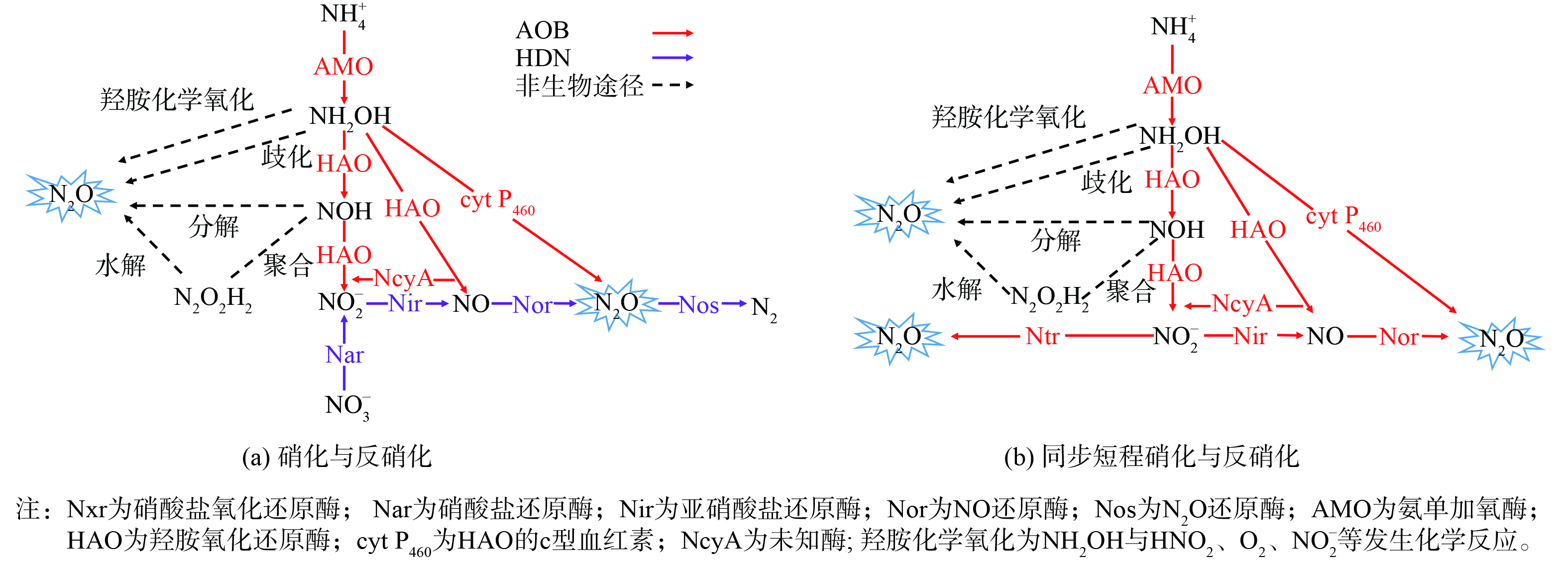
重力流排水管道中N2O排放源于硝化、反硝化脱氮过程,与管道进水氮负荷、水质特性、环境条件,以及硝化菌与反硝化菌活性、丰度呈现显著相关性[15]。排水管道N2O产生过程传统上指好氧硝化与异养反硝化,即亚硝化细菌 (ammonia oxidizing bacteria,AOB) 先将氨氮 (NH4+) 氧化为亚硝酸氮 (NO2−) ,硝化细菌 (nitrite oxidizing bacteria,NOB) 再将NO2−氧化为硝酸氮 (NO3−) 。之后,反硝化 (heterotrophic denitrifying bacteria,HDB) 细菌将NO3−还原为氮气 (N2) [16]。AOB不仅可将NH4+氧化为NO2−,亦可将NO2−还原为N2O,进行同步短程硝化与反硝化,且被认为是脱氮过程产生N2O的主要来源[17]。NOB过程并不涉及N2O产生过程[18]。图2为排水管道脱氮过程涉及N2O产生的主要生物过程和次要非生物过程,分别分析讨论各个过程N2O转化路径与机制。
-
1) AOB短程硝化途径。AOB将NH4+氧化为NO2−的生物过程主要会经历羟胺/NH2OH (由氨单加氧酶/AMO催化)与次要途径硝酰基/NOH (由羟胺氧化还原酶/HAO催化) 两个中间产物[18] (图2 (a) )。AOB可将大部分NH4+氧化为NO2−,但也存在少量“开小差”行为,即从NH2OH或NOH经生物途径 (①) 或非生物化学途径 (②) 直接转化为N2O[19]。
在生物途径中 (图2 (a) 中红色线条) 存在由NH2OH直接转化为N2O的2个生物过程:1) 一个是在无氧条件下,cyt P460 (HAO的c型血红素) 将NH2OH直接氧化为N2O[20],但此过程在好氧情况下不能发生;2) 另一个是从NH2OH向NO过渡的生物氧化过程 (由HAO催化) ,也是N2O潜在来源[18]。在此过程中,AOB能释放2个细胞色素c分子,参与AOB电子传递;其中,细胞色素之一的c554分子可作为一种NO还原酶/Nor,把由HAO催化产生的NO于菌体外还原为N2O[21],且大多数AOB中都能检测到Nor基因组[22]。高NH4+、低NO2−及NH4+氧化速率较高的条件有利于NH2OH生物氧化经NO产生N2O[23]。此外,经NH2OH生物氧化产生的NO也能逆向转化为NO2− (由未知酶/NcyA催化) [24]。
在非生物化学途径下 (图2 (a) 中黑色虚线条) ,从NH2OH和NOH化学转化N2O分别是NH2OH化学氧化或歧化[18]及NOH在好氧条件下二次聚合,生成次亚硝酸/N2O2H2后再发生水解反应产生N2O[18]。近年来,越来越多研究表明,非生物途径对于污水处理过程中N2O排放存在一定关系[18];N2O产生速率与NH4+氧化速率间呈指数关系,且指数关系可用一个基于NOH化学降解产生N2O模型来表示[18]。
因重力流排水管道中好氧、缺氧、厌氧环境并存,故可诱发硝化与反硝化反应,能按上述AOB过程产生N2O[15]。重力流排水管道中DO为0.1~4 mg·L−1[15,25]。当通风良好时,DO可超过1.0 mg·L−1,且NH4+氧化可在DO<1 mg·L−1下发生,此时AOB对O2的亲和系数为0.5 mg·L−1[15]。在雨季时,雨污合流排水管道因雨水带入DO,常常导致排水管道DO增加 (NH4+也会因雨水带入增加) 。这种情形非常有利于AOB短程硝化过程产生N2O[15]。
2) HDN反硝化途径。HDN反硝化是以有机物作为电子供体,在不同氮氧化物还原酶催化作用下将NO3−依次还原为N2的过程,如图2 (a) 中紫色线条所示。HDN参与催化反硝化过程的酶包括硝酸盐还原酶/Nar、Nir、Nor及N2O还原酶/Nos。Nos比其他反硝化还原酶具有更大的氮转换能力。据估计,Nos最大还原速率大约是Nar或Nir还原速率的4倍。这表明在缺氧或厌氧条件下,N2O可被彻底还原,并不会发生N2O积累[18]。但由于重力流管道中存在DO、H2S等因素,导致N2O在反硝化过程中会发生暂时性积累[15]。另外,有些反硝化细菌并不具备还原N2O的功能,只能把反硝化过程进行到以N2O为终产物的阶段。如荧光假单胞菌 (Pseudomonas Fluorescens) [18],由于即使反硝化作用只进行到N2O阶段,这类反硝化细菌所获得的能量已达到完全反硝化过程 (至N2) 获得总能量的约80%,而这些能量足以维持其生长需要[18]。
在重力流排水管道中,由于存在DO,N2O还原酶 (Nos) 的活性降低,致使HDN反硝化不完全产生N2O,且在通风良好的排水管道中,该作用最为明显[15]。有人利用实验室规模排水管道反应器处理人工合成污水来探究DO对HDN反硝化产生N2O的影响,发现在DO≤0.3 mg·L−1、碳源充足的情况下,HDN反硝化进行完全,N2O产生量可忽略不计;而当DO>0.4 mg·L−1,HDN反硝化受阻而致N2O大量积累与释放;另外,HDN菌活性与丰度也均有所下降[25]。在排水管道中,厌氧或缺氧环境有利于生物膜与沉积物产生具有毒性的H2S,而溶解性H2S能在较低质量浓度下有效抑制N2O还原过程,尤其是在铜元素利用率较低的情况下[15]。为避免H2S腐蚀排水管道,可通过投加NO3−药剂来氧化H2S (反硝化除硫) 而达到防腐蚀目的;但在NO3−加入后,重力流管道中微氧环境 (DO>0.4 mg·L−1) ,HDN反硝化并不完全 (反应器中不存在AOB菌种) ,使得N2O释放量会增加6倍[25]。因此,在重力流排水管道中,投加NO3−药剂控制H2S产生时,应更加关注N2O的产生[25]。
-
除了硝化途径外,AOB亦可通过反硝化途径产N2O。硝化过程中AOB反硝化作用也是活性污泥系统产生N2O不可忽视的途径,且被认为是污水脱氮过程产生N2O的主要来源[17]。AOB可在低DO或高NO2−质量浓度情况下,将NO2−逐步还原为N2O,这个过程被称为AOB反硝化作用[16]。低DO会对NOB产生明显抑制作用,使NO2−进一步氧化受阻,造成NO2−积累;此时,AOB会分泌一系列Nir、异构亚硝酸盐还原酶/Ntr、Nor等酶,而Nor酶在有氧条件下不会受到抑制,且AOB基因组中没有发现编码Nos的基因,所以,AOB反硝化终产物不是N2而是N2O (图2b) [26]。AOB在Ntr酶催化作用下可直接 (图2b中左侧水平红线) 将NO2−还原形成N2O[27],亦可在反硝化过程 (图2b中右侧水平红线) 经NO而形成N2O[26]。这2个生物途径构成了AOB产生N2O的主要途经,且在DO<1.5 mg·L−1时便会发生,至DO<0.2 mg·L−1时作用最为明显。在这样的DO条件下,NH2OH和NOH非生物化学途径亦可产生N2O,与图2 (a) 黑色虚线条路径完全一致[28]。
YU等[29]在基因表达和转录水平上进一步研究了AOB在低DO与NO2−积累条件下的反应,指出在序批式亚硝化单胞菌 (Nitrosomonas europaea) 培养指数增长阶段,当系统处于低DO条件时,AMO与HAO酶的质量浓度更高,NH4+与NH2OH代谢能力得以增强,有利于N2O产生;在实验室污水处理系统中,当NO2−质量浓度升至280 mg·L−1时,反硝化作用进一步加强,会产生更多N2O。在AOB反硝化产N2O过程中,NO2−作为电子受体,NH4+、H2、NH2OH、丙酮酸均可作为其电子供体[18],该过程类似ANAMMOX反应过程。
在重力流排水管道系统中,通风不良与流量达峰值等条件均会导致DO偏低 (<1 mg·L−1) ,而NOB对DO的亲和系数较AOB高一个数量级,故在相应DO下,NOB活性受到抑制,导致NO2−积累,引发AOB同步短程硝化与反硝化途径[15]。因此,在峰值流量期间,由于稀释作用,NH4+氧化过程会降低重力流管道氧化还原电位 (ORP) ,导致DO下降,有利于AOB反硝化产生N2O[15]。另外,在一定pH和温度条件下,且NO2−为高质量浓度时,部分NO2−将转化为游离亚硝酸 (free nitrous acid,FNA) 。FNA可抑制微生物活性,即使其质量浓度低至0.1~0.2 mg·L−1也能抑制微生物电子转移,不利于下游污水处理厂的脱氮除磷[16]。因此,为抑制AOB反硝化途径产生N2O,避免低DO与NO2−积累是关键所在。
上述N2O产生机理表明,重力流排水管道是不可忽视的N2O排放源[15]。在收集生活污水、商业与工业混合废水的重力流排水管道中,DO为0.5~3.5 mg·L−1,N2O质量浓度可达1.0~43 μg·L−1。其中,旱季常规流量期间,污水流量低,水力停留时间较长,通风良好的重力流管道上方顶空DO较高 (DO>1.5 mg·L−1) 时,经AOB短程硝化与其非生物化学途径和HDN反硝化不完全所排放的N2O可达1~5 μg·L−1。在峰值流量期间,因污水流量增大,HRT较短,重力流管道上方顶空DO降低 (<1.5 mg·L−1) 而导致NO2−积累,且当DO=0.2 mg·L−1时,AOB同步短程硝化与反硝化及其非生物化学途径和HDN反硝化不完全所排放的N2O可达43 μg·L−1质量浓度峰值。因此,N2O质量浓度与HRT呈线性相关[15]。另外,在雨季时,由于雨水富含DO,在雨污合流管道及管道破损致雨水渗入情况下,污水中的N2O质量浓度可高达6.1~12.7 μg·L−1,这归因于雨污合流致排水管道DO及NH4+负荷增加。当DO<1.5 mg·L−1时,该条件有利于AOB同步短程硝化与反硝化,以及非生物化学途径和HDN反硝化不完全产生N2O,且出现质量浓度的峰值;反之,高DO有利于AOB短程硝化与其非生物化学途径和HDN反硝化不完全产生N2O,且出现质量浓度的谷值[3]。由此可见,与旱季相比,雨季重力流管道中的N2O质量浓度会有所上升。此外,当重力流排水管道同时接收工业废水与生活污水时,N2O质量浓度可高达298 μg·L−1,这是由于重力流管道水量少、水位低,顶部存在充足的好氧空间,DO较高、碳源不足,HDN反硝化严重受阻进而产生大量N2O,亦有利于AOB经生物与非生物途径产生N2O[3]。尽管重力流排水管道所排放的N2O质量浓度值与污水二级生物处理反应器产生的N2O质量浓度 (0.05~2 mg·L−1) 相比较低[15],但重力流管道产生的N2O仍不容小觑,可视为潜在N2O排放源。
表1表明,压力流排水管道因满管而无顶空,产生的CH4全部存在于液相中。重力流排水管道因非满管存在顶空,液相中产生的CH4与H2S会在水流扰动的作用下溢出进入气相。另外,重力流排水管道因存在微氧环境,会诱发行硝化与反硝化和AOB同步短程硝化与反硝化途径,从而产生N2O。
-
基于上述机理分析,可通过破坏排水管道厌氧环境,直接抑制MA与SRB活性,以及生物或化学氧化与化学沉淀等方式间接降低CH4与H2S排放,从而达到减排目的。向排水管道中注入氮氧化物 (NO3−与NO2−) 、O2、金属盐、碱性、游离亚硝酸 (FNA) 等药剂可直接或间接控制CH4与H2S排放。
1) 投加氮氧化物等氧化剂。氮氧化物形式氧化剂诱导排水管道产生缺氧环境是一种广泛应用于降低CH4与H2S排放的控制策略[12]。NO3−控制H2S产生机制有:a) SRB与HDN菌之间竞争有机电子供体;b) NO3−还原过程中间体增加降低H2S产生;c) HDN反硝化过程致pH增加,减少了H2S由液相向气相释放;d) NO3−加入后,自养型硫化物氧化NO3−还原菌 (sulfides oxidizing nitrate reducing bacteria,soNRB) 活性增强,将氧化硫化物与NO3−还原相结合 (反硝化除硫) ,从而实现对H2S控制[30]。然而,需要注意的是,添加NO3−并不会抑制SRB活性,而一旦NO3−耗尽,厌氧环境恢复,溶解性H2S产生系统便会重建[31]。在压力流管道中加入NO3−为10 mg·L−1时,可使H2S质量浓度由4.2 mg·L−1降至0.2 mg·L−1[32]。投入40 mg·L−1的NO3−于实验室规模压力流管道中,在3~4 d后,H2S质量浓度从10~20 mg·L−1降至2~3 mg·L−1[4]。在重力流管道中,由于顶空存在空气流动空间,5 mg·L−1的NO3−足以抑制H2S产生[4]。
NO3−不仅会破坏排水管道系统中的厌氧环境,亦能增加ORP并抑制MA代谢过程。与SRB相比,MA通常位于排水管道生物膜或沉积物内层,NO3−因渗透能力有限而难以抵达其内层。因此,需投入更高剂量的NO3−,方可有效抑制CH4产生[6]。长期添加质量浓度为30 mg·L−1的NO3−可导致压力流管道中MA活性降低90%[30]。现场实验表明,持续投加质量浓度为17 mg·L−1的NO3−达6 h,排水管道液相溶解的CH4会从6 mg·L−1减至2 mg·L−1,且气相中的CH4从571 mg·m−3降至214 mg·m−3[33]。现场实验进一步表明,在一次性投加冲击负荷剂量50 mg·L−1的NO3−后,CH4产量减少了27%,但在停止投加药剂2 d后CH4产量完全恢复[6]。
在排水管道中投NO3−促进了HDN菌活性,有利于反硝化过程,但有可能导致N2O排放。在厌氧压力流管道中投加NO3−可产生N2O,而当NO3−耗尽后时N2O产生现象会消失[30]。因重力流管道顶空存在好氧环境,这可能导致HDN反硝化不完全,从而产生N2O,也有研究发现,向管道中充O2后N2O生成量非常有限[34]。当重力流管道DO为0.0~0.3 mg·L−1、碳源充足情况下,HDN反硝化进行会更加完全;而当DO>0.4 mg·L−1,HDN反硝化受阻而致N2O积累并释放,也会使HDN菌活性与丰度均有所下降[25]。
改用NO2−加入排水管道,上述抑制效果长期且更强[12]。与NO3−主要区别在于,NO2−通过抑制异化硫酸盐还原酶将SO42− 还原为H2S来达到减排目[35]。 NO2−则通过将质子和电子转移到周质亚硝酸盐还原酶 (peripheral nitrite reductase,PNR) 来抑制细胞质异化亚硫酸盐还原酶 (cytoplasmic dissimilating sulfite reductase,DsrAB) 活性,从而阻断SO42− 还原为H2S,即PNR存在是SRB中的一种解毒机制[36]。NO2−对SRB和MA都具有生物灭活毒性,后者似乎对NO2−更为敏感[35]。在混合产CH4细菌培养实验中,17 mg·L−1的NO2−可达到75%的MA活性抑制效果[35]。SRB与MA所受到的抑制作用与NO2−质量浓度和暴露时间成显著相关[35]。间歇式投加NO2−现场实验表明,在3 d内,间歇式投加质量浓度为100 mg·L−1的NO2−可完全抑制H2S和CH4产生。在接下来的3周内,在不添加NO2−的情况下,H2S的产生量显著降低,而CH4产生量在至少3个月内保持在较低水平,甚至可以忽略不计[35]。此外,NO2−刺激了亚硝酸盐还原硫化物氧化细菌活性,这些细菌能利用NO2−氧化残留的硫化物。这意味着NO2−既是一种代谢抑制剂,又是一种硫化物氧化剂[35]。进一步研究表明,在一定pH和温度条件下,部分NO2−将转化为游离亚硝酸 (FNA) ,FNA可抑制微生物的活性,即使FNA质量浓度低至0.1~0.2 mg·L−1也能抑制微生物电子转移,这可能对SRB和MA种群具有生物杀灭作用[16]。
另外,需要注意的是,往排水管道中投加高质量浓度NO2−会导致大量N2O积累,尤其是重力流管道。因其顶空存在空气流动空间,存在较高DO,有利于AOB反硝化与HDN反硝化进行不完全而产生N2O。向压力流排水管道中投加少量NO2−,因AOB丰度极低、且碳源充足使HDN反硝化进行完全,故上述2种途径产生的N2O可忽略不计[12]。
2) 通入氧气。排水管道中充氧可充入空气或纯氧,目的是防止污水中出现厌氧环境。如果排水管道生物膜附近存在DO,H2S就会发生化学和生物氧化;若DO不存在,溶解性H2S就会从生物膜进入水中[5]。当DO为0.5 mg·L−1时,可防止污水中出现溶解性H2S,同时也可氧化已经产生的溶解性H2S[5]。而向排水管道中通入空气,可维持管道末端DO为0.2~1.0 mg·L−1,可有效控制H2S排放[5]。但DO并不能抑制SRB活性,一旦DO耗尽,又会促进H2S产生[37]。
在实验室规模压力流管道中,长期注入质量浓度为15~25 mg·L−1的氧气可减少47%的CH4产生。在暴露6 h的短期时间内,CH4产率降至15%,但在20 d后CH4产量完全恢复[34]。这可能是只有部分O2能渗透到排水管道生物膜,无法完全实现对CH4的产生控制。在排水管道中注入氧气,尤其是重力流管道,有利于AOB经生物与非生物途径产生N2O。另外,由于存在DO,易致HDN反硝化产生N2O。值得注意的是,向管道中注入氧气会消耗很多可生物降解有机物,使得COD降低,从而不利于维持下游污水处理厂脱氮除磷对碳源的需求。
3) 投加铁盐。铁盐广泛用于排水管道去除H2S与CH4。亚铁离子 (Fe2+) 可与S2−形成高度不溶性金属硫化物沉淀 (FeS) 。三价铁盐 (Fe3+) 投加时因其具有强氧化性,可先将部分S2−氧化为单质S,本身则变成Fe2+。同时,Fe3+亦可在异化金属还原菌 (dissimilated metal reducing bacteria,MRB) 作用下再次被还原为Fe2+,之后,再与S2−形成FeS沉淀[37]。Fe3+除了能从水相中去除硫化物外,亦能渗透到生物膜系统中,破坏生物膜厌氧环境,从而有效抑制SRB与MA活性。在长期投加21 mg·L−1氯化铁后,研究对排水管道生物膜系统SRB与MA活性影响发现,SRB活性被有效抑制39%~60%,而MA活性则被有效抑制52%~80%。其中,实验室规模排水管道反应器中污水CH4质量浓度降低了43%,几乎完全控制了 (99%) 硫化物产生[38]。高铁酸盐也可用于排水管道去除H2S与CH4。六价铁 (Fe6+) 的强氧化能力使其能对细胞壁、原生质、基因组及胞外聚合物 (extracellular polymeric substance,EPS) 产生破坏作用,从而导致微生物灭活。在排水管道反应器中投加120 mg·L−1高铁酸盐,脉冲式投加药剂持续1 h,活性生物量从82%降至35%.之后,缩短暴露时间为15 min与增加高铁酸盐质量浓度至200 mg·L−1发现,活性生物量几乎不发生变化,这意味着高铁酸盐具有高强度生物杀灭效果。另外,为进一步探究高铁酸盐对SBB与MA的活性影响,在排水管道反应器中3次间歇式投加20 mg·L−1高铁酸盐药剂发现,SRB与MA的关键功能基因dsrA与mcrA丰度分别显著降低了84.2%和86.6%,故说明MA对高铁更为敏感[39]。此外,排水管道中投加铁盐亦有利于化学除磷[40]。
4) 投药提升pH。下水管道液相中pH提升有利于减少H2S从液体向气相转移/释放,同时也会影响SRB和MA活性。管道污水pH为6.5~8、ORP为−200~−300 mV为管道内H2S产生的最佳条件[10]。当pH从9增至12.5时,H2S产量可减少70%~90%,CH4产量减少95%~100%[41]。MA是严格的专性厌氧菌,对pH非常敏感,最适宜pH范围为6.8~7.2,故pH一旦过高,MA较SRB更为敏感而受到抑制[41]。长期将pH保持在8.6~9.0,可有效抑制实验室规模排水管道中MA与SRB生长[42]。管道上游长期氢氧化物加药模拟表明,对CH4和H2S产量完全控制是可实现的[42]。现场实验表明,pH适度提高可在短期内实现对CH4有效控制。整个排水管道暴露于pH=11.5环境下6 h,足以控制CH4产生超过2周。在碱性药剂冲击负荷加药后的2 d内,H2S产量可减少67%;停止加药后,SRB活性在7 d内逐渐恢复,而MA活性则需要更长时间才能恢复[41]。但是,pH过高会影响脱氮除磷微生物相关酶活性,不利于下游污水处理厂的脱氮除磷。
此外,在排水管道脱氮过程中,脱氮微生物相关酶活性与pH密切相关,且影响污水中N元素存在形态,从而影响N2O产量。在硝化过程中,AOB与NOB代谢过程适宜pH分别为7.0~8.5和6.5~7.5。因此,当pH<6.5或pH>8.5时,NOB代谢活性较AOB更易受pH抑制,导致NO2−积累,进而产生N2O[43]。当pH为5.0~6.0时,N2O产量最高[44],这归因于低pH条件不仅会通过增强还原酶之间的电子竞争来抑制酶的相对活性,还会影响碳源底物代谢速率[45];而当pH为6.8~8时,系统中几乎没有N2O产生[44]。
5) 投加游离亚硝酸 (FNA) 。FNA对排水管道生物膜中SRB和MA活性有抑制作用[6]。当FNA质量浓度为0~0.1 mg·L−1时,随着FNA质量浓度增加,微生物活性会急剧下降。在暴露于质量浓度为0.045 mg·L−1的FNA环境下,微生物活性会降低50% [46]。而当FNA质量浓度高于0.2 mg·L−1、且暴露时间为6~24 h后,微生物活菌率从处理前的约80%显著降至5%~15% [46]。以间歇式投加药剂时,FNA对排水管道生物膜中的MA具有很强的生物杀灭作用。在暴露于0.26 mg·L−1的FNA环境下12 h后,实验室排水管道中CH4产生被抑制,而在药剂停止投加后接下来的两周内,CH4产量仅恢复20% [6]。这种加药方法因为可节约成本,而在实际排水管道中得以应用。在排水管道泵站中持续投加0.26 mg·L−1 FNA药剂8 h,反应10 d后,H2S产量可减少80%以上。MA比SRB对FNA更敏感,这充分证明FNA在排水管道系统中控制CH4和H2S产生是有效的[6]。
-
上述N2O产生机理表明,硝化与反硝化途径在正常情况下不应成为N2O产生的主要来源。只有在碳源匮乏使HDN反硝化受限情况下方可造成N2O大量产生。然而,AOB同步亚硝化与反硝化途径中经反硝化途径产生的N2O不可忽视。重力流管道因顶空存在氧 (O2) ,无法直接通过调控DO,避免AOB反硝化现象。管道中碳源应该不会成为HDN反硝化的限制条件,只要存在适当的缺氧环境,HDN菌则会利用NO2−进行完全反硝化而不致引起AOB反硝化现象。
值得注意的是,应慎用抑制CH4和H2S而采取的投加NO3−/NO2−和充氧的控制方法,因为这样会导致N2O的产生。这就需要因地制宜,权衡是优先控制CH4和H2S,以杜绝燃爆或毒性隐患,亦或采取投加NO3−/NO2−和充氧的方法对CH4和H2S进行控制,最好能一并检查井内的N2O。如果CH4被抑制的CO2当量等于或小于N2O产生的CO2当量,或当地对温室气体控制存在碳汇或负碳手段,则这种控制CH4和H2S的方法可以采用。否则,需要改用上述其他控制CH4和H2S方式,如投加铁盐或铜盐。
硝化与反硝化途径HDN反硝化过程的Nos酶是含铜酶,其活性中心具有催化位点CuZ,含有铜离子。因此,加入铜元素则有利于加强Nos酶活性[16]。铜元素是Nos酶进行生物合成的必需物质,且其含量能影响N2O产量[16]。因此,Cu2+缺失很容易抑制Nos酶活性,从而阻止HDN反硝化过程中N2O还原为N2[16]。使用含Cu2+污泥发酵液作为额外碳源底物,可显著降低N2O产量,且不会影响N和P去除效率[16]。排水管道中的厌氧或缺氧条件有利于生物膜与沉积物产生具有毒性的H2S,而溶解性H2S能在较低质量浓度下有效抑制N2O还原过程,尤其是在铜元素利用率较低的情况下[15]。为降低H2S对Nos酶活性的影响,可往重力流管道中投加铜盐或铁盐。其中,Cu2+可与S2−形成金属硫化物沉淀 (CuS) ,而三价铁盐 (Fe3+) 作用如上所述。
近年来,已发表的关于排水管道中气态污染物的控制策略综述均集中于CH4和H2S,而关于N2O控制方法的总结并不多见。因此,有待进一步深入探讨这几种有毒有害气体协同治理的控制策略。
-
1) CH4产生于管壁生物膜或底部沉积物厌氧环境之中,通过有机物 (以COD计) 厌氧分解最终形成CH4。压力流排水管道因满管无顶空,产生的CH4全部存在于液相中,质量浓度高达3.4~33 mg·L−1。重力流排水管道因顶空存在导致液相中的CH4一部分释放于气相,使液相、气相中CH4质量浓度范围分别为0.1~13.7 mg·L−1和46~35714 mg·m−3。气相中的CH4质量浓度较高时足以发生燃爆事故。
2) H2S产生于管壁厌氧生物膜或底部沉积物表层,由硫酸盐还原菌 (SRB) 利用COD还原SO42− 而形成,在压力流排水管道液相中质量浓度高达4~12 mg·L−1,重力流管道液相、气相中质量浓度分别为2~15 mg·L−1和3~607 mg·m−3。若气相中存在15~76 mg·m−3 的H2S,便足以致人昏迷与呼吸困难。
3) N2O主要产生于重力流管道中,因顶空而常常存在有氧环境,可诱发行硝化与反硝化和同步短程硝化与反硝化途径,其中间过程会产生N2O,但质量浓度不高,范围为1~43 μg·L−1。
4) 为降低排水管道CH4与H2S产生,可向排水管道中注入NO3−/NO2−、O2、金属盐、碱、游离亚硝酸 (FNA) 等药剂,可直接或间接抑制CH4与H2S产生。然而,投加NO3−/NO2−药剂和充氧可能会诱发N2O形成。目前,排水管道气体抑制主要以CH4与H2S为对象,鲜有针对N2O的研究。重力流排水管道因顶空氧的存在,会不可避免诱发N2O的形成,其产生量虽不大,但亦不可忽视,因为N2O的温室效应为CO2的265倍。
5) 针对排水管道中CH4、H2S与N2O 3种气体的防控,需要采取协同策略,可采取向排水管道中投加铜盐或铁盐的方法。铜盐有利于加强HDN反硝化过程Nos酶活性,且能促进N2O的还原,亦可与S2−反应形成CuS,以降低管道产生的H2S质量浓度。铁盐的作用与之相似。Fe3+与Fe6+因具有强氧化性,可同步氧化CH4与H2S。此外,排水管道中投加铁盐亦有利于下游污水处理厂化学除磷。从防患于然角度,未来新建管道可采用压力流、真空排水形势,以减少3种气体的产生。这是由于减少污水管道停留时间、避免管底淤积、减少管壁生物膜滋生等方法可有效限制微生物的活动,从而减弱气体产生。
排水管道中CH4、H2S与N2O的产生机制及其控制策略
Production mechanism and control strategy of CH4 , H2S and N2O in drainage pipeline
-
摘要: 排水管道厌氧环境会产生甲烷 (CH4) 与硫化氢 (H2S) ,而好氧及缺氧环境又会诱发氧化亚氮 (N2O) 。污水中所含有机物 (COD) 、氮 (N) 和硫酸盐 (SO42−) 是产生这些气体的主要根源。系统综述了3种有害气体的产生机理,厘清污水中污染物、管道中微生物及管道环境对有害气体产生的影响。基于此,有针对性地提出了这几类气态污染物的控制策略。其中,对CH4与H2S的抑制手段集中在向管道中投加药剂以限制其产生源头,然而投加NO3−或NO2−药剂与通入氧气这两种控制手段可能会导致N2O这种温室气体的大量产生。因此,应充分了解排水管道中各复杂因素之间的相互作用,以实现对有害污染气体的控制,并实现碳减排的目标。Abstract: Anaerobic environment in drainage pipeline can produce methane (CH4) and hydrogen sulfide (H2S), while aerobic and anoxic environments will induce nitrous oxide (N2O). Chemical oxygen demand (COD), nitrogen (N) and sulfates (SO2-4) contained in wastewater are the major sources of these gases. The production mechanism of three kinds of harmful gases was systematically reviewed, and the effects of pollutants in wastewater, microorganisms in pipeline and pipeline environment on the production of harmful gases were identified. Based on this, the control strategies of these gaseous pollutants were respectively proposed. Among them, the inhibition measures of CH4 and H2S were focused on adding chemical agents to the pipeline to limit the source control of production. However, the addition of NO-3/NO-2 agents and oxygen injection might lead to large production of N2O, which was a kind of greenhouse gas. Therefore, it is necessary to fully understand the interaction between the complicated controlling factors in the dainage pipeline, so as to achieve the control of harmful pollution gases and chieve the goal of carbon reduction.
-

-
表 1 排水管道中CH4、H2S及N2O气体产生质量浓度范围
Table 1. Mass concentration ranges of CH4 , H2S and N2O gases in drainage pipeline
-
[1] ZUO Z Q, REN D H, QIAO L G, et al. Rapid dynamic quantification of sulfide generation flux in spatially heterogeneous sediments of gravity sewers[J]. Water Research, 2021, 203: 117494. doi: 10.1016/j.watres.2021.117494 [2] LI W K, ZHENG T L, MA Y Q, et al. Current status and future prospects of sewer biofilms: their structure, influencing factors, and substance transformations[J]. Science of the Total Environment, 2019, 695: 133815. doi: 10.1016/j.scitotenv.2019.133815 [3] EIJO-RÍO E, PETIT-BOIX A, VILLALBA G, et al. Municipal sewer networks as sources of nitrous oxide, methane and hydrogen sulphide emissions: a review and case studies[J]. Journal of Environmental Chemical Engineering, 2015, 3(3): 2084-2094. doi: 10.1016/j.jece.2015.07.006 [4] MOHANAKRISHNAN J, GUTIERREZ O, SHARMA K R, et al. Impact of nitrate addition on biofilm properties and activities in rising mainsewers[J]. Water Research, 2009, 43(17): 4225-4237. doi: 10.1016/j.watres.2009.06.021 [5] ZHANG L H, SCHRYVER P D, GUSSEME B D, et al. Chemical and biological technologies for hydrogen sulfide emission control in sewer systems: a review[J]. Water Research, 2008, 42(1-2): 1-12. doi: 10.1016/j.watres.2007.07.013 [6] LIU Y W, NI B J, SHARMA K R, et al. Methane emission from sewers[J]. Science of the Total Environment, 2015, 524-525: 40-51. doi: 10.1016/j.scitotenv.2015.04.029 [7] SUN J, HU S, SHARMA K R, et al. Stratified microbial structure and activity in sulfide-and methane-producing anaerobic sewer biofilms[J]. Applied Environmental Microbiology, 2014, 80(22): 7042-7052. doi: 10.1128/AEM.02146-14 [8] CHAOSAKUL T, KOOTTATEP T, POLPRASERT C, et al. A model for methane production in sewers[J]. Environmental Science Health A, 2014, 49(11): 1316-1321. doi: 10.1080/10934529.2014.910071 [9] SCHREIBER L, HOLLER T, KNITTEL K, et al. Identification of the dominant sulfate-reducing bacterial partner of anaerobic methanotrophs of the anme-2 clade[J]. Environmental Microbiology, 2010, 12(8): 2327-2340. [10] 郝晓地. 可持续污水-废物处理技术[M]. 北京: 中国建筑工业出版社, 2006: 279-286 [11] MUYZER G, STAMS A J M. The ecology and biotechnology of sulphate-reducing bacteria[J]. Nature Reviews Microbiology, 2008, 6: 441-454. doi: 10.1038/nrmicro1892 [12] AUGUET O, PIJUAN M, BORREGO C M, et al. Control of sulfide and methane production in anaerobic sewer systems by means of downstream nitrite dosage[J]. Science of the Total Environment, 2016, 550: 1116-1125. doi: 10.1016/j.scitotenv.2016.01.130 [13] OVIEDO E R, JOHNSON D, SHIPLEY H. Evaluation of hydrogen sulphide concentration and control in a sewer system[J]. Environmental Technology, 2011, 33(10): 1207-1215. [14] ZUO Z Q, CHANG J, LU Z S. Hydrogen sulfide generation and emission in urban sanitary sewer in China: What factor plays the critical role?[J]. Environmental Science Water Research & Technology, 2019, 5: 839-848. [15] SHORT M D, DAIKELER A, PETERS G M, et al. Municipal gravity sewers: An unrecognised source of nitrous oxide[J]. Science of the Total Environment, 2014, 468-469: 211-218. doi: 10.1016/j.scitotenv.2013.08.051 [16] CHEN H B, ZENG L, WANG D B, et al. Recent advances in nitrous oxide production and mitigation in wastewater treatment[J]. Water Research, 2020: 184. [17] KIM S W, MIYAHARA M, FUSHINOBU S, et al. Nitrous oxide emission from nitrifying activated sludge dependent on denitrification by ammonia-oxidizing bacteria[J]. Bioresource Technology, 2010, 101: 3958-3963. doi: 10.1016/j.biortech.2010.01.030 [18] LAW Y Y, YE L, PAN Y T, et al. Nitrous oxide emissions from wastewater treatment processes[J]. Philosophical Transactions of The Royal Society B, 2012, 367: 1265-1277. doi: 10.1098/rstb.2011.0317 [19] SCHREIBER F, WUNDERLIN P, UDERT M K. Nitric oxide and nitrous oxide turnover in natural and engineered microbial communities: biological pathways, chemical reactions, and novel technologies[J]. Frontiers in Microbiology, 2012, 3: 372. [20] CARANTO J D, VILBERT A C, LANCASTER K M. Nitrosomonas europaea cytochrome p460 is a direct link 886 between nitrification and nitrous oxide emission[J]. National Acad Science, 2016, 113: 14704-14709. doi: 10.1073/pnas.1611051113 [21] UPADHYAY A K, HOOPER A B, HENDRICH M P. NO reductase activity of the tetraheme cytochrome c554 of nitrosomonas europaea[J]. American Chemistry Society, 2006, 128: 4330-4337. doi: 10.1021/ja055183+ [22] STEIN L. Surveying N2O-producing pathways in bacteria[J]. Methods in Enzymology, 2011, 486: 131-152. [23] WUNDERLIN P, MOHN J, JOSS A, et al. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions[J]. Water Research, 2012, 46(4): 1027-1037. doi: 10.1016/j.watres.2011.11.080 [24] SOLER-JOFRA A, PEREZ J, VAN LOOSDRECHT M C M. Hydroxylamine and the nitrogen cycle: a review[J]. Water Research, 2021: 190. [25] ZHANG G J, PANG Y, ZHOU Y C, et al. Effect of dissolved oxygen on N2O release in the sewer system during controlling hydrogen sulfide by nitrate dosing[J]. Science of the Total Environment, 2022, 816: 151581. doi: 10.1016/j.scitotenv.2021.151581 [26] CASCIOTTI K L, WARD B B. Dissimilatory nitrite reductase genes from autotrophic ammonia-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2001, 67(5): 2213-2221. doi: 10.1128/AEM.67.5.2213-2221.2001 [27] POTH M, POCHT D D. 15N kinetic analysis of N2O production by nitrosomonas europaea: an examination of nitrifier denitrification[J]. Applied and Environmental Microbiology, 1985, 49(5): 1134-1141. doi: 10.1128/aem.49.5.1134-1141.1985 [28] NI B, YUAN Z G, CHANDRAN K, et al. Evaluating four mathematical models for nitrous oxide production by autotrophic ammonia-oxidizing bacteria[J]. Biotechnology and Bioengineering, 2013, 110(1): 153-163. doi: 10.1002/bit.24620 [29] YU R, KAMPSCHREYR M J, VAN LOOSDRECHT M C, et al. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia[J]. Environmental Science and Technology, 2010, 44(4): 1313-1319. doi: 10.1021/es902794a [30] JIANG G, SHARMA K R, YUAN Z. Effects of nitrate dosing onmethanogenic activity in a sulfide-producing sewer biofilmreactor[J]. Water Research, 2013, 47(5): 1783-1792. doi: 10.1016/j.watres.2012.12.036 [31] JIANG G, SHARMA K R, GUISASOLA A, et al. Sulfur transformation in rising main sewers receiving nitrate dosage[J]. Water Research, 2010, 43(17): 4430-4440. [32] BENTZEN G, SMIT A T, BENNETT D, et al. Controlled dosing of nitrate for prevention of H2S in a sewer network and the effects on the subsequent treatment processese[J]. Water Science and Technology, 1995, 31(7): 293-302. doi: 10.2166/wst.1995.0245 [33] AUGUET O, PIJUAN M, GUASCH-BALCELLS H, et al. Implications of downstream nitrate dosage in anaerobic sewers to control sulfide and methane emissions[J]. Water Research, 2015, 68: 522-532. doi: 10.1016/j.watres.2014.09.034 [34] GANIGUÉ R, YUAN Z. Impact of oxygen injection on CH4 and N2O emissions from rising main sewers[J]. Journal of Environmental Management, 2014, 144: 279-285. doi: 10.1016/j.jenvman.2014.04.023 [35] JIANG G M, GUTIERREZ O, YUAN Z G, et al. Effects of nitrite concentration and exposure time on sulfide and methane production in sewer systems[J]. Water Research, 2010, 44(14): 4241-4251. doi: 10.1016/j.watres.2010.05.030 [36] HAVEMAN S A, GREENE E A, STILWELL C P, et al. Physiological and gene expression analysis of inhibition of desulfovibrio vulgaris hildenborough by nitrite[J]. Journal of Bacteriology, 2004, 186(23): 7944-7950. doi: 10.1128/JB.186.23.7944-7950.2004 [37] PARK K, LEE H, PHELAN S, et al. Mitigation strategies of hydrogen sulphide emission in sewer networks: a review[J]. International Biodeterioration & Biodegradation, 2014, 95: 251-261. [38] ZHANG L, KELLER J, YUAN Z. Inhibition of sulfate-reducing and methanogenic activities of anaerobic sewer biofilms by ferric iron dosing[J]. Water Research, 2009, 43(17): 4123-4132. doi: 10.1016/j.watres.2009.06.013 [39] YAN X F, SUN J, DAI X H. Rapid and strong biocidal effect of ferrate on sulfidogenic and methanogenic sewer biofilms[J]. Water Research, 2020, 169: 115208. doi: 10.1016/j.watres.2019.115208 [40] YANG K, LI Z H, ZHANG H Y. Municipal wastewater phosphorus removal by coagulation[J]. Environmental technology, 2010, 31(6): 601-609. doi: 10.1080/09593330903573223 [41] GUTIERREZ O, SUDARJANTO G, REN G, et al. Assessment of ph shock as a method for controlling sulfide and methane formation in pressure main sewer systems[J]. Water Research, 2014, 48: 569-578. doi: 10.1016/j.watres.2013.10.021 [42] GUTIERREZ O, PARK D, SHARMA K R, et al. Effects of long-term ph elevation on the sulfate-reducing and methanogenic activities of anaerobic sewer biofilms[J]. Water Research, 2009, 43(9): 2549-2557. doi: 10.1016/j.watres.2009.03.008 [43] HYNES R K, KNOWLES R. Production of nitrous oxide by Nitrosomonas europaea: effects of acelylene, ph, oxygen[J]. Canadian Journal of Microbiology, 1984, 30(11): 1397-1404. doi: 10.1139/m84-222 [44] THÖRN M, SÖRENSSON F. Variation of nitrous oxide formation in the denitrification basin in a wastewater treatment plant with nitrogen removal[J]. Water Research, 1996, 30(6): 1543-1547. doi: 10.1016/0043-1354(95)00327-4 [45] PAN Y, YE L, NI B, et al. Effect of ph on N2O reduction and accumulation during denitrification by methanol utilizing denitrifiers[J]. Water Research, 2012, 46: 4832-4840. doi: 10.1016/j.watres.2012.06.003 [46] JIANG G M, GUTIERREZ O, YUAN Z G. The strong biocidal effect of free nitrous acid on anaerobic sewer biofilms[J]. Water Research, 2011, 45(12): 3735-3743. doi: 10.1016/j.watres.2011.04.026 -



 下载:
下载: