-
以气溶胶形式存在于空气中的致病微生物极易引起传染病扩散和传播。如近两年新型冠状病毒肺炎 (COVID-19) 疫情的暴发与流行对人类健康产生了严重威胁。经研究发现,气溶胶传播或是COVID-19的主要传播途径之一[1-2]。因此,微生物气溶胶污染与控制已成为研究热点。微生物气溶胶是由微生物依附于气溶胶粒子形成,可通过不同机制对人体健康产生不利影响,如引发呼吸系统疾病、引起传染病传播、增加患癌风险等[3]。而传统的微生物气溶胶净化方法存在一定局限性,如化学消毒剂法易产生残留和二次污染[4];过滤吸附法无法实现微生物灭活,被截留的微生物可以长期存活和繁殖,有一定安全隐患[5]。低温等离子体因其灭活效率高且可实现动态消毒,发展成为新兴的广谱杀菌方法。
低温等离子体是电子、离子、自由基等粒子组成的混合体。与热等离子体不同,低温等离子体中能量主要用来加热电子,整个体系温度较低,故其使用范围更广[6]。低温等离子体的产生方式有电晕放电、辉光放电、介质阻挡放电等。电晕放电是在曲率半径很小的电极上施加直流、交流或脉冲高压产生局部放电[7],放电区域小,仅在放电极周围,是一种低电流密度的非均匀放电[8]。辉光放电与电晕放电放电过程类似,但放电强度有所不同。辉光放电充满整个放电空间,是一种低气压下稳定的自持放电[9]。介质阻挡放电将绝缘介质置于放电空间内,放电形式为微放电。相比之下,介质阻挡放电放电更均匀,可在常压下进行。因此,本研究拟选用介质阻挡放电产生低温等离子体。
低温等离子体中起杀菌作用的有紫外线、带电粒子及活性物种[10-11]。波长260 nm左右的紫外线通过损伤细菌DNA抑制细菌的繁殖能力[11]。积累在细胞膜表面的带电粒子导致细胞膜内外产生跨膜电势,通过电穿孔作用导致细胞死亡。而活性物种由于具有强氧化性被认为是起主导作用的杀菌成分[12-13]。王英等[14]发现,经低温等离子体处理后,苹果汁中的耐高渗酵母菌数量可减少6.82 log,灭活效果显著。LIN等[15]通过低温等离子体实现了鸡蛋壳上沙门氏菌有效灭活,同时鸡蛋的营养品质和感官特性不受影响。低温等离子体还可快速且有效地灭活物体表面存留的SARS-CoV-2[16]。
然而,有关低温等离子体灭活微生物气溶胶的研究较少。微生物气溶胶与物体表面微生物的灭活差异很大。灭菌对象为物体表面时,反应装置多为低温等离子体射流,放电区与射流形成区在空间上有所分离[17]。通过低温等离子体喷射将活性物种等有效杀菌成分直接作用于物体表面,不受限于物体形状。灭菌对象为微生物气溶胶时的反应装置多为传统间隙式。微生物气溶胶与放电生成的低温等离子体在同一空间内混合接触,低温等离子体中的活性物质、带电粒子、紫外线等充分作用于微生物气溶胶导致其失去活性。因此,有必要对低温等离子体灭活微生物气溶胶的灭活效果及影响因素进行研究。
本研究在搭建低温等离子体灭活微生物气溶胶实验台的基础上,选取安全且典型的实验微生物,研究了不同工作电压、流速和相对湿度对微生物气溶胶灭活效果的影响。采用电压电流波形图、李萨如图、发射光谱图和电子顺磁共振表征并分析低温等离子体的放电特性和成分特征,通过对比低温等离子体放电前后微生物气溶胶的可培养性、细胞膜完整性、蛋白质质量浓度及总有机碳水平的差异评估系统的灭活效果,再以杀菌率为评价指标,得到不同影响因素的对灭活效果的影响规律,以期为低温等离子体灭活微生物气溶胶的应用提供参考。
-
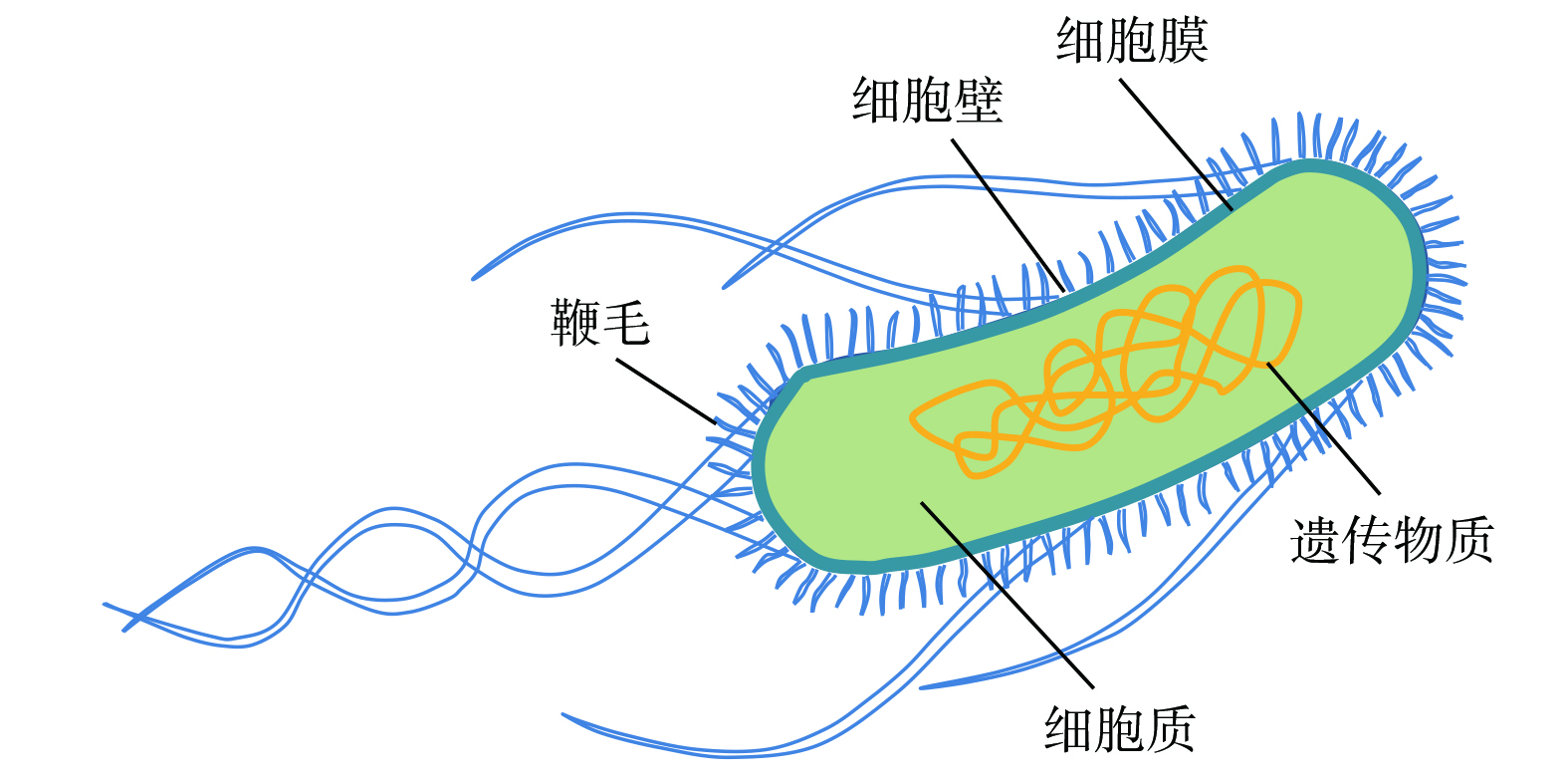
选取枯草芽孢杆菌CMCC(B)63501为实验菌株发生微生物气溶胶,代表可在不利条件下生存的高抗性菌株[18]。枯草芽孢杆菌是革兰氏阳性菌,呈柱状、无荚膜、周生鞭毛,其细胞结构如图1所示。因其对环境友好且对人体及动植物无危害,应用较为广泛[19]。由于枯草芽孢杆菌与炭疽芽孢杆菌同属低G+C革兰氏阳性菌的芽孢杆菌属,且在基因结构和生物特性角度二者高度类似[20]。因此,在微生物灭活领域,枯草芽孢杆菌常作为致病菌炭疽芽孢杆菌安全且有效的替代菌用来评价不同灭活技术的灭活效果[21]。
-
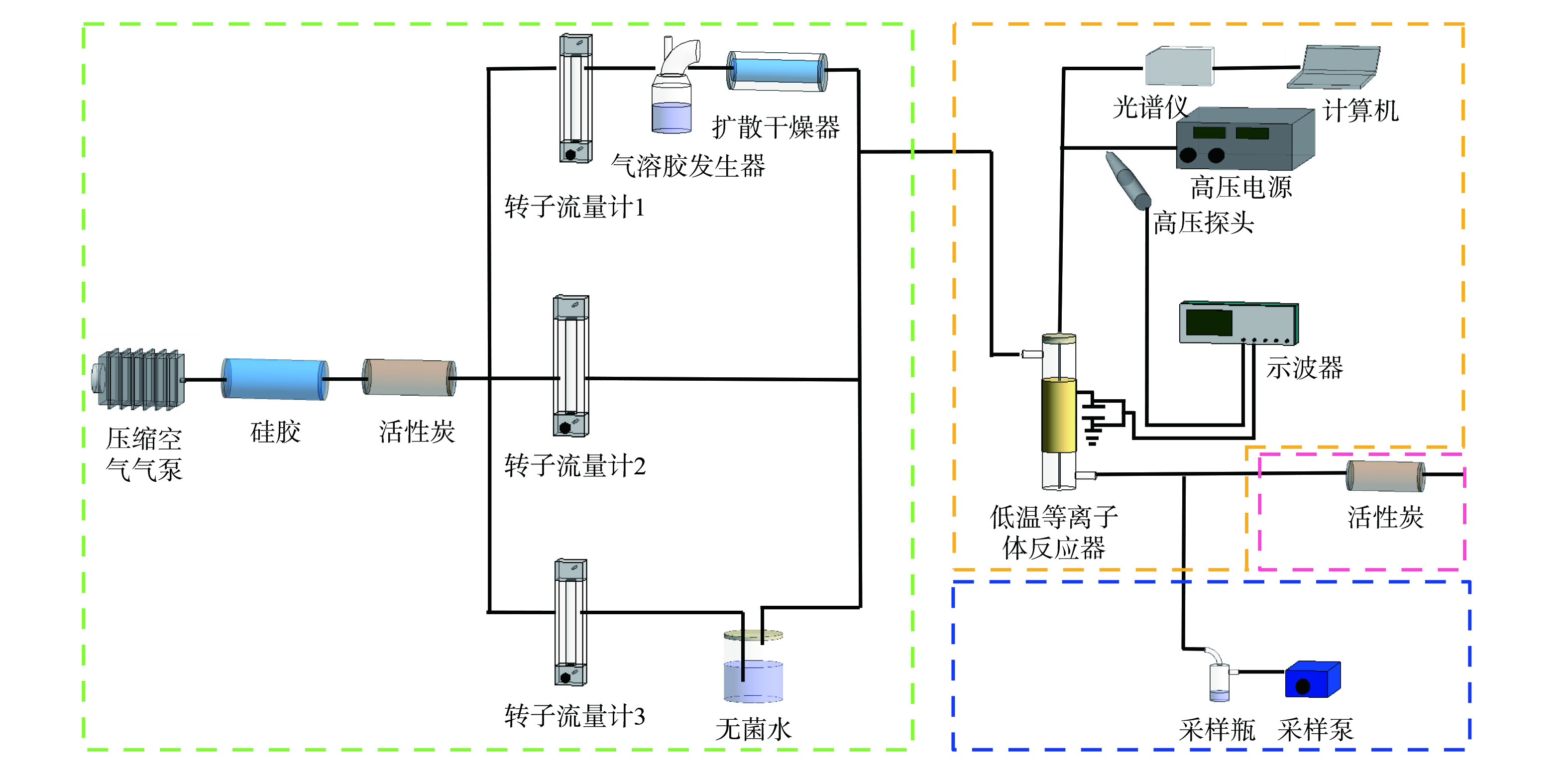
图2为低温等离子体灭活微生物气溶胶的装置。系统主要由微生物气溶胶制备单元、低温等离子体净化单元、采样单元、尾气净化单元构成。
用灭菌接种环取斜面保存的枯草芽孢杆菌CMCC(B)63501于LB液体培养基,恒温振荡 (37 ℃,150 r∙min−1) 培养12 h。菌液以7 000 r∙min−1离心8 min后去除上清液,加入无菌磷酸盐缓冲溶液 (PBS,pH=7.4) ,重悬后重复离心2次。离心后的菌体加入PBS溶液用于气溶胶发生,浓度约为105 cfu·mL−1。
经硅胶除湿、活性炭除杂后的压缩空气进入气溶胶雾化器 (ZR-C03,青岛众瑞智能仪器股份有限公司) 产生枯草芽孢杆菌气溶胶 (8 L·min−1) 。产生的微生物气溶胶由扩散干燥器 (3065,上海汇分电子科技有限公司) 干燥后与干湿空气混合。湿空气由经过转子流量计 (LZB-10WB (F) ,苏州三泰测控技术有限公司) 计量的空气通入含有无菌水的玻璃瓶产生。相对湿度由该单元气体流量控制,由温湿度检测仪检测。经低温等离子体反应器净化后由液体撞击式采样器 (LY36-YTZ,北京海富达科技有限公司) 对实验微生物气溶胶采样 (实验采样流量为11 L·min−1,采样时间为20 min) 。采样瓶90°弧形弯曲的进气管可模拟人的上呼吸道对气溶胶粒子的阻拦。采样液适当稀释后涂布于LB固体培养基,置于恒温培养箱 (HN-40BS,青岛聚创环保集团有限公司) 37 ℃恒温过夜培养后计数,计算杀菌率。含有臭氧、氮氧化物和剩余微生物气溶胶的实验尾气通过活性炭吸附去除。
通过介质阻挡放电产生低温等离子体。反应器由放电电极 (不锈钢棒状电极,直径1 mm) 、石英管 (内径12 mm、壁厚1 mm、长250 mm) 和接地电极 (铜皮) 构成,由高压交流电源 (GJTK-0.01/30 K,上海南罡电除尘器有限公司) 供电。使用示波器 (DPO3054,Tektronix) 和高压探头 (P6015A,Tektronix) 测量电压电流信号,得到低温等离子体电学特性。光学特性由光谱仪 (Maya2000Pro,OceanInsight) 测量,光谱仪带宽203~1 099 nm,入射狭缝5 μm。放电过程中产生的活性物种经捕获剂捕获后由电子顺磁共振波谱仪 (EMXmicro-6/1,布鲁克科技有限公司) 测定信号值,定量描述低温等离子体成分特征。采用的捕获剂为TEMP (四甲基哌啶酮) 溶液和DMPO (5,5二甲基1-吡咯啉N-氧化物) 溶液,分别用来捕获1O2和·OH自由基。
低温等离子体处理前后的枯草芽孢杆菌气溶胶通过稀释平板涂布法分析细菌可培养性的变化。使用SYBR GreenⅠ/Propidium Iodide(SG/PI)染色,利用流式细胞仪 (Accuri C6,美国BD公司) 检测细胞膜的完整性。使用紫外—可见分光光度计 (UV-4802,尤尼柯上海仪器有限公司) 测定细菌蛋白质质量浓度变化。通过总有机碳分析仪 (TOC-VCPH,日本岛津公司) 计算细胞矿化度。
-
1) 杀菌率。通过平板菌落计数法研究枯草芽孢杆菌气溶胶的可培养性,比较低温等离子体处理前后的菌落数,从而计算实验装置的杀菌率。杀菌率计算公式为式 (1) 。
式中:C0表示未经低温等离子体处理的对照组气溶胶中菌浓度;C表示经低温等离子体处理后的暴露组气溶胶中菌浓度。
2) 细胞矿化度。通过总有机碳分析仪测定低温等离子体处理前后样品的总有机碳含量变化,计算细胞矿化度[22]。计算公式为式 (1) 。
式中:ΔT表示低温等离子体处理前后的总有机碳差值;T0表示低温等离子体处理前对照组的总有机碳含量。
-
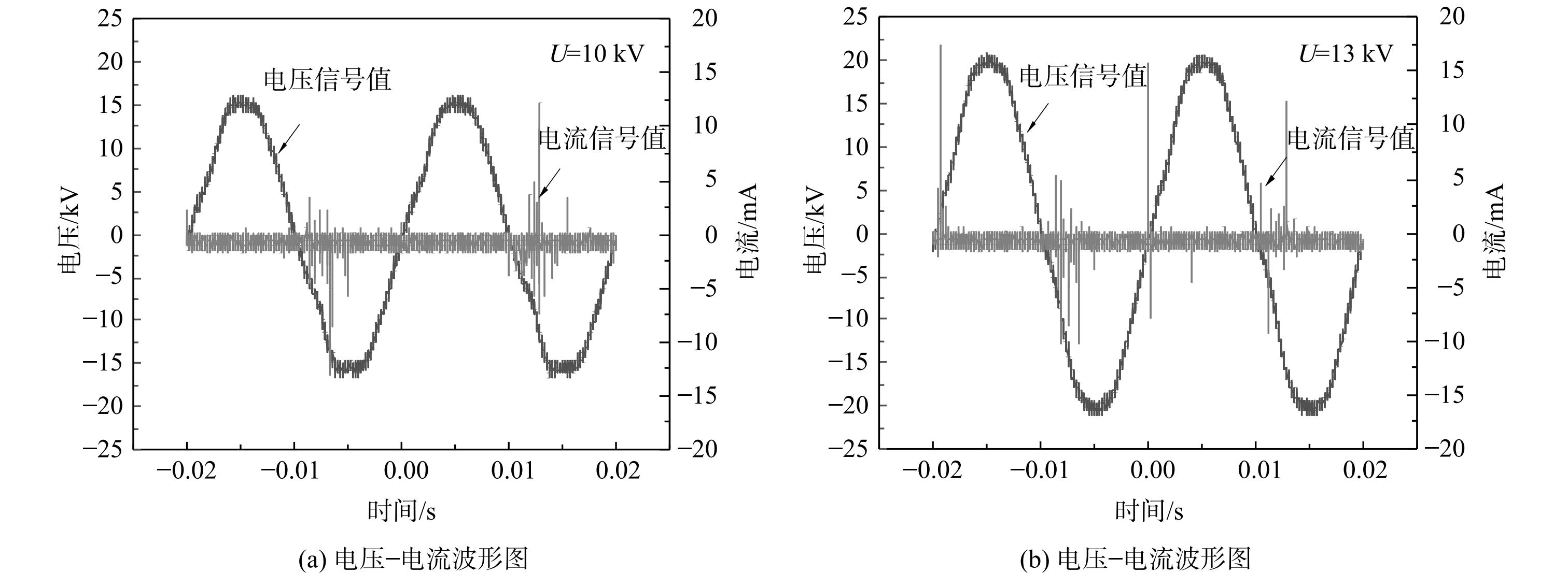
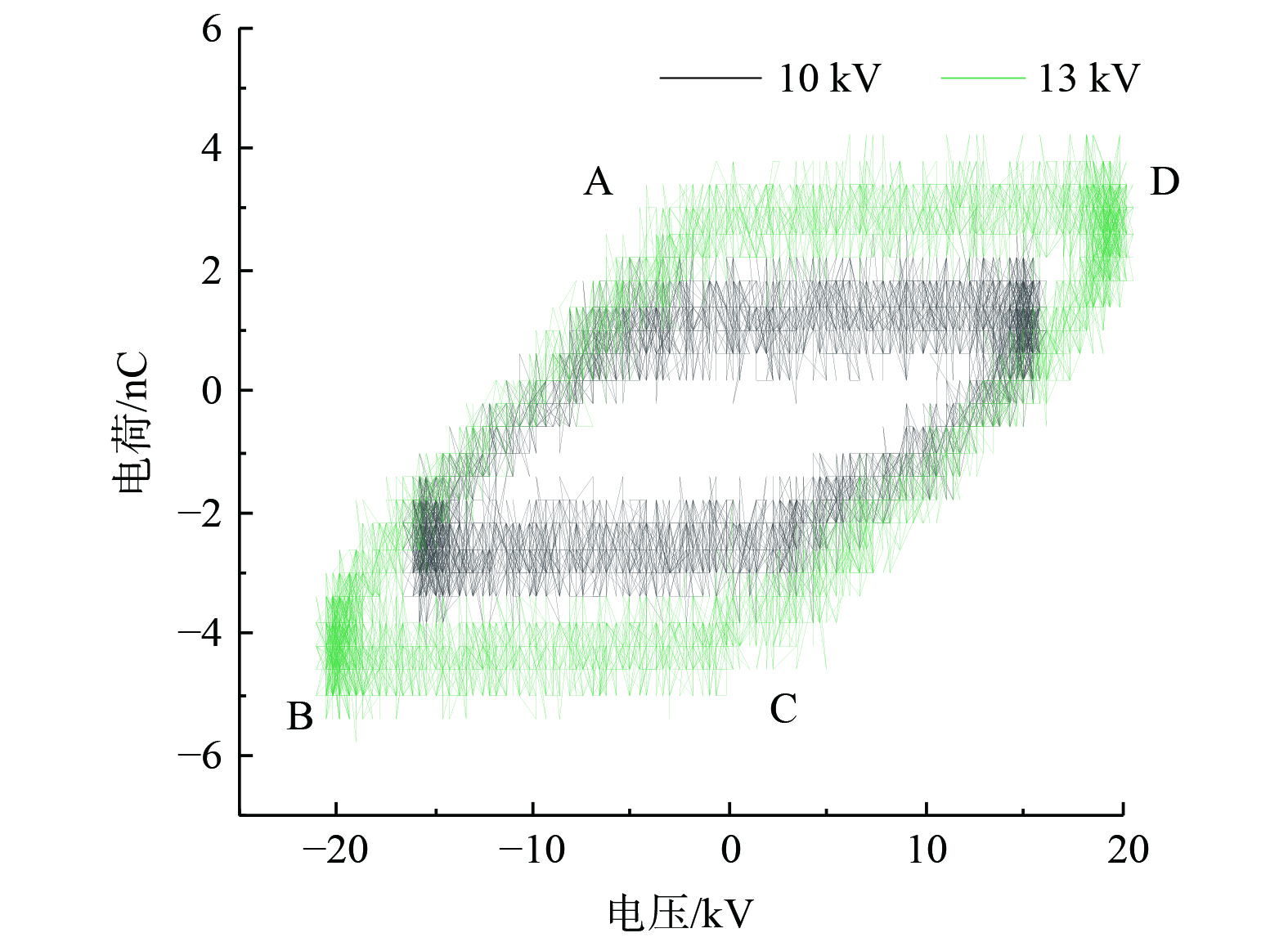
电压-电流波形图是低温等离子体放电过程中最基本的电学特性表征[23]。介质阻挡放电是将绝缘介质置于放电空间内,在放电过程中,当放电间隙的电压高到足以引起击穿时,部分区域的电子密度达到临界值,产生大量的电流细丝,形成微放电。每个微放电过程的持续时间不到10 ns,十分短暂[24]。当反应器内部气体完全击穿后,空间电荷开始在介质表面积累,介质表面积累电荷后产生与原本电场方向相反的电场,削弱有效作用电场从而中断放电电流,微放电熄灭[25]。以外加电压为10 kV和13 kV时的波形图为例 (图3) ,在交流电压正负极性变化时有电流脉冲产生,属于丝状放电,是典型的介质阻挡放电过程。通过对比可以看出,在外加电压U=13 kV时,电压波形幅度增大,放电过程中电流细丝的数量增加,电流脉冲幅值增大,放电强度增强。在微放电后期,高能电子通过碰撞传递能量并激发分子、原子、准分子等粒子,部分原子或分子激发形成离子、自由基等活性粒子[26]。而产生的活性粒子等可作用于微生物,导致微生物失活。通过李萨如图形表征放电功率,不同外加电压下的李萨如图形如图4所示。AB和CD段为放电阶段,BC和AD段为放电熄灭阶段,与波形图中微放电的产生和熄灭一致。李萨如图形的面积正比于放电功率。随着外加电压的升高,放电功率随之增加。这是由于随着外加电压的升高,电流细丝密度增加,放电强度增强,从而导致传输电荷的能力增强。
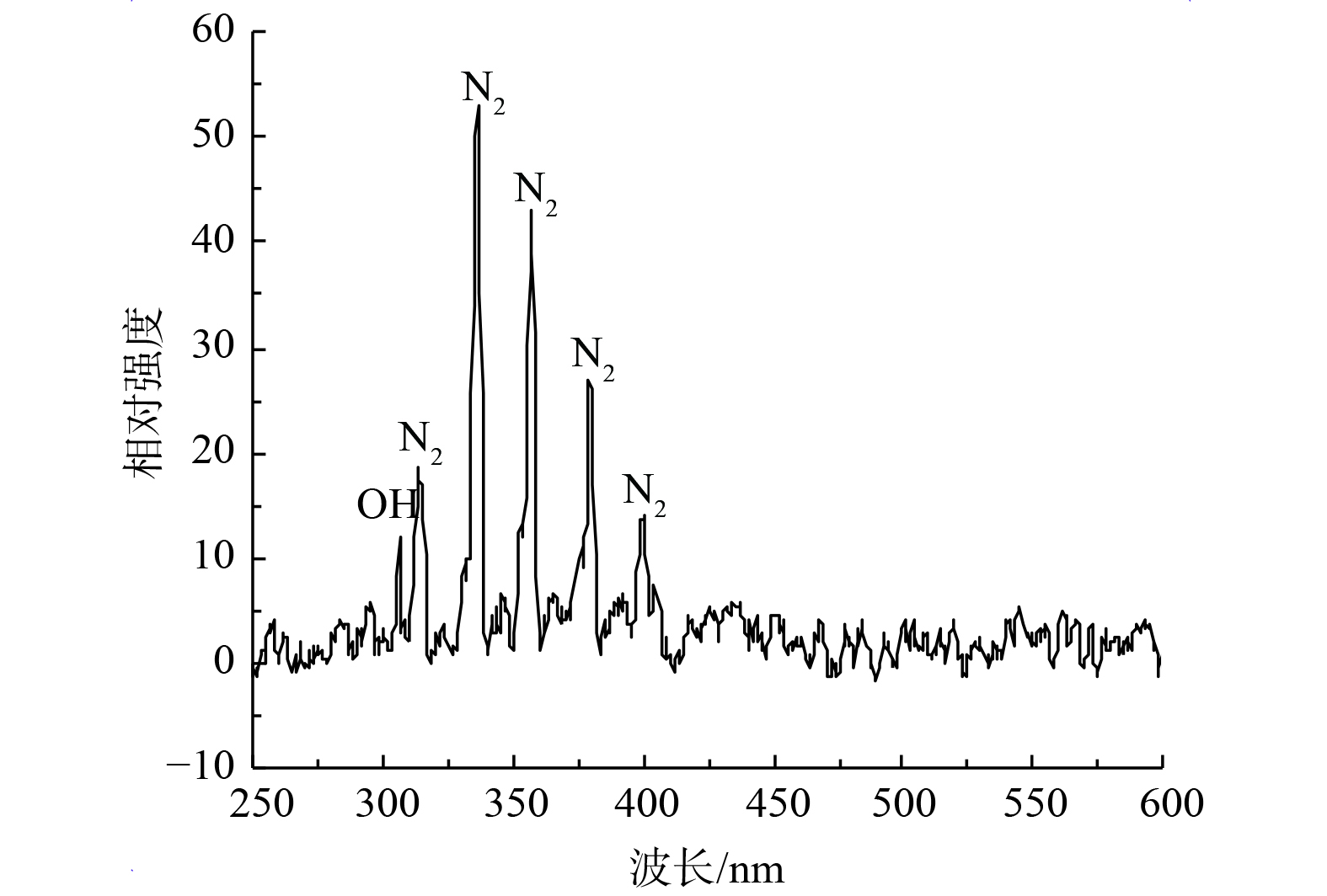
低温等离子体产生过程中伴随着能量变化,高能级态粒子由于不稳定会向低能级态跃迁,跃迁时以光子的形式释放能量[27]。利用发射光谱法可实时对低温等离子体成分进行诊断。图5表明,波长主要集中在300~400 nm,主要是氮分子第二正带系的几个特征峰:313.97 nm、336.29 nm、357.21 nm、379.44 nm。在400.26 nm处可观察到N2+特征峰。这说明基态氮分子在放电过程中产生离解电离形成激发态氮原子等活性氮物质。同时,在波长306.22 nm处还可观察到由水分子和电子碰撞解离得到的羟基自由基谱线[28]。 在本实验中,未检测到波长777 nm处氧原子的特征峰。这可能是由于氧原子在常压下是通过碰撞传递能量,很少发生辐射跃迁[29]。激发态分子、离子、自由基等联合作用致使微生物气溶胶丧失活性。
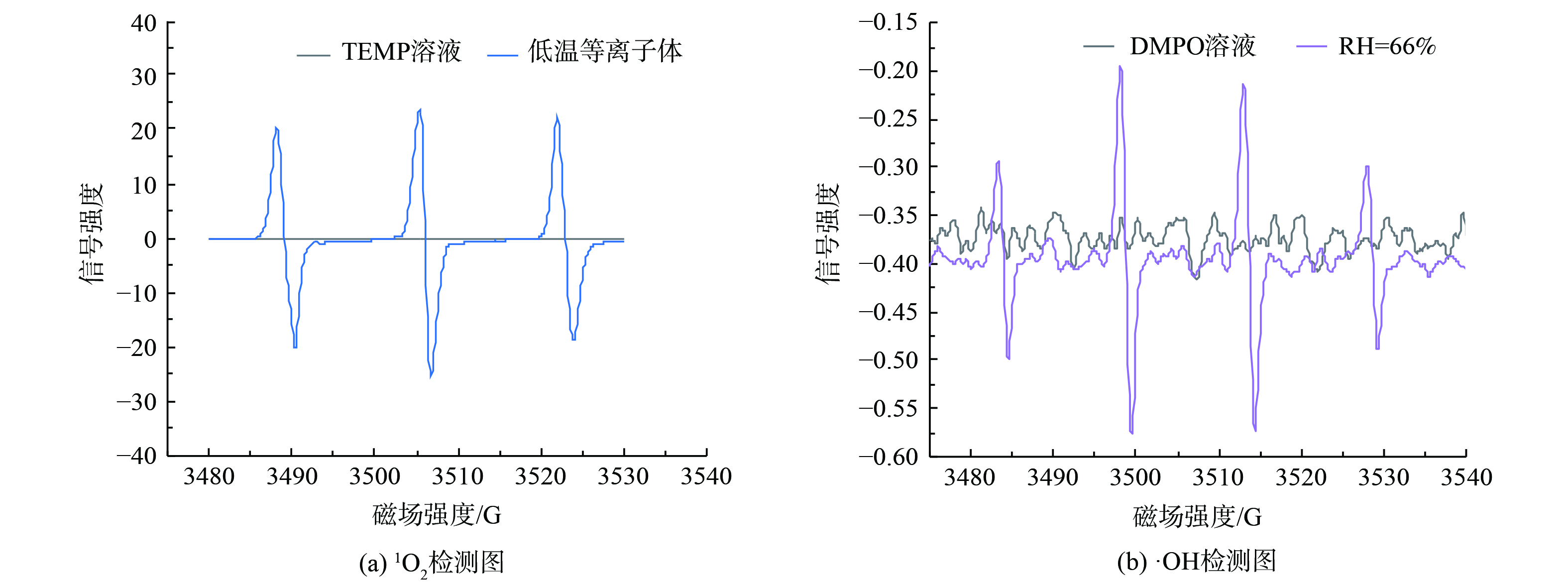
通过电子顺磁共振技术检测低温等离子体中短寿命的活性物种。以N2和O2混合气体作为工作气体通入反应器 (N2和O2的体积比为4:1) ,分别将捕获剂TEMP溶液及DMPO溶液暴露于低温等离子体气氛中检测1O2和·OH自由基。图6表明,液相样品中检测出的活性物种主要由放电产生。如图6(a) 所示,通过TEMP溶液成功捕获到低温等离子体中的单线态氧(1O2)。1O2是分子氧的最低电子激发态,同时也是高活性的非自由基活性氧物质[30]。单线态氧是一种反应性亲双烯体,与细胞内生物大分子的双价键发生特定加合反应,在细胞水平主要氧化功能性和结构性蛋白质,诱导细胞凋亡[31]。同样地,如图6(b) 可知,·OH自由基被DMPO溶液成功捕获。·OH的来源可分为两部分。在工作气体为干燥气体时会检测到少量的·OH,这部分羟基自由基来源于捕获剂液体样品的蒸发[32]。通过鼓泡加入一定H2O后,·OH自由基信号值显著增强,故一定量湿空气的加入有利于·OH的生成。而·OH是活性极强的活性氧物质,通常认为·OH是低温等离子体中主要起灭活作用的成分,其可以和氨基酸残基上的α氢原子发生反应,并引发自由基链反应,最终影响微生物的存活能力[33]。
-
分别对低温等离子体灭活前后的细菌气溶胶采样 (外加电压U=12 kV,流速v= 12 L·min−1,相对湿度RH=20%) ,通过测定细菌的可培养性、细胞膜完整性、蛋白质质量浓度及总有机碳 (TOC) 水平的差异来判断检测实验系统的灭活效果。
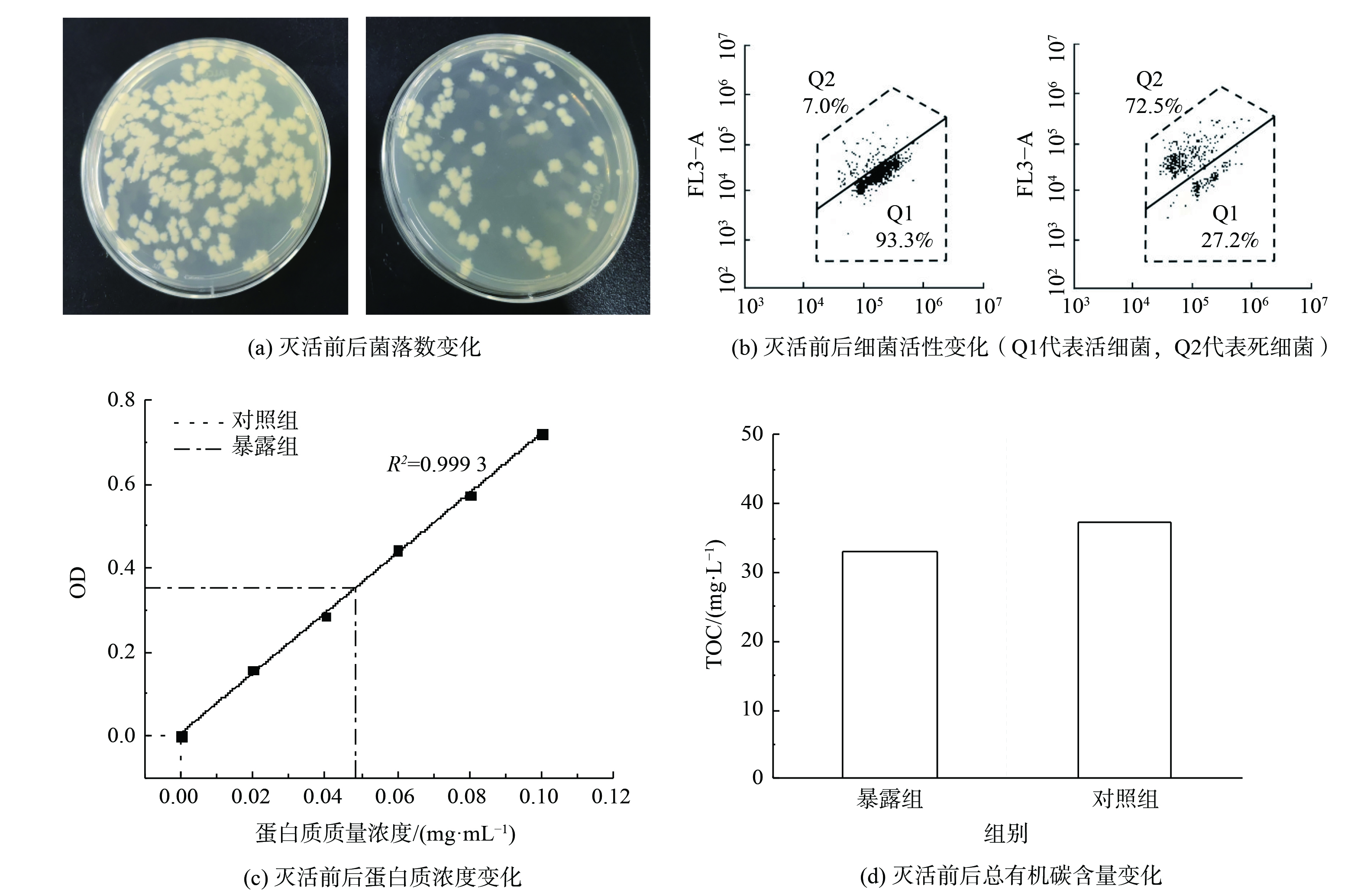
平板计数法是最常用的细菌活性评价方法。该方法是将样品中的活菌培养后计算菌落数。首先,由图7(a)可知,经过低温等离子体灭活后的细菌气溶胶菌落数明显减少,细菌可培养性降低,可计算出杀菌率为71%。其次,使用SYBR GreenⅠ/Propidium Iodide(SG/PI)双染检测细胞膜完整性,SG染料可与活菌细胞DNA结合,发出绿色荧光;PI染料只能穿过细胞膜受损的细胞,与其DNA结合发出红色荧光[7]。因此,以FL1和FL3通道收集荧光强度,经流式细胞仪检测后的结果如图7(b)所示。低温等离子体灭活处理前的枯草芽孢杆菌气溶胶活菌占比为93.3%。此时检测到的少量具有膜通透性的细菌归因于储存过程中产生的亚致死性损伤[34]。经低温等离子体处理后活菌比转变为27.2%,灭活效率为70.8%。这表明实验系统低温等离子体可实现枯草芽孢杆菌气溶胶有效灭活,且细菌细胞膜被破坏。流式细胞仪检测出的杀菌率近似等于平板计数法得到的杀菌率,二者之间的差异是流式细胞仪检测出的杀菌率略低。这是由于在灭活过程中,细菌首先失去了可培养性,然后失去膜完整性[35]。然后,通过考马斯亮蓝G-250染料与蛋白质结合的显色反应测定蛋白质含量。结果如图7(c)所示,经低温等离子体处理后的暴露组细菌悬液光密度(optical density,OD)增加,意味着枯草芽孢杆菌气溶胶通过低温等离子体中带电粒子、活性自由基等成分对细菌细胞膜的电穿孔和氧化破坏作用后,蛋白质产生泄露、细菌失活,此时蛋白质质量浓度有所增加[36]。最后,由图7(d)可知,与对照组相比,暴露在低温等离子体中的枯草芽孢杆菌气溶胶TOC含量降低。推测是由于低温等离子体中的活性组分攻击氨基酸等生物大分子,对细胞造成严重氧化损伤,使细胞胞内物质矿化为H2O和CO2[37]。本实验系统对枯草芽孢杆菌气溶胶的矿化率为11.4%,矿化效果不好。分析可能的原因有:第一,微生物气溶胶分子量大,较难矿化[38];第二,放电过程中放电功率较低,导致放电过程中产生的·OH、1O2等活性物种数量有限,从而对矿化效果产生影响。
-
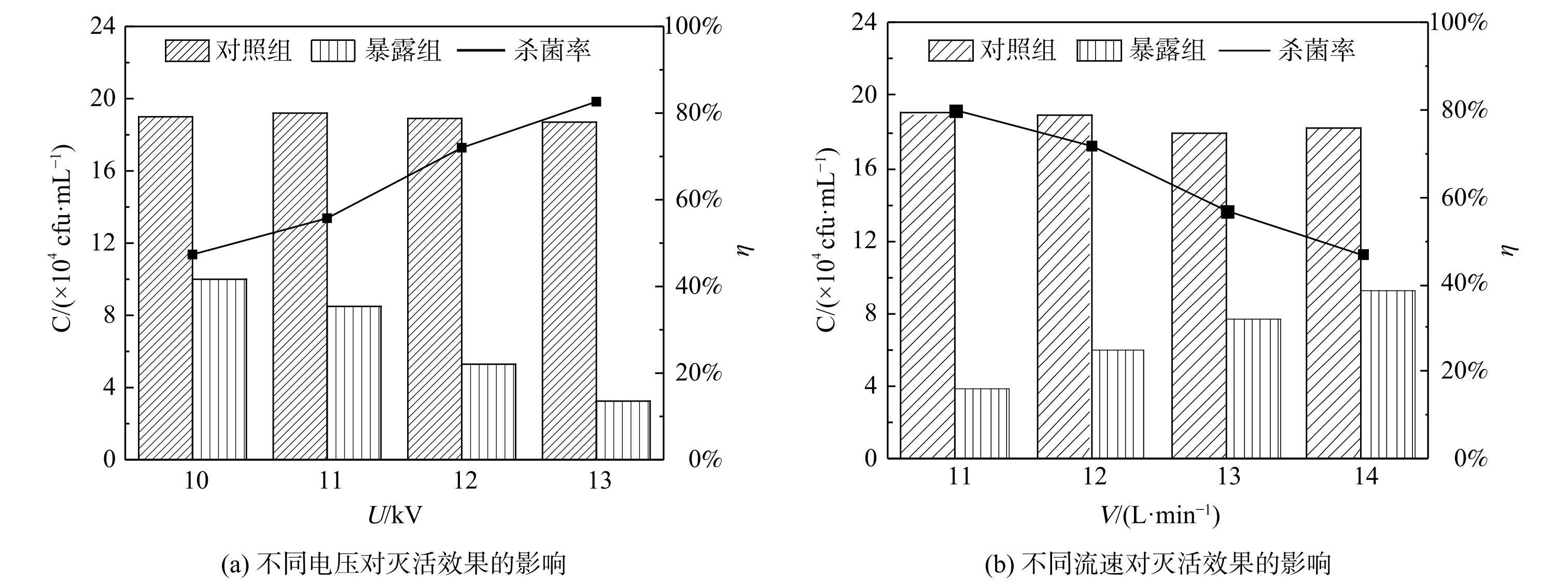
1) 不同电压对灭活效果的影响。研究了外加电压为10~13 kV时 (相对湿度RH=20%,流速v=12 L·min−1) 的杀菌效果。对低温等离子体暴露前后的枯草芽孢杆菌气溶胶采样后培养计数,每组实验重复3次,计算平均值,得到不同电压的杀菌率。结果如图8(a)所示,外加电压越高,杀菌率越高,灭活效果越好。这是由于随着外加电压的升高,介质阻挡放电产生的微放电数量增加,放电电流的大小和密度增加,放电强度增大[25]。每个电流细丝都可看作一个单独的反应通道,故增加的电流细丝可通过电离、激发等方式产生更多的带电粒子及活性粒子[39]。活性物种等与枯草芽孢杆菌气溶胶粒子的碰撞机率增加,通过破坏细胞膜、氧化蛋白质等作用来实现枯草芽孢杆菌气溶胶灭活[10]。
2) 不同流速对灭活效果的影响。选取流速为11~14 L·min−1 (相对湿度RH=20%,外加电压U=12 kV) 测试杀菌效果。如图8(b)所示,随着气体流速的增大,杀菌率呈下降趋势。因为在低温等离子体反应区长度一定的条件下,气体流速的大小决定了气体在反应器内停留时间的长短。气体流速越大,枯草芽孢杆菌气溶胶在反应器内停留时间越短,与·OH等活性粒子及正负带电粒子碰撞的机率减少,杀菌效果降低。
3) 不同相对湿度对灭活效果的影响。实验选取RH=20%、40%、60%和80%代表不同的相对湿度条件,在外加电压U=12 kV,气体流速v=12 L·min−1时研究不同相对湿度对微生物气溶胶灭活效果的影响 (图9) 。在不同相对湿度下,杀菌率呈先上升后下降的趋势。在低相对湿度情况下,杀菌率随着相对湿度的增加而增加,在RH=40%时达到最大值,为86%。当相对湿度进一步增加时,杀菌率逐渐下降。在RH=80%的高相对湿度条件下,杀菌率降为69%。分析产生此现象的原因可能是:在相对湿度较低时,一定水分的加入会产生更多的活性物质,尤其工作气体中的水分子是·OH的主要来源,有利于反应 e+H2O→e+·OH+·H的进行[40]。而·OH在灭活微生物时起重要作用,故灭活效率有所提高[7]。另一方面,随着水分子的加入,放电过程中产生的NOx易酸化形成HNO3,而HNO3具有强氧化性,对灭活微生物气溶胶有促进作用。但由于H2O是电负性气体,随着相对湿度的进一步提高,H2O会与放电过程中产生的电子形成负离子,而负离子在电场中运动缓慢,电离能力差,导致参与电子雪崩的有效电子数量减少,放电电流减小。同时,气体击穿电压增大,更不易击穿[41-43]。因此,在H2O含量较高的情况下,微生物气溶胶的灭活效率降低。
-
1) 介质阻挡放电过程呈微放电,放电强度和放电功率随着外加电压的增大而增大。低温等离子体产生过程中多以氮分子第二正系跃迁为主,通过捕获剂成功捕获到1O2和·OH自由基,说明放电过程产生了活性氮和活性氧,活性物质具有强氧化性可导致微生物气溶胶失去活性。
2) 经低温等离子体暴露后的枯草芽孢杆菌气溶胶可培养性降低了71%,细胞膜破损细菌占比72.5%,蛋白质产生泄露,泄露量为0.048 mg·mL−1,胞内有机物产生矿化,矿化率为11.4%。
3) 随着外加电压的升高,杀菌率呈上升趋势。在外加电压U=13 kV时,杀菌率达83%。杀菌率随气体流速的增大而降低,在气体流速v=14 L·min−1时,杀菌率降为47%。随着相对湿度的增加,杀菌率先升高后下降,在RH=40%时,杀菌率最高,为86%。
低温等离子体灭活微生物气溶胶的效果及影响因素
Inactivation effect of non-thermal plasma on bioaerosol and its influencing factors
-
摘要: 微生物气溶胶相关的突发性疫情时有发生,故研发新型高效的微生物气溶胶灭活技术已引起广泛关注。采用低温等离子体灭活枯草芽孢杆菌气溶胶,对低温等离子体电学特性和光学特性进行测定诊断,并测定活性氧。从细菌可培养性、细胞膜完整性、蛋白质泄露及细胞矿化4个方面分析评估灭活效果,并以杀菌率为指标,研究了外加电压、流速及相对湿度对灭活效果的影响。结果表明,低温等离子体可实现枯草芽孢杆菌气溶胶灭活,灭活效果显著。随着外加电压的增加,灭活效率呈上升趋势。在外加电压为10~13 kV时,对应灭活效率为48%~83%。灭活效率与流速成反比,随着流速的增加,灭活效率减小。流速为11~14 L·min−1时,灭活效率为80%~47%。在不同相对湿度条件下,灭活效率呈先上升后下降的趋势。在RH=40%时,灭活效率达到最大值,为86%。这表明低电压、高流速和高相对湿度不利于微生物气溶胶灭活。本研究结果可为低温等离子体灭活微生物气溶胶技术的应用提供参考。Abstract: Sudden outbreaks related to bioaerosols occur from time to time, so the development of new and efficient bioaerosols inactivation technology has attracted extensive attention.The purpose of this study was to inactivate the Bacillus subtilis aerosol using non-thermal plasma technology. The electrical and optical characteristics of the non-thermal plasma are measured and diagnosed, and reactive oxygen species are also measured.The inactivation effect is analyzed from the four aspects of bacterial cultivability, cell membrane integrity, protein leakage and cell mineralization.Using the sterilization rate as an indicator, the influence of the applied voltage, flow rate and relative humidity on the inactivation effect is studied. The results show that non-thermal plasma can inactivate the Bacillus subtilis aerosol significantly. The inactivation efficiency increases with the increase of applied voltage. When the applied voltage is 10~13 kV, the inactivation efficiency is 48%~83%. As the velocity of flow increases, the inactivation efficiency decreases. When the flow rate is 11~14 L·min−1, the inactivation efficiency is 80%~47%.Under different relative humidity conditions, the inactivation efficiency increased first and then decreased, and reached the maximum value of 86% when RH=40%.Therefore, it can be concluded that low voltage, high flow rate and high relative humidity are not conducive to bioaerosol inactivation.
-
Key words:
- bioaerosol inactivation /
- non-thermal plasma /
- inactivation effect /
- influencing factors
-

-
-
[1] JIANG Y F, WANG H F, CHEN L K, et al. Public and Global Health; Clinical Data on Hospital Environmental Hygiene Monitoring and Medical Staffs Protection during the Coronavirus Disease 2019 Outbreak[J]. Medical Letter on the CDC & FDA, 2020:https://doi.org/10.1101/2020.02.25.20028043. [2] XIAO F, TANG M W, ZHENG X B, et al. Evidence for gastrointestinal infection of SARS-CoV-2[J]. Gastroenterology, 2020, 158(6): 1831-1833. [3] HUMBAL C, GAUTAM S, TRIVEDI U. A review on recent progress in observations, and health effects of bioaerosols[J]. Environment International, 2018, 118: 189-193. doi: 10.1016/j.envint.2018.05.053 [4] 宋璐, 王灿, 孟格, 等. 气载致病微生物和空气消毒技术[J]. 中国给水排水, 2020, 36(6): 37-44. [5] PREHN F, TIMMERMANN E, KETTLITZ M, et al. Inactivation of airborne bacteria by plasma treatment and ionic wind for indoor air cleaning[J]. Plasma Processes and Polymers, 2020, 17(9): 1-12. [6] MA S, ZHAO Y, YANG J, et al. Research progress of pollutants removal from coal-fired flue gas using non-thermal plasma[J]. RENEWABLE & SUSTAINABLE ENERGY REVIEWS, 2017, 67: 791-810. [7] 梁文俊, 李晶欣, 竹涛, 等. 低温等离子体大气污染控制技术及应用 [M]. 北京: 化学工业出版社, 2016. [8] MOHAMMADREZA A, BAHRAM H, RAHIM E. Review on non-thermal plasma technology for biodiesel production: Mechanisms, reactors configuration, hybrid reactors[J]. Energy Conversion and Management, 2022, 258: 115514. doi: 10.1016/j.enconman.2022.115514 [9] 竹涛. 低温等离子体技术处理工业源VOCs [M]. 北京: 冶金工业出版社, 2017. [10] LIAO X Y, LIU D H, XIANG Q S, et al. Inactivation mechanisms of non-thermal plasma on microbes: A review[J]. Food Control, 2017, 75(1): 83-91. [11] BEGGS C B. A quantitative method for evaluating the photoreactivation of ultraviolet damaged microorganisms[J]. Photochemical & photobiological sciences:Official journal of the European Photochemistry Association and the European Society for Photobiology, 2002, 1(6): 431-437. [12] DENG X, SHI J, KONG M G. Physical Mechanisms of Inactivation of Bacillus subtilis spores using cold atmospheric plasmas[J]. IEEE Transactions on Plasma Science, 2006, 34(4): 1310-1316. [13] 马良军, 王佳媚, 黄明明, 等. 不同处理条件对介质阻挡放电低温等离子体杀菌效果及影响机理研究[J]. 微生物学报. 2019, 59(8): 1512-1521 [14] WANG Y, WANG T C, YUAN Y H, et al. Inactivation of yeast in apple juice using gas-phase surface discharge plasma treatment with a spray reactor[J]. LWT - Food Science & Technology, 2018, 97: 530-536. [15] LIN C M, HERIAN T S, SYU S M, et al. Applying a large-scale device using non-thermal plasma for microbial decontamination on shell eggs and its effects on the sensory characteristics[J]. LWT-Food Science & Technology, 2021, 142: 111067. [16] CHEN Z T, GARCIA G, ARUMUGASWAMI V, et al. Cold atmospheric plasma for SARS-CoV-2 inactivation[J]. Physics of fluids (Woodbury, N. Y. :1994), 2020, 32(11): 111702. [17] 李治一. 大气压低温等离子体射流的形成机理研究[D]. 北京: 北京交通大学, 2019. [18] YANG S, HUANG Y C, LUO C H, et al. Inactivation Efficiency of Bioaerosols Using Carbon Nanotube Plasma[J]. CLEAN – Soil, Air, Water, 2011, 39(3): 201-205. [19] 闫杨, 刘月静, 陈芳. 枯草芽孢杆菌的应用现状概述[J]. 生物学教学, 2019, 44(2): 2-3. doi: 10.3969/j.issn.1004-7549.2019.02.001 [20] 程立庆. 炭疽芽胞抗力弱化关键技术研究[D]. 重庆: 第三军医大学, 2010. [21] WU Q. Effect of high-power microwave on indicator bacteria for sterilization[J]. IEEE Transactions on Biomedical Engineering, 1996, 43(7): 752-754. [22] LI D Y, YU P F, ZHOU X F, et al. Hierarchical Bi2O2CO3 wrapped with modified graphene oxide for adsorption-enhanced photocatalytic inactivation of antibiotic resistant bacteria and resistance genes[J]. Water Research, 2020, 184: 116157. doi: 10.1016/j.watres.2020.116157 [23] GOU, J, XIAN, Y, LU, X. Low-temperature, high-density plasmas in long micro-tubes[J]. Physics of plasmas, 2016, 23(5): 053508. [24] LI S J, DANG X Q, YU X, et al. The application of dielectric barrier discharge non-thermal plasma in VOCs abatement: A review[J]. Chemical Engineering Journal, 2020, 388: 124275. doi: 10.1016/j.cej.2020.124275 [25] 庄凤芝, 蔡忆昔, 王军, 等. 常压介质阻挡放电平均放电电流的实验研究[J]. 高电压技术, 2008(10): 2140-2144. [26] 唐晓亮, 邱高, 王良, 等. 常压介质阻挡放电等离子体发射光谱的检测分析[J]. 光散射学报, 2006(02): 156-160. doi: 10.3969/j.issn.1004-5929.2006.02.011 [27] LIANG Y D, WU Y, SUN K, et al. Rapid inactivation of biological species in the air using atmospheric pressure nonthermal plasma[J]. Environmental science & technology, 2012, 46(6): 3360-3368. [28] 李嘉灵. 常压介质阻挡放电等离子体连续处理对PET纤维表面改性技术研究[D]. 上海: 东华大学, 2010. [29] 付悦, 侯书群, 黄相中, 等. 抗氧化剂对单线态氧(1O2)清除能力的一种生物评价方法[J]. 云南民族大学学报(自然科学版), 2016, 25(2): 114-120. [30] 崔宗杰. 单线态氧分子: 生物学和医学(英文)[J]. 北京师范大学学报(自然科学版), 2016, 52(6): 681-686. [31] Gorbanev Yury, O'Connell Deborah, Chechik Victor. Non-thermal plasma in contact with water: the origin of species[J]. Chemistry - A European Journal, 2016, 22(10): 3496-3505. [32] DAI Q, CHEN S, LI Y. Carcinogenesis of asbestos switched on by inducing cross-linkage between DNA complementary pair bases[J]. Chinese Science Bulletin, 2002, 47(13): 1086-1091. [33] 李可欣, 吴蔓莉, 高欢, 等. 基于流式细胞术的活性多环芳烃降解菌检测技术[J]. 分析学, 2021, 49(8): 1357-1365. [34] THANH N V, ROMBOUTS F M, NOUT M J R. Viability and physiological state transitions of Rhizopus oligosporus sporangiospores in tempe starter culture[J]. Antonie van Leeuwenhoek, 2007, 91: 35-34. [35] WEN G, CAO R H, WAN Q Q, et al. Development of fungal spore staining methods for flow cytometric quantification and their application in chlorine-based disinfection[J]. Chemosphere, 2020, 243: 125453. doi: 10.1016/j.chemosphere.2019.125453 [36] 陈绪松, 李栋, 刘志杰, 等. 等离子体射流灭活液体中铜绿假单胞菌的研究[J]. 微生物学通报, 2017, 44(4): 865-871. [37] WANG H, QU G Z, GAN Y S, et al. Elimination of Microcystis aeruginosa in water via dielectric barrier discharge plasma: Efficacy, mechanism and toxin release[J]. Journal of hazardous materials, 2021, 422: 126956. [38] LI D Y, YU P F, ZHOU X F, et al. Hierarchical Bi2O2CO3 wrapped with modified graphene oxide for adsorption-enhanced photocatalytic inactivation of antibiotic resistant bacteria and resistance genes[J]. Water research. 2020, 184: 116157. [39] YU X, DANG X Q, LI S J, et al A comparison of in- and post-plasma catalysis for toluene abatement through continuous and sequential processes in dielectric barrier discharge reactors[J]. Journal of Cleaner Production, 2020, 276: 124251. [40] VANDENBROUCKE A M. MORENT R, GEYTER N D, et al. Non-thermal plasmas for non-catalytic and catalytic VOC abatement[J]. Journal of Hazardous Materials, 2011, 195: 30-54. [41] 成军虎, 张彦, 韩忠. 低温等离子体技术灭活细菌芽孢的研究进展[J]. 现代食品科技, 2021, 37(4): 302-310. [42] 赵宪, 胡兆吉. 低温等离子体协同紫外光工艺处理甲苯[J]. 南昌大学学报(工科版), 2019, 41(2): 108-112. [43] 徐学基, 诸定昌. 气体放电物理[M]. 上海: 复旦大学出版社, 1996. -



 下载:
下载: