-
好氧颗粒污泥(aerobic granular sludge, AGS)是微生物在好氧环境中自凝聚形成的一种生物聚集体[1-2],其具有沉降性能优良、生物量高、耐有机负荷、同步脱氮除磷等优点[3-4]。这也使得AGS技术在污水处理领域有着广阔的应用前景[5]。关于AGS的理化特性、影响造粒的因素以及形成机理也有了广泛研究[6-7]。但AGS经长期储存后,颗粒污泥结构破坏、发生解体、微生物活性降低甚至丧失[8]。因此,探索可长期维持AGS储存稳定性及AGS储存后的活性快速恢复的方法是解决该技术工程化应用的关键和技术瓶颈[9-10]。
AGS的储存方法主要为湿式储存和干式储存。在蒸馏水中储存8个月的AGS大多数发生解体,且微生物几乎完全失去活性[11]。湿式储存方法因营养物质匮乏使AGS中的微生物内源呼吸作用增强,促进蛋白分解菌对蛋白质的降解,从而导致其结构稳定性丧失[12]。HU等[13]表明使用纯丙酮溶液干燥AGS可保持其结构完整性,但大部分微生物同样失活。LV等[14]采用丙酮梯度法将AGS干燥储存40 d后,其颗粒状立体结构保持较好,但颗粒内部微生物数量减少且活性显著降低,且使用丙酮干燥好氧颗粒污泥会造成二次污染,在实际工程应用中并不可取。
固定化微生物技术[15]是将特选的微生物固定在选择的载体上,使其高度密集并保持生物活性,有利于微生物抵抗不利环境的影响,其中包埋法在微生物固定化中最为常用,而海藻酸钠作为包埋材料对微生物毒性小且固定化密度高。赵珏等[16]采用琼脂包埋AGS,在4 ℃环境中储存30 d后,经过22 d的重新曝气才完全实现AGS的活性恢复。
因此,本研究为探究在4 ℃下海藻酸钠凝胶储存AGS的可行性,以海藻酸钠凝胶为载体进行AGS的储存实验,考察了储存前后AGS理化特性变化以及储存后AGS恢复情况,以期为AGS储存和储存后AGS快速恢复方法的选择提供有价值的参考。
-
采集在序批式反应器(sequencing batch reactor, SBR)中培养得到的AGS进行储存实验。AGS用二次蒸馏水清洗3遍,然后投入质量分数为11.5%的海藻酸钠溶液中,再将固液混合体缓慢倒入质量分数为4.0%氯化钙溶液中,使AGS包埋固定在海藻酸钠凝胶内,最后将含有AGS的海藻酸钠凝胶放置在4 ℃下避光储存7个月。
-
1) 接种污泥。以储存后的AGS作为接种污泥。将存有AGS的海藻酸钠凝胶块破碎,使储存后的AGS暴露在外界,为防止AGS中的微生物细胞进一步受损,使用0.01 mol·L−1的磷酸盐缓冲液缓慢清洗掉AGS表面的残留物。最后将清洗后的AGS接种至SBR中。
2) 实验用水。AGS恢复实验用水为人工配制的模拟废水,以葡萄糖和乙酸钠为混合碳源,氯化铵为氮源,磷酸二氢钾为磷源,用NaHCO3 调节进水 pH为7.5左右。具体水质指标:有机污染物浓度(以COD计)为500~1 000 mg·L−1,氨氮(NH4+-N)为80~120 mg·L−1,总氮(TN)为85~126 mg·L−1,总磷(TP)为6.7~11.2 mg·L−1。为保证AGS中的微生物正常生长,同时向进水中添加1 mL·L−1的微量元素溶液。微量元素溶液具体组成同李黔花等[17]方法。
3) 实验装置及其运行方式。在SBR中恢复储存后的AGS。反应器主体是由有机玻璃制成的圆柱体,其内径D为9.8 cm,总高度为100 cm,有效高度H为98 cm,有效高径比 H/D为10,反应器有效容积为7.39 L。SBR运行过程包括:进水、曝气、沉淀、排水和闲置5个阶段,运行周期为6 h,排出比为50%。在AGS恢复过程中SBR每天的运行参数和进水水质条件如表1所示。
-
AGS形态变化使用相机进行观察。混合液悬浮固体浓度(mixed liquid suspended solids, MLSS)、混合液挥发性悬浮固体浓度(mixed liquor volatile suspended solid, MLVSS)、污泥体积指数(SVI30)、COD、NH4+-N、TN、TP和COD容积负荷均采用国家标准方法测定[18],AGS的粒径采用湿式筛分法[19]确定,沉降速度采用重力沉降法测定[20]。采用热提取法[21]提取胞外聚合物(extracellular polymeric substance, EPS),EPS含量由蛋白质(protein, PN)和多糖(polysaccharide, PS)总含量表示,其中PS含量采用苯酚-硫酸法测定[22],PN含量采用BCA (bicinchoninic acid)分光光度法测定[23],EPS、PN和PS含量均以单位质量MLVSS计。脱氢酶活性(Dehydrogenase Activity, DHA)采用2,3,5—氯化三苯基四氮唑还原法进行测定[24],以单位质量MLVSS为计。
-
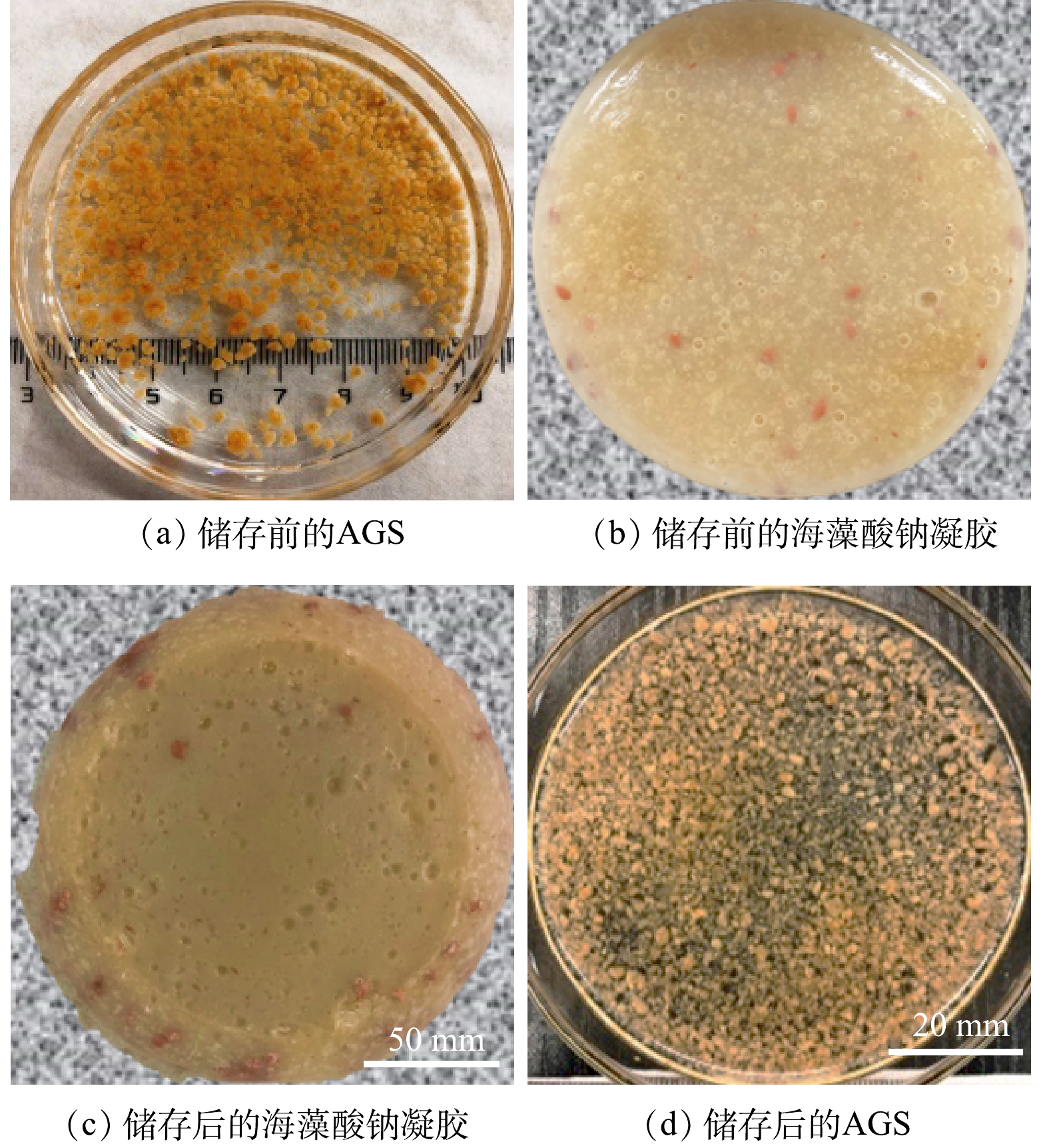
储存前后AGS和海藻酸钠凝胶变化情况如图1所示。AGS储存前为黄色,表面光滑且为球状,粒径主要分布在1.5~2.5 mm (图1(a))。作为AGS储存载体的海藻酸钠凝胶块表面较光滑,鲜亮透明(图1(b))。在4 ℃下储存7个月后,由于水分流失导致海藻酸钠凝胶块形状发生轻微变形,其体积有一定的收缩。而海藻酸钠凝胶块呈灰褐色,透明度明显降低(图1(c))。储存后的AGS呈淡黄色,少量AGS产生污泥碎片和絮状污泥;AGS粒径集中分布在0.6~1.5 mm。与储存前相比,储存后的AGS特性指标均出现下降(表2),其沉降性能(沉降速度)、微生物量(MLVSS/MLSS)和DHA分别下降了43.93%、22.22%和43.34%。与其他研究结果[25-27]相比,该实验储存后的AGS结构完整性、沉降性能和微生物活性均较优。通过以上实验结果可初步判定在4 ℃环境中,采用海藻酸钠凝胶长期储存AGS具有可行性。该储存方法可较好地保持AGS 结构完整性,并在一定程度上维持AGS 的微生物活性。
-
1) AGS外观变化。图2为AGS在恢复过程中的外观变化。恢复第4天时的AGS外观如图2(a)所示,呈白色,颗粒状结构不规则且表面粗糙。随后为了改善AGS表面的粗糙情况,进一步提高曝气量,即AGS所受的水力剪切力增加。因此,大部分形状不规则的AGS在较大剪切力的作用下转化为规则的球状。恢复到第9天时,AGS为黄褐色,整体呈球状或椭球状的立体结构,大多数AGS粒径分布在1.3~2.5 mm (图2(b));经测定发现,此时AGS的SVI30为31.9 mL·g−1,沉降速度为92.71 m·h−1,MLSS为25 830 mg·L−1,MLVSS/MLSS为0.70,EPS质量分数为75.05 mg·g−1,DHA为86.21 μg·(g·h)−1,表明长期储存后的AGS经过9 d的再培养即可完全恢复到储存前的性状。GAO等[11]将AGS储存在−25 ℃环境中8个月,经过10 d的再培养重新恢复AGS活性;而ZHANG等[28]耗时14 d才恢复AGS的结构完整性和活性。
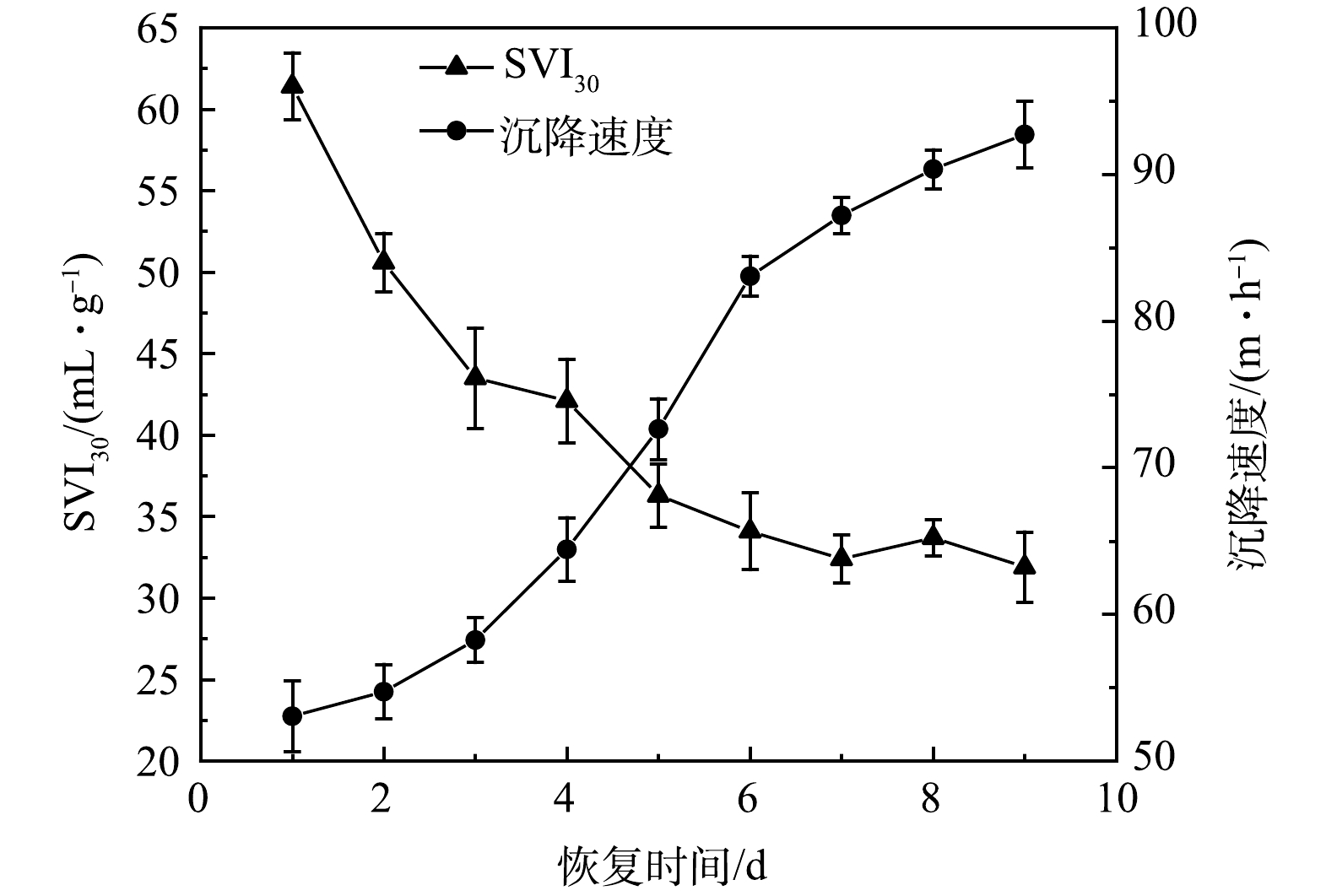
2) SVI30和沉降速度变化。在AGS恢复过程中,SVI30整体呈下降趋势,沉降速度整体呈增加趋势,如图3所示。恢复第1天,AGS的SVI30为61.4 mL·g−1,沉降速度为53.06 m·h−1。与储存前相比,SVI30增加了53.3%,而沉降速度下降了43.93%。在恢复初期,因为沉降性能较差的污泥被排出SBR反应器,所以SVI30明显降低,而此时部分解体的AGS正处于恢复阶段,其沉降速度增加缓慢。从第3天开始沉降速度开始增加,第6天沉降速度增加到83.05 m·h−1。随着AGS恢复程度不断推进,AGS的沉降性能也在不断提高,第9天, AGS的SVI30为31.9 mL·g−1,沉降速度为92.71 m·h−1,表明恢复后的AGS结构密实,沉降性能良好。
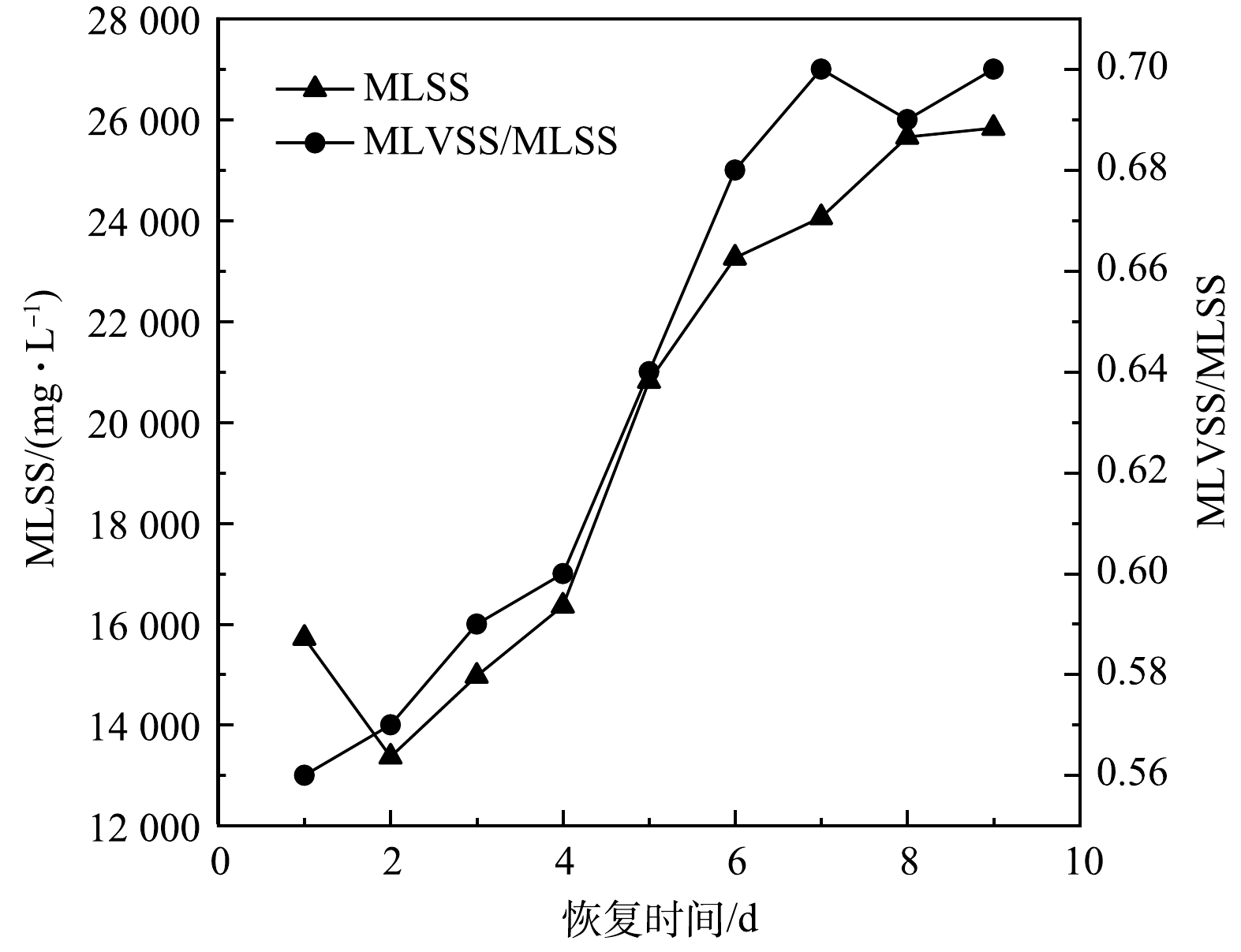
3) MLSS和MLVSS/MLSS变化。图4为AGS在恢复过程中MLSS和MLVSS/MLSS的变化情况。在AGS恢复的第1~2天中,由于污泥沉降时间缩短,大量絮状污泥被排出SBR,因此,AGS的MLSS突然下降。从第2天开始,MLSS开始增加,在第4天达到16 360 mg·L−1,超过储存时的MLSS,在第9天MLSS达到25 830 mg·L−1。此外,由图4可见,AGS恢复第1天时的MLVSS/MLSS为0.56,随着微生物对生活环境的适应,从第3天起,MLVSS/MLSS开始显著增加。因为在长期储存过程中,AGS内部微生物因营养物质匮乏而经历了长时间的饥饿期,在微生物适应SBR的运行条件并获得营养物质的情况下开始大量生长繁殖。第7天起,MLVSS/MLSS相对较为稳定,维持在0.69~0.7,在第9天时MLVSS/MLSS为0.70。
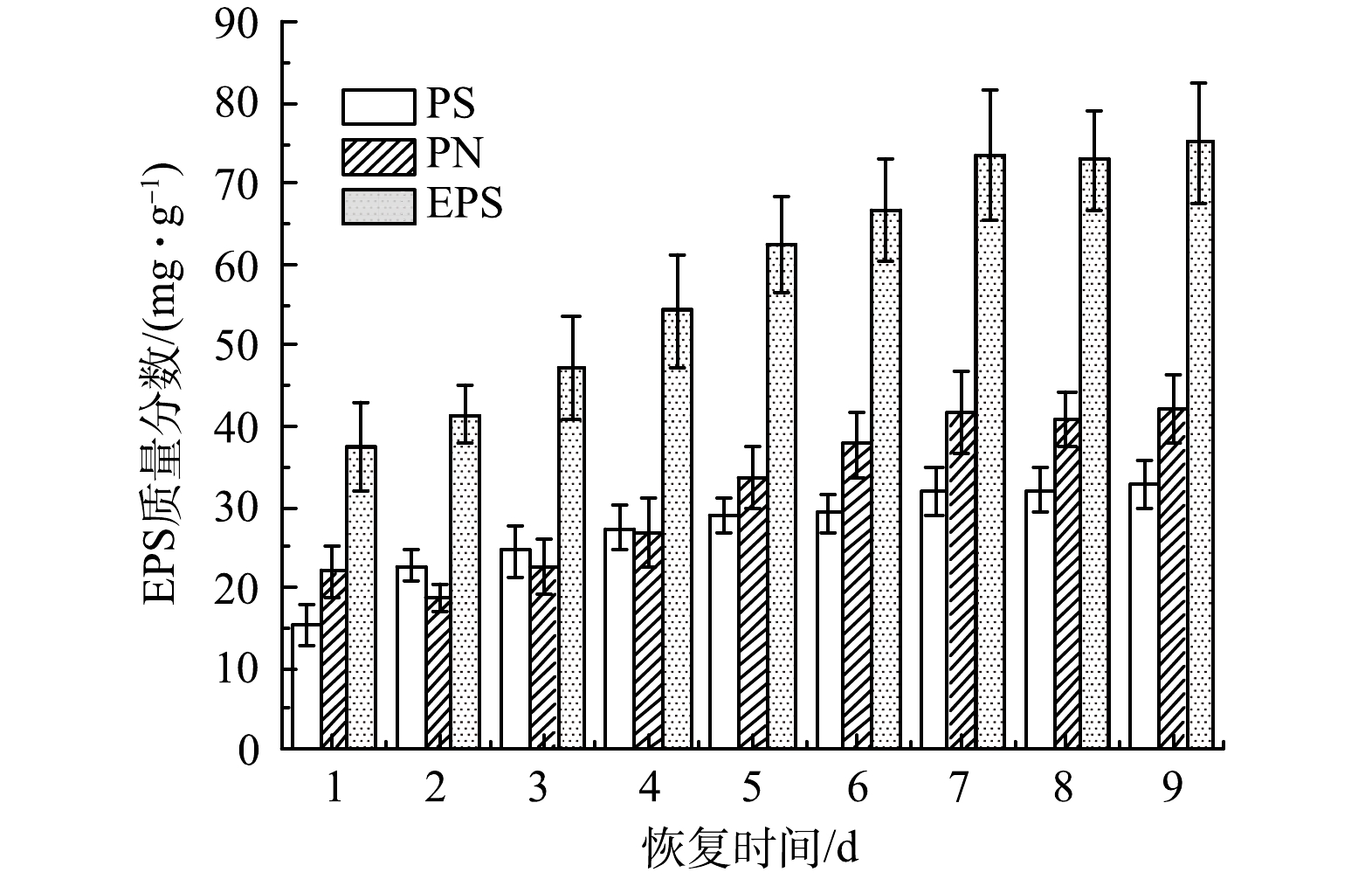
4) EPS、PN和PS变化。图5为AGS在恢复过程中EPS、PS和PN的含量变化情况。在AGS恢复的第1~2天,PS含量增加,PN含量减少。这是因为在新环境条件刺激下,AGS中的微生物需分泌大量PS来维持其正常生命活动[29];由于SBR的选择压增强,即沉降时间缩短,曝气量和COD提高,破坏微生物细胞间信息交流的动态平衡,使微生物的新陈代谢活动受到抑制,因此PN含量出现下降趋势。随着AGS逐渐恢复,EPS和PN含量不断增加,在第7天EPS和PN质量分数分别为73.67 mg·g−1和41.84 mg·g−1,而PS基本维持在25~31 mg·g−1。在整个恢复过程中,AGS的EPS含量处于上升趋势,这与HE等[30]的研究结果一致。当AGS完全恢复时(第9天),PN含量明显高于PS,说明EPS的主要成分为PN,此时EPS、PN和PS质量分数分别为75.05、42.22和32.83 mg·g−1。
5) 脱氢酶(DHA)的变化。脱氢酶是微生物分泌的大分子有机物,能帮助微生物催化底物脱氢,其活性大小间接反映了污泥活性的强弱[31-32],所以采用脱氢酶活性表征恢复过程中的AGS微生物活性[33]。图6为AGS的DHA在恢复过程中的变化情况。第1~3天,因AGS中的微生物正处于对SBR运行条件的适应阶段,所以DHA增加较为平缓,由恢复前的46.83 μg·(g·h)−1增至51.34 μg·(g·h)−1。从第3天起,因为AGS中的微生物对环境适应后开始大量生长、繁殖(图4),故DHA开始显著增加,在第8天其增加到85.27 g·(g·h)−1;当AGS完全恢复活性时(第9天),DHA为86.21 μg·(g·h)−1。
-
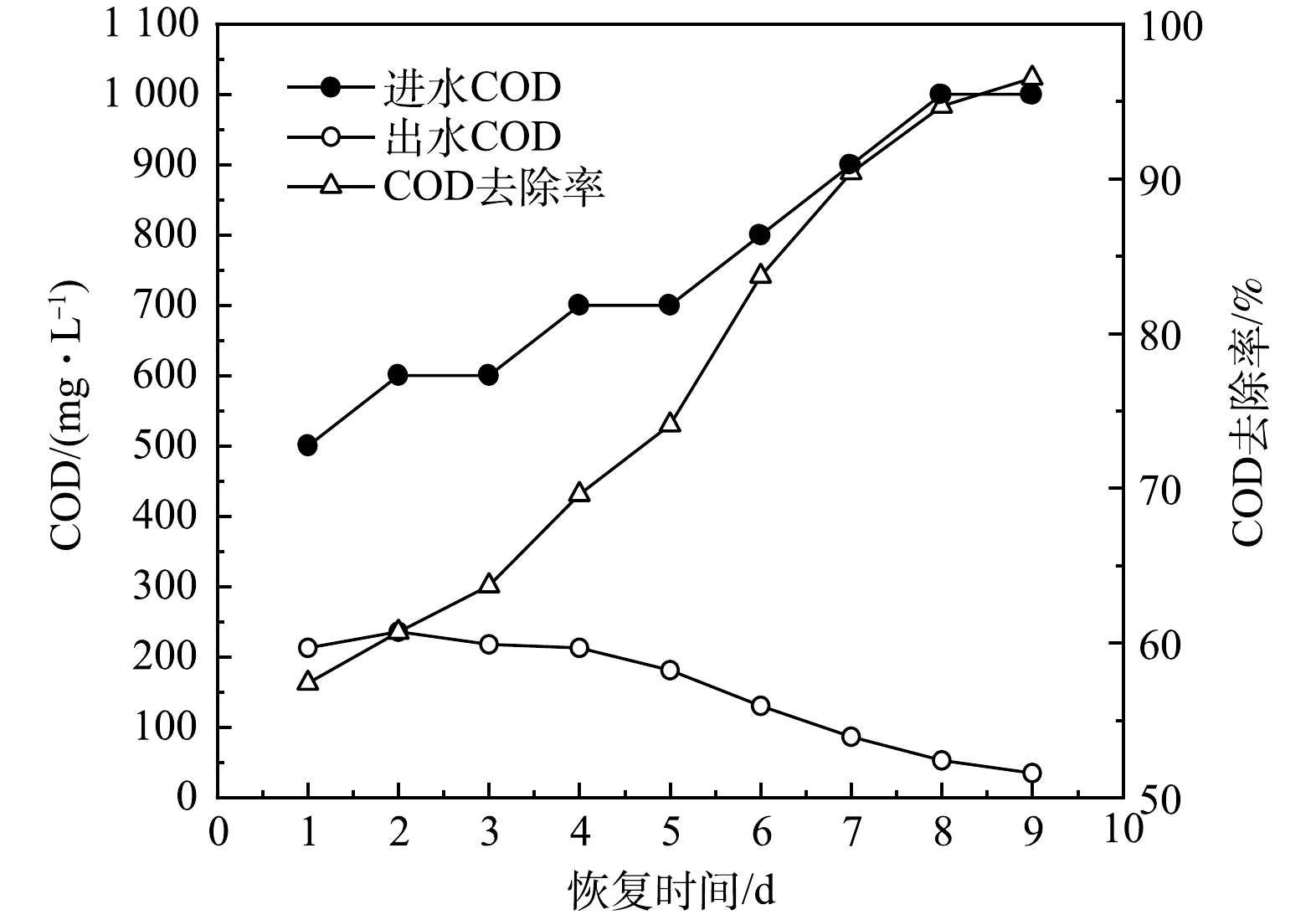
1) AGS去除COD的效果变化。AGS对COD的去除效果变化如图7所示。第1天进水COD为500 mg·L−1,出水COD为213 mg·L−1,COD去除率为57.4%。由于储存后的AGS中部分微生物失去活性,因此与储存前相比,COD去除率降低。随着SBR反应器不断运行,AGS中的微生物量增加且微生物活性也在逐渐恢复,使AGS对COD的去除率出现增加趋势。反应器运行到第5天时, 因为SBR中部分解体的AGS得到恢复,絮状污泥被排出反应器,颗粒状污泥占主体。所以从第5天起,AGS对COD的去除率显著增加。第9天时AGS对进水中的COD去除率达到96.5%,而储存前的AGS对进水COD的去除率为95%[34]。
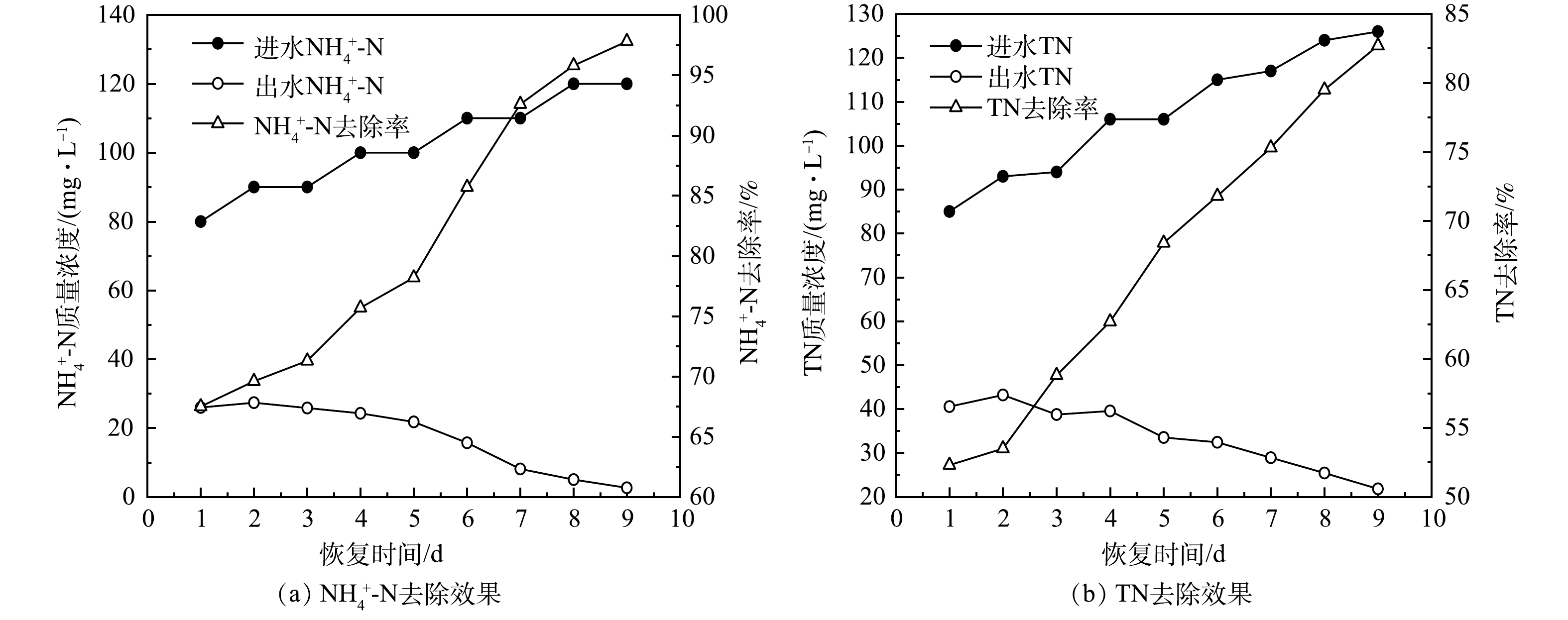
2) AGS 对NH4+-N和TN的去除效果。AGS对NH4+-N和TN的去除效果如图8所示。SBR运行的第1天,AGS对NH4+-N和TN的去除率分别为67.5%和52.3%。一方面,因为储存后的AGS内部微生物活性低,仅靠微生物的同化作用将进水中的部分氮转化为自身细胞原生质成分;另一方面,部分结构完整性保持较好的AGS,其具有同步实现硝化和反硝化的微观环境[35-36],所以在恢复初期AGS对NH4+-N和TN具有一定的去除效果。第5天,进水NH4+-N为100 mg·L−1、进水TN为106 mg·L−1的条件下,AGS对NH4+-N和TN的去除率分别为78.2%、68.4%。随着SBR反应器不断运行,解体的AGS恢复颗粒状结构,部分细小的颗粒污泥粒径增大,硝化和反硝化作用也随之加强,促进了AGS对进水中氮的去除。第9天, AGS对NH4+-N和TN的去除率分别达到了97.8%、82.7%。恢复后的AGS对TN的去除率略高于储存前的去除率(储存前的去除率为80%)。
3)AGS去除TP的效果变化。AGS对TP的去除效果变化如图9所示。SBR运行初期(第1~3天),由于污泥沉降时间缩短(由15 min降至12 min),使储存后形成的AGS碎片和絮状污泥被排出SBR,因此,AGS对TP的去除率由48.5%增加到78.3%。当SBR运行到第4天时,因为部分解体的AGS结构完整性恢复,其沉降性能进一步改善,大量沉降性能较好的AGS被截留在SBR内,导致污泥排出量减少,所以AGS对TP的去除率降至73.1%,随后 AGS的除磷效率基本维持在73%左右。此时,AGS对TP的去除率已超过储存前的去除率(70%)。第9天时,在进水TP为11.2 mg·L−1的条件下,AGS对TP的去除率为73.5%。结合第9天的AGS对进水COD、NH4+-N和TN去除效果发现: SBR运行连续9 d,即可将储存后的AGS除污效果完全恢复到储存前的水平。
-
1)在4 ℃下用海藻酸钠凝胶储存AGS具有可行性,该储存方法可较好地维持AGS 的结构完整性和微生物活性。储存后的 AGS粒径、沉降速度、MLVSS/MLSS和DHA与储存前相比均有降低。
2)恢复过程中,AGS的粒径、沉降速度、MLVSS/MLSS、DHA及EPS质量分数均呈现不同程度的增加趋势。随着进水中的污染物浓度逐渐增加,AGS对COD、NH4+-N、TN和TP的去除效果也随之增加。
3)经过9 d的再培养,储存7个月的AGS活性完全恢复到储存前的水平。恢复后的AGS为黄褐色,具有较好的沉降性能和微生物活性。恢复后的AGS具有良好的除污效果,与储存前相比,其对进水中的COD、NH4+-N、TN和TP的去除率均略有增加,分别达到96.5%、97.8%、82.7%、73.5%。
4)在后续研究中,探究海藻酸钠凝胶在常温、低温环境中储存AGS的效果,考察海藻酸钠凝胶对AGS储存稳定性的影响。在以上研究基础上,对AGS的微观结构进行详细研究、分析,包括AGS的微观形貌、组成元素,储存过程中的微生物菌落及EPS组成变化等,进一步探究海藻酸钠凝胶储存AGS的作用机制。
海藻酸钠凝胶储存好氧颗粒污泥及其活性恢复
Storage of aerobic granular sludge by sodium alginate gel and its recovery analysis
-
摘要: 采用质量分数11.5%的海藻酸钠凝胶为载体,在4 ℃下避光储存好氧颗粒污泥(AGS) 7个月,并将储存后的AGS进行活性恢复。分析了储存前后AGS理化特性变化以及储存后AGS恢复情况,以期为AGS储存和储存后AGS快速恢复方法的选择提供有价值的参考。结果表明:部分AGS在储存过程中发生解体,颗粒粒径变小,沉降速度、MLVSS/MLSS和脱氢酶活性(DHA)分别下降了43.93%、22.22%和43.34%,说明在4 ℃下使用海藻酸钠凝胶储存AGS具有可行性,该储存方法在一定程度上可维持AGS 的结构完整性和微生物活性。经过9 d的再培养,AGS完全恢复到储存前水平。恢复后的AGS为黄褐色,表面光滑,整体呈球状或椭球状,颗粒粒径主要分布在1.3~2.5 mm,SVI30为31.9 mL·g−1,沉降速度为92.71 m·h−1,胞外聚合物(EPS)质量分数为75.05 mg·g−1,DHA为86.21 μg·(g·h)−1,表明恢复后的AGS沉降性能较好,微生物活性较高。恢复后的AGS对COD、NH4+-N、TN和TP的去除率分别为96.5%、97.8%、82.7%、73.5%,具有良好的除污效果。Abstract: Aerobic Granular Sludge (AGS) was stored at 4 ℃ in the dark for 7 months with 11.5% sodium alginate gel as carrier, and the activity of the stored AGS was recovered. The physical and chemical properties of AGS before and after storage as well as the recovery of AGS after storage were analyzed, in order to provide a valuable reference for the selection of AGS storage methods and rapid recovery of AGS after storage. The results showed that some AGS disintegrated during storage, their particle size became smaller, and the sedimentation velocity, MLVSS/MLSS and Dehydrogenase Activity (DHA) decreased by 43.93%, 22.22% and 43.34%, respectively, indicating that it was feasible to use sodium alginate gel to store AGS at 4 ℃. The storage method could maintain the structural integrity and microbial activity of AGS to some extent. After 9 days of recultivation, the AGS recovered completely. The recovered AGS was yellowish brown with smooth surface and spherical or ellipsoid shape, the particle size was mainly distributed in 1.3-2.5 mm, the SVI30 was 31.9 mL·g−1, the sedimentation velocity was 92.71 m·h−1, the extracellular polymeric substance (EPS) concentration was 75.05 mg·g−1 and the DHA was 86.21 μg·(g·h)−1, which indicated that the recovered AGS had a better settling performance and higher microbial activity. The recovered AGS had good removal effects of pollutants, and the removal rates of COD, NH4+-N TN and TP were 96.5%, 97.8%, 82.7% and 73.5%, respectively.
-
Key words:
- aerobic granular sludge /
- sodium alginate gel /
- storage /
- reactivation /
- activity
-

-
表 1 SBR反应器运行参数和条件
Table 1. Operating parameters and conditions of SBR reactor
运行时间/d 各阶段时长/min 曝气量/(m3·h−1) COD、氨氮、总氮和总磷/(mg·L−1) COD容积负荷/(g·(L·d)−1) 进水 曝气 沉淀 排水 闲置 COD NH4+-N TN TP 1 4 338 15 1 2 0.12~0.3 500 80 85 6.7 0.41 2 4 339 14 1 2 0.32 600 90 93 7.5 0.48 3 4 341 12 1 2 0.34 600 90 94 7.8 0.48 4 4 343 10 1 2 0.36 700 100 106 8.4 0.65 5 4 344 9 1 2 0.37 700 100 106 8.6 0.65 6 4 347 6 1 2 0.39 800 110 115 9.2 0.83 7 4 349 4 1 2 0.43 900 110 117 10.6 1.16 8 4 351 2 1 2 0.46 1000 120 124 11.7 1.36 9 4 351 2 1 2 0.5 1000 120 126 11.2 1.36 表 2 AGS储存前后理化特性指标变化
Table 2. Changes of physicochemical properties of AGS before and after storage
储存时间/d SVI30/(mL·g−1) MLSS/(mg·L−1) 沉降速度/(m·h−1) MLVSS/MLSS EPS/(mg·g−1) PN/(mg·g−1) PS/(mg·g−1) DHA/(μg·(g·h)−1) 0 28.7±1.95 24 140 94.63±1.27 0.72 68.60±6.13 41.86±4.61 26.74±2.85 82.65±3.02 210 61.4±2.06 15 720 53.06±2.41 0.56 37.48±5.61 21.96±3.05 15.52±2.56 46.83±2.74 -
[1] KHAN M Z, MONDAL P K, SABIR S. Aerobic granulation for wastewater bioremediation: A review[J]. Canadian Journal of Chemical Engineering, 2013, 91(6): 1045-1058. doi: 10.1002/cjce.21729 [2] 郭海娟, 顾一宁, 马放, 等. 好氧颗粒污泥处理市政污水性能与微生物特性研究[J]. 环境科学学报, 2020, 40(10): 3688-3695. doi: 10.13671/j.hjkxxb.2020.0404 [3] KONG Q, NGO H H, SHU L, et al. Enhancement of aerobic granulation by zero-valent iron in sequencing batch airlift reactor[J]. Journal of Hazardous Materials, 2014, 279(1): 511-517. [4] PRONK M, BASSIN J P, DE KREUK M K, et al. Evaluating the main and side effects of high salinity on aerobic granular sludge[J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1339-1348. doi: 10.1007/s00253-013-4912-z [5] BENGTSSON S, DE BLOIS M, WILÉN B M, et al. A comparison of aerobic granular sludge with conventional and compact biological treatment technologies[J]. Environmental Technology, 2019, 40(21): 2769-2778. doi: 10.1080/09593330.2018.1452985 [6] ZHANG Q G, HU J J, LEE D J. Aerobic granular processes: Current research trends[J]. Bioresource Technology, 2016, 210: 74-80. doi: 10.1016/j.biortech.2016.01.098 [7] 苏海佳, 王陆玺, 邓爽, 等. 好氧颗粒污泥技术及研究进展[J]. 化工进展, 2016, 35(6): 1914-1922. doi: 10.16085/j.issn.1000-6613.2016.06.033 [8] LEE D J, CHEN Y Y, SHOE K Y, et al. Advances in aerobic granule formation and granule stability in the course of storage and reactor operation[J]. Biotechnology Advances, 2010, 28(6): 919-934. doi: 10.1016/j.biotechadv.2010.08.007 [9] SARMA S J, TAY J H, CHU A. Finding knowledge gaps in aerobic granulation technology[J]. Trends in Biotechnology, 2017, 35(1): 66-78. doi: 10.1016/j.tibtech.2016.07.003 [10] CORSINO S F, DI TRAPANI D, TORREGROSSA M, et al. Aerobic granular sludge treating high strength Citrus wastewater: analysis of pH and organic loading rate effect on kinetics, performance and stability[J]. Journal of Environmental Management, 2018, 214(1): 23-35. [11] GAO D W, Yuan X J, Liang H. Reactivation performance of aerobic granules under different storage strategies[J]. Water Research, 2012, 46(10): 3315-3322. doi: 10.1016/j.watres.2012.03.045 [12] ADAV S S, LEE D J, LAI J Y. Proteolytic activity in stored aerobic granular sludge and structural integrity[J]. Bioresource Technology, 2009, 100(1): 68-73. doi: 10.1016/j.biortech.2008.05.045 [13] HU J J, ZHANG Q G, CHEN Y Y. et al. Drying and recovery of aerobic granules[J]. Bioresource Technology, 2016, 218: 397-401. doi: 10.1016/j.biortech.2016.06.121 [14] LV Y, WAN C L, LIU X, et al. Drying and re-cultivation of aerobic granules[J]. Bioresource Technology, 2013, 129(2): 700-703. [15] 赵欣欣, 孙玲, 董玉玮, 等. 固定化微生物技术及其在污水处理中的应用[J]. 水处理技术, 2015, 41(7): 17-20. [16] 赵珏, 宣鑫鹏, 程媛媛, 等. 琼脂包埋好氧颗粒污泥的储存及恢复[J]. 中国给水排水, 2018, 34(3): 23-29. [17] 李黔花, 李志华, 岳秀, 等. 好氧颗粒污泥处理印染废水的效能及其微生物特征[J]. 工业水处理, 2020, 40(3): 43-48. doi: 10.11894/iwt.2019-0056 [18] 国家环境保护总局. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社, 2002. [19] 刘前进. 好氧颗粒污泥培养及其在苯酚溶液中储存稳定性研究[D]. 广东工业大学, 2021. [20] 王硕. 低温好氧颗粒污泥形成过程及其特性研究[D]. 哈尔滨: 哈尔滨工业大学, 2013. [21] 张云霞, 季民, 李超, 等. 好氧颗粒污泥胞外聚合物(EPS)的生化性研究[J]. 环境科学, 2008, 29(11): 3124-3127. doi: 10.3321/j.issn:0250-3301.2008.11.023 [22] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugar and related substances[J]. Analytical Chemistry, 1956, 28(5): 250-256. [23] WALKER J M. The bicinchoninic acid (BCA) assay for protein quantitation[J]. Methods in Molecular Biology, 1994, 32: 5-8. [24] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. [25] XU H C, HE P J, WANG G Z, et al. Enhanced storage stability of aerobic granules seeded with pellets[J]. Bioresource Technology, 2010, 101(21): 8031-8037. doi: 10.1016/j.biortech.2010.05.062 [26] WAN C, ZHANG Q, LEE D J, et al. Long-term storage of aerobic granules in liquid media: Viable but non-culturable status[J]. Bioresource Technology, 2014, 166(8): 464-470. [27] 陈垚, 张志敏, 袁绍春, 等. 高盐好氧颗粒污泥低温储存后活性恢复研究[J]. 中国给水排水, 2015, 31(5): 22-25. [28] ZHANG L L, ZHANG B, HUANG Y F, et al. Re-activation characteristics of preserved aerobic granular sludge[J]. Journal of Environmental Sciences, 2005, 17(4): 655-658. [29] DURMAZ B, SANIN F D. Effect of carbon to nitrogen ratio on the composition of microbial extracellular polymers in activated sludge[J]. Water Science & Technology, 2001, 44(10): 221-229. [30] HE Q, ZHANG W, ZHANG S, et al. Performance and microbial population dynamics during stable operation and reactivation after extended idle conditions in an aerobic granular sequencing batch reactor[J]. Bioresource Technology, 2017, 238: 116-121. doi: 10.1016/j.biortech.2017.03.181 [31] WLODARCZYK T, STEPNIEWSKI W, BRZEZINSKA M. Dehydrogenase activity, redox potential, and emissions of carbon dioxide and nitrous oxide from cambisols under flooding conditions[J]. Biology & Fertility of Soils, 2002, 36(3): 200-206. [32] 李静, 严红, 肖本益. 活性污泥活性的表征及其检测方法研究[J]. 工业水处理, 2016, 36(8): 5-10. doi: 10.11894/1005-829x.2016.36(8).005 [33] ZHANG Y, ZHAO X H. The effects of powdered activated carbon or ferric chloride on sludge characteristics and microorganisms in a membrane bioreactor[J]. Desalination and Water Treatment, 2014, 52(37/38/39): 6868-6877. [34] 刘前进, 刘立凡. 混合碳源的好氧颗粒污泥培养及其除污效果分析[J]. 环境工程学报, 2021, 15(03): 962-971. doi: 10.12030/j.cjee.202006106 [35] 王佳伟, 高永青, 孙丽欣, 等. 中试SBR内好氧颗粒污泥培养和微生物群落变化[J]. 中国给水排水, 2019, 35(7): 1-7. doi: 10.19853/j.zgjsps.1000-4602.2019.07.001 [36] 冷璐, 信欣, 鲁航, 等. 同步硝化反硝化耦合除磷工艺的快速启动及其运行特征[J]. 环境科学, 2015, 36(11): 4180-4188. -



 下载:
下载: