-
菌渣含有丰富的蛋白、多糖、氨基酸等营养物质,若不对其充分利用,则会造成资源浪费。我国每年产生数量庞大的菌渣,其中好氧堆肥技术是实现菌渣资源化最常用途径。然而,传统堆肥腐熟过程是由自然微生物参与的生理生化过程,存在堆肥周期长、腐熟较慢等缺点[1]。目前,接种外源微生物促进堆肥过程[2]是好氧堆肥应用的常用方式。在应用广泛的外源添加物中,微生物菌剂的添加不仅能加速堆肥进程[3-5],还可以提高堆肥产品品质。在堆肥初期,接种微生物菌剂可通过菌群联合作用缩短发酵周期[6]。因此,国内外众多学者致力于培养不同功能的微生物菌剂应用于堆肥,使其快速升温,进而缩短堆肥周期。
固态菌剂可弥补液体菌剂存货短、不易运输的缺陷[7],故得到了广泛应用。目前,常见固态菌剂的制备方法有真空干燥法、低温冷冻干燥、喷雾干燥法等。而微生物固定化技术中的“吸附-包埋”法是近年来新兴的固态菌剂制备技术[8-10]。该技术的产品质量及保质期表现优异,广泛应用于大气和水处理中,但在农业固废处理中的应用却鲜有报道。
本研究利用“吸附-包埋”技术,以多孔淀粉为载体吸附剂[11-13],将吸附筛选出的微生物进行冷冻干燥[14-18]得到“吸附”产品,即包埋基础产品,再将该产品通过“包埋”技术制备出可应用于菌渣堆肥体系中的新型固态菌剂,并对每个步骤的产品进行效果验证,以期为农用微生物菌剂的制备提供参考。
-
1) 供试菌株。供试菌株为课题组前期筛选的堆肥用芽孢杆菌,编号为B402、B409、B508。参考文献[19]的方法制备混合菌剂:利用1.5 L Biltech-3JG-2发酵罐进行混菌发酵;优化培养基为NB,加入15 g·L−1葡萄糖和15 g·L−1酵母粉;培养参数为pH 7.5、转速 250 r·min−1、DO通气比(每分钟通气量与罐体实际料液体积的比值)为2.25 。制得混合菌液记为液态菌剂M,混合菌液的活菌数数量级为1010 cfu·mL−1。
2) 吸附载体及冻干保护剂。载体为多孔淀粉,购买于西安某科技公司,其产品质量符合国家标准(GB 31637-2016)。冻干保护剂有3类:糖类保护剂(乳糖、蔗糖、葡萄糖、海藻糖)、醇类保护剂(甘露醇)、防腐剂(硫代硫酸钠、抗坏血酸、维生素E)。
3) “吸附-包埋”制备法。将液态菌剂M与多孔淀粉按特定比例混合,投加保护剂后置于−80 ℃低温冰箱中预处理30 min;将预处理后的样品置于冷冻干燥机中,等待20~30 min,直到冷冻舱温度低于−40 ℃;在低温下打开真空泵开关,等待10~15 min,直到系统压力低于1.33×104 Pa;待样品干燥完全后取出,一般为24 h。
对冻干过程中用到的糖类保护剂、醇类保护剂和抗氧化剂的种类和浓度进行单因素实验,以此为基础进行响应面优化,以确定最佳冻干保护剂组合,得到粉末态固态菌剂D,记为后续包埋处理的基础产品。将固态菌剂以1∶10的比例置于无菌水中,在40 ℃、160 r·min−1的条件下培养30 min获得发酵液,活菌数的测定采用稀释平板培养计数法,发酵液进行10倍稀释后,涂布平板进行活菌计数。将发酵液在70 ℃下处理15 min 后进行冷却,采用稀释梯度平皿计数法统计活菌数即为芽孢数。通过式(1)和(2)计算存活率和芽孢率。
式中:所有活菌数的单位均为cfu·mL−1。
利用海藻酸钠和CaCl2将包埋基础产品(固态菌剂D)制备成微生物小球(即固态菌剂Q)。包埋处理可进一步提高固态菌剂的保存期,并减少外源微生物菌剂投加到堆体时产生的拮抗及抑制作用。操作过程如图1所示。
4)固态微生物菌剂的产品质量及保存期的确定。与液态菌剂相比,固态菌剂更易运输、保存,货架期更长。为评估固态菌剂中活菌的保存期,每隔7 d测定1次制得微生物菌剂(菌剂M、D、Q)的存活率作为评价指标。 不同保存温度对固态菌剂的保存期可能会产生不同影响。将上述固态菌剂D、Q平均分为3份,每份约80 g,置于食品级PE自封袋中。将其分别置于室温条件下(20 ℃左右)、4 ℃冷藏室中、−20 ℃的冷冻室中,每隔7 d测定1次存活率。
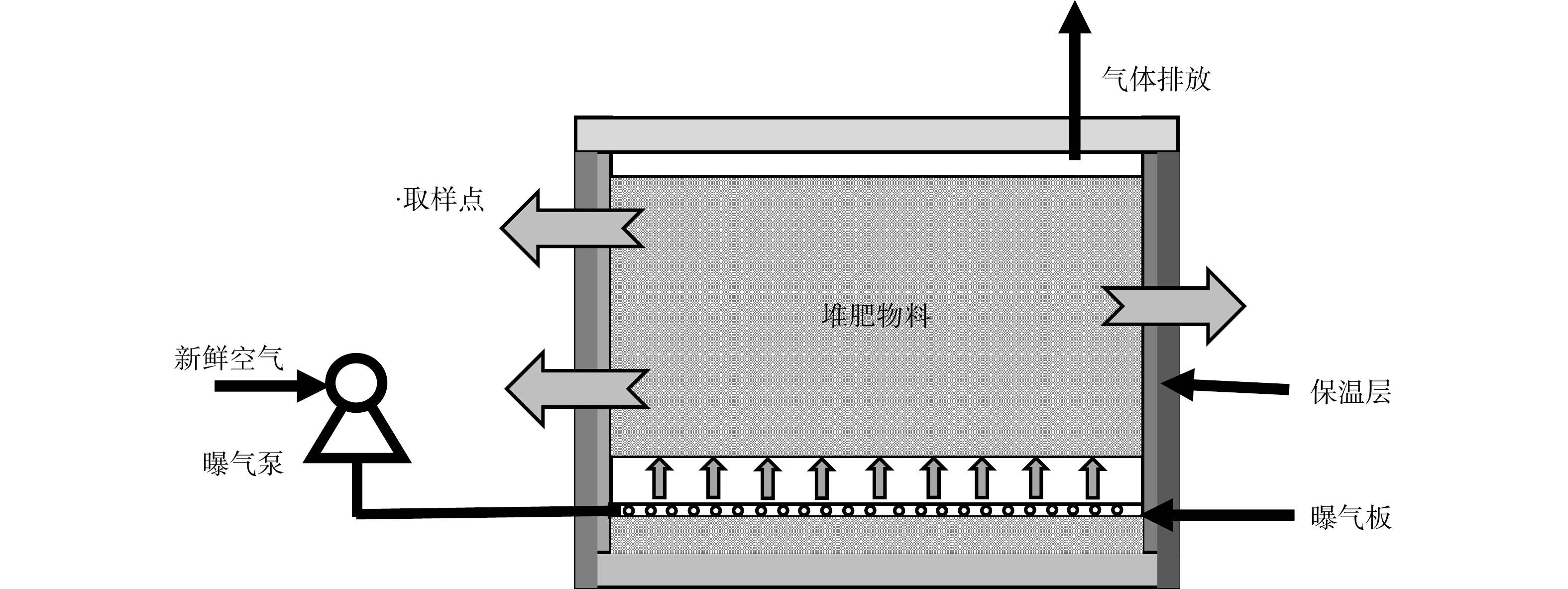
5)菌剂堆肥效果的验证。在PVC箱中进行堆肥实验,堆肥材料为菌渣和秸秆。设置3个实验组,在堆肥初期分别投加放置已保存3个月的菌剂M、D、Q,记为CK、PF、GF组。调整实验条件C/N约为20%,含水率为60%。实验装置如图2所示。
-
使用Design-Expert.v8.0.6.1进行响应面分析,采用平板计数法[20]测定有效活菌数。在堆肥效果验证中,温度早晚各测定1次取平均值,且分别在0、3、5、7、14、21、28、35 d时进行翻堆取样,测定堆肥过程中的有机质(organic matter,OM)、可溶性有机质成分的变化及GI,以此衡量不同菌剂处理下的堆肥腐熟度,判断制备菌剂的实际应用效果。
-
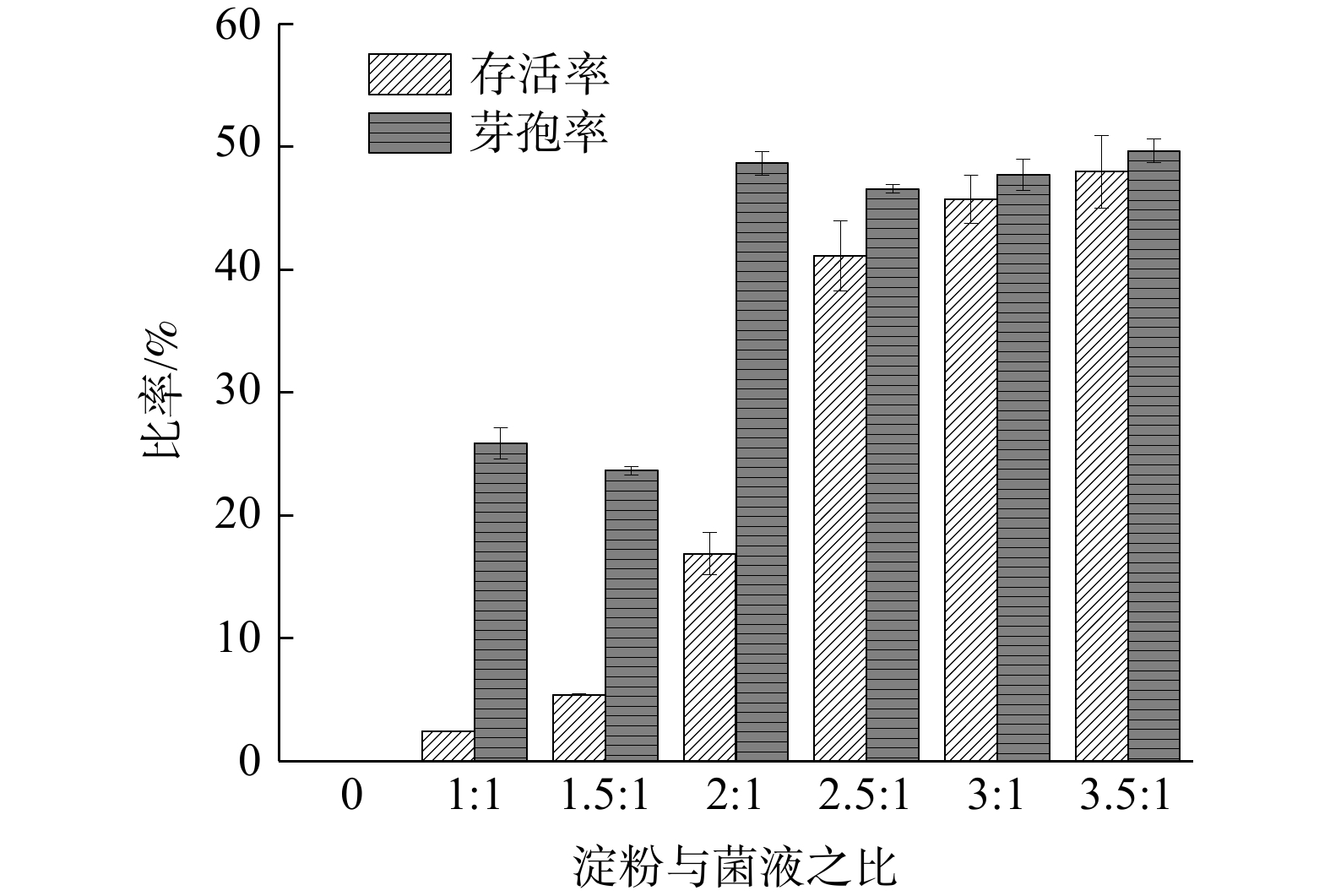
1) 菌液M与多孔淀粉比例的优化。将菌液M与多孔淀粉以不同比例混合,测定冻干后吸附菌液在多孔淀粉中的存活率[21]和芽孢率。当菌液M(体积)与多孔淀粉(质量)的比例(v∶m)大于2.5时,菌液和多孔淀粉分层现象严重,表明此时多孔淀粉对菌液M已达吸附饱和。如图3所示,随着菌液M与多孔淀粉比例不断提高,产品中活菌存活率不断上升。而从经济角度考虑,确定菌液M与多孔淀粉的最佳混合比例为2.5∶1,此时的活菌存活率为41.08%、芽孢率为46.56%。
2) 冷冻干燥保护剂选择的响应面优化。响应面优化是通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法[22]。对糖类、醇类、抗氧化剂[23]进行单因素实验,进而对冷冻干燥保护剂进行响应面优化。单因素实验结果表明,糖类、醇类、抗氧化剂分别选择质量分数为10%的乳糖、质量分数为2.5%的甘露醇、质量分数为0.015%硫代硫酸钠。
基于单因素实验,选乳糖的质量分数(A)、甘露醇的质量分数(B)、硫代硫酸钠的质量分数(C)3个关键影响因素,进行3因素3水平响应面优化研究;以活菌存活率为评价指标,研究关键影响因素对冷冻干燥后所得产品的综合效应,获得固态菌剂制备的最佳方法。因素水平设计如表1所示,实验方案设计及结果如表2所示,方差分析如表3所示。
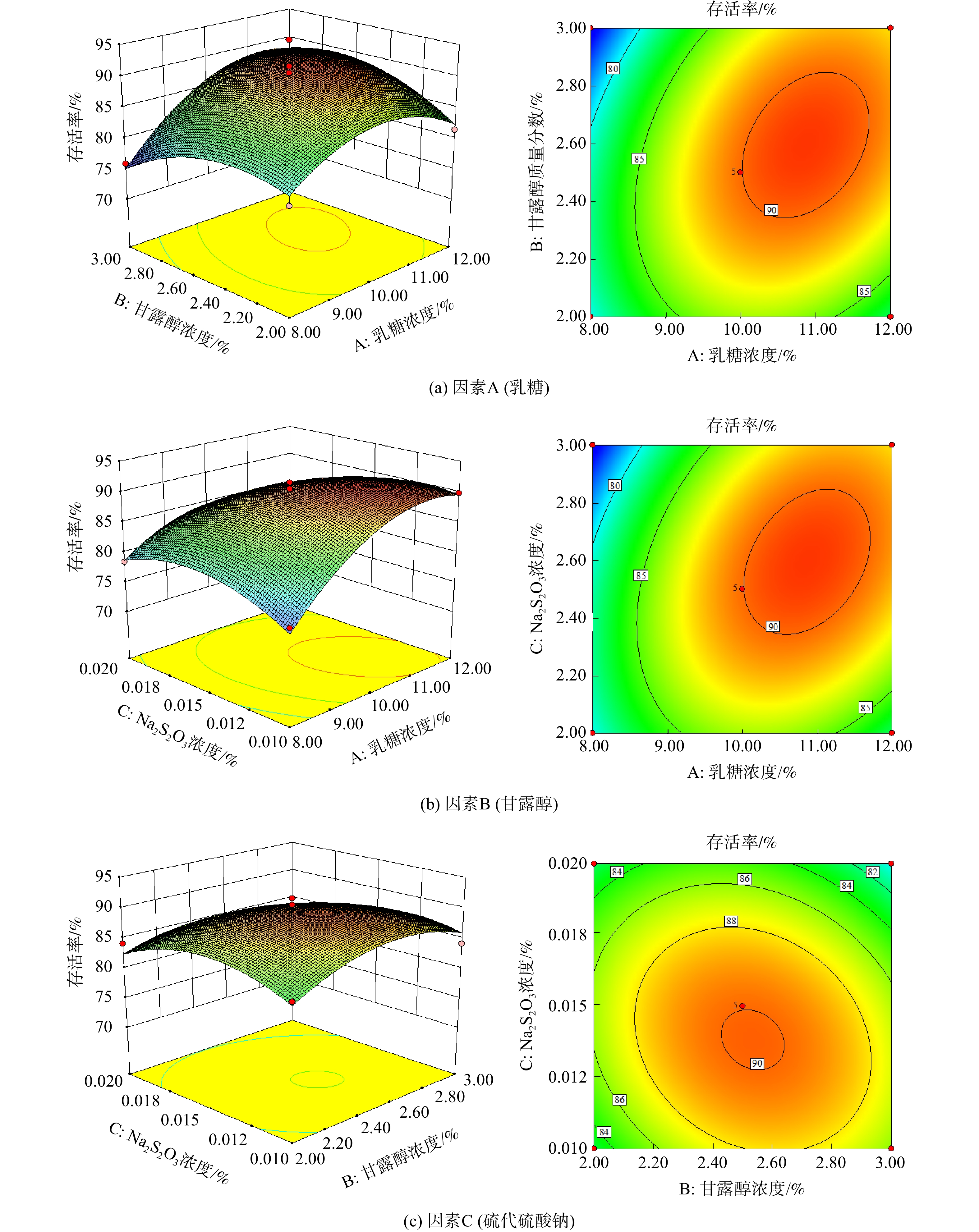
以活菌存活率为评价指标对该模型进行方差分析及模型系数检验。由表3可知,模型的P=0.05<0.05,表明模型适应性好,具有统计学意义。由P值可知,模型变量中的A2、B2、C2对存活率影响显著,说明实验因素和响应因素之间不是简单的线性关系。在该模型中,失拟误差为P=0.112 4>0.05,表明模型拟合度较好,失拟误差可能来源于实验中的随机误差。在选取的各因素水平范围内,按照响应的影响因素顺序为A(乳糖的质量分数)>C(硫代硫酸钠的质量分数)>B(甘露醇的质量分数)。
为确定3个因素的最佳组合,对其进行两两交互,绘制响应曲面及等高线图[24],即1个因素确定1个中值,观察其他2个因素之间的交互影响,并确定最佳范围,结果见图4。
根据响应面优化结果得到冷冻干燥过程保护剂中乳糖、甘露醇、硫代硫酸钠的最佳添加比例,分别为10%~11%、2.4%~2.6%、0.012%~0.015%。根据响应面分析结果,拟合响应面方程如式(3)所示。
通过模型方程确定最佳组合:在乳糖、甘露醇、硫代硫酸钠的质量分数分别为11%、2.6%、0.013%的条件下,预测的最大存活率为91.532 1%(可信度99.8%)。根据模拟得到的最佳组合,进行验证实验。此时,冷冻干燥后菌剂中活菌的存活率为(92.43±1.43)%,芽孢率可达(68.79±2.15)%。一般来说,市面上的冻干保护剂可保证冻干后的活菌存活率>90%。评估表明,优化保护剂与市面上所售冻干保护剂效果相当。该阶段制备的固态菌剂记为菌剂D。制得的固态菌剂实物如图5所示。
活菌数是衡量菌剂质量的关键指标。液态菌剂M中内含大量的芽孢杆菌,芽孢能适应不良环境,对物理伤害和很多有毒的化学物质都有很强的抗性,而在条件适宜时又可转变为营养细胞,从事正常的代谢活动,适合制作农用微生物菌剂,因此,在测定活菌数的同时,测定芽孢率的变化。
-
利用海藻酸钠和CaCl2对固态菌剂D进行包埋,得到目标产品固态菌剂Q。以成型及较好的机械强度为前提,确定了最佳CaCl2的质量分数为5%、海藻酸钠的质量分数为6%,掺入量为20%,并将其放置室温条件下失水,以此制备微生物小球。图6为制得菌剂Q的外貌形态照片。
-
制备的固态菌剂属于农用微生物菌剂,故将其与农用微生物菌剂国家标准(GB 20287-2006)中的各项指标进行对比(见表4)。对比结果表明,制得的固态菌剂D、Q各项指标均符合国家标准。
-
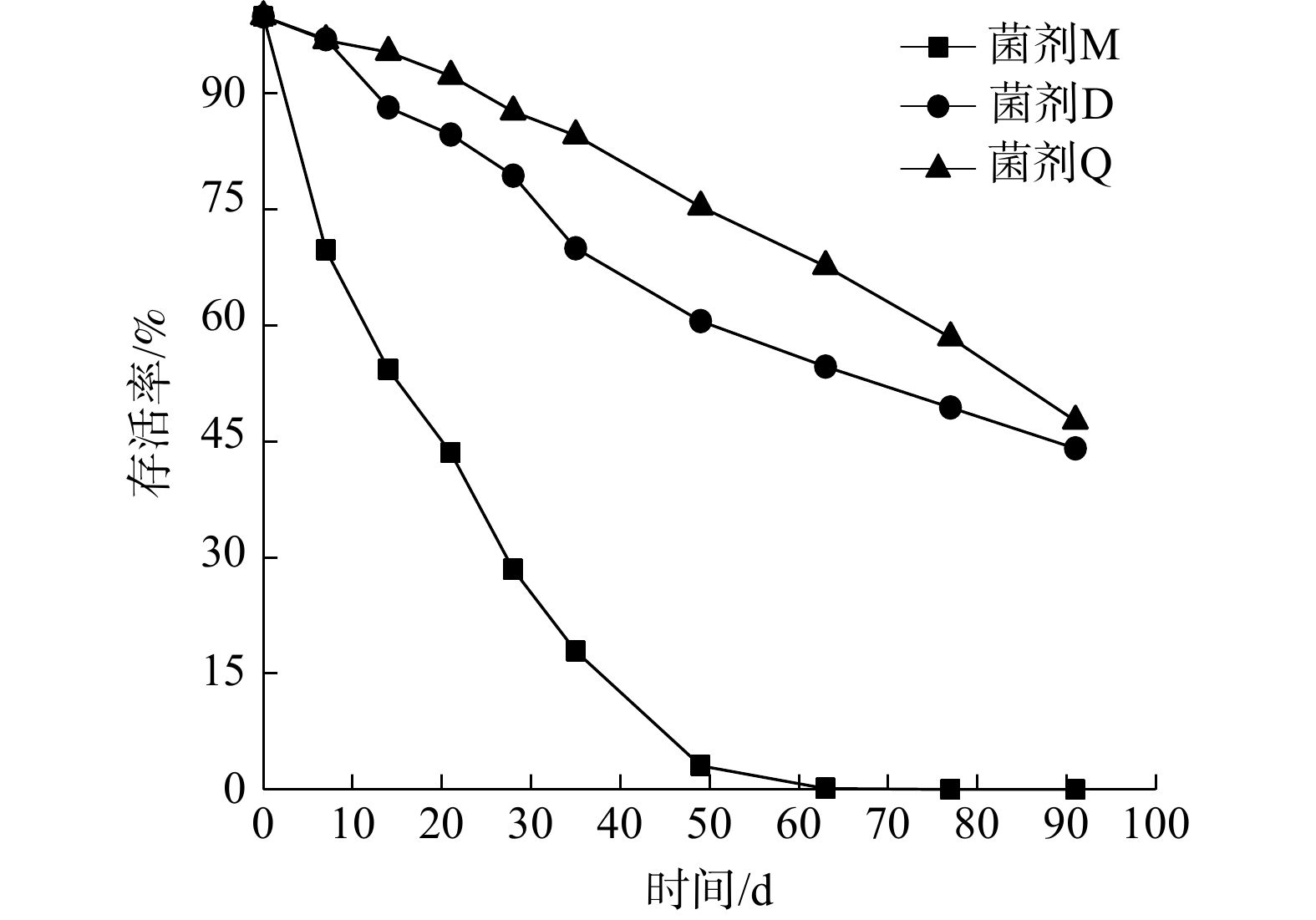
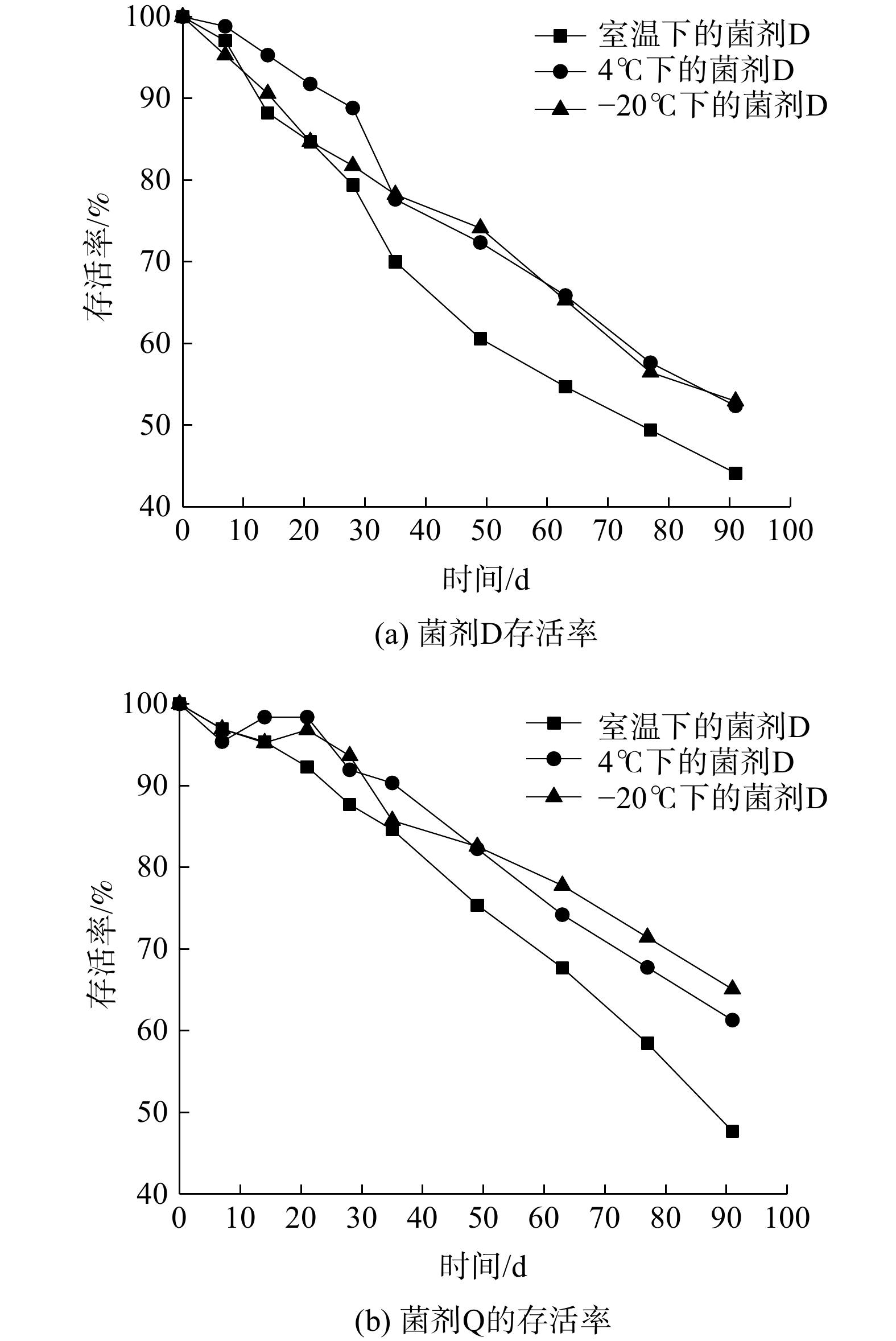
为研究不同温度条件对固态菌剂保存期的影响,研究了固态菌剂的保存温度。由图7可知,在90 d内,3种微生物菌剂的活性均呈现下降趋势。存活率下降最快的是液态菌剂M,在第60天其活性即低至无法检出,此时菌剂已严重腐臭变质,且出现了霉菌。而固态菌剂D、M在90 d后存活率仍然可达44.12%、47.69%,其有效活菌数依然达标。表4中其他指标亦可达到国家标准。
由图8中可知,不同保存温度下,固态菌剂M、Q的最终存活率均可达标,表4中涉及的其他指标在90 d后亦可达标。说明固态菌剂M、Q对保存温度并无苛刻要求。
-
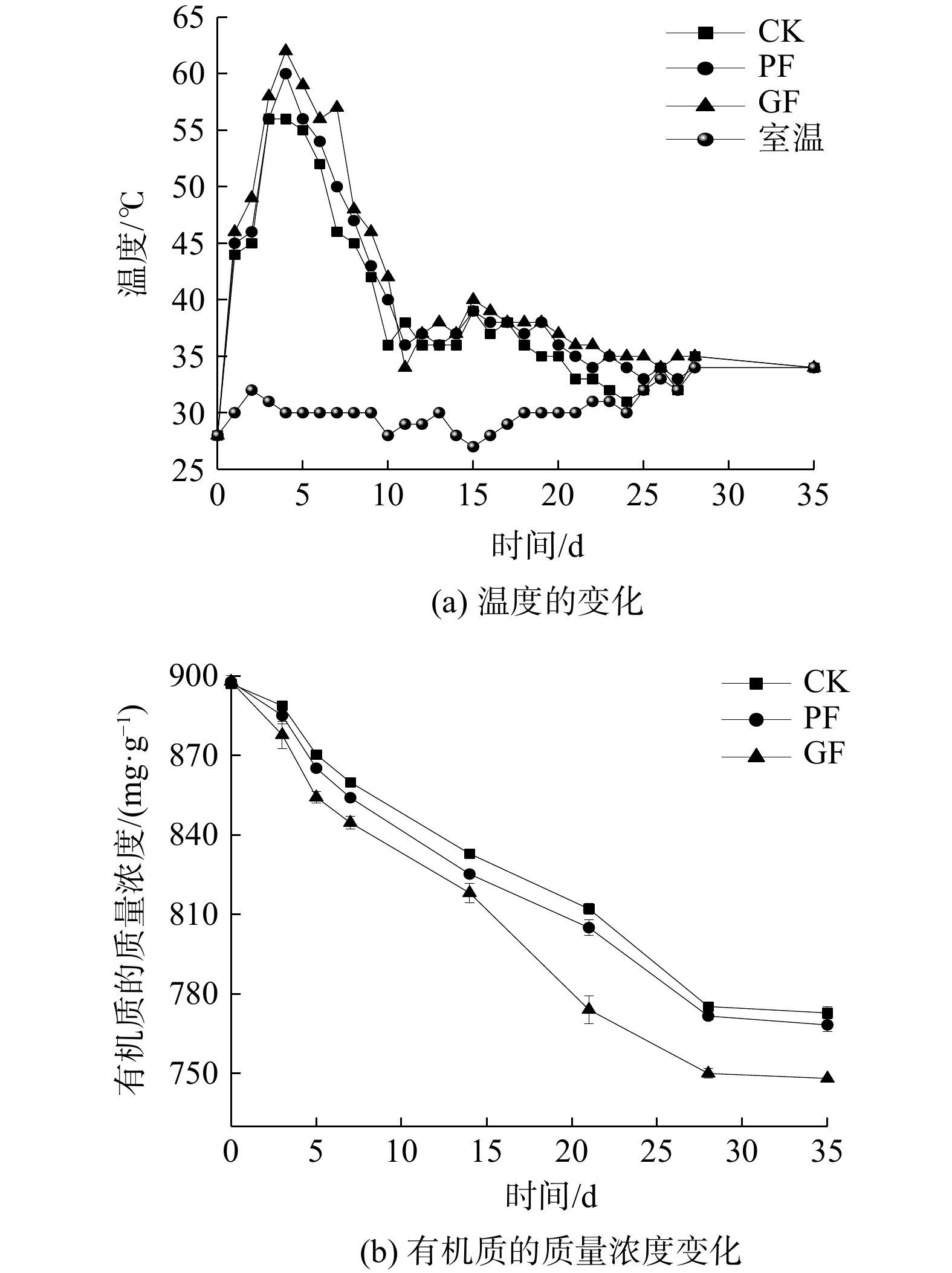
将制备的3种微生物菌剂放置90 d后,添加入堆肥初期的堆体中进行效果验证。由图9(a)可知,反应温度变化均呈现先上升后下降的趋势。设置3个处理组(CK、PF、GF),以初始活菌数相同,CK、PF、GF组添加了保存6个月后的液态菌剂,PF组添加了菌剂M,添加了菌剂Q。3个处理组(CK、PF、GF)的高温期分别持续4、5、5 d,最高温分别为56、60、62 ℃,高温阶段的整体温度趋势为GF>PF>CK。由图7可知,CK处理组在3个月后发生变质、活菌数无法检出,故将其投加到堆体中并无促进作用。与PF处理组相比,GF处理组的效果更佳,说明单位质量GF组菌剂的活菌活性大于PF组,且GF组菌剂在3个月后的存活率更高(见图7)。以上结果表明,研究制得的固态菌剂可在保存若干月后仍维持较高的存活率。在整个堆肥过程中,在升温阶段,GF组菌剂的外貌形态除颜色外并无明显改变;高温期结束后,在堆体中已无法观察到颗粒态的菌剂,说明菌剂的外包结构已被破坏(海藻酸钠和可溶性淀粉已被降解),致使微生物暴露入体系中,菌剂中的微生物的繁殖提升了堆肥温度,并加速了堆肥进程[25-26]。
随着堆肥进程深入,堆体中有机质不断消耗,呈现下降趋势(见图9(b))。随着微生物的增长繁殖,进入高温期后,有机质以较高速率降解;高温期结束时,降解速度减缓。由图9(b)可知,与放置3个月的液态菌剂相比,PF组和GF组表现出更佳的处理效果,说明与放置3个月失活的液态菌剂相比,固态菌剂存活率更能得以保证,特别是包埋后的GF组菌剂,其处理效果更佳。在堆肥后期(14~28 d),GF组菌剂的处理效果出现较大幅度下降。其原因可能是:由于此时颗粒态菌剂外表已完全降解,菌剂已全部释放,进一步促进了堆体中有机质的降解。
-
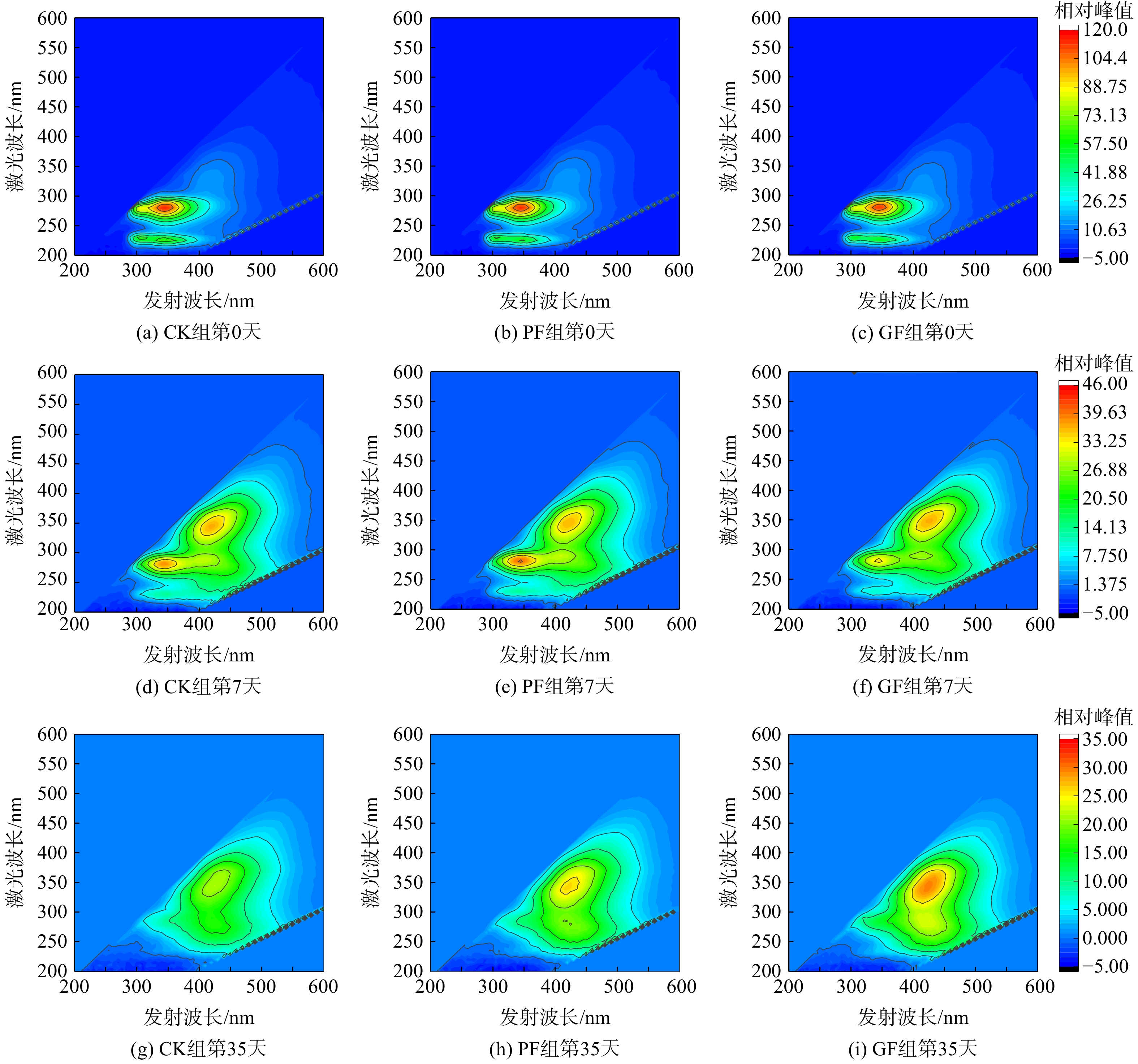
堆肥过程中堆体腐殖质的变化可衡量堆体的腐熟度。测定堆肥过程中可溶性有机质(dissolved organic matter,DOM)各成分的变化,并进行了区域积分(荧光区域积分),结果如图10和表5所示。
在整个堆肥过程中,蛋白质的质量分数从初始的13.60%~18.13%,降至2.93%~3.88%(0~7 d),说明高温期是蛋白质降解的主要时期。堆肥结束后,蛋白质的质量分数低至0~0.73%。腐殖酸的质量分数由最初的30.37%~33.81%增至80.43%~83.18%。与CK组相比,PF、GF处理组的微生物溶解产物较少且腐殖物质(富里酸和腐殖质)含量较高,说明添加微生物菌剂可促进堆肥的腐殖化过程。而GF处理组效果更佳说明包埋微生物菌剂在3个月后能发挥更好的作用。
-
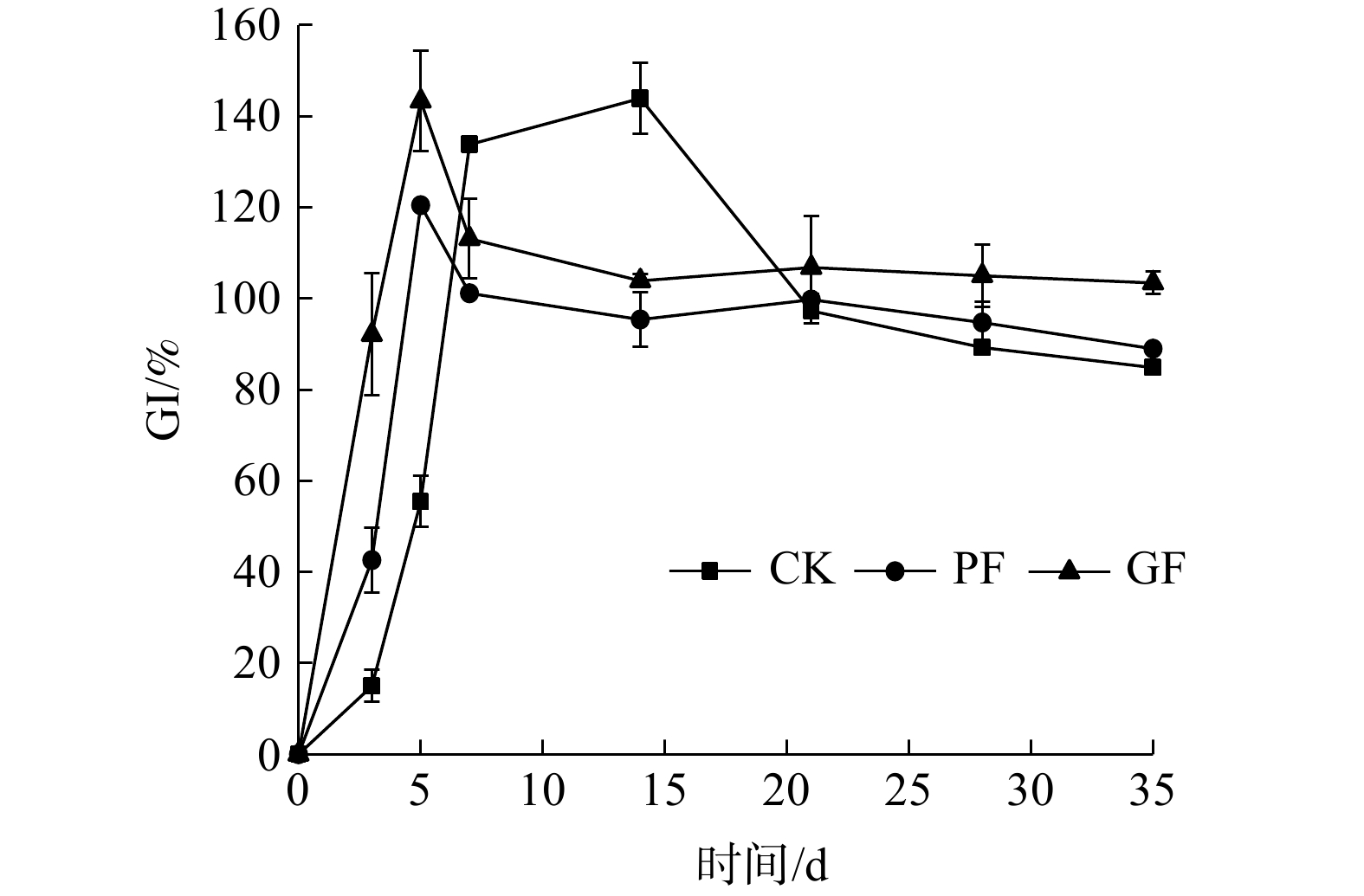
种子发芽指数(germination index,GI)是衡量堆体中是否存在毒性物质的参数之一,也被认为是判断堆肥是否腐熟的间接指标[27]。研究表明,当种子GI达到50%时,可认为堆肥产品的植物毒性在可忍耐的水平;当种子GI达到80%时,可认为堆肥已达到无毒水平,堆肥已经腐熟[27]。由图11可知,3个处理组的种子GI均大于80%,由此可判断本研究的堆体已腐熟,且因为植物毒性低、堆肥效果较好。
-
1)利用“吸附-包埋”技术制备新型固态菌剂的最佳制备工艺为:将多孔淀粉与菌液以2.5∶1时混合后进行冷冻干燥,最佳冻干保护剂组合为乳糖11%、甘露醇2.6%、硫代硫酸钠0.013%,得到包埋基础产品(固态菌剂D),对基础产品进行包埋,得到新型固态菌剂Q。
2)对制备的固态菌剂D、Q进行了产品质量分析,结果表明:初始及3个月后的各项指标均符合国家农用微生物菌剂国家标准(GB 20287-2006),且对保存温度研究发现,制备的固态菌剂更适宜放置在阴凉干燥环境中。
3)对制备菌剂进行了品质监控,发现菌剂稳定性及存活率均处于较高水平。对菌渣堆肥效果验证表明,与添加液态菌剂M组相比,添加D、Q的2组堆体更早进入高温期,堆体启动较快,且高温期持续时间更长;有机质降解率、最终产品质量更高。上述结果说明,利用“吸附-包埋”技术制备固态菌剂在农用领域是可行的且效果较好,可为今后微生物菌剂的制备提供参考。
多孔淀粉固定化堆肥用微生物菌剂的制备条件优化及其堆肥效果验证
Preparation optimization and performance validation of microbial agent for porous starch immobilized compost
-
摘要: 为提升菌渣的堆肥效率,研制了一种保质期较长且可应用于堆肥体系中的固态微生物菌剂。利用堆体中筛选出的微生物制备了混合菌液M,利用多孔淀粉作为吸附载体对其进行吸附,并经冷冻干燥得到包埋基础产品固态菌剂D,然后采用包埋技术将D制成固态菌剂Q。结果表明,新鲜制备的3个阶段微生物菌剂(M、D、Q)的各项指标均符合国家标准;制备3个月后,菌剂Q的存活率仍高达47.69%,远高于菌剂M的0,与比菌剂D提高了8.10%;最终堆肥验证中,菌剂D、Q表现出明显的优势,堆肥过程启动得更早,且腐殖酸含量分别提高了2.61%、3.44%,故菌剂Q的性能最佳。利用“吸附-包埋”技术制备固态菌剂可行且效果明显,可为微生物菌剂的制备提供参考。Abstract: To develop a solid microorganism having a longer shelf life and can be applied to the slag composting system, the mixed bacteria prepared by the microorganisms screened in the stack is prepared by “adsorption-embedded” fixation techniques. A novel solid fungicide Q is prepared by adsorbing the mixed carbide using a porous starch as an adsorption carrier, freeze-drying to obtain a embedding base product, which is recorded as a solid fungicide D, and using embedding techniques to the base product. Results show that the various indicators of freshly prepared microbacterial agents (M, D, Q) meet the national standards. After three months, the survival rate of the bacterioside Q is as high as 47.69%, which is much higher than the 0% of the bacteriosida. It increased by 8.10% compared to the bacterial agent D. In the final compost, the fungicides D and Q showed significant advantages, whereby the compost was started earlier and the humic acid content increased by 2.61%, 3.44% respectively. The bactericide Q showed the optimal performance. The preparation of solid fungicide using the "adsorption-embedded" fixation techniques was demonstrated to be feasible and satisfactory, which can provide reference for the preparation of microbial agents.
-
Key words:
- porous starch adsorption /
- embedding /
- composting /
- microbial agent
-

-
表 1 设计因素编码与水平
Table 1. Design factor coding and level
水平 因素 A B C −1 8% 2% 0.010% 0 10% 2.5% 0.015% 1 12% 3% 0.020% 注:A为乳糖的质量分数;B为甘露醇的质量分数;C为硫代硫酸钠的质量分数。 表 2 响应面优化设计及实验结果
Table 2. Response surface optimization design and experimental results
分组 因素 活菌存活率 A B C 1 12% 2.5% 0.020% (79.86±0.06)% 2 10% 2% 0.020% (84.20±0.02)% 3 12% 2.5% 0.010% (89.90±0.13)% 4 10% 2.5% 0.015% (90.56±0.02)% 5 12% 3% 0.015% (89.60±0.06)% 6 8% 2.5% 0.020% (78.50±1.04)% 7 8% 2% 0.015% (78.69±0.13)% 8 10% 2% 0.010% (83.50±0.09)% 9 10% 2.5% 0.015% (89.60±0.12)% 10 10% 2.5% 0.015% (91.60±0.04)% 11 10% 3% 0.010% (84.20±0.26)% 12 8% 3% 0.015% (75.90±0.11)% 13 10% 2.5% 0.015% (89.14±0.02)% 14 10% 3% 0.020% (79.50±0.14)% 15 10% 2.5% 0.015% (88.90±0.06)% 16 8% 2.5% 0.010% (77.21±0.08)% 17 12% 2% 0.015% (81.50±0.27)% 注:A为乳糖的质量分数;B为甘露醇的质量分数;C为硫代硫酸钠的质量分数。 表 3 回归方程的方差分析表
Table 3. Analysis of variance table for regression equation
因素及误差 变差平方和 自由度 均方 F Pr> F 显著性 A(乳糖) 116.74 1 116.74 42.15 0.000 3 + B(甘露醇) 0.21 1 0.21 0.077 0.788 8 C(Na2S2O3) 20.32 1 20.32 7.34 0.030 3 + AB 29.65 1 29.65 10.71 0.013 6 + AC 32.09 1 32.09 11.59 0.011 4 + BC 7.29 1 7.29 2.63 0.148 7 A2 105.68 1 105.68 38.16 0.000 5 + B2 52.39 1 52.39 18.92 0.003 4 + C2 54.04 1 54.04 19.51 0.003 1 + 模型 442.38 9 49.15 17.75 0.000 5 + 残差 19.39 7 2.77 失拟误差 14.41 3 4.80 3.86 0.112 4 纯误差 4.98 4 1.24 − 注: Pr > F表明无显著影响的概率。“+”为显著相关。 表 4 自制微生物菌剂性能与国家标准的对比
Table 4. Comparison of self-made microbial agents and national standards
菌剂类型或国家标准 有效活菌数/(cfu·g−1) 霉菌杂菌数
/(cfu·g−1)水分 细度 pH 保证期 农用微生物菌剂国家标准(粉剂)
(GB 20287-2006)≥2×108 3.0×106 ≤35% ≥80% 5.5~8.5 6个月 自制微生物菌剂D ≥1.7×1010 0 6.25% 合格 6.66±0.02 − 自制微生物菌剂Q ≥3×109 0 ≤15% 合格 6.98±0.08 − 表 5 三维荧光各区域DOM含量变化
Table 5. Change of DOM content in each region of three-dimensional fluorescence
处理组 堆肥时期 各DOM区域组分含量 区域Ⅰ 区域Ⅱ 区域Ⅲ 区域Ⅳ 区域Ⅴ CK 0 3.27% 10.33% 5.84% 38.21% 30.37% 第7天 0.51% 3.37% 7.02% 19.98% 70.32% 第35天 约为0 0.92% 6.79% 13.67% 80.43% PF 0 5.47% 12.66% 6.86% 41.85% 33.16% 第7天 0.54% 3.21% 6.53% 20.55% 70.51% 第35天 约为0 0.34% 6.27% 12.97% 82.53% GF 0 3.54% 11.54% 6.47% 43.17% 33.81% 第7天 0.36% 2.57% 6.32% 18.59% 73.82% 第35天 约为0 约为0 5.92% 13.20% 83.18% -
[1] 王春铭. 城市污泥堆肥高温菌群的筛选、特性与应用研究[D]. 广州: 中山大学, 2006. [2] 孙利宁. 氧化还原类酶活性在作物秸秆静态高温堆腐过程中的变化[D]. 西安: 西北农林科技大学, 2008. [3] ZENG G M, HUANG H L, HUANG D L, et al. Effect of inoculating white-rot fungus during different phases on the compost maturity of agricultural wastes[J]. Process Biochemistry, 2009, 44(4): 396-400. doi: 10.1016/j.procbio.2008.11.012 [4] ZHAO Y, ZHAO Y, ZHANG Z, et al. Effect of thermo-tolerant actinomycetes inoculation on cellulose degradation and the formation of humic substances during composting[J]. Waste Management, 2017, 68(12): 64-73. [5] ZHOU C, LIU Z, HUANG Z L, et al. A new strategy for co-composting dairy manure with rice straw: Addition of different inocula at three stages of composting[J]. Waste Management, 2015, 40: 38-43. doi: 10.1016/j.wasman.2015.03.016 [6] GOU C, WANG Y, ZHANG X. Inoculation with a psychrotrophic-thermophilic complex microbial agent accelerates onset and promotes maturity of dairy manure-rice straw composting under cold climate conditions[J]. Bioresource Technology, 2017, 243: 339. doi: 10.1016/j.biortech.2017.06.097 [7] 官赟赟, 顾锡慧, 雷太平. 炼油废水COD降解菌固态菌剂的制备及性能考察[J]. 工业水处理, 2016, 36(2): 75-78. doi: 10.11894/1005-829x.2016.36(2).075 [8] ZHEN Y W, YING X U, WANG H Y, et al. Biodegradation of crude oil in contaminated soils by free and immobilized microorganisms[J]. Pedosphere, 2012, 22(5): 717-725. doi: 10.1016/S1002-0160(12)60057-5 [9] BOROWSKI S, MATUSIAK K, POWAŁOWSKI S, et al. A novel microbial-mineral preparation for the removal of offensive odors from poultry manure[J]. International Biodeterioration & Biodegradation, 2016, 23(2): 29-32. [10] SUN D, HALE L, CROWLEY D. Nutrient supplementation of pinewood biochar for use as a bacterial inoculum carrier[J]. Biology and Fertility of Soils, 2016, 52(4): 515-522. doi: 10.1007/s00374-016-1093-9 [11] 葛玲艳. 植物精油型粮食防虫剂的研制及应用[D]. 天津: 天津科技大学, 2011. [12] 安洪欣. 多孔淀粉的研究和应用[J]. 佳木斯大学学报(自然科学版), 2010, 28(2): 262-264. [13] 杨圣岽, 侯聚敏, 张琳, 等. 酶法制备微孔淀粉的研究进展[J]. 吉林农业科学, 2012, 37(4): 77-80. doi: 10.3969/j.issn.1003-8701.2012.04.025 [14] 王帅. 植物乳杆菌培养及冻干技术研究[D]. 西安: 陕西科技大学, 2016. [15] 王俊青, 张峰, 蒙健宗, 等. 预培养冷冻干燥制备植物乳杆菌发酵剂[J]. 食品科技, 2016, 41(1): 2-6. [16] 焦琳. 嗜热链球菌M5-5冻干保护剂配方的优化[J]. 中国酿造, 2017, 36(3): 95-98. doi: 10.11882/j.issn.0254-5071.2017.03.020 [17] 王丽丽. 真空冷冻干燥食品加工工艺的研究[J]. 现代食品, 2020(13): 47-49. [18] HUANG L J, LU Z X, YUAN Y J, et al. Optimization of a protective medium for enhancing the viability of freeze-dried Bacillus amyloliquefaciens B1408 based on response surface methodology[J]. Cryobiology, 2018: 101-106. [19] 李月月. 液态好氧堆肥复合微生物菌剂的研发及应用[D]. 无锡: 江南大学, 2020. [20] 吴婷婷. 短小芽孢杆菌产孢培养技术的研究[D]. 武汉: 华中农业大学, 2013. [21] 李士彦. 高中生物学细菌知识的整合再生[J]. 生物学教学, 2006(3): 60-62. doi: 10.3969/j.issn.1004-7549.2006.03.038 [22] 孙克岩, 张志胜, 佟海菊, 等. 响应面法优化牡蛎复合氨基酸螯合锌制备工艺研究[J]. 食品科技, 2011, 36(7): 107-109. [23] 田烨, 吴明媛. 生物制品冻干保护方法研究进展[J]. 中国医药生物技术, 2018, 13(1): 73-76. doi: 10.3969/j.issn.1673-713X.2018.01.015 [24] 谷薇薇. Box-Behnken响应面法优化芒果苷凝胶处方的研究[J]. 中药材, 2019, 42(10): 2363-2366. [25] LOPEZ M J, VARGAS-GARCIA M C. Tracking organic matter and microbiota dynamics during the stages of lignocellulosic waste composting[J]. Bioresource Technology, 2013, 146: 574-584. doi: 10.1016/j.biortech.2013.07.122 [26] HUANG D L, ZENG G M, FENG C L, et al. Changes of microbial population structure related to lignin degradation during lignocellulosic waste composting[J]. Bioresource Technology, 2010, 101(11): 4062-4067. doi: 10.1016/j.biortech.2009.12.145 [27] LING L, WANG S, GUO X, et al. Succession and diversity of microorganisms and their association with physicochemical properties during green waste thermophilic composting[J]. Waste Management, 2018, 73(5): 101-112. -




 下载:
下载: