-
餐厨垃圾具有有机质含量高、易生物降解的特性[1]。厌氧消化是实现餐厨垃圾减量化、稳定化和资源化的关键技术之一[2]。区别于传统厌氧消化,干式厌氧消化(TS>15%)具有沼液产量少、容积产气率高等优点[3]。因此,干式厌氧消化已在国外得到大量应用,但国内该技术的推广应用仍属起步阶段[4]。随着我国生活垃圾分类的实施,一方面,大量的餐厨垃圾得以分离并亟需资源化处置;另一方面,分类后得到的餐厨垃圾不同于以往未分类的生活垃圾,其杂质含量减少、有机质含量进一步提高;这对于干式厌氧消化工艺意味着更高的有机负荷和潜在的底物有机组成失衡,最终造成抑制影响。
传统湿式厌氧消化常用碳氮比来衡量底物的有机组成,合适的碳氮比为20~30[5],过高或过低都会对产甲烷微生物的代谢造成抑制。而对于干式厌氧消化,由于其含固率高,有机质含量以及挥发性脂肪酸、氨氮等中间产物浓度远高于湿式厌氧消化工艺,其底物有机组成失衡往往会导致更严重的酸化或氨氮抑制影响。因此,较为平衡的底物有机组成更为重要。餐厨垃圾中易被厌氧微生物用以产甲烷的有机物以多糖、蛋白质和脂质为主。不同有机物由于在组成结构、微生物代谢途径等方面的差异,导致他们具有不同的产甲烷速率和甲烷产量。例如,多糖和蛋白质水解产生的小分子单糖以及氨基酸将通过糖酵解途径产生有机酸,蛋白质水解同时释放一定量的氨氮;脂质水解的主要产物为中长链脂肪酸,中长链脂肪酸将通过β氧化每次脱除2个碳生成1分子乙酸和1分子H2实现逐步降解。多糖具有较快的降解速率;脂质主要产物(中长链脂肪酸)的降解却被认为是厌氧消化的限速步骤。此外,多糖、蛋白质和脂质的理论产甲烷量也有较大的差异[6],根据各有机物的元素组成通式估算,多糖、蛋白质和脂质的理论产甲烷量分别为416、496和1 014 mL·g−1。但是,由于厌氧消化微生物代谢的能量消耗以及抑制性影响,各类有机物往往难以被完全降解,实际甲烷产量往往低于理论甲烷产量。综合以上信息可知,导致餐厨垃圾干式厌氧消化过程中产甲烷速率和产甲烷量变化的成因是较为复杂的。即使在相近的碳氮比下,有机物组成也会存在差异;因此,碳氮比并不能充分地指示餐厨垃圾干式厌氧消化工艺是否稳定运行。
对于餐厨垃圾干式厌氧消化,有研究[7-8]报道了产甲烷量、产甲烷速率和厌氧消化稳定性受碳氮比和有机物组成比例的影响;然而,对于各有机组分比例(多糖、蛋白质、脂质)的变化对有机组分的降解以及底物甲烷转化率的影响仍不明确。为此,本研究针对餐厨垃圾干式厌氧消化工艺甲烷转化率的限制性因素进行了分析。以馒头、豆腐和食用油分别代表餐厨垃圾中多糖、蛋白质和脂质3类主要厌氧消化代谢底物,通过批量厌氧消化实验,分析基于有机组成差异的餐厨垃圾干式厌氧消化中甲烷转化率及其限制性因素,以期为餐厨垃圾干式厌氧消化过程中高效稳定产甲烷提供参考。
全文HTML
-
接种污泥取自北京某污水处理厂高温热水解+中温厌氧消化工艺(37~42 ℃,停留时间18 d)的厌氧消化罐出泥,经过4 000 r∙min−1离心10 min后,弃去上清液,剩余固体常温密封保存作为接种污泥。其基本特征如表1所示。馒头(多糖类)、豆腐(蛋白质类)、食用油(脂质类)购于北京某超市。
-
厌氧消化实验采用瑞典Bioprocess Control公司的AMPTSII系统(Automatic Methane Potential Test System II)进行。消化装置为600 mL厚壁玻璃瓶(有效容积300 mL,顶空预留300 mL以防止反应过于剧烈液体溢出)。系统产生的沼气通过3 mol·L−1氢氧化钠溶液脱除CO2,剩余气体经过检测器自动计量并计为甲烷体积。甲烷产量为标准状况下(273.15 K、101 kPa)的气体体积。接种污泥和底物按照挥发性固体质量之比为2进行配置,保持所有实验组的接种比(Inoculum to substrate ratio,ISR)为2,最后加入去离子水直至总重量达到300 g,并控制厌氧消化混合物料初始TS为15%。空白组只添加接种物和去离子水,测得接种泥的产甲烷量,并在其他实验组中扣除接种泥的产甲烷量。系统安装完成后,通入氮气1 min,并密封;然后,将反应瓶放入恒温水浴锅,保持温度为37 ℃。每个反应瓶配有搅拌装置,搅拌桨转速为112 r·min−1。
-
为研究不同有机组成下干式厌氧消化甲烷转化率的差异,本研究设置7组实验(表2);每组中,馒头、豆腐、食用油3种组分的配比基于挥发性固体含量(volatile solid,VS)。每种组分配比均设置2个平行实验。
-
污泥的TS、VS采用重量法[9]测定。用pH计(Mettler Toledo FE20,瑞士)测定pH。污泥样品在转速8 000 r·min−1下离心10 min;上清液通过膜过滤(孔径0.45 μm;Savillex)后,用于测定溶解性指标。氨氮采用纳氏试剂分光光度法测定。溶解性多糖和溶解性蛋白的测定分别采用Dubious分光光度法[10]和修正的Lowry法[11]。总无机碳浓度(TIC)由TOC-VCPH分析仪(Shimadzu,日本)测定的总碳和总有机碳相减得到。挥发性脂肪酸(VFAs)通过气相色谱仪(Shimazu,2014)测定;配备FID检测器、DB-FFAP毛细色谱柱(30 m×0.32 μm×0.25 μm),采用程序升温模式,柱温由220 ℃升至250 ℃。1 g样品水解后,取上清液用Dubious分光光度法测定总多糖含量[12]。1 g样品加入1 mol ·L−1 NaOH溶液,100 ℃加热10 min,冷却30 min,保证蛋白质充分碱解,取上清液用修正的Lowry法测定总蛋白含量。脂质含量采用Bligh-Dyer法[13]提取测定。DOM组分由三维荧光光谱仪(F-7100,Hitachi,日本)测定,并根据CHEN等[14]的方法识别荧光组分。样品冷冻干燥后,取粉末用Vario MACRO Cube元素分析仪(Elementar,德国)用于测定碳氮元素含量。
甲烷转化率为最终累计产甲烷量与理论产甲烷量的百分比。理论产甲烷量(BT)根据所添加底物中测定所得的有机组分含量计算[15],具体按式(1)计算。某一有机组分降解率(ω)的计算如式(2)所示。
式中:αch为添加底物中多糖的含量(以干重计算),g·g−1;αpr为添加底物中蛋白质的含量(以干重计算),g·g−1;αli为添加底物中脂质的含量(以干重计算),g·g−1。
式中:fm为厌氧消化结束时测定的样品中该有机组分的含量(以干重计算),g·g−1;fsub为添加底物中该有机组分的含量(以干重计算),g·g−1;fin为接种污泥中该有机组分的含量(以干重计算),g·g−1。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
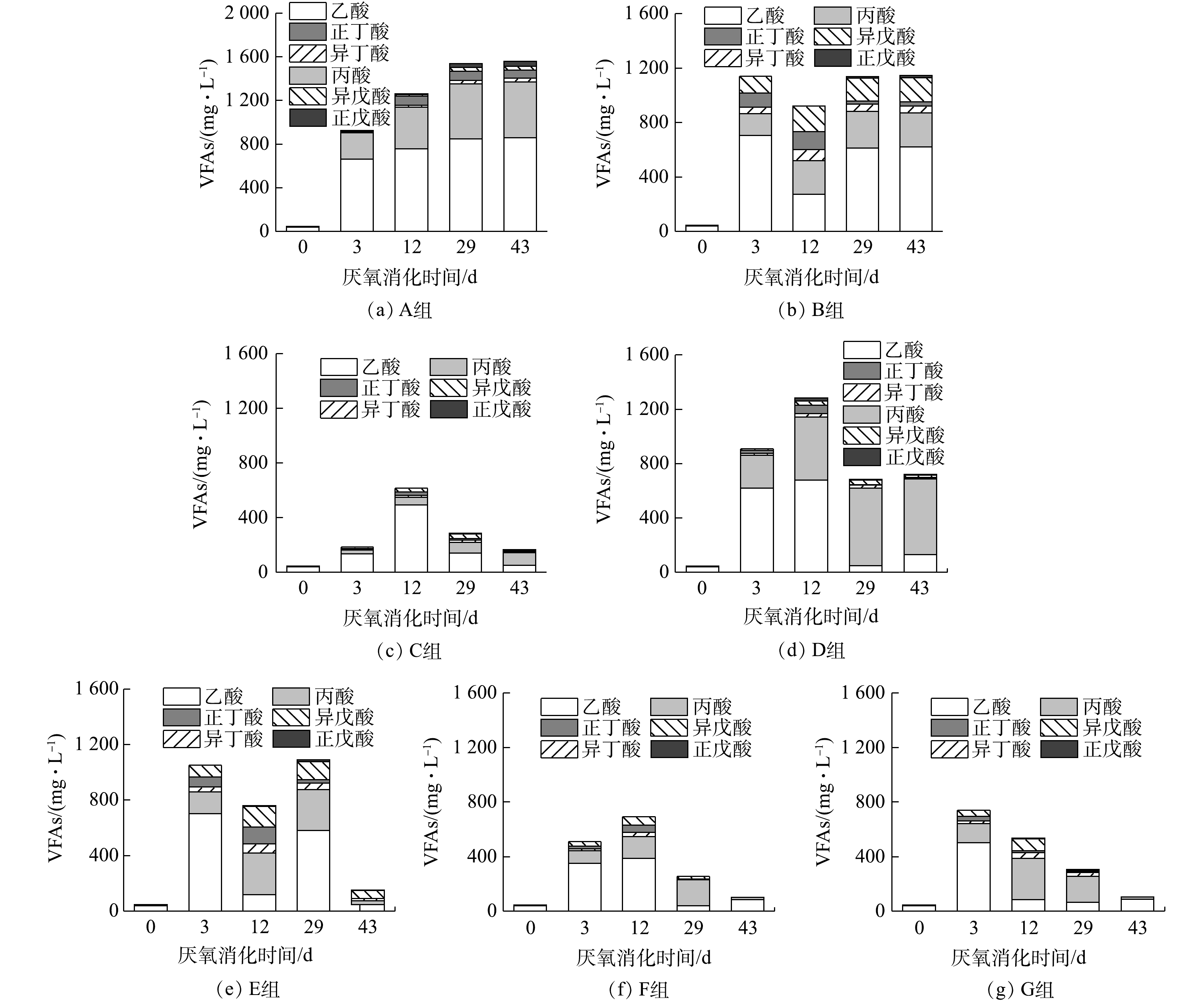
如图1所示,在相同接种比(ISR=2,以计)下,不同有机组成的餐厨垃圾干式厌氧消化表现出不同的累计甲烷产量和产甲烷速率(以底物的VS计算)。单独的多糖类(A组)和蛋白质类(B组)的有机物厌氧消化产甲烷受到严重抑制,在厌氧消化的第8天和第12天产甲烷停止,累积甲烷产量只有88.22和162.73 mL·g−1。单独的脂质类有机物(C组)在干式厌氧消化过程中,在前30 d的产甲烷速率缓慢,主要产甲烷阶段出现在28~38 d,期间的甲烷产量占总累积甲烷产量的78.82%,最终累积产甲烷量达到861.07 mL·g−1。结合厌氧消化过程中pH、氨氮、溶解性有机物、TIC以及VFAs(图2、图3)的变化情况可知,各有机组分厌氧消化的中间产物累积情况有明显差异。多糖类有机物干式厌氧消化主要表现为,底物快速水解酸化产生有机酸累积和pH急速下降带来的酸化抑制;而蛋白质类有机物干式厌氧消化主要表现为,氨氮对产甲烷菌的毒性抑制;脂质类有机物由于在厌氧消化前期本身水解酸化进程缓慢,故未产生过快的产酸现象。
在多糖类为主的有机底物中,适当加入蛋白质和脂质(D组),便可避免产酸快速累积导致pH的迅速下降,累积的乙酸在第29天被顺利代谢消耗,最终累积产甲烷量提升到了276.67 mL·g−1。向以蛋白质类为主的有机底物中,适当加入多糖和脂质(E组),可使其氨氮抑制减弱,导致累积的乙酸、丙酸和异戊酸在第43天被顺利代谢,累积产甲烷量从而提升到了430.37 mL·g−1。在以脂质为主的有机底物中,适当多糖和蛋白质的加入(F组),导致了最低pH、氨氮浓度、TIC和VFAs的累积水平均有所提升,同时也出现了丙酸积累;该组累积产甲烷量下降到了711.25 mL·g−1,主要产甲烷阶段提前至23~31 d。在3种有机组分比例均衡的情况下(G组),酸化抑制和氨氮抑制作用较轻。本研究结果与部分已有研究[16-17]的结果一致:不同类型有机物混合的厌氧消化,有助于改善累积产甲烷量和提升产甲烷速率。
-
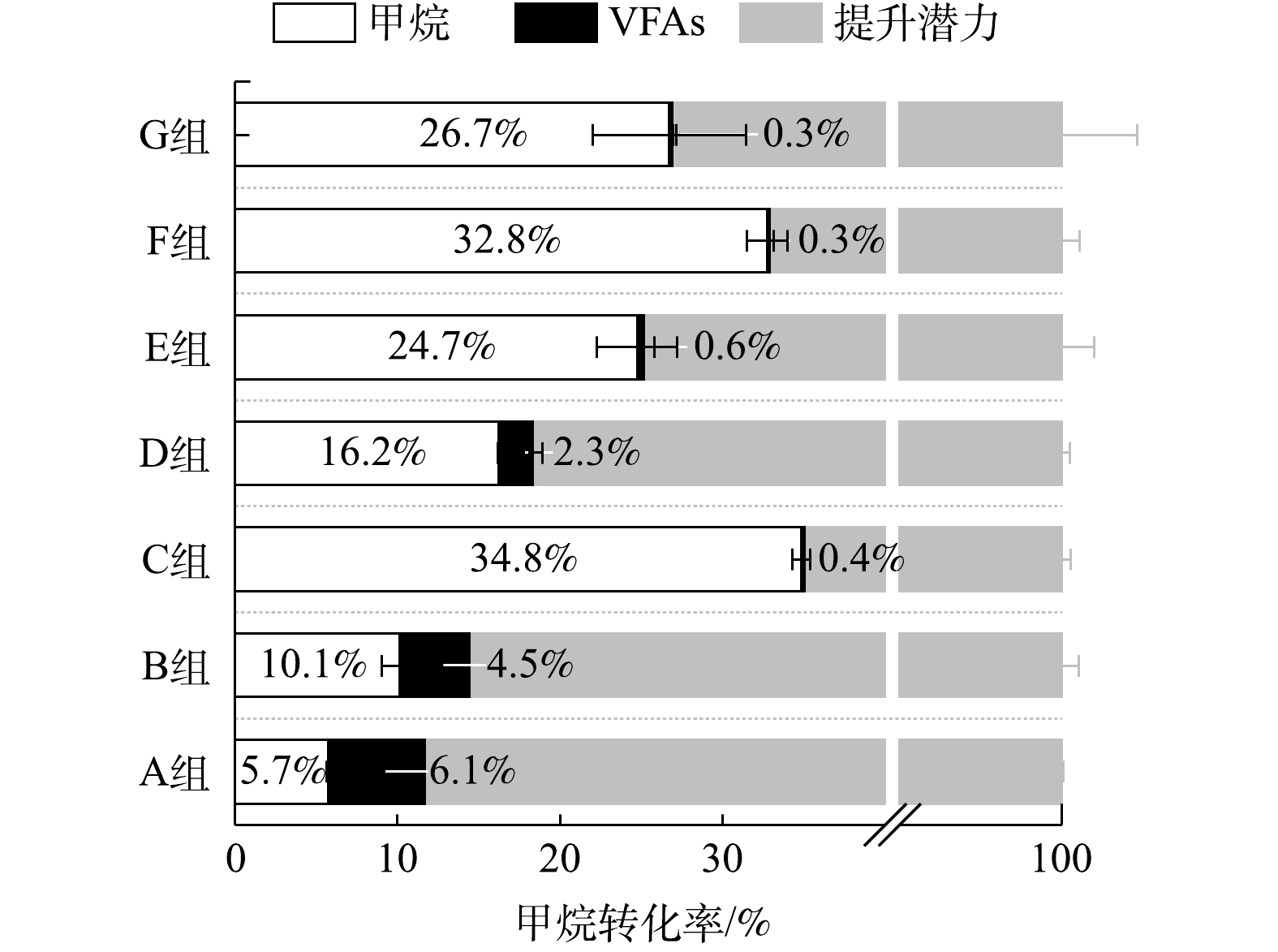
在不同有机组成下,厌氧消化甲烷转化率如表3所示。多糖和蛋白质比例的增加会降低餐厨垃圾干式厌氧消化的甲烷转化率,而脂质比例的增加会提升厌氧消化的甲烷转化率。
如图4(a)所示,3种有机组分在厌氧消化过程的降解性有明显差异。多糖降解性最好,平均降解率为62.87%;而蛋白质的降解性最差,平均降解率仅为29.62%。这与YANG等[18]的研究结果一致。随着底物中蛋白质比例的提高,厌氧消化结束时残余的溶解性蛋白含量也随之升高(图2(b))。许之扬等[19]的研究表明,随着厌氧消化的进行,胞外聚合物中蛋白质含量不断增加,这些蛋白质难以被进一步降解。
根据CHEN等[14]的方法将荧光组分按照区域划分,图5中三维荧光光谱显示,这些残留的溶解性蛋白质属于芳香类蛋白质和溶解性微生物代谢产物。这不同于詹瑜等[20]的研究结果:在厌氧消化过程中,芳香类蛋白质向腐殖酸、溶解性微生物代谢产物转化。这可能是由于,在本研究中产生的芳香类蛋白具有更加稳定的结构,难以被微生物利用。此外,蛋白质组分的增加也抑制了乙酸、丙酸和异戊酸的代谢。在厌氧消化过程中,甲烷的生成主要以乙酸为直接底物,所有脂肪酸必须降解成乙酸才能被产甲烷菌利用[21]。蛋白质分解释放的氨氮抑制了产甲烷菌对乙酸的利用,从而导致丙酸和异戊酸的累积。而异戊酸作为支链脂肪酸,比直链脂肪酸更加难以降解[22]。
多糖由于其水解速率较快,产生的有机酸不能及时被产甲烷菌消耗,造成了体系pH的快速下降。低pH条件导致甲烷转化率降低的原因可以从2方面解释。第一,在低pH条件下,VFAs主要以游离态存在,可以自由穿过细胞膜,在细胞内解离,使细胞质酸化,从而降低质子的跨膜运输,影响细胞的电生理和新陈代谢[23]。第二,pH的降低会影响溶液中碳酸(氢)盐的电离平衡,使其以CO2的形态释放[24]。TIC的主要组成是碳酸盐和溶解CO2。CO2是嗜氢产甲烷菌利用H2还原生成甲烷的重要底物。A组和C组的TIC在第3 d基本降到了0,特别是A组中TIC一直未能回升,这将导致氢利用产甲烷途径停止。氢气同时也难以被消耗,较高的氢分压将进一步抑制厌氧消化过程有机物的发酵产酸。
通过进一步的分析可发现,厌氧消化甲烷转化率(y)与脂质降解率(x)之间存在线性正相关(y=1.08x+0.13,R2=0.993 8)(图4(d)),而与多糖和蛋白质的降解率无线性相关性(图4(b)、图4(c))。甲烷转化率与脂质降解率之间的线性正相关可以从2方面解释。第一,长链脂肪酸的降解产物能够顺利转化成甲烷。长链脂肪酸(long-chain fatty acid,LCFA)是脂质分解的主要产物,其降解被认为是脂质产甲烷的主要限制步骤[25]。LCFA降解是热力学非自发反应,为了克服热力学不利因素,需要产甲烷菌不断去除LCFA降解的产物,主要是把乙酸和H2转化成甲烷[26]。相反,蛋白质与多糖的降解主要取决于相关的发酵细菌的参与,即使发酵产物累积,这2种组分也依旧能够降解。第二,脂质的理论产甲烷量要远高于其他2种组分,这意味3种组分在相同的降解率下,脂质产生的甲烷要比多糖或者蛋白更多,对甲烷转化率的影响也更大。因此,对于脂质类,尽管其他2种组分的加入并未带来酸化抑制或氨氮抑制,但是在初期提高了VFAs的累积水平。而高水平的乙酸和H2阻碍了LCFA降解,所以多糖和蛋白质比例的增加仍然降低了有机底物的整体甲烷转化率。此外,在本研究中,高脂质水平的底物有较长的产甲烷迟滞期,这可能是脂质分解产生LCFA所造成的。在C组和F组中,VFAs在初期的累积水平很低,同时产甲烷速率也很低,直到厌氧消化进行20 d以后,产甲烷速率才达到高峰。LCFA在厌氧消化初期吸附在细胞表面,可限制其与底物的传质[27]。但这种影响一般被认为是可逆的“物理屏障”作用,随着LCFA降解菌的富集,这种影响迅速被解除[28]。
-
VFAs是甲烷转化的前体物,厌氧消化结束时的VFAs根据式(3)~式(7)可以换算成标准状况下(273.15 K、101 kPa)甲烷的体积。
如图6所示,用降解的有机组分的量计算理论总产甲烷量(计为100%),多糖类(A组)和蛋白质类(B组)损失的甲烷产量仅有少部分留于残余的VFAs,大部分以其他形式损失。多糖类有机物损失的甲烷产量可能由于:低pH下产甲烷菌可利用的碳源以CO2的形式散失。而蛋白类有机组分可能是由于:微生物的代谢作用,使其结构发生了转化,因此难以被微生物进一步利用产生甲烷。脂质的加入能够缓解中间产物的累积,提高甲烷转化率,但其主要产物LCFA在初期影响产甲烷速率,导致较长的迟滞期。因此,这三者需要控制在合适的混合比例才能实现高效稳定的甲烷转化。
总之,餐厨垃圾中多糖类和蛋白类占比的提升会增加干式厌氧消化酸化以及氨氮抑制的风险,从而降低其甲烷转化率。虽然提升脂质占比可以提高甲烷转化率,但同时也推迟了主要产甲烷阶段。因此,需要三者合适的配比,以实现餐厨垃圾干式厌氧消化高效稳定地产生甲烷。
2.1. 不同有机组成底物的干式厌氧消化产甲烷性能
2.2. 不同有机组成底物的甲烷转化率限制性因素
2.3. 不同有机组成底物的甲烷转化率提升潜力
-
1)在干式厌氧消化过程中,多糖降解性最好,平均降解率为62.87%;而蛋白质的降解性最差,平均降解率仅为29.62%。
2)餐厨垃圾中多糖和蛋白质比例的增加会显著降低甲烷转化率,而脂质比例的增加则可显著提升甲烷转化率。
3)高多糖比例的餐厨垃圾干式厌氧消化会导致低pH下产甲烷菌可利用的碳源以CO2的形式散失;在高蛋白质比例下,蛋白质结构发生转化,难以被微生物进一步利用;在高脂质比例下,产甲烷速率在初期受限,导致较长的迟滞期。




 下载:
下载: