-
环丙沙星(ciprofloxacin,CIP)是一种典型的喹诺酮类抗生素,其具有喹诺酮和哌嗪环结构[1]。CIP在医学上有抗菌性强,能用来预防畜禽疾病和感染引起的人为性疾病[2],其广泛使用对微生物、植物、动物和人类健康构成潜在威胁,破坏原有环境的生态平衡[3-4]。目前,抗生素类废水处理技术主要有生物法、物理法,化学法等[5]。但由于抗生素类废水具有杀菌性强的特点,不易被生物降解,物理法也只能对污染物进行转移,不能对其彻底去除[6]。因而,寻求高效彻底的治理工艺成为研究热点。
传统Fenton法在处理难降解、有毒有害有机物方面具有独特优势[7],但其在发挥优势的同时,自身也存在许多缺陷:需在较低pH下(<4.0)反应,催化剂难分离而无法重复利用;反应体系中外加铁离子会造成溶液色度的增加,且反应后要重新调节pH。这不仅增加了处理成本,还会生成铁泥,给污水处理造成不便[8]。为了能在更宽的pH范围下提升Fenton活性,充分分离、回收和循环利用催化剂,众多研究已趋于非均相Fenton反应[9]。非均相Fenton反应体系具有反应条件温和,操作简单,对降解物无选择性,且有处理效率高等优点而被广泛使用[10]。但非均相铁基芬顿体系在非酸性条件下具有易丧失芬顿活性的缺陷[11],故诸多研究者已开始关注其他具有芬顿活性的金属离子。有研究发现,金属离子在pH为5.5~9.5时,类芬顿活性顺序为Cu(Ⅱ)>Cr(Ⅲ)>Co(Ⅱ)>Fe(Ⅲ)>Mn(Ⅱ)>Ni(Ⅱ),Cu(Ⅱ)/H2O2体系产生羟基自由基(·OH)能力最强[12]。Zn2+与Cu2+有相近离子尺寸和电子环境,且具有Fenton催化活性,因此,添加Zn2+与Cu2+发挥双金属间协同作用,可以提高催化剂的活性,同时可减少金属离子溶出[13]。
本研究采用化学共沉淀法制备以Cu为核心元素、掺杂Zn元素的非均相铜基催化剂,通过正交实验研究了Cu/Zn金属盐投加比例、模板剂葡萄糖添加量、反应液pH、焙烧温度等因素对催化剂催化降解CIP的影响;利用XRD、SEM、BET、XPS等表征手段对优选出的Cu/Zn催化剂进行分析表征,探讨了Zn掺杂元素对Cu/Zn催化剂的催化性能影响;考察了Cu/Zn催化剂投加量、H2O2投加量、溶液初始pH等对CIP的最优条件,同时研究了反应体系的H2O2消耗量和·OH生成量,最后探讨了非均相铜基催化剂对CIP的降解机理。
全文HTML
-
CIP标准品,购自阿拉丁;乙腈(HPLC)、甲酸(HPLC)、无水乙醇(AR)均购自天津市科密欧化学试剂有限公司;硝酸铜、硝酸锌、硫酸钛、硫酸、邻苯二甲酸氢钾、香豆素、磷酸二氢钾、氢氧化钠、30% H2O2、无水葡萄糖均为分析纯,购自国药集团化学试剂有限公司。
高效液相色谱仪(LC1100,美国安捷伦);扫描电子显微镜(SU-8010,日本日立);X射线衍射仪(XRD-6100,日本岛津);BET(Quantachrome Instruments Quadrasorb EVO,美国);XPS(ESCALAB 250Xi,美国赛默飞世尔科技公司);ICP-MS(ThermoFisher X SERIESⅡ,美国);LC-MS(waters 2996,waters micromass-ZQ,美国);马弗炉(德国Nabertherm);电热恒温鼓风干燥箱(DHG-92468,上海精宏实验设备有限公司);原子荧光光谱仪(AF-640);pH计(STARTER5000,美国奥豪斯);多头磁力加热搅拌器(HJ-4,常州国华电器有限公司);三频数控超声波清洗器(KQ-500VDE,昆山市超声仪器有限公司)。
-
1)非均相铜基催化剂的制备。分别称取一定量Cu(NO3)2·3H2O和Zn(NO3)2·6H2O,溶解到100 mL蒸馏水中,将双金属盐混合液搅拌10 min至其溶解均匀,加入模板剂无水葡萄糖。在持续搅拌的同时,将3.33 mol·L−1的NaOH逐滴加到混合液中,控制悬浊液pH,将得到的沉淀液继续搅拌20 min后超声10 min,在室温下静置3 h,使用无水乙醇和蒸馏水离心洗涤至上清液为中性,将离心洗涤后的样品在60 ℃下干燥12 h。最后将烘干研磨后的样品分别在300、500、700 ℃的马弗炉里煅烧2 h,制得的非均相铜基催化剂。
2)正交实验方案设计。实验过程中发现制备出催化性能较优的催化剂受到多种实验条件的影响。因此,利用正交实验探讨了非均相铜基催化剂制备过程中的Cu/Zn金属盐摩尔比、模板剂葡萄糖添加量、反应液pH、焙烧温度等条件对制备出的催化剂催化降解CIP的影响,正交实验条件如表1所示。
-
以优选出的Cu/Zn催化剂与30%H2O2进行非均相Fenton反应降解CIP。在室温下,准确移取浓度为20 mg·L−1的CIP溶液100 mL至250 mL锥形瓶中,用NaOH溶液或稀H2SO4调节pH。加入适量Cu/Zn催化剂,吸附平衡后加入30% H2O2,控制搅拌速度为250 r·min−1,每隔15 min取样,经0.22 µm滤膜过滤后,用HPLC测定反应液中CIP的剩余浓度。实验结果均通过3次平行实验取平均值。
-
1) CIP的HPLC分析。CIP浓度检测采用LC1100高效液相色谱仪。色谱分离条件为Promosil C18色谱柱(4.6 mm×150 mm,5 μm),流动相为乙腈:0.2%甲酸水溶液=17∶83,检测波长为277 nm,流速为1 mL·min−1,色谱柱温度为30 ℃,进样量设定为20 µL。
2) H2O2消耗量测定。取经0.22 μm滤膜过滤后的上清液1 mL置于25 mL具塞比色管中,将1 mL的0.1 mol·L−1的Ti(SO4)2溶液、1 mL的2 mol·L−1的H2SO4溶液依次加入比色管中,然后准确加入去离子水10 mL,充分振荡,显色5 min后在400 nm处测其吸光度[14],得到H2O2浓度与吸光度的标准曲线为y=0.011 5x+0.7088(R2=0.998 6),其中x为H2O2浓度,y为吸光度。
3) ·OH产生量测定。采用荧光光谱法测定。以香豆素作为探针分子,捕获·OH生成具有强大荧光特性的7-羟基香豆素。将pH为7.2的缓冲液0.5 mL和0.1 mol·L−1香豆素溶液50 mL混合均匀,分别取不同时刻反应液5 mL与上述溶液混合,置于封闭空间中,用紫外灯照射及磁力搅拌5 min后,置于荧光光谱仪测量其荧光度,由标准曲线得出反应体系·OH的浓度(C·OH=1.58×I460 mmol·L−1[10])。荧光检测的激发波长为345 nm,发射波长为460 nm,积分时间为1 s。
4) LC-MS分析。采用LC-MS检测中间产物:C18色谱柱(安捷仑poroshell 120 EC-C18 2.7 μm 4.6 mm×100 mm)。流动相为乙腈/0.2%甲酸水溶液=17∶83,离子源是大气压电离源,流速1 mL·min−1,进样杆温度为35 ℃,DAD检测器,高分辨质谱为ESI源(Q-Exactive Thermofishe)。
1.1. 试剂与仪器
1.2. 非均相铜基催化剂的制备
1.3. 实验方法
1.4. 分析方法
-
表2显示了正交实验结果。在室温下,当CIP浓度为20 mg·L−1、溶液初始pH为5.0、催化剂投加量为3.0 g·L−1时,在吸附平衡30 min后投加H2O2为149.55 mmol·L−1条件下反应60 min。由表2可知,A是影响催化降解CIP的主要因素,其次是B,再次是C,而D影响最小,制备非均相铜基催化剂的最佳方案:A为10∶3、B为0.02 mol、C为5.0、D为700 ℃。后续所有实验的催化剂均采用此条件下所制备,并命名为Cu/Zn催化剂。
-
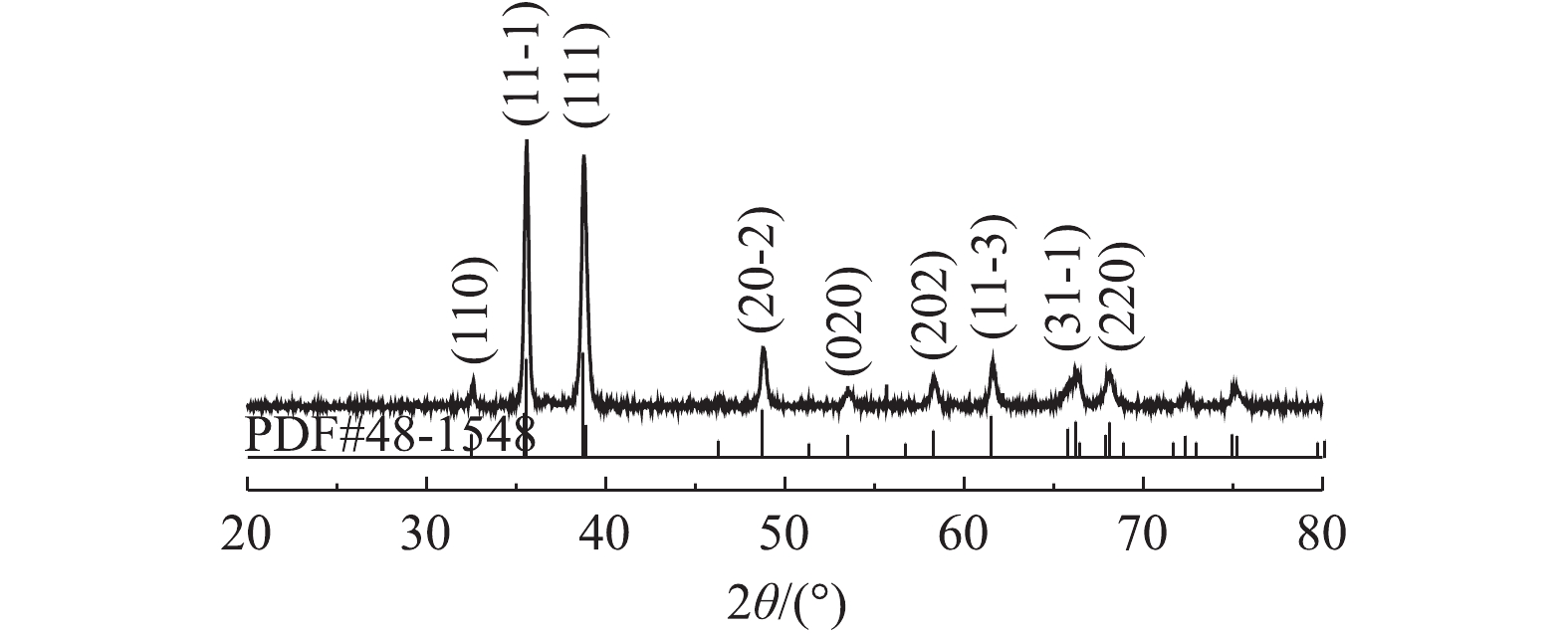
1) XRD分析。图1为化学共沉淀法制备Cu/Zn催化剂的XRD图。由图1可知,催化剂在2θ为32.508°、35.543°、38.708°、48.716°、53.49°、58.27°、61.35°、66.57°、68.12°等位置出现的特征衍射峰与CuO(PDF NO.48-1548)相一致,分别对应CuO的(110)、(11-1)、(111)、(20-2)、(020)、(202)、(11-3)、(31-1)、(220)晶面[15],这表明所制备的Cu/Zn催化剂主要成分为CuO。
2) SEM分析。图2为Cu/Zn催化剂的SEM图。由图2可见,催化剂大部分是由直径约50 nm的小椭圆形颗粒构成,也有小部分颗粒粒径达到200 nm,整个样品颗粒均匀分布。由图2(a)可知,当放大倍数为15 000时催化剂出现小部分片状团聚,小颗粒之间连接不紧密,狭缝孔明显。由图2(b)可知,当放大倍数为60 000时催化剂表面附着有小白点形式的微小纳米颗粒。分析其可能原因是,在模板剂葡萄糖的作用下,形成了良好的胶束,使添加的元素Zn能够附着于材料表面[16],加速了铜基催化剂的协同作用。
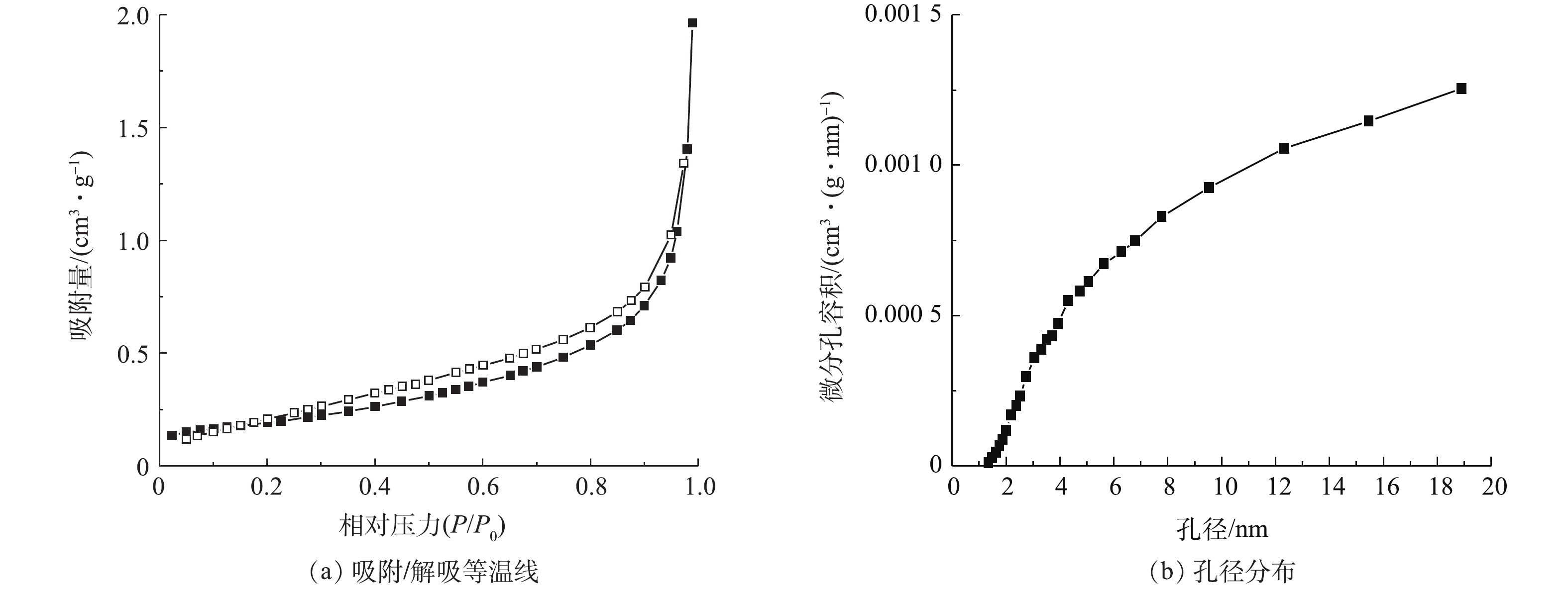
3) BET分析。图3为Cu/Zn催化剂的N2吸附-脱附等温线和孔结构分布图。根据国际纯粹与应用化学联合会的分类标准,Cu/Zn催化剂的吸附等温线属于Ⅲ类,吸附等温线显示了催化剂具有介孔结构。由图3还可以看到,催化剂的N2吸附-脱附等温线出现了明显的狭长H3型滞后环。滞后环的吸附分支在相对高压力下没有明显的极限吸附量,且吸附量随压力增加而呈递增趋势,可能是裂隙孔或堆积孔,而这多出现在有狭长裂口孔状结构的片层材料里,即颗粒堆积而形成的狭缝孔,这与催化剂的SEM图(图2(a))相吻合[17]。Cu/Zn催化剂孔径分布曲线图进一步说明了材料是均匀的介孔材料,孔径大小大部分位于2~8 nm。
Cu/Zn催化剂的比表面积为0.739 m2·g−1、总孔容为0.003 cm3·g−1、中孔孔容为0.0029 cm3·g−1、平均孔径为3.414 nm,属于中孔。
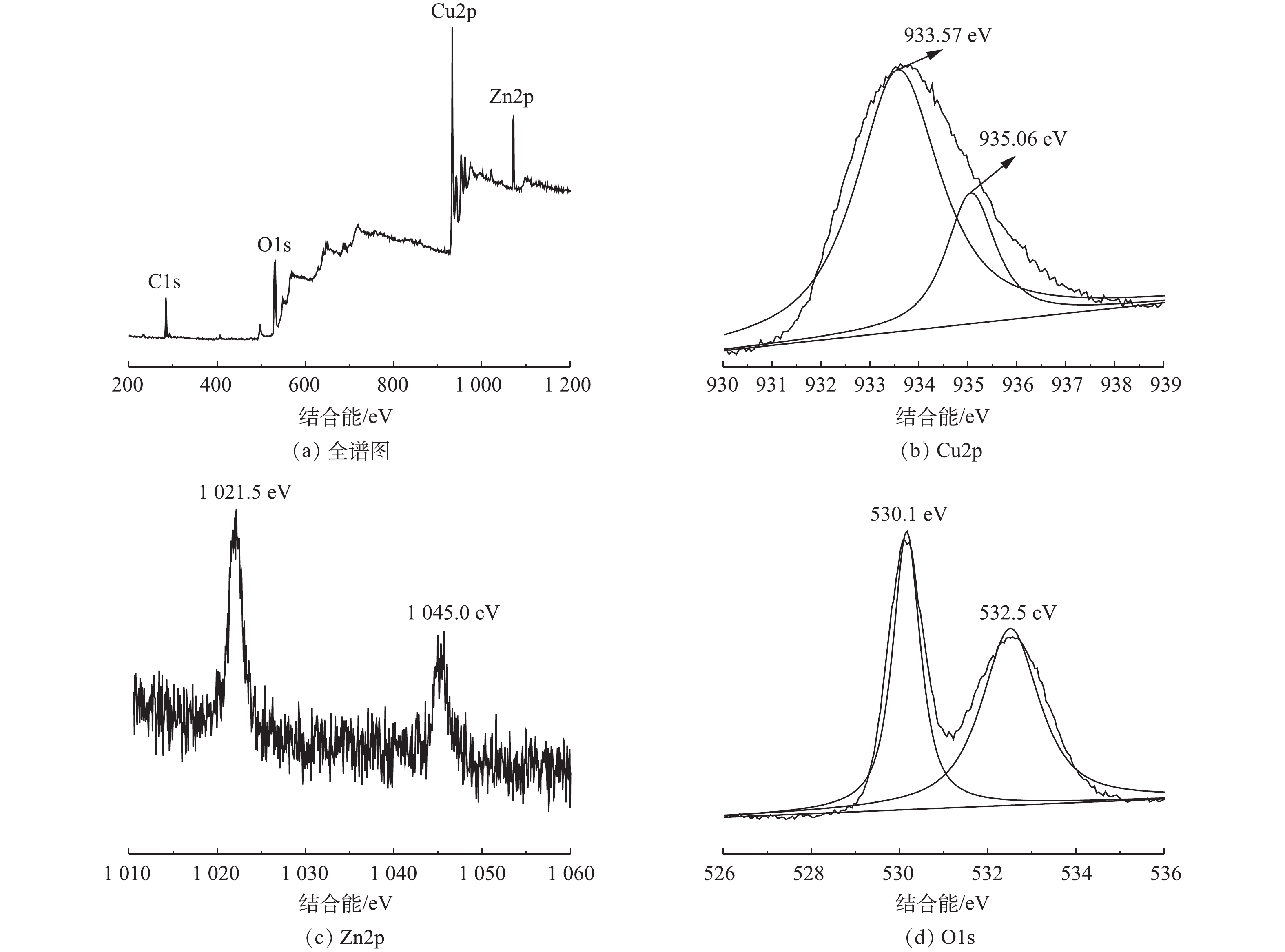
4) XPS分析。图4为Cu/Zn催化剂的XPS图。图4(a)为Cu/Zn催化剂全谱扫描图,说明了催化剂中存在Cu、Zn、O、C的4种元素。其中,图4(b)在结合能为934 eV的Cu2p3/2轨道峰拟合成结合能为933.57 eV的还原态Cu+和结合能为935.06 eV的氧化态Cu2+,通过计算可得,Cu+/Cu2+值为3.39[18]。这说明催化剂中含量较多的Cu+可催化H2O2分解产生·OH,而存在的Cu2+可与H2O2反应生成Cu+,达到Cu+/Cu2+高效循环,其反应方程如式(1)~式(3)所示。
图4(c)为Zn元素在结合能为1 021.5 eV和1 045.0 eV位置出现的2个峰,分别对应Zn2p3/2和Zn2p1/2,表明锌元素以Zn2+形式与O结合,在催化剂表面有ZnO存在,少量的Zn掺杂能够调控表面氧空穴从而间接影响·OH的产生[19-20]。图4(d)为O1s轨道峰,结合能为530.1 eV为晶格氧,其能够使金属氧化物被还原较高价态,从而促进氧化还原反应进行;532.5 eV处的峰为表面氧,表面氧可以吸附氧气从而捕捉电子产生更多的·OH,达到降解CIP的目的[19]。
-
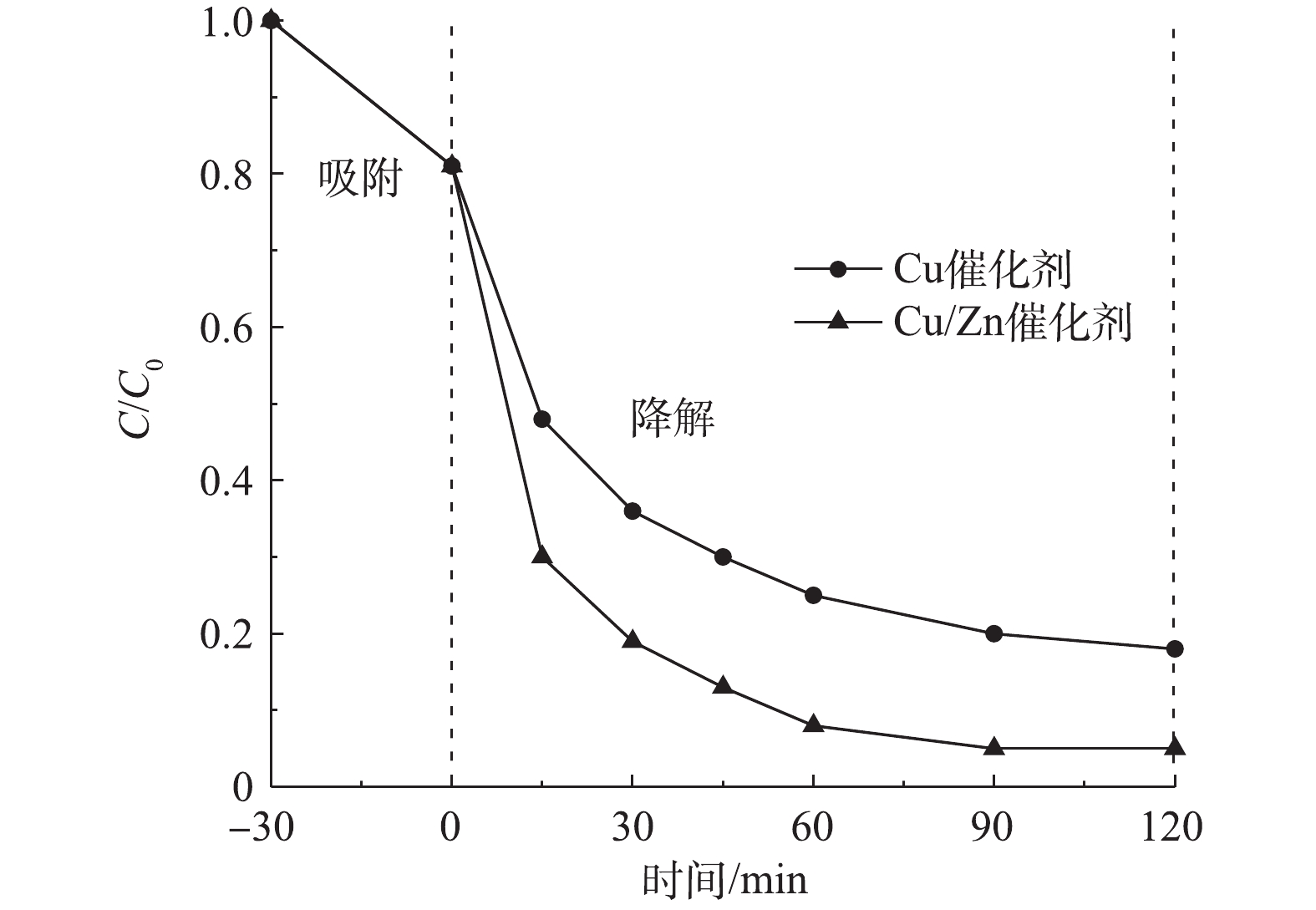
图5为相同条件下制备的Cu/Zn催化剂和Cu催化剂对CIP催化降解效果对比。实验条件:室温下,当CIP浓度为20 mg·L−1、溶液初始pH为5.0、催化剂投加量为3.0 g·L−1时,在吸附平衡30 min后投加H2O2为149.55 mmol·L−1。由图5可知,反应120 min时,Cu/Zn催化剂和Cu催化剂对CIP的降解趋于缓慢,降解率分别为95.0%和81.9%;从整个反应过程看,反应进行30 min时,Cu/Zn催化剂对CIP的降解率为80.6%,而Cu催化剂仅降解63.7%的CIP。结果表明,与Cu催化剂相比,在掺杂Zn元素后的Cu/Zn催化剂不仅引入了新的活性位点,且双金属可协同活化H2O2会产生更多的·OH,可显著提高对CIP的催化降解性能。
-
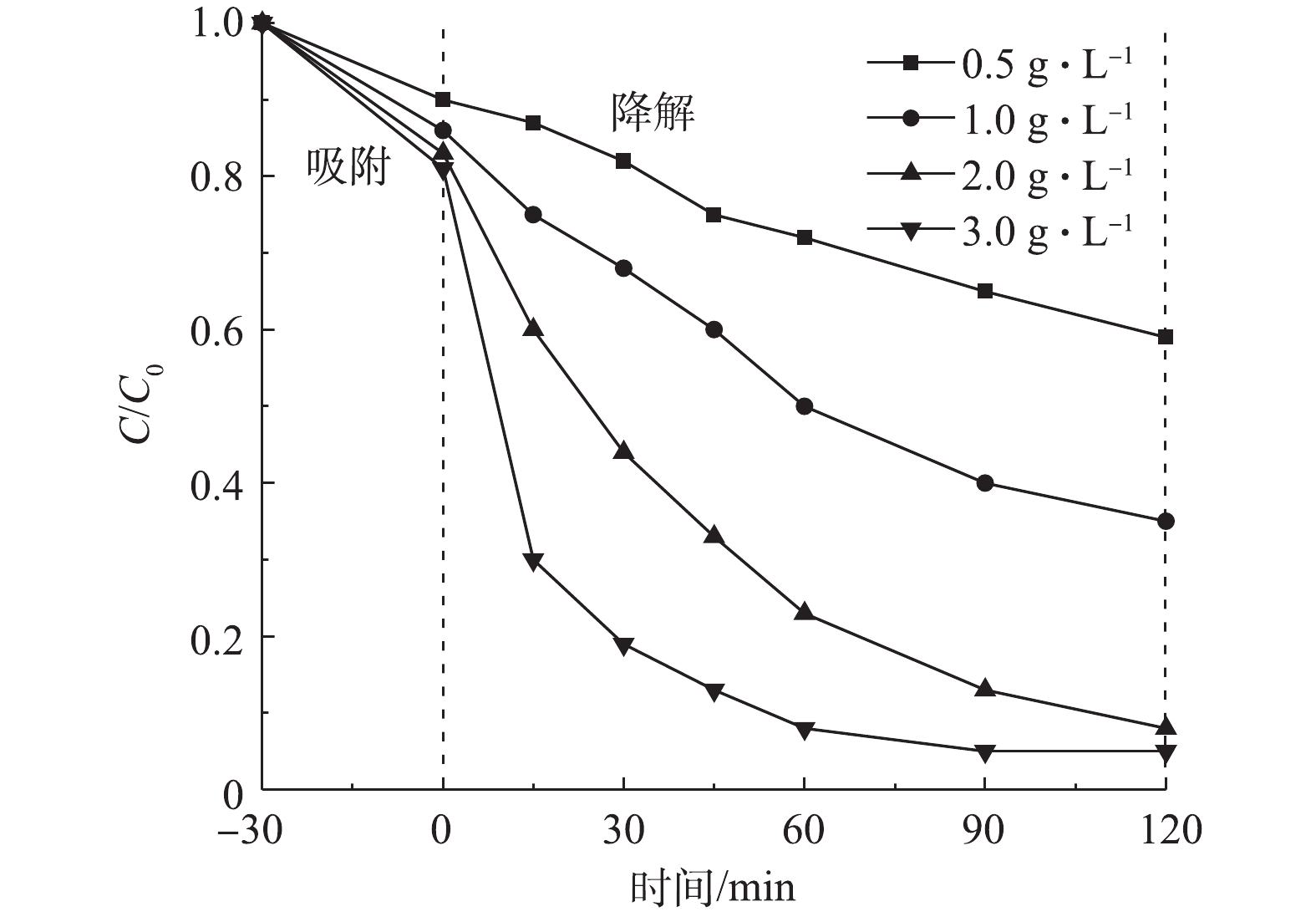
1) Cu/Zn催化剂投加量的影响。在室温下,当CIP浓度为20 mg·L−1、溶液初始pH为5.0时,Cu/Zn催化剂投加量分别为0.5、1.0、2.0、3.0 g·L−1,吸附平衡后投加H2O2为149.55 mmol·L−1,在此条件下考察催化剂投加量对CIP降解效果(图6)。由图6可知,催化剂吸附量在10.0%~20.0%,反应体系中CIP的降解率随着催化剂投加量的增加而呈递增趋势。当反应时间为15 min时,明显发现催化剂投加量为3.0 g·L−1对CIP的降解效果最佳(70.5%),其降解率约为投加量0.5 g·L−1的7倍,投加量1 g·L−1的2.8倍,投加量2 g·L−1的1.75倍;当反应时间为60 min时,催化剂投加量为3.0 g·L−1时对CIP的降解率达92.0%,而当其投加量为2.0、1.0、0.5 g·L−1时的降解率分别为77.6%、48.5%、24.6%;当反应时间为90 min时,催化剂投加量为3.0 g·L−1和2.0 g·L−1时,其对CIP的降解率分别为95.0%和87.0%,而投加量为1.0 g·L−1和0.5 g·L−1时对CIP的降解率为60.0%和35.0%。这说明随着催化剂投加量的增加,提供了更多的表面活性位点,可以在短时间内与H2O2反应生成更多的·OH,加速了氧化降解CIP。此后继续增加反应时间,催化剂投加量为3.0 g·L−1对CIP的降解率不变。因此,选择催化剂投加量为3.0 g·L−1时,在90 min内CIP可完成催化降解。
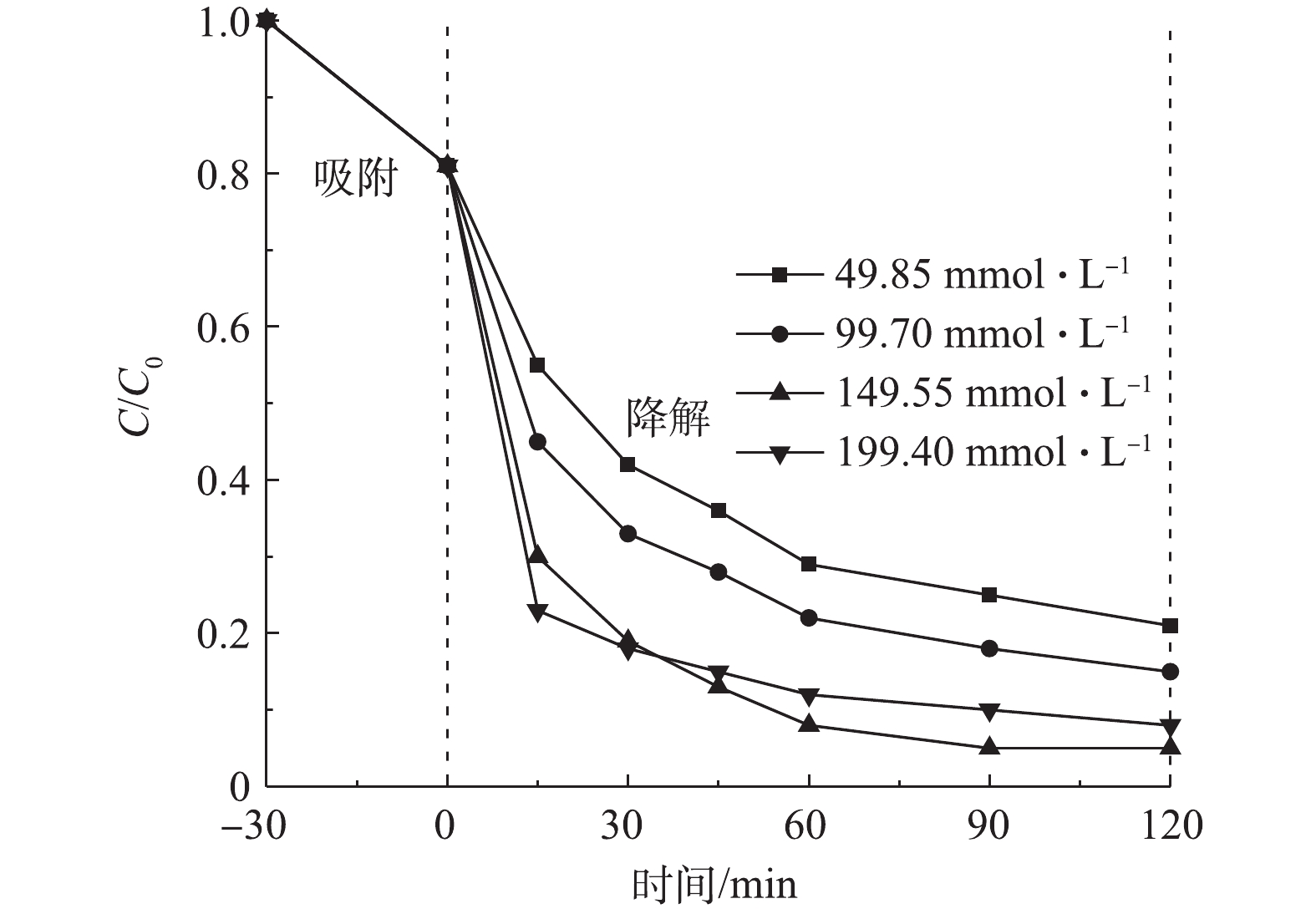
2) H2O2投加量的影响。非均相Fenton反应的基本原理是催化剂与H2O2产生·OH来对目标污染物进行氧化降解,因此,H2O2投加量将会直接影响到·OH的产生速率,进而影响降解CIP的效率[21]。在室温下,反应器中CIP浓度为20 mg·L−1,调节溶液初始pH为5.0,投加Cu/Zn催化剂为3.0 g·L−1,吸附平衡后H2O2投加量分别为49.85、99.70、149.55、199.40 mmol·L−1,在此条件下考察H2O2投加量对CIP降解效果(图7)。由图7可知,CIP的降解率在30 min内随H2O2投加量的增加而增大;但随着反应时间继续增加(>30 min),投加量为199.40 mmol·L−1对CIP的降解率迅速放缓,低于投加量为149.55 mmol·L−1的降解率。反应体系在30 min内均能大部分的降解CIP是由于催化剂能与足量的H2O2反应,短时间内产生大量的·OH来降解CIP;但当投加量提高到199.40 mmol·L−1且反应时间大于30 min后,因H2O2浓度过大会与·OH反应生成氧化能力小得多的HO2·,甚至还会使H2O2无效分解为H2O和O2[22]。因此,本实验选择H2O2投加量为149.55 mmol·L−1。
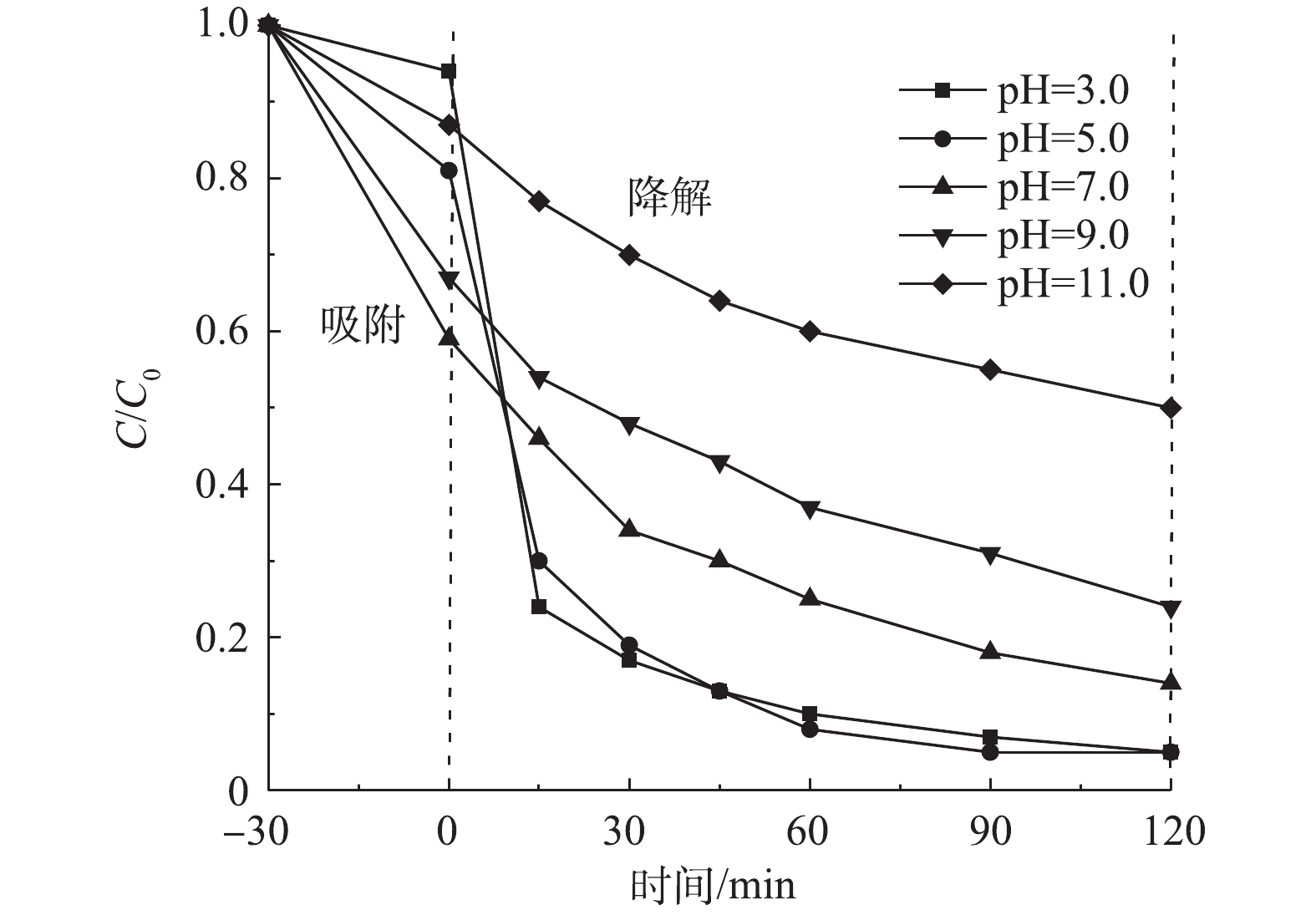
3)溶液初始pH的影响。在室温下,反应器中CIP浓度为20 mg·L−1,调节溶液初始pH分别为3.0、5.0、7.0、9.0、11.0,Cu/Zn催化剂投加量为3.0 g·L−1,吸附平衡后分别投加H2O2为149.55 mmol·L−1,在此条件下考察溶液初始pH对CIP降解效果(图8)。由图8可知,pH为3.0、5.0的反应体系时,CIP降解曲线差异较小,说明这2种反应体系中CIP降解率较为一致。但由图8中也可以看出,随着pH增大,CIP的降解率呈降低趋势。当反应时间为90 min时,pH为3.0、5.0、7.0、9.0和11.0各反应体系对CIP降解率分别为93.2%、95.0%、82.3%、69.4%、45.2%。这是因为反应体系pH>7.0时影响了CIP的水解形态,导致其降解率会显著降低,且H2O2也容易分解成O2和H2O,导致其生成·OH速率降低[23];继续增加反应时间,pH为3.0、5.0的反应体系对CIP降解率趋于不变,而pH为7.0、9.0和11.0反应体系的降解率分别为86.4%、76.2%、50.6%。由于不同的目标污染物降解有各自特定的pH,但与传统Fenton法相比,本实验结果说明了Cu/Zn催化剂能在pH为3.0~7.0时达到较好降解率。考虑到实际应用的可行性,选择溶液初始pH为5.0。
-
为了分析反应体系中H2O2消耗量及·OH产生量,采用钛盐分光光度法测定了反应体系H2O2消耗量,以香豆素作为探针,使用荧光光度法测定了体系中·OH的产生量。在室温下,CIP浓度为20 mg·L−1、溶液初始pH为5.0、催化剂Cu/Zn投加量为3.0 g·L−1、吸附平衡后H2O2投加量为149.55 mmol·L−1的条件下,分析降解过程中H2O2的消耗量和·OH产生量(图9)。由图9可知,在反应30 min时,H2O2实际消耗了63.0%,即消耗了94.2 mmol·L−1的H2O2,此刻产生了81.0 mmol·L−1的·OH,H2O2利用率达到86.0%;当反应60 min时,H2O2实际消耗了81.0%,即消耗了121.1 mmol·L−1的H2O2,此刻产生了74.0 mmol·L−1的·OH,H2O2利用率达到了61.1%。由图7可知,当反应体系进行到60 min时,CIP的降解率已达92.0%,即此时反应体系中H2O2消耗81.0%就能去除大部分的CIP,而反应体系继续进行时(>60 min)还有H2O2消耗及·OH产生是为了降解CIP的中间产物,使其最终降解为CO2和H2O等。传统Fenton反应体系能达到10%~60%的H2O2利用率,而本实验最大能达到86.0%的H2O2利用率,这说明本研究制备的Cu/Zn催化剂在反应体系中能高效催化H2O2产生·OH,从而可快速地降解CIP。
-
反应过程中金属离子的溶出是评价催化剂稳定性的一个重要因素。通过ICP-MS分析反应进行到30、60、90、120 min时体系中金属离子溶出浓度,不同反应时溶出总铜浓度几乎保持不变,稳定在2.6~2.9 mg·L−1,这显著低于已有研究[24]中高达17~200 mg·L−1的总铜浓度;溶出锌离子浓度未检出。这可能是因为Cu/Zn催化剂经过高温焙烧后晶粒粒径变小,其比表面积增大,CuO与ZnO协同作用增强,使催化剂的稳定性提高,故不易于溶出[25]。上述结果表明,Cu/Zn催化剂具有良好的稳定性,在反应过程中金属离子的溶出量较低。
-
Cu/Zn催化剂与H2O2反应产生具有强氧化性的·OH,其通过攻击CIP导致化学键的断裂,从而生成短链羧酸,最终降解为CO2、H2O、
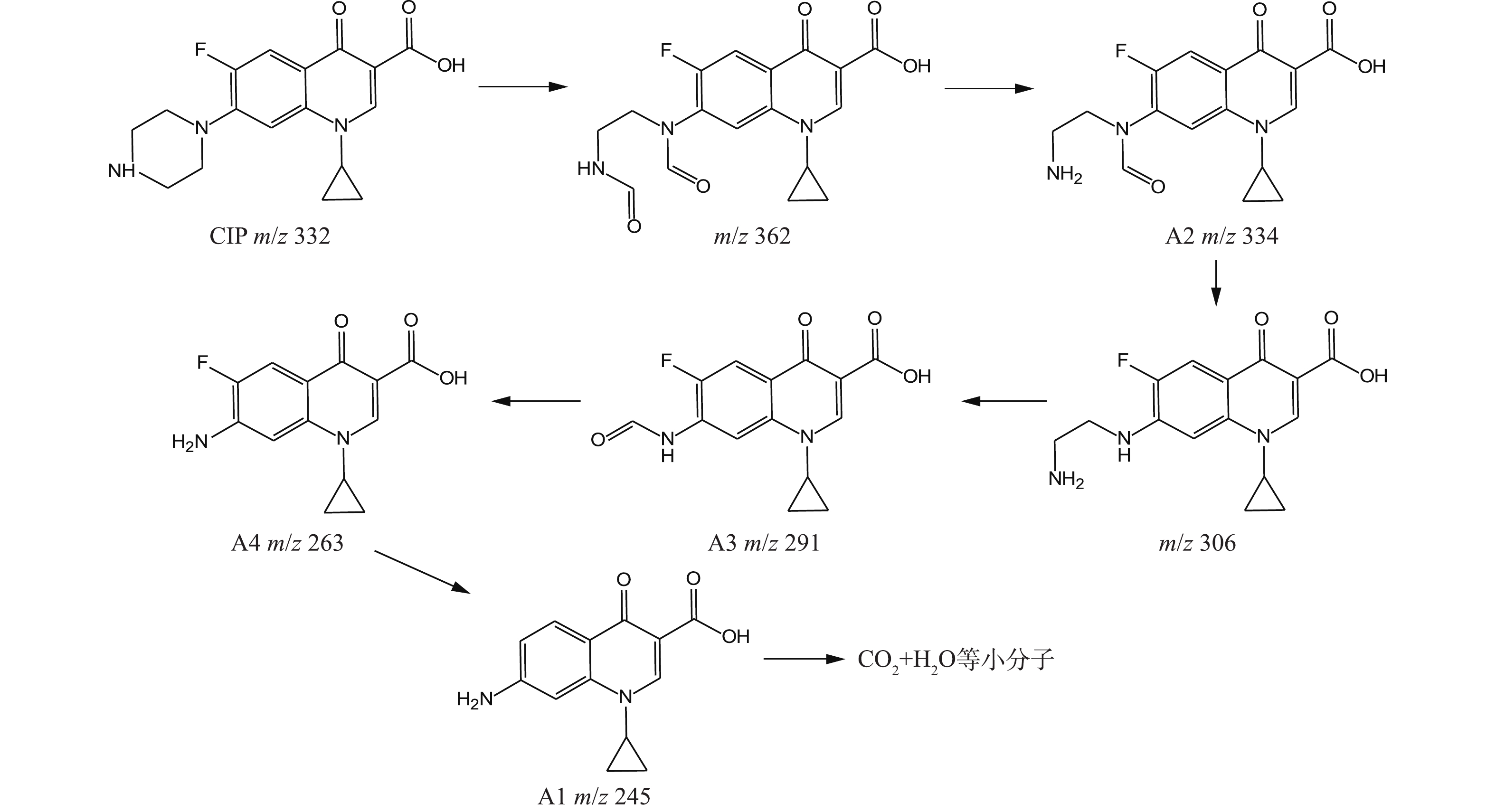
${\rm{NO}}_3^ - $ 、${\rm{NH}}_4^ + $ 等。在CIP氧化过程中,通过LC-MS谱图(30 min)检测出4种中间降解产物(A1、A2、A3、A4),其详细检测结果见表3。根据HPLC实验结果可知,CIP出峰时间tR为1.68 min,m/z为332,其主要质谱特征碎片为m/z=314 (对应于CIP的1个H2O损失)、m/z=288 (对应于CIP的COO—损失)、且还出现了含量较少的m/z=245 (对应于CIP的哌嗪环断裂)和m/z=231 (对应于环丙基环脱落)[26]。基于表3提出的合理降解路径是:官能团的可氧化次序为哌嗪环>苯环>吡啶酮环[27],结合AN等[28]对CIP分子前线电子密度的计算,且哌嗪环是CIP分子结构的活性中心,因此,CIP的氧化分解主要发生在哌嗪环上;CIP的哌嗪环被·OH攻击导致C—C键断裂,即哌嗪环开环,之后继续被·OH氧化并醛基化,生成双醛基衍生物,该物质上的醛基易被·OH氧化,损失一个甲醛后生成A2[29];A2的N1在损失了仲胺氮基后生成A3;产物A4为CIP中哌嗪环侧链被完全氧化,最后只剩下氨基,是被·OH多次攻击的结果[30];A4经过C—F键的断裂和进一步氧化转化成A1,最终A1在持续攻击下而被完全矿化成CO2和H2O等小分子物质,CHONG等[31]也报道了相似的CIP降解路径。
根据以上结果,在Cu/Zn与H2O2反应体系中CIP可能存在的降解路径如图10所示。
2.1. 正交实验
2.2. 催化剂的表征
2.3. Cu/Zn催化剂与Cu催化剂降解效果对比
2.4. Cu/Zn催化剂催化降解CIP的影响因素
2.5. 降解过程H2O2的消耗量与·OH产生量
2.6. Cu/Zn催化剂的稳定性
2.7. CIP降解机理
-
1) Cu/Zn催化剂主要是由CuO组成的介孔材料,具有较好的结晶度及均匀的颗粒状表面形貌,比表面积为0.739 m2·g−1、总孔容为0.003 cm3·g−1、中孔孔容为0.0029 cm3·g−1、平均孔径为3.414 nm。
2)采用浓度为20 mg·L−1的CIP作为目标污染物,在初始溶液pH为5.0、催化剂投加量为3.0 g·L−1、H2O2投加量为149.55 mmol·L−1最适条件下,Cu/Zn催化剂具有良好的催化性能;在反应进行到30 min时,产生了81.0 mmol·L−1的·OH,H2O2利用率可达86.0%;当反应时间为90 min时对CIP的降解率为95.0%;Cu/Zn催化剂具有良好的稳定性。
3) Cu/Zn催化剂能在pH为3.0~7.0时保持较好的非均相Fenton反应效果,解决了传统Fenton催化剂在非酸性条件下催化活性较低的局限。
4)在CIP氧化30 min时,通过LC-MS检测出4种中间降解产物(A1、A2、A3、A4),其出峰时间分别为1.462、3.382、3.556、3.731 min,其对应的化合物分子式分别为C13H12N2O3、
${{\rm{C}}_{16}}{{\rm{H}}_{16}}{\rm{F}}{{\rm{N}}_3}{\rm{O}}_4 $ 、C14H11FN2O4、${{\rm{C}}_{13}}{{\rm{H}}_{11}}{\rm{F}}{{\rm{N}}_2}{\rm{O}}_3 $ 。



 下载:
下载: