-
不锈钢渣是生产不锈钢时产生的副产物,每生产1 t不锈钢大约产生300 kg不锈钢渣[1]。不锈钢渣中铬元素含量高达4%[2],主要存在于尖晶石相内,少部分以氧化物的形式内嵌于硅酸盐类矿相中[1, 3-4]。目前,我国对冷态不锈钢渣的综合利用率较低,主要以堆场露天存放为主。在堆存过程中,不锈钢渣中含钙、镁的矿相会与空气中CO2发生碳酸化反应,而三价铬则会被O2氧化为六价铬。在雨水的淋溶作用下,不锈钢渣中硅酸盐类矿相、碳酸化产物相和氧化生成的二次相中的铬可以被释放到堆场周边的水和土壤中。六价铬毒性较强,具有高致癌性和高致病变性[5],随着雨水渗入周边土壤或地下水中,会对周围生态环境带来极大威胁[6-7]。
铬作为重金属,兼具较高回收价值与环境风险,因此,如何安全地从含铬矿物中提取铬元素已经成为当前研究的热点问题。目前,从含铬矿物中提取铬可通过火法冶金与湿法冶金工艺来实现。火法冶金工艺是在碱性条件下对含铬矿物焙烧提取铬元素的一种方法[8-10],该方法适用于铬含量较高的矿物(36%~56% Cr2O3)。火法冶金工艺提铬效率较低,能耗较高[11],物中包含大量铬酸盐残留物(COPR),不仅污染环境,还会严重危害人类身体健康[12],这些缺点阻碍了该方法的广泛应用。19世纪70年代以来,人们开始探索在酸性或碱性溶液中生产铬酸盐的湿法冶金工艺。赵明辉等[13]采用液相氧化法,在NaOH溶液中分解铬铁矿,发现当铬铁矿粒径为38~48 µm,矿碱质量比为1:7,温度245 ℃,初始碱质量分数65%,氧气压力为0.8 MPa,反应时间480 min,铬的提取率可以达到99%以上。AMER et al[14]采用以碱性溶液、纯氧为原料的液相氧化法来提取铬,并且对铬铁矿进行了机械活化碱浸的预处理手段以提高矿石的化学反应性,降低了反应温度。XU et al[15]提出了一种改进的加压浸出工艺,虽舍弃了机械活化,但适当的提高氧分压和NaOH的浓度,使得铬的提取率大大提高。CHEN et al[16]研究了在高氧压的KOH半熔盐中从菲律宾铬铁矿中提取铬,在最优化的条件下,铬元素的提取率可以达到98%。
提取不锈钢渣中铬元素兼具铬资源回收与固体废弃物解毒的作用,但是与工艺较为成熟的从铬铁矿中提取铬元素相比,以不锈钢渣为原料从中提取铬的研究较少。作为湿法冶金提取铬的首要理论基础,不锈钢渣中含铬相的碱性氧化热力学亟需研究。本研究采用X射线荧光分析(XRF)来分析不锈钢渣的化学组成;采用X射线衍射(XRD)来分析不锈钢渣的矿相组成和铬的赋存形态;采用HSC Chemistry 5.0热力学软件来计算不锈钢渣中各种基质元素和铬元素在水溶液中可能的存在形态,并采用FactSage 7.0热力学软件对不锈钢渣中的含铬相在不同碱度的溶液中可能发生的氧化反应进行热力学计算。本文研究结果在一定程度上为不锈钢渣的资源化利用和生态风险评价提供了热力学理论基础。
全文HTML
-
本文所采用的不锈钢渣来自中国南方某不锈钢厂生产的电炉渣(EAF渣),经破碎、研磨和筛分,获得粒径小于75 µm的EAF渣样,渣样置于105 ℃的恒温干燥箱内干燥6 h后装袋备用。
-
采用PW2400型X射线荧光光谱仪(瑞士菲利浦)以及ZHY401/601压样机(北京合众)来对EAF渣的化学组成进行分析。
采用D/MAX2500PC型X射线衍射仪分析EAF渣的组成矿相,实验条件:Cu-Kα射线,管电压设置为40 kV,管电流100 mA,扫描范围为15°~75°,扫描速度为5°/min。通过JADE 5.0软件对该EAF渣的矿相组成进行定性分析和半定量分析[17]。
采用HSC分析EAF渣中铬元素以及其他基质元素在溶液中的存在形态。温度设定为25 ℃,介电常数值设定为78.382,水的标准吉布斯自由能为−56.678 kcal/mol,Eh值选取范围为−2.0~2.0 V,pH值选取范围为0~14。
采用FactSage分析EAF渣中含铬相在不同碱度溶液中的氧化反应热力学。所选取的数据库:FactPS、FToxid、FTsalt、FTmisc和FTlite,所用参数选取的单位:T(K)、P(atm)、Energy(J)、Mass(mol)和Vol(litre),参与反应的各物质均选取为稳定存在相。计算温度选取为273~573 K,温度步长选取为50 K。
1.1. 实验材料
1.2. EAF渣物化性能分析
-
EAF渣的化学组成以氧化物形式表示,其结果见表1。
表1可知,该EAF渣主要含有SiO2和CaO,含量分别为30.72%和39.07%,碱度(CaO/SiO2)1.3为碱性渣。除此之外,还含有0.68%的V2O5和6.40%的Cr2O3。可以看出,该渣中的铬元素含量较高。
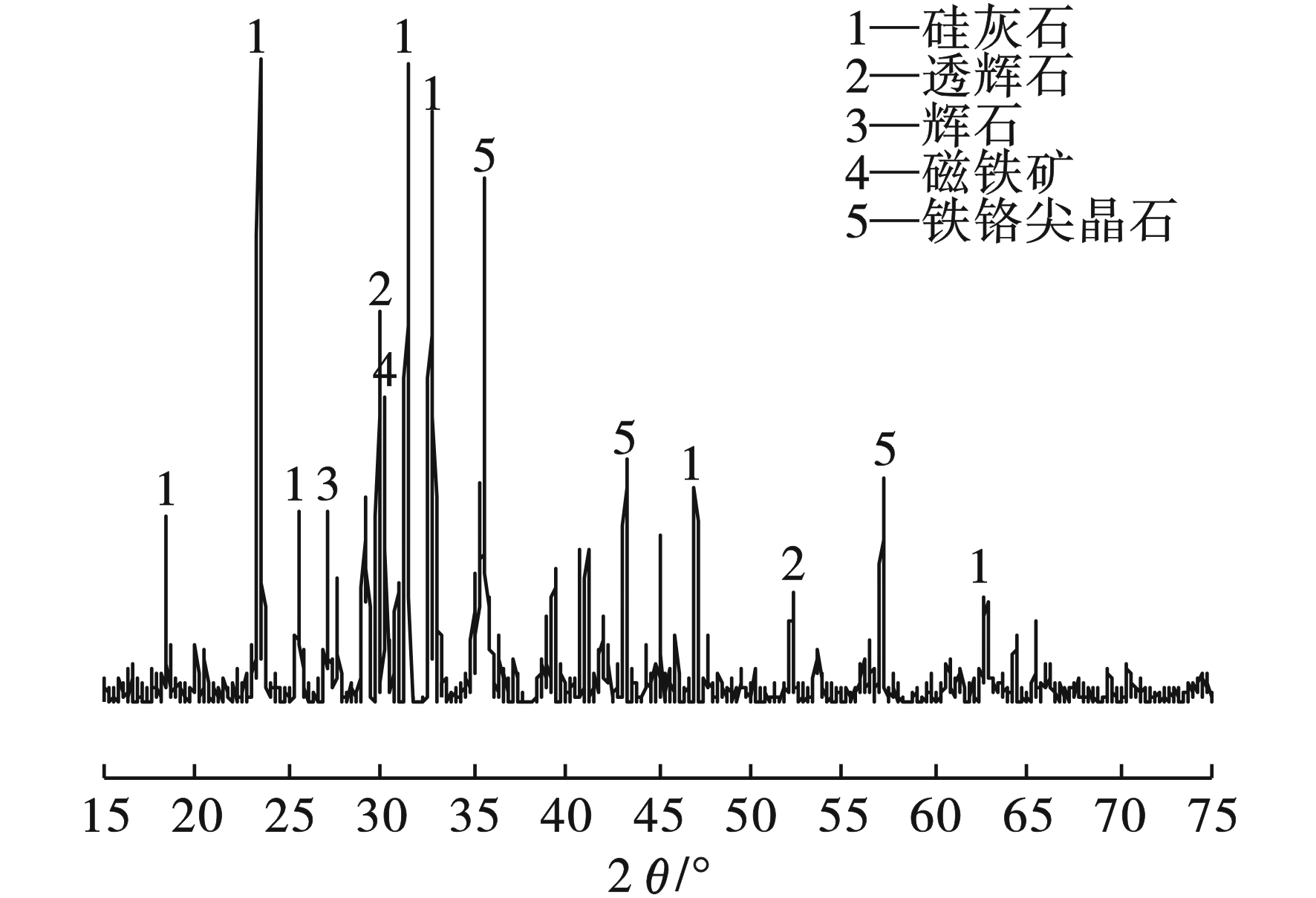
EAF渣原渣XRD结果见图1。
图1可见,该EAF渣主要由硅灰石((Ca,Fe)SiO3)、透辉石(CaMgSi2O6)、辉石((Ca,Mg,Fe)Si2O6)、磁铁矿(Fe3O4)和铁铬尖晶石(FeCr2O4)组成。通过绝热法对EAF渣组成矿相的含量进行定量分析,其结果见表2。
表2可知,该EAF渣主要含有硅灰石和透辉石,含量分别为47.5 wt.%和21.8 wt.%,另外还还有辉石和铁铬尖晶石以及少量的磁铁矿。由此可得,该EAF渣中的铬元素主要以铁铬尖晶石的形式存在。
-
采用HSC Chemistry 5.0热力学软件中的E-pH模块对不锈钢渣中的基质元素和铬元素的存在形态进行模拟。
-
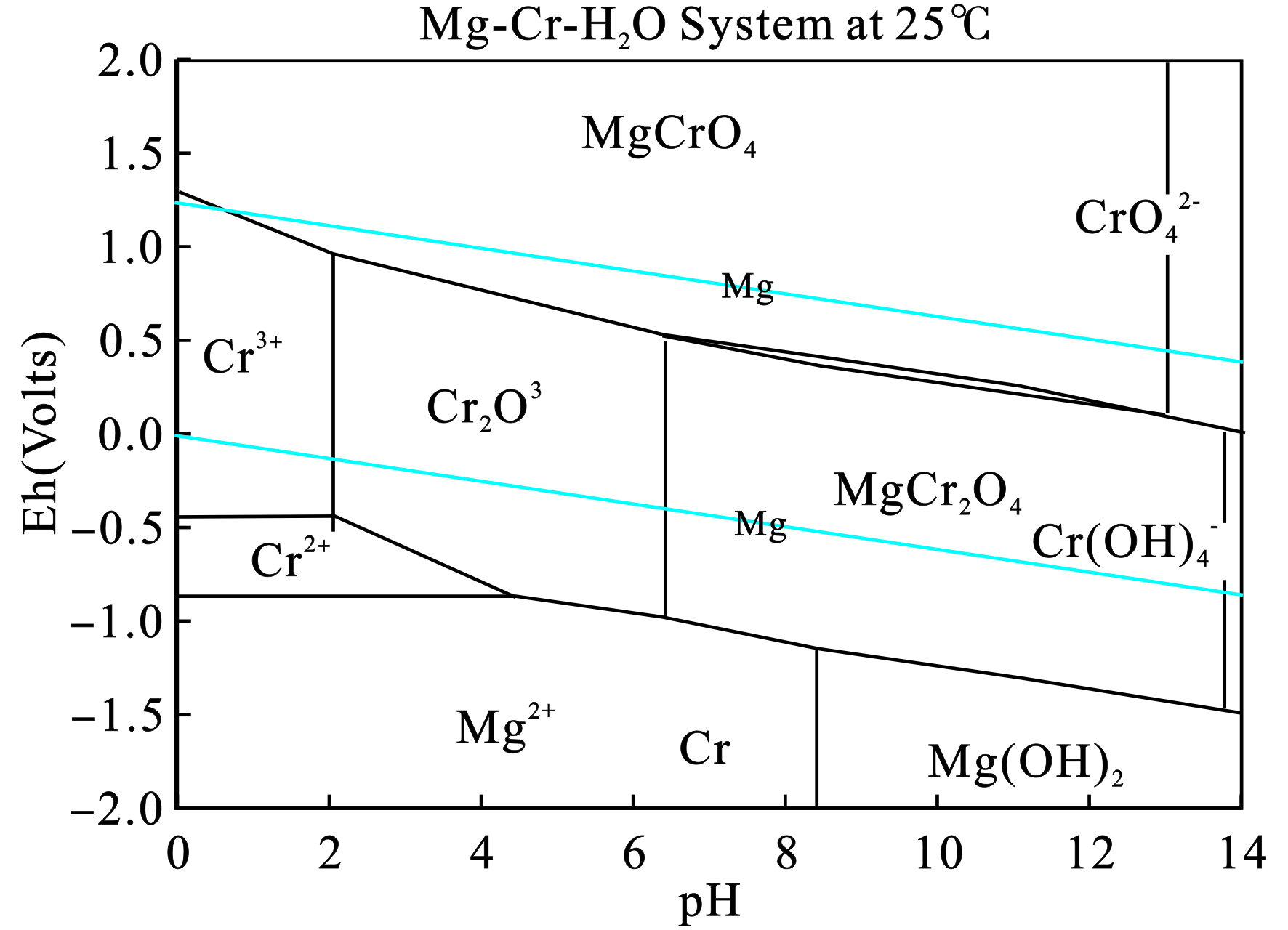
设置实验温度为25 ℃,按默认设置选取铬与镁在水中可能存在的形态,各个形态的标准吉布斯自由能见表3,根据此表的相关数据,可得Cr-Mg-H2O系的E-pH图,结果见图2。
图2可见,在pH值为0~14、Eh值为−2.0~2.0 V范围内,铬与镁在水溶液中的存在形态为Cr3+、Cr2+、CrO42−、Cr2O3、Cr(OH)4−、MgCr2O4、Mg2+、MgCrO4和Mg(OH)2。当Eh>0.5 V时,该体系主要以稳定的MgCrO4存在;当pH>6,Eh在−0.5~1.0 V之间时,则以稳定的MgCr2O4形式存在。
-
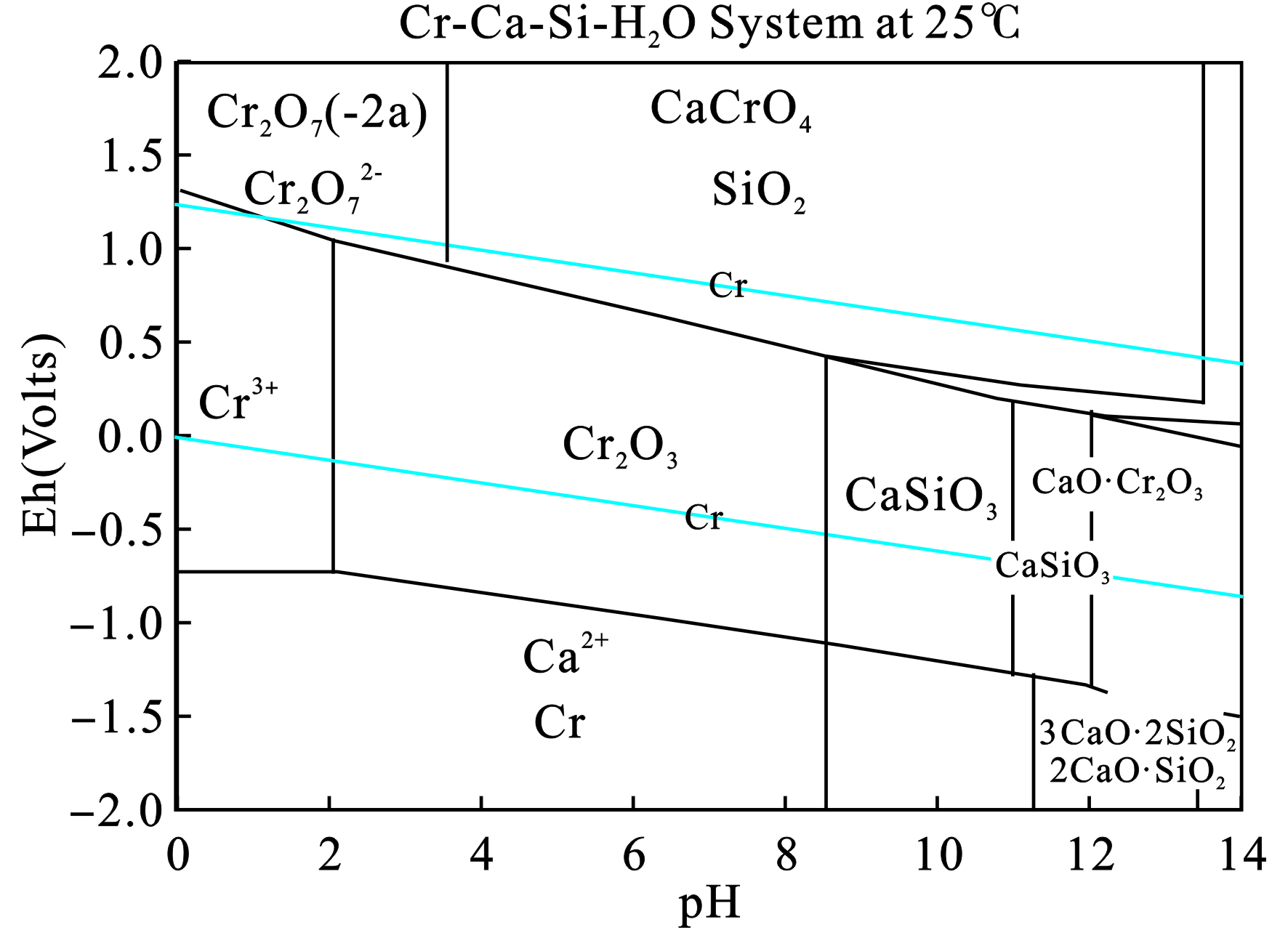
实验温度设置为25 ℃,按照默认设置选取铬、钙和硅在水中可能存在的形态,然后可以得到各个形态在室温下的标准吉布斯自由能,见表4。根据此表的数据,可以得到Cr-Ca-Si-H2O系的E-pH图,见图3。
图3可见,在pH值0~14、Eh值−2.0~2.0 V范围内,室温条件下铬、钙和硅在水溶液中的存在形态为Cr2O72−、CaCrO4、SiO2、Cr3+、Cr2+、Cr2O3、CaSiO3、CaO·Cr2O3、Ca2+、Cr、3CaO·2SiO2和2CaO·SiO2。当溶液的Eh>0.5 V时,铬主要以高价态的六价铬存在,在此体系中,则会以CaCrO4的形式存在。当溶液的pH>8,溶液中则主要含有CaSiO3、CaO·Cr2O3、3CaO·2SiO2和2CaO·SiO2。
-
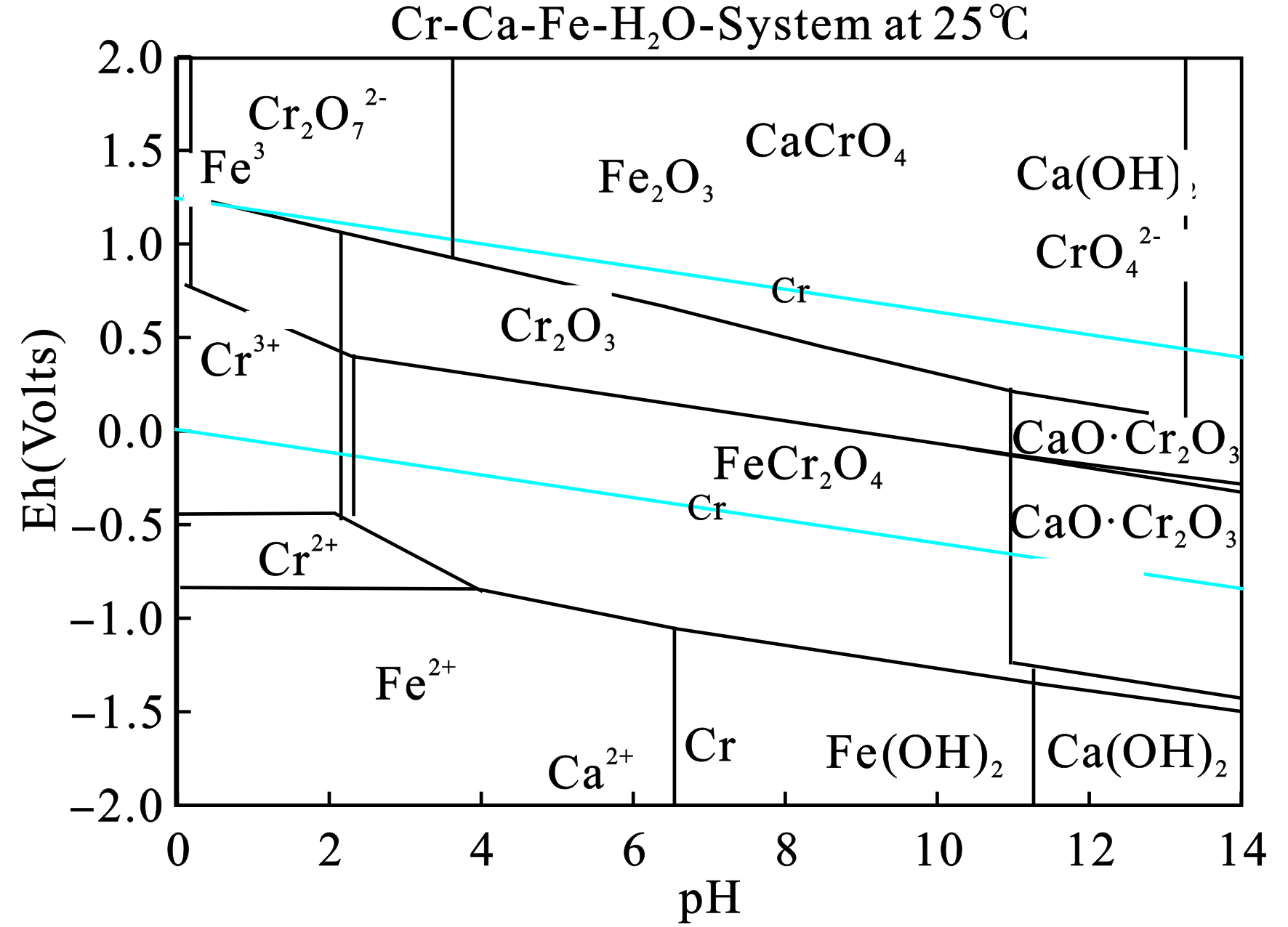
实验温度设置为25 ℃,按照默认设置选取铬、钙和铁在水中可能存在的形态,然后可以得到各个形态在室温下的标准吉布斯自由能,见表5。根据此表的数据,可以得到Cr-Ca-Fe-H2O系的E-pH图,见图4。
图4可见,在pH值0~14、Eh值−2.0~2.0范围内该体系中各元素的存在形态主要为Ca2+、CaCrO4、CaO、CaO·Cr2O3、Ca(OH)2、Cr2O3、Fe2O3、Fe(OH)2、Cr3+、Cr2+、CrO42−、Cr2O72−、Fe3+和Fe2+。另外,当溶液的pH大于2时,还出现了存在较为稳定的中间相CaCrO4和FeCr2O4。与2.1中XRD检测结果相同,该EAF渣中铬元素主要以铁铬尖晶石的形式存在。
-
由2.2节可知,不锈钢渣中的铬元素与基质元素可能形成的物质有以下几种:Cr2O3、FeCr2O4、FeCrO4、MgCr2O4、MgCrO4、CaCr2O4和CaCrO4。采用FactSage 7.0热力学软件中的Reaction模块,对上述可能存在的含铬相在碱性条件下发生的氧化反应进行热力学计算。
-
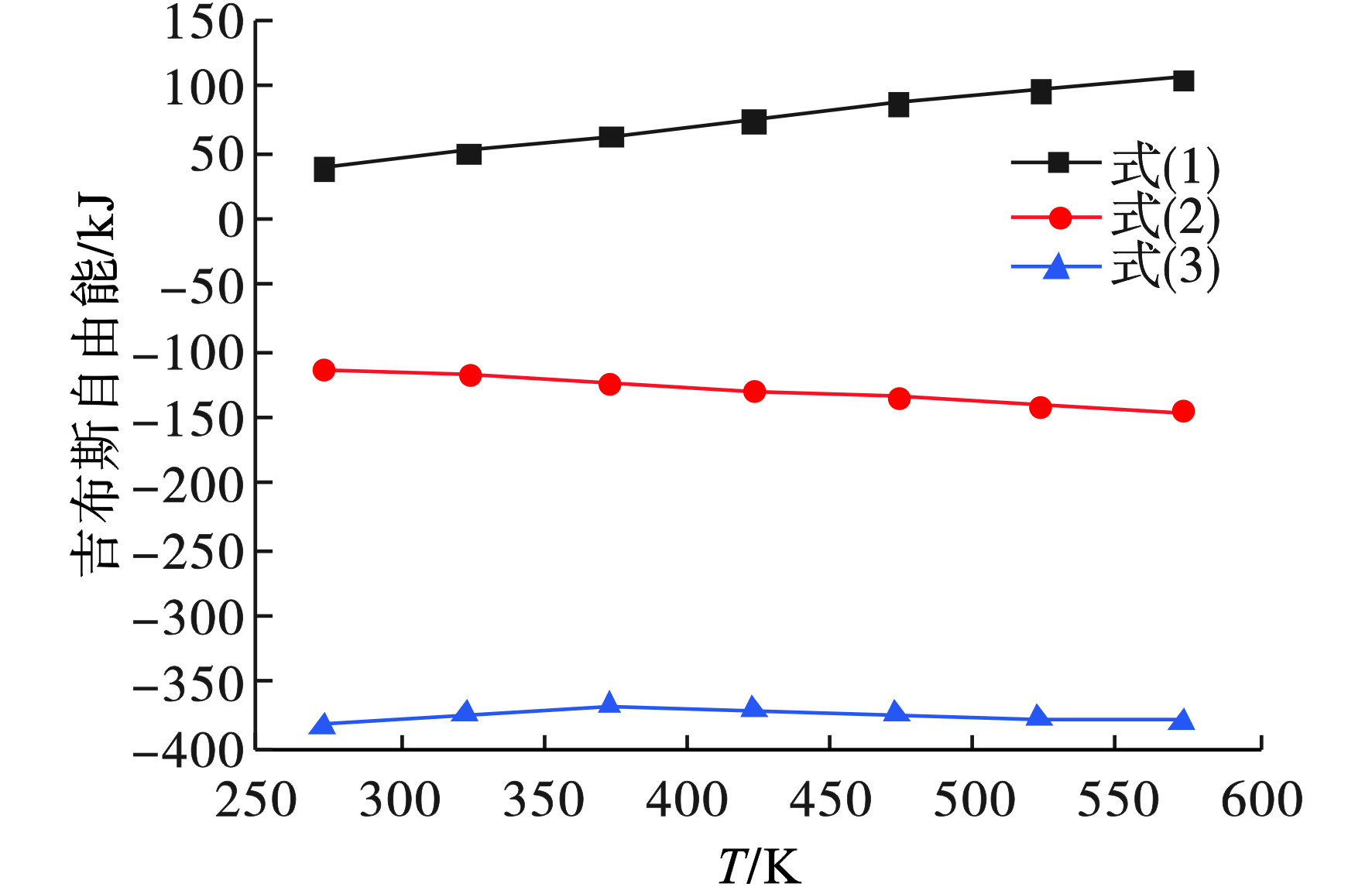
假设Cr2O3在不同碱性试剂下发生的氧化反应的氧化剂为O2,所用的碱性试剂为Na2CO3或NaOH,所发生的氧化反应见式(1)~(3)。
采用FactSage7.0热力学软件的Reaction反应模块对上述化学方程式在273~573 K进行计算,结果见图5。
图5可见,反应式(1)即当Cr2O3只与O2发生氧化反应时,可以看出,在273~573 K的范围内,该氧化反应的吉布斯自由能ΔG均大于0,即Cr2O3在纯氧中不会自发的发生氧化反应。当向该反应体系中加入碱性试剂Na2CO3或NaOH时,可以看出,在273~573 K的范围内,式(2)和(3)的吉布斯自由能ΔG均小于0,即在碱性条件下,所发生的氧化反应均可以自发的进行。并且由该图还可以看出,在相同的温度下,式(3)的吉布斯自由能ΔG明显要比式(2)的吉布斯自由能ΔG低很多,即表明Cr2O3在NaOH溶液中更容易自发的发生氧化反应[18],这与KIM et al[19]所得结果一致。并且如前所述,由于当使用Na2CO3进行焙烧时,需要消耗大量的热量,还会产生大量的未处理残渣(COPR)严重污染环境,因此研究者不再推荐使用Na2CO3,而是采取NaOH溶液进行提取实验。
-
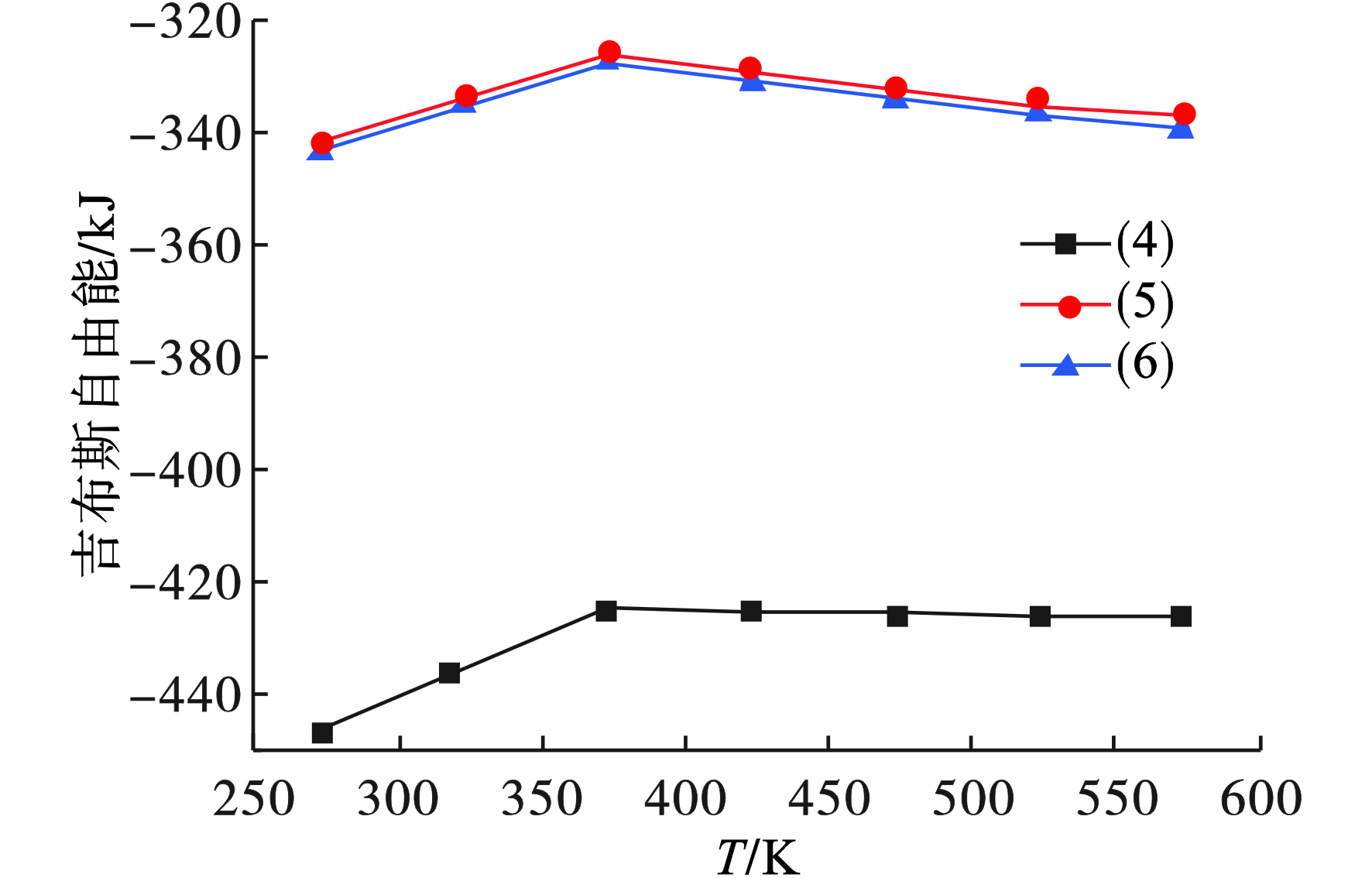
由上述2.3.1可知,碱性试剂选取为NaOH,所用氧化剂为O2,渣中其他含铬固溶体MgCr2O4、FeCr2O4和CaCr2O4在该体系中所发生的氧化反应见式(4)~(6)。
采用FactSage 7.0热力学软件中Reaction模块,对其在温度为273~573 K范围内所发生氧化反应的吉布斯自由能ΔG进行计算,将结果进行整理,见图6。
图6可见,渣中三种固溶体在NaOH溶液中发生氧化反应时,在273~573 K温度下,反应吉布斯自由能ΔG均小于0,表明该3种物质在该反应条件下均可以自发的发生氧化反应。并且由图6还可以看出,在该温度范围内,相同温度下,与MgCr2O4和CaCr2O4的吉布斯自由能ΔG相比,FeCr2O4的吉布斯自由能ΔG的负值更大,即更容易在该条件下发生氧化反应。
2.1. EAF渣化学成分和矿相组成分析
2.2. 不锈钢渣中基质元素及铬元素的存在形态研究
2.2.1. Cr-Mg-H2O系E-pH图分析
2.2.2. Cr-Ca-Si-H2O系E-pH图分析
2.2.3. Cr-Ca-Fe-H2O系E-pH图分析
2.3. EAF渣化学成分和矿相组成分析
2.3.1. Cr2O3氧化反应热力学
2.3.2. 含铬固溶体氧化反应热力学
-
采用HSC Chemistry 5.0热力学软件对不锈钢渣中铬元素与其他基质元素存在形态进行模拟,采用FactSage 7.0热力学软件的Reaction模块对不锈钢渣中含铬物质在碱性条件下发生的氧化反应进行热力学计算,所得结果如下。
1)所选取的EAF渣主要含有SiO2和CaO,另外还含有少量的MnO、MgO、TiO2、Al2O3、Fe2O3、V2O5和Cr2O3。矿相主要为硅灰石、透辉石和辉石,另外还含有少量磁铁矿和铁铬尖晶石。
2)当体系pH为0~14,Eh为−2.0~2.0 V时,不锈钢渣中铬元素与基质元素Ca、Si、Fe、Mg和O在水溶液中可形成的物质有:CaCrO4、CaO、CaO·Cr2O3、CaO·Fe2O3、2CaO·Fe2O3、Ca(OH)2、Cr、FeCr2O4、Cr2O3、FeO、Fe2O3、Fe3O4、Fe(OH)2、Fe(OH)3、Ca2+、Cr3+、Cr2+、CrO42−、Cr2O72−、Fe3+、Fe2+、2CaO·SiO2、3CaO·2SiO2、CaSiO3、Ca2SiO4、MgCr2O4、Mg、MgCrO4、MgO、Mg(OH)2和Mg2+。可以形成的含铬物质为Cr2O3、FeCr2O4、FeCrO4、MgCr2O4、MgCrO4、CaCr2O4和CaCrO4。
3)设置体系温度为273~573 K,Cr2O3与O2发生氧化反应时,反应吉布斯自由能ΔG均大于0,表明Cr2O3在纯氧中不会自发的发生氧化反应。当加入碱性试剂Na2CO3或NaOH时,所发生的氧化反应均能自发进行,但与NaOH反应的吉布斯自由能ΔG负值更大,与NaOH更容易发生氧化反应。因此可选取NaOH为后续实验的碱性试剂
4)当体系温度在273~573 K时,FeCr2O4、MgCr2O4和CaCr2O4均可以与NaOH发生氧化反应,但是,FeCr2O4发生氧化反应的吉布斯自由能ΔG负值更大,因此,与MgCr2O4和CaCr2O4相比,FeCr2O4更容易发生氧化反应。



 下载:
下载: