-
精神活性药品对人体中枢神经系统具有强烈抑制或兴奋作用,部分具有强烈成瘾性,主要包括抗焦虑药物、镇静安眠药物以及非法毒品等[1-2],包括苯二氮卓药物在内的精神活性药品使用量呈现逐年上升的趋势[3]. 与其他药物类似,许多精神活性药品并不能完全被人体吸收代谢,而是随排泄物进入城市污水处理系统,不能被城市污水处理厂消除完全的部分最终随污水厂出水排入受纳水环境[4-5]. 持续排放的精神活性药品对各级水生生物都具有不同程度的生态毒性效应. 研究表明,氯胺酮(948 μg·L−1)能够导致青鳉幼鱼(Oryzias latipes)行为改变,诱导其氧化应激反应,并扰乱乙酰胆碱酯酶的表达[6]. 低暴露浓度下,吗啡(0.07 ng·g−1)能够降低淡水贻贝(Elliptio complanata)组织中血清素水平和乙酰胆碱酯酶活性[7],而地西泮(100 μg·L−1)能够抑制大型蚤(Daphnia magna)的趋光行为并诱导其繁殖增强[8].
有学者采用固相萃取方法,结合液相色谱-质谱,广泛调查了环境水样中多种精神活性药品的污染水平. 结果显示,甲基苯丙胺、氯胺酮、可卡因、阿普唑仑、劳拉西泮、地西泮和咖啡因等精神活性药品作为新型污染物在污水处理厂进水、出水以及地表水中普遍检出[9-12]. 其中,甲基苯丙胺、地西泮和咖啡因在污水处理厂进水检出浓度可达2000、1180、120000 ng·L−1 [10, 13];氯胺酮在医院废水的检出浓度高达10000 ng·L-1[11]. 目前,有关精神活性药品在沉积物和污泥中的提取方法研究较少,采用超声萃取[14-15]或加速溶剂萃取[16-17]法结合固相萃取净化,提取分析甲基苯丙胺、氯胺酮、可卡因、地西泮等少数几种精神活性药品在沉积物和污泥中的含量. 事实上,沉积物和污泥作为物质的储存库是环境水体的重要组成部分[18]. 甲基苯丙胺、吗啡、可卡因等精神活性药品通过现行的污水处理工艺并不能完全降解,而是被污泥吸附并持续缓慢地向环境中释放,成为环境水体中精神活性药品的重要污染源[19-20]. 此外,由于制贩毒活动往往存在一定的隐蔽性,通过检测河流不同深度沉积物中甲基苯丙胺、吗啡等非法毒品的含量,可以溯源追踪较早排放的非法毒品,为锁定制贩毒窝点,举证制贩毒活动提供线索.
由于已报道的提取方法往往只关注少数几种精神活性药品,并且提取过程繁琐,耗时长,需要借助大型提取设备,具有一定的局限性. 因此,本研究开发了一种同时快速灵敏检测沉积物和污泥中多种精神活性药品的QuEChERS(quick, easy, cheap, effective, rugged, and safe)提取方法. 比较了开发的QuEChERS提取方法和已报道的超声萃取、加速溶剂萃取方法的效果,并通过考察加标回收率、相对标准偏差和方法定量限对方法的准确度、精密度和灵敏度进行了验证. 本研究开发的提取分析方法能够用于环境沉积物和污泥样品的检测,为环境水体中精神活性药品的来源、含量、分配和降解研究提供方法支持.
-
超高效液相色谱-三重四极杆串联质谱联用仪(UPLC-MS/MS,1290-6470,美国Agilent Technologies公司);万分之一天平(BSA224S,德国Sartorius公司);冻干机(DGJ-25C,中国博登生物科技有限公司);VORTEX涡旋混合仪(XK80-A,江苏新康医疗器械有限公司);离心机(L550,湖南湘仪实验室仪器开发有限公司);超声水浴萃取仪(PS-50T,深圳市洁康机电设备有限公司);加速溶剂萃取仪(E-916,瑞士Buchi公司);固相萃取装置(SBEQ-CG1824,上海安谱科学仪器有限公司);24孔平行氮吹仪(EFAA-DC24-RT,上海安谱科学仪器有限公司).
标准品甲基苯丙胺、氯胺酮、吗啡、可待因、可卡因、咪达唑仑、硝西泮、劳拉西泮、阿普唑仑、氯硝西泮、三唑仑、地西泮、氯氮卓、美沙酮和咖啡因均从中国食品药品检定研究院购买;浓度为100 mg·L−1 的同位素标记标准品甲基苯丙胺-D5、氯胺酮-D4、阿普唑仑-D5、硝西泮-D5、美沙酮-D9均从Cerilliant公司(美国)购买;吗啡-D3和可待因-D3从CNW公司(德国)购买. 所有标准品纯度均高于95%,15种目标精神活性药品的基本物理化学性质如表1所示.
色谱纯甲醇、乙腈、二氯甲烷、乙酸乙酯、丙酮从Merk公司(德国)购买;实验用超纯水为屈臣氏蒸馏水;色谱纯甲酸、乙酸和乙酸铵从CNW公司购买(德国);QuEChERS盐析试剂(含6 g无水硫酸镁和1.5 g无水乙酸钠)和分散固相萃取试剂(含900 mg无水硫酸镁、150 mg PSA和150 mg封端C18)从Agilent公司购买(美国).
-
标准储备溶液:分别准确称取10.0 mg标准品,加入色谱纯甲醇溶解,在100 mL容量瓶中用甲醇定容,获得100 mg·L−1 的标准储备溶液,置于-20 ℃冰箱中避光保存.
标准工作溶液:分别取100 μL浓度为100 mg·L−1的标准储备溶液至10 mL容量瓶,用甲醇定容,混合均匀,获得15种目标精神活性药品浓度均为1 mg·L−1 的混合标准工作溶液. 分别取100 μL浓度为100 mg·L−1的同位素标记标准品至10 mL容量瓶,用甲醇定容,混合均匀,获得浓度均为1 mg·L−1的混合同位素内标标准工作溶液,置于-20 ℃冰箱中避光保存.
标准系列工作溶液:分别移取浓度为1 mg·L−1 的混合标准工作溶液5、10、20、50、100、200 μL于进样小瓶中,均加入100 μL浓度为1mg·L−1的混合同位素内标标准工作溶液,用甲醇定容至1 mL,获得标准物质浓度分别为5、10、20、50、100、200 μg·L−1 ,同位素内标标准物质浓度均为100 μg·L−1 的标准系列工作溶液.
-
沉积物样品和污泥样品分别从广州市海珠湖和南沙污水处理厂获得,样品采集后,冻干,磨碎,过200目筛,置于4 ℃冷藏保存. 分别准确称取2 g冻干后的沉积物或0.5 g冻干后的污泥样品,加入100 ng混合同位素内标(100 μL,mg·L−1 ),加入5 mL超纯水,涡旋1 min混合均匀,加入10 mL乙腈(含1%乙酸),加入QuEChERS盐析试剂(6 g无水硫酸镁/1.5 g无水乙酸钠),然后立即用手剧烈振荡1 min进行提取,将提取液置于3040 g离心10 min,随后取7 mL上清液于15 mL聚丙烯离心管,加入分散固相萃取试剂(900 mg无水硫酸镁/150 mg PSA/150 mg封端C18),手摇振荡30 s,在3040 g条件下离心10 min,取5 mL上清液用氮气轻轻吹至近干,然后采用500 μL甲醇重新溶解,提取液过0.22 μm有机相滤膜,置于−20 ℃冰箱中避光保存. 样品分析前,将甲醇置换成V/V = 3:7的乙腈/水(含5 mmol·L−1乙酸铵和0.2%甲酸)溶液.
-
色谱柱:Agilent ZORBAX Eclipse Plus C18柱(50 mm × 2.1 mm,1.8 μm),色谱柱前端接孔径为0.22 μm的在线过滤器,用于滤过样品和流动相溶液中的微小颗粒物;柱温为40 ℃;进样体积为5 μL;流动相为缓冲水溶液A(含5 mmol·L−1乙酸铵和0.2%甲酸)和B乙腈,流动相流速为0.3 mL·min−1,总运行时间6 min,流动相采用如下程序梯度洗脱目标精神活性药品:0 min,30% B;1.5 min,30% B;3 min,55% B;4 min,70% B;4.5 min,70% B;5 min,90% B;6 min,90% B,每针样品分析结束后,设置4 min后运行时间平衡液相色谱柱.
-
色谱柱分离后,样品在电喷雾离子源(ESI)正离子模式下,进入质谱检测器,离子源干燥气流速5 L·min−1;干燥气温度300 ℃;雾化器压力35 psi;鞘气温度300 ℃;鞘气流速12 L·min−1;喷嘴电压500 V;毛细管电压3500 V. 样品经ESI雾化进入质谱后,通过多重反应模式(MRM)进行分析,15种目标精神活性药品的母离子、子离子、碎裂电压、碰撞能等质谱分析参数如表2所示.
-
提取前,分别称取冻干后的2 g沉积物和0.5 g污泥样品,向沉积物和污泥样品中分别加入10、40、100 μL目标精神活性药品浓度均为1 mg·L−1 的混合标准工作溶液,使15种目标精神活性药品在沉积物中的加标浓度分别为5 、20 、50 ng·g−1 ;在污泥中的加标浓度分别为20、80、200 ng·g−1 ;同时,每个样品中均加入100 μL浓度为1 mg·L−1 的混合同位素内标标准工作溶液,每个加标样品做3个平行样. 加标样品的绝对回收率Rabs和相对回收率Rrel根据公式(1)和(2)进行计算[21]:
其中,Ass和Ab分别为目标精神活性药品在加标样品(沉积物或污泥)和未加标的空白样品(沉积物或污泥)中的峰响应值,As为目标精神活性药品在对应浓度的标准工作溶液中的峰响应值;Css和Cb分别为目标精神活性药品在加标样品(沉积物或污泥)和未加标的空白样品(沉积物或污泥)中测得的浓度,Cs为目标精神活性药品在对应浓度的标准工作溶液中测得的浓度.
-
分别称取冻干后的2 g沉积物和0.5 g污泥样品进行提取,向提取液基质中分别加入1 mg·L−1 的混合标准工作溶液5、10、20、50、100、200 μL,同时均加入1 mg·L−1的混合同位素内标标准工作溶液100 μL,获得样品基质匹配曲线溶液. 基质效应ME根据公式(3)进行计算:
其中,Smatrix和Ssolvent分别为目标精神活性药品在样品基质(沉积物或污泥)匹配曲线溶液和溶剂标准工作溶液中的斜率;ME > 0表示基质增强效应,ME = 0表示不存在基质效应,ME < 0表示基质抑制效应,ME的绝对值越低,表示基质效应越弱.
-
本研究考察了提取溶剂乙腈中乙酸含量、盐析试剂组成及分散固相萃取试剂组成对沉积物中15种目标精神活性药品的提取效率(图1). 不同乙酸含量条件下15种目标精神活性药品的回收率结果如图1a所示,在乙腈中分别加入0%乙酸溶液、1%乙酸溶液和5%乙酸溶液时,除了可待因和地西泮,大部分目标精神活性药品的回收率逐渐下降;整体上,乙酸溶液的体积分数为0%和1%时,大部分目标精神活性药品的回收率比较接近,当乙酸溶液的体积分数为5%时,15种精神活性药品的回收率较低;考虑到环境基质来源较复杂,加入适量乙酸可以提高酸碱性精神活性药品的稳定性,为了提高提取方法对不同来源沉积物的适用性,选择提取溶剂为1%甲酸-乙腈溶液.
两种不同缓冲盐体系下15种目标精神活性药品的回收率结果如图1b所示,甲基苯丙胺、氯胺酮、阿普唑仑、氯硝西泮和三唑仑在乙酸钠缓冲盐体系下的回收率较高;可待因和劳拉西泮在柠檬酸钠缓冲盐体系下的回收率较高,其余目标精神活性药品在柠檬酸钠缓冲盐和乙酸钠缓冲盐体系下的回收率比较接近,考虑到柠檬酸钠缓冲盐价格较高,试验选择的盐析试剂为乙酸钠盐.
不同净化试剂条件下,15种目标精神活性药品的回收率结果如图1c所示,采用硫酸镁/PSA作为净化试剂时,吗啡、可待因和劳拉西泮的回收率较低;采用硫酸镁/C18作为净化试剂时,阿普唑仑和三唑仑的回收率较低;相比采用单一的硫酸镁净化试剂,采用硫酸镁/PSA/C18作为净化试剂时,阿普唑仑、三唑仑和地西泮的回收率明显提高;无水硫酸镁/PSA/C18混合分散固相萃取(d-SPE)试剂进行净化,15种精神活性药品的回收率整体比较好. 通过QuEChERS提取方法优化结果得出,试验样品采用含1%乙酸的乙腈溶液提取,加入无水硫酸镁和乙酸钠促进提取和溶液分层,提取液通过无水硫酸镁/PSA/C18混合分散固相萃取(d-SPE)试剂进行净化前处理样品.
考虑到15 种精神活性物质均采用正离子模式进行测定,在流动相中加入一定量的甲酸可以使流动相pH处于一个稳定的状态,减少因为离子形态与分子形态共存而造成的峰变形和分裂,增加目标物的离子化效率,从而增加灵敏度. 沉积物和污泥样品基质复杂,QuEChERS 法常用的吸附剂有 C18、 PSA 等. 其中无水硫酸镁作为除水剂来除去样品基质中的水分, C18 主要是去除脂肪和酯类等非极性干扰物,PSA 可去PSA是吸附基质中的碳水化合物、脂肪酸、有机酸、酚类和少量的色素,硫酸镁、PSA、C18; 采用硫酸镁/PSA/C18进行净化均获得比较理想的净化效果,且对回收率的影响较小.
-
不同加标浓度条件下,QuEChERS提取方法对沉积物和污泥中15种目标精神活性药品均表现出良好的提取效果,其相对回收率Rrel结果如表3所示. 加标浓度为5、20、50 ng·g−1时,15种目标精神活性药品在沉积物中的加标回收率范围分别为56%—121%、57%—116%和58%—115%,RSD < 15%;加标浓度为20、80、200 ng·g−1 时,15种目标精神活性药品在污泥中的加标回收率范围分别为55%—117%、64%—132%和74%—135%,RSD < 12%,说明该方法具有良好的准确度和精密度. 15种目标精神活性药品在加标量均为100 ng(100 μL、1 mg·L−1 )的溶剂标准工作溶液、沉积物加标样品和污泥加标样品中的多重反应监测离子如图2所示,QuEChERS提取液中15种精神活性药品的目标离子峰清晰可辨,能高效地进行定性定量分析.
-
目标精神活性药品的方法检出限(MDLs)和方法定量限(MQLs)通过最低浓度的环境加标样品进行计算,MDLs和MQLs分别为3倍信噪比(S/N)和10倍S/N,表示方法能够从环境基质中检测到的目标精神活性药品最低量. S/N值通过仪器自带的Masshunter软件计算获得. 如表3所示,15种目标精神活性药品在沉积物中的MDLs和MQLs范围分别为0.01—0.24 ng·g−1和0.04—0.8 ng·g−1 ;在污泥中的MDLs和MQLs范围分别为0.06 —0.83 ng·g−1 和0.22—2.78 ng·g−1 . 采用本文的QuEChERS方法进行提取,甲基苯丙胺、氯胺酮和可卡因在沉积物和污泥中的MQLs低于已报道的超声萃取/固相萃取和加速溶剂萃取/固相萃取方法[14-16]. 相比沉积物,污泥中目标精神活性药品的MDLs和MDLs较高. 15种目标精神活性药品在沉积物和污泥中的方法检出限均低于1 ng·g−1 ,方法定量限均低于3 ng·g−1 ,说明QuEChERS方法能够用于环境沉积物和污泥中精神活性药品的高灵敏分析.
-
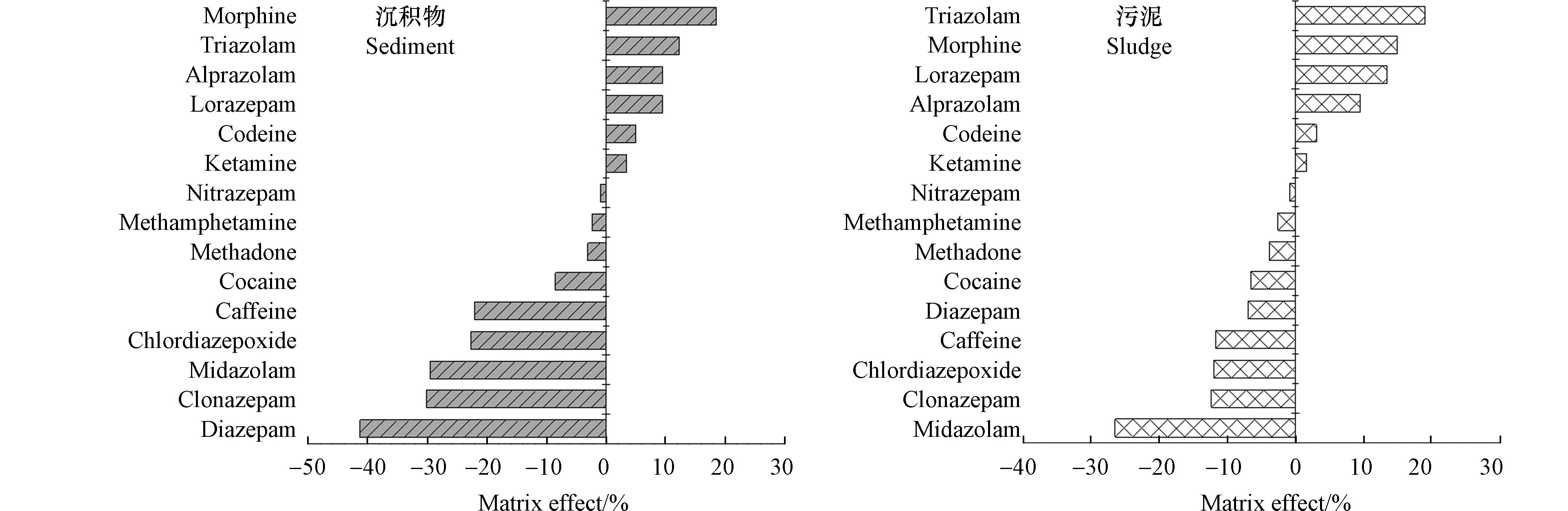
样品提取液中往往存在能够伴随目标物质一起洗脱的基质共存物,造成样品UPLC-MS/MS信号的增强或抑制,导致基质效应[22]. 如图2所示,所有目标精神活性药品在沉积物和污泥中都存在一定程度的基质效应. 其基质效应范围分别为–41.24%—18.54%和–26.45%—19.05%. 除咪达唑仑、氯硝西泮和地西泮,大部分目标精神活性药品的基质效应在±20%范围之内. 15种目标精神活性药品在沉积物和污泥中表现出相同趋势的基质效应:吗啡、可待因、劳拉西泮、阿普唑仑、三唑仑和氯胺酮在沉积物和污泥中主要受到基质增强效应的影响;甲基苯丙胺、可卡因、咪达唑仑、硝西泮、氯硝西泮、地西泮、氯氮卓、美沙酮和咖啡因在沉积物和污泥中主要受到基质抑制效应的影响. 相比污泥,大部分目标精神活性药品在沉积物中受到的基质效应更强.
-
将开发的QuEChERS方法应用于环境样品分析,在采集于广州海珠湖底的沉积物中检出8种目标精神活性药品:甲基苯丙胺、氯胺酮、咪达唑仑、氯硝西泮、三唑仑、地西泮、美沙酮和咖啡因,其浓度范围为0.051—1.395 ng.g−1 干重;在采集于南沙污水处理厂的脱水污泥中检出4种目标精神活性药品:甲基苯丙胺、咪达唑仑、硝西泮和咖啡因,其浓度范围为<MQLs—45.119 ng.g−1 干重.
-
(1)本方法快速、准确,对沉积物和污泥中15种目标精神活性药品的加标回收率为55%—135%,相对标准偏差小于15%,可同时检测环境样品中多种精神活性药品.
(2)本方法对沉积物和污泥中15种目标精神活性药品的方法检出限均低于1 ng·g−1,可用于环境样品中痕量精神活性药品的高灵敏检测.
(3)采用本方法在环境沉积物和污泥样品中分别检出8种和4种目标精神活性药品,为精神活性药品的管制、溯源追踪和环境生态风险评价提供方法支持.
QuEChERS-液相色谱串联质谱检测沉积物和污泥中精神活性药品残留
Simultaneous determination of psychoactive drugs in sediment and sludge using QuEChERS extraction coupled with ultrahigh performance liquid chromatography-tandem mass spectrometry
-
摘要: 本研究建立了沉积物和污泥中15种典型精神活性药品的QuEChERS(quick,easy,cheap,effective,rugged and safe)提取和超高效液相色谱-三重四极杆质谱(UPLC-MS/MS)痕量分析方法. 冻干后的沉积物或污泥样品采用含1%乙酸的乙腈溶液提取,加入无水硫酸镁和乙酸钠促进提取和溶液分层,提取液通过无水硫酸镁/PSA/C18混合分散固相萃取(d-SPE)试剂进行净化,氮吹浓缩后供UPLC-MS/MS检测. 通过建立的痕量分析方法,15种目标精神活性药品在沉积物中的检出限(MDLs)和定量限(MQLs)分别为0.01—0.24 ng·g−1和0.04—0.80 ng·g−1,当加标浓度为5、20、50 ng·g−1时,回收率为56%—121%、57%—116%和58%—115%,相对标准偏差小于15%;在污泥中的检出限(MDLs)和定量限(MQLs)分别为0.06—0.83 ng·g−1和0.22—2.78 ng·g−1,当加标浓度为20、80、200 ng·g−1时,回收率为55%—117%、64%—132%和74%—135%,相对标准偏差小于12%. 采用该方法,在环境沉积物和污泥中分别检出8种和4种精神活性药品,浓度范围分别为0.051—1.395 ng·g−1干重和<MQLs—45.119 ng·g−1干重. 该方法快速、准确、灵敏度高,不需要借助专门的提取设备,适合同时快速检测沉积物和污泥中多种精神活性药品,为环境水体中痕量精神活性药品的追踪溯源和风险评估提供方法支持.
-
关键词:
- QuEChERS /
- 超高效液相色谱-三重四极杆质谱 /
- 精神活性药品 /
- 沉积物 /
- 污泥.
Abstract: The present study developed analytical method based on QuEChERS (quick, easy, cheap, effective, rugged and safe) extraction and ultrahigh performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) determination, to simultaneously analyze 15 typical psychoactive drugs in sediment and sludge. The frozen dried sediment or sludge sample was extracted with acetonitrile (containing 1% acetic acid), meanwhile, the anhydrous magnesium sulfate and sodium acetate were added to accelerate extraction and solvent layering. Then, the extraction solution was cleaned-up by dispersive solid-phase extraction (SPE) using anhydrous magnesium sulfate/PSA/C18 sorbents. Finally, the extract was concentrated with nitrogen and detected by UPLC-MS/MS. Using the proposed analytical method, the method detection limits (MDLs) and method quantification limits (MQLs) of 15 target psychoactive drugs in sediment were ranged at 0.01—0.24 ng·g-1 and 0.04—0.80 ng·g-1, respectively. The recoveries of 15 target psychoactive drugs at the range of 56%—121%, 57%—116% and 58%—115% with the relative standard deviation (RSD) lower than 15%, in the sediment samples with spiked levels of 5 ng·g−1, 20 ng·g−1 and 50 ng·g−1, respectively. The method detection limits (MDLs) and method quantification limits (MQLs) of 15 target psychoactive drugs in sludge were ranged at 0.06—0.83 ng·g−1 and 0.22—2.78 ng·g−1, respectively. The recoveries of 15 target psychoactive drugs at the range of 55%—117%, 64%—132% and 74%—135% with the RSD lower than 12%, in the sludge samples with spiked levels of 20 ng·g−1, 80 ng·g−1 and 200 ng·g−1, respectively. There were 8 and 4 target psychoactive drugs detected in the environmental sediment and sludge samples, respectively, with the concentrations at the range of 0.051—1.395 ng·g−1 and <MQLs—45.119 ng·g−1 dry weight. The developed analytical method is rapid, accurate and sensitive, and with no need for special extraction equipment, which can be applied to simultaneously and rapidly detect various psychoactive drugs in sediment and sludge. The proposed analytical method supply method support for the tracking and risk assessment of trace psychoactive drugs in sediment and sludge of aquatic environment. -

-
表 1 目标精神活性药品基本物理化学性质
Table 1. Basic information and physicochemical properties of target psychoactive drugs
化合物
CompoundCAS 分子式
Molecular formulalg Kow lg Koc pKa 甲基苯丙胺 537-46-2 C10H15N 2.07 3.21 9.87 氯胺酮 6740−88-1 C13H16ClNO 2.18 3.22 7.5 吗啡 57-27-2 C17H19NO3 0.89 3.47 9.12 可待因 76-57-3 C18H21NO3 1.19 3.12 9.19 可卡因 50-36-2 C17H21NO4 2.30 3.28 8.85 咪达唑仑 1622−61-3 C18H13ClFN3 4.33 5.59 5.5 硝西泮 146-22-5 C15H11N3O3 2.25 3.79 2.61;11.9 劳拉西泮 846-49-1 C15H10Cl2N2O2 3.98 3.30 13.0 阿普唑仑 28981−97-7 C17H13ClN4 3.87 6.33 5.08;18.3 氯硝西泮 1622−61-3 C15H10ClN3O3 2.53 4.02 1.86;11.89 三唑仑 28911−01-5 C17H12Cl2N4 2.42 6.55 4.32;10.08 地西泮 439-14-5 C16H13ClN2O 2.82 4.05 3.4 氯氮卓 58-25-3 C16H14ClN3O −1.57 5.79 4.8 美沙酮 76-99-3 C21H27NO 3.93 4.86 8.94 咖啡因 58-08-2 C8H10N4O2 −0.07 1.00 −0.92 注:Kow:正辛醇-水分配系数;Koc:有机碳吸附系数;pKa:酸离解常数.
Note: Kow: N-octanol-water partition coefficient; Koc: organic carbon adsorption coefficient; pKa: logarithm value of acid dissociation constant.表 2 目标精神活性药品质谱参数和保留时间
Table 2. UPLC-MS/MS mass transitions and retention times of the target psychoactive drugs
化合物
Compound母离子
Parent ion(m/z)子离子
Daughter ion (m/z)碰撞能/eV
CE碎裂电压/V
Fragmentor保留时间/min
RT内标
Interior label甲基苯丙胺
Methamphetamine150.1 91.1* 29 95 2.005 甲基苯丙胺-d5
Methamphetamine-d5119.1 10 氯胺酮
Ketamine238.1 125.0* 39 110 2.226 氯胺酮-d4
Ketamine207.1 15 吗啡
Morphine286.1 152.1* 76 175 1.028 吗啡-d3
Morphine-d3165.1 50 可待因
Codeine300.2 165.1 58 170 1.760 可待因-d3
Codeine-d3215.1* 30 可卡因
Cocaine304.2 82.1 35 140 2.606 可待因-d3
Codeine-d3182.1* 23 咪达唑仑
Midazolam326.1 291.2* 33 195 3.057 阿普唑仑-d5
Alprazolam-d5249.2 46 硝西泮
Nitrazepam282.0 236.1* 28 155 3.567 硝西泮-d5
Nitrazepam180.1 48 劳拉西泮
Lorazepam321.0 275.1* 28 145 3.618 阿普唑仑-d5
Alprazolam-d5229.1 38 阿普唑仑
Alprazolam309.1 205.1 48 200 3.635 阿普唑仑-d5
Alprazolam-d5281.2* 29 氯硝西泮
Clonazepam316.0 241.1 43 155 3.672 吗啡-d3
Morphine-d3270.1* 30 三唑仑
Triazolam343.1 308.1* 30 205 3.688 阿普唑仑-d5
Alprazolam-d5315.1 35 地西泮
Diazepam285.1 154.1 32 175 4.252 吗啡-d3
Morphine-d3193.1* 38 氯氮卓
Chlordiazepoxide300.1 282.1* 29 165 2.811 氯胺酮-d4
Ketamine227.1 29 美沙酮
Methadone310.2 105.0 35 125 3.549 美沙酮-d9
Methadone-d9265.3* 15 咖啡因
Caffeine195.0 138.1 23 120 1.924 氯胺酮-d4
Ketamine110.1 28 甲基苯丙胺-d5
Methamphetamine-d5155.1 121.1 10 95 2.000 — 92.1* 23 氯胺酮-d4
Ketamine-d4242.1 129.0* 35 110 2.220 — 211.1 14 吗啡-d3
Morphine-d3289.2 152.0* 77 175 1.022 — 165.1 49 可待因-d3
Codeine-d3303.2 215.1* 28 170 1.754 — 165.1 55 硝西泮-d5
Diazepam-d5287.1 241.2* 29 175 3.545 — 185.1 41 阿普唑仑-d5
Alprazolam-d5314.1 210.1 46 170 3.624 — 286.2* 29 美沙酮-d9
Methadone-d9319.3 268.2* 15 135 3.543 — 105.0 30 注:标*的离子为定量离子.
Note: The * refers to the quatification ion.表 3 目标精神活性药品在沉积物中的回收率、方法检出限、方法定量限
Table 3. Recoveries (n=3, %±relative standard deviation), method detection limits (MDLs) and method quantitation limits (MQLs) of the target psychoactive drugs from sediment
沉积物
Sediment污泥
Sludge化合物
Compound加标回收率/%
RecoveryMDLs/
(ng·g−1)MQLs/
(ng.g−1)加标回收率/%
RecoveryMDLs/
(ng·g−1)MQLs/
(ng·g−1)5 ng·g−1 20 ng·g−1 50 ng·g−1 20 ng·g−1 80 ng·g−1 200 ng·g−1 甲基苯丙胺 107±3 95±2 97±2 0.02 0.07 101±1 120±1 115±1 0.06 0.22 氯胺酮 116±2 101±4 103±2 0.03 0.08 107±1 124±1 121±3 0.14 0.48 吗啡 121±5 116±3 115±1 0.24 0.80 113±9 132±2 135±4 0.83 2.78 可待因 118±5 105±1 107±1 0.06 0.21 105±2 129±1 128±3 0.28 0.94 可卡因 68±14 57±7 60±9 0.01 0.04 55±9 64±6 60±6 0.45 1.51 咪达唑仑 77±9 65±3 68±3 0.02 0.08 65±6 79±10 89±5 0.10 0.35 硝西泮 97±6 88±2 96±1 0.12 0.40 96±2 108±2 114±2 0.51 1.70 劳拉西泮 83±9 83±6 85±3 0.11 0.36 109±3 131±2 129±4 0.64 2.12 阿普唑仑 109±1 104±6 110±1 0.07 0.22 117±1 127±1 129±2 0.16 0.52 氯硝西泮 75±14 83±3 99±7 0.12 0.39 105±12 113±7 120±4 0.32 1.07 三唑仑 97±2 90±3 90±1 0.01 0.04 115±5 131±2 130±4 0.07 0.25 地西泮 66±15 61±9 71±7 0.07 0.24 99±6 113±7 132±6 0.21 0.71 氯氮卓 56±10 61±5 58±6 0.06 0.20 58±9 70±1 74±1 0.15 0.50 美沙酮 109±1 95±4 96±2 0.03 0.09 102±2 118±2 111±1 0.23 0.76 咖啡因 87±4 66±3 60±3 0.14 0.46 92±5 86±3 76±1 0.13 0.44 注:粗体表示化合物回收率超过70%—130%范围. Note: Bold type refers the recovery value out of the range of 70%—130%. -
[1] 邓洋慧, 郭昌胜, 殷行行, 等. 太湖入湖河流中精神活性物质污染特征与生态风险 [J]. 生态毒理学报, 2020, 15(1): 119-130. doi: 10.7524/AJE.1673-5897.20191027001 DENG Y H, GUO C S, YIN X X, et al. Pollution characteristics and ecological risks of psychoactive substances in rivers entering Taihu Lake [J]. Asian Journal of Ecotoxicology, 2020, 15(1): 119-130(in Chinese). doi: 10.7524/AJE.1673-5897.20191027001
[2] FERNÁNDEZ-RUBIO J, RODRÍGUEZ-GIL J L, POSTIGO C, et al. Psychoactive pharmaceuticals and illicit drugs in coastal waters of North-Western Spain: Environmental exposure and risk assessment [J]. Chemosphere, 2019, 224: 379-389. doi: 10.1016/j.chemosphere.2019.02.041 [3] GONZÁLEZ-MARIÑO I, CASTRO V, MONTES R, et al. Multi-residue determination of psychoactive pharmaceuticals, illicit drugs and related metabolites in wastewater by ultra-high performance liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2018, 1569: 91-100. doi: 10.1016/j.chroma.2018.07.045 [4] KOSJEK T, PERKO S, ZUPANC M, et al. Environmental occurrence, fate and transformation of benzodiazepines in water treatment [J]. Water Research, 2012, 46(2): 355-368. doi: 10.1016/j.watres.2011.10.056 [5] CAUSANILLES A, RUEPERT C, IBÁÑEZ M, et al. Occurrence and fate of illicit drugs and pharmaceuticals in wastewater from two wastewater treatment plants in Costa Rica [J]. Science of the Total Environment, 2017, 599/600: 98-107. doi: 10.1016/j.scitotenv.2017.04.202 [6] LIAO P H, YANG W K, YANG C H, et al. Illicit drug ketamine induces adverse effects from behavioral alterations and oxidative stress to p53-regulated apoptosis in medaka fish under environmentally relevant exposures [J]. Environmental Pollution, 2018, 237: 1062-1071. doi: 10.1016/j.envpol.2017.11.026 [7] GAGNÉ F, ANDRÉ C, GÉLINAS M. Neurochemical effects of benzodiazepine and morphine on freshwater mussels [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2010, 152(2): 207-214. [8] RIVETTI C, CAMPOS B, BARATA C. Low environmental levels of neuro-active pharmaceuticals alter phototactic behaviour and reproduction in Daphnia magna [J]. Aquatic Toxicology, 2016, 170: 289-296. doi: 10.1016/j.aquatox.2015.07.019 [9] METCALFE C, TINDALE K, LI H X, et al. Illicit drugs in Canadian municipal wastewater and estimates of community drug use [J]. Environmental Pollution, 2010, 158(10): 3179-3185. doi: 10.1016/j.envpol.2010.07.002 [10] CHIAIA A C, BANTA-GREEN C, FIELD J. Eliminating solid phase extraction with large-volume injection LC/MS/MS: Analysis of illicit and legal drugs and human urine indicators in US wastewaters [J]. Environmental Science & Technology, 2008, 42(23): 8841-8848. [11] LIN A Y C, LEE W N, WANG X H. Ketamine and the metabolite norketamine: Persistence and phototransformation toxicity in hospital wastewater and surface water [J]. Water Research, 2014, 53: 351-360. doi: 10.1016/j.watres.2014.01.022 [12] WU M H, XIANG J J, QUE C J, et al. Occurrence and fate of psychiatric pharmaceuticals in the urban water system of Shanghai, China [J]. Chemosphere, 2015, 138: 486-493. doi: 10.1016/j.chemosphere.2015.07.002 [13] van der VEN K, KEIL D, MOENS L N, et al. Neuropharmaceuticals in the environment: Mianserin-induced neuroendocrine disruption in zebrafish (Danio rerio) using cDNA microarrays [J]. Environmental Toxicology and Chemistry, 2006, 25(10): 2645-2652. doi: 10.1897/05-495R.1 [14] HU P, GUO C S, ZHANG Y, et al. Occurrence, distribution and risk assessment of abused drugs and their metabolites in a typical urban river in North China [J]. Frontiers of Environmental Science & Engineering, 2019, 13(4): 94-104. [15] ÁLVAREZ-RUIZ R, ANDRÉS-COSTA M J, ANDREU V, et al. Simultaneous determination of traditional and emerging illicit drugs in sediments, sludges and particulate matter [J]. Journal of Chromatography A, 2015, 1405: 103-115. doi: 10.1016/j.chroma.2015.05.062 [16] LANGFORD K H, REID M, THOMAS K V. Multi-residue screening of prioritised human pharmaceuticals, illicit drugs and bactericides in sediments and sludge [J]. Journal of Environmental Monitoring, 2011, 13(8): 2284-2291. doi: 10.1039/c1em10260e [17] STEIN K, RAMIL M, FINK G, et al. Analysis and sorption of psychoactive drugs onto sediment [J]. Environmental Science & Technology, 2008, 42(17): 6415-6423. [18] 鲍林林, 李叙勇. 河流沉积物磷的吸附释放特征及其影响因素 [J]. 生态环境学报, 2017, 26(2): 350-356. BAO L L, LI X Y. Release and absorption characteristics of phosphorus in river sediment and their influential factors [J]. Ecology and Environmental Sciences, 2017, 26(2): 350-356(in Chinese).
[19] CHIAVOLA A, TEDESCO P, BONI M R. Fate of selected drugs in the wastewater treatment plants (WWTPs) for domestic sewage [J]. Environmental Science and Pollution Research International, 2019, 26(2): 1113-1123. doi: 10.1007/s11356-017-9313-x [20] YADAV M K, GERBER C, SAINT C P, et al. Understanding the removal and fate of selected drugs of abuse in sludge and biosolids from Australian wastewater treatment operations [J]. Engineering, 2019, 5(5): 872-879. doi: 10.1016/j.eng.2019.07.012 [21] ZHONG Y H, CHEN Z F, LIU S S, et al. Analysis of azole fungicides in fish muscle tissues: Multi-factor optimization and application to environmental samples [J]. Journal of Hazardous Materials, 2017, 324: 535-543. doi: 10.1016/j.jhazmat.2016.11.024 [22] YAO L, ZHAO J L, LIU Y S, et al. Simultaneous determination of 24 personal care products in fish muscle and liver tissues using QuEChERS extraction coupled with ultra pressure liquid chromatography-tandem mass spectrometry and gas chromatography-mass spectrometer analyses [J]. Analytical and Bioanalytical Chemistry, 2016, 408(28): 8177-8193. doi: 10.1007/s00216-016-9924-y -




 下载:
下载: