-
As和Sb是自然界中天然存在的两种元素,因其为元素周期表同一主族上的相邻元素,两者也表现出了相似的化学性质和环境行为[1-2]。其中,As及其化合物因显而易见的毒害性一直受到关注[3]。近年来,随着Sb元素在环境中的累积及污染事件时有发生,锑化合物也受到科研工作者的关注[4-7]。在天然锑矿中,两种元素常常共存,也意味锑矿开采造成的环境问题中两种元素也是相伴存在[8-9]。因而,近年来科研工作者有积极探索同时处理两种元素污染的工程技术[10]。
在As和Sb的污染处理技术中,因处理目标和出水水质要求的不同而选用相应的处理技术[6]。其中,硫酸盐还原菌介导的硫化物沉淀处理技术因其成本低廉、用途广泛、多目标同时实现而占有一席之地[11]。近年来,有不少研究涉及硫酸盐还原菌用于水体As或Sb污染的治理[10-13],探讨硫酸盐还原菌把As或Sb从水相转移到固相中的潜力。这类研究表明,硫酸盐还原菌对水体中Sb的去除效率很高[10,13-14],但是除As效果却没有明确结论:有些研究表明硫酸盐还原菌能够有效去除水体中As[13,15],而另一些研究却发现硫酸盐还原菌对As的去除能力很有限[16-17]。而随着对Sb元素研究的深入,研究者也发现与As处理相似的问题,即硫酸盐还原菌会使固相中的Sb重新释放入水相中[18]。研究者认为,硫酸盐还原菌处理体系的pH值及其硫化物含量,可能是制约As或Sb去除效果的关键因素[11,18]。
不过,在有关硫酸盐还原菌去除水体中As或Sb的研究中,一个富有启示的结论是,当水体中有其他金属离子时,特别是Fe的存在能够显著降低水体As残留量[10,16-17,19],对Sb的去除也有促进作用[10]。在自然界中,矿石中Fe的存在并不罕见,在锑矿尾矿中也会发现大量的含铁矿物[20],探讨Fe元素在砷或锑迁移、转化中的作用具有现实意义[21]。在之前的研究中,研究者为提高硫酸盐还原菌的生理活性及去除砷的效率,也曾采用添加还原Fe粉或Fe(Ⅱ)的方式[10,16-17,22-25],但这些研究大多采用一个恒定的Fe加入量,对于不同的Fe加入量可能导致的pH变化、硫化物含量变化、铁硫化物生成量的不同及最终对砷和锑去除效率的影响还有待深入探讨。本实验将通过设置一系列的Fe(Ⅱ)浓度梯度,来揭示Fe(Ⅱ)对硫酸盐还原菌处理体系中砷和锑的去除机理和效率的影响,以期为将来的工程处理提供理论依据。
-
试验所用的SRB复合菌群从广西锑矿区的尾矿砂中筛选、富集而来,该菌群用于所有试验处理中。菌种的筛选、富集过程以及菌种鉴定在另一研究成果中已详述[10],本研究所用的培养基成分如下(g·L−1):KH2PO4 (0.5)、NH4Cl (1)、Na2SO4 (1)、MgSO4·7H2O (2)、乳酸钠(3.65)、抗坏血酸(0.1)、CaCl2 (0.1)和酵母膏(1)。
培养基主要成分所用药品为分析纯或更优级试剂,实验用水均为Millipore去离子水(18.2 MΩ·cm)。试验中用于菌种培养的所有血清瓶在使用前均在10%硝酸中浸泡24 h以上,防止残余的重金属或有机物污染,之后依次用清水、去离子水冲洗,并在60 ℃烘箱中烘干。
-
实验研究采用批处理模式(表1),所有试验处理均在22个50 mL血清瓶中进行:在超净台上,把灭菌后的培养液趁热分装在灭菌后的血清瓶中,每个血清瓶装入45 mL培养液,通入氩气,封口保存。其中,Fe/As比为2(T2)、4(T4)、10(T10)、20(T20)、40(T40)、100(T100)的处理各设3个平行,Fe/As比为0(T0)及不接种SRB的处理(CK)作为对照,各设2个平行。待冷却后,CK加入5 mL冷却培养液,其他处理接种对数期的菌液5 mL,所有血清瓶放于30 ℃恒温箱中静置培养约48 h,取样测定pH值和硫化物浓度(以此作为处理起点,即初始0点)。之后,CK组和T0组加入2.5 mL pH 4.01的苯二甲酸氢钾缓冲溶液,T2-T100处理组分别加入2.5 mL浓度为200、400、1000、2000、4000、10000 mg·L−1的Fe(Ⅱ)储备液。所有浓度的Fe(Ⅱ)储备液均由pH 4.01的苯二甲酸氢钾缓冲溶液在氩气保护下溶解和逐步稀释硫酸亚铁铵((NH4)2Fe(SO4)2·6H2O)制成。
加Fe(Ⅱ)后振荡3 h,按比例取样;取样后所有处理按比例加入As(Ⅲ)储备液(250 mg·L−1),使得初始As浓度均为5 mg·L−1,振荡9 h后按比例取样;取样后所有处理按比例加入Sb(Ⅲ)储备液(250 mg·L−1),使得初始Sb浓度均为5 mg·L−1,振荡12 h后按比例取样。所有处理放在30 ℃恒温箱培养,分别于第8 天、第15 天取样。样品溶液取出后,根据相应的处理节点(0、3 h(0.125 d)、12 h(0.5 d)、1 d、8 d、15 d),测定pH、Fe(Ⅱ)、硫化物、
${\rm{SO}}_4^{2-} $ 、As(Ⅲ)及Sb(Ⅲ)等。As(Ⅲ)储备液和Sb(Ⅲ)储备液在使用当天分别由固态亚砷酸钠(NaAsO2,纯度99%,Fluka公司)和固态酒石酸锑钾(KSbC4H4O7,99%纯度,Acros Organics公司)在氩气保护下溶于除氧超纯水配制而成。除氧超纯水由煮沸的超纯水充入氩气冷却制成。 -
取样时一部分样品溶液立即用pHS-3C型数显酸度计(上海,雷磁)测定pH;另一部分样品经0.45 µm滤膜过滤后,测定硫化物、Fe(Ⅱ)、As(Ⅲ)、Sb(Ⅲ)及
${\rm{SO}}_4^{2-} $ 等。硫化物总量采用亚甲蓝分光光度法于665 nm测定(GB/T 16489),Fe(Ⅱ)采用邻二氮杂菲分光光度法于510 nm测定(GB/T 11064.7—2013),${\rm{SO}}_4^{2-} $ 的测定采用铬酸钡分光光度法于420 nm测定(HJ/T 342─2007),所用仪器均为756MC紫外/可见分光光度计(上海,菁华)。As(Ⅲ)和Sb(Ⅲ)测定均采用氢化物发生原子荧光光谱法(HG-AFS,海光AFS-2202E,北京)以测定总砷和总锑的形式进行,以液态砷标(100 μg·mL−1,2% HNO3,Accu Standard公司)和液态锑标(1000 μg·mL−1,中国计量科学研究院)作基准物质,以硫脲和抗坏血酸作为还原剂[20]。样品分析所用试剂均为分析纯及以上,所有测验用水均为Millipore去离子水。
-
数据处理及分析主要使用Office软件Excel 2010及统计分析软件SPSS 22.0,对原始数据进行运算、单因素方差分析及相关分析。
-
在加入Fe(Ⅱ)、As(Ⅲ)和Sb(Ⅲ)之前,接种培养2 d的硫酸盐还原菌pH为7.17,硫化物浓度为217.37 mg·L−1(图1)。加入Fe(Ⅱ)3 h后,Fe/As比不同的处理组pH都有不同程度的下降且Fe/As比越高,pH越低,T0—T100处理组pH值分别降为6.96、6.62、6.57、6.44、6.23、5.72和5.14;As(Ⅲ)和Sb(Ⅲ)的加入并没有造成pH的进一步降低,部分处理组pH甚至稍微提高;静置培养至第8天时pH值均有所升高,第15天时pH则又下降(图1a)。总体来看,不同处理组pH随时间的变化趋势较为一致,而在相同的时间点上pH则随着Fe/As比的升高而降低。
硫化物浓度的变化趋势和pH较为一致(图1b):Fe(Ⅱ)加入3 h后,不同处理组的硫化物浓度从初始217.37 mg·L−1都有下降,且Fe(Ⅱ)加入量越多,硫化物浓度减少也越多,T0—T100处理组硫化物浓度分别降为194.65、183.10、178.48、155.11、111.35、48.71、0.19 mg·L−1;As(Ⅲ)和Sb(Ⅲ)的加入并没有造成硫化物浓度的明显降低,部分处理组的硫化物含量很快就恢复到As(Ⅲ)和Sb(Ⅲ)加入前的浓度水平;第8天时各组硫化物浓度都有所升高,继续培养7 d后(即第15天)各组硫化物浓度则又有下降。除了T100组,其他处理组的硫化物浓度都维持在一个较高的水平,T0—T20组都超过100 mg·L−1,T40也一直在50 mg·L−1波动。
由于加入的Fe(Ⅱ)来自(NH4)2Fe(SO4)2·6H2O,所以不同浓度Fe(Ⅱ)的加入也引进了新的
${\rm{SO}}_4^{2-} $ ,因而,${\rm{SO}}_4^{2-} $ 的残余量($ {m_{\rm{r}}} $ )等于实测量($ {m_{\rm{d}} } $ )减去由Fe引入量($ {m_{\rm{Fe}}} $ 为各组的初始Fe(Ⅱ)含量),计算式如下:对数据进行修正后,不同处理组
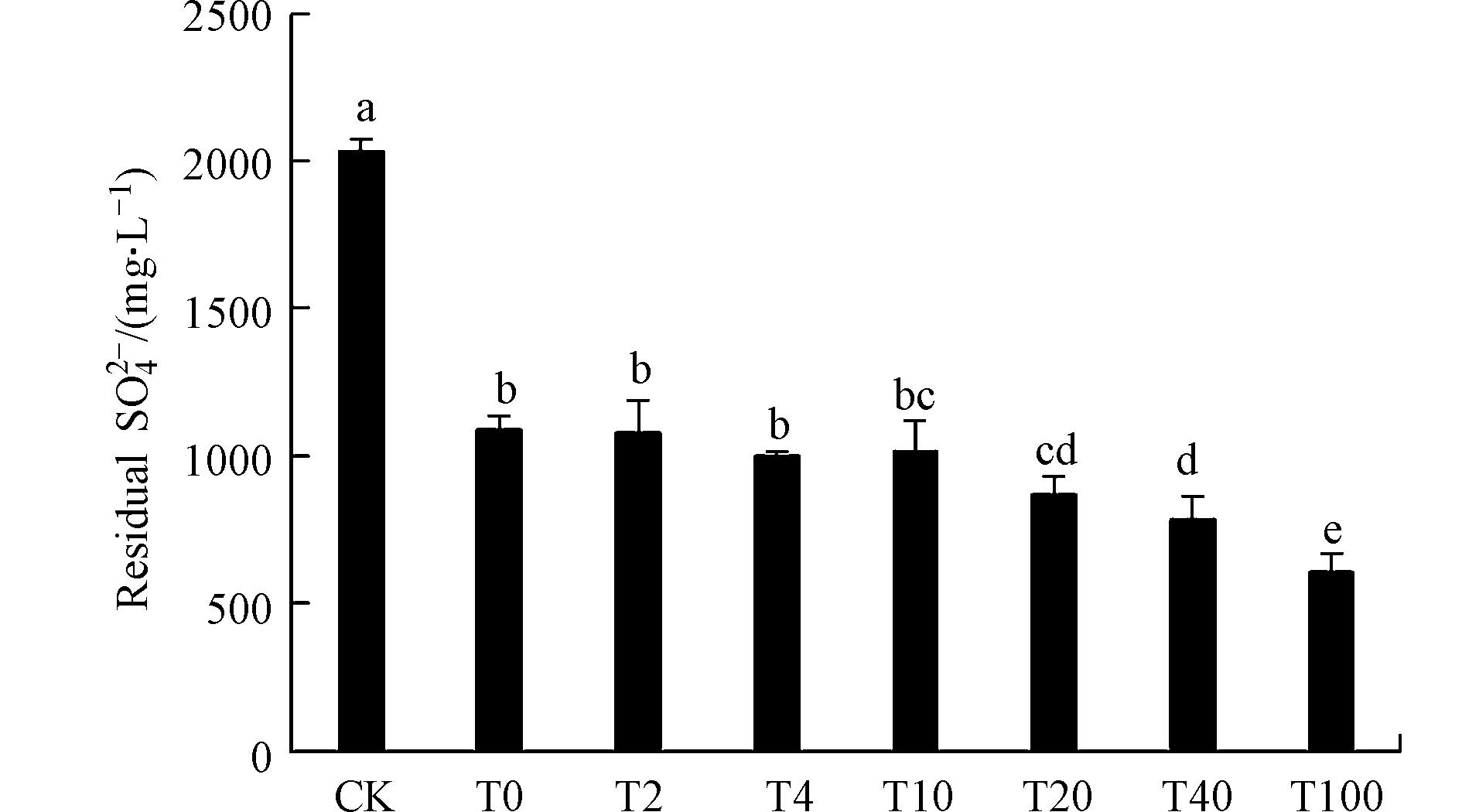
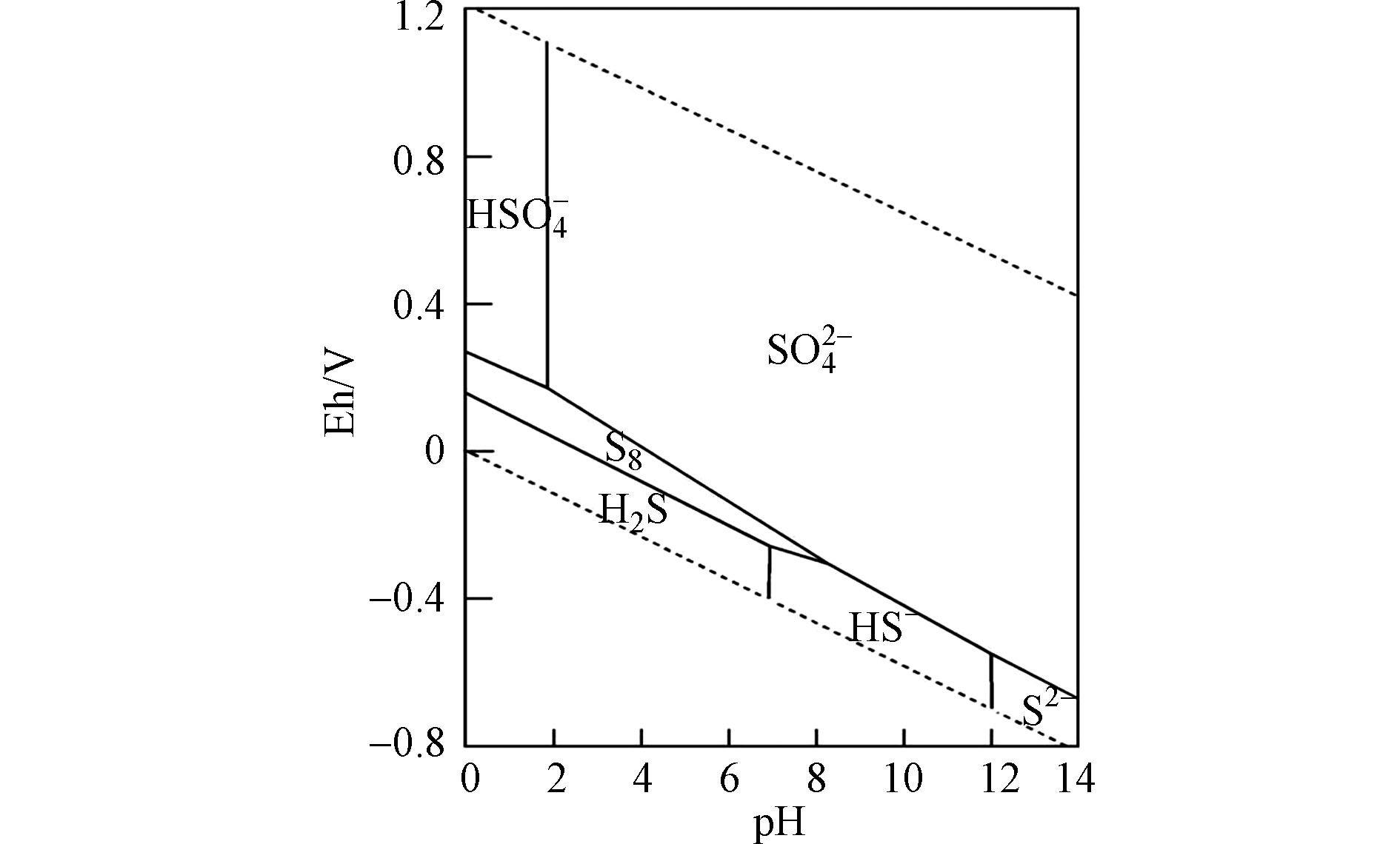
${\rm{SO}}_4^{2-} $ 浓度的残余量表明(图2),与CK相比,硫酸盐还原菌的存在使得各组${\rm{SO}}_4^{2-} $ 浓度均有不同程度的明显下降,其中,T0—T10组${\rm{SO}}_4^{2-} $ 浓度差异不显著,T20—T100组${\rm{SO}}_4^{2-} $ 浓度则随着Fe(Ⅱ)加入量的增加而明显下降。反过来说,较高浓度的Fe(Ⅱ)促进了基质中${\rm{SO}}_4^{2-} $ 的转化与去除。从基质pH值、硫化物浓度随时间的变化状况及硫酸根的残余含量发现,Fe(Ⅱ)的不同加入量对初始条件一致的硫酸盐还原菌处理体系产生了显著影响。根据水体中硫元素的平衡相图(图3)及硫化氢的一级解离常数Ka1=1.3×10−7,加入Fe(Ⅱ)前基质pH约为7.17,表明此时硫化物主要以H2S及HS−两种形态共存,与Fe(Ⅱ)反应如下:
显然,这是一个消耗硫化物及产酸的过程,这也能直观解释加Fe(Ⅱ) 3 h后pH和硫化物浓度在T0—T100组的逐次递减。这里,一个隐含的pH影响因素是碳源(乳酸钠)的氧化消耗所产生的
${\rm{HCO}}_3^{-} $ [27-28],因
${\rm{HCO}}_3^{-} $ 是两性离子,可在一定程度上调节体系的pH,避免基质过酸或过碱。所以,基质的pH值可认为是H2S、HS−、${\rm{HCO}}_3^{-} $ 及${\rm{CO}}_3^{2-} $ 解离平衡的结果[10]。通常,pH值低于5.5将对硫酸盐还原菌的生理活性产生影响[29],不过,在这个批量试验中,由于Fe(Ⅱ)及类金属加入前,48 h的微生物培养使得细菌生长进入了对数期且在此期间积累了足量的碱度和硫化物,这些目标元素的加入并未对微生物的生理活性造成较大冲击,这从第8天时pH和硫化物含量的升高能够得以证实。硫化物是
${\rm{SO}}_4^{2-} $ 的还原产物,二者应是此消彼长的关系,但T0—T100处理组却呈现了硫化物浓度和${\rm{SO}}_4^{2-} $ 残余含量的一致性。造成这种现象的原因,一方面是因为${\rm{SO}}_4^{2-} $ 的消耗和硫化物的产生主要是在加入Fe(Ⅱ)前的48 h内,此时各处理组中二者的含量并无显著差异;另一方面,Fe(Ⅱ)的加入改变了两者的关系,随着初始Fe(Ⅱ)浓度的升高,对基质中硫化物的消耗增多,这既降低了硫化物对硫酸盐还原菌本身的毒害性[30]而利于硫化物的再产生又避免了硫化物转变为${\rm{SO}}_4^{2-} $ 的可能性[31]。值得注意的是,尽管T0—T100组的${\rm{SO}}_4^{2-} $ 残余浓度达到了显著性差异,但相差量最高也只有480 mg·L−1(占初始${\rm{SO}}_4^{2-} $ 的23.6%),这可能是受碳源浓度制约,因为处理后期已没有足够的碳源来维持硫酸盐还原菌快速生长来消耗${\rm{SO}}_4^{2-} $ 。 -
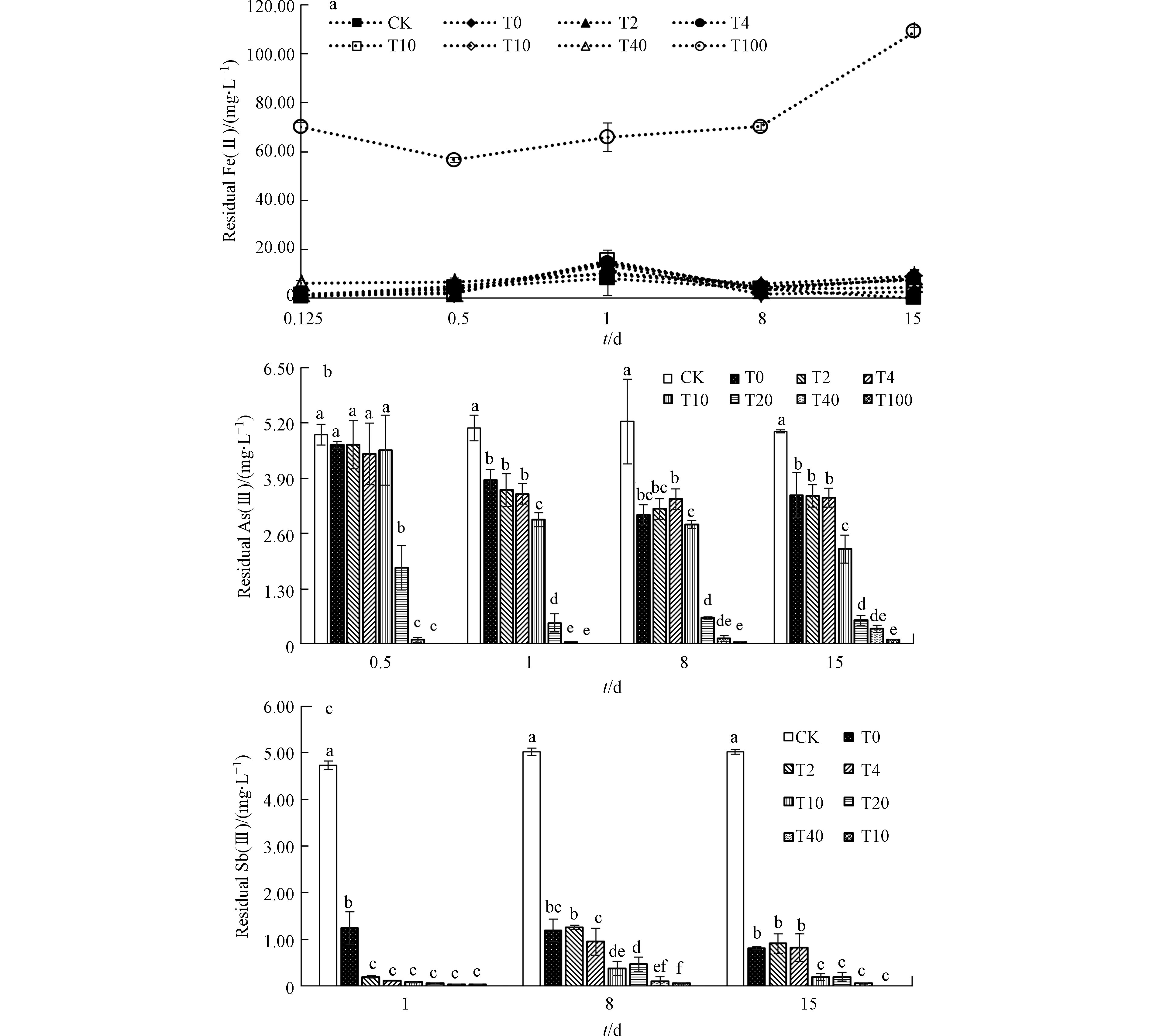
加入3 h后各组Fe(Ⅱ)的残余浓度表明(图4a),除了T40和T100组,其他各组Fe(Ⅱ)浓度均与T0组没有显著差异(P > 0.05),此时T0—T20组的Fe(Ⅱ)去除率达100%,T40组Fe(Ⅱ)去除率也达98%以上,T100去除率约为86%。在Fe(Ⅱ)残余浓度较高的T100组,As(Ⅲ)的加入造成了Fe(Ⅱ)的显著下降,而Sb(Ⅲ)的加入又显著提高了Fe(Ⅱ)的残余浓度(P < 0.05)。由于T0—T40组Fe(Ⅱ)的残余浓度较低,As(Ⅲ)和Sb(Ⅲ)的加入虽然使得各组Fe(Ⅱ)呈现与T100组相似的变化趋势,但各组Fe(Ⅱ)的浓度变化并不明显。第8天和第15天时,各组Fe(Ⅱ)的残余浓度有所起伏,不过,处理终点时除T100还有约109 mg·L−1的Fe(Ⅱ)外,其他各组的浓度均低于10 mg·L−1。
各组中As(Ⅲ)的残余浓度变化显示了硫酸盐还原菌去除As(Ⅲ)的效率和极限(图4b):与CK相比,各组As(Ⅲ)浓度均有所下降,且随加入处理时间的延长而进一步降低,但第15天时又有轻微上升;各组对比来看,T0—T100组的As(Ⅲ)浓度随Fe/As比的提高而降低。其中,T0—T4组的As(Ⅲ)浓度差异不明显,与对照相比,约降低了30%;T10组最终去除率达55.6%,T20—T100的As(Ⅲ)去除率在第8天时达到最高(均超过95%),第15天时残余浓度又有所升高,但去除率也均超过89%,基本达到0.5 mg·L−1的排放标准。
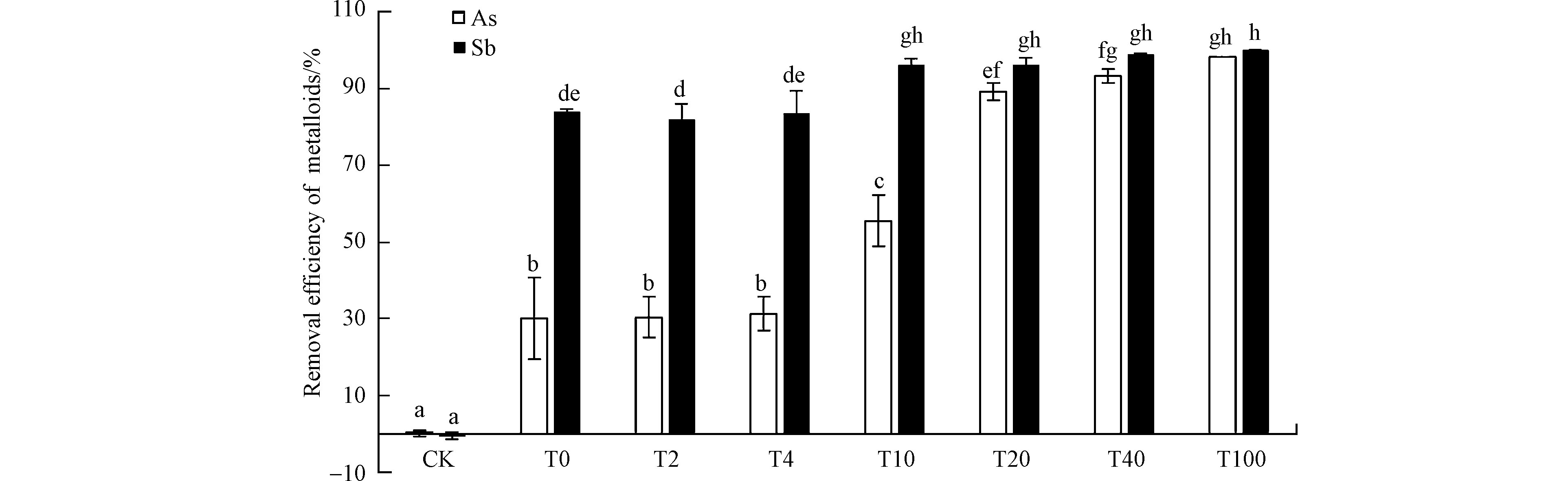
各组Sb(Ⅲ)残余浓度随时间的变化显示出,硫酸盐还原菌作用下各组Sb(Ⅲ)浓度均有明显下降(图4c):与As(Ⅲ)变化趋势不同的是,各组Sb(Ⅲ)的残余浓度在Sb(Ⅲ)加入12 h后(即第1天)达到最低,第8天时各组Sb(Ⅲ)浓度升高,第15天时又达到新的平衡,但也都高于第1天的残余量(T0组除外);各组对比来看,T0—T100组的Sb(Ⅲ)浓度随Fe/As比的提高而降低。其中,T0—T4组的Sb(Ⅲ)浓度差异不明显,与对照相比,约降低了82%;T10—T100组的最终去除率均达96%以上,对应的Sb(Ⅲ)残余浓度已经低于0.5 mg·L−1的排放标准。对处理终点时As(Ⅲ)和Sb(Ⅲ)的去除率(均以5 mg·L−1初始浓度计算)进行方差分析及多重比较(图5),可发现每一组的Sb(Ⅲ)去除率均高于As(Ⅲ),除T40和T100外,这种差异均达到显著性水平(P < 0.05)。总体来看,达到一定浓度(≥50 mg·L−1)的Fe(Ⅱ)显著提升了硫酸盐还原菌对两种元素的去除率,并且这种提升作用随Fe(Ⅱ)浓度的增加而强化,因而,500 mg·L−1Fe(Ⅱ)对硫酸盐还原菌去除As(Ⅲ)和Sb(Ⅲ)的促进作用最为明显,使得As(Ⅲ)和Sb(Ⅲ)的去除率从T0组的30.2%、83.8%分别提高到98.2%和100%。
与前人的研究结果相似的是,Fe(Ⅱ)的确能够提高As(Ⅲ)和Sb(Ⅲ)的去除率[10,16-17],并对As(Ⅲ)和Sb(Ⅲ)的去除效果有稳定作用。从图4可以看出,初始Fe(Ⅱ)越高,As(Ⅲ)和Sb(Ⅲ)的残余浓度越低,但两种元素达到最低浓度的时间有所差异。之前有研究者发现,硫酸盐还原菌对Sb的去除效果通常较好,在基质硫化物浓度不太高的情况下,基本可以达到污水排放标准(0.5 mg·L−1)[13-14]。不过,欧阳小雪等[32]在探讨硫酸盐还原菌去除Sb(Ⅲ)的实验研究中发现,处理后期出现了已沉淀Sb盐的复溶现象。最近也有研究者发现,硫酸盐还原菌会使已沉淀吸附在固相中的Sb化合物重新释放入水相中[18]。不过,初始Fe(Ⅱ)浓度对Sb的吸附作用有重要影响,Fe/As比小于10的几组处理中,Sb(Ⅲ)的去除率基本没有差别,这可能说明基质Fe浓度较低时,是不足以提供足够强度的吸附位点固定Sb(Ⅲ)的;在Fe/As比超过10的几组处理中,尽管基质中仍有较高浓度的硫化物存在(T100除外),但Sb(Ⅲ)的复溶现象并不明显。实验表明,加入适当的Fe(Ⅱ)的确有利于硫酸盐还原菌对Sb的去除,并稳定这种去除效果。
与Sb(Ⅲ)相比,Fe(Ⅱ)对硫酸盐还原菌除As的促进作用更为显著。另外,As的去除没有Sb的去除快,在第8天时达到最大去除量。不过,因除As的效率不如Sb,因而,处理后期As的复溶现象也不像Sb那么明显。从As的排放标准来看(0.5 mg·L−1),需要Fe/As比超过10才能达到出水标准。据此,可知As(Ⅲ)和Sb(Ⅲ)的去除机理可能略有不同。结合以往的研究[10],在基质中硫化物含量充足的情况下,Fe(Ⅱ)的迅速沉淀往往形成非晶形沉淀物,因而,在砷和锑的去除过程中,主要是无定形铁硫化物的吸附作用在起作用[33]。但是,Fe/As比低的几组中As和Sb的去除率,与T0组并无差别,这表明,FeS的吸附作用还会受到其他因素的制约。这种制约作用,很可能是pH和硫化物所致[11],而T0—T100组中均有pH较高及硫化物过量的问题,这显然对硫酸盐还原菌除As很不利。已有研究证实,控制基质pH值以避免硫代砷酸盐的生成,将极大地提高除As效率[29]。从这个意义上来说,较高浓度Fe(Ⅱ)的加入除了提供较多的吸附位点外,也降低了基质pH值,因而对除As效果有明显的促进。
-
对初始Fe(Ⅱ)加入量与其他指标(第15 天取样所测)进行Pearson相关性分析发现,初始Fe(Ⅱ)与基质pH、硫化物浓度、残余Fe(Ⅱ)浓度、残余As(Ⅲ)浓度、残余Sb(Ⅲ)浓度及残余
${\rm{SO}}_4^{2-} $ 浓度等均呈极显著相关关系(P < 0.01):与理化指标pH、硫化物及${\rm{SO}}_4^{2-} $ 等均呈现较强的负相关关系,与残余 Fe(Ⅱ)呈现正相关关系,与类金属的残余浓度呈现负相关关系(表2)。由于As(Ⅲ)和Sb(Ⅲ)在分析时采用残余浓度,初始Fe(Ⅱ)与As(Ⅲ)和Sb(Ⅲ)的负相关关系表明了初始Fe(Ⅱ)加入量的升高对As或Sb的去除有促进作用。此外,其他指标间也呈现一定的相关性,如残余的As(Ⅲ)和Sb(Ⅲ)与pH、硫化物均呈现较强的正相关性,表明pH、硫化物浓度的升高对基质中As(Ⅲ)和Sb(Ⅲ)的去除有不利影响;As(Ⅲ)和Sb(Ⅲ)的正相关系数为0.892(P < 0.01),表明它们的去除或共存受到相同的基质条件制约,反过来说,它们之间不存在竞争关系。同时,就As(Ⅲ)和Sb(Ⅲ)比较来看,As(Ⅲ)与其他指标的相关系数均高于Sb(Ⅲ),表明As(Ⅲ)的残余量对基质条件变化的响应更为敏感。对于硫酸盐还原菌处理砷污染废水来讲,较为普遍的结论是,由于中性或偏碱性条件下As(Ⅲ)易与过量的硫化物形成硫代亚砷酸盐而限制其去除[29],而Sb(Ⅲ)在硫化物过量时则相对惰性[3]。同时,As(Ⅲ)和Sb(Ⅲ)的正相关性说明,由于相似的化学性质,两者在相同的机制条件下呈现了较为一致的去除趋势,而铁硫化物也呈现出对As(Ⅲ)和Sb(Ⅲ)较为优越的去除潜力[3]。
-
不同浓度Fe(Ⅱ)的加入消耗了硫酸盐还原菌产生的碱度和硫化物,使得基质pH和硫化物含量均有所下降,不过低浓度Fe(Ⅱ)加入产生的黑色沉淀并不能明显促进硫酸盐还原菌对As(Ⅲ)和Sb(Ⅲ)的去除,达到一定浓度的Fe(Ⅱ)才能显著提高As(Ⅲ)和Sb(Ⅲ)的去除率。在相同的处理条件下,As(Ⅲ)和Sb(Ⅲ)的沉淀行为也有所不同,Sb(Ⅲ)沉淀速度更快、去除效率更高。总之,硫酸盐还原菌处理体系中As(Ⅲ)和Sb(Ⅲ)的去除效率受基质pH、硫化物、共存离子等因素制约,也受到自身化学性质的影响,适量Fe(Ⅱ)的加入提高了As(Ⅲ)和Sb(Ⅲ)的去除效率,并降低了固相中As(Ⅲ)和Sb(Ⅲ)复溶的可能性。
致谢 感谢2016级农业资源与环境专业杨晶同学在试验处理中提供帮助,感谢中国科学院地球化学研究所环境地球化学国家重点实验室提供平台和便利。
Fe(Ⅱ)浓度对硫酸盐还原菌去除水体中砷和锑的影响
Effect of different contents of Fe(Ⅱ) on removal of arsenic and antimony from water by sulfate reducing bacteria
-
摘要: 在硫酸盐还原菌处理体系中,加入浓度分别为10、20、50、100、200、500 mg·L−1的Fe(Ⅱ),探讨不同浓度的Fe(Ⅱ)对硫酸盐还原菌去除As(Ⅲ)和Sb(Ⅲ)(初始浓度均为5 mg·L−1)的影响。结果显示,不同浓度Fe(Ⅱ)的加入对体系pH、硫化物含量及
${\rm{SO}}_4^{2-} $ 残余量均产生了显著影响;10 mg·L−1和20 mg·L−1的Fe(Ⅱ)对硫酸盐还原菌去除As(Ⅲ)和Sb(Ⅲ)的影响并不显著,随着Fe(Ⅱ)浓度的升高,体系中As(Ⅲ)和Sb(Ⅲ)的去除率均有明显提高;经过15 d的静置处理,500 mg·L−1 Fe(Ⅱ)对硫酸盐还原菌去除As(Ⅲ)和Sb(Ⅲ)的促进作用最为明显,使得As(Ⅲ)和Sb(Ⅲ)的去除率从不加Fe(Ⅱ)时的30.2%、83.8%分别提高到98.2%、100%;比较每个Fe(Ⅱ)浓度下As(Ⅲ)和Sb(Ⅲ)的去除率发现,Sb(Ⅲ)的去除率均高于As(Ⅲ)。研究表明,硫酸盐还原菌处理体系中As(Ⅲ)和Sb(Ⅲ)的去除效率将受基质pH、硫化物、共存离子等因素制约,也受到自身化学性质的影响,适量Fe(Ⅱ)的加入提高了As(Ⅲ)和Sb(Ⅲ)的去除效率,并降低了固相中As(Ⅲ)和Sb(Ⅲ)复溶的可能性。Abstract: In the treatment system of sulfate-reducing bacteria, Fe(Ⅱ) reagent at a specific concentration (10, 20, 50, 100, 200, and 500 mg·L−1) was added at each time to a treatment system of sulfate-reducing bacteria (SRB), to investigate the effect of concentration of Fe(Ⅱ) on the removal of As(Ⅲ) and Sb(Ⅲ)—initial concentrations of both were at 5 mg·L−1—by SRB. The results showed that all Fe(Ⅱ) reagents had a significant effect on the pH, sulfide content, and residual${\rm{SO}}_4^{2-} $ of the treatment system, 10 and 20 mg·L−1 of Fe(Ⅱ) had no significant effect on the removal of As(Ⅲ) and Sb(Ⅲ) by SRB. However, the removal rate of As(Ⅲ) and Sb(Ⅲ) in the system improved with the Fe(Ⅱ) concentration and thus, 500 mg·L−1 Fe(Ⅱ) had the largest effect on the removal of As(Ⅲ) and Sb(Ⅲ) by SRB (compared to the control when adding no Fe(Ⅱ), the removal rate of As(Ⅲ) and Sb(Ⅲ) increased from 30.2% and 83.8% to 98.2% and 100% in a 15-day static treatment, respectively). In each treatment, the removal rate of Sb(Ⅲ) was higher than that of As(Ⅲ). This study indicates that the removal efficiency of As(Ⅲ) and Sb(Ⅲ) in the SRB treatment system is influenced by substrate pH, sulfide, coexisting ions, etc., as well as their own chemical properties and the addition of appropriate amount of Fe(Ⅱ) can improve the removal efficiency and at the same time, reduce the resolution of As(Ⅲ) and Sb(Ⅲ) from the solid phase.-
Key words:
- sulfate-reducing bacteria /
- Fe(Ⅱ) /
- arsenic /
- antimony
-

-
表 1 批量处理试验设计
Table 1. Batch mode test design
处理组编号
Treatment numberSRB Fe(Ⅱ)/(mg·L−1) As(Ⅲ) (5 mg·L−1) Sb(Ⅲ) (5 mg·L−1) CK - - + + T0 + - + + T2 + 10 + + T4 + 20 + + T10 + 50 + + T20 + 100 + + T40 + 200 + + T100 + 500 + + 表 2 15 d的处理后基质各指标间的相关关系
Table 2. Correlation between the indicators in the matrix after 15 days’ treatment
初始Fe(Ⅱ)Initial Fe(Ⅱ) pH 硫化物Total sulfide Fe(Ⅱ) As(Ⅲ) Sb(Ⅲ) pH −0.977** 硫化物Total sulfide −0.938** 0.974** Fe(Ⅱ) 0.927** −0.854** −0.745** As(Ⅲ) −0.767** 0.837** 0.903** −0.519* Sb(Ⅲ) −0.673** 0.736** 0.806** −0.435 0.892** SO42- −0.889** 0.908** 0.905** −0.742** 0.810** 0.662** 注:**,P < 0.01; *,P < 0.05. -
[1] LIU J L, YAO J, DURAN R, et al. Bacterial shifts during in-situ mineralization bio-treatment to non-ferrous metal (loid) tailings [J]. Environmental Pollution, 2019, 255: 113165. doi: 10.1016/j.envpol.2019.113165 [2] KULP T R, MILLER L G, BRAIOTTA F, et al. Microbiological reduction of Sb(Ⅴ)in anoxic freshwater sediments [J]. Environmental Science & Technology, 2014, 48(1): 218-226. [3] HAN Y, SEONG H J, CHON C, et al. Interaction of Sb(Ⅲ) with iron sulfide under anoxic conditions: Similarities and differences compared to As(Ⅲ) interactions [J]. Chemosphere, 2018, 195: 762-770. doi: 10.1016/j.chemosphere.2017.12.133 [4] REN M, DING S, FU Z, et al. Seasonal antimony pollution caused by high mobility of antimony in sediments: In situ evidence and mechanical interpretation [J]. Journal of Hazardous Materials, 2019, 367: 427-436. doi: 10.1016/j.jhazmat.2018.12.101 [5] BURTON E D, HOCKMANN K, KARIMIAN N, et al. Antimony mobility in reducing environments: The effect of microbial iron (Ⅲ)-reduction and associated secondary mineralization [J]. Geochimica et Cosmochimica Acta, 2019, 245: 278-289. doi: 10.1016/j.gca.2018.11.005 [6] UNGUREANU G, SANTOS S, RUI B, et al. Arsenic and antimony in water and wastewater: Overview of removal techniques with special reference to latest advances in adsorption [J]. Journal of Environmental Management, 2015, 151: 326-342. [7] HE M, WANG X, WU F, et al. Antimony pollution in China [J]. Science of the Total Environment, 2012, 421-422(3): 41-50. [8] SUN X, LI B, HAN F, et al. Impacts of arsenic and antimony co-contamination on sedimentary microbial communities in rivers with different pollution gradients [J]. Microbial Ecology, 2019, 78(3): 589-602. doi: 10.1007/s00248-019-01327-5 [9] ARSIC M, TEASDALE P R, WELSH D T, et al. Diffusive gradients in thin films reveals differences in antimony and arsenic mobility in a contaminated wetland sediment during an oxic-anoxic transition [J]. Environmental Science & Technology, 2018, 52(3): 1118-1127. [10] LIU F, ZHANG G, LIU S, et al. Bioremoval of arsenic and antimony from wastewater by a mixed culture of sulfate-reducing bacteria using lactate and ethanol as carbon sources [J]. International Biodeterioration & Biodegradation, 2018, 126: 152-159. [11] ALAM R, MCPHEDRAN K. Applications of biological sulfate reduction for remediation of arsenic–A review [J]. Chemosphere, 2019, 222: 932-944. doi: 10.1016/j.chemosphere.2019.01.194 [12] DE MATOS L P, COSTA P F, MOREIRA M, et al. Simultaneous removal of sulfate and arsenic using immobilized non-traditional SRB mixed culture and alternative low-cost carbon sources [J]. Chemical Engineering Journal, 2018, 334: 1630-1641. doi: 10.1016/j.cej.2017.11.035 [13] WANG H, CHEN F, MU S, et al. Removal of antimony (Sb(Ⅴ)) from Sb mine drainage: Biological sulfate reduction and sulfide oxidation–precipitation [J]. Bioresource Technology, 2013, 146(10): 799-802. [14] ZHANG G, OUYANG X, LI H, et al. Bioremoval of antimony from contaminated waters by a mixed batch culture of sulfate-reducing bacteria [J]. International Biodeterioration & Biodegradation, 2016, 115: 148-155. [15] TECLU D, TIVCHEV G, LAING M, et al. Bioremoval of arsenic species from contaminated waters by sulphate-reducing bacteria [J]. Water Research, 2008, 42(19): 4885-4893. doi: 10.1016/j.watres.2008.09.010 [16] SAHINKAYA E, YURTSEVER A, TOKER Y, et al. Biotreatment of As-containing simulated acid mine drainage using laboratory scale sulfate reducing upflow anaerobic sludge blanket reactor [J]. Minerals Engineering, 2015, 75: 133-139. doi: 10.1016/j.mineng.2014.08.012 [17] ALTUN M, SAHINKAYA E, DURUKAN I, et al. Arsenic removal in a sulfidogenic fixed-bed column bioreactor [J]. Journal of Hazardous Materials, 2014, 269(1): 31-37. [18] YE L, CHEN H, JING C. Sulfate-Reducing bacteria mobilize adsorbed antimonate by thioantimonate formation [J]. Environmental Science & Technology Letters, 2019, 6(7): 418-422. [19] LEE M K, SAUNDERS J A, WILSON T, et al. Field-scale bioremediation of arsenic-contaminated groundwater using sulfate-reducing bacteria and biogenic pyrite [J]. Bioremediation Journal, 2019, 23(1): 1-21. doi: 10.1080/10889868.2018.1516617 [20] FU Z, ZHANG G, LI H, et al. Influence of reducing conditions on the release of antimony and arsenic from a tailings sediment [J]. Journal of Soils and Sediments, 2016, 16(10): 2471-2481. doi: 10.1007/s11368-016-1484-4 [21] KARIMIAN N, JOHNSTON S G, BURTON E D. Iron and sulfur cycling in acid sulfate soil wetlands under dynamic redox conditions: A review [J]. Chemosphere, 2018, 197: 803-816. doi: 10.1016/j.chemosphere.2018.01.096 [22] ZACARÍAS-ESTRADA O L, BALLINAS-CASARRUBIAS L, MONTERO-CABRERA M E, et al. Arsenic removal and activity of a sulfate reducing bacteria-enriched anaerobic sludge using zero valent iron as electron donor [J]. Journal of Hazardous Materials, 2020, 384: 121392. doi: 10.1016/j.jhazmat.2019.121392 [23] BAI H, KANG Y, QUAN H, et al. Treatment of acid mine drainage by sulfate reducing bacteria with iron in bench scale runs [J]. Bioresource Technology, 2013, 128: 818-822. doi: 10.1016/j.biortech.2012.10.070 [24] 王悦, 周孜迈, 邓文娜, 等. 两种体系去除水体中的砷 [J]. 环境化学, 2018, 37(12): 2613-2620. doi: 10.7524/j.issn.0254-6108.2018033001 WANG Y, ZHOU Z M, DENG W N, et al. A study on the removal of arsenic from water by two systems [J]. Environmental Chemistry, 2018, 37(12): 2613-2620(in Chinese). doi: 10.7524/j.issn.0254-6108.2018033001
[25] 胡一帆, 王文兵, 仵彦卿. 弱磁场强化零价铁去除水中砷的效果 [J]. 环境化学, 2019, 38(5): 1074-1081. doi: 10.1002/etc.4383 HU Y F, WANG W B, WU Y Q. The role of weak magnetic field in accelerating the removal of arsenic by zero valent iron [J]. Environmental Chemistry, 2019, 38(5): 1074-1081(in Chinese). doi: 10.1002/etc.4383
[26] LIANG H C, BILLIN S J, WILLIS W B, et al. Designing a wastewater treatment plant to remove sulfate at an iron mine [J]. Proceedings of the Water Environment Federation, 2010, 2010(11): 5664-5674. doi: 10.2175/193864710798193671 [27] NEVATALO L M, MAKINEN A E, KAKSONEN A H, et al. Biological hydrogen sulfide production in an ethanol–lactate fed fluidized-bed bioreactor [J]. Bioresource Technology, 2010, 101(1): 276-284. doi: 10.1016/j.biortech.2009.07.042 [28] THAUER R K, JUNGERMANN K, DECKER K, et al. Energy conservation in chemotrophic anaerobic bacteria [J]. Bacteriological Reviews, 1977, 41(1): 100-180. doi: 10.1128/br.41.1.100-180.1977 [29] SUN J, HONG Y, GUO J, et al. Arsenite removal without thioarsenite formation in a sulfidogenic system driven by sulfur reducing bacteria under acidic conditions [J]. Water Research, 2019: 362-370. [30] 姚琪, 黄建洪, 杨磊, 等. 硫酸盐生物还原过程中涉硫组分代谢特性 [J]. 环境工程学报, 2018, 12(10): 2783-2790. doi: 10.12030/j.cjee.201802082 YAO Q, HUANG J H, YANG L, et al. Characteristic of metabolism for sulfur-containing components during sulfate bioreduction process [J]. Chinese Journal of Environmental Engineering, 2018, 12(10): 2783-2790(in Chinese). doi: 10.12030/j.cjee.201802082
[31] SAALFIELD S L, BOSTICK B C. Changes in iron, sulfur, and arsenic speciation associated with bacterial sulfate reduction in ferrihydrite-rich systems [J]. Environmental Science & Technology, 2009, 43(23): 8787-8793. [32] 欧阳小雪, 张国平, 李海霞, 等. 用硫酸盐还原菌去除废水中锑的实验研究 [J]. 地球与环境, 2014, 42(5): 663-668. OUYANG X X, ZHANG G P, LI H X, et al. Removal of antimony in synthetic wastewater by sulfate-reducing bacteria [J]. Earth and Environment, 2014, 42(5): 663-668(in Chinese).
[33] WATSON J H P, ELLWOOD D C, DENG Q, et al. Heavy metal adsorption on bacterially produced FeS [J]. Minerals Engineering, 1995, 8(10): 1097-1108. doi: 10.1016/0892-6875(95)00075-2 -






 下载:
下载: