-
在污水处理过程中,碳源作为微生物新陈代谢的必需物质和能量来源,对系统内各种污染物(氮、磷)的去除[1-2]和污泥性能(吸附性能、沉降性能)[1-3]有着非常重要的影响。由于雨水[4]、河水、地下水[5]的渗透稀释,我国5 476座城镇污水处理厂中有2 052座(数量占比37.5%)的进水耗氧有机污染物浓度(以COD计)小于150 mg·L−1,与设计进水水质相差甚远[6]。特别地,南方地区多个城镇污水处理厂的BOD5实际进水值比设计进水低,为设计值的1/2~1/3倍[7]。除此以外,对广东省60多座污水处理厂调查发现,40多座污水处理厂存在进水耗氧有机物浓度(以COD计)偏低的现象,其中23座污水厂进水COD值小于100 mg·L−1,10座污水厂进水COD值小于60 mg·L−1[8]。可见,我国南方地区污水处理厂低浓度进水现象较为普遍。低浓度污水往往需外加碳源来保证脱氮,增加了处理成本,同时会使丝状菌生长速率超过菌胶团细菌[9],容易引发污泥膨胀,增加污水处理难度。
在现有的污水处理工艺中,循环式活性污泥法(cyclic activated sludge system,CASS)能很好地处理低浓度污水,出水水质稳定达标[10-11]。CASS工艺是序批式活性污泥法的改良工艺,通常功能区分为污泥选择区和主反应区,体积比为1∶5,污泥选择区进行反硝化脱氮和厌氧释磷,主反应区进行硝化和好氧聚磷。该工艺具有反应器配置灵活、操作简便、污泥丝状膨胀少和占地面积小等优点,已广泛应用于处理城市污水、工业废水和农村生活污水等[12-14]。在处理低浓度污水时,通过梯级非限制曝气等方式,能有效缓解反硝化碳源不足的问题,促进同步硝化反硝化,在出水达标的前提下显著增强脱氮效率[15]。同时CASS工艺前端的污泥选择区能有效抑制污泥丝状膨胀,活性污泥体积指数一般较低(20~40 mg·L−1),污泥沉降性能良好[16]。
尽管CASS工艺对低浓度进水有良好的适应性,但当进水浓度过低时,会对其沿程污染物降解特征和微生物群落响应机制造成显著影响。有研究表明,当进水COD值为98 mg·L−1时,耗氧有机物浓度(以COD计)在进水曝气0.5 h大幅降低,随后微生物以内源呼吸为主,细胞衰亡释放代谢产物造成水体有机物浓度缓慢升高,有机物、氨氮、总氮和总磷的去除主要发生在运行前期,曝气结束后污染物浓度基本不变,曝气阶段主反应区变形菌门的相对丰度最高[11],污染物浓度变化的主要原因是由于活性污泥与污水接触初期具有快速吸附的性能,吸附作用通常在5~15 min内完成[17]。污染物去除与微生物群落结构变化密切相关,这些沿程变化的特征必然会引起微生物群落结构的沿程差异;同时,进料方式的改变会富集不同的脱氮功能菌,当进水COD值为150 mg·L−1时,序批式进料生化池的硝化螺旋菌属和黄杆菌属丰度较高,而连续式进料的硝化菌属和脱氯单胞菌属丰度较高[18]。可见,对于CASS工艺,微生物的群落特征与污水处理性能密切相关[19]。然而,现有研究大多集中在反应器的整体微生物变化[11,18,20],鲜有涉及沿程(分区、分阶段)微生物群落结构变化方面的研究。而揭示低进水浓度下CASS工艺微生物群落结构的沿程变化特征,是了解污染物降解沿程变化过程机理的关键。
因此,本研究选取广东省某CASS工艺城镇污水处理厂作为研究对象,统计历年运行数据,分析工艺处理效果,沿程布点采集完整周期内不同的反应区域与运行阶段的污水和污泥样品,综合研究CASS生化池沿程污染物变化与沿程微生物群落结构变化,从微生物学角度揭示低负荷CASS工艺的污水处理机理与运行机制,为长期处于低负荷进水条件CASS工艺的设计及运行优化提供参考。
-
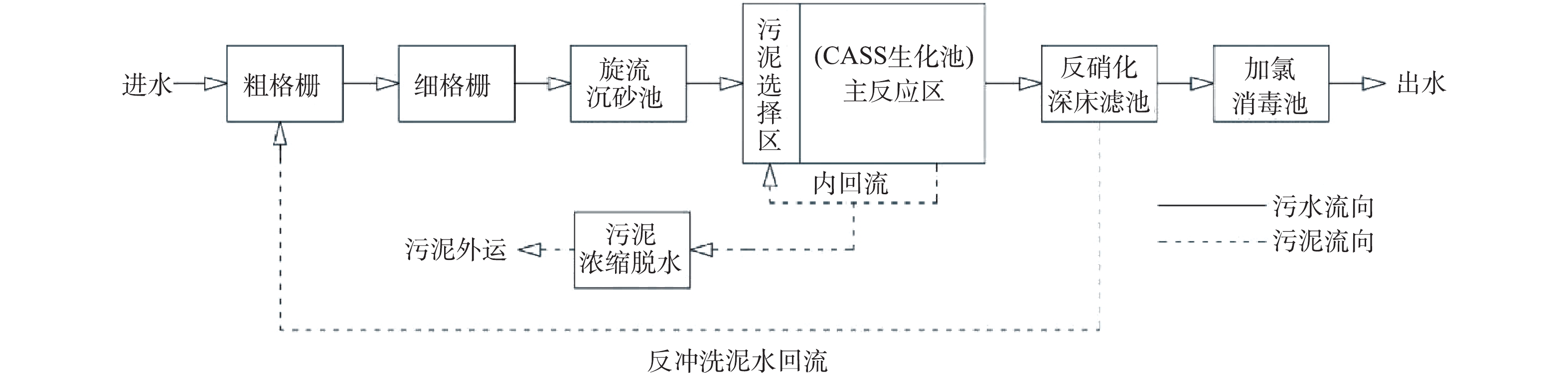
广东省某CASS城镇污水厂处理规模为6×104 m³·d−1。该污水厂未采取外加碳源与化学除磷剂的方式,出水执行《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A排放标准。该污水厂预处理段由粗格栅、细格栅及旋流沉砂池组成,二级处理单元为CASS生化池,深度处理采用反硝化深床滤池和加氯消毒工艺。CASS生化池分为污泥选择区和主反应区两部分,体积比1∶5,有效水深6 m,换水率30%,进水时污泥选择区启动潜流搅拌,主反应区启动潜流搅拌和鼓风曝气,完整1周期时长为4 h,进水2 h,沉淀1 h,滗水40 min,闲置20 min。进水5 min后开始污泥回流至进水结束,流量为130 m3·h−1,回流比为18.8%。沉淀5 min后开始排剩余污泥至沉淀结束,流量为20 m3·h−1。水力停留时间为17.1 h,污泥龄为15.1 d,MLSS为4 064~5 615 mg·L−1,MLVSS为1 986~2 969 mg·L−1,SVI为28.9~39.9 mg·L−1,曝气时主反应区溶解氧为1~2 mg·L−1。实验时生化池内温度为20~25 ℃。工艺流程如图1所示,月均水质指标如表1所示。该厂月均进水COD值均小于150 mg·L−1,属于典型的低进水浓度污水处理厂。
-
采集不同区域与不同运行阶段的污水样品,采样点分别布设在配水井出水、细格栅出水、旋流沉砂池出水、污泥选择区中段(进水10 min、进水1 h、进水结束、沉淀1 h、滗水结束、闲置结束)、主反应区出水段(进水10 min、进水1 h、进水结束、沉淀1 h、滗水结束、闲置结束),每个采样点均分析化学需氧量(COD)、总氮(TN)、硝态氮(NO3−-N)、铵态氮(NH4+-N)、总磷(TP)水质指标,采集6次完整周期样本,对每个指标重复测定3次取均值,对各污染物的沿程变化进行研究。
-
采集CASS生化池污泥选择区和主反应区不同运行阶段(进水1 h、进水结束、沉淀1 h、闲置结束)的活性污泥样品,用250 mL塑料瓶储存,置于−80 ℃的冰箱保存待测。样品DNA使用PowerWater® SterivexTM DNA Isolation Kit(MoBio, USA)试剂盒按说明书进行提取,使用Nanodrop(Thermo Scientific, USA)检测DNA浓度和纯度,使用琼脂糖凝胶电泳法检测蛋白污染及DNA完整度。质检合格的DNA样品通过引物515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT-3’)对DNA V4~V5可变区进行扩增,条件为94 ℃预变形5 min,94 ℃变形30 s,52 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸10 min,每个样品做3个重复。完成扩增后,用1%琼脂糖凝胶电泳检测PCR产物,每个扩增子的主带长度均不小于420 bp,按等质量原则计算样品体积,将各PCR产物进行混合,在Illumina Nova 6000平台进行PE250测序,获得的原始序列经质控过滤后得到有效的高质量序列,采用UPARSE方法将有效序列进行OTU聚类,并与SILVA数据库进行比对分析。
-
水样COD、BOD5、TN、TP、NH4+-N、NO3−-N、MLSS、MLVSS、SVI等指标均根据国家标准方法进行测定[21]。溶解氧和温度由雷磁DZB-718-A型便携式多参数分析仪测定。
使用Origin 2022软件对理化数据与微生物相对丰度进行绘图,利用STAMP软件进行优势微生物差异分析。将OTU信息导入Excel 2022,使用USEARCH软件计算多样性指数。使用TBtools软件绘制微生物菌属聚类热图。使用R软件(版本4.2.2)vegan程序包对微生物菌属和环境因子进行RDA冗余分析,ggplot2程序包进行绘图。通过PICRUSt软件对OTU丰度表进行标准化,比对KEGG数据库信息进行功能基因预测分析。
-
按照CASS工艺功能区划分,通过对预处理段和生化池的沿程布点,分析COD、TN、NO3−-N、NH4+-N、TP污染物的沿程变化特征,研究各功能区不同运行阶段的污染物去除性能。
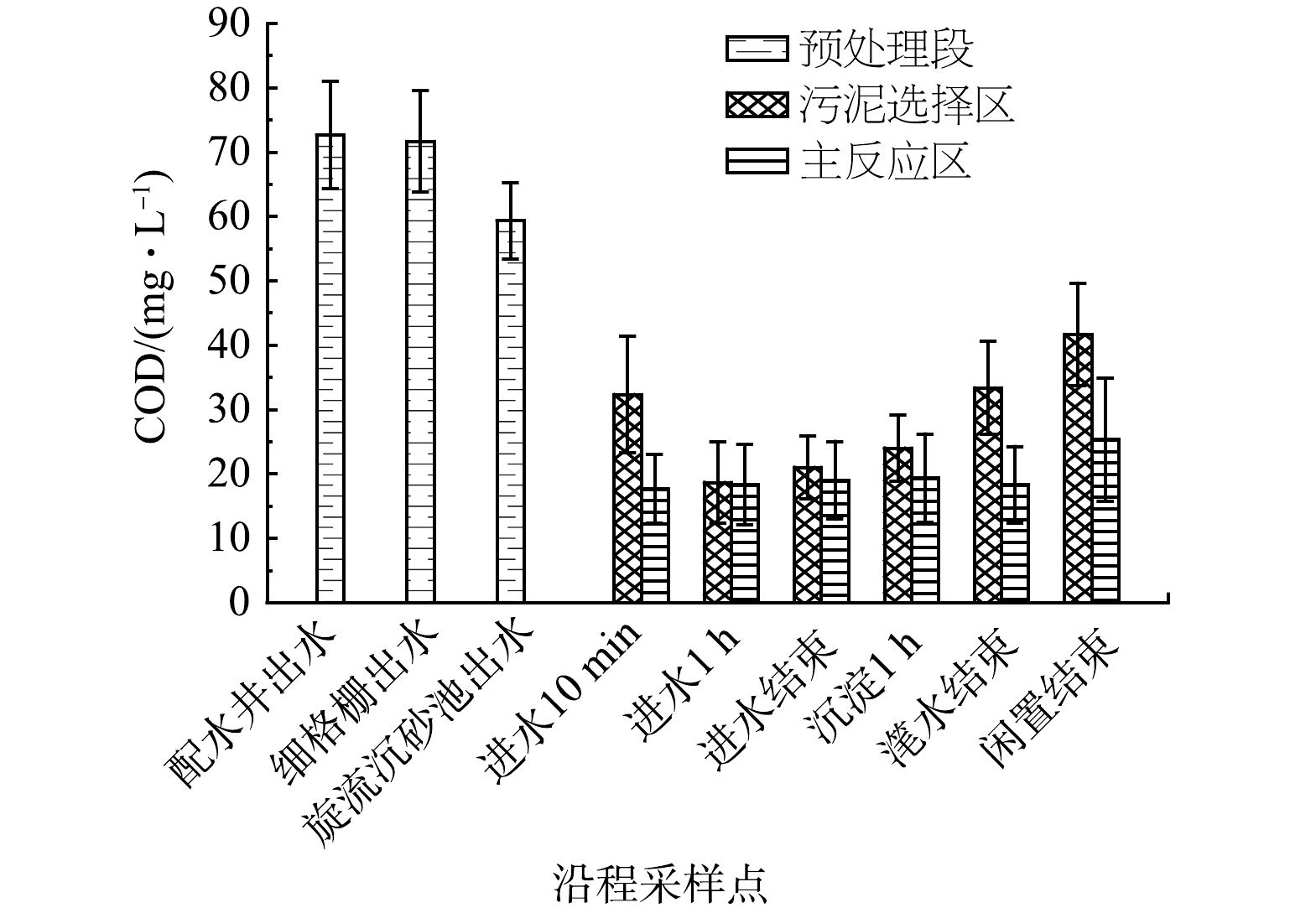
1)耗氧有机物(以COD计)沿程变化分析。图2揭示了预处理段、污泥选择区和主反应区COD值变化特征。从配水井到旋流沉砂池通过物理作用去除污水中18.36%的耗氧有机物(以COD计),进入生化池前初始的COD值为59.33 mg·L−1,污水进入污泥选择区后,进水10 min COD值迅速降低至32.33 mg·L−1,主要原因是由于生物吸附,吸附一般进行5~15 min后即达到饱和[17],该过程也存在回流液的混合稀释。进水1 h异养菌降解吸附的有机物,部分有机碳源用于脱氮除磷,COD值达到最低18.67 mg·L−1。吸附饱和后活性污泥若未及时完成泥水分离,会重新释放有机物至上覆水流[22],同时存在进水有机物补充,共同导致进水结束时COD值上升至21 mg·L−1。进水结束至闲置结束污泥选择区COD值持续上升至41.67 mg·L−1,原因是进水有机物含量低,可生物利用组分很快被降解完,当水中有机物浓度过低时,微生物开始进行内源呼吸,部分细胞衰亡释放代谢物到水中,导致COD值上升[11],同时可能存在部分固态有机物厌氧分解。
主反应区COD值变化不明显,表明有机物的吸附降解主要发生在污泥选择区。将旋流沉砂池出水与主反应区滗水结束的耗氧有机物浓度(以COD计)对比,CASS生化池可去除污水中56.42%的耗氧有机物(以COD计),出水COD值为18.33 mg·L−1。
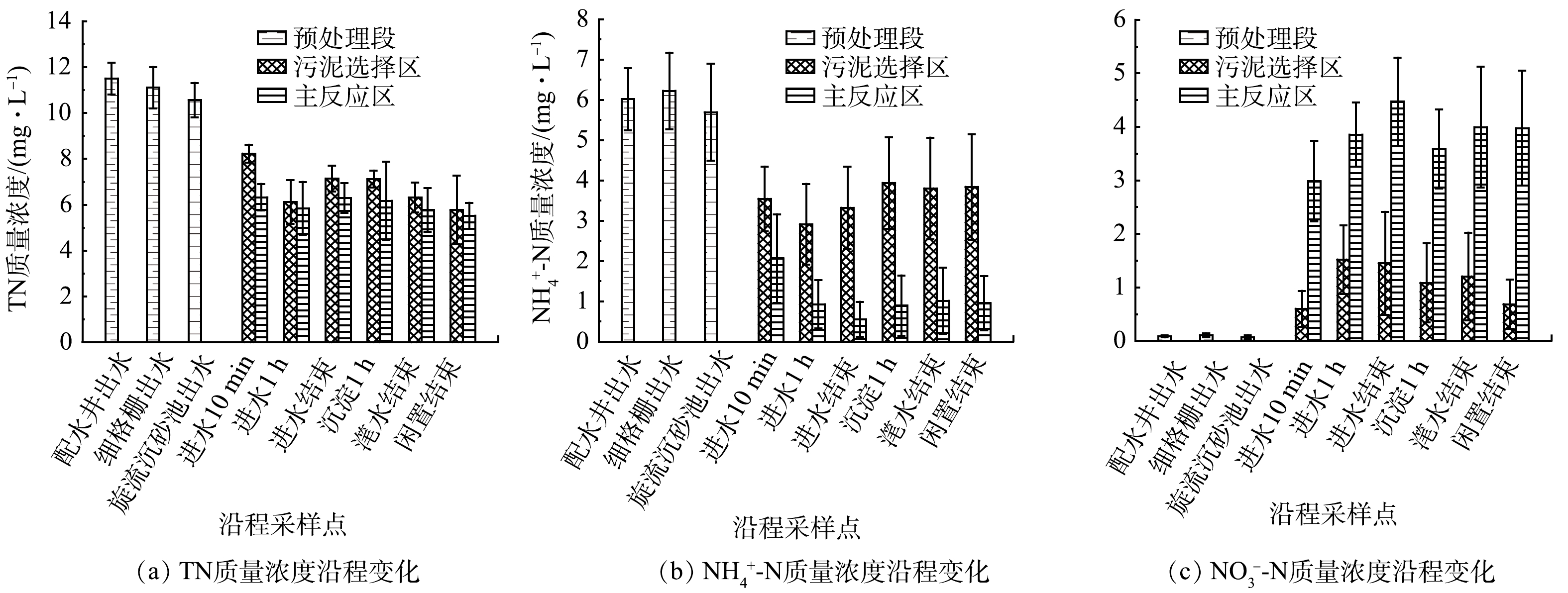
2)氮素沿程变化分析。图3(a)、图3(b)、图3(c)揭示了预处理段、污泥选择区和主反应区TN、NH4+-N及NO3−-N质量浓度变化特征。经细格栅和旋流沉砂池处理去除8.09%的TN与5.48%的NH4+-N,进入生化池初始的TN、NH4+-N及NO3−-N质量浓度分别为10.57、5.69、0.07 mg·L−1。污泥选择区进水阶段TN变化情况与COD相似,进水10 min主要发生吸附,进水1 h主要进行反硝化脱氮,进水结束时TN质量浓度上升至7.14 mg·L−1,主要由于进水补充、NO3−-N内回流和吸附的TN解吸导致,随后阶段主要以反硝化为主,闲置结束TN质量浓度降低至5.77 mg·L−1。同样,污泥选择区NH4+-N质量浓度在进水1 h降至最低值2.91 mg·L−1。有研究[23]表明,当溶解氧较低时硝化主要以短程硝化为主,由于内回流液中含有少量溶解氧,故该阶段主要发生短程硝化导致NH4+-N质量浓度降低。沉淀过程底部溶解氧含量较低,厌氧条件下NH4+-N的释放速率与释放量比好氧条件下高[24],沉淀1 h选择区NH4+-N质量浓度上升至3.94 mg·L−1。进水NO3−-N质量浓度几乎为0 mg·L−1,污泥选择区的NO3−-N绝大部分来自主反应区内回流的NO3−-N,进水阶段NO3−-N质量浓度始终低于主反应区,进水结束后NO3−-N质量浓度持续降低至0.69 mg·L−1,说明选择区沿程均存在反硝化脱氮。
主反应区TN质量浓度在进水曝气1 h降低至5.84 mg·L−1,好氧硝化使NH4+-N质量浓度在进水结束时下降至最低值0.55 mg·L−1,与选择区沿程NH4+-N质量浓度维持在较高水平相比,表明NH4+-N的降解去除主要发生在主反应区,进水结束时NO3−-N上升至最高值4.47 mg·L−1;进水结束后发生反硝化脱氮使TN降低,NH4+-N因含氮物质分解释放而上升,与污泥选择区沿程变化一致。滗水阶段氧传质增强,NO3−-N质量浓度上升至4 mg·L−1,此时TN质量浓度降低至5.77 mg·L−1,说明出现同步硝化反硝化脱氮现象。闲置阶段主反应区NO3−-N质量浓度仍维持在较高水平,表明NO3−-N的去除主要发生在污泥选择区。比较旋流沉砂池出水与主反应区滗水结束的TN与NH4+-N质量浓度可知,CASS生化池可去除41.71%的TN与77.78%的NH4+-N。以进水10 min与闲置结束的TN质量浓度为始末值计算,污泥选择区脱氮效率为23.23%,主反应区脱氮效率为8.80%,表明污泥选择区具有更高的脱氮效能。
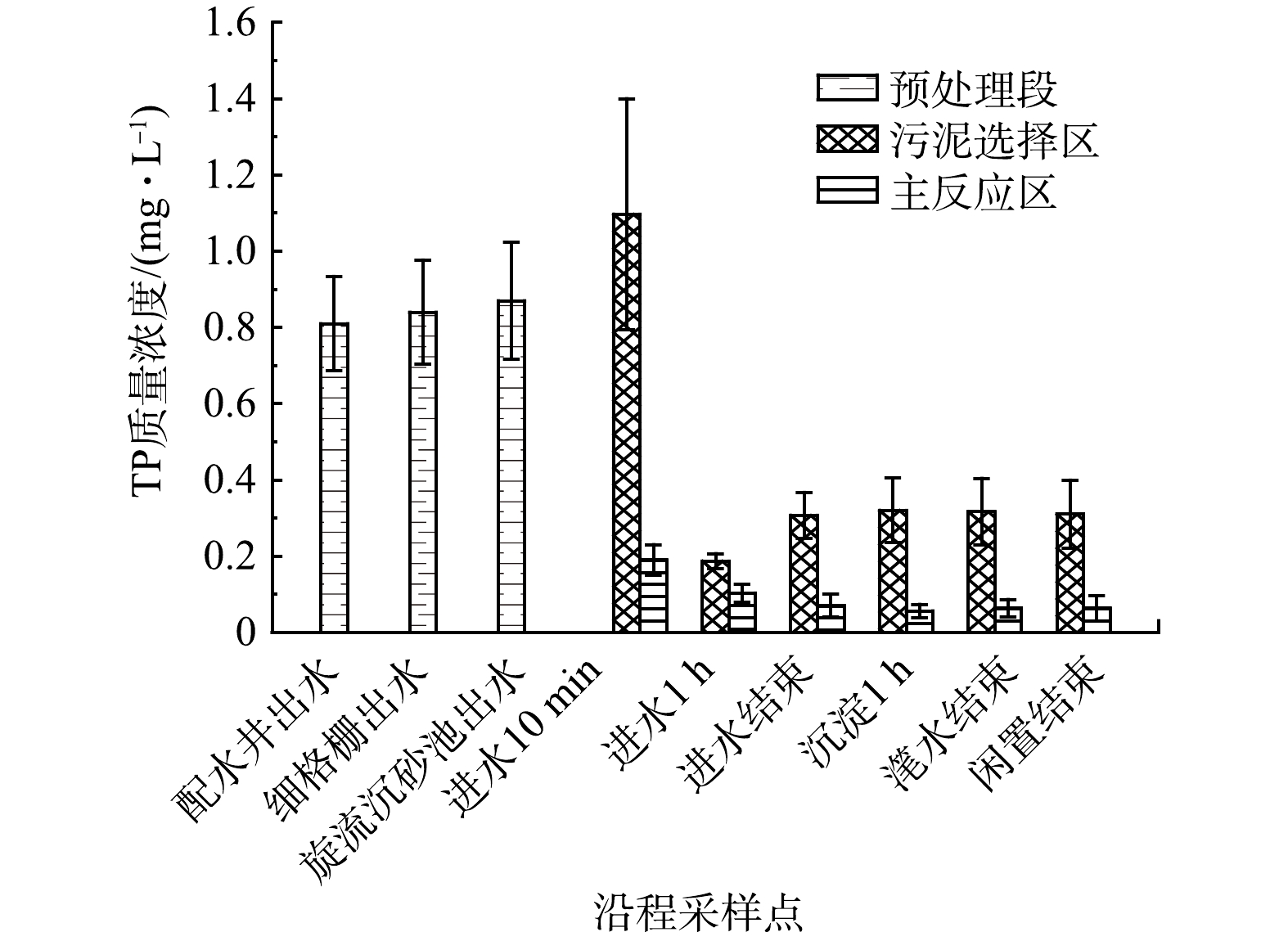
3) TP沿程变化分析。图4揭示了预处理段、污泥选择区和主反应区TP质量浓度变化特征。在预处理段通过物理作用去除污水TP效果不明显,进入生化池初始的TP质量浓度为0.87 mg·L−1。进水10 min由于聚磷菌厌氧释磷导致污泥选择区的TP升至最高值1.1 mg·L−1。进水1 h由于从主反应区内回流的混合液中含有NO3−-N,聚磷菌能以NO3−-N作为电子受体替代氧进行生物除磷[25],使得污泥选择区TP质量浓度显著下降至最低值0.19 mg·L−1。进水结束时生物吸附趋于饱和,部分有机磷分解释放到水体中,伴有进水补充,TP质量浓度升高至0.31 mg·L−1。
由于主反应区进水时曝气充氧,聚磷菌超量吸磷,TP质量浓度显著降低,沉淀1 h TP质量浓度达到最低值0.06 mg·L−1,该过程NO3−-N和TP同步降低,出现反硝化除磷现象。污泥选择区与主反应区在进水结束后TP质量浓度基本不变,在活性污泥DNA检测中发现两个区域均存在蓝藻菌,磷是蓝藻生长的关键营养元素[26],说明维持出水TP质量浓度较低的原因除了聚磷菌好氧吸磷外还包括蓝藻吸磷。对比两个区域进水10 min和进水1 h的TP降低幅度可知,TP的去除主要发生在污泥选择区。将旋流沉砂池出水与主反应区滗水结束的TP质量浓度进行对比,可知CASS生化池可去除99.59%的TP,出水TP质量浓度为0.063 mg·L−1。
-
1)微生物多样性分析。基于OTU数据,从α多样性特点综合分析微生物多样性,各功能区及其不同运行阶段活性污泥的α多样性指数如表2所示。8组样品的覆盖率指数均大于0.99,说明数据的可靠性非常高。微生物相对数量使用OTUs数值来评估,比较不同区域同一阶段,污泥选择区活性污泥的OTUs数值除进水1 h较低外,其余阶段均高于主反应区,污泥选择区微生物总量普遍较多;从同一区域沿程变化看,污泥选择区微生物数量在增多,主反应区的则先降低后升高,与沿程COD变化相似,原因是污水厂中大部分细菌群落与COD呈正相关关系[27]。
Simpson、Shannon和Chao1指数分别反映微生物群落的多样性、均一性和物种总数。Simpson指数显示污泥选择区沿程的微生物多样性先升高后降低,主反应区的先降低后升高,结合沿程污染物变化特征和工艺设计推测,该结果是由于选择区微生物前期吸附较多碳源,促进异养菌的生长使多样性升高,后期自养菌占比大多样性降低,主反应区进水阶段曝气充氧硝化细菌占比大多样性降低,停止曝气后该类菌丰度降低多样性升高。根据Shannon指数,污泥选择区沿程微生物均一性先降低后升高,主反应区的先升高后降低,表明污泥选择区某些功能性微生物数量在运行初期增多,后期减少,主反应区则相反。进水1 h时主反应区Shannon指数最低,可能是由于硝化菌在此时数量最多造成的。Chao1指数对稀有物种比较敏感,污泥选择区的Chao1指数比主反应区高,2个区域沿程Chao1指数在升高,说明选择区的稀有物种数目更丰富,沿程稀有物种增多。
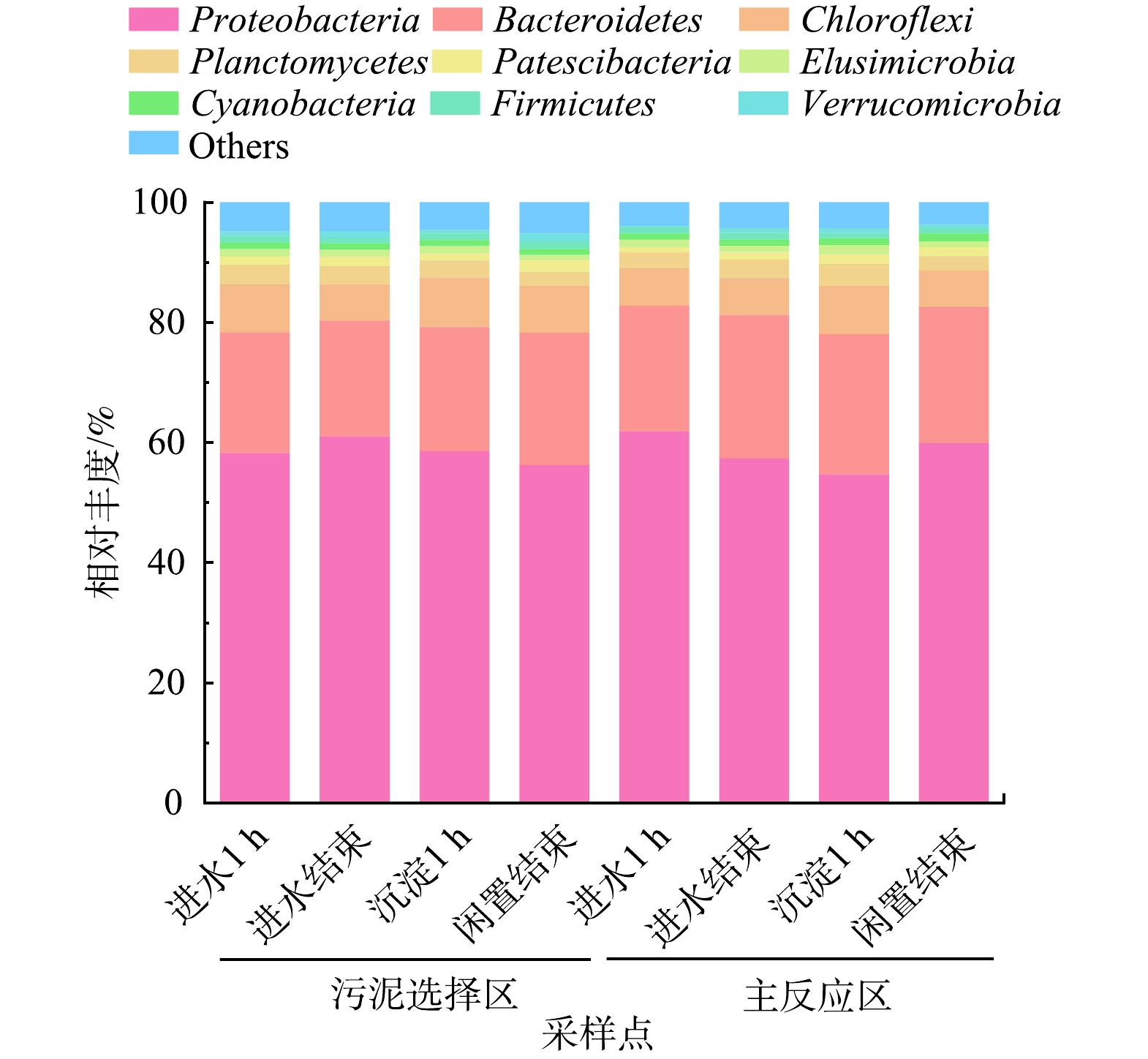
2)门水平微生物分析。由图5可知生化池的优势菌门(平均相对丰度>1%)有:Proteobacteria (变形菌门,58.47%)、Bacteroidetes (拟杆菌门,21.6%)、Chloroflexi (绿弯菌门,7.06%)、Planctomycetes (浮霉菌门,2.91%)、Patescibacteria (髌骨菌门,1.44%)、Elusimicrobia (迷踪菌门,1.15%)、Cyanobacteria (蓝藻菌门,1.07%)和Firmicutes (厚壁菌门,1.02%)。变形菌门是生化池中相对丰度最高的菌门(54.68%~61.87%),在污泥选择区丰度先上升后下降,主反应区则相反,该变化与微生物多样性的变化一致,通常变形菌的生长速度快,代谢途径广,含有大多数反硝化菌[28],表明变形菌门是影响微生物多样性变化的关键菌门,更易在低浓度污水中生存。主反应区的拟杆菌门平均相对丰度(22.69%)比污泥选择区(20.51%)高,拟杆菌门主要参与有机物的降解[29],表明污泥选择区吸附的有机物一部分在主反应区被降解。污泥选择区的绿弯菌门平均相对丰度(7.51%)比主反应区(6.61%)高,绿弯菌门具有良好的除磷功能[30],表明磷的去除主要发生在选择区,该结果也与沿程总磷变化特征相吻合。迷踪菌门为兼养型微生物,可利用O2、NO3−-N或NO2−-N进行呼吸[31],其在主反应区的平均相对丰度(1.2%)较选择区(1.11%)高。蓝藻菌门能积累外源性磷,具有超量吸磷的作用[32],其在污泥选择区的沿程相对丰度持续降低(1.11%~0.97%),而在主反应区则持续升高(0.99%~1.26%),其丰度变化与NO3−-N质量浓度沿程变化趋势一致(见图3 c),推测是由于两个区域沿程的NO3−-N质量浓度变化影响蓝藻菌的丰度变化。
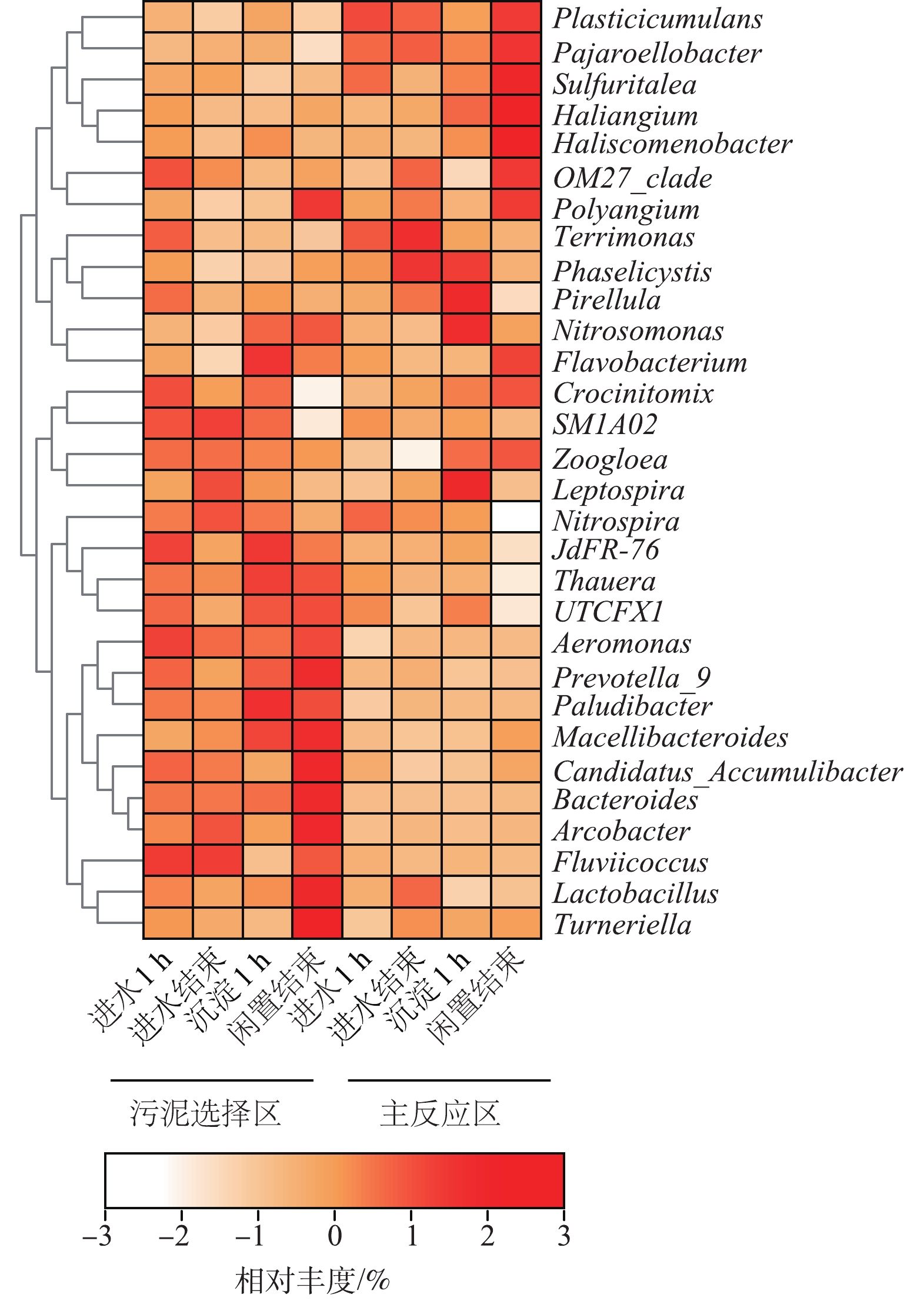
3)属水平微生物分析。为直观地展现低进水浓度生化池不同功能区域的微生物菌属沿程变化特征,在属水平上对活性污泥样品中丰度前30的菌属绘制热图并进行聚类分析,如图6所示。其中有6个优势菌属(最大相对丰度>1%),分别为Zoogloea(动胶菌属)、Sulfuritalea(硫针菌属)、Thauera(陶厄氏菌属)、OM27_clade、UTCFX和Haliangium。污泥选择区运行前期Zoogloea丰度最高(进水1 h,57.18%),沿程持续降低,而在主反应区运行末期其丰度最高(闲置结束,59.11%),Zoogloea能分泌胞外聚合物形成微生物絮状体[33],提高污泥沉降性能,同时其能通过在细胞内形成多聚偏磷酸盐的方式吸收磷[34],表明选择区在进水阶段除磷能力较强,主反应区运行后期依靠该菌属维持较低TP质量浓度,与总磷沿程变化特征一致。Sulfuritalea在有氧条件下能降解有机酸[35],污泥选择区进水阶段Sulfuritalea相对丰度最高(进水结束,2.8%),主反应区进水阶段其丰度逐渐降低(进水结束,2.56%),随后沿程丰度逐渐升高,在闲置结束达到最高(3.99%),该结果进一步表明部分有机物的降解发生在主反应区。Thauera是一种反硝化聚磷菌,在低有机碳源条件具有竞争优势[36],其能够使用硝酸盐作为电子受体降解各种芳香族化合物和卤代衍生物[37],同时可通过代谢羟基丁酸盐积累磷酸盐[38],该菌在去除有机物和脱氮除磷等方面均发挥作用,污泥选择区进水1 h时该菌属丰度较高(1.55%),促进选择区进行反硝化除磷。Haliangium是一种典型的反硝化细菌,与水和土壤环境的氮循环相关[39],在污泥选择区中不是优势菌属,沿程丰度先降低后升高,在主反应区中则持续升高(闲置阶段,1.42%),表明其主要参与主反应区的脱氮。
在污泥选择区沿程中,进水1 h时Zoogloea、Aeromonas(气单胞菌属)、Fluviicoccus和Thauera丰度较高,其中Zoogloea具有除磷功能,Aeromonas与氨氧化、好氧反硝化有关[40],Thauera具有降解有机物与反硝化除磷功能,该阶段主要发生有机物的降解,反硝化除磷和氨氧化;进水结束时SM1A02和Nitrospira(硝化螺旋菌属)丰度较高,其中Nitrospira主导NO2−-N氧化[41],该阶段NO2−-N氧化性能提高;沉淀1 h时Flavobacterium、JdFR-76和Paludibacter丰度较高,Thauera的丰度进一步提高,表明该阶段反硝化性能进一步提升;闲置结束时Polyangium、Prevotella_9(普雷沃氏菌属)、Macellibacteroides、Candidatus_Accumulibacter、Bacteroides(拟杆菌属)、Arcobacter(弓形菌属)、Lactobacillus和Turneriella丰度较高,其中Prevotella_9是一类能强化人工湿地反硝化性能的菌属[42],Bacteroides通常存在于厌氧环境中,是一种氢氧化型自养反硝化细菌[43],Arcobacter在低C/N比和低温下具有较高的脱氮效率[44],Candidatus_Accumulibacter是典型的聚磷菌,Macellibacteroides可将蛋白质和多糖降解为各种有机酸[45]。综上表明,该阶段脱氮菌类型多丰度高,脱氮性能进一步增强,同时存在聚磷菌厌氧释磷和大分子有机物的降解,与沿程耗氧有机物、氮和磷的变化趋势相对应。
在主反应区沿程中,进水1 h Nitrospira丰度较高,该阶段主要发生NO2−-N氧化;进水结束时Terrimonas、Phaselicystis和Lactobacillus丰度较高,Terrimonas适宜在低负荷条件下进行反硝化脱氮[46],Lactobacillus可以降解碳水化合物,产生醋酸、乳酸和乙醇[47],表明该阶段主要发生有机物的降解和反硝化脱氮;沉淀1 h时Pirellula、Nitrosomonas(亚硝化单胞菌属)和Leptospira丰度较高,Nitrosomonas主导氨氧化[48],说明该阶段氨氧化性能提高,与此时NH4+-N质量浓度升高有关;闲置结束时Plasticicumulans、Pajaroellobacter、Sulfuritalea、Haliangium、Haliscomenobacter、OM27_clade、Polyangium、Flavobacterium、Crocinitomix和Zoogloea丰度较高,其中Sulfuritalea降解有机酸,Haliangium主要进行反硝化,Zoogloea具有除磷功能,故该阶段进一步降解有机物和脱氮除磷。
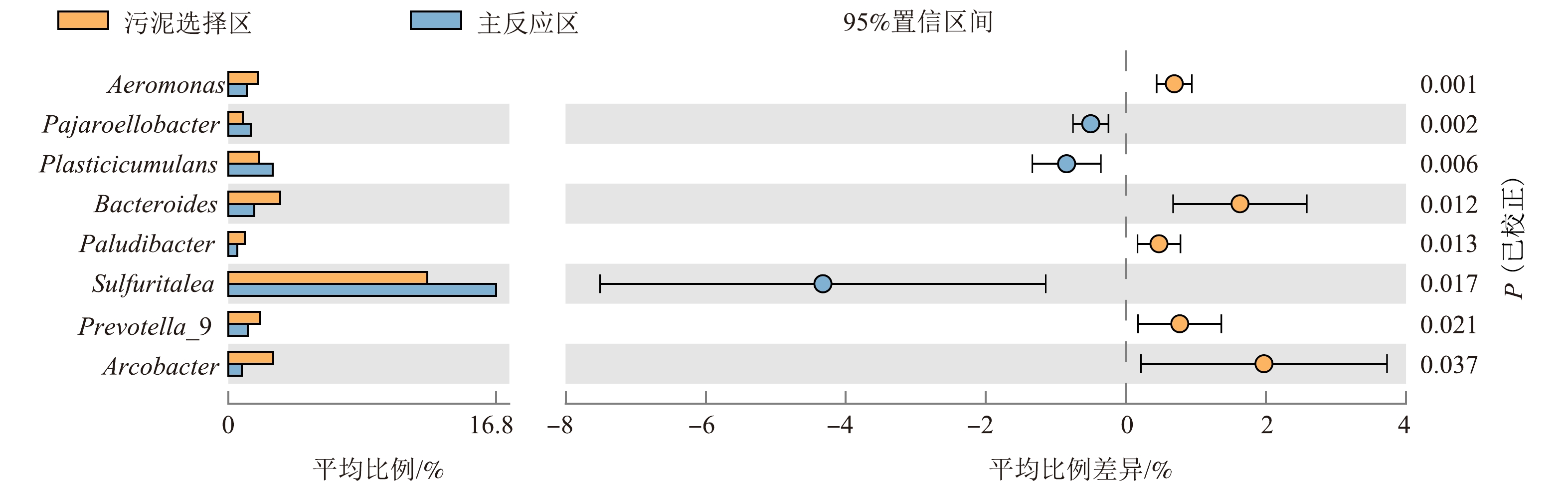
为探究不同功能区域的显著差异微生物菌属,将2个区域丰度前30的微生物菌属信息导入STAMP软件,设置P=0.05过滤条件,输出显著差异菌属,结果如图7所示。由图7可知,与主反应区相比,污泥选择区的显著优势菌属为Aeromonas、Bacteroides、Paludibacter、Prevotella_9和Arcobacter,其中Paludibacter可以分解各种糖类,产生醋酸和丙酸作为反硝化的碳源[49],其余菌属也均与脱氮相关,表明与主反应区相比,污泥选择区主要依赖这5种菌属进行脱氮。在主反应区中,显著优势菌属为Pajaroellobacter、Plasticicumulans和Sulfuritalea,Sulfuritalea主要降解有机酸,进一步表明部分有机物在主反应区被降解。
-
环境因素是影响微生物群落结构的主要因素[50],本研究选取COD、NH4+-N、NO3−-N、TN和TP作为环境因子,结合沿程微生物群落结构变化,利用冗余分析(RDA)研究环境因子与微生物菌属之间的相关性,如图8所示。主轴1和主轴2的特征值分别为52.14%和23.46%,解释了总方差的75.6%。在这些环境变量中NO3−-N的解释度最高(38.92%),对微生物群落结构的塑造影响最显著,NO3−-N是污水处理厂生物脱氮的重要环境因素[51],结合NO3−-N沿程变化可知,其主要在污泥选择区被去除,在主反应区的降解效率低、残留质量浓度高,低浓度生化池主要反硝化菌为Thauera、Haliangium、Bacteroides、Arcobacter、Aeromonas和Prevotella_9,但其丰度占比低,平均丰度分别为1.45%、0.82%、0.48%、0.37%、0.3%和0.32%,反硝化菌数量占比低是限制污水厂脱氮的主要因素,其中Haliangium与TN呈负相关,Thauera、Bacteroides、Arcobacter、Aeromonas和Prevotella_9与NO3−-N呈负相关。NH4+-N和TP的贡献率仅次于NO3−-N,分别位居第2和第3(17.51%和7.76%)。在低进水浓度CASS生化池中,观察到NH4+-N与TP呈正相关,主要是由于好氧时硝化与聚磷同步发生,厌氧时含氮物质分解释放NH4+-N同步聚磷菌释磷的结果。Plasticicumulans和Sulfuritalea与COD呈负相关关系;Candidatus_Accumulibacter与TP呈正相关,受COD影响较大;Nitrospira与TN呈正相关。上述结果进一步佐证沿程功能性微生物具有降解有机物和脱氮除磷的能力,同时可为优化调整工艺参数、富集各功能性微生物类群提供依据。
-
为了获得不同生化区域细菌的功能,采用PICRUSt软件,根据KEGG(http://www.genome.jp/kegg/)数据库预测细菌群落的功能。如图9所示,有6个功能基因组别,包括新陈代谢、人类疾病、细胞工程、生物体系统、遗传信息加工和环境信息加工。根据KEGG功能分类,碳水化合物代谢、氨基酸代谢、辅因子和维生素代谢、萜类和聚酮化合物代谢、异生素降解和代谢、脂质代谢、能量代谢、细胞运输以及遗传信息复制和修饰为低浓度生化池中的主要功能基因,其相对丰度之和在污泥选择区和主反应区分别为81.65%和81.57%,除其他次生代谢物的生物合成外,其余的基因丰度均是选择区大于主反应区。相关研究表明,有机物的添加可显著提高反硝化功能基因的活性,增加反硝化过程相关功能基因的数量[23],结合微生物多样性分析,污泥选择区大部分基因丰度比主反应区高的原因主要是选择区的耗氧有机物(以COD计)浓度高,微生物数量多。
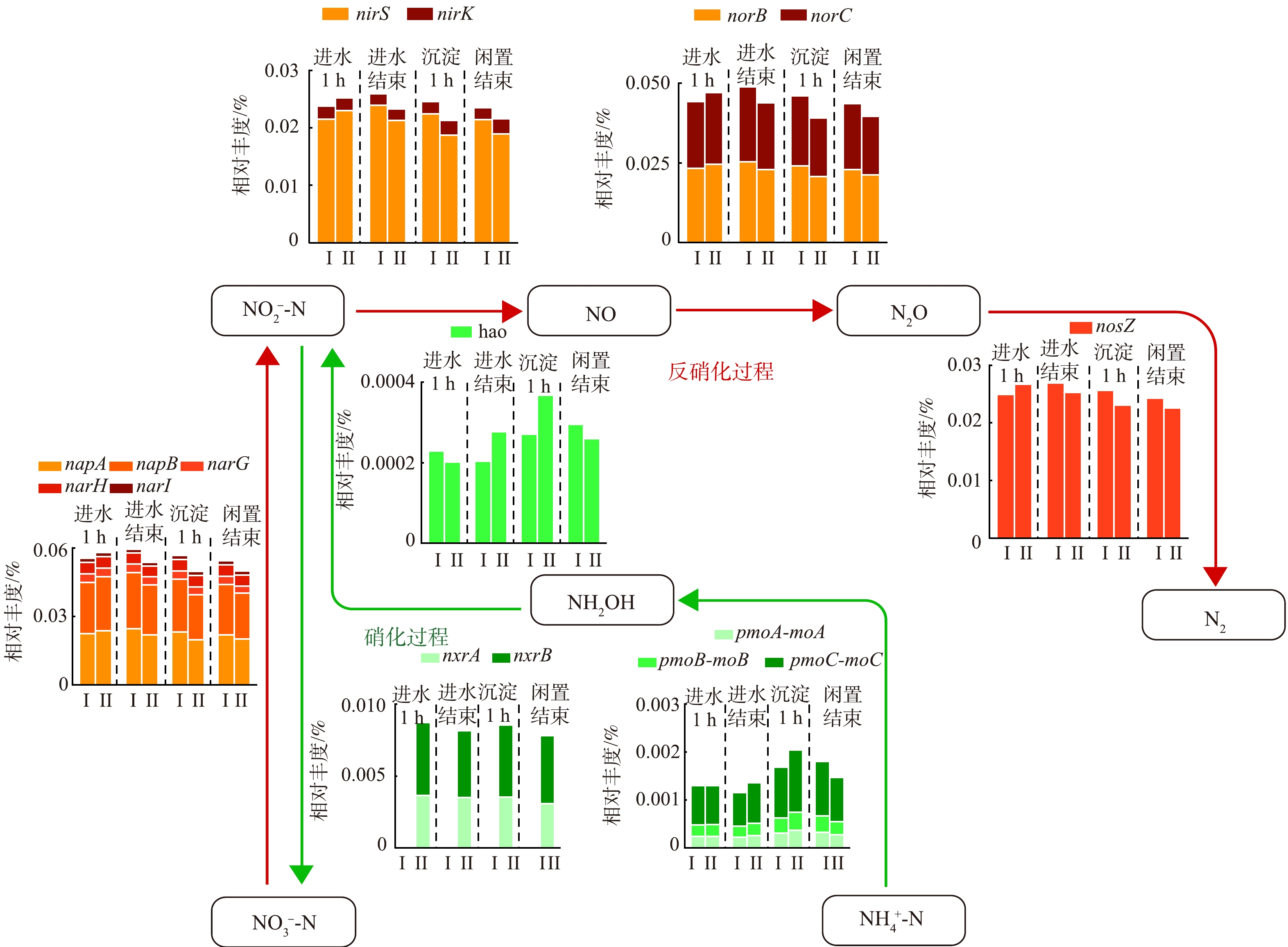
由RDA分析可知NO3−-N的解释度最高,为了进一步研究氮代谢途径,选择了硝化代谢基因(pmoA/B/C-moA/B/C、hao、nxrA/B)和反硝化代谢基因(narG/H/I、napA/B、nirS/K、norB/C、nosZ),污泥选择区和主反应区分别标记为I和II(图10)。在硝化途径中,沉淀1 h时主反应区氨和羟胺氧化功能基因丰度较高(pmoA/B/C-moA/B/C、hao),表明此时硝化性能增强,结合沿程污染物的变化主要是由于NH4+-N质量浓度的升高促进了硝化反应,使该类功能基因丰度上升。主反应区沿程NO2−-N氧化功能基因丰度(nxrA/B)明显比污泥选择区高,短程硝化适宜的溶解氧质量浓度为0.5 mg·L−1[52],当溶解氧为1~2 mg·L−1时,NO2−-N积累率下降,主要进行全程硝化[53],生化池主反应区进水曝气时溶解氧为1~2 mg·L−1,主要以全程硝化为主,而污泥选择区始终处于厌氧或缺氧状态,主要以短程硝化为主,基因nxrA/B丰度低,结合沿程菌属丰度变化可知两个区域的Nitrospira(NOB)丰度差别并不大,说明溶解氧对NOB的丰度影响不大,主要是限制NOB对NO2−-N的氧化功能,该结果与先前的研究报道一致[54]。从反硝化途径看,污泥选择区和主反应区沿程均在进行反硝化,除进水1 h外,其余阶段选择区反硝化基因丰度均比主反应区高,佐证污泥选择区具有较高的脱氮效率。
-
1)根据低进水浓度CASS生化池沿程污染物变化特征,可知耗氧有机物(以COD计)、TN、NO3−-N、TP主要在污泥选择区被吸附降解,NH4+-N主要在主反应区被降解。污泥选择区进水1 h COD和TP值降至最低,由于进水补充、厌氧大分子有机物分解释放和聚磷菌释磷,随后其沿程均有所上升,进水阶段NO3−-N质量浓度始终低于主反应区,进水结束后沿程NO3−-N质量浓度持续下降;主反应区进水阶段NH4+-N质量浓度显著降低。表明污泥选择区主要去除有机物和完成反硝化脱氮和除磷,主反应区主要进行硝化脱氨。总体而言,生化池可去除低浓度污水中56.42%的耗氧有机物(以COD计)、41.71%的TN、77.78%的NH4+-N、99.59%的TP。
2)沿程微生物变化特征结果表明,生化池的优势菌门有变形菌门、拟杆菌门、绿弯菌门、浮霉菌门、髌骨菌门、迷踪菌门、蓝藻菌门和厚壁菌门,污泥选择区微生物总量较主反应区多,变形菌门是影响微生物多样性变化的关键菌门。属水平上,污泥选择区进水1 h Zoogloea、Aeromonas和Thauera丰度较高,除磷、氨氧化和反硝化性能较强;进水结束Nitrospira丰度较高;沉淀1 h Thauera的丰度提高,反硝化性能提升;闲置结束Prevotella_9、Bacteroides、Arcobacter、Macellibacteroides和Candidatus_Accumulibacter丰度较高,脱氮菌类型多丰度高,脱氮性能提高,同时存在大分子有机物的分解释放和聚磷菌厌氧释磷。主反应区进水1 h Nitrospira丰度较高,主要发生硝化NO3−-N质量浓度上升;进水结束Terrimonas和Lactobacillus丰度较高,该过程以反硝化和有机物降解为主;沉淀1 h Nitrosomonas丰度较高,主要发生氨氧化;闲置结束Sulfuritalea、Haliangium、Zoogloea丰度较高,该阶段同步进行有机物降解、反硝化脱氮和除磷。
3)沿程功能性微生物丰度变化与污染物浓度变化相对应,NO3−-N对微生物群落结构的塑造影响最显著(解释度为38.92%)。整体功能基因丰度污泥选择区大于主反应区,氮代谢途径表明沿程主反应区均发生全程硝化反硝化,选择区均发生短程硝化和全程反硝化。除进水1 h外,其余阶段选择区的反硝化功能基因丰度均比主反应区高。
低进水浓度CASS工艺沿程污染物去除特征及微生物群落变化
Pollutant removal characteristics and microbial community changes along the CASS process with low concentration influent
-
摘要: 南方部分城镇污水浓度偏低,而循环式活性污泥法(CASS)能较好地处理低浓度污水,处理性能与微生物群落特征密切相关,但鲜有研究涉及其沿程微生物群落结构变化。本研究选取广东省某CASS城镇污水厂作为典型案例,分析其沿程污染物去除特征和微生物变化,从微生物学角度探讨污染物的去除机理。结果表明:低进水浓度CASS生化池沿程耗氧有机物(以COD计)、TN、NO3−-N、TP主要在污泥选择区被吸附降解,进水1 h COD和TP值降至最低,NH4+-N主要在主反应区被氧化降解,生化池可去除污水中56.42%的耗氧有机物(以COD计)、41.71%的TN、77.78%的NH4+-N、99.59%的TP。生化池主要优势菌门有变形菌门、拟杆菌门、绿弯菌门和浮霉菌门,变形菌门是影响微生物多样性变化的关键菌门。属水平上,进水1 h选择区Zoogloea、Aeromonas和Thauera丰度较高,主反应区Nitrospira丰度较高;进水结束选择区Nitrospira丰度较高,主反应区Terrimonas和Lactobacillus丰度较高;沉淀1 h选择区Thauera丰度提高,主反应区Nitrosomonas丰度较高,主要发生氨氧化;闲置结束选择区脱氮菌类型多丰度高,主反应区Sulfuritalea、Haliangium、Zoogloea丰度较高。沿程功能性微生物丰度变化与污染物浓度变化相对应。NO3−-N对微生物群落结构的塑造影响最显著(解释度为38.92%)。氮代谢途径表明沿程主反应区均发生全程硝化反硝化,选择区均发生短程硝化和全程反硝化,除进水1 h外,其余阶段选择区的反硝化功能基因丰度均比主反应区高。Abstract: The concentration of sewage in some cities in southern China is low, while it can be treated by cyclic activated sludge system (CASS), and the treatment performance is closely related to the microbial community characteristics, but few studies had addressed the changes in microbial community structure along the process. In this study, a CASS urban wastewater plant in Guangdong Province was selected as a typical case to analyse the pollutant removal characteristics and microbial changes along the process, and to explore the pollutant removal mechanism from a microbiological perspective. The results showed that oxygen-consuming organic matter (COD), TN, NO3−-N and TP were mainly adsorbed and degraded in the sludge selection zone along the CASS biochemical tank with low influent concentration, and COD and TP values in the influent decreased to minimum at 1 hour, while NH4+-N was mainly oxidized and degraded in the main reaction zone. Biochemical tank could remove 56.42% of oxygen-consuming organic matter (COD), 41.71% of TN, 77.78% of NH4+-N, and 99.59% of TP from the sewage. The main dominant bacterial phyla in the biochemical tank were Amoebacteria, Bacteroidetes, Green Campylobacter and Phyllobacterium, of which Amoebacteria was the key phylum influencing the microbial diversity. At the genus level, high abundance of Zoogloea, Aeromonas and Thauera occurred in the selection zone, and high abundance of Nitrospira occurred in the main reaction zone after 1 hour feeding. At the end of feeding, high abundance of Nitrospira occurred in the selection zone, high abundance of Terrimonas and Lactobacillus occurred in the main reaction zone. After 1 hour of sedimentation, the abundance of Thauera increased in the selection zone and high abundance of Nitrosomonas occurred in the main reaction zone, where ammonia oxidation mainly occurred. At the end of idle, high abundance and types of denitrifying bacteria occurred in selection zone, and high abundance of Sulfuritalea, Haliangium and Zoogloea occured in the main reaction zone. Changes in the abundance of functional microorganisms along the process corresponded to changes in pollutant concentrations. NO3−-N had the most significant effect on shaping the structure of the microbial community (38.92% explained). The nitrogen metabolic pathway showed that nitrification and denitrification occurred along the main reaction zone, short-course nitrification and full denitrification occurred in the selection zone, and the abundance of denitrification functional genes was higher in the selection zone than in the main reaction zone at all stages except for 1 hour feeding.
-

-
表 1 月均水质指标
Table 1. Water quality index
项目 COD/(mg·L−1) BOD5/(mg·L−1) SS/(mg·L−1) NH4+-N/(mg·L−1) TN/(mg·L−1) TP/(mg·L−1) 进水 67.0~97.0 7.9~30.5 44.0~86.0 7.2~12.6 10.4~16.5 1.0~1.7 出水 11.0~14.0 0.3~2.5 3.0~4.0 0.2~3.2 3.1~7.9 0.1~0.3 去除率 85.2% 94.9% 94.1% 86.7% 64.0% 85.9% 表 2 微生物Alpha多样性指数
Table 2. Alpha diversity index of microorganisms
功能区域 运行阶段 Chao1 OTUs Shannon Simpson 覆盖率 污泥选择区 进水1 h 2 246.7 1 229 7.41 0.040 0.991 进水结束 2 294.5 1 280 7.2 0.056 0.991 沉淀1 h 2 311.4 1 290 7.3 0.047 0.991 闲置结束 2 403.5 1 316 7.49 0.038 0.991 主反应区 进水1 h 2 170.6 1 252 7.04 0.056 0.991 进水结束 2 218.7 1 214 7.26 0.048 0.991 沉淀1 h 2 279.4 1 251 7.58 0.029 0.992 闲置结束 2 273.4 1 287 7.54 0.030 0.992 -
[1] 杨雄, 彭永臻, 宋姬晨, 等. 进水中碳水化合物分子大小对污泥沉降性能的影响[J]. 中国环境科学, 2015, 35(2): 448-456. [2] 孙雅雯, 张建华, 彭永臻, 等. 外加碳源类型对A~2/O-BCO系统脱氮除磷性能的影响[J]. 化工学报, 2018, 69(8): 3626-3634. [3] 李梅, 朱明璇, 王洪波, 等. 污泥对有机物的吸附动力学试验及模型构建[J]. 安全与环境学报, 2019, 19(6): 2150-2158. doi: 10.13637/j.issn.1009-6094.2019.06.038 [4] XU Z, XIONG L, LI H, et al. Pollution characterization and source analysis of the wet weather discharges in storm drainages[J]. Desalination and Water Treatment, 2017, 72(4): 169-181. [5] 刘文强, 郁达伟, 郑利兵, 等. 南昌某城市污水处理厂进水浓度低成因分析研究[J]. 环境科学学报, 2022, 42(9): 141-150. doi: 10.13671/j.hjkxxb.2022.0088 [6] 李兰娟, 钱言, 陈天放, 等. 我国南方地区城镇污水处理厂进水低浓度原因分析及对策建议[C]//中国环境科学学会2021年科学技术年会论文集. 天津, 2021: 228-233. [7] 邵林广. 南方城市污水处理厂实际运行水质远小于设计值的原因及其对策[J]. 给水排水, 1999(2): 15-17. doi: 10.3969/j.issn.1002-8471.1999.02.004 [8] 邱鸿荣, 罗建中, 郑国辉. 城市污水处理厂进水浓度低原因及其对策的研究[J]. 广东化工, 2010, 37(12): 93-94. doi: 10.3969/j.issn.1007-1865.2010.12.045 [9] GUO J H, PENG Y Z, WANG S Y, et al. Filamentous and non-filamentous bulking of activated sludge encountered under nutrients limitation or deficiency conditions[J]. Chemical Engineering Journal, 2014, 255: 471-478. doi: 10.1016/j.cej.2014.04.098 [10] 袁剑辉, 董超, 谢明鸿, 等. CASS工艺在低浓度进水条件下的运行优化[J]. 中国给水排水, 2014, 30(16): 120-124. doi: 10.19853/j.zgjsps.1000-4602.2014.16.031 [11] 李芷昕, 李惠平, 沈康, 等. 广东省某污水处理厂CASS工艺运行优化效果评价[C]//中国环境科学学会2022年科学技术年会论文集. 2022: 29-34. [12] 柴宗学. CASS工艺在城市污水处理厂运行参数的优化及应用的研究[D]. 哈尔滨: 哈尔滨工业大学, 2014. [13] SHAOPO W, JINGJIE Y, TIANLAN W, et al. Applying real-time control for achieving nitrogen removal via nitrite in a lab-scale CAST system[J]. Environmental Technology, 2012, 33(10): 1133-1140. doi: 10.1080/09593330.2011.610362 [14] 杨赵军, 王宁. 循环活性污泥工艺处理中原地区农村生活污水研究[C]//河海大学, 南阳市人民政府, 南阳师范学院, 南水北调集团中线公司, 2022(第十届)中国水生态大会论文集, 2022: 838-850. [15] 李柏林, 张智, 陈杰云, 等. 三峡库区污水厂典型工艺的SND脱氮技术研究[J]. 中国给水排水, 2012, 28(11): 1-5. doi: 10.3969/j.issn.1000-4602.2012.11.001 [16] WANG Y Y, ZHANG Z X, YAN M, et al. Impact of operating conditions on nitrogen removal using cyclic activated sludge technology (CAST)[J]. Journal of Environmental Science and Health Part A, Toxic/Hazardous Substances & Environmental Engineering, 2010, 45(3): 370-376. [17] 蒋礼源. 微生物絮凝吸附处理城市污水实验研究[D]. 合肥: 合肥工业大学, 2007. [18] LIANG W H, YU C, REN H Q, et al. Minimization of nitrous oxide emission from CASS process treating low carbon source domestic wastewater: Effect of feeding strategy and aeration rate[J]. Bioresource Technology, 2015, 198: 172-80. doi: 10.1016/j.biortech.2015.08.075 [19] WU L W, NING D L, ZHANG B, et al. Global diversity and biogeography of bacterial communities in wastewater treatment plants[J]. Nature Microbiology, 2019, 4(7): 1183-1195. doi: 10.1038/s41564-019-0426-5 [20] GAO F, NAN J, ZHANG X H, et al. A dynamic modelling of nutrient metabolism in a cyclic activated sludge technology (CAST) for treating low carbon source wastewater[J]. Environmental Science and Pollution Research International, 2017, 24(20): 17016-17030. doi: 10.1007/s11356-017-9277-x [21] 国家环境保护总局. 水和废水监测分析方法 第4版 [M]. 北京: 中国环境科学出版社, 2002. [22] 王元元, 刘和, 符波, 等. 活性污泥吸附联合发酵产酸资源化回收污水碳源[J]. 环境工程学报, 2017, 11(12): 6276-6281. doi: 10.12030/j.cjee.201702067 [23] TAO R, STEVEN A W, LIANG Y C, et al. Nitrous oxide emission and denitrifier communities in drip-irrigated calcareous soil as affected by chemical and organic fertilizers[J]. Science of the Total Environment, 2018, 612: 739-749. doi: 10.1016/j.scitotenv.2017.08.258 [24] 胡雪峰, 高效江, 陈振楼. 上海市郊河流底泥氮磷释放规律的初步研究[J]. 上海环境科学, 2001, 20(2): 5. [25] 邹华, 阮文权, 陈坚. 硝酸盐作为生物除磷电子受体的研究[J]. 环境科学研究, 2002(3): 38-41. doi: 10.3321/j.issn:1001-6929.2002.03.011 [26] CAO X, WANG Y, HE J, et al. Phosphorus mobility among sediments, water and cyanobacteria enhanced by cyanobacteria blooms in eutrophic Lake Dianchi[J]. Environmental Pollution, 2016, 219: 580-587. doi: 10.1016/j.envpol.2016.06.017 [27] ZHANG L, SHEN Z, FANG W K, et al. Composition of bacterial communities in municipal wastewater treatment plant[J]. Science of the Total Environment, 2019, 689: 1181-1191. doi: 10.1016/j.scitotenv.2019.06.432 [28] JI B H, JIANG M, YANG Y, et al. High treatment effectiveness for secondary effluent in Fe-C microelectrolysis constructed wetlands with electron donor supplementation[J]. Journal of Cleaner Production, 2022, 342: 130934. doi: 10.1016/j.jclepro.2022.130934 [29] THOMAS F, HEHEMANN J H, REBUFFET E, et al. Environmental and gut bacteroidetes: The food connection[J]. Frontiers in Microbiology, 2011, 2: 93. [30] CAROLINE K, LEVANTESI C, ARJAN B, et al. Identity, abundance and ecophysiology of filamentous Chloroflexi species present in activated sludge treatment plants[J]. Fems Microbiology Ecology, 2007, 59(3): 671-682. doi: 10.1111/j.1574-6941.2006.00251.x [31] MÉHEUST R, CASTELLE C J, MATHEUS C P B, et al. Groundwater Elusimicrobia are metabolically diverse compared to gut microbiome Elusimicrobia and some have a novel nitrogenase paralog[J]. Isme Journal, 2020, 14(12): 2907-2922. doi: 10.1038/s41396-020-0716-1 [32] 史小丽, 王凤平, 蒋丽娟, 等. 光照时间对外源性磷在模拟水生态系统中迁移的影响[J]. 环境科学, 2003(1): 40-45. doi: 10.3321/j.issn:0250-3301.2003.01.006 [33] LARSEN P, NIELSEN J L, OTZEN D, et al. Amyloid-like adhesins produced by floc-forming and filamentous bacteria in activated sludge[J]. Applied and Environmental Microbiology, 2008, 74(5): 1517-1526. doi: 10.1128/AEM.02274-07 [34] MCMAHON K D, JENKINS D, KEASLING J D. Polyphosphate kinase genes from activated sludge carrying out enhanced biological phosphorus removal[C]//Annual Conference & Exposition of Water Environment Federation. 2001. [35] CHEN C M, MING J, BRANDON A Y, et al. Characterization of aerobic granular sludge used for the treatment of petroleum wastewater[J]. Bioresource Technology, 2019, 271: 353-359. doi: 10.1016/j.biortech.2018.09.132 [36] REN T, CHI Y L, WANG Y, et al. Diversified metabolism makes novel Thauera strain highly competitive in low carbon wastewater treatment[J]. Water Research, 2021, 206: 117742. doi: 10.1016/j.watres.2021.117742 [37] MECHICHI T, STACKEBRANDT E, GAD'ON N, et al. Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions, and description of Thauera phenylacetica sp. nov., Thauera aminoaromaticasp. nov., and Azoarcus buckelii sp. nov.[J]. Archives of Microbiology, 2002, 178(1): 26-35. doi: 10.1007/s00203-002-0422-6 [38] WANG Q K, HE J Z. Complete nitrogen removal via simultaneous nitrification and denitrification by a novel phosphate accumulating Thauera sp. strain SND5[J]. Water Research, 2020, 185: 116300. doi: 10.1016/j.watres.2020.116300 [39] HE S, DING L L, LI K, et al. Comparative study of activated sludge with different individual nitrogen sources at a low temperature: Effluent dissolved organic nitrogen compositions, metagenomic and microbial community[J]. Bioresource Technology, 2018, 247: 915-923. doi: 10.1016/j.biortech.2017.09.026 [40] WU P, ZHANG X X, WANG C C, et al. Feasibility of applying intermittent aeration and baffles for achieving granular nitritation in a continuous short-cut denitrifying phosphorus removal system[J]. Science of the Total Environment, 2020, 715: 137023. doi: 10.1016/j.scitotenv.2020.137023 [41] CHIELLINI C, MUNZ G, PETRONI G, et al. Characterization and comparison of bacterial communities selected in conventional activated sludge and membrane bioreactor pilot plants: a focus on Nitrospira and Planctomycetes bacterial phyla[J]. Current Microbiology, 2013, 67(1): 77-90. doi: 10.1007/s00284-013-0333-6 [42] JIA L X, SUN H M, ZHOU Q, et al. Pilot-scale two-stage constructed wetlands based on novel solid carbon for rural wastewater treatment in southern China: Enhanced nitrogen removal and mechanism[J]. Journal of Environmental Management, 2021, 292: 112750. doi: 10.1016/j.jenvman.2021.112750 [43] WU G M, LI Z J, HUANG Y, et al. Electrochemically assisted sulfate reduction autotrophic denitrification nitrification integrated (e-SANI®) process for high-strength ammonium industrial wastewater treatment[J]. Chemical Engineering Journal, 2020, 381: 122707. doi: 10.1016/j.cej.2019.122707 [44] CHEN X, ZHANG Q, ZHU Y N, et al. Response of rotating biological contactor started up by heterotrophic nitrification-aerobic denitrification bacteria to various C/N ratios[J]. Chemosphere, 2022, 291: 133048. doi: 10.1016/j.chemosphere.2021.133048 [45] JABARI L, GANNOUN H, CAYOL J, et al. Macellibacteroides fermentans gen. nov., sp. nov., a member of the family Porphyromonadaceae isolated from an upflow anaerobic filter treating abattoir wastewaters[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62: 2522-2527. doi: 10.1099/ijs.0.032508-0 [46] LI Y X, PAN Z Z, LIAO J S, et al. Micro-aeration and low influent C/N are key environmental factors for achieving ANAMMOX in livestock farming wastewater treatment plants[J]. Water Research, 2023, 120141. [47] LI Y Z, CHEN Z, PENG Y Y, et al. Deeper insights into the effects of substrate to inoculum ratio selection on the relationship of kinetic parameters, microbial communities, and key metabolic pathways during the anaerobic digestion of food waste[J]. Water Research, 2022, 217: 118440. doi: 10.1016/j.watres.2022.118440 [48] NORISUKE U, HIROTSUGU F, YOSHITERU A, et al. Isolation of Nitrospira belonging to Sublineage II from a Wastewater Treatment Plant[J]. Microbes and Environments, 2013, 28(3): 346-353. doi: 10.1264/jsme2.ME13042 [49] UEKI A, AKASAKA H, SUZUKI D, et al. Paludibacter propionicigenes gen. nov., sp. nov., a novel strictly anaerobic, Gram-negative, propionate-producing bacterium isolated from plant residue in irrigated rice-field soil in Japan[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 39-44. doi: 10.1099/ijs.0.63896-0 [50] LAURENCE H, MAURO T, JAKOB Z, et al. Composition of bacterial and archaeal communities in freshwater sediments with different contamination levels (Lake Geneva, Switzerland)[J]. Water Research, 2011, 45(3): 1213-1228. doi: 10.1016/j.watres.2010.11.018 [51] AHMAD H A, AHMAD S, GAO L J, et al. Energy-efficient and carbon neutral anammox-based nitrogen removal by coupling with nitrate reduction pathways: A review[J]. Science of the Total Environment, 2023, 889: 164213. doi: 10.1016/j.scitotenv.2023.164213 [52] 杨庆, 杨玉兵, 杨忠启, 等. 溶解氧对短程硝化稳定性及功能菌群的影响[J]. 中国环境科学, 2018, 38(9): 3328-3334. doi: 10.3969/j.issn.1000-6923.2018.09.016 [53] 马勇, 陈伦强, 彭永臻, 等. 实际生活污水短程/全程硝化反硝化处理中试研究[J]. 环境科学, 2006(12): 2477-2482. doi: 10.3321/j.issn:0250-3301.2006.12.020 [54] KIM T, HITE M, ROGACKI L, et al. Dissolved oxygen concentrations affect the function but not the relative abundance of nitrifying bacterial populations in full-scale municipal wastewater treatment bioreactors during cold weather[J]. Science of the Total Environment, 2021, 781: 146719. doi: 10.1016/j.scitotenv.2021.146719 -



 下载:
下载: