-
赤泥是铝土矿提取氧化铝过程中产生的一种盐碱化副产物[1]。全球每年产生赤泥 (1.2~1.5)×108 t,截至2020年,全球赤泥库存已达40×108 t[2]。尽管目前已有不少关于赤泥综合利用的尝试,如有价金属回收、开发建筑材料、环境修复等,但全球的赤泥利用率仍不足10%[3],这将导致大量的赤泥只能通过筑坝堆存[4]。由于赤泥具有高盐碱性、腐蚀性、浸出毒性等不良特性,其在堆存过程中易对周边水体、土壤、植被等造成严重破坏[5]。例如,赤泥中的碱性物质迁移至水体和土壤环境会对水生动物和植物产生毒性,从而抑制其正常生长甚至导致其死亡[6-7]。我国是全球最大的氧化铝生产和消费国[8],氧化铝生产过程中产生的大量赤泥堆存造成的环境安全问题已严重制约氧化铝工业的可持续发展[9]。因此,消除赤泥的潜在环境风险刻不容缓。
近年来,植被恢复已成为消除赤泥潜在环境风险的有效途径[10]。由于赤泥具有碱性强、养分贫瘠、物理结构差等极端立地特征,致使在赤泥堆场上成功开展植被恢复较为困难[11]。采取基质改良措施将赤泥转化为类土基质是决定赤泥堆场能否成功开展植被恢复的关键[12]。其中,团聚体是指示赤泥土壤化的重要指标,其作为最基本的土壤系统单元活跃地参与地球表层生态系统过程[13-14]。团聚体对土壤的物理、化学和生物过程起着关键的调控作用。目前,关于不同类型有机-无机改良剂对赤泥理化性质、微生物特性、团聚体结构与稳定性影响的研究已有较多报道[15-17]。
研究表明,由于不同粒径团聚体颗粒与有机物和矿物质的结合方式不同[18],致使不同粒径团聚体中酶活性、微生物群落分布存在空间分异性[19],进而影响团聚体中养分的分布及其生物有效性。赤泥团聚体结构及其有机碳分布受风化过程和植被的影响[20],但关于改良剂与植被联合修复对赤泥团聚体中养分、酶活性、微生物空间分异特征影响的研究鲜有报道,这将制约对赤泥土壤化过程中养分生物地球化学过程以及能否在赤泥上成功建立稳定植被群落的认识。本研究拟通过开展盆栽修复实验,探究改良剂与植被联合修复下赤泥团聚体中养分、酶活性、微生物群落的空间分异特征及其彼此间的关系,旨在为深入理解改良剂与植被联合修复下赤泥土壤化过程中养分迁移转化特征及其潜在影响机理提供参考。
-
2021年7月在位于贵州省清镇市站街镇的贵州广铝铝业有限公司的赤泥堆场 (106°20′15″E,26°39′36″N) 采集赤泥样品。将采集的新鲜赤泥自然风干后去除杂物,研磨过2 mm筛备用。木醋液pH为2.99、电导率 (EC) 为4.57 mS·cm−1;磷石膏采自贵州省福泉市瓮福磷石膏堆场,其组分为CaSO4·2H2O;菌渣采自某食用菌生产基地;鱼粪采自某水产养殖基地;黑麦草种子购于某园林公司。赤泥与改良剂的理化性质见表1。
-
共设5个处理组:1) 赤泥+纯水+黑麦草 (R) ;2) 赤泥+2%木醋液+2%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA1) ;3) 赤泥+2%木醋液+5%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA2) ;4) 赤泥+5%木醋液+2%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA3) ;5) 赤泥+5%木醋液+5%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA4) 。每个处理设置3个平行。不同体积分数的木醋液为其原液用去离子水稀释所得。磷石膏、菌渣、鱼粪的添加量为赤泥质量的占比。赤泥盆栽修复实验方法为:分别称取1 500 g赤泥置于一系列塑料 (口径和高度分别为20、17 cm) ,按液固比为1∶2.5分别添加不同体积分数的木醋液和纯水对赤泥进行碱性调控,稳定陈化3 d后,再分别添加不同改良剂 (磷石膏、菌渣、鱼粪) 与赤泥混合均匀。每盆播种黑麦草种子50粒,定期浇水,维护植物生长 (其中,对照组中黑麦草未正常发芽) ,于室外遮雨棚中培养90 d后,采集各处理组的赤泥样品。采用干筛法[21]将赤泥筛分为1~2 mm、0.5~1 mm、0.25~0.5 mm、<0.25 mm的团聚体。将获得的赤泥团聚体样品分为3部分,一部分保存于−80 ℃冰箱用于分析微生物群落组成及多样性,一部分置于4 ℃冰箱保存用于测定酶活性,一部分于室内自然风干、研磨过筛后用于测定有机质与养分质量分数。
-
赤泥团聚体养分与有机质质量分数参照鲁如坤[22]的方法测定,采用酶试剂盒 (购自苏州科铭生物技术有限公司) 并参照关松荫等[23]的方法测定赤泥团聚体酶活性。将赤泥样品送至上海某检测公司测定微生物群落组成及多样性,测定方法的概述详见参考文献[24]。
-
采用SPSS 22.0对各处理组进行单因素方差分析 (One-Way ANOVA) ,各组间多重比较采用LSD法,显著水平为P<0.05;采用Origin 2021作图。微生物数据分析方法参考TAN等[24]的研究。
-
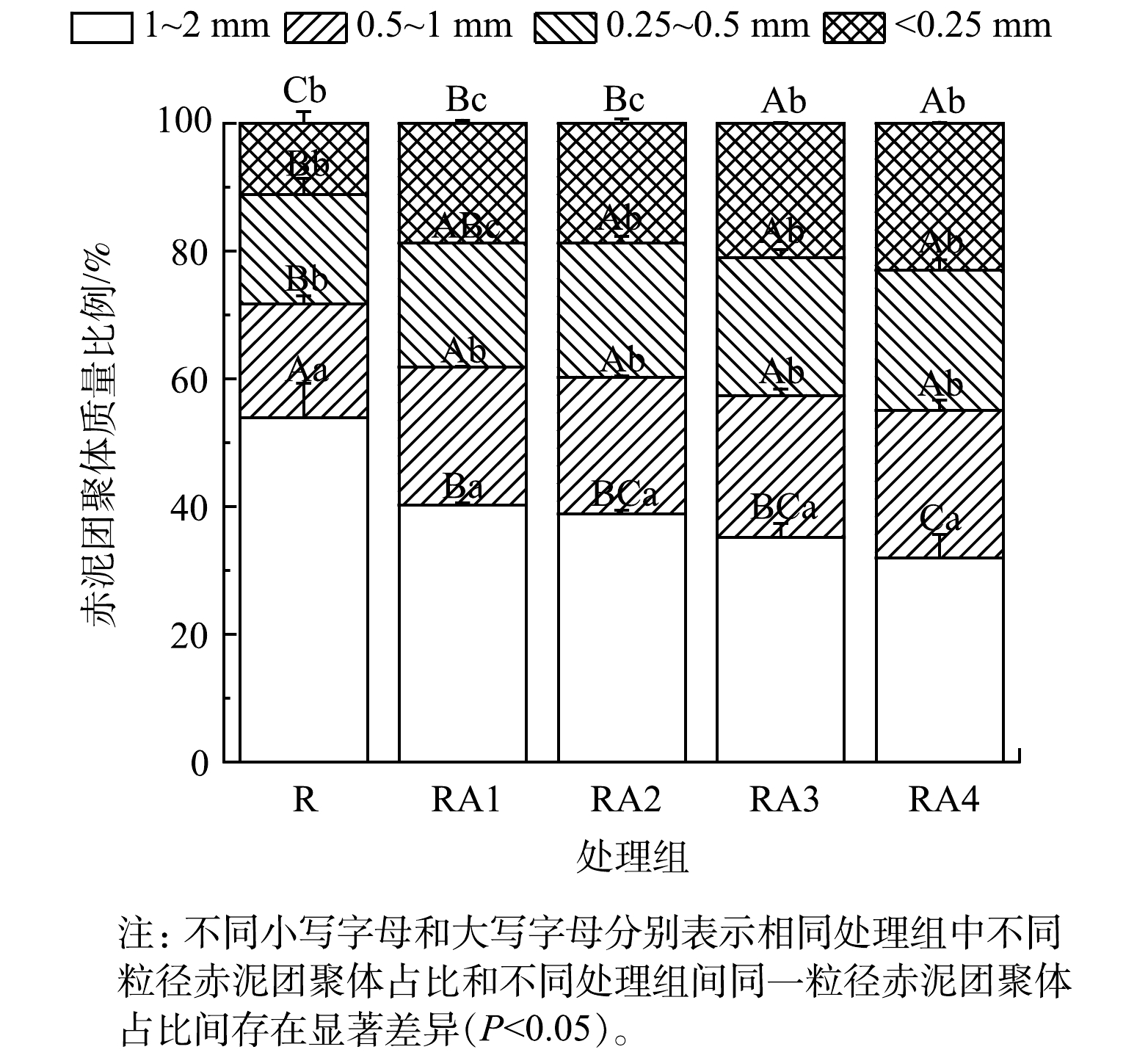
赤泥团聚体组成特征见图1。R组团聚体粒径主要集中在1~2 mm,大团聚体 (2~0.25 mm) 与微团聚体 (<0.25 mm) 占比分别为87.27%、10.89%。与R组相比,RA1、RA2、RA3、RA4处理组大团聚体 (2~0.25 mm) 占比分别降低至80.42%、79.78%、78.17%、75.84%,微团聚体 (<0.25 mm) 占比分别增加至18.56%、18.41%、20.77%、22.64%。总体上,大团聚体占比均高于微团聚体,其原因可能包括:有机改良剂及植物根系分泌物中新鲜有机碳胶结形成的不稳定大团聚体易破坏为微团聚体[25];随着赤泥生境的改善,微生物群落及酶活性增加促进赤泥中输入的有机物分解,导致大团聚体稳定性丧失,释放稳定的微团聚体[26-27]。同时,由于赤泥中交换性Na+的半径较小,导致其具有较大的水合半径,造成水合斥力增大,从而使胶粒间引力减弱,破坏赤泥团聚体结构[28-30]。赤泥中Fe3+的还原[31]、植物根系的破坏[32]和植物细根与菌丝形成核的分解[33]也可能导致微团聚体的形成。
-
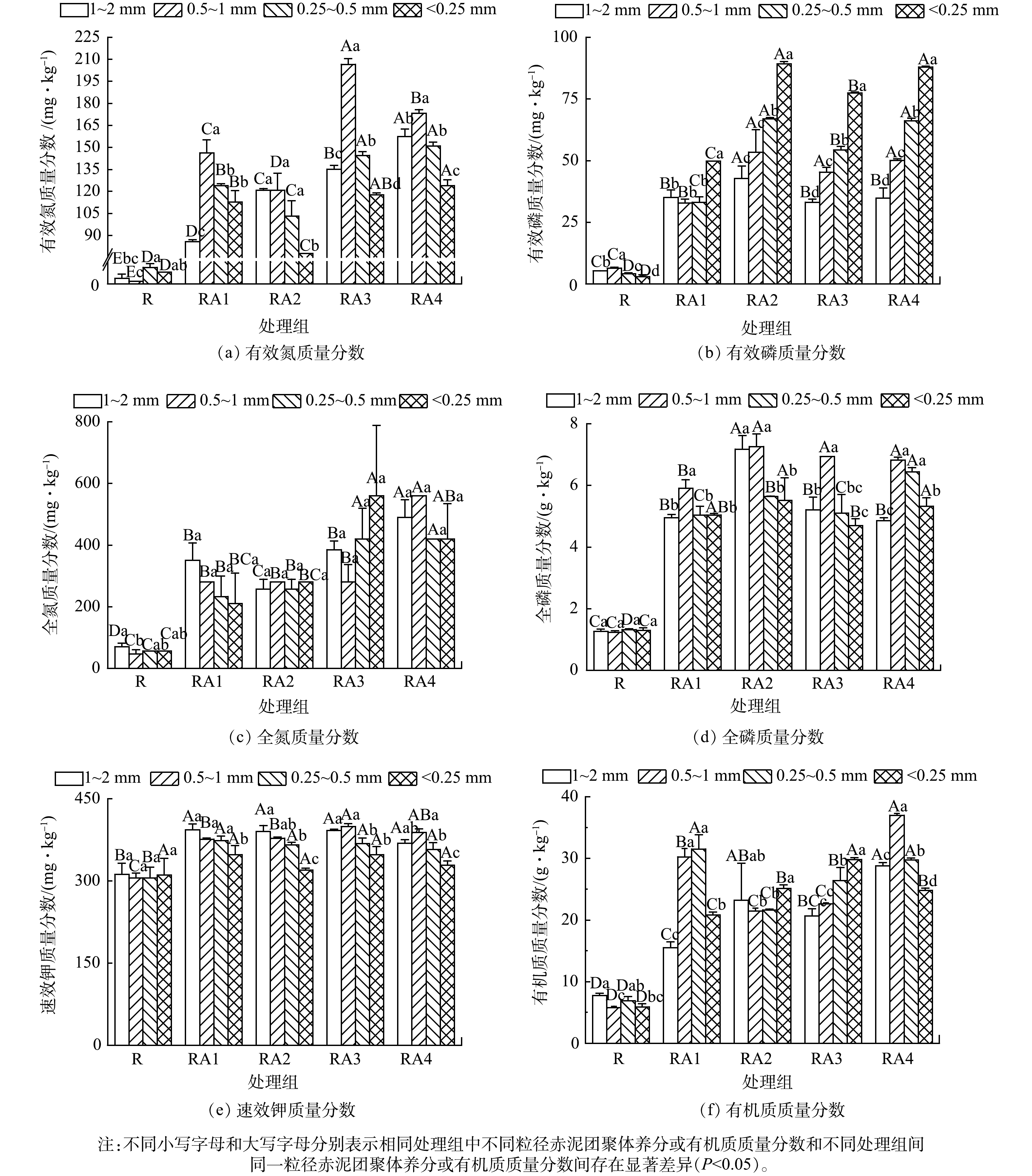
赤泥团聚体中养分及有机质质量分数空间分异特征见图2。与R组相比,RA1、RA2、RA3、RA4处理组中不同粒径团聚体的养分质量分数显著增加,有效氮、有效磷、全氮、全磷、速效钾、有机质的质量分数分别增加8.29~129.00、4.17~29.39、2.67~11.00、2.61~4.89、0.03~0.31、1.00~5.38倍。整体上,有机质主要分布于<1 mm团聚体 (图2(f)) ,这是由于小粒径团聚体中吸附的大量有机质通过胶结作用附着在大团聚体表面[34-35],由于1~2 mm团聚体易受破坏,增加<1 mm团聚体的质量比例,导致有机质主要分布于<1 mm团聚体。有效氮、有效磷、全氮、全磷、速效钾等亦主要分布于<1 mm团聚体 (图2(a)~图2(e)) ,其原因可能是由于微生物的分解转化过程造成营养物质分布的差异[36]。此外,有机质的矿化作用也是增加团聚体中氮、磷、钾质量分数的重要原因[37]。全磷 (图2(d)) 、有效磷 (图2(b)) 分别主要分布在0.5~1 mm、<0.25 mm团聚体中,2者分布特征存在差异可能与赤泥微团聚体中高浓度的铁铝氧化物吸附磷素并增加磷的有效性有关[38-39]。整体上,养分及有机质主要分布于<1 mm团聚体。
-
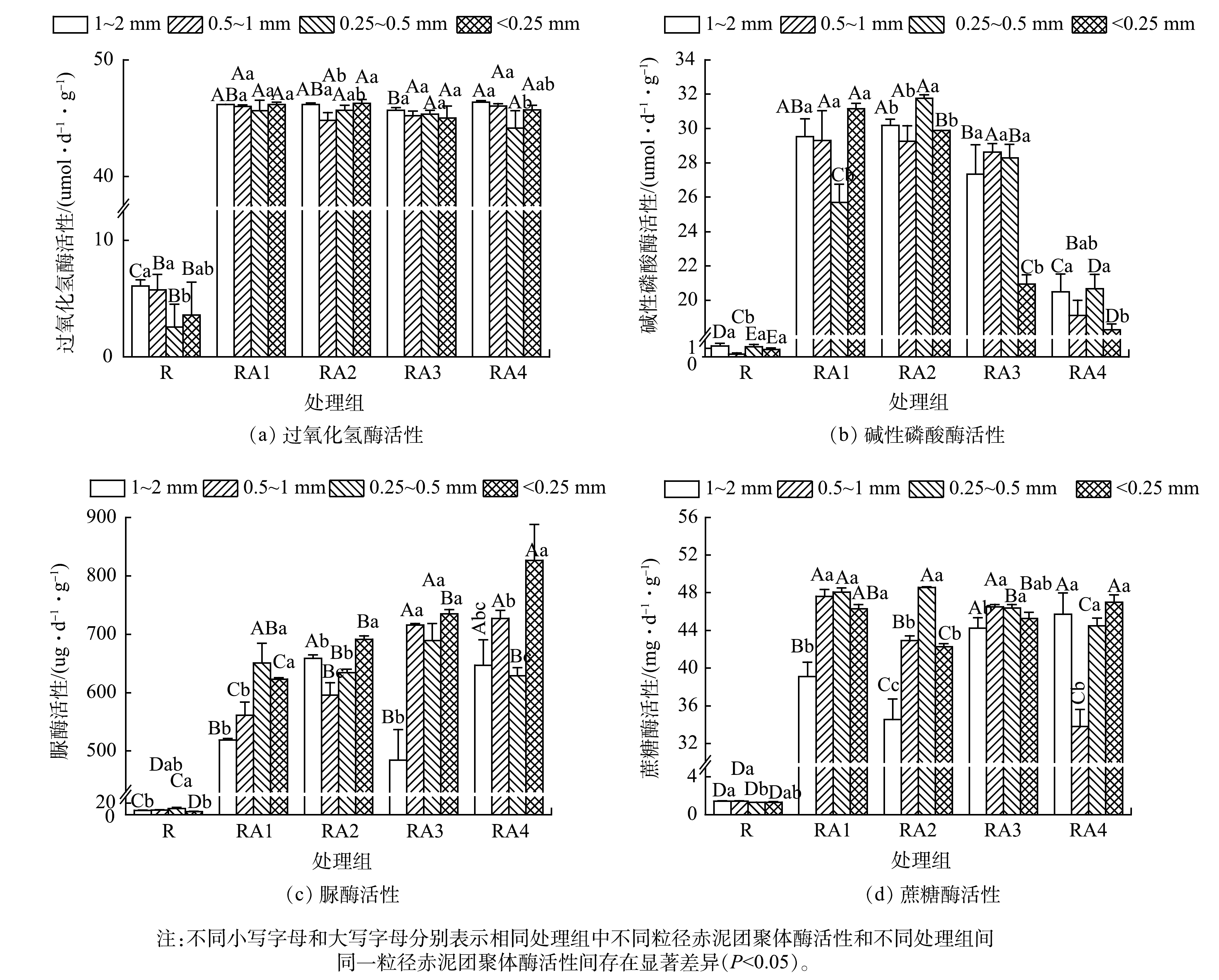
赤泥团聚体中酶活性空间分异特征见图3。与R组相比,其它处理组中各粒径团聚体的酶活性总体上均有不同程度的增加。过氧化氢酶活性在1~2 mm、<0.25 mm团聚体中较高 (图3(a)) ;碱性磷酸酶和脲酶活性分别在0.25~0.5 mm和<0.25 mm团聚体中最高;蔗糖酶活性在0.25~1 mm、<0.25 mm团聚体中较高。总体上,<1 mm团聚体中的酶活性最高。其原因可能是改良剂和植物改善赤泥养分质量分数及微环境并促进微生物生长[40],而不同粒径团聚体中微生物的分布差异也会调控酶活性的分布特征。此外,植物根系是土壤酶的来源之一,也会对酶活性造成影响[41]。与WANG等[42]的研究结果 (微团聚体的酶活性较低) 不同的是,本研究中酶活性最低的情形大多集中于>0.25 mm团聚体,这可能与微团聚体质量比例增加或微团聚体质量分数偏多有关。
-
1) 改良剂与植被联合修复对赤泥团聚体微生物群落多样性空间分异特征的影响。赤泥团聚体微生物群落多样性见表2和表3。单个样本的覆盖率均大于99%,表明测序结果能真实地反映赤泥样品中的细菌和真菌群落。R组无微生物群落检出,其原因可能是新鲜赤泥的极端生境导致微生物无法生存,这与李辉等[43]的研究结果 (新鲜赤泥中微生物数量极少导致有效序列数过低) 相同。相比R组,其他处理组中细菌的Alpha多样性指数均不同程度增加。整体上Shannon指数在<1 mm团聚体中最高。Simpson指数在<0.25 mm的团聚体中最高,在1~2 mm团聚体中最低。Ace和Chao1指数在<1 mm团聚体中最高,而在1~2 mm团聚体最低。真菌Shannon指数主要在1~2 mm团聚体中最高,在<0.25 mm团聚体中最低。真菌Simpson指数则主要在0.25~0.5 mm团聚体最高。真菌Ace和Chao1指数在0.5~2 mm团聚体中均最低,但在0.25~0.5 mm团聚体中最高。由此可见,改良剂与植被联合修复主要增加了<1 mm团聚体中微生物群落多样性与物种丰富度,其原因可能是由于不同粒径赤泥团聚体中微生物群落分布受养分分布特征的影响。LIAO等[19]研究也表明,不同粒径土壤团聚体中养分分布不均匀,为微生物提供空间上不均匀的微生境。此外,由于团聚体周转[27, 36]会造成大粒径团聚体外部的微生物脱落至较小粒径团聚体中。
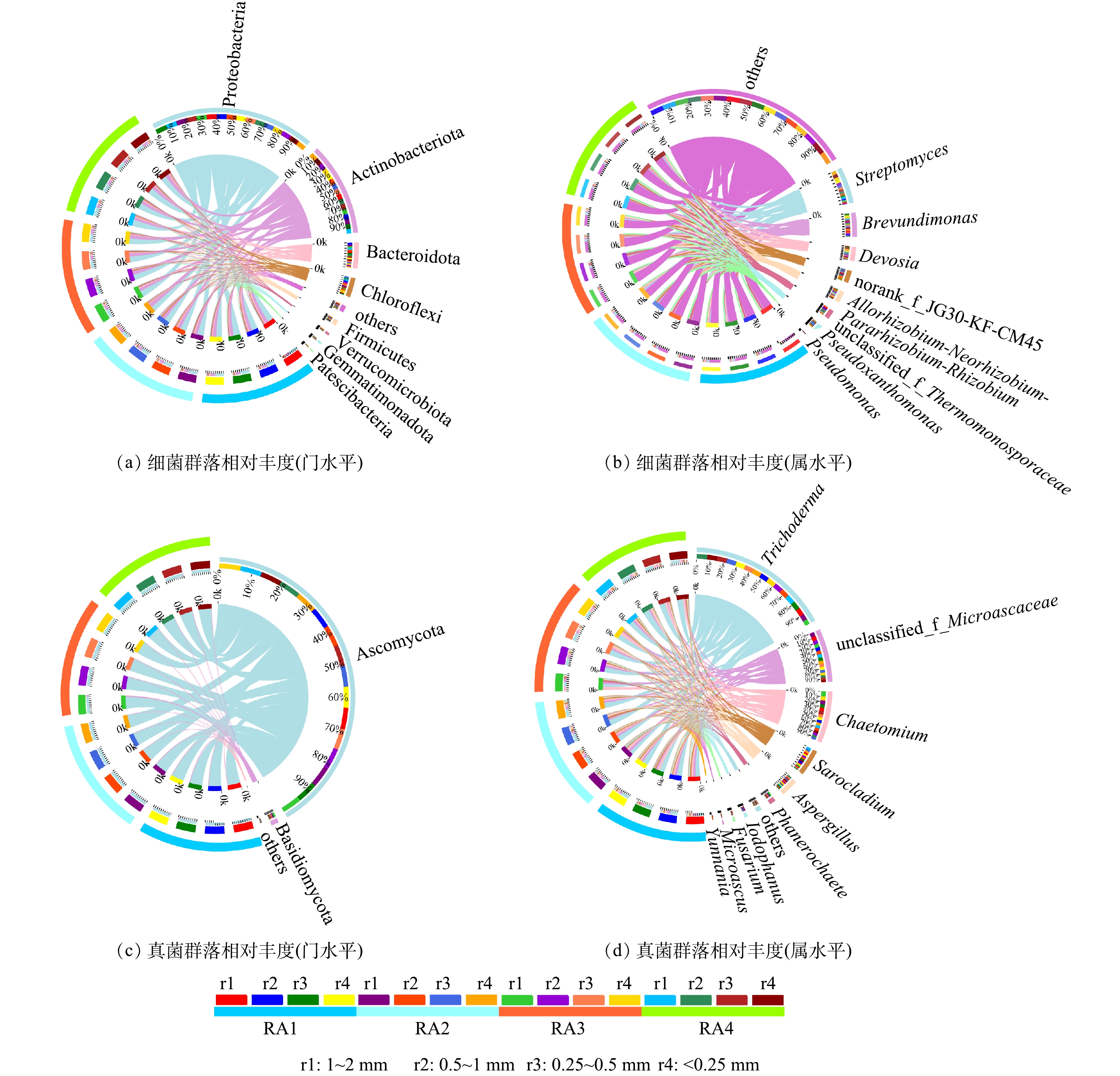
2) 改良剂与植被联合修复对赤泥团聚体微生物群落组成空间分异特征的影响。赤泥团聚体微生物群落组成如图4所示,在门水平上 (图4(a)) ,主要优势细菌门为变形菌门 (Proteobacteria)、放线菌门 (Actinobacteriota)、拟杆菌门 (Bacteriodota)、绿弯菌门 (Chloroflexi)、厚壁菌门 (Firmicutes)。其中,Proteobacteria、Bacteriodota的相对丰度在1~2 mm团聚体中最高,Actinobacteriota和Chloroflexi分别主要分布在<0.25 mm和0.5~1 mm团聚体。有研究表明,赤泥自然堆放23 a后,由于其极端生境得到显著改善,Proteobacteria、Actinobacteriota和Firmicutes的相对丰度显著增加[43],这与本研究结果相似。在属水平上 (图4(b)) ,主要优势细菌属有链霉菌 (Streptomyces)、短波单胞菌 (Brevundimonas)、沃斯氏菌 (Devosia)。其中,Streptomyces和Brevundimonas的相对丰度分别在<0.25 mm和1~2 mm团聚体中最高。Devosia的相对丰度在<1 mm团聚体中最高,在1~2 mm团聚体中最低。
在门水平上 (图4(c)) ,优势真菌主要有子囊菌门 (Ascomycota) 、担子菌门 (Basidiomycota) 。不同处理组的不同粒径团聚体中Ascomycota的相对丰度达89.5%以上,其分别在<0.25 mm和1~2 mm团聚体中最高和最低。在属水平上 (图4(d)) ,优势真菌属主要有木霉菌属 (Trichodema) 、毛壳菌属 (Chaetomium) 、帚枝霉属 (Sarocladium) 、曲霉菌属 (Aspergillus) 、白腐真菌 (Phanerochaete) 、镰刀真菌 (Fusarium) 。真菌优势物种的相对丰度在门水平和属水平上大多在<1 mm团聚体中最高。
-
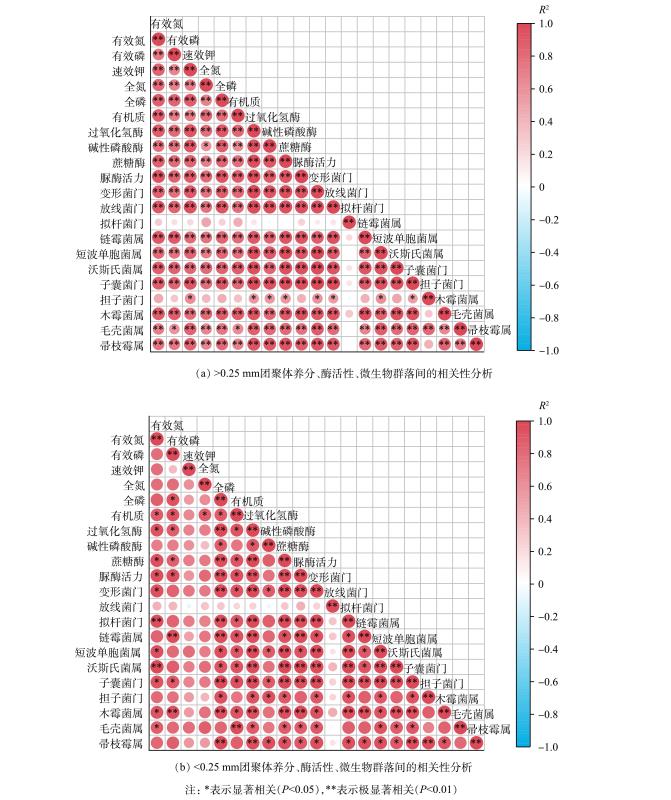
赤泥团聚体中养分、酶活性、微生物群落间的相关性见图5。在大团聚体 (>0.25 mm) 中,养分与酶活性、变形菌门、放线菌门、链霉菌属、短波单胞菌属、沃斯氏菌属、子囊菌门、木霉菌属、毛壳菌属、帚枝霉属间均呈显著 (P<0.05) 或极显著 (P<0.01) 正相关。酶活性与变形菌门、放线菌门、链霉菌属、短波单胞菌属、沃斯氏菌属、子囊菌门、木霉菌属、毛壳菌属、帚枝霉属、担子菌门间呈显著 (P<0.05) 或极显著 (P<0.01) 正相关。而养分 (图2) 与酶活性 (图3) 主要分布在<1 mm团聚体中,这可能是真菌优势物种的相对丰度在门水平和属水平上大多在<1 mm团聚体中最高的原因。大粒径团聚体的主要胶结物质为有机质等有机胶体[44],有机质与全磷呈正相关,且0.5~1 mm团聚体中有机质处于较高水平 (图2(f)) ,这可能是导致0.5~1 mm团聚体中全磷质量分数较高 (图2(d)) 的重要原因。在微团聚体 (<0.25 mm) 中,酶活性、养分、微生物间大多呈显著正相关 (P<0.05) 。综上表明,改良剂与植被联合修复下,不同粒径赤泥团聚体中养分、酶活性、微生物群落间主要表现出协同关系,其能积极促进彼此的正向增长。
-
1) 赤泥团聚体中有效氮、有效磷、全氮、全磷、速效钾、有机质质量分数分别增加了8.29~129.00、4.17~29.39、2.67~11.00、2.61~4.89、0.03~0.31、1.00~5.38倍,其主要分布于<1 mm团聚体。
2) 赤泥团聚体中过氧化氢酶、碱性磷酸酶、脲酶、蔗糖酶活性分别增加了6.51~16.90、30.61~174.49、60.51~164.91、22.90~36.25倍;微生物群落丰度和多样性均不同程度增加;酶活性与微生物群落丰度和多样性大多在<1 mm团聚体中最高。
改良剂与植被联合修复对赤泥团聚体养分和微生物特性的影响
The synergistic remediation effects of amendment and vegetation on nutrient and microbial property in bauxite residue aggregates
-
摘要: 改良剂与植被联合修复是促进赤泥土壤化的关键,但其对赤泥团聚体中养分和微生物特性的影响尚不清晰。通过开展盆栽修复实验探究改良剂 (磷石膏、木醋液、鱼粪、菌渣) 与黑麦草联合修复对赤泥团聚体中养分、酶活性、微生物群落空间分异特征的影响。结果表明,在改良剂与植被联合修复赤泥后,大团聚体 (>0.25 mm) 和微团聚体 (<0.25 mm) 占比分别减少和增加。团聚体中有机质、养分质量分数、酶活性及微生物群落Alpha多样性指数显著增加 (P<0.05) ,且主要分布于<1 mm团聚体。此外,团聚体养分、酶活性、微生物群落间呈显著正相关 (P<0.05) 。本研究结果可为深入了解赤泥土壤化过程中养分迁移转化机理及修复植物的养分自维持机制提供参考。Abstract: The synergistic remediation of amendment and vegetation is the key to promote soil formation of bauxite residue; however, their effects on the nutrient and microbial properties of bauxite residue aggregates are still unclear. The synergistic remediation of amendments (phosphogypsum, wood vinegar, fish manure, and mushroom residue) and perennial ryegrass (Lolium perenne L.) on the spatial differentiation characteristics of nutrient, enzyme activity, and microbial community in the bauxite residue aggregates were investigated by conducting a pot experiment. The results showed that the proportion of macroaggregates (>0.25 mm) and microaggregates (<0.25 mm) reduced and increased in the amended and revegetated bauxite residue, respectively. The organic matter, nutrient, enzyme activity, and the alpha diversity indices of microbial community in the bauxite residue aggregates increased significantly (P<0.05) under the synergistic remediation of amendment and vegetation, which were mainly distributed in the aggregates with size of <1 mm. In addition, there was a significant positive correlation among the nutrient, enzyme activity, and microbial community in the bauxite residue aggregates (P<0.05). These results can provide a reference for in-depth understanding of the mechanisms of the migration and transformation of nutrient during soil formation of bauxite residue and the nutrient self-sustaining in plants.
-

-
表 1 赤泥与改良剂的理化性质
Table 1. Physicochemical properties of bauxite residue and amendments
供试材料 pH EC/(mS·cm−1) 全氮/(g·kg−1) 全磷/(g·kg−1) 有机质/(g·kg−1) 有效氮/(mg·kg−1) 有效磷/(mg·kg−1) 速效钾/(mg·kg−1) 赤泥 10.86 1.00 0.14 2.30 7.81 1.59 3.98 595 磷石膏 5.24 2.44 0.14 3.80 2.90 7.72 57.25 85.20 鱼粪 6.48 3.23 1.40 56.13 61.20 275.58 212.08 880.00 菌渣 4.66 5.48 1.40 3.80 55.30 310.99 648.15 6 206.00 表 2 赤泥团聚体细菌群落多样性和丰富度指数
Table 2. The diversity and richness indices of bacterial community in the aggregates of bauxite residue
处理组 粒径/mm 群落多样性 群落丰富度 Coverage Shannon Simpson Ace Chao1 R 1~2 0 0 0 0 0 0.5~1 0 0 0 0 0 0.25~0.5 0 0 0 0 0 <0.25 0 0 0 0 0 RA1 1~2 5.16±0.02Aa 0.017±0.001Ab 1192.54±2.26Ab 1185.54±3.35Aa 0.992 0.5~1 5.19±0.02Aa 0.017±0.001Bb 1270.14±4.60Aa 1285.13±3.92Aa 0.991 0.25~0.5 5.16±0.01Aa 0.018±0.000Ab 1258.79±1.63Ba 1255.87±5.54Ca 0.992 <0.25 5.15±0.02Aa 0.024±0.001Aa 1260.69±26.90Aa 1259.93±53.69Aa 0.992 RA2 1~2 5.15±0.03Aa 0.015±0.001Ab 1220.11±20.39Aa 1233.18±24.87Aa 0.992 0.5~1 5.07±0.03BCab 0.020±0.000ABb 1236.33±20.71Aa 1260.89±13.52Aa 0.992 0.25~0.5 5.17±0.04Aa 0.021±0.001Ab 1262.56±1.99Ba 1256.87±1.83Ca 0.992 <0.25 5.00±0.03Bb 0.038±0.004Aa 1254.81±6.80Aa 1278.07±10.05Aa 0.992 RA3 1~2 5.14±0.03Aab 0.017±0.000Ab 1229.62±13.07Ac 1271.45±50.85Aa 0.991 0.5~1 5.00±0.00Cb 0.025±0.003Aab 1247.35±33.04Abc 1300.47±41.87Aa 0.991 0.25~0.5 5.22±0.06Aa 0.020±0.002Aab 1339.93±12.02Aa 1375.23±12.93Aa 0.991 <0.25 5.05±0.06ABab 0.032±0.005Aa 1325.78±26.14Aab 1341.55±35.15Aa 0.991 RA4 1~2 5.17±0.03Aa 0.017±0.002Ab 1239.05±26.15Aa 1250.61±32.81Aa 0.992 0.5~1 5.14±0.04ABab 0.019±0.001ABb 1284.65±39.02Aa 1307.56±64.90Aa 0.991 0.25~0.5 5.22±0.02Aa 0.020±0.001Ab 1286.19±9.32Ba 1285.89±2.21Ba 0.992 <0.25 5.01±0.03ABb 0.034±0.004Aa 1308.35±44.03Aa 1326.79±53.21Aa 0.991 注:不同小写字母和大写字母分别表示相同处理组中不同粒径赤泥团聚体细菌Alpha多样性指数和不同处理组间同一粒径赤泥团聚体细菌Alpha多样性指数存在显著差异 (P<0.05) 。 表 3 赤泥团聚体真菌群落多样性和丰富度指数
Table 3. The diversity and richness indices of fungal community in the aggregates of bauxite residue
处理组 粒径/mm 群落多样性 群落丰富度 Coverage Shannon Simpson Ace Chao1 R 1~2 0 0 0 0 0 0.5~1 0 0 0 0 0 0.25~0.5 0 0 0 0 0 <0.25 0 0 0 0 0 RA1 1~2 2.11±0.06Aa 0.20±0.02Aa 179.01±2.79Ba 184.35±4.80Ba 0.999 0.5~1 2.06±0.05Aa 0.23±0.01Ba 247.06±52.57Aa 237.08±35.68Aa 0.999 0.25~0.5 2.12±0.05Aa 0.21±0.02Aa 232.57±9.56ABa 212.03±16.97Aa 0.999 <0.25 1.98±0.03Aa 0.25±0.02Aa 250.64±2.35Aa 217.48±1.11Aa 0.999 RA2 1~2 2.23±0.15Aa 0.18±0.02Ab 219.28±15.60ABab 203.26±2.21Aa 0.999 0.5~1 2.05±0.09Aa 0.22±0.02Bab 179.40±8.00Ab 192.76±1.18Aa 0.999 0.25~0.5 1.95±0.03Ba 0.26±0.01Aa 251.39±3.11ABa 204.42±12.63Aa 0.999 <0.25 2.05±0.02Aa 0.23±0.00Aab 243.66±14.33Aa 201.47±3.66Aa 0.999 RA3 1~2 2.18±0.00Aa 0.17±0.01Ab 176.66±3.89Ba 176.70±6.70Ba 0.999 0.5~1 2.03±0.06Ab 0.23±0.01Ba 195.19±6.53Aa 199.20±5.96Aa 0.999 0.25~0.5 2.03±0.02ABb 0.24±0.01Aa 224.36±4.95Ba 218.23±1.83Aa 0.999 <0.25 2.00±0.01Ab 0.23±0.01Aa 202.44±29.16Aa 182.06±20.50Aa 0.999 RA4 1~2 2.03±0.17Aa 0.23±0.05Aa 234.14±19.16Aa 215.42±2.51Aa 0.999 0.5~1 1.86±0.03Aa 0.30±0.01Aa 208.98±19.10Aa 199.33±1.93Aa 0.999 0.25~0.5 1.97±0.03ABa 0.26±0.01Aa 278.17±24.44Aa 222.45±10.86Aa 0.999 <0.25 1.95±0.06Aa 0.28±0.03Aa 233.05±17.11Aa 214.49±16.01Aa 0.999 注:不同小写字母和大写字母分别表示相同处理组中不同粒径赤泥团聚体真菌Alpha多样性指数和不同处理组间同一粒径赤泥团聚体真菌Alpha多样性指数存在显著差异 (P<0.05) 。 -
[1] XUE S G, ZHU F, KONG X F, et al. A review of the characterization and revegetation of bauxite residues (red mud)[J]. Environmental Science and Pollution Research, 2016, 23(2): 1120-1132. doi: 10.1007/s11356-015-4558-8 [2] SWAIN B, AKCIL A, LEE J C. Red mud valorization an industrial waste circular economy challenge; review over processes and their chemistry[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(4): 520-570. doi: 10.1080/10643389.2020.1829898 [3] 薛生国, 李晓飞, 孔祥峰, 等. 赤泥碱性调控研究进展[J]. 环境科学学报, 2017, 37(8): 2815-2828. [4] BRAY A W, STEWART D I, COURTNEY R, et al. Sustained bauxite residue rehabilitation with gypsum and organic matter 16 years after initial treatment[J]. Environmental Science & Technology, 2018, 52(1): 152-161. [5] REN J, YANG B, CHEN J, et al. Alkalinity neutralization of bauxite residue by nitrohumic acid: mineral transformation and subsequent formation of organo-mineral complexes[J]. Applied Geochemistry, 2022, 136: 105153. doi: 10.1016/j.apgeochem.2021.105153 [6] SAHA N, KHARBULI Z Y, BHATTACHARJEE A, et al. Effect of alkalinity (pH 10) on ureogenesis in the air-breathing walking catfish, Clarias batrachus[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2002, 132(2): 353-364. [7] 管博, 于君宝, 陆兆华, 等. 黄河三角洲滨海湿地水盐胁迫对盐地碱蓬幼苗生长和抗氧化酶活性的影响[J]. 环境科学, 2011, 32(8): 2422-2429. [8] XUE S G, LI M, JIANG J, et al. Phosphogypsum stabilization of bauxite residue: conversion of its alkaline characteristics[J]. Journal of Environmental Sciences, 2019, 77: 1-10. doi: 10.1016/j.jes.2018.05.016 [9] 黄玲, 李义伟, 薛生国, 等. 氧化铝赤泥堆场盐分组成变化[J]. 中国有色金属学报, 2016, 26(11): 2433-2439. [10] WU H, TANG T, ZHU F, et al. Long term natural restoration creates soil‐like microbial communities in bauxite residue: a 50-year filed study[J]. Land Degradation & Development, 2021, 32(4): 1606-1617. [11] ZHU F, XUE S G, HARTLEY W, et al. Novel predictors of soil genesis following natural weathering processes of bauxite residues[J]. Environmental Science and Pollution Research, 2016, 23(3): 2856-2863. doi: 10.1007/s11356-015-5537-9 [12] ZHU F, HOU J T, XUE S G, et al. Vermicompost and gypsum amendments improve aggregate formation in bauxite residue[J]. Land Degradation & Development, 2017, 28(7): 2109-2120. [13] RILLIG M C, MULLER L A, LEHMANN A. Soil aggregates as massively concurrent evolutionary incubators[J]. The ISME Journal, 2017, 11(9): 1943-1948. doi: 10.1038/ismej.2017.56 [14] 刘亚龙, 王萍, 汪景宽. 土壤团聚体的形成和稳定机制: 研究进展与展望[J]. 土壤学报, 2022: 1-18. [15] XUE S G, YE Y Z, ZHU F, et al. Changes in distribution and microstructure of bauxite residue aggregates following amendments addition[J]. Journal of Environmental Sciences, 2019, 78: 276-286. doi: 10.1016/j.jes.2018.10.010 [16] TIAN T, LIU Z, ZHU F, et al. Improvement of aggregate‐associated organic carbon and its stability in bauxite residue by substrate amendment addition[J]. Land Degradation & Development, 2020, 31(16): 2405-2416. [17] DONG M Y, HU S X, LV S Q, et al. Recovery of microbial community in strongly alkaline bauxite residues after amending biomass residue[J]. Ecotoxicology and Environmental Safety, 2022, 232: 113281. doi: 10.1016/j.ecoenv.2022.113281 [18] TISDALL M, OADES J M. Organic matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163. doi: 10.1111/j.1365-2389.1982.tb01755.x [19] LIAO H, ZHANG Y C, ZUO Q Y, et al. Contrasting responses of bacterial and fungal communities to aggregate-size fractions and long-term fertilizations in soils of northeastern China[J]. Science of the Total Environment, 2018, 635: 784-792. doi: 10.1016/j.scitotenv.2018.04.168 [20] 朱锋, 李萌, 薛生国, 等. 自然风化过程对赤泥团聚体有机碳组分的影响[J]. 生态学报, 2017, 37(4): 1174-1183. [21] 祁迎春, 王益权, 刘军, 等. 不同土地利用方式土壤团聚体组成及几种团聚体稳定性指标的比较[J]. 农业工程学报, 2011, 27(1): 340-347. [22] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 106-190. [23] 关松荫, 张德生, 张志明. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 260-344. [24] TAN C J, LUO Y F, FU T L. Soil microbial community responses to the application of a combined amendment in a historical zinc smelting area[J]. Environmental Science and Pollution Research. 2022, 29(9): 13056-13070. [25] 王敏, 李祥云, 赵征宇, 等. 番茄秸秆和菌菇渣还田对土壤团聚体稳定性及其有机碳分布的影响[J]. 山东农业科学, 2022, 54(2): 95-103. [26] ABIVEN S, MENASSERI S, ANGERS D A, et al. Dynamics of aggregate stability and biological binding agents during decomposition of organic materials[J]. European Journal of Soil Science, 2007, 58(1): 239-247. doi: 10.1111/j.1365-2389.2006.00833.x [27] SIX J, ELLIOTT E T, PAUSTIAN K. Soil macroaggregate turnover and microaggregate formation: a mechanism for C sequestration under no-tillage agriculture[J]. Soil Biology and Biochemistry, 2000, 32(14): 2099-2103. doi: 10.1016/S0038-0717(00)00179-6 [28] HU F N, XU C Y, LI H, et al. Particles interaction forces and their effects on soil aggregates breakdown[J]. Soil and Tillage Research, 2015, 147: 1-9. doi: 10.1016/j.still.2014.11.006 [29] XUE S G, WANG Q L, TIAN T, et al. Regional-scale investigation of salt ions distribution characteristics in bauxite residue: a case study in a disposal area[J]. Journal of Central South University, 2019, 26(2): 422-429. doi: 10.1007/s11771-019-4014-x [30] 宋松松, 胡斐南, 刘婧芳, 等. 土壤内外力共同作用下溅蚀团聚体粒径分布及迁移特征[J]. 中国水土保持科学(中英文), 2022, 20(3): 17-26. [31] LOVLEY D R, FRAGA J L, BLUNT HARRIS E L, et al. Humic substances as a mediator for microbially catalyzed metal reduction[J]. Acta Hydrochimica Et Hydrobiologica, 1998, 26(3): 152-157. doi: 10.1002/(SICI)1521-401X(199805)26:3<152::AID-AHEH152>3.0.CO;2-D [32] SIX J, BOSSUYT H, DEGRYZE S, et al. A history of research on the link between (micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 79(1): 7-31. doi: 10.1016/j.still.2004.03.008 [33] OADES J M. Soil organic matter and structural stability: mechanisms and implications for management[J]. Plant and Soil, 1984, 76(1): 319-337. [34] 王艳玲, 蒋发辉, 徐江兵, 等. 长期配施有机肥对旱地红壤微团聚体中有机碳含量的影响[J]. 土壤通报, 2018, 49(2): 377-384. [35] 王蕾, 王艳玲, 李欢, 等. 长期施肥下红壤旱地磷素有效性影响因子的冗余分析[J]. 中国土壤与肥料, 2021(1): 17-25. doi: 10.11838/sfsc.1673-6257.19549 [36] UPTON R N, BACH E M, HOFMOCKEL K S. Spatio-temporal microbial community dynamics within soil aggregates[J]. Soil Biology and Biochemistry, 2019, 132: 58-68. doi: 10.1016/j.soilbio.2019.01.016 [37] LU M Z, YANG M Y, YANG Y R, et al. Soil carbon and nutrient sequestration linking to soil aggregate in a temperate fen in Northeast China[J]. Ecological Indicators, 2019, 98: 869-878. doi: 10.1016/j.ecolind.2018.11.054 [38] ZHU F, LI Y B, XUE S G, et al. Effects of iron-aluminium oxides and organic carbon on aggregate stability of bauxite residues[J]. Environmental Science and Pollution Research. 2016, 23(9): 9073-9081. [39] WERNER F, MUELLER C W, THIEME J, et al. Micro-scale heterogeneity of soil phosphorus depends on soil substrate and depth[J]. Scientific Reports, 2017, 7(1): 3203. doi: 10.1038/s41598-017-03537-8 [40] YAN Y J, DAI Q H, HU G, et al. Effects of vegetation type on the microbial characteristics of the fissure soil-plant systems in karst rocky desertification regions of SW China[J]. Science of the Total Environment, 2020, 712: 136543. doi: 10.1016/j.scitotenv.2020.136543 [41] CUI Y X, FANG L C, GUO X B, et al. Ecoenzymatic stoichiometry and microbial nutrient limitation in rhizosphere soil in the arid area of the northern Loess Plateau, China[J]. Soil Biology and Biochemistry, 2018, 116: 11-21. doi: 10.1016/j.soilbio.2017.09.025 [42] WANG Y D, HU N, GE T D, et al. Soil aggregation regulates distributions of carbon, microbial community and enzyme activities after 23-year manure amendment[J]. Applied Soil Ecology, 2017, 111: 65-72. doi: 10.1016/j.apsoil.2016.11.015 [43] 李辉, 曲洋, 姚敏杰, 等. 赤泥自然成土过程及其微生物驱动机制[J]. 应用生态学报, 2021, 32(4): 1452-1460. [44] 黄荣珍, 王金平, 朱丽琴, 等. 杉木人工林土壤微团聚体中铁铝氧化物与微生物的分布及其关系[J]. 水土保持通报, 2022, 42(1): 1-9. -



 下载:
下载: