-
近年来,由于抗生素的广泛使用以及由此产生的环境污染引起了广泛关注[1]。四环素(tetracycline, TC)作为一种典型的抗细菌感染的抗生素,因其抗菌效果显著,价格低廉,已成为畜禽养殖业用量最大的抗生素之一[2-3]。有研究表明,TC很难被动物代谢,约70%~90%的TC通过粪便和尿液排泄到环境当中[4],而这些TC残留会通过饮用水和食物链进入人体,对人体健康构成严重威胁[5]。目前,从废水中去除TC的方法主要有电化学处理法、高级氧化法、生物降解法、吸附法和膜分离法等[6],其中吸附法因其高效、成本低、操作简单等优点而被广泛应用于TC的去除[7]。吸附法的关键是选取高效、稳定的吸附剂。活性炭、活性氧化铝和碳纳米管等吸附剂由于价格昂贵使其大规模应用于废水处理中受到限制[8]。因此,选择一种高效、低成本的吸附剂是吸附技术中的关键。
生物炭(biochar, BC)是由废弃生物质(农林废弃物、禽畜粪便等)在限氧条件下热解制得的一种多孔富碳材料[9]。生物炭因其具有比表面积大、孔结构发达、官能团丰富以及价格低廉等诸多优点被普遍应用在废水处理领域[10-11]。猪粪(swine manure, SM)作为我国最为丰富的农业废弃物之一,年产量约为38×109 t,同时,由于畜禽养殖业大量使用TC,猪粪含有大量TC残留,是TC污染的主要源头之一,如果将畜禽养殖所产生的猪粪资源化制备为生物炭并应用于废水中TC的去除,不仅可以从源头上控制TC污染,还可以达到“以废治废”的目的[12]。然而,原始生物炭的吸附能力有限,为了提高吸附效率,对生物炭改性是很有必要的。在众多改性剂中,β-环糊精聚合物(β-cyclodextrin, β-CD)是一种具有亲水外缘和内腔疏水结构的重要络合剂,具有无毒、绿色、可生物降解等优点[13]。β-CD独特的空腔结构有利于β-CD与有机污染物通过“主客体”相互作用形成包合物,有利于污染物的吸附去除。然而,β-CD作为一种亲水性化合物,在捕获污染物后很难从水环境中有效分离,为了解决这一难题,有研究者尝试将β-CD负载到非水溶性材料上,如:沸石、碳纳米管、纤维素等,以解决β-CD吸附污染物后难分离的问题,同时也可提高对水中污染物的去除效果[14-15]。目前,有研究报道了以农林废弃物制备生物炭与β-CD结合对重金属的吸附效果,但鲜有研究报道β-CD改性畜禽粪便基生物炭对废水中TC的去除作用及机制。
基于以上研究,本文以猪粪为原料制备生物炭(SMBC),采用β-CD对生物炭进行了改性,分析了SMBC和β-CD改性生物炭(β-SMBC)的结构及组成特点,考察了溶液pH以及2种吸附剂投加量对TC吸附的影响,系统研究了SMBC和β-SMBC对TC的吸附特性,并对吸附机制进行了探讨,以期为畜禽粪便基生物炭及其改性吸附剂应用于抗生素污染废水处理领域提供参考。
-
TC(C22H24N2O8)购于上海麦克林生化科技有限公司;β-CD(C42H70O35)购于天津市大茂化学试剂厂;环氧氯丙烷购于天津大茂化学试剂厂;HNO3和NaOH均为分析纯,购于天津大茂化学试剂厂,实验用水为去离子水。
本实验主要仪器:752N Plus紫外可见分光光度计(上海仪电分析仪器有限公司);SHZ-82气浴恒温振荡器(上海力辰邦西仪器科技有限公司);FA-N型系列电子天平(邦西仪器科技上海有限公司);PHS-3C型pH计(上海仪电科学仪器股份有限公司)。
-
猪粪采自武威市某养殖场。将采集的猪粪风干,捡出其中的石块等杂物后,粉碎至粒径小于20目,将其装入坩埚中,置于马弗炉中在300 ℃条件下炭化6 h,冷却至室温后过80目筛,装于棕色瓶中待用。制得的生物炭标记为SMBC。
称取30 g改性材料(β-CD),与300 mL的NaOH溶液(7%)和12.20 mL环氧氯丙烷混合,将混合溶液在室温(25 ℃)、120 r·min−1条件下搅拌6 h得到改性溶液[14];然后称取12 g的SMBC加入改性溶液中,在和上述相同条件下继续搅拌6 h后过滤,过滤所得固体用去离子水洗涤至滤液中性,于75 ℃下烘干保存备用,制得重量恒定的改性生物炭,标记为β-SMBC。
-
采用元素分析仪(varioELcube,德国)测定SMBC和β-SMBC的元素含量;利用扫描电子显微镜(SEM)(JSM-5600 LV,日本)分析SMBC和β-SMBC的表面形貌;采用比表面积及孔径分析仪(BET)(ASAP 2020,美国)测量SMBC和β-SMBC的比表面积和孔径分布;采用X射线衍射仪(XRD)(MiniFlex600,日本)分析SMBC和β-SMBC的物相组成和结构;以傅里叶红外光谱(FTIR)(VERTEX 7000,德国)表征吸附前后表面主要官能团吸收峰的波数、强度变化。
-
吸附动力学实验:准确称取0.03 g的吸附剂(SMBC或β-SMBC)于具塞离心管中,分别加入30 mL质量浓度为20 mg·L−1的TC溶液,置于气浴恒温振荡器中,于25 ℃、150 r·min−1条件下振荡,分别于0.083、0.167、0.5、1、2、4、8、12、16、20和24 h取出样品,经0.45 μm滤膜过滤后采用紫外分光光度计在358 nm处测定吸光度,依据标准曲线计算TC的浓度。
等温吸附实验:准确称取0.03 g的吸附剂(SMBC或β-SMBC)于具塞离心管中,分别加入30 mL不同初始质量浓度(5、10、15、20、30、40、50、60、80和100 mg·L−1)的TC溶液,置于条件为150 r·min−1、25 ℃的气浴恒温振荡器中振荡4 h取出,过0.45 μm滤膜,测定并计算滤液中TC的质量浓度。
影响因素实验:吸附剂投加量为0.5至3.0 g·L−1,TC初始质量浓度为20 mg·L−1;TC溶液pH采用HNO3和NaOH调节,调节范围为2.0~10.0,TC初始质量浓度为20 mg·L−1;温度为25、35和45 ℃,其余操作同等温吸附实验。各实验设置3组平行样,结果取平均值。
-
1)吸附剂对TC的吸附量和吸附效率分别按式(1)和式(2)计算。
式中:q为吸附量,mg·g−1;R为吸附率,%;c0和ce分别为TC的初始质量浓度和平衡质量浓度,mg·L−1;V为TC溶液的体积,L;m为吸附剂质量,g。
2)分别采用准一级动力学(式(3))、准二级动力学(式(4))和颗粒内扩散方程(式(5))对吸附动力学数据进行拟合。
式中:qt为t时刻TC的吸附量,mg·g−1;qe为吸附平衡时的吸附量,mg·g−1;t为吸附时间,h;k1为准一级动力学吸附速率常数,h−1;k2为准二级动力学吸附速率常数,g·(mg·h)−1; Kd为颗粒内扩散常数,mg·(g·h1/2)−1;Ci为与边界层厚度相关的常数。
3)采用Langmuir(式(6))、Freundlich(式(7))和Temkin等温吸附方程(式(8))对等温吸附数据进行拟合。
式中:ce为体系吸附平衡时TC的质量浓度,mg·L−1;qe为吸附平衡时TC的吸附量,mg·g−1;KL为Langmuir方程吸附常数,L·mg−1;KF为Freundlich方程吸附常数,L·mg−1;n为吸附强度指数;qm为最大吸附量,mg·g−1;A和Kt为Temkin方程常数。
4)在不同的温度下,通过式(9)和式(10)计算热力学参数∆Gθ、∆Hθ和∆Sθ,探究温度对SMBC和β-SMBC吸附TC的影响。
式中:R为气体常数,8.314 J·(mol·K)−1;T为开氏温度,K;KL是Langmuir等温方程常数,L·mol−1;∆Gθ为吉布斯自由能变化,kJ·mol−1;∆Hθ为吸附过程中的焓变,kJ·mol−1;∆Sθ为吸附过程中的熵变,J·(mol·K)−1。将式(9)中的lnKL对1/T作图,用所得线性回归方程的斜率和截距分别计算∆Hθ和∆Sθ,再通过式(10)计算∆Gθ。
-
表1为SMBC和β-SMBC的元素组成、灰分、比表面积和孔径等表征结果。可以通过计算元素的摩尔比来确定吸附剂(SMBC或β-SMBC)的芳香性(H/C)、亲水性(O/C)和极性(O+N/C)。H/C值越小,代表吸附剂的芳香性越强,O/C值越小,代表吸附剂的疏水性越强;(O+N)/C越大,则吸附剂的极性越强[10]。由表1可知,β-SMBC的极性相较于SMBC降低,而疏水性增强。SMBC改性后,比表面积由6.11 m2·g−1增大到15.35 m2·g−1,总孔体积由0.016 cm3·g−1增加到0.022 cm3·g−1。比表面积增大可能是因为在改性过程中β-CD颗粒附着在生物炭表面,形成表面凸起的微小颗粒,从而导致比表面积增大,此外改性过程中的搅拌可使生物炭孔隙中的可溶性物质分离,使得β-SMBC总孔体积升高。
图1为SMBC和β-SMBC的SEM图谱。由图1可以看出,SMBC表面比较光滑,具有明显的孔结构。与SMBC相比,β-SMBC的表面较为粗糙,孔结构也较为发达,与此同时,可以看到大量白色物质出现并覆盖在SMBC的表面和孔隙上。这表明β-CD成功附着于SMBC表面。
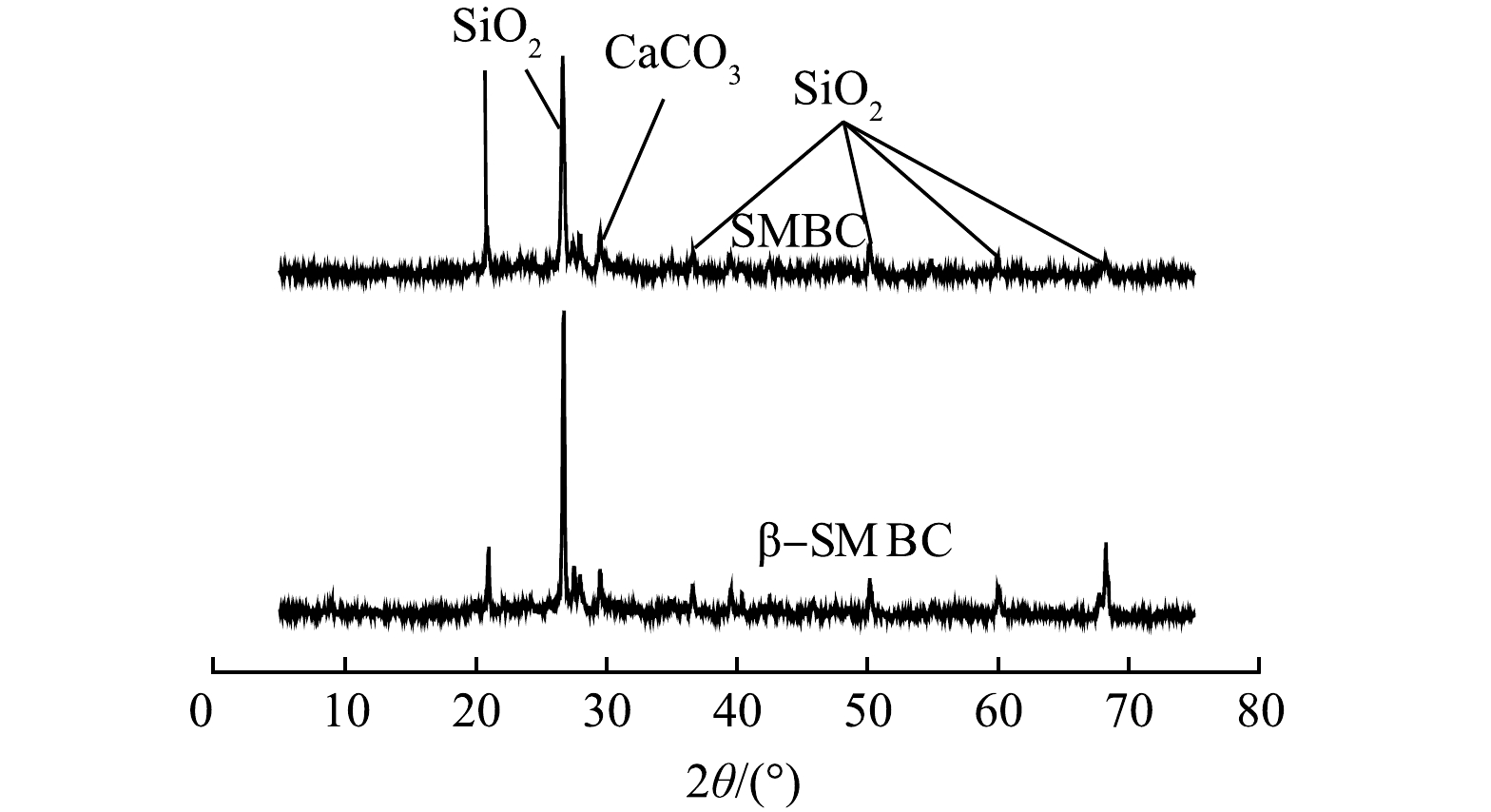
图2为SMBC和β-SMBC的XRD图谱。SMBC衍射图上主要的峰(2θ分别为20.87º、26.67º、36.88º、50.25º、60.03º和68.28º)均为SiO2的特征峰,在2θ在29.46º的衍射峰为CaCO3的特征峰,CO3−的存在有利于生物炭对阳离子的吸附。由图2可知,在改性前后,峰强和位置并无明显变化,表明改性过程并不影响SMBC的晶体结构。
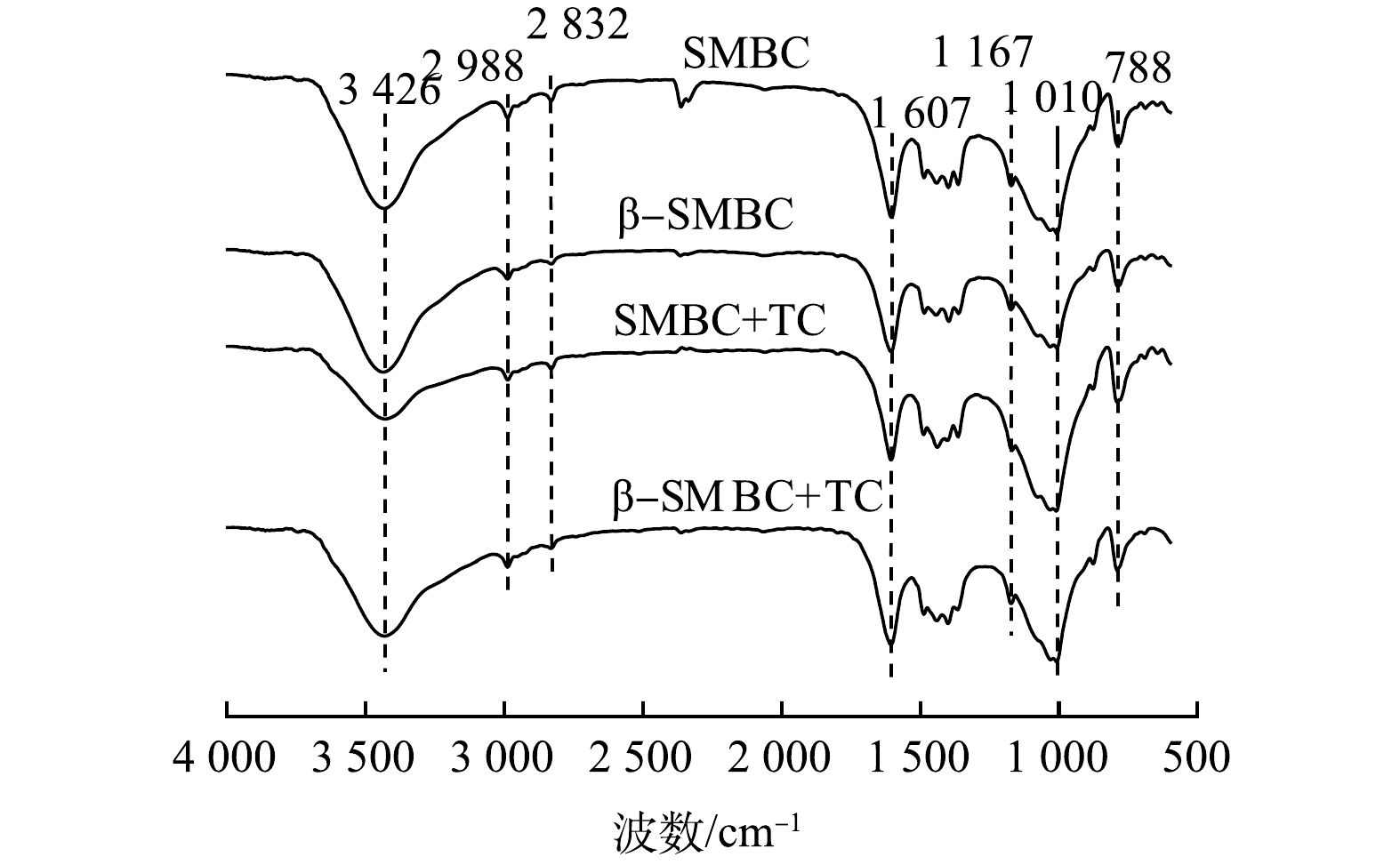
SMBC和β-SMBC吸附TC前后的FTIR图谱如图3所示。由图3可知,SMBC和β-SMBC具有相似的峰型,3 426 cm−1附近的峰为羟基(—OH)的伸缩振动峰,峰型比较宽泛,2 988 cm−1和2 823 cm−1的特征峰为C—H的伸缩振动区,主要基团有—CH3和—CH2—,1 607 cm−1附近的峰为芳环C=C的伸缩振动峰和—C=O—伸缩振动峰,1 167 cm−1附近的峰为碳水化合物中C—O的伸缩振动峰,1 010 cm−1附近的峰为C—O—C的伸缩振动峰,788 cm−1附近为C—H的伸缩振动峰[14-16]。以上结果表明,SMBC具有丰富的含氧官能团,经改性之后其表面官能团未发生改变。
-
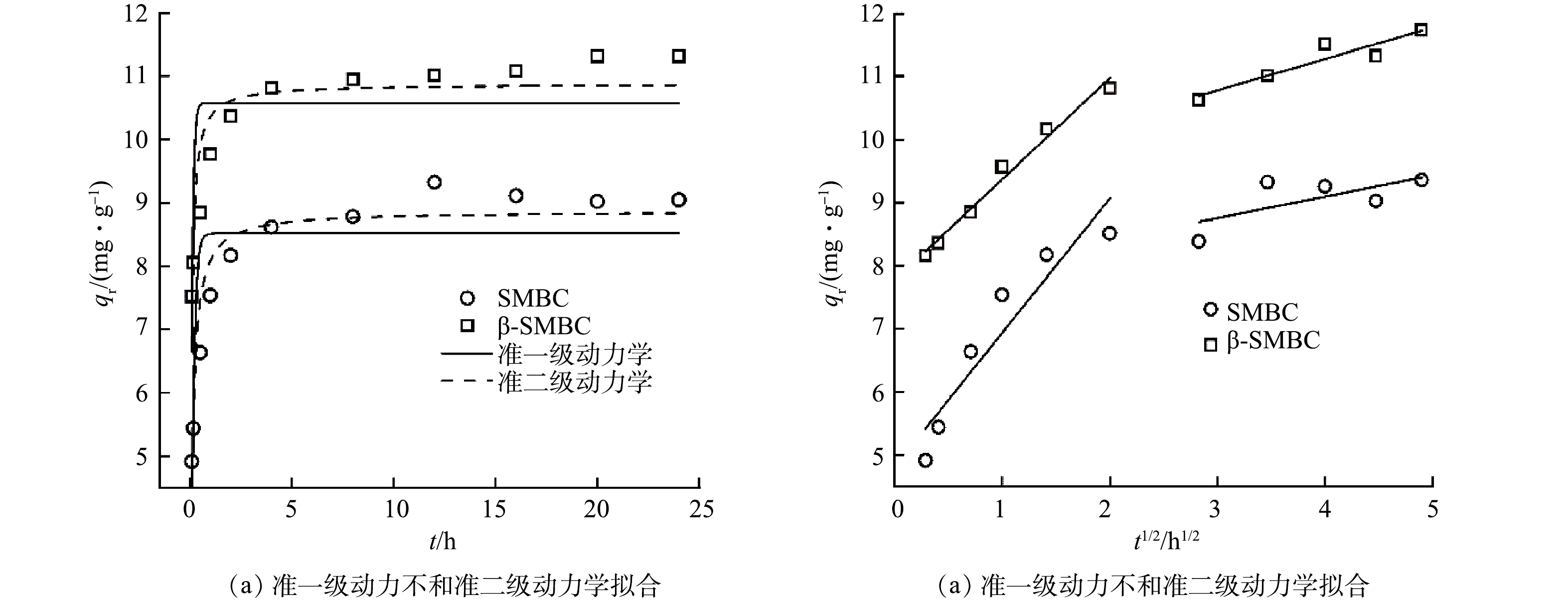
图4(a)为吸附剂对TC的吸附动力学拟合曲线。可以看出,在TC初始质量浓度为20 mg·L−1时,SMBC和β-SMBC对TC的吸附动力学规律基本一致,随着吸附时间的增加,TC的吸附量先增加后趋于平衡。在吸附初始阶段(4 h内),吸附剂可以为TC提供较多的吸附位点,吸附位点被占据后,吸附速率减小,吸附过程逐渐趋于稳定。在相同的吸附时间下,β-SMBC对TC的吸附量均大于SMBC。这主要是因为β-SMBC具有更大的比表面积和总孔体积,可为TC提供更多的吸附位点。
由表2可见,准二级动力学方程拟合所得R2均大于准一级动力学方程,此外,通过准二级动力学方程拟合所得TC理论吸附量(qm)与实验所得的平衡吸附量基本一致。因此,准二级动力学方程能更好地描述SMBC和β-SMBC对TC的吸附动力学过程,而且也表明SMBC和β-SMBC在对TC的吸附过程中,化学吸附是控制吸附速率的关键[10]。准二级动力学方程拟合所得β-SMBC的速率常数(k2)大于SMBC的,表明β-SMBC对TC的吸附效果更强。
TC吸附量qt与t1/2的曲线图(图4(b))表现出2个阶段。第1阶段(4 h以内)代表TC通过液膜扩散作用扩散到SMBC和β-SMBC表面,其中TC扩散穿过SMBC和β-SMBC颗粒周围的边界层是影响TC吸附速率大小的关键过程。第2阶段(4 h以后)代表TC从SMBC和β-SMBC表面继续扩散到其内部孔隙中直到吸附平衡。由表2可以看出,第1阶段拟合所得斜率Kd1(代表表面扩散速率)大于第2阶段拟合所得斜率Kd2(代表颗粒内扩散速率)。表明TC在SMBC和β-SMBC颗粒表面的扩散相较于颗粒内扩散更快,这主要是因为在开始阶段TC的浓度大,在高初始TC浓度的驱动下,TC更易从溶液迁移到吸附剂的表面,表面位点被TC占据后,SMBC和β-SMBC对TC的吸附速率则主要由颗粒内扩散所控制[17]。由表2和图4(b)可知,2个部分的拟合线均未过原点,且边界层常数C1和C2均不为0。说明颗粒内扩散不是吸附过程的唯一控速步骤,SMBC和β-SMBC对TC的吸附可能由表面扩散和颗粒内扩散共同控制[18]。
-
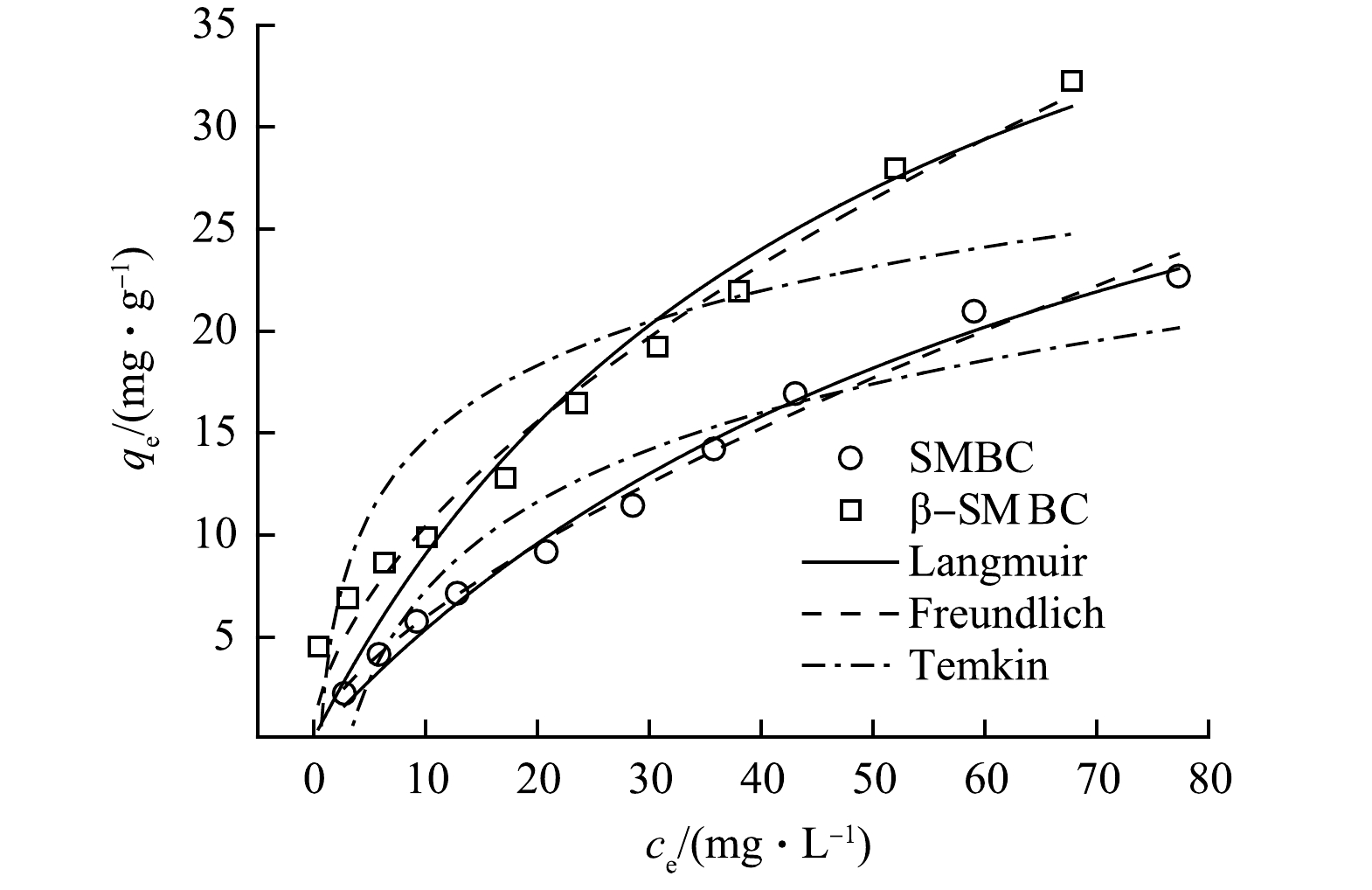
吸附等温线用于描述体系中SMBC(β-SMBC)表面的TC浓度与溶液中的TC浓度关系的曲线。图5为SMBC和β-SMBC吸附TC的等温吸附拟合曲线。可以看出,TC在SMBC和β-SMBC上的吸附量随着TC初始浓度的增加而增加。由表3可知,Freundlich方程拟合所得R2均大于其他方程拟合所得结果。这表明SMBC和β-SMBC对TC的等温吸附过程可被Freundlich模型更好地描述,说明SMBC和β-SMBC对TC吸附不局限于单分子层吸附,而是以多分子层不均匀吸附为主[19]。 此外,1/n代表有限吸附过程,SMBC和β-SMBC对TC吸附拟合所得1/n均小于1,说明TC分子易被SMBC和β-SMBC吸附[20]。通过Langmuir方程拟合所得SMBC和β-SMBC对TC的最大吸附量分别为35.050 mg·g−1和53.503 mg·g−1,说明SMBC经β-CD改性后对TC的吸附能力有一定提高。这主要是因为在改性过程中,生物炭的比表面积增大,吸附位点增加,同时在改性过程中引入了更多的含氧官能团,β-SMBC表面的羟基等含氧官能团与TC分子之间产生氢键作用力,从而通过β-CD改性后提高了对TC的吸附量[21]。
-
由表4可见,在不同温度下,∆Gθ均小于0。这表明SMBC和β-SMBC对TC的吸附是一个自发进行的过程。此外,∆Gθ均小于-20 kJ·mol−1,表明SMBC和β-SMBC对TC的吸附主要以物理吸附为主[15]。此外,∆Hθ>0,说明吸附过程是一个吸热的过程,随着温度的升高,SMBC和β-SMBC对TC的吸附量增加;∆Sθ>0,说明在吸附过程中吸附体系固液两相的混乱度增大。结合前文吸附动力学研究结果,推测SMBC和β-SMBC对TC的吸附过程中同时存在物理和化学吸附作用。
-
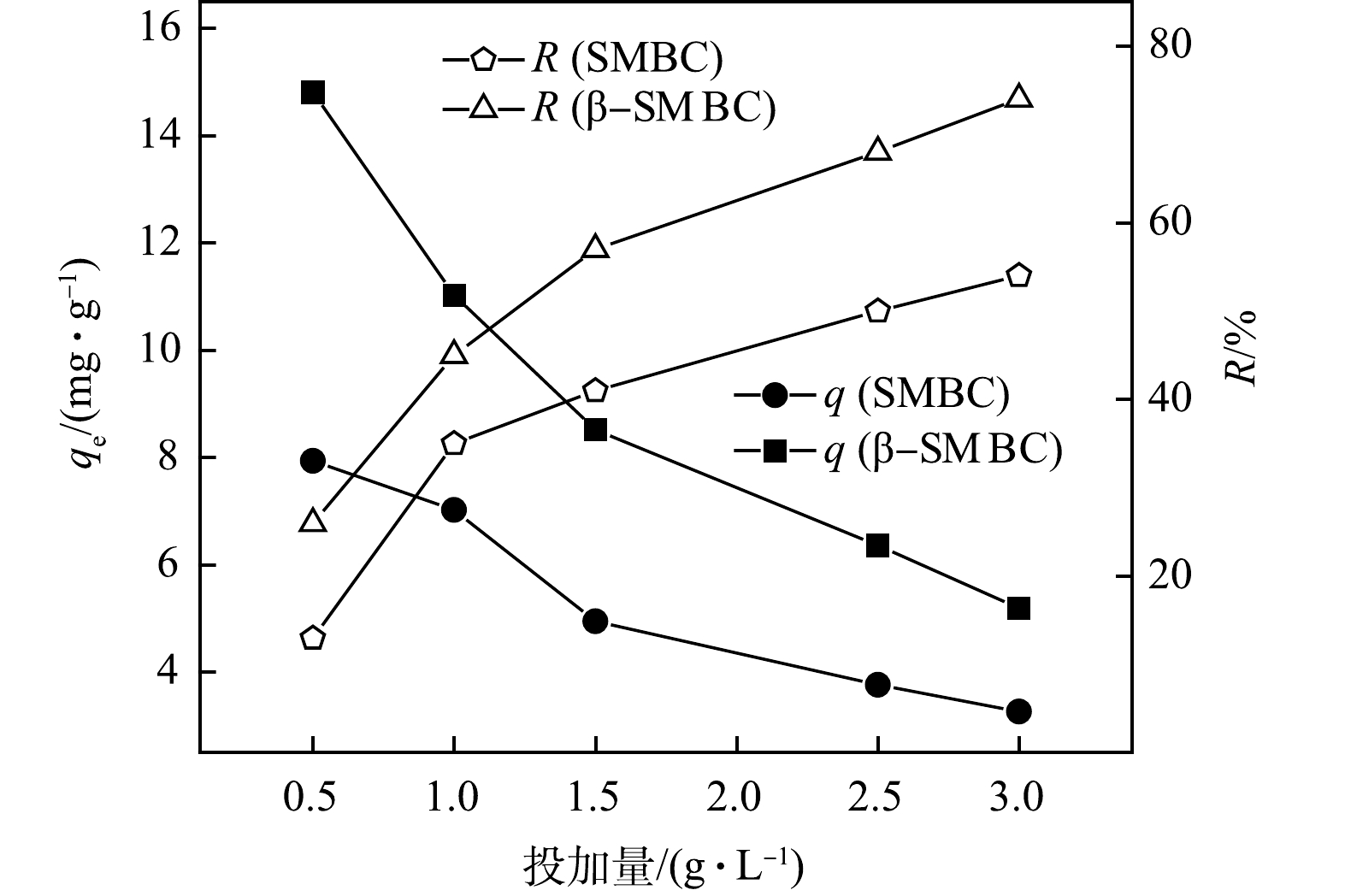
SMBC和β-SMBC投加量对TC吸附量和去除率的影响如图6所示。由图6可知,随着投加量从0.5 g·L−1增加到3.0 g·L−1时,SMBC和β-SMBC对TC的单位吸附量逐渐减小,并趋于平衡,但吸附剂对TC的去除率逐渐增大。在吸附剂投加量小于1.5 g·L−1时,随着投加量的增加,TC的去除率迅速增大。这是因为随着SMBC和β-SMBC投加量的增大,吸附体系中的SMBC和β-SMBC可为TC提供更多的吸附位点,从而有利于TC的去除。当投加量大于1.5 g·L−1时,SMBC和β-SMBC对TC的去除率增加趋缓,且单位吸附量基本趋于稳定。这主要是由于SMBC和β-SMBC投加量增大到一定程度会引起吸附剂的团聚,形成的团聚体反而不利于溶液中的TC扩散到其内部的吸附位点,从而导致SMBC和β-SMBC对TC吸附的单位吸附量减小[17]。因此,综合TC去除率以及经济效益,吸附剂的最佳投加量选择为1.5 g·L−1。
-
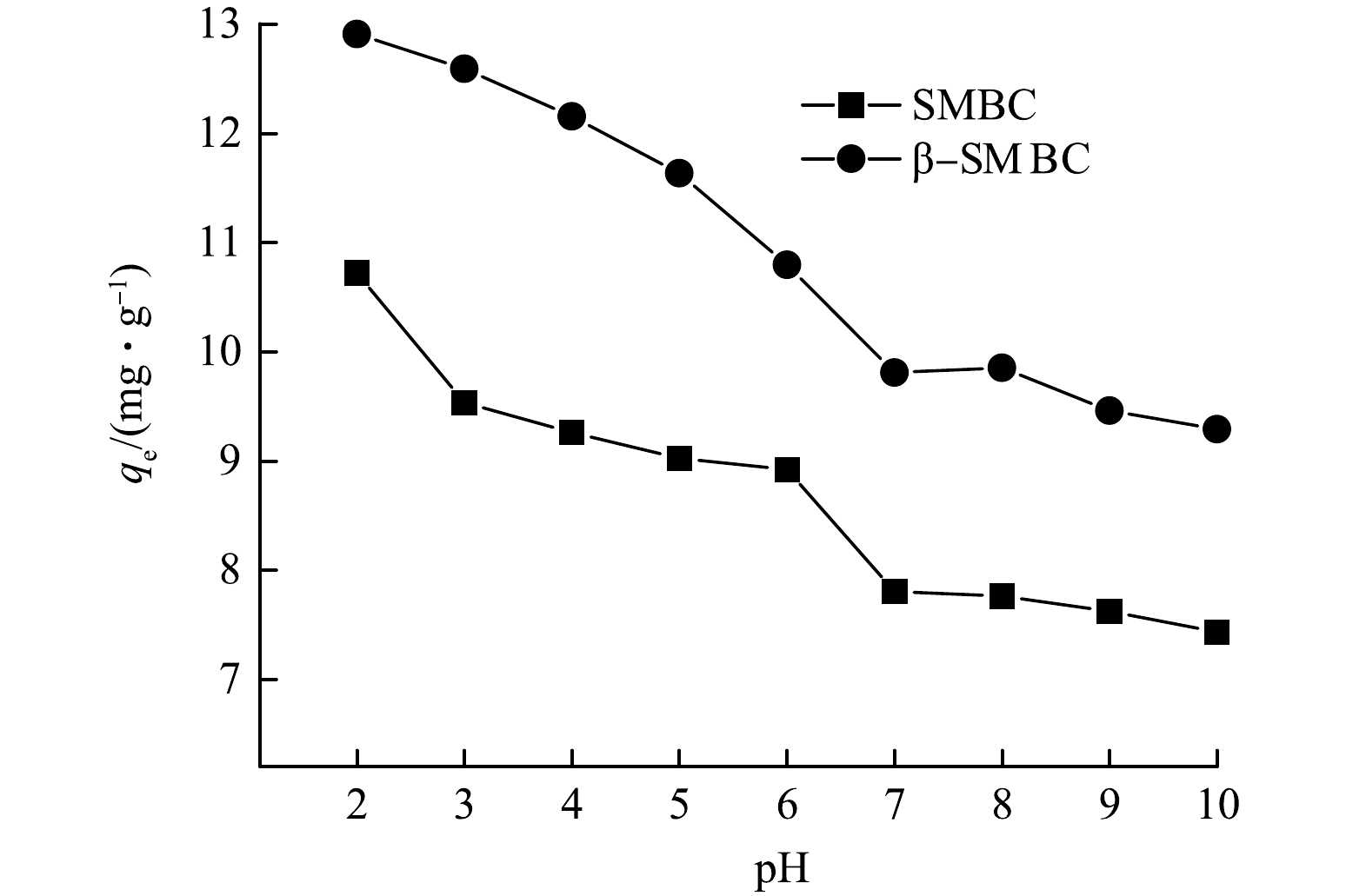
溶液初始pH对吸附剂的表面电荷特性、吸附质的溶解度以及吸附质在溶液中的赋存形态具有重要影响。TC是一种具有3个电离常数的两性有机物,电离常数分别为pKa1=3.4,pKa2=7.6,pKa3=9.7,当pH<3.4时,TC主要以阳离子TCH3+形态存在,当3.4<pH<7.6时,TC主要以中性离子TCH20形态存在,当7.6<pH<9.7时,主要以阴离子TCH−存在,当pH>9.7时,则主要以二价阴离子TC2-为主要存在形式[21]。由图7可知,随着初始溶液pH的增大,SMBC和β-SMBC对TC的吸附性能逐渐减弱,主要原因是溶液pH在2~3时,TCH3+能够和SMBC和β-SMBC表面大量的电负性位点结合,从而吸附量增大;当pH在4~8时,随pH的增大,吸附量明显减小,主要是由于吸附剂与TC分子间的静电吸引力和氢键作用变弱;当pH>8时,吸附量的变化很小,主要是在此时TC主要以阴离子形式存在,而静电吸引力明显减弱,结合前文分析可能是物理吸附和化学吸附共同作用的结果[22]。溶液初始pH的不同会影响SMBC和β-SMBC对TC的吸附作用,结果表明,在酸性条件下更有利于SMBC和β-SMBC对TC的的去除。因此溶液pH是影响TC吸附的重要因素。
-
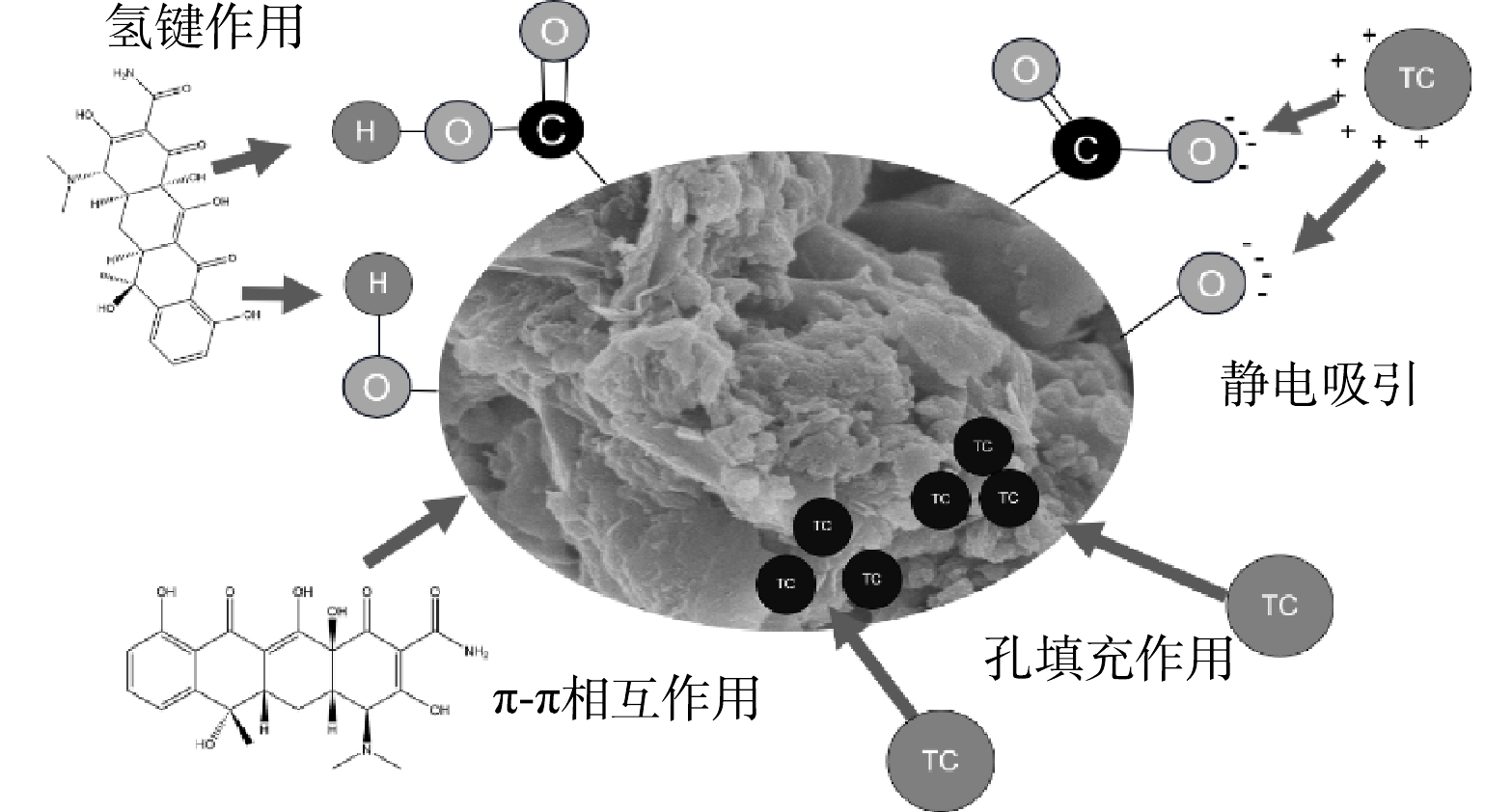
结合吸附特性结果可见,SMBC和β-SMBC对TC的吸附主要有物理吸附和化学吸附作用。为进一步探究TC在β-SMBC上的吸附机制,本文结合吸附前后FITR图谱、溶液pH对吸附的影响及模型拟合等进行探讨。由图3可以看出,SMBC和β-SMBC吸附TC后特征峰发生了一定变化,位于峰值3 426 cm−1处的—OH伸缩振动减弱,而1 010 cm−1处C—O—C峰强增大。说明在吸附过程中—OH中H被取代,从而导致—OH的减少。1 607 cm−1处—C=O—的伸缩振动也相对减弱,进一步证明氢键作用参与吸附过程[23-25]。位于788 cm−1的峰在吸附后峰强增加,表明芳环上的H被置换。TC分子中的氨基可通过氢键与β-SMBC表面的—OH和C—O—C等基团相互作用。FTIR图谱中可看出β-SMBC表面存在的大量含氧官能团,因此β-SMBC可作为π电子供体,而TC由于分子结构中存在不饱和单元(如氨基和芳香基团)可作为π电子受体,在吸附过程中β-SMBC可与TC分子发生EDA(电子供体-受体)相互作用,因此π-π相互作用也是主要的吸附机制[26]。前述有关溶液pH对β-SMBC吸附TC的影响研究中可看出,TC分子电离时,β-SMBC与TC的静电相互作用也发挥着较为重要的作用。
基于以上论述,β-SMBC对TC吸附机制如图8所示。β-SMBC对TC的主要吸附机制有静电作用、氢键作用和π-π相互作用,此外,β-SMBC的比表面积和孔结构发达,孔填充作用对TC的吸附有一定作用。
-
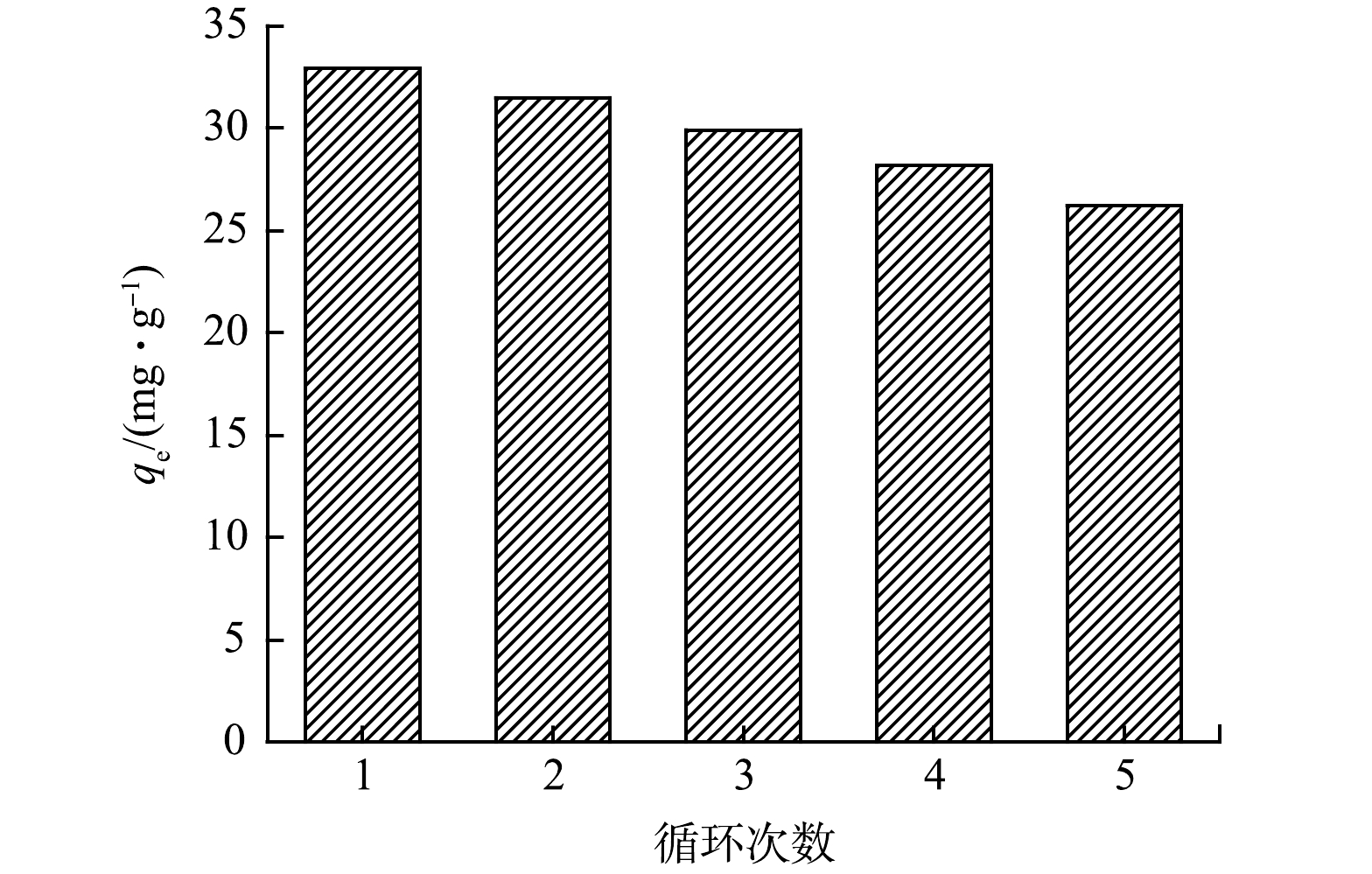
吸附剂经多次重复使用后吸附-解吸能力是衡量其经济性的重要指标。为进一步研究β-SMBC的重复利用性,使用0.1 mol·L−1的HCl为再生试剂,对吸附后的β-SMBC进行再生,而后用再生的β-SMBC对TC进行4次吸附-解吸实验。由图9可知,β-SMBC对TC的吸附能力随着循环次数的增加而逐渐降低,但仍然保持了较好的吸附效果,进行5次吸附-解吸循环后,β-SMBC对TC的吸附量保持在初始吸附量的79%。随着循环次数增加,吸附量呈下降趋势,这主要归因于β-SMBC吸附前后其物理和化学性质的变化,如吸附剂比表面积和总孔体积的减小以及表面官能团的消耗[27]。以上研究结果表明,β-SMBC再生后,可多次用于TC的吸附去除,证明其具有一定的成本效益和环境效益。
-
1)与SMBC相比,β-SMBC具有更大的比表面积,孔隙结构也更为发达,且具有更多的含氧官能团。
2)吸附动力学过程是一个前期快速吸附,后期慢速平衡的过程,吸附过程主要包括表面扩散和颗粒内扩散两个阶段,吸附动力学数据可被准二级动力学方程很好地拟合。SMBC和β-SMBC对TC的等温吸附行为能被Freundlich模型更好地描述,说明吸附过程不局限于单分子层吸附,而是以多分子层不均匀吸附为主,且主要的吸附机制为静电作用、氢键作用和π-π相互作用。吸附过程属于自发的吸热过程。
3)溶液pH是影响SMBC和β-SMBC吸附TC的重要因素,在低pH条件下,更有利于SMBC和β-SMBC对TC的吸附。当SMBC和β-SMBC投加量为1.5 g·L−1时可以达到最佳去除效果。再生后的β-SMBC具有较高的可重复利用性。
β-环糊精改性猪粪生物炭对水中四环素的吸附特性及机制
Adsorption characteristics and mechanism of tetracycline in water by swine manure biochar modified with β−cyclodextrin
-
摘要: 为了从源头控制抗生素污染以及达到“以废治废”的目的,以猪粪为原料制备猪粪生物炭(SMBC),以β-环糊精(β-CD)为改性剂制得改性猪粪生物炭(β-SMBC)。通过元素分析、比表面积分析、SEM和FTIR等对SMBC和β-SMBC的组成、形貌和结构进行表征。以四环素(TC)为目标污染物,考察了溶液pH、吸附剂投加量和温度对其吸附TC的影响,研究了SMBC和β-SMBC对水中TC的吸附特性及机制。结果表明:溶液pH对SMBC和β-SMBC吸附TC的影响较大,在酸性条件下更有利于TC的吸附。SMBC和β-SMBC对TC的吸附动力学均能被准二级动力学方程很好地描述,吸附过程主要包括液膜扩散和颗粒内扩散两个阶段。同时,Freundlich模型能更好的描述TC在SMBC和β-SMBC上的吸附行为,最大吸附量分别为35.050和53.503 mg·g−1。与SMBC相比,β-SMBC对TC的吸附效果更好,且主要的吸附机制为静电作用、氢键作用和π-π相互作用。热力学结果表明,SMBC和β-SMBC对TC的吸附是一个自发的吸热过程。上述结果表明,β-SMBC对TC具有较强的吸附性能且其重复利用性好,是一种在抗生素废水处理领域具有应用前景的高效、可再生吸附材料。Abstract: In order to control antibiotic pollution from the source and achieve the purpose of "treating waste with waste", swine manure biochar (SMBC) was prepared from swine manure, and β-cyclodextrin (β-CD) was used as modifier to prepare modified swine manure biochar (β- SMBC). The composition, morphology, and structure of SMBC and β-SMBC were characterized by elemental analysis, specific surface area analysis, SEM, and FTIR. Taking tetracycline (TC) as the target pollutant, the effects of solution pH, adsorbent dosage, and temperature on TC adsorption by SMBC and β- SMBC were investigated, and the adsorption characteristics and mechanisms of SMBC and β-SMBC on TC in water were studied. The results showed that the pH of the solution had a greater effect on TC adsorption by SMBC and β-SMBC, and TC adsorption was more favorable under acidic conditions. The adsorption kinetics of SMBC and β-SMBC toward TC could be well described by the pseudo-second-order equation, and the adsorption process was mainly divided into two stages: liquid film diffusion and internal particle diffusion. Meanwhile, the Freundlich models could better describe the adsorption behavior of TC on SMBC and β-SMBC with maximum adsorption of 35.050 and 53.503 mg·g−1, respectively, and TC removal by β-SMBC was better than SMBC. The main adsorption mechanisms are electrostatic interaction, hydrogen bonding, and π - π interaction. The thermodynamic results indicated that the adsorption of TC by SMBC and β-SMBC was a spontaneous endothermic process. In conclusion, β-SMBC had a strong performance on TC adsorption and its reusability was excellent. Therefore, β-SMBC is a highly efficient and regenerable adsorbent material with application prospects in the field of antibiotic wastewater treatment.
-
Key words:
- swine manure /
- biochar /
- β-Cyclodextrin /
- tetracycline /
- adsorption mechanisms
-

-
表 1 SMBC和β-SMBC的物理化学性质
Table 1. Physico-chemical characteristics of SMBC and β-SMBC
吸附剂 C/% H/% O/% N/% 灰分/% H/C O/C (O+N)/C 比表面积/ (m2·g−1) 总孔体积/(cm3·g−1) SMBC 48.45 1.79 33.35 0.67 15.34 0.036 0.688 0.702 6.11 0.016 β-SMBC 53.62 1.85 23.20 0.75 20.58 0.034 0.432 0.446 15.35 0.022 表 2 SMBC和β-SMBC吸附TC的动力学模型拟合参数
Table 2. Kinetic parameters for TC adsorption on SMBC and β-SMBC
吸附剂 准一级动力学 准二级动力学 颗粒内扩散 qm/(mg·g−1) k1/h−1 R2 qm/(mg·g−1) k2/(g·(mg·h)−1) R2 Kd1 C1 R2 Kd2 C2 R2 SMBC 8.516 7.198 0.716 8.869 1.168 0.909 2.129 4.802 0.888 0.340 7.728 0.468 β-SMBC 10.567 11.964 0.610 10.877 1.842 0.856 1.602 7.764 0.982 0.498 9.283 0.873 表 3 SMBC和β-SMBC吸附TC的等温线拟合参数
Table 3. Isotherm parameters for the adsorption TC onto SMBC and β-SMBC
吸附剂 Langmuir Freundlich Temkin qm/(mg·g−1) KL/(L·mg−1) R2 KF/(L·mg−1) n R2 A/(L·mg−1) Kt/(J·mol−1) R2 SMBC 35.050 0.013 0.988 1.256 1.478 0.990 0.315 6.309 0.909 β-SMBC 53.503 0.020 0.941 2.740 1.725 0.979 1.595 5.285 0.758 表 4 SMBC和β-SMBC吸附TC的热力学参数
Table 4. Thermodynamics parameters for TC adsorption by SMBC and β-SMBC
吸附剂 ∆Hθ/(kJ·mol−1) ∆Sθ/[J·(mol·K)−1] ∆Gθ/(kJ·mol−1) 298 K 308 K 318 K SMBC 0.0103 81.325 −24.124 −24.937 −25.750 β-SMBC 0.0258 100.174 −29.804 −30.805 −31.806 -
[1] CHEN Z Y, ZHANG W, WANG G, et al. Bioavailability of soil-sorbed tetracycline to Escherichia coliunder unsaturated conditions[J] Environmental Science & Technology, 2017, 51 (11): 6165–6173. [2] LIU J L, ZHOU B Q, ZHANG H, et al. A novel Biochar modified by Chitosan-Fe/S for tetracycline adsorption and studies on site energy distribution[J]. Bioresource Technology, 2019, 294: 122152. doi: 10.1016/j.biortech.2019.122152 [3] YU F, LI Y, HAN, S, et al. Adsorptive removal of antibiotics from aqueous solution using carbon materials[J]. Chemosphere, 2016, 153: 365-385. doi: 10.1016/j.chemosphere.2016.03.083 [4] CHEN Y, WANG F, DUAN L, et al. Tetracycline adsorption onto rice husk ash, an agricultural waste: Its kinetic and thermodynamic studies[J]. Journal of Molecular Liquids, 2016, 222: 487-494. doi: 10.1016/j.molliq.2016.07.090 [5] XU L Y, ZHANG H, XIONG P, et al. Occurrence, fate, and risk assessment of typical tetracycline antibiotics in the aquatic environment: A review[J]. Science of the Total Environment, 2020, 753: 141975. [6] ZHANG Z L, LI Y, DING L, et al. Novel sodium bicarbonate activation of cassava ethanol sludge derived biochar for removing tetracycline from aqueous solution: Performance assessment and mechanism insight[J]. Bioresource Technology, 2021, 330(5): 124949. [7] 马锋锋, 赵保卫, 钟金魁, 等. 牛粪生物炭对磷的吸附特性及其影响因素研究[J]. 中国环境科学, 2015, 35(4): 1156-1163. [8] 姜晶, 黄晓月, 白金龙, 等. 高锰酸钾改性生物炭对水中噻虫胺吸附性能及机理[J]. 环境工程学报, 2022,16(4):1175-1185. [9] LUO X W, SHEN M X, LIU J H, et al. Resource utilization of piggery sludge to prepare recyclable magnetic biochar for highly efficient degradation of tetracycline through peroxymonosulfate activation[J]. Journal of Cleaner Production, 2021, 294: 126372. doi: 10.1016/j.jclepro.2021.126372 [10] WANG H L, CAO X D, RINKLEBE J. Biochar effects on environmental qualities inmultiple directions[J]. Chemosphere, 2020, 250: 126306. doi: 10.1016/j.chemosphere.2020.126306 [11] WANG Z Y, HAN L F, SUN K, et al. Sorption of four hydrophobic organic contaminants by biochars derived from maize straw, wood dust and swine manure at different pyrolytic temperatures[J]. Chemosphere, 2016, 144: 285-291. doi: 10.1016/j.chemosphere.2015.08.042 [12] CHEN T W, LING L, DENG S H, et al. Sorption of tetracycline on H3PO4 modified biochar derived from rice straw and swine manure[J]. Bioresource Technology, 2018, 267: 431-437. doi: 10.1016/j.biortech.2018.07.074 [13] HUANG T, SU Z Y, DAI Y X, et al. Enhancement of the heterogeneous adsorption and incorporation of uraniumVI caused by the intercalation of β-cyclodextrin into the green rust[J]. Environmental Pollution, 2021, 290: 118002. doi: 10.1016/j.envpol.2021.118002 [14] ZHAO H T, MA S, ZHENG S Y, et al. β–cyclodextrin functionalized biochars as novel sorbents for high-performance of Pb2+ removal[J]. Journal of Hazardous Materials, 2019, 362(15): 206-213. [15] LIU J, ZHOU J, WU Z H, et al. Concurrent elimination and stepwise recovery of Pb(II) and bisphenol A from water using β–cyclodextrin modified magnetic cellulose: adsorption performance and mechanism investigation[J]. Journal of Hazardous Materials, 2022, 432: 128758. doi: 10.1016/j.jhazmat.2022.128758 [16] 桂向阳, 刘晨, 许吉宏, 等. 畜禽粪便生物炭的二维红外光谱分析[J]. 光谱学与光谱分析, 2020, 40(11): 292-298. [17] 马锋锋, 赵保卫, 刁静茹, 等. 磁性生物炭对水体中对硝基苯酚的吸附特性[J]. 中国环境科学, 2019, 39(1): 172-180. doi: 10.3969/j.issn.1000-6923.2019.01.019 [18] CHEN Y C, LIU J T, ZENG Q B, et al. Preparation of Eucommia ulmoides lignin-based high-performance biochar containing sulfonic group: Synergistic pyrolysis mechanism and tetracycline hydrochloride adsorption[J]. Bioresource Technology, 2021, 329: 124856. doi: 10.1016/j.biortech.2021.124856 [19] LI B, ZHANG Y, XU J, et al. Effect of carbonization methods on the properties of tea waste biochars and their application in tetracycline removal from aqueous solutions[J]. Chemosphere, 2021, 267(12): 129283. [20] HAMEED B H, TAN I, AHMAD A L. Adsorption isotherm, kinetic modeling and mechanism of 2, 4, 6-trichlorophenol on coconut husk-based activated carbon[J]. Chemical Engineering Journal, 2008, 144(2): 235-244. doi: 10.1016/j.cej.2008.01.028 [21] JANG H M, KAN E. Engineered biochar from agricultural waste for removal of tetracycline in water[J]. Bioresource Technology, 2019, 284: 437-447. doi: 10.1016/j.biortech.2019.03.131 [22] YU H X, GU L, CHEN L, et al. Activation of grapefruit derived biochar by its peel extracts and its performance for tetracycline removal[J]. Bioresource Technology, 2020, 316: 123971. doi: 10.1016/j.biortech.2020.123971 [23] CHATHURI P, SAMEERA R. G, TODD E. M, et al. Biochar based removal of antibiotic sulfonamides and tetracyclines in aquatic environments: A critical review.[J]. Bioresource Technology, 2017, 246: 150-159. doi: 10.1016/j.biortech.2017.07.150 [24] ZENG Z, YE S, WU H, et al. Research on the sustainable efficacy of g -MoS2 decorated biochar nanocomposites for removing tetracycline hydrochloride from antibiotic-polluted aqueous solution[J]. Science of the Total Environment, 2018, 648: 206-217. [25] HOSLETT J, GHAZAL H, KATSOU E, et al. The removal of tetracycline from water using biochar produced from agricultural discarded material[J]. Science of the Total Environment, 2021, 751: 141755. doi: 10.1016/j.scitotenv.2020.141755 [26] JI L L, CHEN W, DUAN L, et al. Mechanisms for strong adsorption of tetracycline to carbon nanotubes: a comparative study using activated carbon and graphite as adsorbents[J]. Environmental Science & Technology, 2009, 43(7): 2322-2327. [27] Geng X X, Lv S Y, Yang J, et al. Carboxyl-functionalized biochar derived from walnut shells with enhanced aqueous adsorption of sulfonamide antibiotics[J]. Journal of Environmental Management, 2021, 280: 111749. doi: 10.1016/j.jenvman.2020.111749 -




 下载:
下载: