-
水体氮污染是引起富营养化的主要原因之一[1-2]。近些年来,国家对城镇污水处理厂出水的氮含量不断提出更高的要求。因此,采用更为高效的技术对城市污水处理厂尾水进行深度脱氮处理,以降低尾水中的氮含量,已是大势所趋。硫自养反硝化和异养反硝化是目前2种非常成熟的生物脱氮技术。针对含氮废水,硫自养反硝化菌可以利用单质硫或还原态硫化物作为电子供体进行反硝化脱氮,不需要外加碳源,且污泥产量低、活性高[3]。而以异养反硝化为主体的脱氮工艺因其具有处理时间短、处理水量大、易于维护管理的特点,目前还无法被取代。异养反硝化虽然脱氮速率快,但出水氮含量很难达到更低水平,故将硫自养反硝化作为其补充能够取得更加优异的脱氮效果。
因此,在异养反硝化系统中投加硫源,构建协同反硝化体系,成为本领域的研究方向之一。李祥等[4]在启动成功的异养反硝化反应器中添加硫磺作为硫源,培养硫自养反硝化菌,在没有额外添加无机碳源的情况下,运行116 d后,体系的总氮去除率达85%以上,并且减少了60%的污泥量。XU等[5]在污水处理厂二沉池出水中加入有机碳源后,再让其通入以硫磺为填料的自养反硝化反应器,使出水总氮由(12.9±1.8) mg∙L−1进一步降至2.5 mg∙L−1以下。已有研究者在活性污泥中添加硫源来实现以异养为主的协同反硝化,但目前膜生物反应器内以异养为主的协同反硝化研究还相对较少,而相比于活性污泥法,膜生物反应器法具有污泥少、不发生污泥膨胀、操作简便的优势。因此,若能在膜生物反应器中实现以异养为主的硫自养与异养协同反硝化,将具有十分重要的工程意义。
因为陶粒成本低、挂膜速度快、脱氮效率高,所以,采用膜生物反应器法的污水处理厂大多采用陶粒作为填料来进行挂膜。在硫自养反硝化中,从反应速率、投资成本、副产物生成等方面考虑,以单质硫作为硫源更具优势[6]。因此,将陶粒和硫磺混合作为反硝化生物填料更加符合实际应用,且硫磺既能作为硫源,也能和陶粒一起作为填料被反硝化生物附着,形成生物膜。基于上述原因,本研究将硫磺颗粒与陶粒填料混合填充至反应柱中,形成自养与异养耦合的反硝化体系,针对城市污水处理厂尾水,在不同的陶粒和硫磺比例下,通过对反应器进出水离子之间变化关系的探究及微生物学分析,揭示反应器中硫自养和异养协同反硝化的作用机制,并分析将其运用于城市污水处理厂尾水深度脱氮的可行性。
-
接种的反硝化菌采用甘度公司的反硝化菌种进行培养驯化。甘度反硝化菌粉中主要包括有假单胞菌属、产碱杆菌属、科奈瑟菌科、红螺菌科、芽孢杆菌属、纤维粘菌科等。驯化反硝化菌用水的主要成分为:0.5 g∙L−1 CH3COONa、0.4 g∙L−1KNO3,大量元素:0.01 g∙L−1KH2PO4、0.0056 g∙L−1 CaCl2·2H2O、0.3 g∙L−1MgSO4·7H2O、0.5 g∙L−1KHCO3;微量元素:微量元素浓缩液A 1.25 mL∙L−1,微量元素浓缩液B 1.25 mL∙L−1。微量元素浓缩液A的组成:5 g∙L−1FeSO4、5 g∙L−1EDTA-Na;微量元素浓缩液B的组成:15 g∙L−1EDTA-Na、0.0014 g∙L−1H3BO4、0.99 g∙L−1MnCl2·4H2O、0.25 g∙L−1CuSO4·5H2O、0.21 g∙L−1NaSeO4·10H2O、0.19 g∙L−1NiCl2·6H2O、0.43 g∙L−1ZnSO4·7H2O、0.22 g∙L−1NaMoO4·2H2O。
富集培养方法:称取150 g的甘度反硝化菌粉于20 L的塑料水桶中,加入15 L自来水,搅拌均匀,氮气吹脱5~10 min营造缺氧环境。保持室内温度25 ℃,每3天重新加入1次营养物质,加入比例与初始用水相同,重复2次。而后在塑料水桶内加入2 g∙L−1的颗粒硫磺,以同样条件继续培养3次。
-
本研究的实验装置为柱式生物滤池反应器,进水方式采用连续上流式。反应器内径为6 cm,有效高度为65 cm,为有机玻璃材质,出水口距离布水板的高度为60 cm,取样口距离布水板的高度为15 cm。实验全过程均在25 ℃环境下进行。
-
共设置7个不同比例的陶粒-硫磺组合,装入150 mL的广口锥形瓶中。每个锥形瓶中加入60 mL的填料,各实验组中陶粒与硫磺的体积比分别为1∶0、5∶1、2∶1、1∶1、1:2、1∶5和0∶1。批次实验结果表明,陶粒与硫磺体积比为2∶1和5∶1的2组混合生物填料脱氮效率较高。故实验中共设置了3个反应柱,编号分别为R1(异养对照组)、R2(高硫耦合组)、R3(低硫耦合组),填充填料中陶粒与硫磺的比分别为1∶0、2∶1、5∶1,相应的床孔隙率分别为53%、45%、50%。
挂膜方式为闷曝挂膜,模拟废水由实验室自来水加入乙酸钠和硝酸钾配制而成。在硫自养与异养耦合反硝化体系中,随着有机碳源投加量的增加,异养反硝化所占的比例越来越高,体系总体脱氮效率有所提升。这说明硫自养和异养反硝化的脱氮效果有叠加效应[7-9],而过高的硫源对异养反硝化和硫自养反硝化均会产生抑制作用[10]。因此,在该运行过程中必须及时关注各种基质的浓度,才能确保其脱氮效果。在各反应器挂膜成功后,保持进水NO3−的质量浓度为30 mg∙L−1,反应器进水的C/N在1~3、4~6、7~9阶段分别控制在2、4、6,每个C/N条件下的HRT控制在4 、2、1 h,总共分为9个运行阶段,每个阶段的运行时长为28 d。3个反应器在各阶段的运行条件如表1所示。
-
1)水质指标分析方法。水样采集间隔为48 h,实验水样采集之后立即用0.45 μm水系滤膜过滤,放置于50 mL离心管内,并保存于4 ℃冰箱中待测。监测分析方法参考《水和废水监测分析方法》(第四版),NH4+采用纳氏试剂法测定,pH采用便携式pH计测定,NO3−-N、NO2−-N、SO42−采用离子色谱仪(戴安ICS-1100)进行测定,COD采用国标法测定。
2)其他分析方法。微生物群落结构分析采用16S rRNA高通量基因测序分子生物学技术进行。为分析附着在填料表面上的生物膜,取填料样品,采用超声的方法将附着生长的微生物振离后,反复冲洗,收集冲洗液,再经抽滤截留将微生物富集。
-
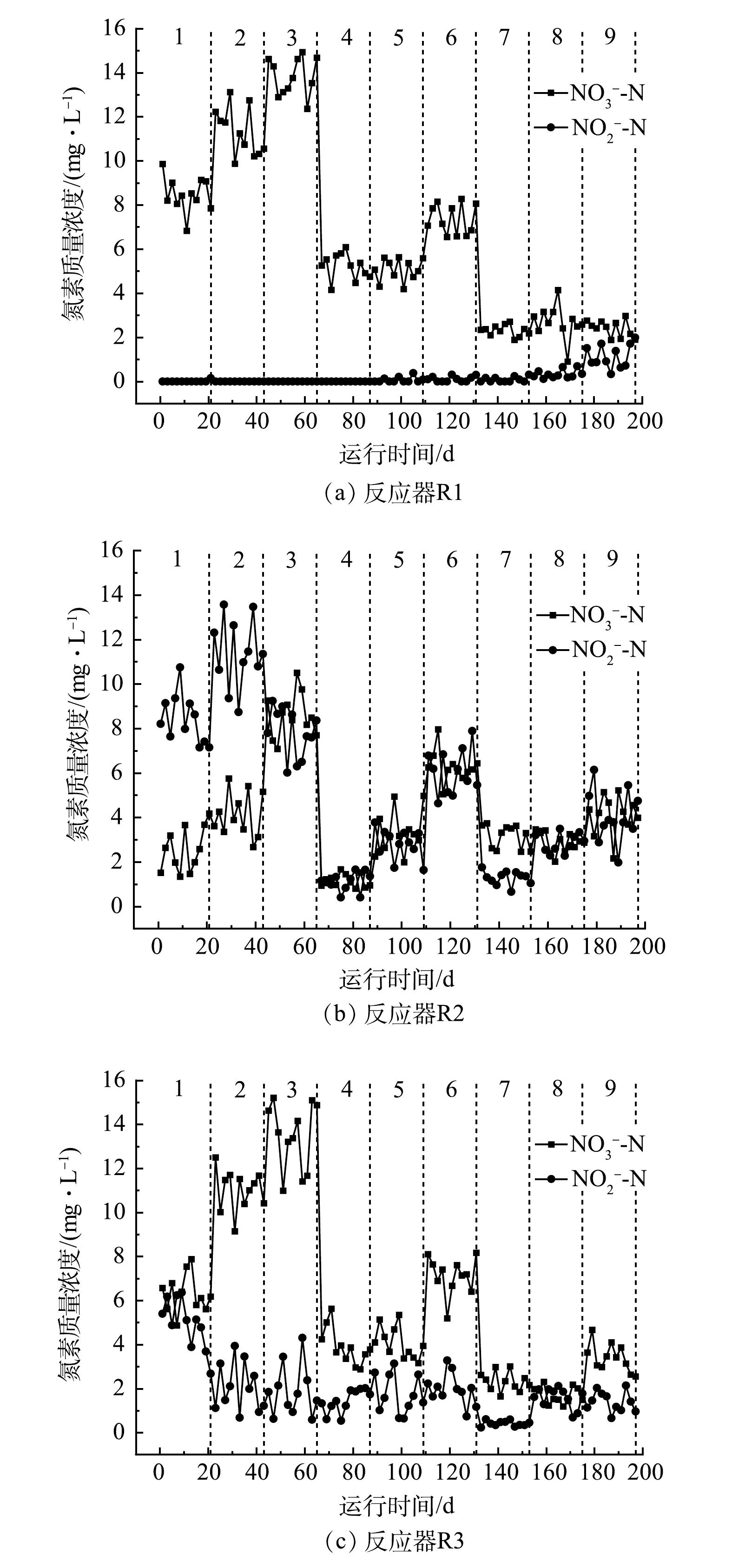
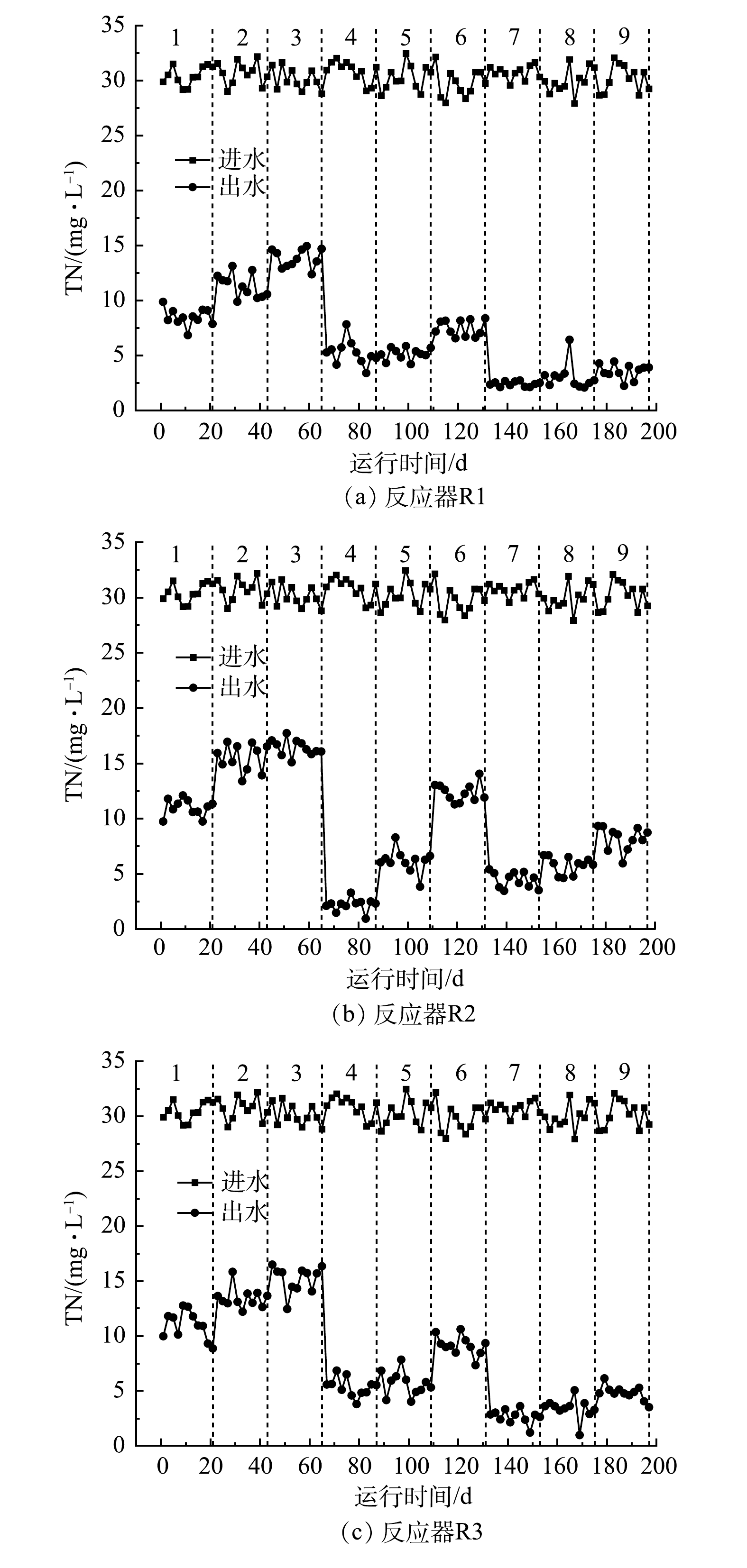
模拟废水以KNO3作为氮污染源,而实验出水中未检测出NH4+-N,因此,进水NO3−-N浓度近似为总氮浓度,而出水总氮近似为NO3−-N和NO2−-N浓度之和。如图1所示,第在1~3阶段,C/N较低,出水TN较高, TN的去除率随HRT的缩短而降低。这说明在C/N为2的条件下,硫自养与异养耦合反硝化的脱氮能力要比异养反硝化弱。相比于第1~3阶段,在第4~6阶段,总体脱氮效率有所提升, R2在第4阶段对TN的去除率为(92.62±1.36)%,比R1高出10%左右,平均出水TN质量浓度仅为(2.28±0.44) mg∙L−1,说明R2取得了较好的耦合反硝化效果。在第7~9阶段,相较于第4~6阶段(除R2第4阶段),3个反应器对TN的去除率均得到提升。从总体上来看,这3个阶段R1的平均出水TN浓度较低,且在HRT由4 h缩短到1 h的过程中,对其脱氮效率的影响不大,仅降低了3%左右,而R2、R3的平均出水TN浓度比R1要高。这可能是因为,随着C/N提升到6,反应器内碳源充足,各反应器内的环境越来越适合异养反硝化菌群的生长,不利于硫自养与异养反硝化的耦合,R1的脱氮效率因碳源充足而提高,而在R2和R3中因反应器内硫自养反硝化的存在,对异养反硝化造成了影响,脱氮效率有所降低。
综上所述,在C/N为4,HRT为4 h的情况下,陶粒与硫磺填料比为2∶1的混合生物填料反应器对总氮有较好的处理效果,其脱氮效率与C/N为6、HRT为4 h下的异养反硝化对照组相近,分别为(92.62±1.36)%和(92.21±0.74)%,出水TN均在3 mg∙L−1以下。虽然去除效率基本相同,但R2减少了33%碳源的使用,降低了碳源投加的成本。若R1的进水C/N也为4,则R2的总氮去除效率要比R1高10%左右。以上结果都说明,硫自养与异养反硝化在此条件取得了较佳的协同脱氮效果。综合9个阶段来看,以陶粒为主体填料决定了异养反硝化在耦合体系中的主体地位,所以C/N对脱氮效率影响较大。实验中,HRT的改变对R1的影响最小。这是因为异养反硝化的脱氮速率相比硫自养反硝化更快,而随着填料中硫磺比例的提高,硫自养反硝化在体系内的作用更加明显。因此,对于R2和R3反应器来说,脱氮效率对HRT的变化更为敏感。
由图2(a)可以看出,在第4~5阶段,R1反应器的出水中开始检测到NO2−-N,并且在第7~9阶段,NO2−-N的浓度逐渐升高。其原因可能为,在C/N为2和4的阶段,R1反应器内NO2−-N转化为N2的速率要大于NO3−-N转化为NO2−-N的速率。但C/N为6时,当HRT由4 h缩短至1 h时,NO3−-N的还原速率最终超过了NO2−-N的还原速率,异养反硝化菌很难将产生的NO2−-N全部还原,从而造成出水NO2−-N的积累。
R2出水的氮素变化如图2(b)所示。在第1和第2阶段,R2中的NO3−-N出水浓度比R1低,但NO2−-N却比R1要高的多。这表明R2内的硫自养反硝化促进了体系内NO3−-N还原为NO2−-N。其原因有2点:一方面可能是硫自养反硝化本身的转化作用,加速了NO3−-N的还原;另一方面也可能是硫自养反硝化促进了异养反硝化菌的活性,加速了NO3−-N转换为NO2−-N的过程。而体系内NO2−-N的大量积累,可能是因异养反硝化的电子供体不足或者硫自养反硝化还原NO2−-N的速率较慢所致。在第4阶段,R2的NO3−-N和NO2−-N出水浓度相较于R1更低,在1 mg∙L−1左右。这说明:在第4阶段R2反应器内的硫自养反硝化对NO3−-N转换为NO2−-N同样具有促进作用。再对比R2的第1~2阶段,出水氮素浓度较低应该是NO2−-N的还原速率大幅提高所致。这可能是因为:在C/N为4的情况下,反应器内有机物充足,异养反硝化能够顺利的将NO2−-N还原。
如图2(c)所示,R3反应器各阶段的出水NO3−-N浓度与R1相近,但R3在各阶段都出现NO2−-N的积累。这是其在各阶段对TN平均去除率低于R1的主要原因。注意到在第1、4、5阶段,R3的平均NO3−-N出水浓度低于R1,高于R2。这也证明了陶粒与硫磺混合体系的确能够促进NO3−-N还原为NO2−-N,但其促进程度与填料中的硫磺占比有关,即与体系内的硫自养反硝化水平有关。另外还注意到,R2在HRT为2.5 h和1 h的阶段,NO2−-N的出水浓度均要高于R3。这可能是因为R2反应器内硫磺的占比较高,使得体系内硫自养反硝化菌的占比较高,在HRT较低的情况下,硫自养反硝化菌还原NO2−-N速率低于异养反硝化菌,所以积累了较多的NO2−-N。
-
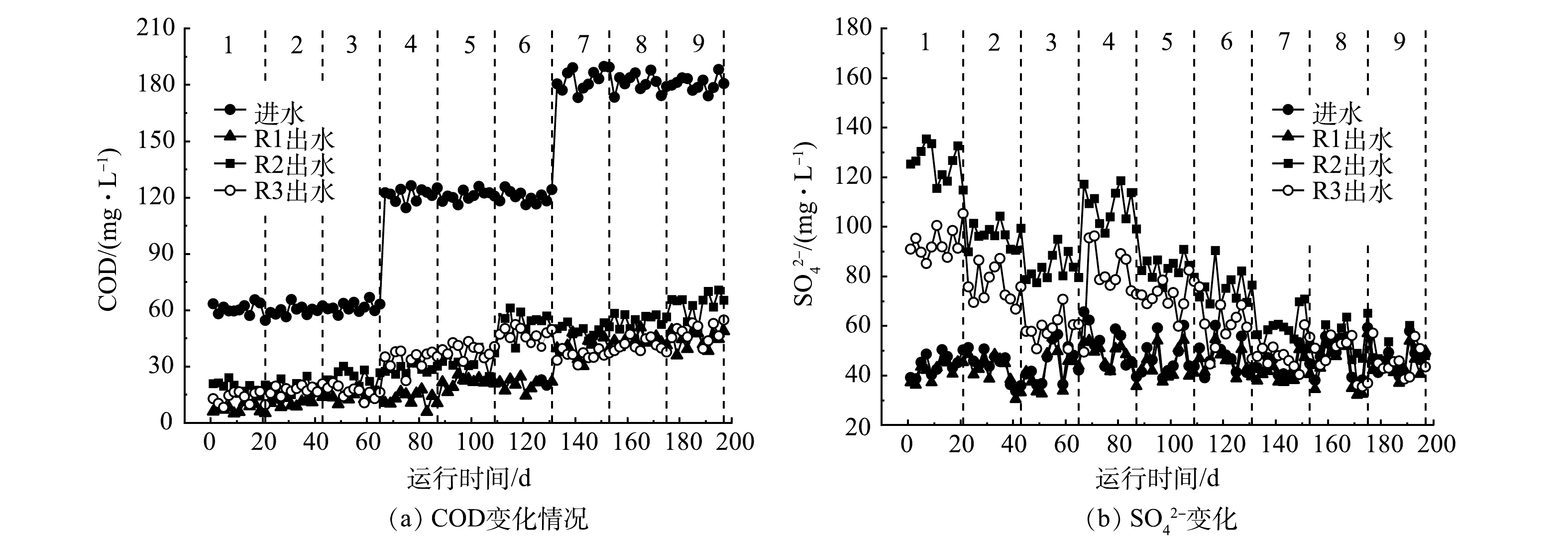
1) COD和SO42−变化规律。进出水COD和SO42−变化情况也能反映体系内异养与硫自养反硝化情况。由图3(a)可看出,随着C/N的升高,剩余的出水COD也越来越高。结合脱氮效果,对于R1和R3,提高C/N虽能够提升脱氮效率,但C/N过高会引起出水COD升高,而增加碳源也会使处理成本提高,因此,通过提升C/N比来提高脱氮效率并不是最好的选择。对比第4~6阶段和第7~9阶段可见,当C/N为4和6时,各反应器的COD利用量与HRT呈负相关,而各反应器对HRT变化的敏感程度和填料中的硫磺占比呈正相关,硫磺占比越高,HRT缩短时对COD利用量的影响就越大。
由图3(b)可见,R1各阶段的进出水SO42−浓度几乎没有发生变化,且除第3和第6阶段外,其他阶段的出水SO42−浓度要略低于进水。其原因可能是,R1反应器存在少量的硫酸盐还原菌,还原了一部分SO42-[11]。针对R2而言,C/N越低,HRT越长,则SO42−生成量越高。此外,R2在第1~3阶段的SO42−平均生成量的降低量大于第7~9阶段,这说明HRT对R2反应器SO42−生成量的影响能力与C/N也有联系。其原因可能是,在C/N较低时,R2中硫自养反硝化的占比较高,所以C/N越低,HRT对SO42−生成量的影响越大,反之,则影响越小。R3的SO42−平均生成量在各阶段均略低于R2。这可能是由于R3反应器中填料的硫磺占比较低,硫自养反硝化的效果不如R2反应器。
2)反应器填料表面SEM分析。为了观察反应器内微生物的生长情况,本研究将不同C/N条件下(第1、4、7阶段)各反应器中的陶粒填料取出并进行SEM分析。由图4(a)可以看到,陶粒表面有许多孔隙和一些碎石状的物体。这说明陶粒的比表面积较大,可为反硝化菌的附着与生长提供了较佳的条件。在挂膜完成后,陶粒表面零散的分布着一些球菌和杆状菌,且有一层较薄的薄膜层。推测其可能是由细菌分泌的胞外聚合物组成。第1阶段运行结束后,R1陶粒表面出现了较多短杆菌、长杆菌和球菌,生物膜结构变得稳定,随着C/N的提高,在第4和第7阶段,R1陶粒表面的生物膜变得更加致密,细菌数量进一步增加,主要菌群变成了长杆菌和球菌。此外,还发现了一些聚集成团簇状的丝状菌,而生物膜上丝状菌可以作为纽带将各种细菌联结起来,使其他菌种更易于在膜上固定[12]。
图5为R2陶粒填料表面的SEM图。与R1明显不同,在第1阶段,R2陶粒表面主要是一些短杆菌,几乎没有球菌和长杆菌,通过上文的分析可以知道,这一阶段,R2中的硫自养反硝化脱氮占比达75.52%,所以这些短杆菌很可能是硫自养反硝化菌。当C/N提高时,R2陶粒表面的细菌增多,但仍以短杆菌为主,没有长杆菌和丝状菌出现。这说明,在硫磺的影响下,R2 和R1中进行反硝化的主要微生物群落出现了一定的差别。综合以上结果可以推测,R2在第4阶段取得了优于R1脱氮效果的可能原因是:1)进行反硝化的主要微生物群落不同于R1。2)少量丝状菌的出现降低了R1脱氮效率。
图6为R3陶粒填料表面的SEM图。可见,随着C/N比的提高,R3陶粒表面细菌同样增加,且不同C/N下,R3与R1陶粒表面的菌群组成相似,主要为杆菌和球菌,但和R2一样,没有丝状菌出现。这表明硫磺和陶粒组成的混合生物填料对丝状菌的生长一定的抑制作用。
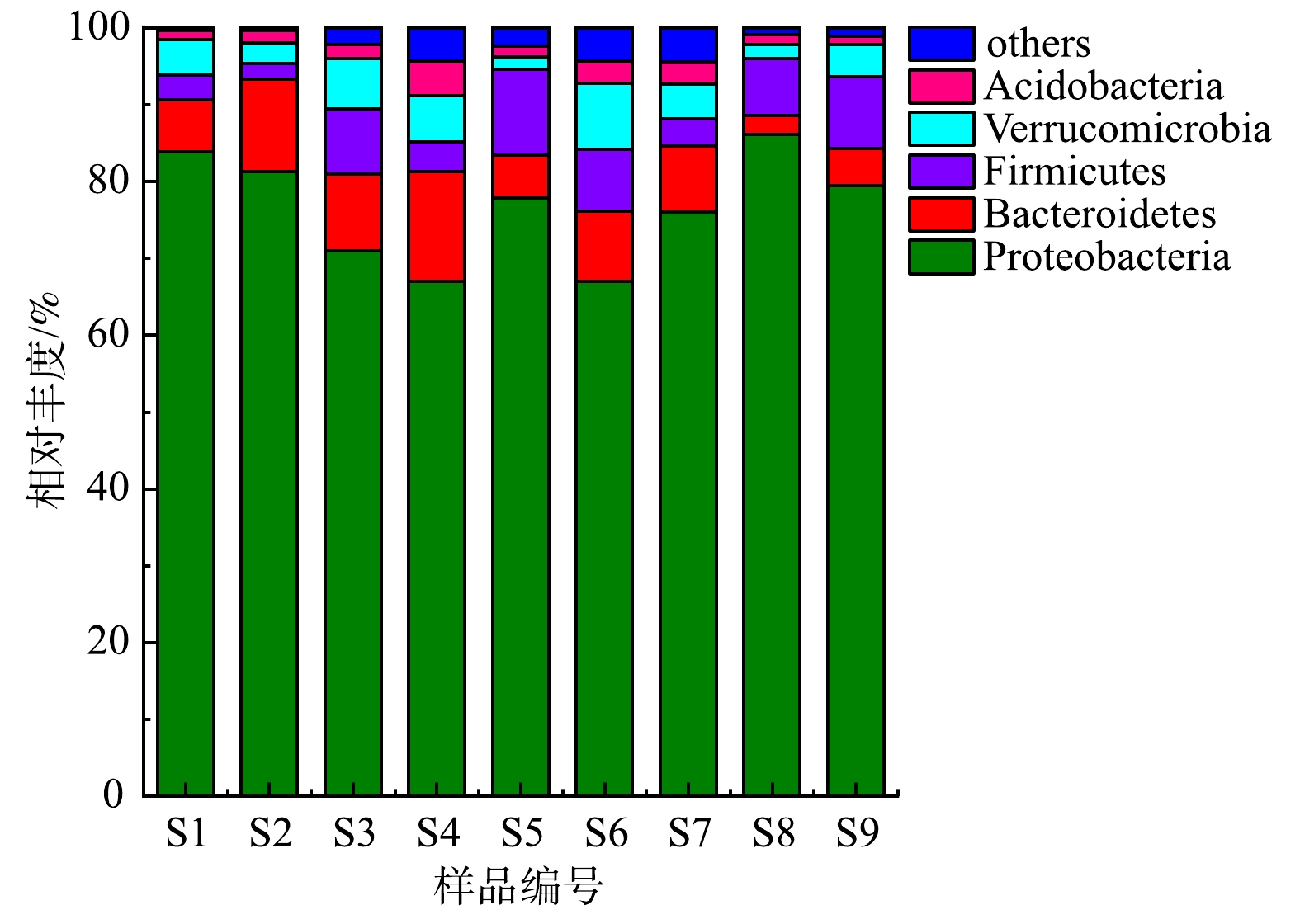
3)反应器微生物群落高通量分析。为从微生物层面解析混合生物填料反应器内硫自养与异养反硝化的耦合机理,对反应器运行过程中的微生物群落结构进行了分析。取出不同C/N下(第1、4、7阶段)各反应器中的陶粒填料,依次编号为S1~S9(表2),对这些附着填料表面的生物样品DNA进行了16S rRNA高通量测序。
图7为各样品中微生物在门水平上的分类结果。可以看出,Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)、Firmicutes(厚壁菌门)、Verrucomicrobia(疣微菌门)和Acidobacteria(酸杆菌门)为各个样品中的优势菌群。大多数的反硝化菌都属于Proteobacteria和Bacteroidetes[13],二者在很多关于反硝化的研究当中都占有相当高的比例[14-16]。Firmicutes能够代谢蛋白质、氨基酸、多糖等有机物[17],在本实验中,推测其主要包含一些能够利用内源性有机物的异养菌。Verrucomicrobia经常在水生生态系统中被发现[18],可以看到,不同C/N下R2中的Verrucomicrobia相对丰度较低,推测是因为R2中产生的含硫化合物浓度较高,抑制了Verrucomicrobia的生长。Acidobacteria在土壤和脱氮工艺常被检测到[19- 20],有研究者认为其在生态环境中有着重要的生态功能[21]。
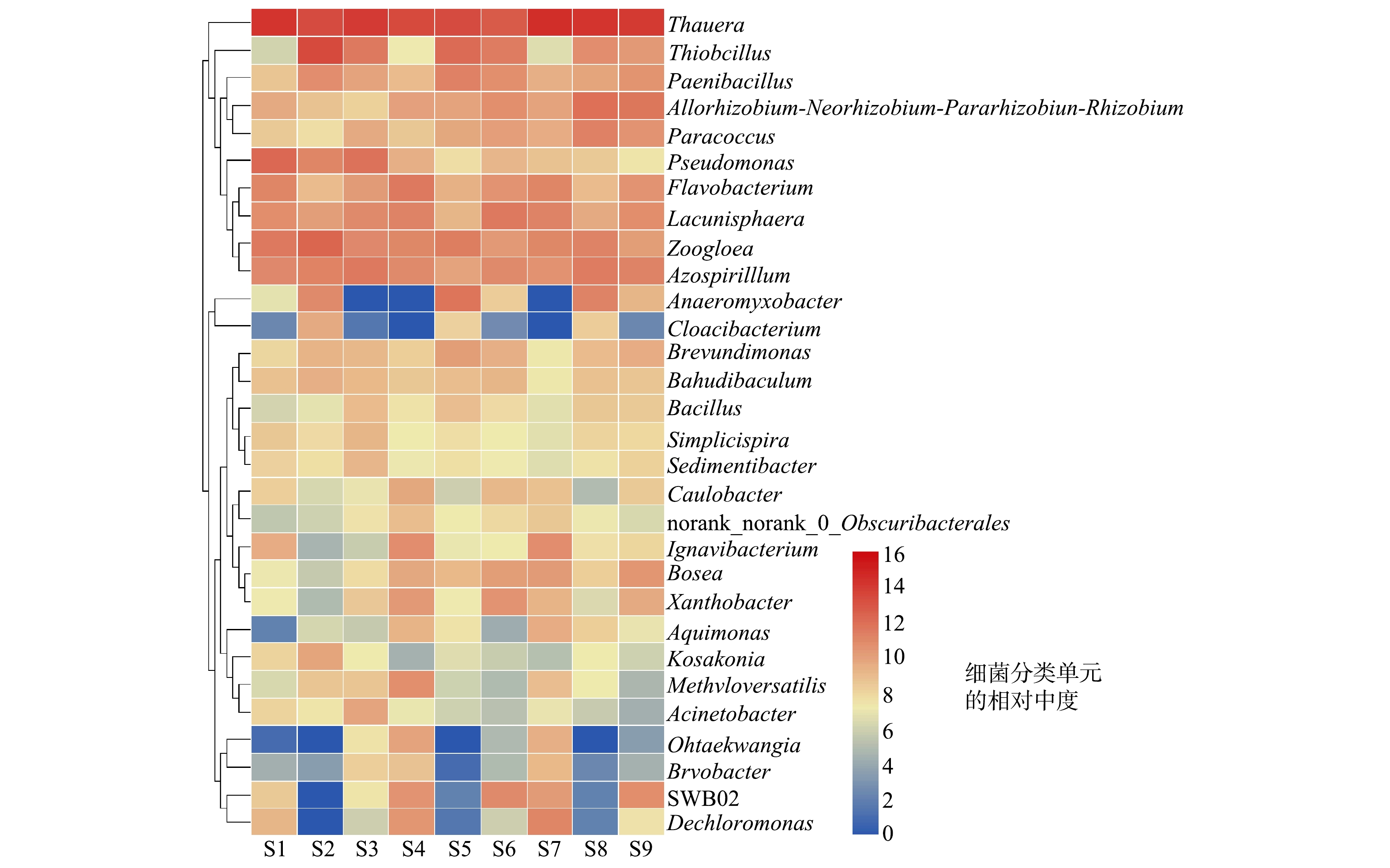
进一步地将各样品中丰度排名前30的微生物群落在属水平上分类,其分类结果如图8所示。Thauera(陶厄氏菌属)是一类在反硝化过程中起着重要作用的反硝化菌[22],其在很多以CH3COONa为碳源的脱氮工艺中都被发现[23-24],在各个样品当中,Thauera的相对丰度在18.33%~46.15%,占有很高的比例。Thiobacillus(硫杆菌属)在R2、R3反应器也有着很高的相对丰度。Thiobacillus是一种兼性厌氧菌,其在硫自养反硝化体系中经常被发现,在厌氧条件下,能利用水中的还原性硫或硫化物,将NO3−还原为N2[25- 26]。在所有样品中,S2中的Thiobacillus相对丰度最高,为25.03%,超过了其中的Thauera(23.47%)。这也印证了上文对R2在第1阶段生成SO42−最多的原因的推测。随着C/N的提高,R2,R3中的Thiobacillus丰度也逐渐降低,说明高C/N会对Thiobacillus产生抑制。另外,当C/N为4时,R2中的Thauera和Thiobacillus的相对丰度在3个反应器中都是最高的,二者的相对丰度之和为39.13%,而R1和R3分别为26.97%和25.91%。这也解释了上文中R2在第4阶段取得了较高脱氮效率的原因:硫自养和异养反硝化在R2取得了较好的协同效果。
其他占比较高的反硝化菌还有Paenibacillus(类芽孢杆菌属)、Paracoccus(副球菌属)、Flavobacterium(黄杆菌属)、Pseudomonas(假单胞菌属)和Zoolega(动胶菌属)。Paenibacillus能够将水中的NO3−还原为NO2−[27]。 HORN[28]等从蚯蚓肠道中分离出Flavobacterium菌株,发现其能将NO2−还原为N2O,但却不具备还原NO3−的能力。PARK[29]在研究中发现,其分离出的Flavobacterium菌株也不能够将NO3−还原,所以推测Flavobacterium在反硝化过程中主要参与还原NO2−,对于Paracoccus和Pseudomonas,二者的丰度变化似乎和进水C/N有关,当C/N提高时,各反应器中Paracoccus的相对丰度增加,Pseudomonas 的相对丰度减少。
-
1)混合生物填料体系的最佳运行参数为:陶粒与硫磺的体积比为2∶1、C/N为4、HRT为4 h。R2组在此运行参数下取得了最高的脱氮效率,其 TN平均去除率和出水平均质量浓度分别为(92.62±1.36)%和(2.39±0.22) mg∙L−1。在C/N为6,HRT为4 h的条件下,R1组的TN平均去除率为(92.21±0.74)%,与R2组的最高脱氮效率相近。这说明混合生物填料体系能在保证脱氮效率的同时,减少了碳源投加,降低处理成本。
2)最佳运行参数下,R2组中硫自养反硝化的脱氮比例为35.64%。此时R2组中异养反硝化对COD的利用率为55.18%,在R2组的9个运行阶段中最高。
3)硫自养反硝化的存在,促进了NO3−-N向NO2−-N的转化,但会导致出水中SO42−浓度的升高,此外还刺激了反应体系脱氮效果对HRT变化的敏感程度。
4)在最佳参数条件下,陶粒与硫磺体积比为2∶1的混合生物填料能够促进体系内硫自养和异养反硝化微生物的生长,此时R2中Thauera(陶厄式菌属)和Thiobacillus(硫杆菌属)的相对丰度在3个反应器中最高,二者的相对丰度之和为39.13%,而R1和R3中则分别为26.97%和25.91%。
基于异养-硫自养反硝化耦合技术的陶粒-硫磺混合生物填料对城市污水处理厂尾水的深度脱氮
Deep nitrogen removal from urban wastewater by ceramsite-sulfur mixed biological fillers based on heterotrophy-sulfur autotrophic denitrification coupling technology
-
摘要: 针对城市污水处理厂脱氮能力的不足,设计了2种不同体积比的陶粒-硫磺混合生物填料反应器(陶粒与硫磺的体积比分别为2∶1和5∶1),并用其对城市污水处理厂尾水进行了深度处理。结果表明,陶粒与硫磺体积比为2∶1的混合生物填料反应器(R2,高硫耦合组)在C/N为4,HRT为4 h的条件下处理模拟废水时脱氮效率最高,TN平均去除率和平均出水质量浓度分别为(92.62±1.36)%和(2.39±0.22) mg∙L-1。相比于R1(异养对照组),R2在保证脱氮效率的同时,碳源投加量更少;此外,R2在最佳条件下促进了体系内反硝化微生物群落Thauera(陶厄氏菌属)和Thiobacillus(硫杆菌属)的生长,二者的相对丰度之和为39.13%。Abstract: Aiming at the deficiency of nitrogen removal capacity of urban sewage plant, two biological packing reactors with different volume ratios of ceramsite and sulfur mixing fillers (ceramsite/sulfur ratios: 2:1 and 5:1) were designed to further treat urban wastewater. The results showed that the biological packing reactor with ceramsite/sulfur: 2∶1 mixing fillers (R2, high sulfur coupling group) had the highest nitrogen removal efficiency at a C/N ratio of 4 and HRT of 4 h, and the average TN removal rate and effluent concentration were (92.62±1.36) % and (2.39±0.22) mg∙L-1, respectively. Compared with R1 (heterotrophic denitrification group), R2 (high sulfur coupling group) could ensure the denitrification efficiency with less carbon source addition. In addition, R2 (high sulfur coupling group) promoted the growth of denitrifying microbial communities Thauera and Thiobacillus in the system under the optimal parameters, and their total abundance was 39.13%.
-

-
表 1 反应器的运行条件
Table 1. Operating conditions of reactor
阶段 运行时间/ d HRT/ h 进水NO3−-N/(mg∙L−1) 进水COD/(mg∙L−1) C/N 进水SO42-/( mg∙L−1) 1 1~21 4 30.45±0.856 63.62±2.66 2 51.69±5.14 2 23~43 2 30.67±1.02 62.11±2.55 2 37.91±3.97 3 45~65 1 30.1±0.97 62.52±3.24 2 35.11±6.26 4 67~87 4 30.87±0.95 120.5±3.14 4 27.52±1.76 5 89~109 2 30.24±1.18 120.97±2.71 4 40.74±6.79 6 111~131 1 29.72±1.28 121.67±3.57 4 27.92±7.15 7 133~153 4 30.72±0.62 180.7±3.76 6 31.83±6.48 8 155~175 2 29.98±1.19 180.81±4.57 6 34.37±7.71 9 177~197 1 30.16±1.24 183.06±5.61 6 41.74±4.39 表 2 样品编号
Table 2. Sample numbers
样品
编号取样
阶段C/N 取样
反应器样品
编号取样
阶段C/N 取样
反应器S1 1 2 R1 S6 4 4 R3 S2 1 2 R2 S7 7 6 R1 S3 1 2 R3 S8 7 6 R2 S4 4 4 R1 S9 7 6 R3 S5 4 4 R2 -
[1] FRUMIN G T, GILDEEVA I M. Eutrophication of water bodies: A global environmental problem[J]. Russian Journal of General Chemistry, 2014, 84(13): 2483-2488. doi: 10.1134/S1070363214130015 [2] OBRIST-FARNER J, BRENNER M, CURTIS J H, et al. Recent onset of eutrophication in lake izabal, the largest water body in guatemala[J]. Journal of Paleolimnology, 2019, 62(4): 359-372. doi: 10.1007/s10933-019-00091-3 [3] 王振兴, 李向全, 侯新伟, 等. 地下水硝酸盐污染的生物修复技术研究进展[J]. 环境科学与技术, 2012, 35(S1): 163-166. [4] 李祥, 马航, 黄勇, 等. 异养与硫自养反硝化协同处理高硝氮废水特性研究[J]. 环境科学, 2016, 37(7): 2646-2651. [5] XU Z, CHEN X, LI H, et al. Combined heterotrophic and autotrophic system for advanced denitrification of municipal secondary effluent in full-scale plant and bacterial community analysis[J]. Science of the Total Environment, 2020, 717: 136981-136981. doi: 10.1016/j.scitotenv.2020.136981 [6] LI R, FENG C, HU W, et al. Woodchip-sulfur based heterotrophic and autotrophic denitrification (WSHAD) process for nitrate contaminated water remediation[J]. Water Research, 2016, 89: 171-179. doi: 10.1016/j.watres.2015.11.044 [7] 王巧茹, 史旋, 宋伟, 等. 碳源强化下的硫自养/异养反硝化协同作用[J]. 环境工程学报, 2019, 13(11): 2593-2600. doi: 10.12030/j.cjee.201812042 [8] QIU Y Y, ZHANG L, MU X, et al. Overlooked pathways of denitrification in a sulfur-based denitrification system with organic supplementation[J]. Water Research, 2020: 169. [9] OH S E, YOO Y B, YOUNG J C, et al. Effect of organics on sulfur-utilizing autotrophic denitrification under mixotrophic conditions[J]. Journal of Biotechnology, 2001, 92(1): 1-8. doi: 10.1016/S0168-1656(01)00344-3 [10] 邵博. 微氧强化自养-异养联合反硝化处理含不同硫氮比废水的效能研究[D]. 哈尔滨: 哈尔滨工业大学, 2019. [11] FAN F, ZHANG B, LIU J, et al. Towards sulfide removal and sulfate reducing bacteria inhibition: Function of biosurfactants produced by indigenous isolated nitrate reducing bacteria[J]. Chemosphere, 2020: 238. [12] 苏雪莹, 付昆明. 丝状菌在污水处理中的控制与应用[J]. 水处理技术, 2015, 41(9): 19-23. [13] MIAO L, LIU Z. Microbiome analysis and -omics studies of microbial denitrification processes in wastewater treatment: Recent advances[J]. Science China-Life Sciences, 2018, 61(7): 753-761. doi: 10.1007/s11427-017-9228-2 [14] LIU J, ZHANG P, LI H, et al. Denitrification of landfill leachate under different hydraulic retention time in a two-stage anoxic/oxic combined membrane bioreactor process: Performances and bacterial community[J]. Bioresource Technology, 2018, 250: 110-116. doi: 10.1016/j.biortech.2017.11.026 [15] XING W, LI J, LI P, et al. Effects of residual organics in municipal wastewater on hydrogenotrophic denitrifying microbial communities[J]. Journal of Environmental Sciences, 2018, 65: 262-270. doi: 10.1016/j.jes.2017.03.001 [16] JIANG X, YING D, YE D, et al. Electrochemical study of enhanced nitrate removal in wastewater treatment using biofilm electrode[J]. Bioresource Technology, 2018, 252: 134-142. doi: 10.1016/j.biortech.2017.12.078 [17] LEVEN L, ERIKSSON A R B, SCHNURER A. Effect of process temperature on bacterial and archaeal communities in two methanogenic bioreactors treating organic household waste[J]. Fems Microbiology Ecology, 2007, 59(3): 683-693. doi: 10.1111/j.1574-6941.2006.00263.x [18] WAGNER M, HORN M. The planctomycetes, verrucomicrobia, chlamydiae and sister phyla comprise a superphylum with biotechnological and medical relevance[J]. Current Opinion in Biotechnology, 2006, 17(3): 241-249. doi: 10.1016/j.copbio.2006.05.005 [19] WARD N L, CHALLACOMBE J F, JANSSEN P H, et al. Three genomes from the phylum acidobacteria provide insight into the lifestyles of these microorganisms in soils[J]. Applied and Environmental Microbiology, 2009, 75(7): 2046-2056. doi: 10.1128/AEM.02294-08 [20] CAO S, DU R, LI B, et al. High-throughput profiling of microbial community structures in an anammox-uasb reactor treating high-strength wastewater[J]. Applied Microbiology and Biotechnology, 2016, 100(14): 6457-6467. doi: 10.1007/s00253-016-7427-6 [21] JANSSEN P H. Identifying the dominant soil bacterial taxa in libraries of 16s rrna and 16s rrna genes[J]. Applied and Environmental Microbiology, 2006, 72(3): 1719-1728. doi: 10.1128/AEM.72.3.1719-1728.2006 [22] LIAO R, LI Y, YU X, et al. Performance and microbial diversity of an expanded granular sludge bed reactor for high sulfate and nitrate waste brine treatment[J]. Journal of Environmental Sciences, 2014, 26(4): 717-725. doi: 10.1016/S1001-0742(13)60479-9 [23] DU R, CAO S, LI B, et al. Performance and microbial community analysis of a novel deamox based on partial-denitrification and anammox treating ammonia and nitrate wastewaters[J]. Water Research, 2017, 108: 46-56. doi: 10.1016/j.watres.2016.10.051 [24] 吴兴海, 李咏梅. 碳氮比对不同滤料反硝化滤池脱氮效果的影响[J]. 环境工程学报, 2017, 11(1): 55-62. doi: 10.12030/j.cjee.201509116 [25] DI CAPUA F, MILONE I, LAKANIEMI A M, et al. Effects of different nickel species on autotrophic denitrification driven by thiosulfate in batch tests and a fluidized-bed reactor[J]. Bioresource Technology, 2017, 238: 534-541. doi: 10.1016/j.biortech.2017.04.082 [26] CHRISTIANSON L, LEPINE C, TSUKUDA S, et al. Nitrate removal effectiveness of fluidized sulfur-based autotrophic denitrification biofilters for recirculating aquaculture systems[J]. Aquacultural Engineering, 2015, 68: 10-18. doi: 10.1016/j.aquaeng.2015.07.002 [27] ZHU W, WANG C, HILL J, et al. A missing link in the estuarine nitrogen cycle?: Coupled nitrification-denitrification mediated by suspended particulate matter[J]. Scientific Reports, 2018: 8. [28] HORN M A, IHSSEN J, MATTHIES C, et al. Dechloromonas denitrificans sp nov., flavobacterium dificans sp nov., paenibacillus anaericanus sp. Nov and paenibacillus terrae strain mh72, n2o-producenitring bacteria isolated from the gut of the earthworm aporrectodea caliginosa[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55: 1255-1265. doi: 10.1099/ijs.0.63484-0 [29] PARK M, RYUT H T S H, VU, et al. Flavobacterium defluvII sp nov., isolated from activated sludge[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 233-237. doi: 10.1099/ijs.0.64669-0 -



 下载:
下载: