-
地下水硝酸盐污染已成为当前不可忽视的环境地质问题之一,具有受人类胁迫、来源广、迁移能力强、污染途径复杂等特点[1-2]。据调查,我国北方环渤海7省(市)的地下水硝酸盐超标率达34.0%[3],华北平原地下水硝酸盐超标率达18.9%[4]。南方的滇池流域,以及长沙、成都、合肥、杭州和桂林等城市周边地区均存在地下水硝酸盐超标问题。其中,长沙周边地下水硝态氮质量浓度最高值达77.5 mg·L−1[5],桂林东部农村地下水硝态氮质量浓度最高达到46.6 mg·L−1[6]。农村生活污水和畜禽养殖废水及固体废物是重要的地下水硝酸盐污染来源。有研究[7-8]表明,地下水中的硝酸盐主要来源于农村生活污水和粪肥。这些含氮物质可在微生物作用下转化为迁移能力很强的硝酸盐,并持续地渗入地下,且超过了自然净化能力,使得地下水中的硝酸盐持续富集[9]。硝酸盐污染对地下饮用水源的安全构成了威胁,人体长期摄入较高浓度的硝酸盐会导致高铁血红蛋白症、“蓝色婴儿”症和癌症等病症[10-11]。为此,我国限定了地下饮用水中的硝酸盐质量浓度,要求硝态氮低于20 mg·L−1。
自然净化作用不足以完全去除下渗的硝酸盐,这主要是受限于缺氧环境和有机质碳源[12]。硝酸盐自然净化过程一般通过反硝化微生物进行,而反硝化微生物大都属于缺氧异养型,需要缺氧条件和有机质碳源。为此,可通过添加有机质以强化微生物反硝化作用。有机质碳源可分为液体型和固体型[13]。液体碳源具有操作复杂、成本高、副反应大等缺点[14]。固体碳源可避免上述缺点,而且契合了农村硝酸盐污染的特点。农村硝酸盐污染具有分散广、规模小、维护管理难和空间异质性特点。基于此,针对农村重要污染源,在其附近构建基于固体碳源的强化生物反硝化带,是一种阻控地表硝酸盐下渗的有效策略。
固相反硝化是利用固体有机质作为微生物载体,并释放出溶解性有机质作为碳源,将硝酸盐还原为氮气[15]。固体碳源可分为人工合成高聚物、天然物质和改性天然物质[16]。其中,木质生物质具有易获取、成本低、寿命长、碳氮比高等特点,是目前研究和应用最为广泛的天然材料[16]。但是,木质生物质碳源受组分和结构特征的限制,释碳速率缓慢,导致反硝化速率很低[17]。木质生物质主要包括木质素和综纤维素(纤维素和半纤维素)。综纤维素为反硝化碳源的有效组分,但受到木质素的阻碍而无法被利用。木质素作为一种芳香族化合物,难以被微生物利用,并通过紧密缠结的结构保护了综纤维素[18]。为此,可通过去除木质素改变木质生物质的组成和结构,增强综纤维素的生物可利用性[19-20]。
在造纸、生物燃料等行业,针对木质生物质中木质素的去除已有很多方法。其中,氢氧化钙和过氧乙酸处理可以有效去除木质素,保留固态综纤维素[21]。氢氧化钙处理主要是通过破坏木质素和综纤维素之间的酯键,溶解去除木质素,增加比表面积[22]。氢氧化钙处理具有成本低、安全、可回收等特点。但是,在温和反应条件下氢氧化钙处理只能去除部分木质素[23-24],因而限制了生物可利用性的提高幅度。为此,可采用过氧乙酸处理进一步提高木质生物质的生物可利用性,进而提高作为碳源时的反硝化速率。另外,固体碳源释碳量过大可能导致出水中有机物、氨氮等污染[25]。因此,木质碳源的释碳量最好能够根据反硝化生物利用碳的速率进行调控。
本研究基于农村硝酸盐污染的特点,开发了改性碎木碳源,研究了地下水微生物在碎木碳源条件下的强化生物反硝化行为。采用氢氧化钙和过氧乙酸对白杨碎木进行了化学处理,以改变该生物质的组分与结构,加快其作为反硝化碳源时的释碳速率,并通过改变化学处理条件来调控木质碳源的释碳能力。最后,通过木质碳源的反硝化批量实验评估了其对反硝化的强化效能,分析了可能的二次污染问题,以期为防控农村地区地下水硝酸盐污染提供参考。
-
1)碳源原料为白杨碎木,C、N元素含量分别为(47.10±0.02)%和(0.12±0.02)%。碎木经粉碎后筛分,取用的粒级分别为1~10、0.1~1和0.038~0.1 mm,水洗烘干后密封备用。
2)分别采用氢氧化钙和过氧乙酸对碎木进行处理。其中,过氧乙酸为甲溶液和乙溶液(试剂名称)2种试剂以1∶1体积比混合,在投加前,采用GB 19104-2008标定实际浓度,质量百分数为17%~20%。
3)根据研究区(桂林东部农村)的地下水硝态氮质量浓度水平(最高达46.6 mg·L−1),设计模拟污水的NO3−-N质量浓度为100.0 mg·L−1,采用硝酸钾(KNO3)和超纯水进行配制。
-
1)碎木的化学处理方法。对于碎木的化学改性方法包括氢氧化钙处理、过氧乙酸处理以及2种药剂组合处理,依次编为ST、PT和SPT,实验设计的控制因素见表1。其中,SPT为在优化ST的基础上进行的二次处理。
称取5.0 g碎木于150 mL的具塞锥形瓶中,按设计药剂量加入氢氧化钙或过氧乙酸,补加超纯水至固液质量比为1∶10;将试样瓶置入摇床,控制转速为200 r·min−1,反应温度为90 ℃(ST)或50 ℃(PT,SPT),反应时间见表1。反应结束后将碎木进行水洗抽滤,至滤液为中性,最后将碎木在60 ℃下烘干备用。
2)处理后碎木还原糖产量的测定。碎木在纤维素酶和β-葡萄糖苷酶水解后生成还原糖,用于表征碎木在生物酶作用下的释碳量。酶活性的测定参考饲料酶活性测定方法(GB 23881-2009),分别以滤纸和水杨素作为底物。经测定,纤维素酶和β-葡萄糖苷酶的酶活性分别为1206 FPU·g−1和342 CBU·g−1。还原糖的测定步骤为:称取1.0 g碎木于50 mL离心管内,依次加入20 FPU纤维素酶、20 CBU β-葡萄糖苷酶和0.03 %的叠氮化钠,最后补加醋酸钠缓冲溶液至固液比为1∶25;试样置入摇床,控制条件为150 r·min−1、50 ℃和3 d;反应结束后,溶液经0.45 μm滤膜过滤,滤液用DNS法测定还原糖含量。
3)处理后碎木化学组分的测定。根据处理后碎木还原糖产量的结果,筛选了7种处理条件下的碎木,分别为未处理(UT)、氢氧化钙处理(ST)和组合处理(SPT)碎木。其中,ST包括ST 0.06和ST 0.1,分别表示每克碎木投加0.06 g和0.1 g的氢氧化钙;SPT为对ST 0.1的2次处理,分为SPT 0.05、SPT 0.1、SPT 0.2和SPT 0.5,表示每克碎木的过氧乙酸投加量依次为0.05、0.1、0.2和0.5 g。碎木样品的化学组分采用范氏洗涤法测定,对样品依次采用中性洗涤剂、酸性洗涤剂和72%硫酸进行逐级溶解,最后的残留固体再进行灼烧(550 ℃,2.5 h)。每级溶解后固体样品的质量减少值为对应成分的含量(质量差计算值)。中性洗涤剂溶解的成分为蛋白质、糖类、淀粉和脂肪等,酸性洗涤剂溶解的成分为半纤维素,72%硫酸溶解的成分为纤维素,木质素含量则通过溶解去除上述成分后固体样品与灼烧后灰分之间的质量差值。
4)碎木碳源条件下的生物反硝化批量实验。依据处理碎木的还原糖产量和化学组分测定结果,选择3种处理条件的碎木作为反硝化碳源。3种碎木分别为UT、ST 0.1和SPT 0.5,编号同于化学组分测定,以不投加碎木碳源作为对照(CK)。
实验步骤为:称取5.0 g碎木加入500.0 mL的玻璃瓶中,加入390.0 mL模拟硝酸盐污水和取于菜地表层土壤的10.0 mL接种液;试样经氮气曝气20 min后用胶塞密封;在25 ℃条件下恒温培养,在实验开始后第0、2、4、6、8、10、12和15天时取水样,并补加等体积的超纯水;部分水样用于测定pH,部分水样经0.45 μm滤膜过滤后测定溶解性有机物(DOC)、硝态氮(NO3−-N)、亚硝态氮(NO2−-N)、氨氮(NH4+-N)和总氮(TN)。其中,DOC浓度采用总有机碳分析仪(德国Analytikjena,multi N/C 3100)测定,而NO3−-N、NO2−-N、NH4+-N和TN的浓度分别采用紫外分光光度法、N- (1-萘基) -乙2胺光度法、纳氏试剂光度法、碱性过硫酸钾消除紫外分光光度法测定。第15天的水样采用吸收和三维荧光扫描光谱仪(Aqualog~UV~800)测定三维荧光光谱,激发波长(Ex)和发射波长(Em)分别为200~500 nm和200~800 nm,步进分别为5 nm和2 nm,以超纯水作为空白,扣除瑞利散射后进行内滤校正。
-
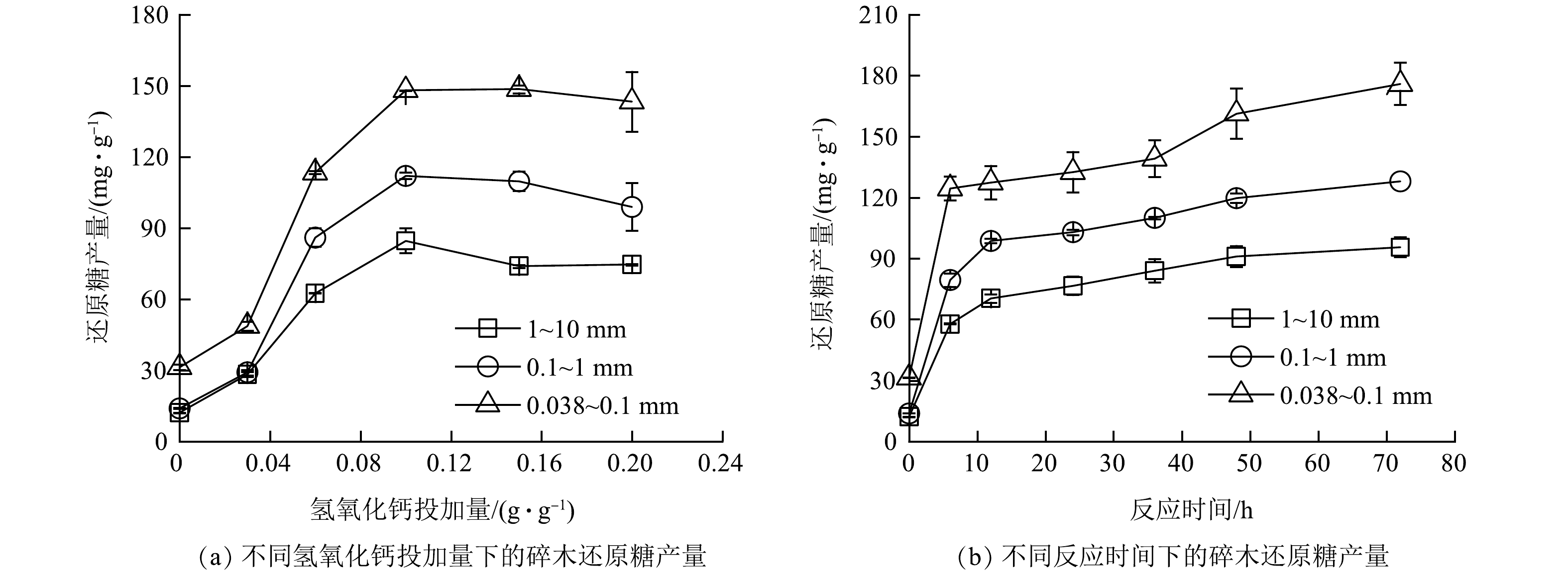
1)氢氧化钙处理后碎木的还原糖产量。使用不同投加量的氢氧化钙对3种粒径的碎木进行处理,经酶水解后的还原糖产量如图1(a)所示。碎木的还原糖产量有着随氢氧化钙投加量的增加先逐渐升高后趋于平缓的变化趋势,且随着碎木粒级的增加而降低。在氢氧化钙投加量为0.1 g·g−1条件下反应24 h,粒径为0.038~0.1、0.1~1和1~10 mm的碎木还原糖产量依次为148.1、112.1和84.7 mg·g−1,还原糖产量分别提高至未处理碎木的4.7、8.0和7.0倍。图1(b)反映了在氢氧化钙投加量为0.1 g·g−1条件下碎木的还原糖产量与反应时间的关系。碎木的还原糖产量随反应时间的增加先快速升高,后缓慢上升。粒径为0.038~0.1、0.1~1和1~10 mm的碎木在反应12 h时,还原糖产量分别为127.4、98.8和70.5 mg·g−1。
经氢氧化钙处理后,3种粒级碎木的还原糖产量提高效果与HU等[26]的研究结果基本一致,后者用氢氧化钙处理后木屑的还原糖产量提高了约5.4倍。采用氢氧化钙处理碎木,主要是破坏了木质素与综纤维素之间的酯键,溶解去除了木质素,进而增强了综纤维素被酶水解的性能。但是,处理后碎木的还原糖产量远低于最大值(550.0~650.0 mg·g−1) [27]。另外,处理碎木的还原糖产量随粒级的降低而增加,这主要是因为小粒级碎木由于具有更大的比表面积,进行生物酶水解时反应更为充分。总之,对碎木进行氢氧化钙处理,可有效地提高还原糖产量,且处理条件温和、反应速度较快。对于0.1~1 mm的碎木,在氢氧化钙投加量为0.1 g·g−1 、反应温度为90 ℃和反应时间为24 h的处理条件下,还原糖产量为112.1 mg·g −1,可提高至未处理碎木的8.0倍。
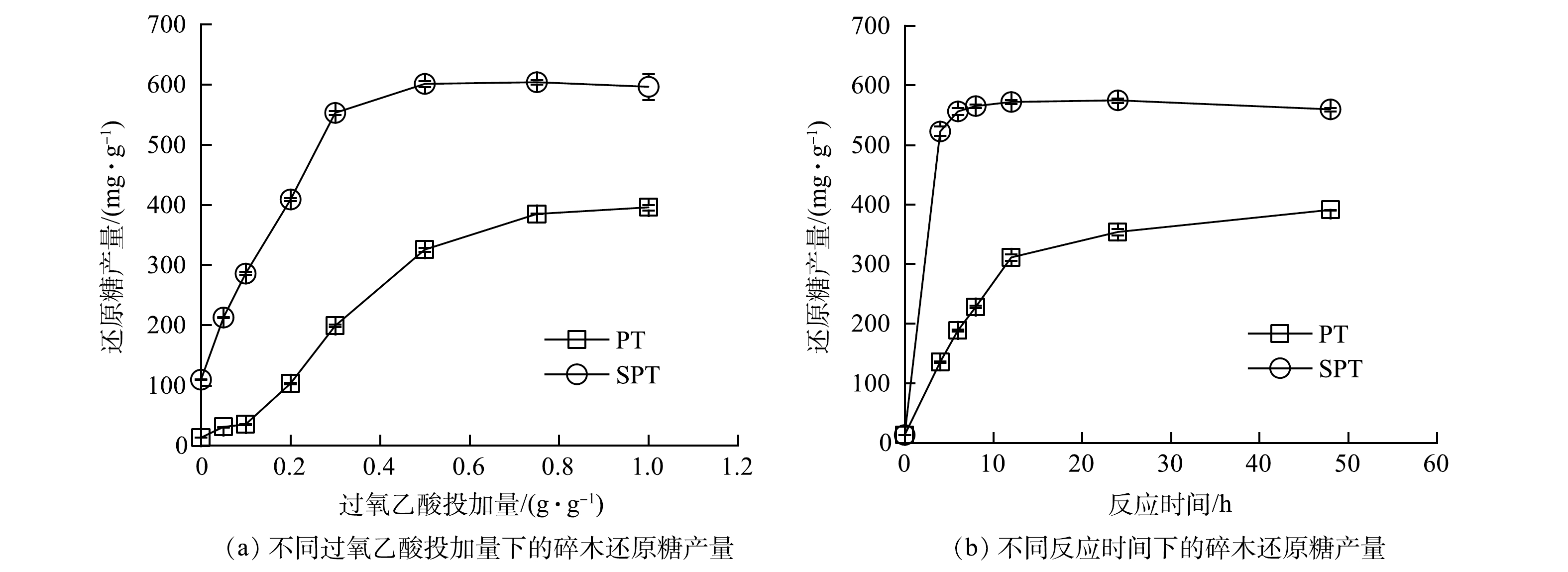
2)组合处理条件下碎木的还原糖产量。在50 ℃、24 h的处理条件下,PT和SPT处理组的还原糖产量与过氧乙酸投加量之间的关系如图2(a)所示。碎木的还原糖产量随过氧乙酸投加量的增加先快速升高,后趋于平稳,且SPT组的还原糖产量明显高于PT组。在过氧乙酸投加量为0.5 g·g−1 的条件下,SPT组和PT组的还原糖产量分别达到600.6 mg·g−1和357.1 mg·g−1,还原糖产量分别提高至未经处理碎木的43.2倍和25.7倍。由图2(b)可以看出,SPT的还原糖产量随反应时间的增加先快速升高,在6 h后趋于稳定,碎木的还原糖产量为572.1 mg·g−1。PT的还原糖产量在反应12 h后仍缓慢升高,在12 h时的碎木还原糖产量为311.1 mg·g−1。
SPT组碎木的还原糖产量达到600.6 mg·g−1后趋于稳定,这接近了碎木还原糖产量的最大值[27]。这表明碎木中的有效组分在生物酶的作用下完全释放。在同等条件下,SPT组的碎木还原糖产量明显高于 PT组。这与HU等的研究结果一致[26],主要是因为氢氧化钙破坏了半纤维素和木质素之间的碳-碳键,使得过氧乙酸可直接作用于木质素中的芳香核。因此,采用2种药剂进行组合处理,不仅提高了处理效率,同时也降低了过氧乙酸的投加量。总之,在氢氧化钙处理的基础上,采用过氧乙酸处理可进一步增强碎木在生物酶作用下的水解释碳能力。另外,可以通过调节过氧乙酸投加量,实现对碎木释碳能力的调控,使之适用于不同环境条件下反硝化生物利用碳的速率。
-
对筛选出的7种不同处理碎木进行化学组分测定,结果见表2。碎木的化学组分主要包括中性洗涤剂溶解物、纤维素、半纤维素和木质素。前3者的累加含量随处理程度的增强而升高,由72.9%逐渐升高至97.0%。碎木中的木质素含量逐渐降低,由26.8%降低至2.8%。其中,ST 0.1、SPT 0.1、SPT 0.2和SPT 0.5的木质素去除率分别为17.2%、45.1%、64.6%和89.6%。木质素含量与还原糖产量呈显著的线性负相关,其相关系数为0.986,随着木质素含量的减少,还原糖产量的值增大。
木质生物质中可被微生物利用的组分包括中性洗涤剂溶解物(蛋白质、脂肪、淀粉和糖类等)、纤维素和半纤维素。碎木经过氢氧化钙和过氧乙酸处理后,可生物利用组分的质量分数由72.9%上升至97.0%,较大程度上保留了有效固体组分。另外,碎木的木质素含量与还原糖产量呈显著的线性负相关。这主要是因为,化学处理后碎木的木质素含量降低、天然结构发生变化和比表面积的增加。木质素作为一种复杂疏水性高分子聚合物,难以被微生物利用,并与综纤维素紧密缠结。这阻碍了微生物对其他组分的利用,这种抑制效应随木质素含量的升高而增强[28]。氢氧化钙可破坏木质素和其他组分间的酯键以及木质素内部的醚键、酯键和碳-碳键等,降低木质素的分子质量,增强其亲水性能,使得木质素从碎木中去除[29]。过氧乙酸对于木质素具有较强的选择性和氧化性,通过生成水合氢离子攻击脂肪链和芳香环中的亲核位点,使得木质素发生降解,生成具有亲水性的羟基和羧基等,进而使得木质素从碎木中进入到溶液中[27,30]。最后,碎木的部分物质去除后,表面形成了一定的孔洞,从而增加与微生物接触的比表面积。
-
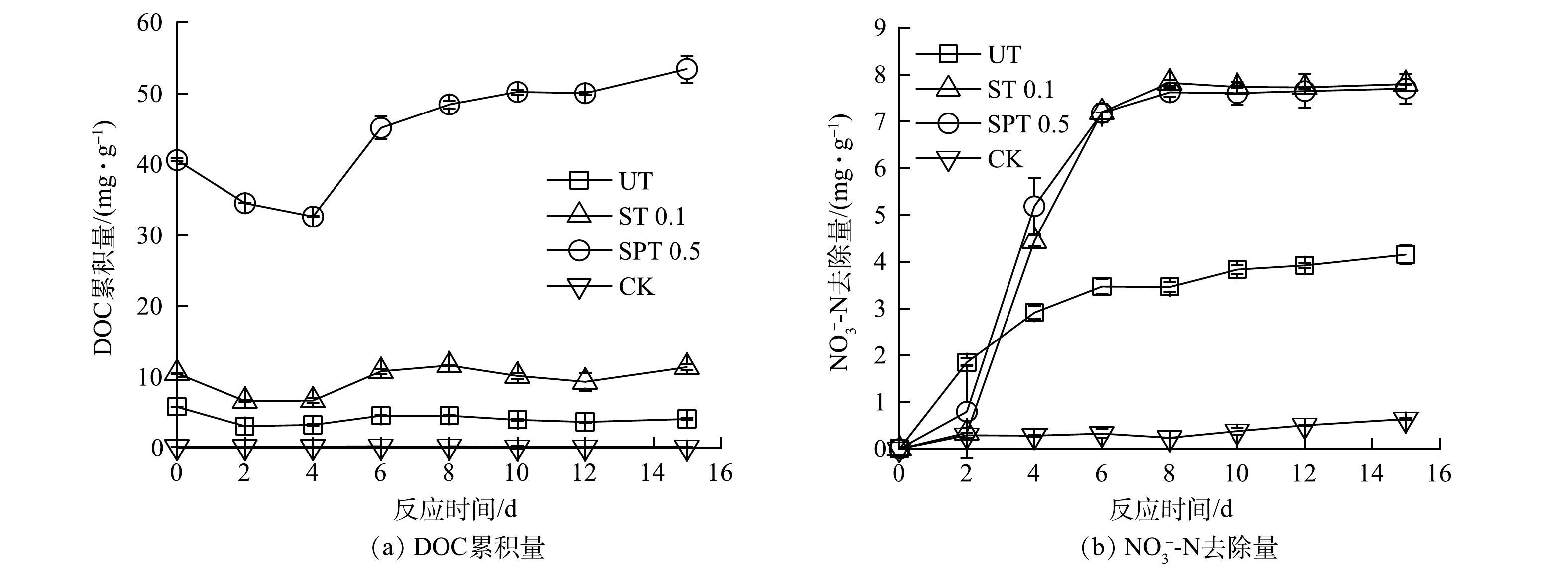
1)碎木碳源条件下的碳利用和硝酸盐去除。释碳能力不同的UT、ST 0.1和SPT 0.5碎木碳源在反硝化过程中DOC的变化如图3(a)所示。由图3(a)可看出,在碎木碳源条件下的DOC累积量先缓慢降低后升高,最后又趋于平稳。在处理6 d后,ST 0.1和SPT 0.5的平均DOC累积量分别为10.6 mg·g−1和49.4 mg·g−1,分别提高至UT的2.6倍和11.9倍。经吸收和三维荧光扫描光谱仪测定,在不同碎木碳源条件下生物反硝化在第15天产生的DOC组分具有较明显的三维荧光光谱差异。UT中DOC的荧光光谱分布于Ex/Em为 200~230 nm/200~320 nm、200~230 nm/460~580 nm。ST 0.1和SPT 0.5中DOC荧光光谱的Ex/Em 分别分布于200~240 nm/200~370 nm、200~240 nm/440~520 nm和200~280 nm/240~360 nm、200~280 nm/420~550 nm。其中Em在200~380 nm内的峰面积在UT、ST 0.1和SPT 0.5中依次增加。图3(b)反映了碎木碳源条件下NO3–-N累积去除量的变化。在第8 天,UT、ST 0.1和SPT 0.5的NO3--N累积去除量分别为3.5、7.8和7.6 mg·g−1,NO3−-N去除率分别为43.8%、97.5%和95.0%。在第2~6天,UT、ST 0.1和SPT 0.5的NO3−-N去除速率依次为0.4、1.7和1.6 mg·(g·d)−1,ST 0.1和SPT 0.5的NO3−-N去除速率分别提高至UT的4.3倍和4.0倍。
化学处理后碎木的释碳能力得到不同程度的强化,作为反硝化碳源时主要表现为DOC释放量的差别。ST 0.1和SPT 0.5的平均DOC累积量分别提高至UT的2.6倍和11.9倍,这与处理后碎木的还原糖产量结果相一致,即分别提高至未处理碎木的8.0倍和43.4倍。有研究[31-32]表明,类蛋白组分的三维荧光特征值Em为200~380 nm,而类腐殖质组分的Em为380~500 nm。因此,碎木碳源条件下的DOC含有一定量的类腐殖质和类蛋白,且类蛋白的含量在UT、ST 0.1和SPT 0.5中依次增加。这主要是因为:随着处理程度的增强,碎木碳源的生物可利用性也增强了,促进了水解类微生物繁殖和代谢,产生了较多的类蛋白物质。碎木碳源条件下释放的DOC 成分包括大分子的类腐殖质、类蛋白等和小分子的有机酸类和糖类[33]。大多反硝化微生物只能利用小分子有机物作为电子供体去除硝酸盐,因此,碎木碳源释放的大分子有机物仍需进一步水解才能被反硝化微生物利用。在第6天后,ST 0.1和SPT 0.5由于缺氮,减少了微生物对DOC 的利用,使得残留DOC量升高。残留DOC量是衡量固相反硝化效能的重要指标,易造成有机物的二次污染[34]。为此,对碎木处理程度的控制应契合反硝化微生物利用碳的速率,使得释放的DOC尽量用于生物反硝化。
在处理碎木碳源条件下的生物反硝化作用均得以强化,NO3−-N去除速率提高至UT的4.0~4.3倍。这主要是因为处理后碎木释放了更多的DOC,进而为反硝化微生物提供了更多的有效碳。与ST 0.1相比,SPT 0.5虽具有较高DOC释放量,但NO3−-N去除速率不再表现出明显的升高。这主要是因为生物反硝化过程中DOC利用速率和非反硝化生物的竞争作用。本研究中的反硝化速率为1.6~1.7 mg·(g·d)−1,这接近了其他纤维素类生物质碳源条件下最大反硝化速率,在预处理枸杞枝和玉米芯碳源条件下分别为1.3 mg·(g·d)−1和2.2 mg·(g·d)−1[35-36]。一般认为,在某种碳源条件下,反硝化微生物的DOC利用量和NO3−-N去除量的比值(碳氮比值)为定值,而该值又与碳源具体成分相关。碎木碳源释放的DOC中含有大量的类蛋白和类腐殖质等大分子有机物,这些物质无法被反硝化微生物直接利用,进而限制了DOC的利用速率,以及反硝化速率。另外,高有机物浓度刺激了非反硝化微生物的繁殖代谢,如产甲烷菌和硫酸还原菌,与反硝化微生物形成竞争,这限制了反硝化速率的进一步提高。
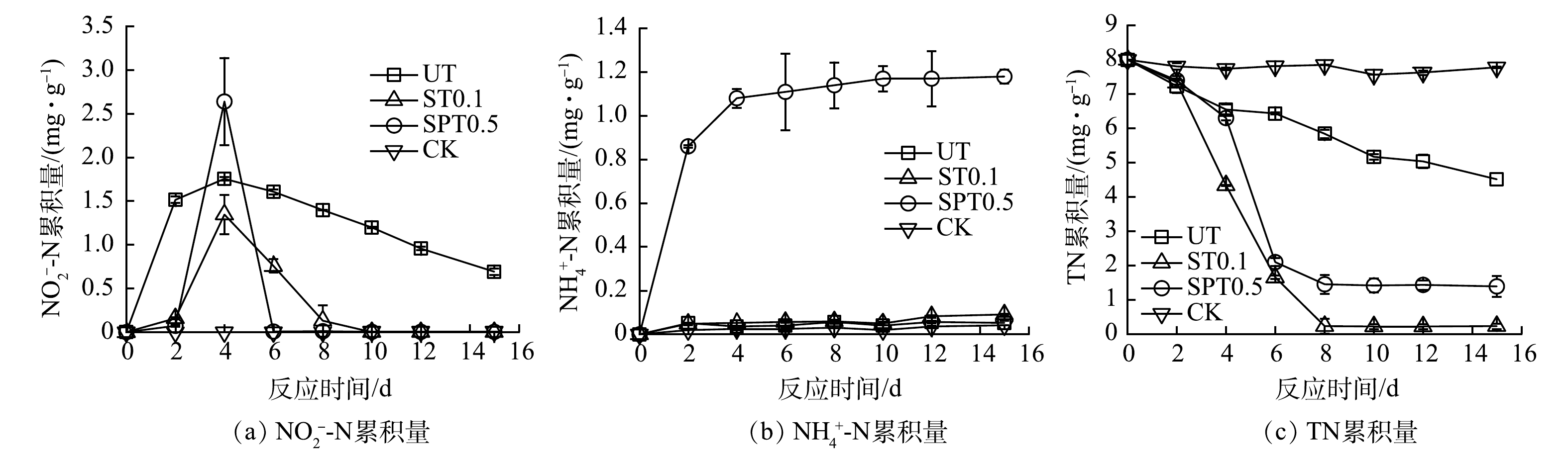
2)碎木碳源条件下生物反硝化过程中的含氮产物。在固相反硝化过程中,主要含氮产物包括NO3−-N、NO2−-N、NH4+-N和TON等。图4(a)为在碎木碳源条件下反硝化过程中NO2−-N的累积变化曲线。UT、ST 0.1和SPT 0.5的NO2--N累积量均在第4天出现峰值,依次为1.8、1.3和2.6 mg·g−1,分别占NO3−-N累积去除量的61.9%、29.2%和50.0%。图4(b)为在碎木碳源条件下反硝化过程中NH4+-N累积量的变化。UT和ST 0.1的NH4+-N累积量较低,低于0.1 mg·g−1。SPT 0.5出现较高的NH4+-N累积量,在第8天后的平均值达到1.2 mg·g−1,占NO3−-N累积去除量的15.8%。图4(c)为碎木碳源条件下反硝化过程中TN累积量的变化。3种碳源条件下的TN累积量均有降低,且ST 0.1的TN去除效果最好。在第8天,UT、ST 0.1和SPT 0.5中的TN累积量依次为5.8、0.2和1.5 mg·g−1,TN的去除率分别为27.5%、97.5%和81.3%。
生物反硝化是微生物利用DOC作为电子供体将NO3−依次还原为NO2−、NO、N2O和N2的过程。其中,NO2−的还原被认为是限制环节,易出现NO2−的累积[37-38]。NO2−的累积量取决于NO3−和NO2−还原速率的差值。碎木碳源释放的DOC被优先用于NO3−的还原,而DOC量过多或不足均可扩大NO3−和NO2−还原速率差。另外,SPT 0.5中出现了较高的NH4+-N累积,占NO3−-N去除量的15.8%。这可能是因为发生了异化硝酸盐还原为铵作用(DNRA)。有研究表明,高碳氮比有利于DNRA的发生[39]。由此可推测,SPT 0.5中较高的DOC量促进了DNRA,使得15.8%的NO3−转化为NH4+。
通过计算,在反硝化过程中TN主要为NO3−-N、NO2−-N和NH4+-N。反硝化初期的TN主要为NO3−-N和NO2−-N。反硝化后期的TN存在形式差别较大,UT中的TN主要为NO3−-N和NO2−-N,而SPT 0.5中的TN则主要为DNRA的产物NH4+-N,约占TN的80.0%。ST 0.1的NO3−-N去除率高且NH4+-N产物少,使得TN去除率达到97.5%。总之,碎木碳源释放的DOC量过高或过低,均可增加NO2−-N累积的风险,也不利于TN的去除,尤其是DOC量过高时易造成NH4+-N的二次污染。
-
1)碎木经氢氧化钙和过氧乙酸处理后,在生物酶水解条件下的还原糖产量明显提高。对于0.1~1 mm的碎木,在氢氧化钙处理后的还原糖产量提高至未经处理碎木的8.0倍,再经过氧乙酸处理后,还原糖产量可提高至43.4倍。此外,可通过改变化学处理条件而控制碎木的还原糖产量,进而调控碎木作为碳源时的释碳能力。
2)经氢氧化钙和过氧乙酸处理后,碎木保留了大部分作为碳源时的有效组分(中性洗涤剂溶解物、纤维素和半纤维素),这些组分的含量由72.9%增加至97.0%。处理后碎木的木质素去除率可达90%,且木质素含量越低则还原糖产量越高。
3)在还原糖产量提高8.0倍的碎木碳源条件下,生物反硝化速率为1.7 mg·(g·d)−1,提高至未处理碎木的4.3倍。但采用还原糖产量提高43.4倍的改性碎木为碳源时,反硝化速率不仅没有进一步明显的提高,还易造成DOC和NH4+-N的污染。
木质碳源释碳能力的优化及其对地下水生物反硝化的强化效果
Optimization of carbon release capacity of wood carbon source and its enhancement on biological denitrification efficiency of groundwater
-
摘要: 木质生物质碳源适用于防控农村地下水硝酸盐污染,但存在因释碳能力差而导致反硝化效率低的问题。为此,采用氢氧化钙和过氧乙酸对碎木进行了处理,测定了处理后碎木还原糖产量和化学组分,验证了处理碎木在作为碳源时的反硝化强化效能。结果表明:0.1~1 mm的未处理碎木,其还原糖产量为13.9 mg·g−1;经氢氧化钙处理后,其还原糖产量可提升至未处理碎木的8.0倍;在氢氧化钙处理的基础上再用过氧乙酸进行处理后,其还原糖产量可提升至未处理碎木的43.4倍,并能够通过改变处理条件而控制提升倍数;处理后碎木碳源的木质素含量与还原糖产量呈显著的线性负相关,相关系数大于0.98;在提高8.0倍还原糖产量的碎木碳源条件下,生物反硝化速率达到1.7 mg·(g·d)−1,是未处理碎木碳源的4.3倍;碎木碳源的还原糖产量提高43.4倍后,反硝化速率并未进一步得到提高,还导致了有机物和氨氮的污染。Abstract: Woody biomass is applicable to nitrate pollution control in rural area. However, the denitrification rate is low for woody carbon source due to its poor capacity of carbon release. Therefore, woodchip was pretreated with calcium hydroxide and peracetic acid, its reducing sugar yield and chemical compositions were determined, and its enhancement on denitrification efficiency was verified. The results showed that the reducing sugar yield was 13.9 mg·g−1 for untreated woodchip (0~0.1 mm), and it was increased to 8.0 times after calcium hydroxide pretreatment and 43.4 times after calcium hydroxide and peracetic acid pretreatment. The increase of reducing sugar yield could be regulated by changing the chemical pretreatment conditions. A significant linear correlation occurred between the lignin content and the reducing sugar yield for pretreatment woodchip, the corresponding correlation coefficient exceeded 0.98. The denitrification rate could reach 1.7 mg·(g·d)−1 for the pretreatment woodchip with 8.0 times reducing sugar yield, which was 4.3 times as high as that the untreated woodchip. However, for the pretreatment woodchip with 43.4 times reducing sugar yield, its denitrification rate did not increase further, while the pollution of organic matter and ammonia nitrogen occurred.
-
Key words:
- rural pollution /
- nitrate /
- denitrification /
- woody carbon source /
- reducing sugar
-

-
表 1 碎木化学处理条件的设计
Table 1. Experimental design of chemical treatment for woodchip
处理名称 碎木粒级/mm 反应时间/h 药剂投加量/(g·g−1) ST 0.038~0.1,0.1~1,1~10 24 0,0.03,0.06,0.1,0.15,0.2 ST 0.038~0.1,0.1~1,1~10 6,12,24,36,48,72 0.1 PT,SPT 0.1~1 24 0,0.05,0.1,0.2,0.3,0.5,0.75,1.0 PT,SPT 0.1~1 4,6,8,12,24,48 0.5 注:ST、PT和SPT依次为氢氧化钙、过氧乙酸和2种药剂组合处理。 表 2 不同处理碎木的化学组分及还原糖产量
Table 2. Chemical components and reducing sugar yield in various pretreatment woodchip
碎木处理程度 化学组分/% 还原糖产量/
(mg·g−1)中性洗涤剂溶解物 纤维素 半纤维素 木质素 灰分 UT 4.5±0.4 54.1±1.1 14.3±0.9 26.8±0.2 0.3±0.0 13.9±0.1 ST 0.06 4.4±0.6 57.4±1.3 12.4±1.2 25.2±0.1 0.5±0.0 86.0±2.7 ST 0.1 8.5±0.2 58.9±1.0 9.9±1.9 22.2±0.9 0.5±0.0 112.1±0.9 SPT 0.05 9.6±0.1 55.5±0.9 12.5±0.8 21.8±0.0 0.6±0.1 212.7±0.4 SPT 0.1 15.3±0.6 55.0±1.6 14.2±1.5 14.7±0.2 0.7±0.1 285.9±1.7 SPT 0.2 15.9±0.2 62.1±1.9 11.8±0.2 9.5±2.2 0.6±0.1 408.8±1.9 SPT 0.5 13.4±0.6 67.6±0.3 16.0±0.5 2.8±0.1 0.2±0.0 603.9±2.4 注:UT为未处理;ST 0.06和ST 0.1分别表示每克碎木的氢氧化钙投加量为0.06 g和0.1 g;SPT为对ST 0.1的2次处理,SPT 0.05、SPT
0.1、SPT 0.2和SPT 0.5分别表示每克碎木的过氧乙酸投加量为0.05、0.1、0.2和0.5 g 。 -
[1] 王仕琴, 郑文波, 孔晓乐. 华北农区浅层地下水硝酸盐分布特征及其空间差异性[J]. 中国生态农业学报, 2018, 26(10): 1476-1482. [2] 傅雪梅, 孙源媛, 苏婧, 等. 基于水化学和氮氧双同位素的地下水硝酸盐源解析[J]. 中国环境科学, 2019, 39(9): 3951-3958. doi: 10.3969/j.issn.1000-6923.2019.09.042 [3] 赵同科, 张成军, 杜连凤, 等. 环渤海七省(市)地下水硝酸盐含量调查[J]. 农业环境科学学报, 2007, 26(2): 779-783. doi: 10.3321/j.issn:1672-2043.2007.02.072 [4] 李晓欣, 王仕琴, 陈肖如, 等. 北方区域尺度地下水-包气带硝酸盐分布与变化特征[J]. 中国生态农业学报(中英文), 2021, 29(1): 208-216. [5] 熊江波, 李雁勇, 王翠红, 等. 长沙市城区周边地区地下水硝酸盐态氮含量及污染状况评价[J]. 湖南农业科学, 2010(7): 88-90. doi: 10.3969/j.issn.1006-060X.2010.07.027 [6] 秦金月, 刘吉刚, 胡荣庭, 等. 岩溶区农村地下水硝酸盐污染分布特征及原因浅析[J]. 西部皮革, 2020, 42(24): 3-4. [7] 曹胜伟, 费宇红, 田夏, 等. 硝酸盐污染氮氧同位素溯源及贡献率分析-以南阳地区为例[J]. 水文地质工程地质, 2019, 46(2): 82-91. [8] 汪银龙, 冯民权, 董向前. 汾河下游雨季硝酸盐污染源解析[J]. 环境科学, 2019, 40(9): 4033-4041. [9] SOLOMON K M H, RENE E R, ERIC D V H, et al. Nitrate removal from groundwater: A review of natural and engineered processes[J]. Journal of Water Supply:Research and Technology - Aqua, 2018, 67(8): 885-902. doi: 10.2166/aqua.2018.194 [10] MATHEWSON P D, EVANS S, BYRNES T, et al. Health and economic impact of nitrate pollution in drinking water: A Wisconsin case study[J]. Environmental Monitoring and Assessment, 2020, 192(11): 724. doi: 10.1007/s10661-020-08652-0 [11] HORD N G. Dietary nitrates, nitrites, and cardiovascular disease[J]. Current Atherosclerosis Reports, 2011, 13(6): 484-492. doi: 10.1007/s11883-011-0209-9 [12] LÓPEZ-AVILÉS G, ALMENDARIZ-TAPIA F J, MEZA-ESCALANTE E R, et al. Simultaneous denitrification and methanogenesis in an anaerobic expanded bed reactor[J]. Revista Mexicana de Ingeniería Química, 2017, 16(1): 281-290. [13] 黄有文, 张立秋, 李淑更, 等. 固体碳源生物膜处理低碳城市污水脱氮性能[J]. 水处理技术, 2017, 43(11): 98-102. [14] 高欣东, 冯婧微, 李春华, 等. 水处理过程中外加碳源类型及其影响因素研究进展[J]. 现代化工, 2020, 40(S1): 26-32. [15] ZHANG Q, CHEN X, WU H, et al. Comparison of clay ceramsite and biodegradable polymers as carriers in pack-bed biofilm reactor for nitrate removal[J]. International Journal of Environmental Research and Public Health, 2019, 16(21): 4184. doi: 10.3390/ijerph16214184 [16] WANG J L, CHU L B. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 2016, 34(6): 1103-1112. doi: 10.1016/j.biotechadv.2016.07.001 [17] HANG Q Y, WANG H Y, CHU Z S, et al. Application of plant carbon source for denitrification by constructed wetland and bioreactor: Review of recent development[J]. Environmental Science and Pollution Research, 2016, 23(9): 8260-8274. doi: 10.1007/s11356-016-6324-y [18] YAO L, LU Y C, HU H Q, et al. Structural characterization of lignin and its degradation products with spectroscopic methods[J]. Journal of Spectroscopy (Hindawi), 2017, 2017: 1-15. [19] MIYAMOTO T, MIHASHI A, YAMAMURA M, et al. Comparative analysis of lignin chemical structures of sugarcane bagasse pretreated by alkaline, hydrothermal, and dilute sulfuric acid methods[J]. Industrial Crops and Products, 2018, 121: 124-131. doi: 10.1016/j.indcrop.2018.04.077 [20] TARASOV D, LEITCH M, FATEHI P. Lignin-carbohydrate complexes: Properties, applications, analyses, and methods of extraction: A review[J]. Biotechnology for Biofuels, 2018, 11(1): 269. doi: 10.1186/s13068-018-1262-1 [21] YIMLAMAI B, CHOORIT W, CHISTI Y, et al. Cellulose from oil palm empty fruit bunch fiber and its conversion to carboxymethylcellulose[J]. Journal of Chemical Technology and Biotechnology, 2021, 96(6): 1656-1666. doi: 10.1002/jctb.6689 [22] 翟旭航, 李霞, 元英进. 木质纤维素预处理及高值化技术研究进展[J]. 生物技术通报, 2021, 37(3): 162-174. [23] 秦影, 傅英娟, 秦梦华. 木质纤维素生物质精炼的研究进展[J]. 大连工业大学学报, 2018, 37(3): 171-178. [24] SIERRA R S, HOLTZAPPLE M T, GRANDA C B. Long-term lime pretreatment of poplar wood[J]. Aiche Journal, 2011, 57(5): 1320-1328. doi: 10.1002/aic.12350 [25] LI P, ZUO J N, WANG Y J, et al. Tertiary nitrogen removal for municipal wastewater using a solid-phase denitrifying biofilter with polycaprolactone as the carbon source and filtration medium[J]. Water Research, 2016, 93: 74-83. doi: 10.1016/j.watres.2016.02.009 [26] HU R T, ZHENG X L, XIN J, et al. Selective enhancement and verification of woody biomass digestibility as a denitrification carbon source[J]. Bioresource Technology, 2017, 244(Pt 1): 313-319. [27] LEE H R, LEE H W, LEE Y W, et al. Improved pretreatment of yellow poplar biomass using hot compressed water and enzymatically-generated peracetic acid[J]. Biomass and Bioenergy, 2017, 105: 190-196. doi: 10.1016/j.biombioe.2017.07.004 [28] CHU Q L, SONG K, BU Q, et al. Two-stage pretreatment with alkaline sulphonation and steam treatment of Eucalyptus woody biomass to enhance its enzymatic digestibility for bioethanol production[J]. Energy Conversion and Management, 2018, 175: 236-245. doi: 10.1016/j.enconman.2018.08.100 [29] KIM J S, LEE Y Y, KIM T H. A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass[J]. Bioresource Technology, 2016, 199: 42-48. doi: 10.1016/j.biortech.2015.08.085 [30] CHOI J H, PARK S Y, KIM J H, et al. Selective deconstruction of hemicellulose and lignin with producing derivatives by sequential pretreatment process for biorefining concept[J]. Bioresource Technology, 2019, 291: 121913. doi: 10.1016/j.biortech.2019.121913 [31] 冯萃敏, 张欣蕊, 孙丽华, 等. PAC-UF工艺的膜污染特性及膜污染物质研究[J]. 给水排水, 2015, 51(3): 125-131. [32] 闫晓寒, 文威, 解莹, 等. 溶解性有机物特性及在国内的污染研究现状[J]. 环境科学与技术, 2020, 43(6): 169-178. [33] WANG H S, CHEN N, FENG C P, et al. Insights into heterotrophic denitrification diversity in wastewater treatment systems: Progress and future prospects based on different carbon sources[J]. Science of the Total Environment, 2021, 780: 146521-146521. doi: 10.1016/j.scitotenv.2021.146521 [34] HU R T, ZHENG X L, ZHENG T Y, et al. Effects of carbon availability in a woody carbon source on its nitrate removal behavior in solid-phase denitrification[J]. Journal of Environmental Management, 2019, 246: 832-839. [35] 雷志娟, 张立秋, 王登敏, 等. 预处理方法对玉米芯静态反硝化特性的影响及微生物群落分析[J]. 现代化农业, 2019(9): 33-36. doi: 10.3969/j.issn.1001-0254.2019.09.018 [36] 范天凤, 董伟羊, 赵转军, 等. 改性枸杞枝作为反硝化脱氮碳源的研究[J]. 环境科学学报, 2021, 41(9): 3513-3520. [37] ADAV S S, LEE D J, LAI J Y. Enhanced biological denitrification of high concentration of nitrite with supplementary carbon source[J]. Applied Microbiology and Biotechnology, 2010, 85(3): 773-778. doi: 10.1007/s00253-009-2265-4 [38] RÜTTING T, BOECKX P, MÜLLER C, et al. Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle[J]. Biogeosciences, 2011, 8(7): 1779-1791. doi: 10.5194/bg-8-1779-2011 [39] 胡国山, 张建美, 蔡惠军. 碳源、C/N和温度对生物反硝化脱氮过程的影响[J]. 科学技术与工程, 2016, 16(14): 74-77. doi: 10.3969/j.issn.1671-1815.2016.14.015 -



 下载:
下载: