-
双酚A (bisphenol A, BPA)是合成塑料的原料,可以制成各种常见的塑料品,如水瓶、运动器材、医疗器械等。不合理的使用使其广泛存在于工业废水、地表水、地下水甚至饮用水中[1]。双酚A具有神经毒性、免疫毒性、致癌性和致畸性[2],也可影响人和动物的内分泌系统,导致雄性动物雌性化和生殖能力下降。因此,去除双酚A对生态环境和人类健康有重要意义。
目前,双酚A的脱除方法有物理法、化学法、生物法等。其中,酶法处理因其速度快、选择性强而得到了广泛的应用[3]。辣根过氧化物酶(horseradish peroxidase, HRP)是一种具有铁卟啉活性中心的血红素蛋白,能在过氧化氢的存在下氧化降解双酚A。当底物分子被氧化成自由基后,可以重新排列、偶联形成相应的聚合物以及其他化合物[4],这些化合物无毒,易于从水中去除。然而,游离的HRP存在着热稳定性和存储稳定性差、成本高、难回收且不能重复利用的缺点。一种有效的解决方法是将酶固定在特定载体上[3],可显著改善其稳定性,实现其长期使用。
金属有机骨架(metal organic frameworks, MOFs)是由金属离子和有机配体通过络合作用自组装形成的具有周期性网络结构的晶态多孔材料,既结合了无机材料的稳定性,又结合了有机材料的多样可修饰性。MOFs材料由于具有较大的比表面积、可调节的多孔形态和良好的生物相容性,在生物传感、催化、药物缓释等领域取得了重大突破[5]。已有研究证明金属有机骨架可以用于酶的共价固定化。SHIN等[6]通过二环己基碳二亚胺使胰蛋白酶接枝到MIL-88B-NH2(Cr)上,并用于牛血清蛋白降解。DOHERTY等[7]利用戊二醛将β-葡萄糖苷酶固定在NH2-MIL-53(A1)上用于催化水解D-水杨苷转化成葡萄糖。据报道,MIL-88B(Fe)是一种高稳定性、高生物相容性的铁基MOF[8]。基于此,本研究中,利用MIL-88B(Fe)富含官能团的优势,采用EDC/NHS作为交联剂,将HRP负载于MIL-88B(Fe)上,并考察了固定化酶降解双酚A的影响因素,探究了固定化酶的稳定性和可重复使用性。
全文HTML
-
HRP(>160 U·mg−1,冻干粉,RZ>2),双酚A(BPA),三氯化铁(FeCl3·6H2O),对苯二甲酸(H2BDC),1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺(NHS),N, N-二甲基甲酰胺(DMF),乙醇(C2H5OH)和苯酚购自阿拉丁试剂有限公司(中国上海)。4-氨基安替比林(4-AAP)、过氧化氢(H2O2,质量分数为30%)、聚乙二醇(PEG)购自国药化学试剂有限公司(中国上海)。
-
采用X射线衍射仪(XRD,Bruker D8)对MIL-88B(Fe)和MIL-88B(Fe)/HRP材料进行表征。采用傅里叶变换红外光谱仪(FTIR,Thermo-Nicole,美国)对材料表面的官能团进行测定。采用扫描电子显微镜(SEM, Carl Zeiss显微镜,德国)观察样品的形貌。采用热重分析仪(TGA,EXSTAR,日本)测定热稳定性。
-
MIL-88B(Fe)材料根据文献[9]报道的方法进行制备:将0.756 g (2.770 mmol)三氯化铁和0.231 g (1.385 mmol)对苯二甲酸溶解在60 mL的N,N-二甲基甲酰胺(DMF)中。在室温下搅拌30 min后,将溶液转移到高压反应釜中,置于150 ℃的烘箱中恒温加热反应2 h。反应结束后自然冷却至室温,将所得固体用离心分离并用乙醇洗涤数次,最后在真空干燥箱中60 ℃干燥12 h后,得到MIL-88B(Fe)粉末材料。
-
将10 mg MIL-88B(Fe)材料、40 mg的EDC和20 mg的NHS加入到10 mL质量浓度为0.04 mg·mL−1的酶溶液中,在室温下搅拌4 h,反应结束后,所得混合物用去离子水清洗以去除未固定的游离酶。收集含残留酶的上清液,采用Bradford法,用紫外分光光度计在波长为595 nm处测定蛋白含量[10],以计算得出酶的负载量。将MIL-88B(Fe)/HRP分散在去离子水中,并在4 ℃的冰箱中保存。
-
以苯酚、4-AAP和H2O2为底物,采用比色法测定酶的活性[11]。通过记录在510 nm处的吸光度变化来监测催化反应。1个活性单位被定义为在上述条件下每分钟水解1×10−6 mol的H2O2所需HRP的量。
-
降解实验在锥形瓶(150 mL)中进行。试剂按如下顺序添加:双酚A (10~100 mg·L−1)溶液、2.5 mL磷酸盐缓冲液(pH=7, 200 mmol·L−1)、1 mg·mL−1 PEG (0.1~0.8 mL)、H2O2和MIL-88B(Fe)/HRP材料(0.02~0.10 g·L−1)。将混合溶液用磁力搅拌器搅拌,并在预定的时间用注射器取出上清液,用0.22 μm过滤器过滤以备后续测定。所有实验均进行3次,数据取平均值。
采用分光光度法(λ=510 nm)测定双酚A的质量浓度。在铁氰化钾存在下,双酚A与4-氨基安替比林在pH为10.0±0.2时反应生成橙色染料,吸光度值与双酚A的浓度成正比[3]。
-
每次反应结束后,用离心分离法分离出所使用的MIL-88B(Fe)/HRP,并用去离子水清洗,以去除物料内残留的反应溶液。之后,在上述实验条件下,催化剂在新的反应介质中重复使用。每一轮降解在25 ℃进行,并测定保留活性。所有实验均进行3次,取平均值。
1.1. 实验原料
1.2. 表征
1.3. MIL-88B(Fe)的制备
1.4. MIL-88B(Fe)/HRP的制备
1.5. 酶活性的测定
1.6. 降解实验
1.7. 回收实验
-
1) SEM分析。由图1(a)可以看出,MIL-88(Fe)的形态为纺锤状。EDS能谱分析表明了MIL-88B(Fe)中Fe、C、O元素的存在和均匀分布。通过EDC/NHS将HRP共价固定在MIL-88(Fe)上后,Fe-MOF的形态保持不变(图1(b))。
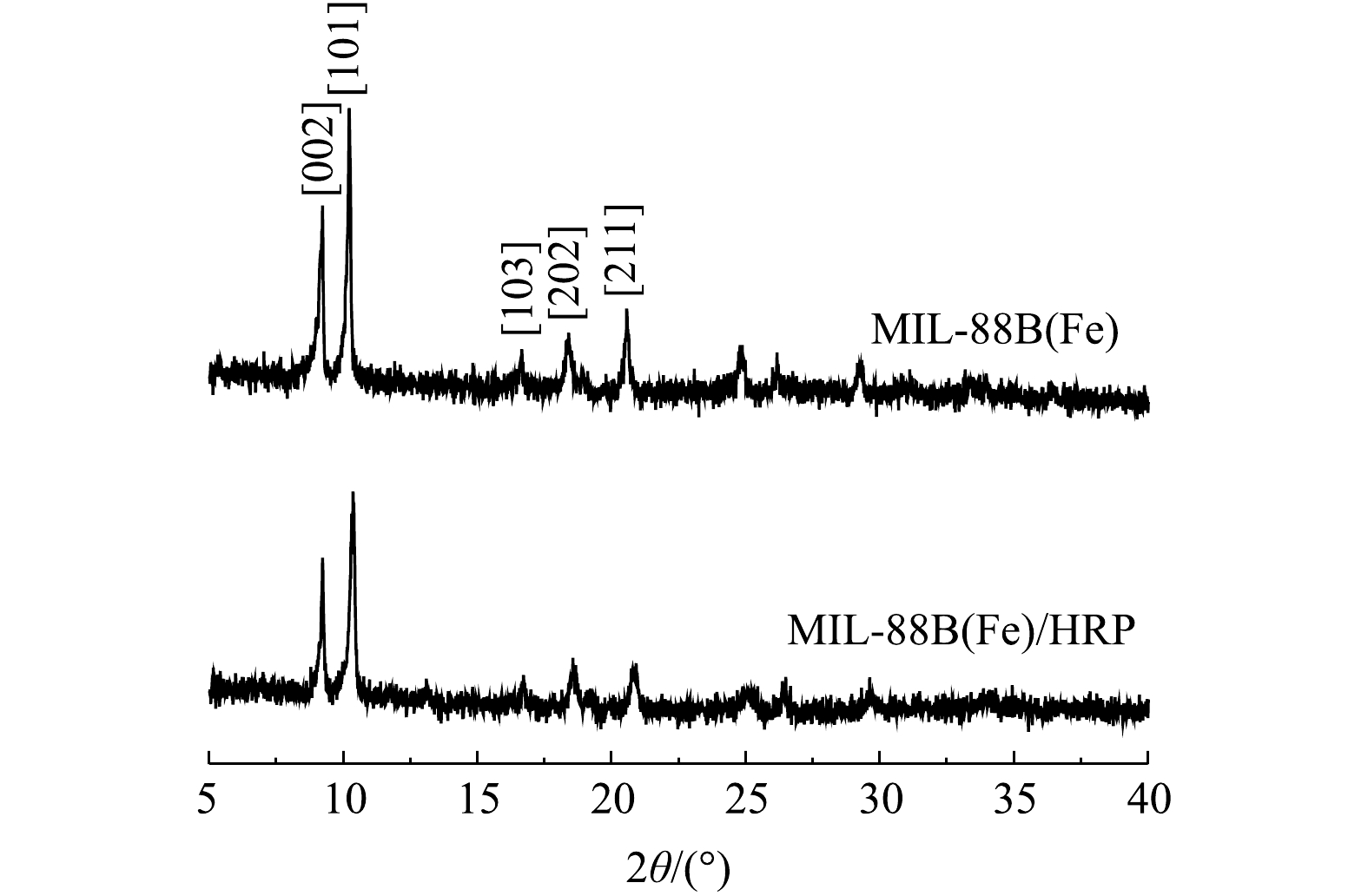
2) XRD分析。合成的MIL-88B(Fe)的XRD图谱如图2所示。衍射峰与之前报道MIL-88B(Fe)的相应峰[002]、[101]、[103]、[202]和[211]匹配良好[12],并且衍射峰强度高,说明MIL-88(Fe)结晶良好。MIL-88B(Fe)/HRP的特征峰与MIL-88B(Fe)基本一致,表明在HRP存在下,MIL-88B(Fe)的结构完整性和结晶形态得以保留,且结合过程中没有导致相变。峰强变弱表明酶成功负载在MIL-88B(Fe)上。
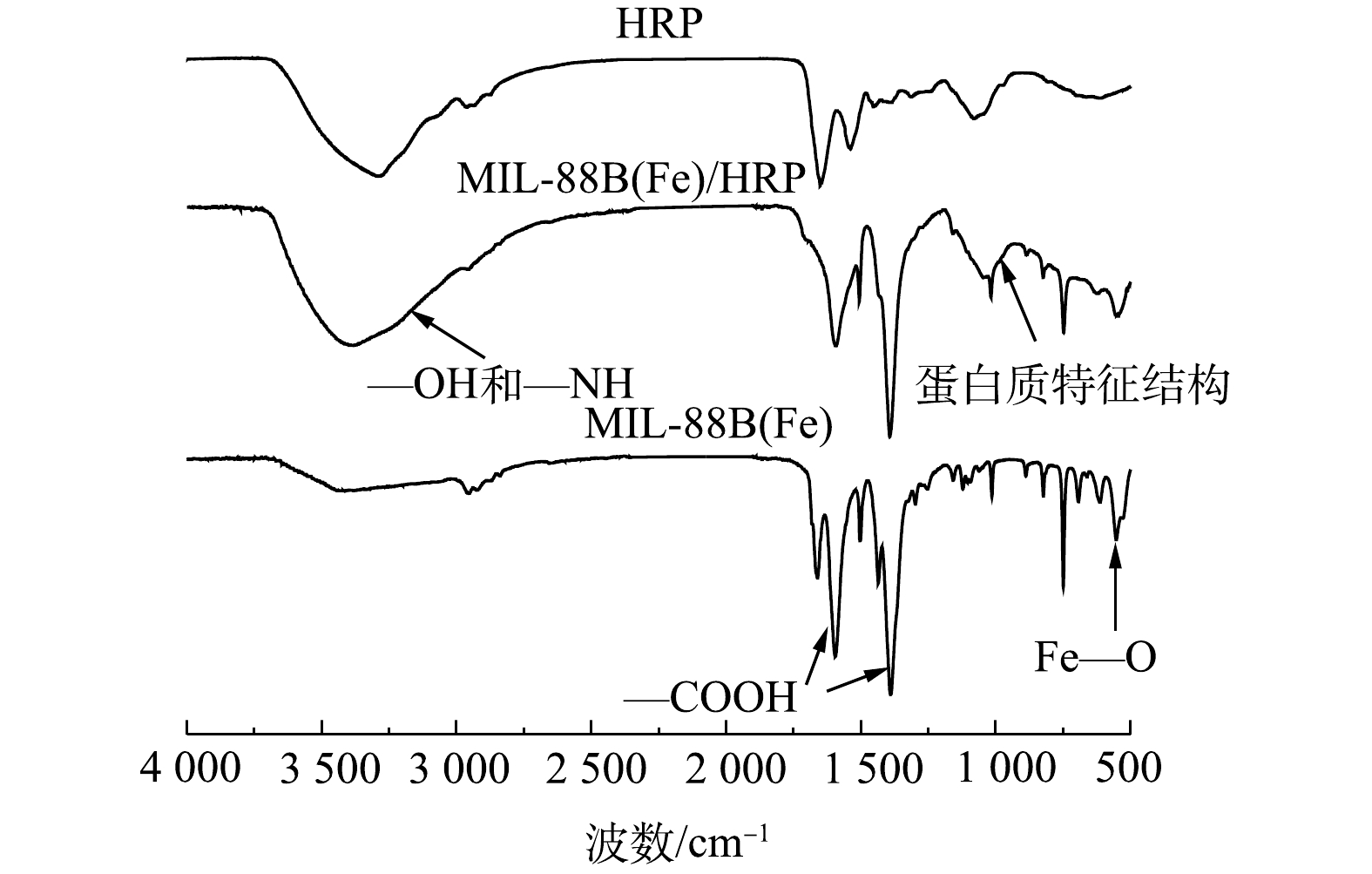
3) FTIR分析。为了进一步分析MIL-88B(Fe)样品的分子结构和官能团,对其进行了FTIR光谱表征,结果如图3所示。分别在552、1 394和1 548 cm −1处观察到MIL-88B(Fe)的特征吸收峰,这与文献[13]中报道的结果相同。在552 cm −1处的强波段为Fe—O振动峰。在1 548 cm−1和1 394 cm−1处的2个峰是羧基的不对称振动峰和对称振动峰,这证实了MIL-88B(Fe)材料中存在二羧酸配体[14]。在负载HRP后,MIL-88(Fe)出现了新的特征峰,其中1 029.93 cm−1为酰胺键的N—H弯曲振动峰,其在1 174~955 cm−1的蛋白质特征结构区域内[15],3 700~3 000 cm−1处的特征峰为—OH和—NH基团[16]。可以看出,固定化酶材料同时具有MIL-88B(Fe)和HRP的特征吸收峰,表明MIL-88(Fe)/HRP的成功制备。
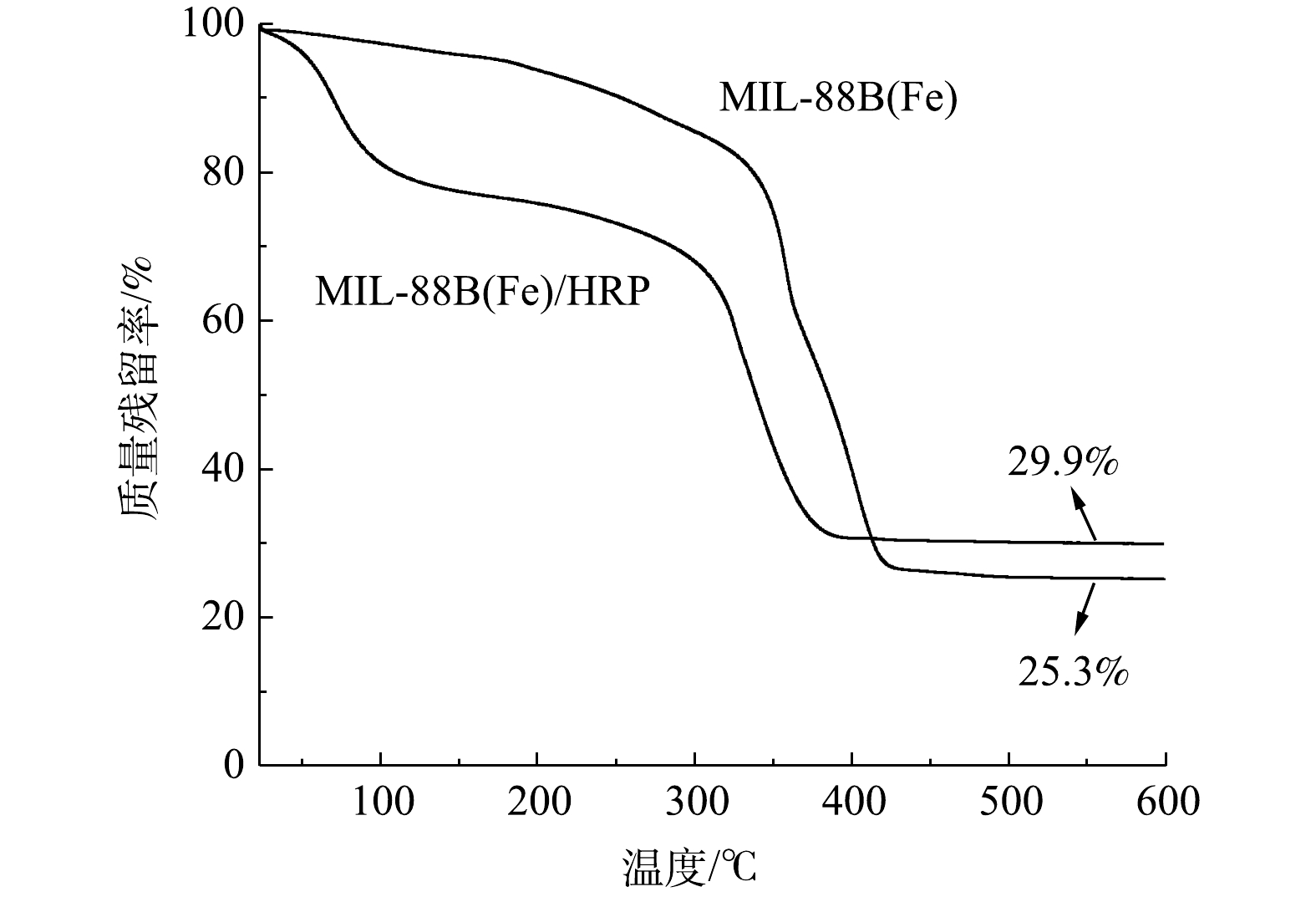
4) TGA分析。热重曲线(图4)表明,MIL-88B(Fe)在<350 ℃条件下具有良好的热稳定性。当温度高于350 ℃时,结构发生坍塌(急剧失重)。与MIL-88B(Fe)相比,MIL-88(Fe)/HRP的TGA曲线有2个明显的失重步骤。第1次质量损失(<100 ℃)是由于吸附水和结合水的蒸发[17]。第2次质量损失(约300 ℃)是由于MOF骨架的坍塌所致,这与MIL-88B(Fe)的变化趋势一致。当温度达到450 ℃时,固定化酶保留了29.9%的初始质量,比MIL-88B(Fe)的25.3%稍微高一点,这是由于固定化酶在热解过程中残留了一些有机物所导致的[18]。
-
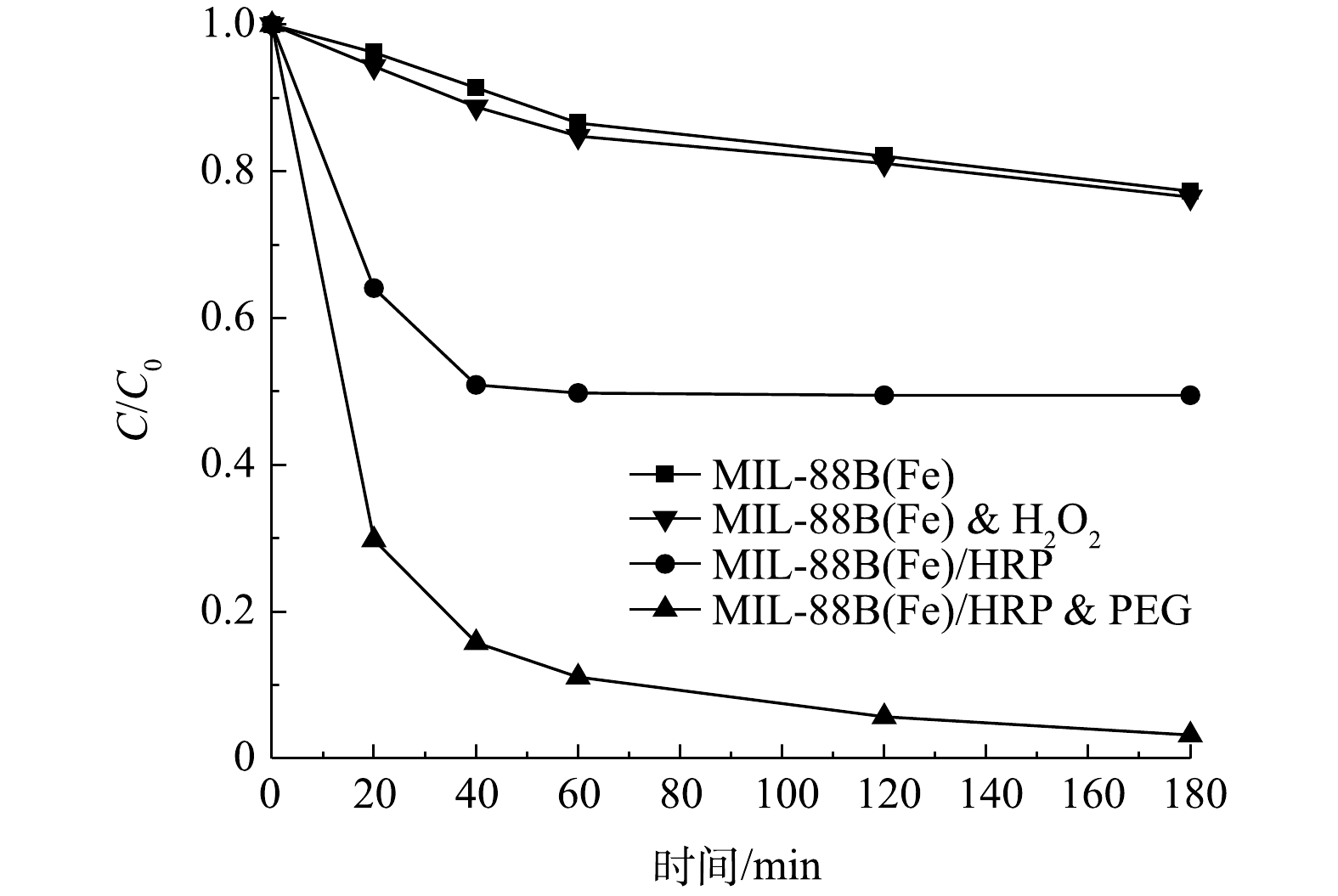
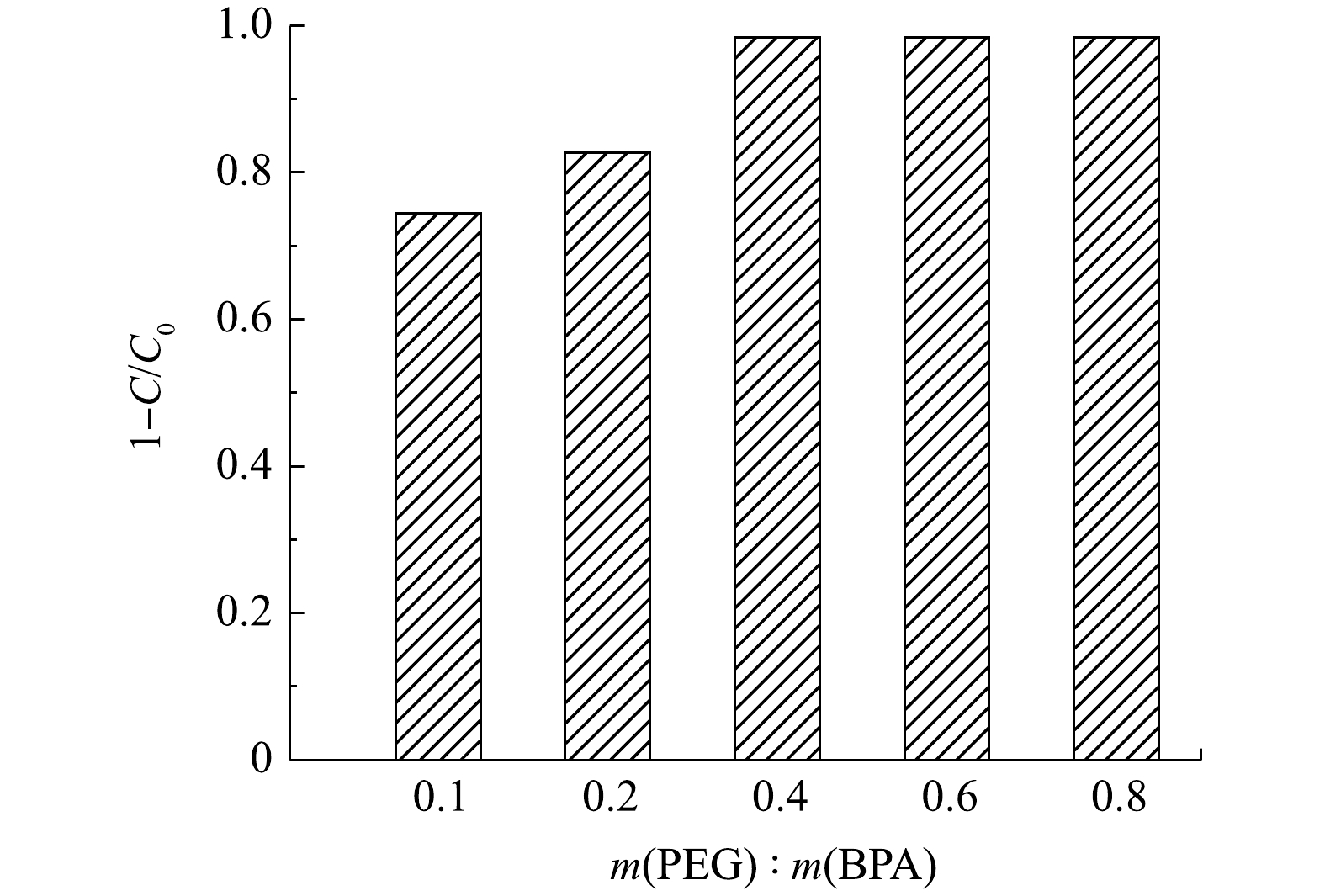
1)反应时间及PEG的影响。在pH为7.0的条件下,对双酚A (20 mg·L−1)进行了降解实验,以评价合成材料的催化性质。如图5所示,MIL-88(Fe)的吸附性能较差,在3 h内对双酚A的去除率仅为22.6%。在添加了过氧化氢之后,没有观察到明显的催化效果。在相同条件下,以MIL-88(Fe)/HRP为催化剂,1 h内可去除50.5%的BPA。较低的BPA降解率可能是因为催化过程中自由基和聚合产物附着在酶上,导致酶被灭活,从而使反应终止[19]。为了防止这种情况发生,一些研究者建议在反应体系中加入如聚乙二醇(PEG)等高亲水性物质。PEG可以在HRP活性中心附近形成保护层,防止反应过程中形成的游离苯氧基破坏过氧化物酶;同时,PEG对降解产物的亲和力比酶强,可以防止降解产物与酶结合[20]。在PEG的作用下,MIL-88(Fe)/HRP材料可以实现高效快速降解BPA,反应1 h后,BPA的去除率高达99.2%。与之前的相关研究相比,MIL-88(Fe)/HRP表现出优异的催化性能(表1)。
在催化剂投加量为0.06 g·L−1、BPA初始质量浓度为20 mg·L−1时,可以看出,在初始60 min内双酚A降解速度较快,随着时间的推移,降解速度有所减慢,在3 h基本达到降解平衡,此时双酚A的降解率为98.4%。因此,确定最佳降解反应时间为3 h。如图6所示,当PEG/BPA的质量比为0.1时,双酚A的降解率为72.7%。随着PEG用量的增加,双酚A的降解率显著提高。这是由于酶失活数量的减少,降解反应得以继续。当PEG/BPA的质量比为0.4时,双酚A降解率达到98.4%,且随着PEG的进一步添加,降解率保持不变。因此,确定最佳PEG/BPA的质量比为0.4。
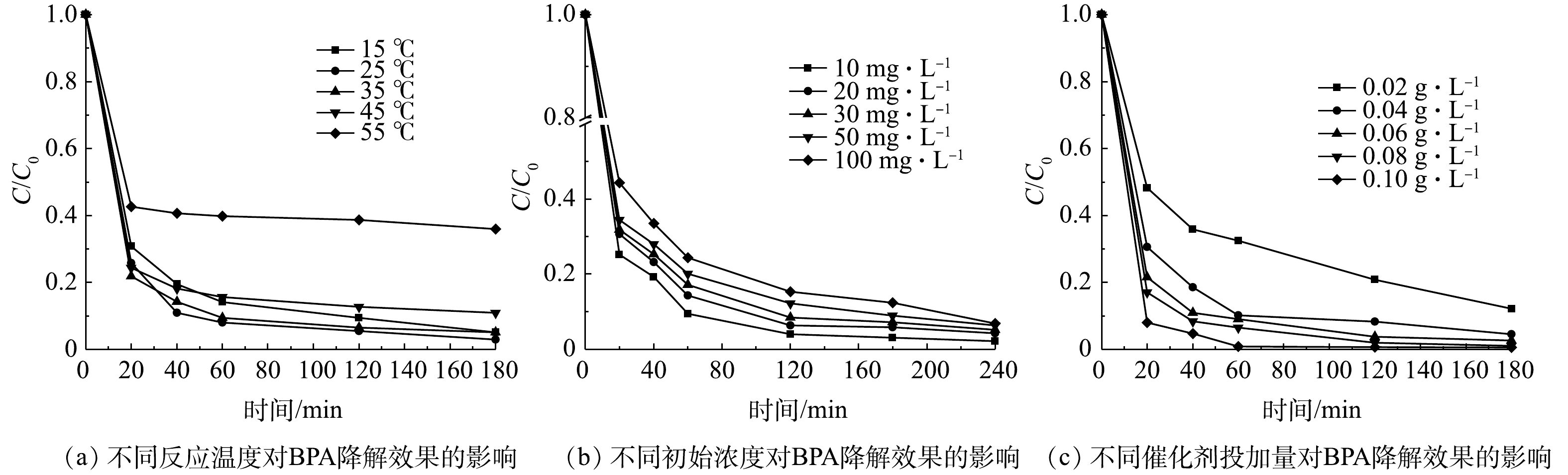
2)反应温度的影响。由图7(a)可以看出,在较低温度(15~35 ℃)下,各温度下的降解率差异较小;随着反应温度提高,酶开始失活。因此,选择常温25 ℃进行后续实验。
3)双酚A初始质量浓度的影响。如图7(b)所示,当双酚A质量浓度为10 mg·L−1时,MIL-88B(Fe)/HRP的降解效率最高;随着双酚A质量浓度由10 mg·L−1增加到100 mg·L−1,其去除率有所下降。其原因是,过多的双酚A分子聚集,导致无法接触HRP上的活性位点[29]。此外,随着双酚A质量浓度的增加,酶催化的反应速率趋于平衡,双酚A的去除率开始降低。值得注意的是,即使双酚A质量浓度为100 mg·L−1时, 仍有93.1%的BPA在4 h内被去除,这显示了MIL-88B(Fe)/HRP优秀的降解性能及其在废水处理中潜在的应用前景。
4)催化剂用量的影响。如图7(c)所示,当催化剂用量由0.02 g·L−1增加到0.10 g·L−1时,双酚A的降解率迅速提高,这是因为降解双酚A的催化活性位点有所增加。当催化剂用量为0.10 g·L−1时,1 h内可去除99.2%的BPA,但酶用量过高势必会导致成本增加。为了降低成本,控制反应速率以及方便测量,选择0.06 g·L−1作为双酚A降解的最佳催化剂剂量。
-
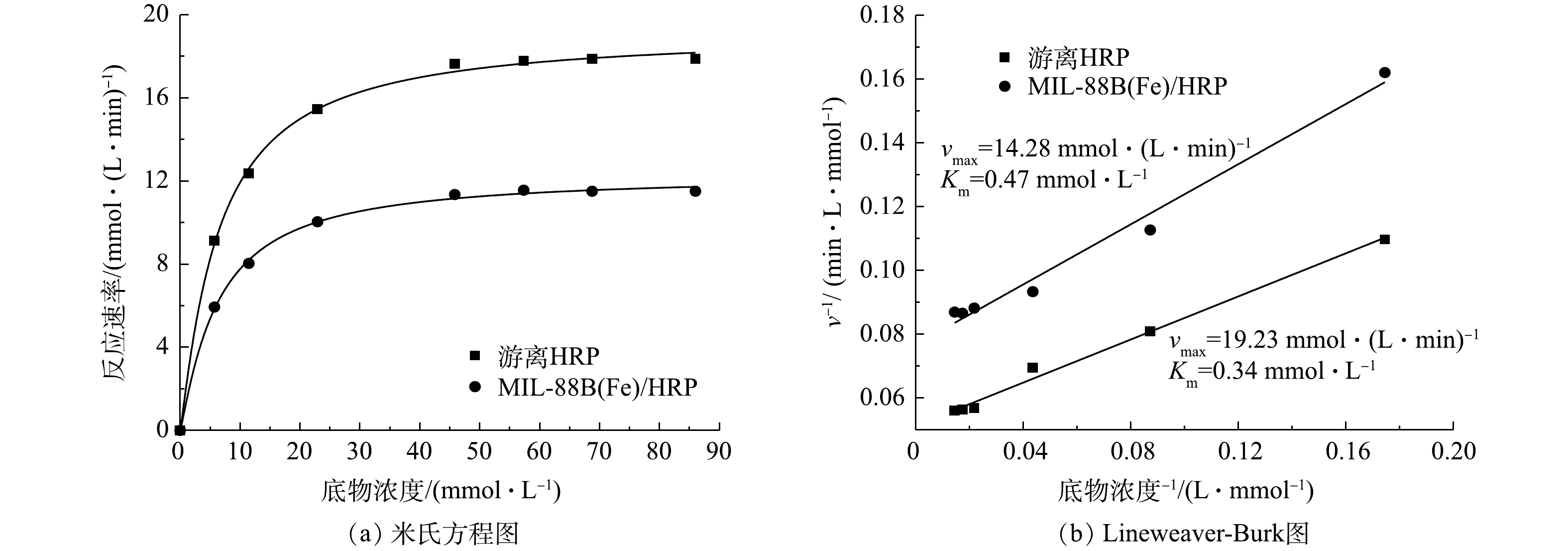
利用米氏方程和Lineweaver-Burk图计算游离酶和固定化酶的动力学参数(米氏常数Km和最大反应速率vmax)。采用Bradford法测定得出材料固定化酶的最大负载量为38.9 mg·g−1,在保证酶的质量相同的情况下测定游离酶和固定化酶的参数。如图8(a)所示,随着底物浓度的增加,酶促反应速率先增加后趋于平稳。与游离酶相比,由于传质受限,固定化酶的反应速率较低[30]。米氏常数Km值是指酶与底物之间的亲和力,其值的大小只与酶的性质有关系,Km值越小,底物与酶的亲和力越高。如图8(b)所示,游离酶的Km为0.34 mmol·L−1,固定化酶的Km值增加到了0.47 mmol·L−1,vmax由19.23 mmol·(L·min)−1下降到14.28 mmol·(L·min)−1。这是由于共价固定改变了酶蛋白的构象,阻碍了底物与HRP活性位点的接触,使亲和力降低,最大反应速率降低。经实验测定,固定化酶可以保留游离酶活性的70.6%。
-
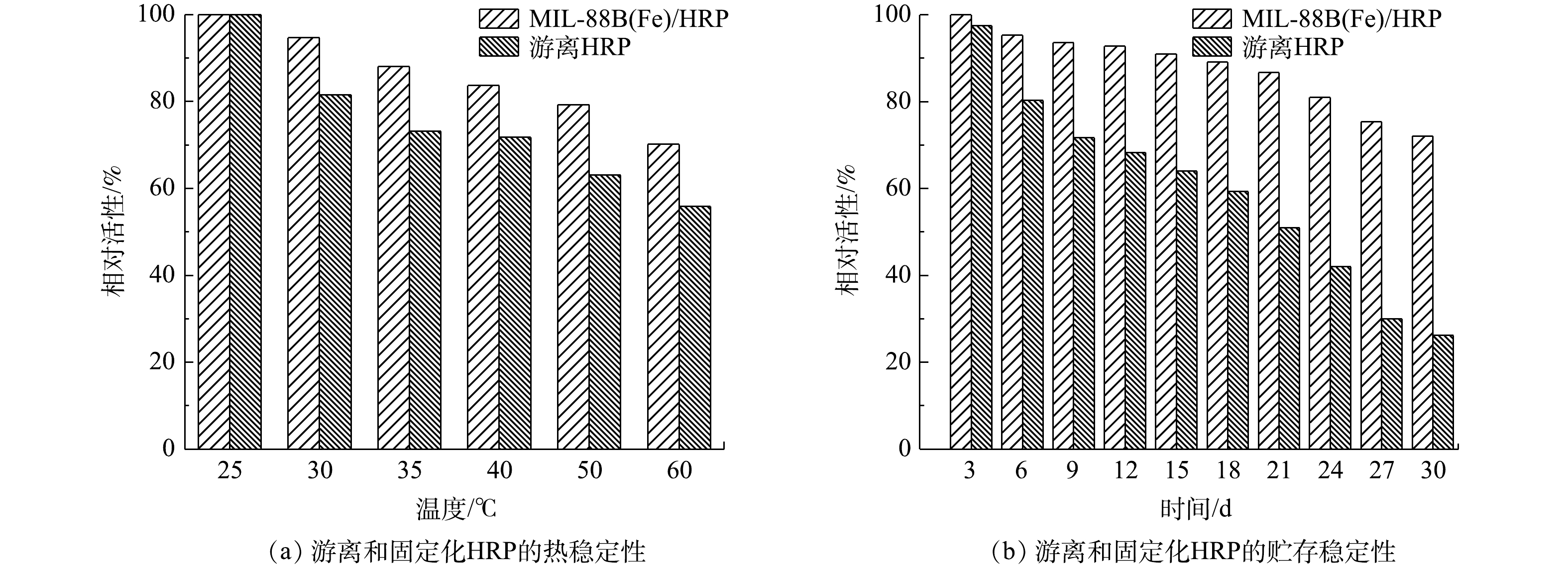
在工业应用中,酶的高温变性也是一个迫切需要解决的问题。固定和游离HRP的热稳定性实验,是通过在25~60 ℃内孵育1 h后,测量其残余活性来进行。由图9(a)可以看出,经过60 ℃热处理后,游离HRP的残余活性下降到55.9%,而固定化后的HRP仍保持初值的70.2%。在不同温度下,MIL-88B(Fe)/HRP的活性均高于游离酶。上述结果表明,固定化酶比游离酶具有更好的耐热性,这是由于固定化限制了酶的构象变化所致。据报道,MIL-88B(Fe)的保护作用可以抑制酶分子的展开和非特异性聚集,从而防止HRP的热变性[31]。
合成样品的贮存稳定性是评价固定化效率的重要指标。对MIL-88B(Fe)/HRP和游离HRP均通过在4 ℃去离子水中存储30 d后的残余活性进行评估(图9(b))。与所预期一样,MIL-88B(Fe)/HRP的活性下降速度明显慢于游离酶。固定化后的HRP在储藏15 d后仍保留了高达90%的初始活性,而游离的HRP的活性则降低到初始活性的64%。30 d后,游离HRP只剩下26.2%的初始活性,而合成材料的活性达到70%以上。游离HRP活性的丧失可能是由于在贮存过程中蛋白构象发生变化,活性位点不能与底物反应[32]。相反,MIL-88B(Fe)/HRP由于与酶形成强共价键,对构象变化表现出很强的抗性[33]。因此,固定化酶比游离HRP更稳定,保质期更长。上述结果表明,MIL-88B(Fe)/HRP具有良好的耐久性,在工业应用中具有较大的潜力。
-
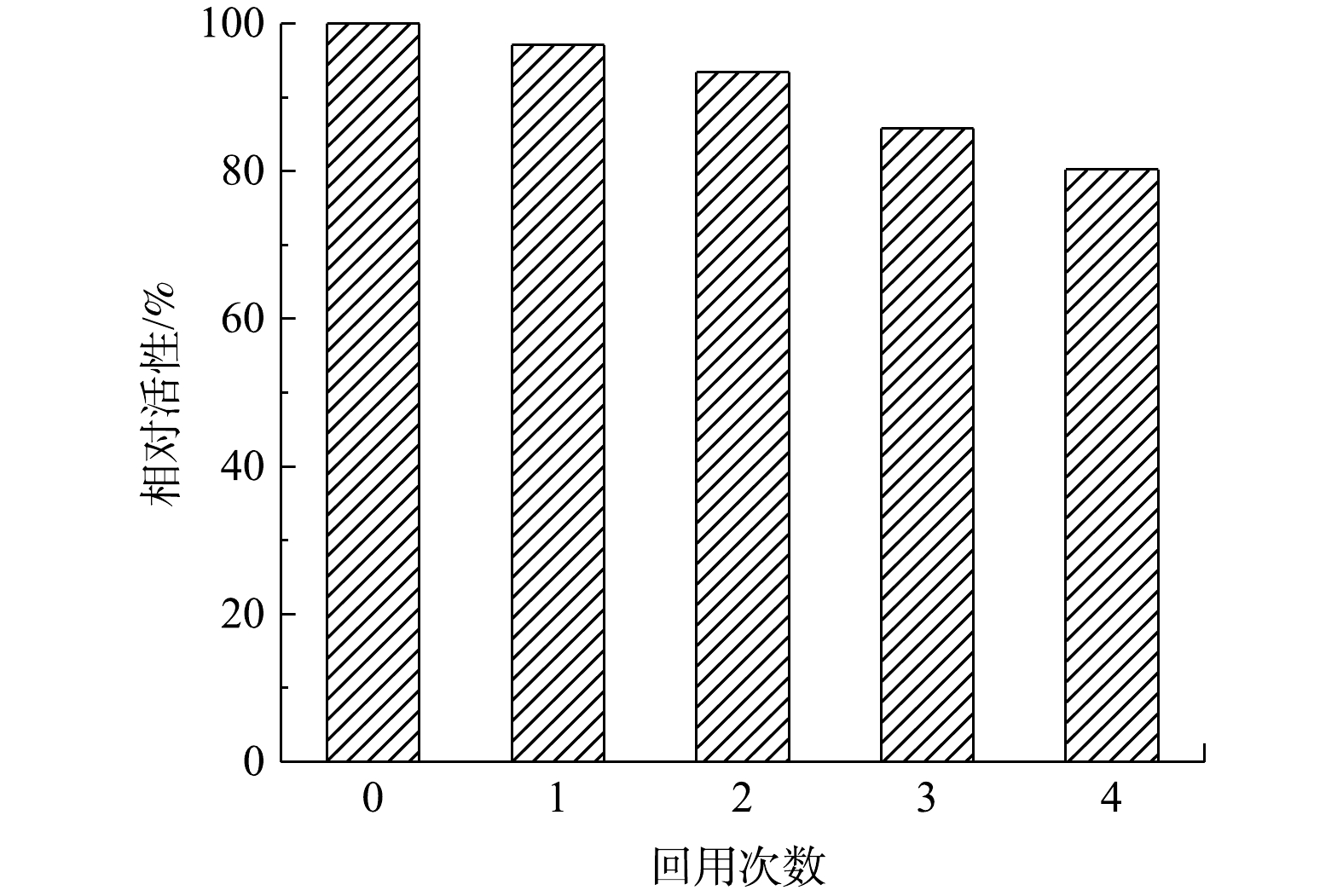
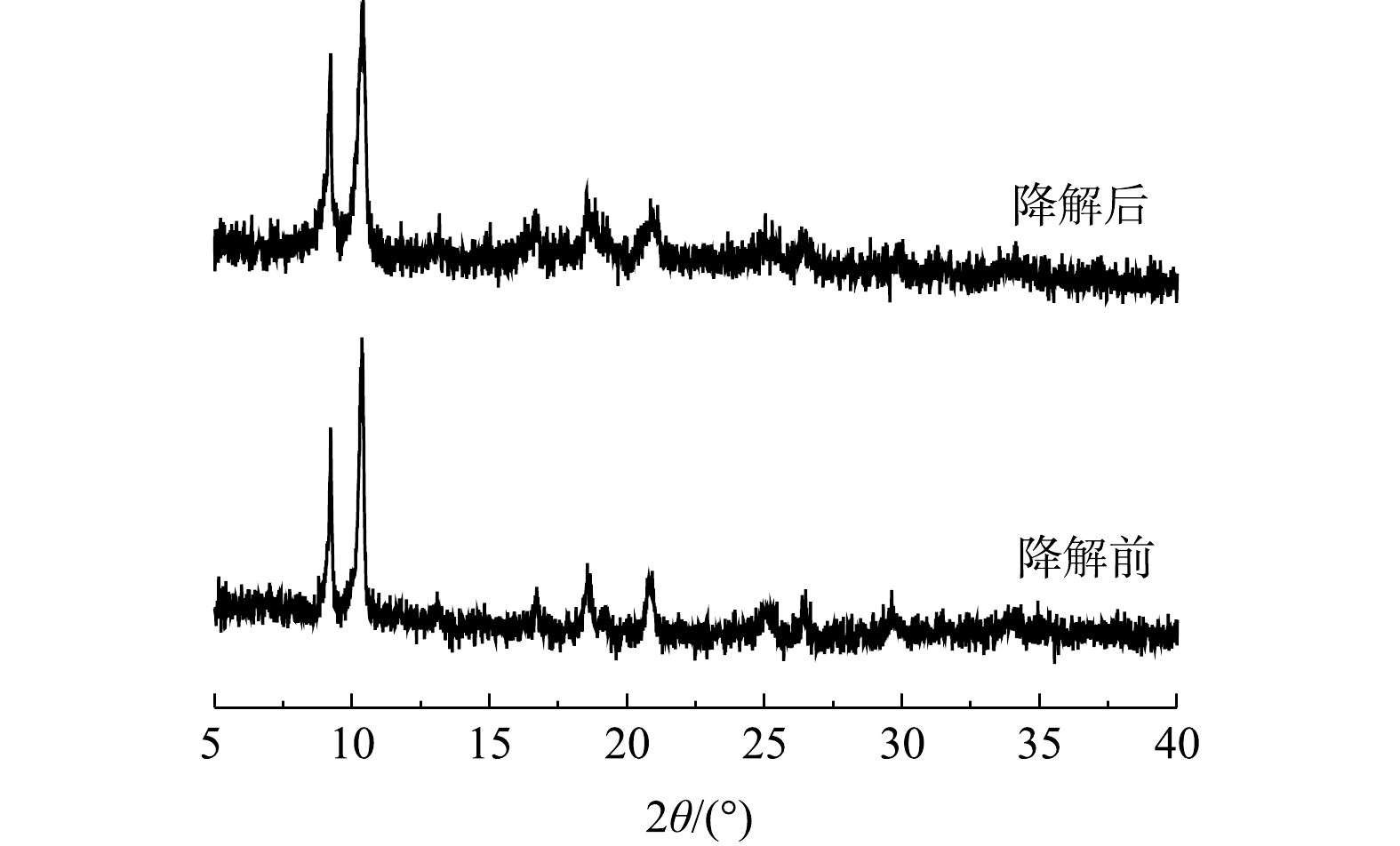
酶固定化的主要目的之一是实现酶的重复利用。为此,研究了MIL-88B(Fe)/HRP在连续使用数次后的残留活性。如图10所示,固定化的HRP经过4次循环,残余活性仍超过80%,且第4次降解后MIL-88B(Fe)/HRP的XRD谱图仍保留了原材料的特征峰(图11)。这表明催化剂经循环使用后其结构没有发生变化,具有较高的稳定性。其原因与HRP和MIL-88B(Fe)通过EDC/NHS形成的强共价键有关,共价键的形成可增强催化剂的结构稳定性,防止酶的脱落,从而保持较高的催化活性[34]。但催化剂的相对活性随着重复使用次数的增加而降低,对于活性降低的可能原因有3点:一是由于样品量微小,部分MIL-88B(Fe)/HRP在回收过程中丢失,材料回收率仅为91.3%;二是反应过程中产物在催化剂表面的积累会阻碍HRP的活性位点,对下一个反应周期产生不利影响[35];三是HRP在与底物反应过程中蛋白发生部分折叠或变性,导致酶失活[36]。从整体上看,固定化酶具有分离简单、稳定性好、可回收等优点,从而可大大降低酶体系的实际应用成本。
2.1. 材料表征
2.2. 不同反应条件对BPA降解效果的影响
2.3. 酶促反应动力学
2.4. 热稳定性和贮存稳定性
2.5. 固定化HRP的可重复使用性
-
1)通过EDC/NHS共价交联体系将HRP固定化到MIL-88B(Fe)上,可得到MIL-88B(Fe)/HRP复合材料;通过一系列XRD、FTIR、SEM、TGA等手段的表征,证明了MIL-88B(Fe)的成功合成,及HRP的成功负载。
2)在PEG/BPA质量比为0.4的情况下,最终确定在pH为7、25 ℃、BPA的初始质量浓度为20 mg·L−1,固定化酶投加量为0.06 g·L−1的实验条件下,3 h内可去除98.4%的BPA。
3)在酶固定化后,酶与底物的亲和力降低。酶的活性保留了游离HRP的70.6%。
4)在固定化酶之后,MIL-88B (Fe)/HRP比游离HRP具有更好的热稳定性、贮存稳定性和可重复使用性,这可为工业应用提供潜在的可能性。




 下载:
下载: