-
我国是一个贫水国家,尤其在西北地区,水资源严重短缺[1]。以集雨窖水作为居民的生活用水,可解决用水量不足的问题;但集蓄的窖水中存在一定的有机物等营养源,微生物容易繁殖,贮存较长时间后会腐败变质,有腥臭味,影响人体感官和饮用安全。因此,如何选择经济有效的消毒方式来维持集雨窖水的水质,对保障这些地区居民饮水安全具有重要意义。
氯消毒法因具有消毒效果良好、持续消毒能力强、使用管理较方便、成本较低等优点[2],因此,可作为较为常见的抑制水质恶化的措施,且成为偏远地区分散居民维持窖水水质的一种保鲜剂。凌波等[3]研究了太阳辐照、紫外线、次氯酸钠、微滤和铜锌合金微粒等5种消毒方法对窖水消毒的效果,结果表明,微滤较适用水柜水消毒,次氯酸钠较适用于窖水的消毒。而三氯异氰尿酸(trichloroisocyanuric acid,TCCA)是一类应用较多的高效有机氯胺消毒剂[4],在水中水解生成次氯酸和异氰尿酸,因次氯酸分子不带电荷,可顺利通过细胞膜进入细胞内部,破坏微生物的酶系统,抑制其新陈代谢,从而灭活细菌。有研究[5-10]表明,与NaClO和Cl2相比,TCCA有效氯含量高,具有消毒效果好、水中余氯衰减慢、消毒副产物生成量少、使用方便和价格便宜等优点,是一种安全有效的替代消毒剂,可对井水、河水、灾区饮用水进行消毒。TCCA已被美国联邦食品和药物管理局(FDA)及环保局(EPA)正式批准允许用于食品及饮用水的消毒杀菌[11],在日本、西欧等地也已广泛应用于饮用水和游泳池等领域[12]。TCCA使用后完全分解的残余物为氨气和二氧化碳,对环境无害、对人体安全[13-14],动物实验属无毒级物质[15];按国标要求在渔业上使用,未发现毒副作用或过敏症状[16]。
本研究采用TCCA作为氯制消毒剂对窖水进行了消毒实验,研究了向窖水中投加氯消毒剂后主体水中的余氯衰减规律以及微生物的变化情况,探讨了投加量、温度及pH等因素对消毒剂作用效果的影响,为集雨窖水消毒工艺的选择和解决农村饮水安全问题提供参考。
全文HTML
-
本研究水样采用实际集雨窖水,实验期间窖水水温为(18.4±0.9) ℃,pH为8.26±0.08,浊度为(5.38±0.46) NTU,CODMn为(4.76±0.76) mg·L−1,UV254为(0.086 1±0.003 6) cm−1,氨氮浓度为(0.59±0.07) mg·L−1,菌落总数为(2.53±1.07)×104 CFU·mL−1。
-
TCCA购自百消净生物科技有限公司,主要成分为三氯异氰尿酸及其增效剂、控释剂和净水剂等,使用前,采用碘量法测定有效氯含量超过80%,实验中所用常规试剂均为分析纯,药剂溶液使用超纯水配制。
温度采用温度计测定;pH采用雷磁PHS-3E型pH计测定;氨氮、菌落总数和余氯分别采用纳氏试剂分光光度法、平皿计数法和N,N-二乙基-1,4-苯二胺(DPD)分光光度法测定。
-
1)窖水中的余氯衰减规律。用次氯酸钠溶液预处理玻璃仪器烘干待用;将所取的窖水水样摇匀后,分装于若干个2 L的烧杯中,根据需要调节溶液的pH后,用塑料薄膜封口并置于设定温度下的恒温培养箱中。实验前,采用碘量法测定所用氯消毒剂的有效氯浓度,待烧杯中的水样达到所需温度后,分别向各个烧杯中加入一定量的氯消毒剂,经磁力搅拌器搅拌1 min后,使消毒剂与水样充分接触,继续存放于恒温培养箱中,此过程不再搅拌。每隔一定时间,在烧杯中取样,采用DPD法测定各水样的余氯浓度。
2) TCCA对窖水中微生物的灭活效果。将所取窖水分装于2 L的烧杯中,置于恒温培养箱中控制温度,向水样中投加一定量的消毒剂,经磁力搅拌器搅拌1 min后,使消毒剂与水样充分接触,继续存放于恒温培养箱中,此过程不再搅拌。每隔一定时间取样,加入过量的无菌10% Na2S2O3终止反应,采用平皿计数法测定菌落总数,每个水样做2个平行样。所用的容器和试剂均经过灭菌处理,利用灭活率和对数灭活率评价消毒效果,计算方法如式(1)和式(2)所示。
式中:R为灭活率;N0为原水水样中的菌落总数,CFU·mL−1;Nt为消毒后水样中的菌落总数,CFU·mL−1;lgR为对数灭活率。
1.1. 实验用水
1.2. 试剂与方法
1.3. 实验设计
-
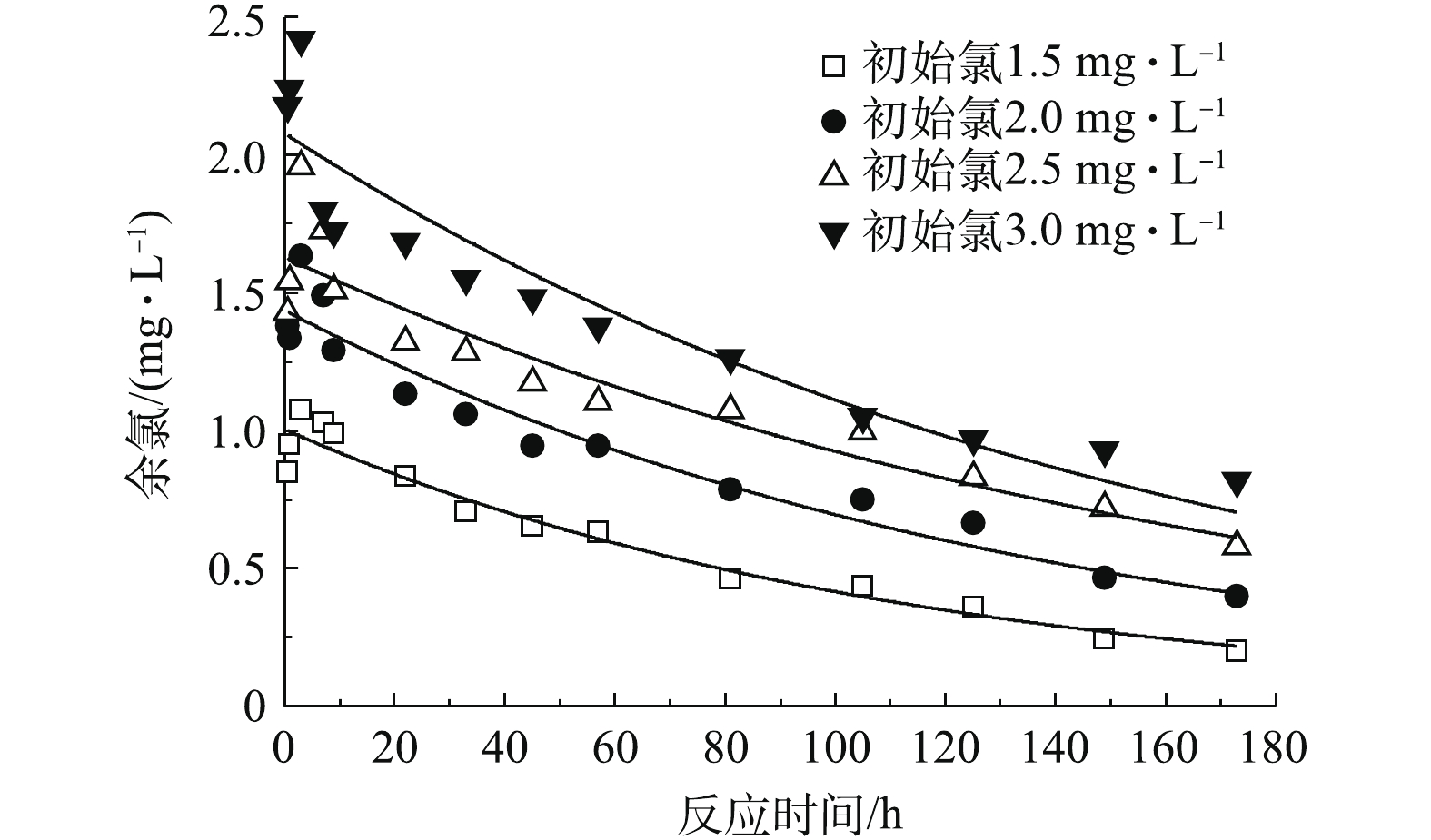
1)初始氯投加量对余氯衰减的影响。在20 ℃的温度下,向4个烧杯中分别投加一定量的TCCA,理论有效氯投加量分别为1.5、2.0、2.5和3.0 mg·L−1。每隔一定时间测定烧杯中的余氯浓度,余氯变化情况如图1所示。可以看出,在不同的初始氯投加量下,水中余氯浓度在反应初期都未达到初始理论有效氯浓度,而是从某浓度值逐渐上升,在3 h左右达到最大值,而后随时间逐渐衰减。在3 h时,在1.5、2.0、2.5 和3.0 mg·L−1投加量下的余氯分别为1.07、1.63、1.96 和2.42 mg·L−1,到173 h时,水样中余氯的衰减量分别为1.30、1.60、1.92和2.18 mg·L−1,这说明余氯的消耗量随初始氯投加量的升高也相应增大。在整个过程中,水样中的余氯浓度始终低于理论有效氯浓度。其原因在于,TCCA的溶解度较低且溶解速率较慢,在反应前期有一个逐渐向水中扩散的过程,大概持续3 h,而向水体中扩散的部分TCCA同时会水解生成HClO(式(3)),其可与水体中的一些还原性物质反应,使水样中余氯浓度低于初始理论有效氯浓度。
 (3)
(3)
采用一级动力学模型对不同初始理论有效氯投加量下的余氯衰减过程进行拟合,结果见表1。由表1可知,随初始理论有效氯投加量的升高,余氯的消耗量也相应增大,但余氯的衰减速率却在减小,这与很多研究的结果[2, 17]一致。其原因可能在于,初始理论有效氯投加量较小时,氧化能力较弱,反应生成简单的化合物,比较迅速地完成反应过程,余氯衰减速率较大;初始浓度较大时,氧化能力较强,水中可以被氯氧化的有机物越多,慢速反应和快速反应同时发生,总体余氯衰减速率减慢。由拟合结果可以进一步看出,初始理论有效氯投加量越低,拟合效果越好,这说明氯投加量较低的水样的反应更接近一级反应。
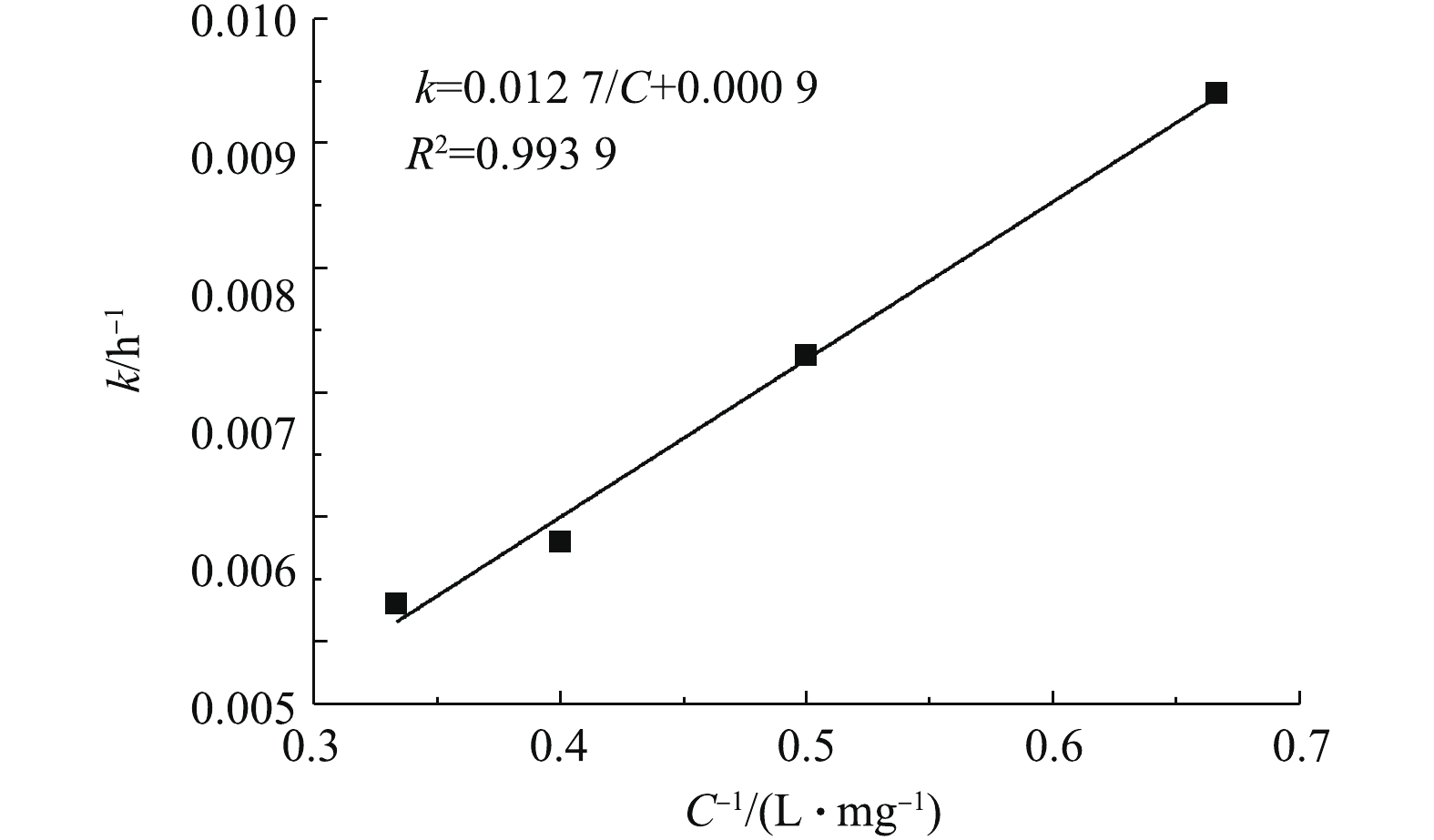
初始理论有效氯投加量与余氯的衰减系数的关系如图2所示。由图2可知,主体水余氯衰减系数k和 1/C存在较好的线性关系。因此,余氯的衰减系数与初始理论有效氯投加量的关系可以近似用式(4)表示。
2)反应物浓度对余氯衰减的影响。为体现窖水中不同的反应物浓度,分别将窖水稀释2倍和5倍,同时以纯水作为对比,以稀硝酸和氢氧化钠调节溶液的pH,使其与原水相同,以耗氧量和UV254为有机物浓度指标。在20 ℃下,向烧杯中分别投加一定量的TCCA,使水样的初始理论有效氯浓度为2.5 mg·L−1,每隔一定时间测定烧杯中的余氯浓度,余氯衰减情况如图3所示。由图3可知,原水与稀释5倍水样中的余氯经过153 h后,分别衰减了1.65 mg·L−1和1.20 mg·L−1,余氯的衰减量随水样中反应物浓度的减小而减少。在纯水中几乎不含有可与余氯反应的物质,余氯也衰减了0.79 mg·L−1,说明余氯的衰减有很大一部分在于自身的分解,如式(5)和式(6)所示。
采用一级动力学模型对不同反应物浓度下的余氯衰减情况进行拟合,拟合结果见表2。由表2可知,反应物浓度越低,余氯衰减系数越小,水体中的余氯衰减越慢。这可以通过传质效率来解释,反应底物浓度越高,传质效率越高,消耗氯的反应越快。
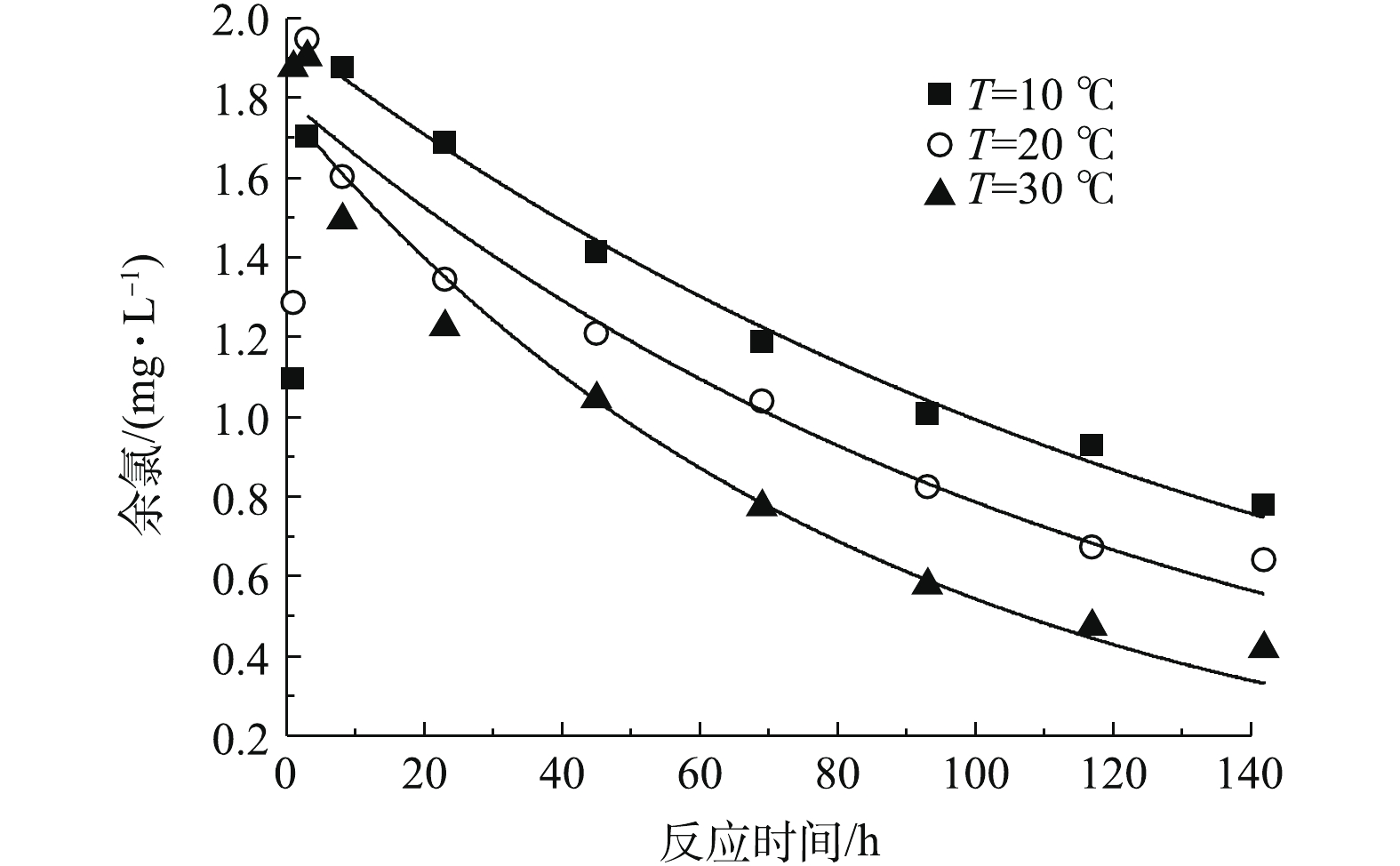
3)温度对余氯衰减的影响。在初始理论有效氯浓度为2.5 mg·L−1的条件下,研究了温度分别为10、20和30 ℃时的余氯衰减情况。由图4可知,142 h内,余氯的衰减量随温度的升高而增加,从10 ℃时的1.72 mg·L−1增加到30 ℃时的2.08 mg·L−1。采用一级动力学模型对不同温度下的余氯衰减情况进行拟合,结果见表3。由表3可知,温度越高,余氯衰减系数越大,水中余氯衰减越快。因为水体中投加氯消毒后,作用效果主要有2个方面:一是灭活微生物;二是与水体中的一些物质发生化学反应。水温的升高使得细菌等微生物的生长繁殖速度加快,须消耗更多的余氯来抑制微生物数量的增长。同时,温度升高还提高了氯和水体中反应物的活性,使得余氯在水中的化学反应速率加快。另外,余氯自身的降解速率也随之加快,从而使余氯的衰减速率增加。
为更好地描述氯衰减规律和温度间的关系,分别采用阿伦尼乌斯方程、线性函数、指数函数及幂函数模型对反应温度T和余氯衰减系数k进行拟合,结果见表4。由表4可知,指数函数模型对反应温度T和余氯衰减系数k的拟合结果最好,其次是阿伦尼乌斯方程,两者的可决系数R2>0.95,而幂函数模型的拟合结果较差。因此,在温度为10~30 ℃时,可以用指数函数或者阿仑尼乌斯方程描述余氯衰减系数与温度T的关系。
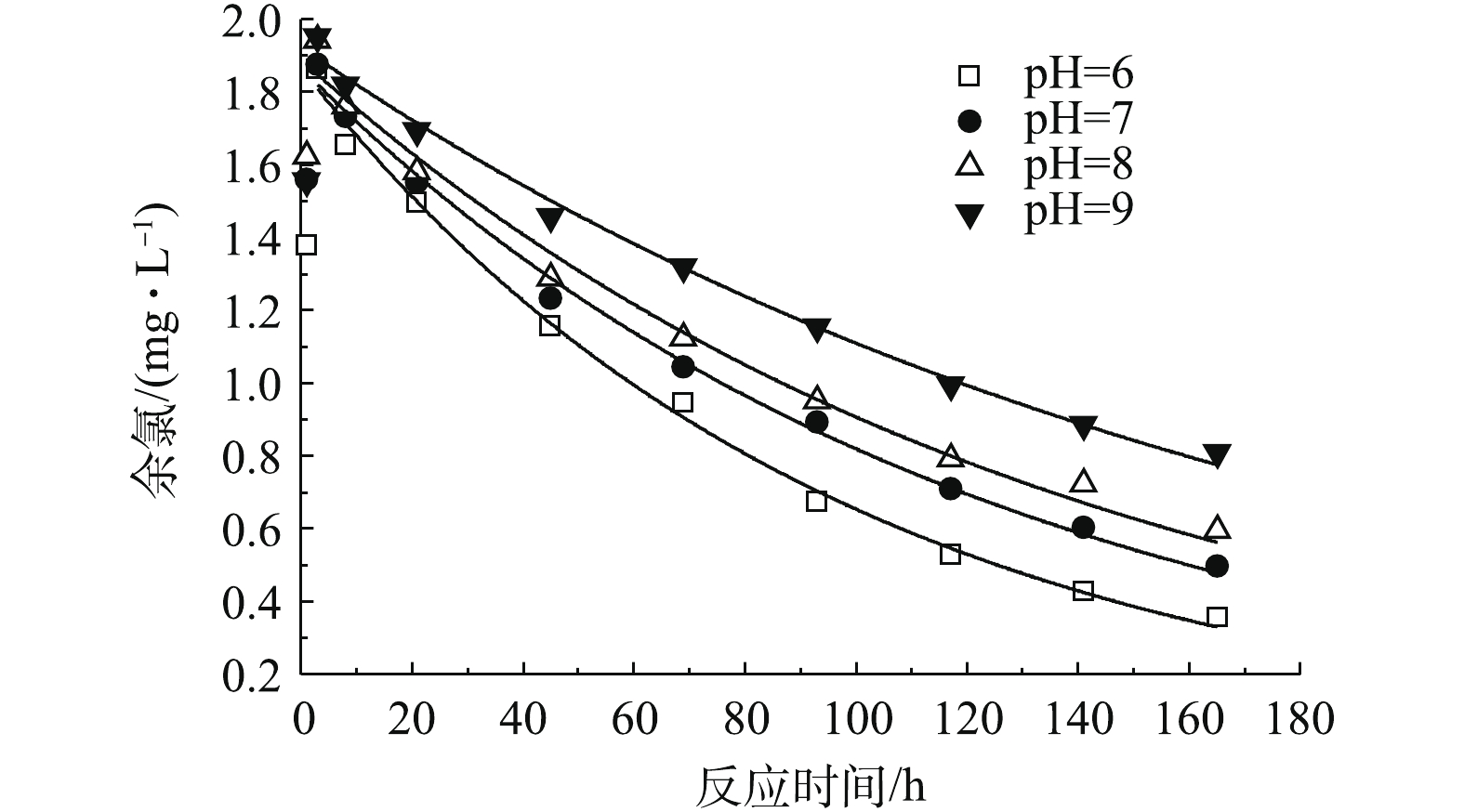
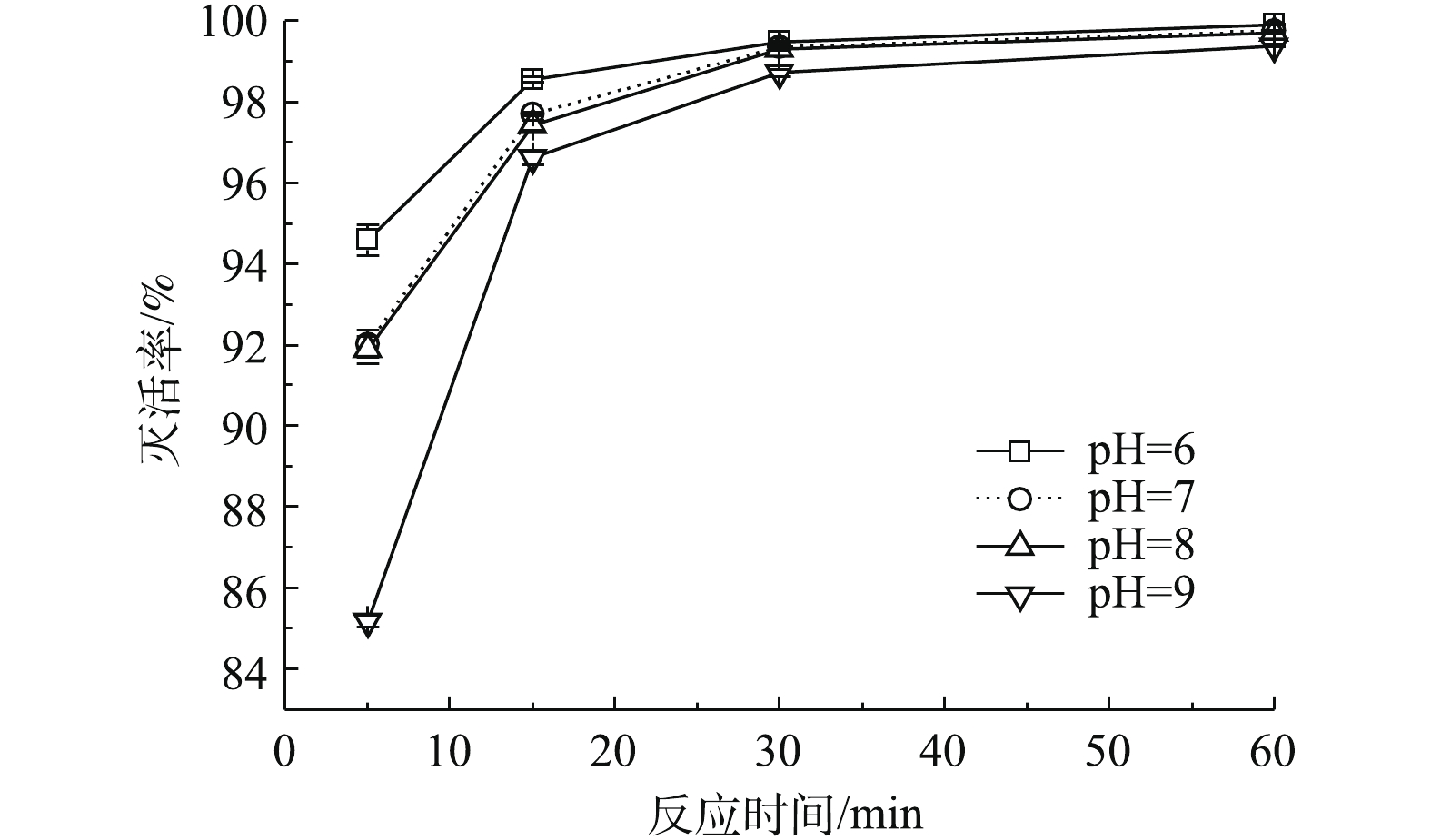
4) pH对余氯衰减的影响。以稀硝酸和氢氧化钠调节水样的pH为6、7、8和9,在初始理论有效氯浓度为2.5 mg·L−1的条件下,研究不同pH时的余氯衰减情况,结果如图5所示。由图5可知,在pH为6~9时,165 h内余氯的衰减量随水体pH的升高而减少,从pH=6时的2.14 mg·L−1减少到pH=9时的1.69 mg·L−1。
不同pH下余氯衰减的一级动力学拟合结果(表5)显示,pH越大,余氯衰减系数越小,水体中的余氯衰减得越慢。分析其原因为:TCCA溶于水中后发生水解反应,生成次氯酸和异氰尿酸(式(3))。次氯酸是TCCA消毒的主要作用物质,但本身是一种弱酸,在水中可部分离解为氢离子和次氯酸根,反应方程式如式(7)所示。
可见,次氯酸与次氯酸根在水中的相对比例取决于温度和pH。当溶液的pH较低时,溶液中次氯酸分子所占的比例较高。次氯酸分子不带电荷,容易通过细胞膜进入细胞内部,杀菌能力强,所以其消耗速度快。同时,较高的次氯酸浓度在溶液中自身分解反应加快,使得水体中的余氯衰减速度加快。
-
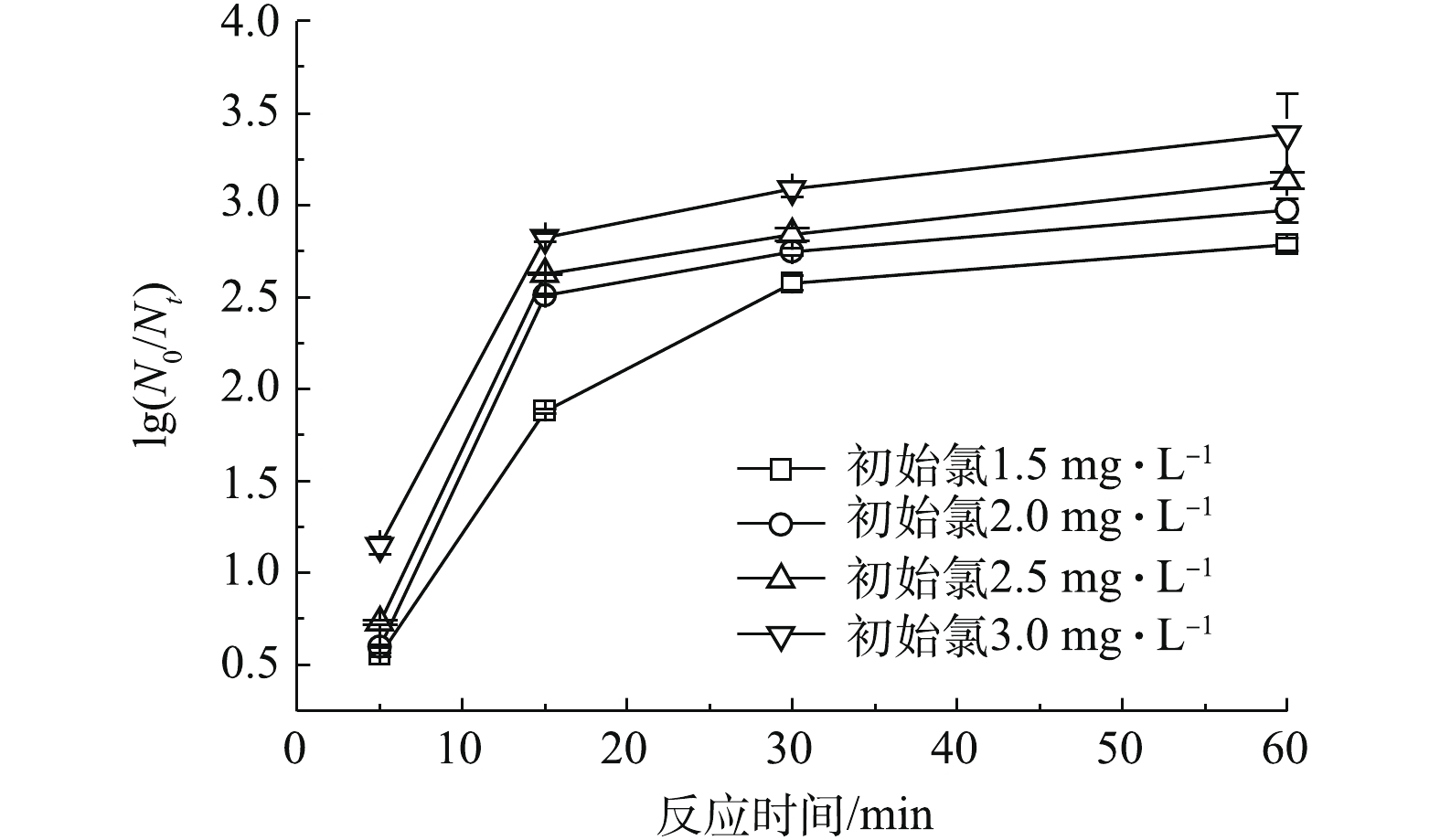
1)消毒剂投加量对灭菌效果的影响。在20 ℃下,向4个烧杯中分别投加一定量的TCCA,使水样的初始理论有效氯投加量为1.5、2.0、2.5和3.0 mg·L−1,待接触5、15、30和60 min后,测定水样中的菌落总数。菌落总数的对数灭活率变化如图6所示。由图6可知,在一定的消毒剂投加量下,随着接触时间的增加,菌落总数的灭活率增加。当消毒剂浓度为1.5~2.5 mg·L−1时,可在60 min内完成对菌落总数99.0%的灭活;原水中菌落总数平均为3.66×104 CFU·mL−1时,反应后水中菌落总数小于100 CFU·mL−1,并且随着反应时间的增加,灭活率还有增加的趋势。当消毒剂浓度大于2.5 mg·L−1时,在30 min内可完成对菌落总数99.9%的灭活。
当接触时间一定时候,菌落总数的灭活率随消毒剂投加量的增加而增大;接触时间为15 min时,2 mg·L−1及以上浓度的消毒剂对菌落总数的灭活率基本已经达到最大,而后的消毒效果增加并不明显。高浓度的消毒剂可以在较短时间里灭活大多数细菌,消毒剂浓度较低时,虽然不能迅速达到灭菌,但是其灭活率保持较长时间的增长趋势,灭菌的效果会一直持续到消毒剂消耗完[18]。
2) pH对灭菌效果的影响。在20 ℃下,以稀硝酸和氢氧化钠调节水样的pH分别为6、7、8和9,向4个烧杯中分别投加一定量的TCCA,使水样的初始理论有效氯投加量为2.5 mg·L−1。待接触5、15、30和60 min后测定水样中的菌落总数。菌落总数的灭活率变化如图7所示。由图7可知,溶液的pH越低,氯消毒剂的消毒效果越好。溶液的初始pH为6.0时,接触5 min对菌落总数的灭活率为94.6%,而初始pH为9.0时的灭活率只有85.2%。由式(7)可知,pH对氯消毒效果的影响主要在于影响水中次氯酸与次氯酸根的相对比例,而次氯酸的消毒效果优于次氯酸根。当溶液pH较高且呈碱性时,溶液中次氯酸根浓度相对较高,微生物表面带有负电荷,带有负电荷的次氯酸根离子不易透过带有负电荷的微生物细膜外膜,从而造成消毒效果较差[19]。
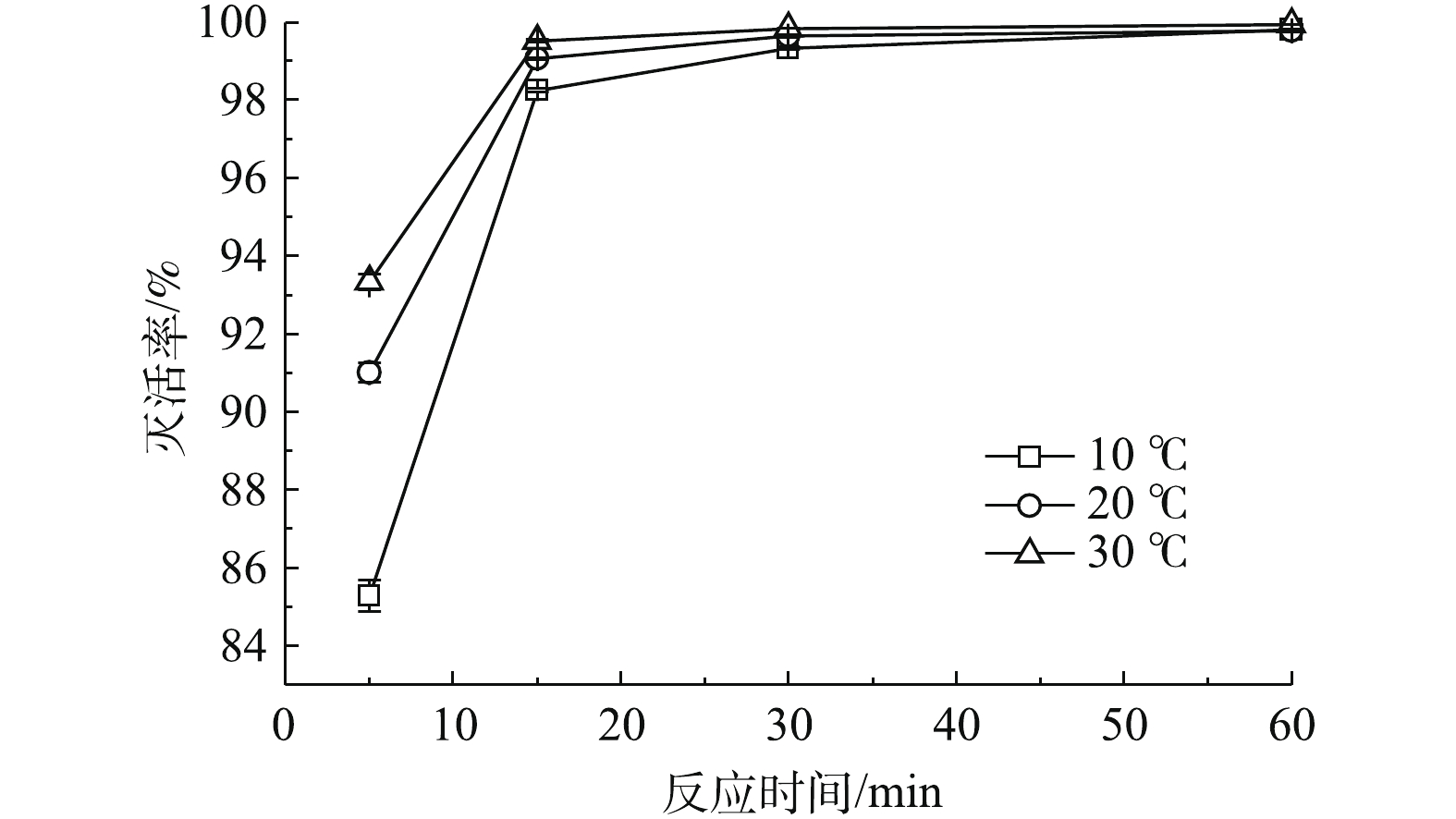
3)温度对灭菌效果的影响。分别在10、20和30 ℃的条件下,向3个烧杯中分别投加一定量的TCCA,使水样初始理论有效氯投加量为2.5 mg·L−1。待接触5、15、30 和60 min后测定水样中的菌落总数。菌落总数的灭活率如图8所示。由图8可知,在30 ℃的反应温度下,接触15 min对菌落总数的灭活率为99.5%,而当反应温度为10 ℃时,则需要反应30 min,对菌落总数的灭活率才可以达到99.0%以上。因此,反应温度较高时,氯消毒剂的消毒效果较好。原因可能在于,较高温度条件下次氯酸的活性较高,更容易透过细胞外膜,并且在微生物细胞内的化学反应速度加快,消毒效果更好。
4)氨氮浓度对灭菌效果的影响。原水的氨氮浓度为0.54 mg·L−1时,向原水中添加一定量氯化铵溶液,使水中的氨氮浓度分别达到1.04、1.54和2.04 mg·L−1,在20 ℃下,向4个烧杯中分别投加一定量的TCCA,使水样的初始理论有效氯投加量为2.5 mg·L−1。待接触5、15、30和60 min后,测定水样中的菌落总数。菌落总数的灭活率变化如图9所示。由图9可知,在一定时间内,溶液中氨氮的浓度越高,氯消毒剂的消毒效果越差。消毒剂与原水接触15 min可使菌落总数的灭活率达到99.0%以上,而当水中的氨氮浓度为2.04 mg·L−1时,接触15 min后菌落总数的灭活率仅有88.5%,接触1 h后灭活率也仅有93.3%。
氯制消毒剂加入含有氨氮的水中会发生反应,反应式如式(8)~式(10)所示。
生成的氯胺也具有消毒作用,但主要是依靠次氯酸起作用。由式(8)、式(9)和式(10)可知,当水中的HOCl因消毒反应而被消耗后,反应会向左进行,继续产生起主要消毒作用的HOCl。如果氯消毒剂形成了氯胺,消毒作用效果会比较缓慢,相比而言需要更长的反应时间。有研究表明,氯与水体接触5 min 对细菌的灭活率可达到99.0%以上,而氯胺在相同条件下,5 min仅杀菌60.0%,若要达到99.0%以上的灭菌效果,接触时间增加到10 h以上[20]。
2.1. 窖水中的余氯衰减规律
2.2. TCCA对窖水中微生物的灭活效果
-
TCCA的投加量在实际应用中要具有可操作性。若投加量过高,消毒效果好,可减少投加频率,但余氯浓度高,影响居民的口感;若过低,可能微生物超标,则要增大投加频率。因此,TCCA的投加要适量。实际窖水处在封闭不透光的环境,投加TCCA后,水解生成的HClO自身分解相对减少;窖水水温比较稳定,春冬季平均10 ℃左右,夏秋季平均20 ℃左右[21-23],温度低不利于微生物繁殖和氯与水中物质的反应,氯的损耗相对减少;窖水pH一般在8左右[21],偏弱碱性,有利于长时间内余氯浓度的维持;窖水存储时间长,水质一般较稳定。因此,为保持水中一定的余氯浓度,达到较好的微生物灭活效果,TCCA消毒剂的投加量主要考虑温度的影响而适当调整,且每隔一段时间应予以补充。
初始氯投加量对余氯衰减的影响实验是在20 ℃下进行的,引入修正系数α对余氯衰减的一级动力学模型进行修正,计算方法如式(11)和式(12)所示。
式中:k20为20 ℃时余氯的一级衰减系数,h−1;kT为温度T时余氯的一级衰减系数,h−1;Ct为t时刻窖水中余氯浓度,mg·L−1;C0为初始氯投加量,mg·L−1;k为余氯的一级衰减系数,h−1。
由《生活饮用水卫生标准》(GB 5749-2006)可知,采用氯制剂消毒后管网末梢余氯浓度应大于0.05 mg·L−1。当窖水中余氯浓度低至0.05 mg·L−1时,不同初始氯投加量下缓释极限时间如表6所示。温度对缓释极限时间影响不大,考虑到余氯浓度对口感的影响和节约用量,建议投加量为2.5 mg·L−1,投加周期为25 d。
TCCA作为新一代氯制消毒剂,比ClO2更经济高效,比液氯更加安全[24],且消毒效果持续稳定,较适用于窖水的消毒,可为保持与改善窖水水质提供参考。
-
1)投加TCCA后,水中的余氯浓度在反应初期会有一个逐渐上升的过程,在3 h左右达到最大值,随后余氯浓度随时间逐渐衰减,一级动力学模型对余氯衰减过程拟合较好。初始氯投加量越大,主体水中余氯总衰减量越大,但衰减系数与初始投加量的倒数1/C呈线性正相关。水中有机物等反应物浓度越低,余氯衰减系数越小,水体中的余氯衰减得越慢。pH越小,水体中的余氯衰减越快;温度越高,水体中的余氯衰减得越快,在10~30 ℃时,指数函数和阿仑尼乌斯方程可以较好地描述主体水余氯衰减系数与温度的关系。
2)水中菌落总数的灭活率随消毒剂投加量的增加而增大。当消毒剂浓度为1.5~2.5 mg·L−1时,在60 min内,可完成对菌落总数99.0%的灭活,并且随反应时间的延长,灭活率有增加的趋势;当消毒剂浓度大于2.5 mg·L−1时,在30 min内,可完成对菌落总数99.9%的灭活。pH越小,消毒效果越好;温度越高,消毒效果越好。溶液中有氨氮存在时,氯消毒剂会与之反应生成氯胺,氯消毒剂的短期消毒效果会变差。
3) TCCA较适用于窖水的消毒,且消毒效果较稳定,建议投加量为2.5 mg·L−1,投加周期为25 d。



 下载:
下载: